Трофические функции двигательных нервных волокон
Наряду с функцией передачи импульсов, вызывающих мышечные сокращения, нервные волокна и их окончания оказывают также трофическое воздействие на мышцу, т. е. участвуют в регуляции ее обмена веществ. Хорошо известно, что денервация мышцы, развивающаяся при дегенерации двигательного нерва, приводит к атрофии мышечных волокон, которая проявляется в том, что вначале уменьшается количество саркоплазмы, а затем и диаметр мышечных волокон; позднее происходит разрушение миофибрилл. Специальные исследования показали, что эта атрофия не является результатом лишь бездеятельности мышцы, потерявшей двигательную активность. Бездеятельность мышцы может быть вызвана и путем тендотомии, т. е. перерезки сухожилия. Однако, если сравнить мышцу после тендотомии и после денервации, можно убедиться, что в последнем случае в мышце развиваются качественно иные изменения ее свойств, не обнаруживающиеся при тендотомии. Наиболее ярко это проявляется в изменениях чувствительности мышцы к ацетилхолину. В нормальной и тендотомированной мышце к ацетилхолину чувствительна только постсинаптическая мембрана, в которой сосредоточены хемовозбудимые ионные каналы, снабженные холинорецепторами. Денервация приводит к тому, что такие же каналы появляются и во внесинаптических областях мышечного волокна. В результате чувствительность денервированной мышцы к ацетилхолину резко возрастает. Указанная гиперчувствительность к ацетилхолину не формируется, если при помощи определенных химических реагентов затормозить белковый синтез в мышечных волокнах. Реиннервация мышцы вследствие регенерации нервных волокон приводит к исчезновению холинорецептивных каналов области внепостсинаптической мембраны. Эти данные свидетельствуют о том, что нервные волокна регулируют синтез белков, образующих хемовозбудимые холинорецепторные каналы.
В денервированной мышце резко падает также активность ряда ферментов, в частности АТФ-азы, играющей важную роль в процессе освобождения энергии, заключенной в фосфатных связях АТФ. В то же время при денервации значительно усилены процессы распада белков. Это приводит к характерному для атрофии постепенному уменьшению массы мышечной ткани.
Важную роль в осуществлении трофических влияний нерва играет ацетилхолин, секретируемый нервными окончаниями как в покое, так особенно при возбуждении. Имеются основания считать, что ацетилхолин и продукты его расщепления холинэстеразой — холин и уксусная кислота — участвуют в обмене веществ мышцы, оказывая активирующее влияние на определенные ферментные системы. Так, при введении ацетилхолина в денервированную мышцу кролика резко увеличивается распад аденозинтрифосфата, креатинфосфата и гликогена во время тетануса, вызванного прямым электрическим раздражением этой мышцы.
Из нервных окончаний выделяются вещества, которые оказывают специфическое влияние на синтез белков мышечного волокна. Об этом свидетельствуют опыты с перекрестным сшиванием двигательных нервов, иннервирующих быстрые и медленные скелетные мышцы. При таком сшивании периферические отрезки нервов и их окончания в мышце дегенерируют, а по их путям в мышцу прорастают новые волокна из центральных отрезков нервов. Вскоре после того, как эти волокна образуют двигательные окончания, происходит отчетливая перестройка функциональных свойств мышц. Мышцы, которые ранее были быстрыми, теперь становятся медленными, а те, которые были медленными, становятся быстрыми. При такой перестройке изменяется активность АТФ-азы их сократительного белка миозина: в бывших быстрых мышцах она резко падает, а в медленных возрастает. Соответственно в первых скорость распада АТФ увеличивается, а во вторых — уменьшается. Изменяются также свойства ионных каналов клеточной мембраны.
Трофическое влияние на скелетную мышцу оказывают и волокна симпатической нервной системы, окончания которых высвобождают норадреналин.
ОСОБЕННОСТИ НЕРВНО-МЫШЕЧНОЙ ПЕРЕДАЧИ ВОЗБУЖДЕНИЯ В ГЛАДКИХ МЫШЦАХ
Механизм передачи возбуждения с двигательного нервного волокна на волокна гладкой мышцы в принципе сходен с механизмом нервно-мышечной передачи в скелетной мускулатуре. Различия касаются лишь химической природы медиатора и особенностей суммации постсинаптических потенциалов.
Во всех скелетных мышцах возбуждающим медиатором является ацетилхолин. В гладких мышцах передача возбуждения в нервных окончаниях осуществляется при помощи разных медиаторов. Так, для гладких мышц желудочно-кишечного тракта возбуждающим медиатором является ацетилхолин, а для гладких мышц кровеносных сосудов — норадреналин.
Порция медиатора, высвобождаемая нервным окончанием в ответ на одиночный нервный импульс, в большинстве случаев оказывается недостаточной для критической деполяризации мембраны гладкомышечной клетки. Критическая деполяризация происходит только при поступлении к нервному окончанию нескольких следующих друг за другом импульсов. Тогда одиночные возбуждающие постсинаптические потенциалы суммируются (рис. 57) и в момент, когда их сумма достигает пороговой величины, возникает потенциал действия.
В скелетном мышечном волокне частота следования потенциалов действия соответствует частоте ритмического раздражения двигательного нерва. В отличие от этого в гладких мышцах такое соответствие нарушается уже при частотах 7—15 имп/с. Если же частота стимуляции превышает 50 имп/с, возникает торможение типа пессимального.
Тормозные синапсы в гладких мышцах. Раздражение некоторых нервных волокон, иннервирующих гладкие мышцы, может вызывать их торможение, а не возбуждение. Нервные импульсы, приходящие в определенные нервные окончания, высвобождают тормозной медиатор.
При ритмическом раздражении тормозных нервных волокон тормозные постсинаптические потенциалы суммируются друг с другом, причем эта суммация оказывается наиболее эффективной в диапазоне частот 5—25 имп/с (рис. 58).
Если раздражение тормозящего нерва несколько предшествует стимуляции активирующего нерва, то возбуждающий постсинаптический потенциал, вызываемый по-
 Рис.57. Суммация постсинаптических потенциалов в гладкомышечных волокнах морской свинки. |
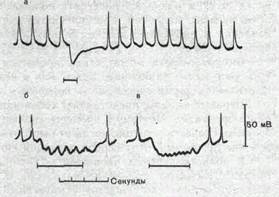 Рис. 58. Тормозные постсинаптические потенциалы в гладкомышечном волокне кишки морской свинки. а — тормозный потенциал, вызванный одиночным раздражением интрамурального тормозного нерва; бив — сум-мация тормозных потенциалов при ритмическом раздражении этого нерва. Частота раздражении 2 в секунду (б) и 4 в секунду (в). Горизонтальная линия— период раздражения. |
следним, ослабляется и может оказаться недостаточным для критической деполяризации мембраны. Раздражение тормозного нерва на фоне спонтанной активности мышцы угнетает генерацию потенциалов действия и, следовательно, приводит к прекращению ее сокращений.
Роль тормозного медиатора в гладких мышцах, возбуждаемых ацетилхолином (например, кишечника, бронхов), исполняет норадреналин. Наоборот, в мышечных клетках сфинктера мочевого пузыря и некоторых других гладких мышцах, для которых возбуждающим медиатором является норадреналин, тормозным медиатором служит ацетилхолин. Последний оказывает тормозящее действие и на клетки водителя ритма сердца.
В скелетных мышцах нервно-мышечная передача, осуществляемая при помощи ацетилхолина, блокируется препаратами кураре, обладающими большим сродством к холинорецепторам. В гладких мышцах холинорецептор имеет иную химическую структуру, чем в скелетных, поэтому она блокируется не препаратами кураре, а атропином.
В тех гладких мышцах, в которых медиатором служит норадреналин, хемовозбудимые каналы снабжены адренорецепторами. Различают два основных вида адренорецепторов: а-адренорецепторы. и (b-адренорецепторы, которые блокируются различными химическими соединениями — адреноблокаторами.
К возбудимым тканям кроме нервной и мышечной относится и железистая ткань, но механизмы возбуждения клеток желез внешней секреции несколько отличны от таковых у нервных и мышечных.
Как показали микроэлектродные исследования мембрана секреторных клеток в состоянии покоя является поляризованной, причем наружная поверхность ее заряжена положительно, а внутренняя — отрицательно. Разность потенциалов составляет 30— 40 мв. При стимуляции секреторных нервов, иннервирующих железу, возникает не деполяризация, а гиперполяризация мембраны и разность потенциалов достигает 50—60 мв. Предполагают, что это происходит вследствие нагнетания С1
и других отрицательных ионов в клетку. Под влиянием электростатических сил в клетку вслед за этим начинают поступать положительные ионы, что приводит к повышению осмотического давления, поступлению в клетку воды, увеличению гидростатического давления и набуханию клетки. В результате возникает выброс секрета из клетки в просвет железы.
Выброс секрета может стимулироваться не только нервными, но и химическими (гуморальными) влияниями. Здесь, как и везде в организме, регуляция функций осуществляется двумя способами — нервным и гуморальным.
Нервный импульс представляет собой наиболее быстрый способ передачи информации в организме. Поэтому в процессе эволюции в тех случаях, когда была необходима большая скорость реакций, когда от быстроты ответных реакций зависело само существование организма, этот способ передачи сигналов стал основным.
В области нервных окончаний — в синаптических щелях нервный импульс, как правило, вызывает выделение медиатора и, таким образом, взаимодействие между клетками остается по существу химическим. При этом вместо медленного распространения химического вещества с током жидкости (с движущейся кровью, лимфой, тканевой жидкостью и т. д.) в нервной системе с большой скоростью распространяется сигнал к выделению биологически активного вещества (медиатора) в области нервных окончаний (на месте). Все это резко повысило быстроту ответных реакций организма, сохранив по существу принцип химического взаимодействия между клетками. Вместе с тем в ряде случаев, когда при клеточном взаимодействии необходима еще более быстрая и притом всегда однозначная реакция, межклеточная передача сигнала обеспечивается прямым электрическим взаимодействием клеток. Такой тип связи наблюдается, например, при взаимодействии клеток миокарда, а также некоторых электрических синапсов ЦНС, получивших название эфапсов.
Межклеточные связи сводятся не только к электрическим взаимодействиям или влияниям медиаторов. Химическая взаимосвязь между клетками является более сложной. Клетки органов и тканей вырабатывают ряд специфических химических веществ, действующих на другие клетки и вызывающих не только включение и выключение (или усиление или ослабление) функции, но и изменение интенсивности обмена веществ и процессов синтеза клеткой специфических белков. Механизмы всех этих рефлекторных влияний и межклеточных взаимодействий подробно рассмотрены во втором разделе учебника.
Дата добавления: 2016-03-27 ; просмотров: 2065 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
При изучении трофической функции двигательных нервов главным приемом, так же как и при изучении трофической функции симпатических нервов, является повреждение или перерезка волокон с последующим исследованием морфологических, функциональных и биохимических изменений, происходящих в денервированной мышце. А изменения при таких операциях происходят очень значительные. В первую очередь меняется структура ткани. После перерезки нерва в скелетной мышце развиваются дегенеративные процессы. Сначала уменьшается диаметр мышечных волокон, затем исчезает поперечная исчерченность и наконец мышца полностью перерождается.
Помимо структурных изменений появляются изменения функционально-морфологические. Меняется тканевый метаболизм, расширяется хеморецептивная зона, появляются фибрилляции, повышается чувствительность денервированной мышцы к химическим, механическим и электрическим раздражениям. В частности, к ацетилхолину чувствительность дененервированной мышцы млекопитающих и амфибий может повыситься в 1000 и даже в 100000 раз по сравнению с чувствительностью мышцы, у которой нервные связи не нарушены. То есть возникает полная картина структурных, биохимических и функциональных изменений, а все они, в свою очередь, являются результатом нарушения трофики.
Функциональные сдвиги, происходящие после перерезки двигательных нервов, особенно отчетливо проявляются в повышении чувствительности денервированной мышцы. Наиболее показательным в этом отношении является так называемый тономоторный эффект. Тономоторный эффект — это медленное сокращение мышц в ответ на раздражение симпатических или сосудорасширяющих нервов в отсутствии двигательных нервов, то есть тех нервов, которые, собственно, и должны заставлять мышцу сокращаться.
Развивается тономоторный эффект очень медленно и становится достаточно хорошо выраженным только спустя несколько дней после перерезки двигательного нерва. Под влиянием адреналина или при раздражении симпатического нерва он усиливается.
После реиннервации мышцы, то есть после того, как нерв регенерирует и вновь соединится с мышцей, тономоторный эффект исчезает и при стимуляции симпатических или сосудорасширяющих нервов медленное сокращение мышцы больше уже не наблюдается. При этом обнаруживается очень интересный феномен. Если на определенном этапе регенерации двигательного нерва, когда она еще полностью не завершилась, нанести на этот нерв раздражение, то это раздражение не вызовет сокращения мышцы, но притормозит тономоторный эффект. Это очень важный факт, поскольку его можно рассматривать как экспериментальное разделение трофического и двигательного влияний одного и того же моторного нерва. Двигательного влияния еще нет, мышца в ответ на активность формирующегося нерва не реагирует, а трофическое влияние уже есть, о чем свидетельствует торможение тономоторного эффекта.
С механизмами расширения хеморецептивной зоны мышцы после ее денервации мы уже немножко ознакомились в предыдущей части раздела, когда рассматривали трофические свойства синапсов. Здесь мы разберем этот вопрос более подробно.
Впервые этот феномен был описан А. Г. Гинецинским и Н. М. Шама- риной (1942 г.) на примере хронической денервации мышц лягушки и черепахи. Эти исследователи показали, что мышечное волокно реагирует на ацетилхолин только в области концевой пластинки и что внесинаптическая область волокна к ацетилхолину не чувствительна. Чувствительной она становится только после перерезки двигательного нерва. При этом повышение чувствительности мышцы происходит не сразу, а развивается постепенно. В течение первых шести дней после денервации внесинаптические участки мышцы на ацетилхолин никакой реакции не дают. На седьмой день на действие ацетилхолина начинает отвечать сокращением только небольшой участок мышечного волокна. Однако с каждым днем область мышечного волокна, реагирующая на медиатор, все более увеличивается, и, начиная с тринадцатого дня, на его воздействие начинает медленно сокращаться все волокно. То есть денервация возвращает мышцу к тому состоянию, которое характерно для эмбриональных мышц, отличающихся повышенной чувствительностью к медиаторам и резко замедленной сократительной способностью. После реиннервации чувствительность мышечного волокна к действию ацетилхолина вновь начинает ограничиваться областью концевой пластинки, а скорость его сокращения возвращается к норме.
Эффект, обнаруженный Гинецинским и Шамариной, впоследствии наблюдали многие ученые на разных видах животных, в том числе и на млекопитающих. При этом было показано, что сроки развития сенсибилизации у разных животных могут быть различными. Так, С. Тес- лефф (1960 г.), исследовав этот феномен на мышцах крыс и кошек, показал, что спустя одну-две недели после денервации, мышцы млекопитающих проявляют такую же высокую чувствительность к локально нанесенному ацетилхолину, как и концевая пластинка. Сама же концевая пластинка сохраняет при этом исходную возбудимость. А вот у амфибий, согласно данным С. В. Куффлера (1943 г.), сенсибилизация обнаруживается только спустя несколько недель. Кроме того, было показано, что чувствительность денервированной мышцы возрастает не только к ацетилхолину, но и к адреналину, норадреналину, кофеину и к веществам никотиноподобного действия, что свидетельствует о радикальных метаболических изменениях, происходящих в ткани, и косвенно указывает на участие двигательных нервов в трофических процессах.
Вообще-то, вопрос о том, в результате чего повышается хемочувствительность денервированной мышцы, совсем не прост. Некоторое время предметом дискуссий среди исследователей была гипотетическая возможность повышения хемочувствительности волокон в результате влияния на них продуктов распада концевой пластинки. Дело в том, что после перерезки нервного волокна его дистальная часть, то есть та часть, которая примыкает к мышце, дегенерирует, и из концевой пластинки в результате ее дегенерации начинают выделяться накопившиеся в ней химические вещества. Эти вещества, а также продукты распада самой концевой пластинки могут вступать в реакцию с химическими элементами, содержащимися в мышечной ткани, и таким образом изменять ее чувствительность на всем ее протяжении.
Однако Б. Катц и Р. Миледи (1961 г.) показали, что повышенная чувствительность развивается и после удаления концевой пластинки. Это свидетельствовало о том, что трофические процессы, регулирующие состояние периферического аппарата, запускаются не только в результате гуморальных процессов, но и в результате активности нервных структур.
Для того чтобы проверить, что имеет большее значение для возникновения сверхчувствительности — потеря двигательной активности или потеря мышцей нервных связей, Миледи (1960,1963 гг.) сделал попытку денервировать мышечные волокна, не меняя рисунка нормальной активности мышцы. Для этого нужно было денервировать мышцу не полностью: удалить только часть волокон, для того чтобы оставшиеся нервные связи позволили мышце сокращаться так же, как она сокращалась до иннервации.
Для этого была использована портняжная мышца. Волокна портняжной мышцы получают иннервацию в двух или трех местах. Часть нервов была перерезана возле концевых пластинок. Передача нервных импульсов продолжала осуществляться по оставшимся нервным волокнам. Если бы сенсибилизация была связана с потерей двигательной активности, то в этом случае она не должна была развиться, поскольку мышца продолжала сокращаться в ответ на стимуляцию сохранных нервных волокон. Однако денервированная часть сокращающейся мышцы оказалась очень чувствительной к ацетилхолину. Не настолько чувствительной, как в случае полной денервации, но, тем не менее, значительно более чувствительной, чем она была до начала эксперимента.
На основании этих опытов было сделано заключение, что гиперсенсибилизация после денервации возникает не потому, что мышца перестает сокращаться, а потому, что она оказывается лишенной прямого тормозящего влияния двигательного нерва, регулирующего хемо- рецептивные свойства ее волокон. Эти данные указывают на прямое трофическое воздействие двигательного нерва на мышечную ткань и позволяют разделить два типа нервных влияний — активирующее и трофическое.
Рассмотрим еще несколько изменений, возникающих в мышцах после перерезки двигательных нервов, появление и течение которых может указывать на то, что двигательные нервы выполняют трофические функции. Это появление фибрилляций, динамика ДНК и нарушение обменных процессов.
Фибрилляции мышечных волокон развиваются у разных животных спустя различные сроки после перерезки нерва. Если дистальный отрезок перерезанного нерва достаточно длинный, то фибрилляции появляются несколько позже, чем в тех случаях, когда дистальный конец нерва более короткий или нерв обрезан у самой концевой пластинки. Это связано с тем, что трофические вещества, транспортируемые с током цитоплазмы, расходуются не сразу, а постепенно. И чем длиннее сохранный отрезок нерва, тем дольше идет нормальное течение трофических процессов. Чем короче — тем быстрее запасы трофических веществ истощаются, трофика нарушается и мышца начинает реагировать на эти нарушения повышением химической чувствительности и появлением фибрилляций.
Об этом же свидетельствует и еще один факт. У животных, испытавших перед перерезкой нерва очень сильное физическое напряжение, фибрилляции наступают раньше, чем у тех животных, которые перед перерезкой нерва находились в спокойном состоянии. Это связано, скорее всего, с тем, что при активном функционировании животных обменные процессы проходят настолько интенсивно, что метаболические резервы значительно истощаются, и поэтому денервационные изменения развиваются очень быстро.
Оба эти примера показывают, что развитие фибрилляций связано с нарушениями трофических функций, возникающих после перерезки двигательных нервов.
О том, что наличие нервных влияний необходимо не только для поддержания нормального уровня метаболизма, но и для регуляции изменений, протекающих в таких сложных структурах, как белковые и углеводные соединения, свидетельствуют нарушения обменных процессов, возникающие в результате денервации. Нарушения обменных процессов денервированной мышцы отличаются от нарушений обменных процессов, возникающих в тех случаях, когда мышца не денерви- рована, а просто иммобилизована на длительное время.
И наконец еще одним показателем того, что двигательные нервы имеют отношение к трофическим процессам, являются динамические изменения содержания дезоксирибонуклеиновой кислоты (ДНК) в мышечной ткани после ее денервации. В денервированной мышце происходит повышение абсолютного содержания ДНК, связанное с увеличением числа ядер. Через десять месяцев после денервации содержание ДНК в мышечной ткани возрастает на четыреста процентов. В результате интенсивной электростимуляции, призванной приостановить дистрофические процессы в денервированной мышце (электротерапия), мышечные волокна могут сохранить нормальный диаметр, однако и высокое содержание ДНК в ткани при этом тоже сохранится. Это свидетельствует о том, что в мышце развиваются трофические нарушения, возникшие в результате отсутствия нервной регуляции метаболических процессов. После реиннервации уровень ДНК возвращается к прежним значениям.
Таким образом, участие двигательных нервов в трофических процессах отражается практически на всех уровнях жизнедеятельности организма, включая молекулярные.
Распространение возбуждения в нервных волокнах.Изменения мембранного потенциала, вызываемые электрическим током, подразделяются на пассивные и активные.
Пассивные, или электротонические, изменения мембранного потенциала определяются физическими (электрическими) параметрами как самой мембраны, так и всей клетки (волокна) в целом.
Пассивные сдвиги мембранного потенциала возникают при действии на возбудимые образования электрического тока любой силы, формы или направления. Однако если при гиперполяризующем (анодном) и слабом деполяризующем (катодном) токах пассивные изменения потенциала могут наблюдаться в чистом (неосложненном) виде, то при близких к порогу и сверхпороговых деполяризующих стимулах они сопровождаются активными сдвигами потенциала: локальным ответом и потенциалом действия, связанными с изменениями ионной проницаемости мембраны.
Пассивные свойства мембраны и всего волокна в целом в значительной мере определяют условия возникновения и распространения возбуждения в нервном волокне.
Исследования показывают, что в однородно поляризуемом, однородном участке нервного волокна изменения мембранного потенциала при приложении прямоугольного толчка гиперполяризующего или слабого деполяризующего тока нарастают по экспоненте:
где RC = τ – постоянная времени мембраны, т.е. время, в течение которого потенциал нарастает до 63% от своей конечной величины. При выключении тока потенциал возвращается к исходному уровню по экспоненте с той же постоянной времени τ. Такие изменения мембранного потенциала принято называть пассивными или электротоническими, в отличие от активных, связанных с повышением или снижением ионных проводимостей мембраны.
Подобные изменения наблюдаются на сферических клетках (на соме). Описание цилиндрической клетки, в частности аксона, более сложно. В этом случае уже нельзя считать внутренний проводник эквипотенциальным по всей длине. Внешний проводник можно считать эквипотенциальным за счет увеличения объема внеклеточной жидкости. Потенциал на такой мембране зависит не только от времени включения тока, но и от расстояния х по отношению к месту приложения тока:
Через длительное время (намного большего постоянной времени
t = RМ CМ) после включения импульса емкость мембраны полностью зарядится и емкостный ток станет равным нулю. Уравнение примет вид:
где V0 – потенциал в начале кабеля (х = 0), l – постоянная длины волокна.
Постоянная длины характеризует крутизну затухания потенциала вдоль волокна. Чем больше l, тем дальше по волокну проходит сигнал. Скорость электротонического распространения пропорциональна удвоенной величине константы длины волокна l и обратно пропорциональна постоянной времени t = RМ CМ. Величина l может быть выражена через сопротивление мембраны RМ , сопротивление внутренней среды – аксоплазмы Ri и диаметра волокна d:
Кабельные свойства нервных волокон оказывают существенное влияние не только на развитие электротонических потенциалов, но и на характер активных ответов – величину порога, амплитуду, крутизну нарастания и длительность потенциала действия.
В настоящее время можно считать строго доказанным, что проведение потенциала действия (ПД) вдоль нервного волокна осуществляется с помощью локальных токов, возникающих между возбужденным и покоящимся участками мембраны. Локальный ток изменяет величину мембранного потенциала покоя в покоящемся участке до критического уровня деполяризации, что и является причиной возникновения потенциала действия.
Многочисленными исследованиями было показано, что скорость проведения пропорциональна постоянной длины волокна l и обратно пропорциональна постоянной времени мембраны t (Чайлохян Л.М., 1962). Поскольку в безмякотных нервных волокнах l пропорциональна квадратному корню из диаметра волокна
скорость проведения при прочих равных условиях также пропорциональна корню квадратному из диаметра волокна.
В миелинизированных нервных волокнах проведение происходит сальтаторно – от перехвата Ранвье к перехвату Ранвье. Длина межперехватного участка примерно пропорциональна диаметру волокна, поэтому скорость проведения в этих волокнах пропорциональна не корню квадратному из диаметра волокна, а просто его диаметру.
Принято считать, что скорость проведения зависит от величины так называемого фактора безопасности (гарантийности) Ф, т.е. отношения амплитуды распространяющегося ПД к пороговому потенциалу. Пороговый потенциал – это та величина, на которую нужно изменить мембранный потенциал, чтобы достичь критического уровня деполяризации.
где Vs – амплитуда ПД, Vt – пороговый потенциал.
При Ф = Vt распространения возбуждения нет. Для аксона краба это отношение равно 7.
Сложное влияние на фактор безопасности оказывает уровень потенциала покоя. Кратковременная подпороговая деполяризация мембраны, не изменяющая существенным образом критического потенциала и амплитуды потенциала действия, повышает фактор безопасности, так как Vt = Eo – Ek. При сильной же деполяризации амплитуда спайка падает, критический потенциал растет, поэтому фактор безопасности уменьшается.
Наряду с фактором безопасности существенное влияние на скорость проведения возбуждения оказывает крутизна восходящей фазы распространяющегося потенциала действия. Крутизна этой фазы зависит как от пассивных, так и активных свойств мембраны.
Примерно 1/3 восходящей фазы распространяющегося ПД связана с пассивной деполяризацией мембраны нервного волокна током локальной цепи. Скорость же этой деполяризации при данной силе локального тока определяется постоянной времени мембраны t = RM CM. Чем эта величина меньше, тем быстрее нарастает деполяризация и, следовательно, круче поднимается спайк. Инактивация натриевой системы, или снижение проницаемости для натрия (активные свойства мембраны), резко уменьшает крутизну восходящей фазы. Таким образом, при большинстве воздействий изменения скорости нарастания восходящей фазы ПД по своему направлению совпадают с изменениями фактора безопасности.
Согласно теории локальных токов, амплитуда распространяющегося потенциала действия Vs, в отличие от мембранного спайка, зависит не только от ЭДС возбужденной мембраны Е, но и от соотношения входных сопротивлений возбужденного R1 и невозбужденного (сопротивление нагрузки R2) участков волокна:
Из формулы (1) ясно, что при проведении возбуждения по геометрически неоднородным возбудимым проводникам амплитуда распространяющегося спайка должна существенно зависеть от того, насколько близко находится возбужденный в данный момент участок волокна к месту его ветвления или расширения.
При расширении нервного волокна, например, в месте перехода его в тело клетки или в области ветвления аксона, суммарная площадь сечения волокон и общая площадь их мембраны увеличивается, а следовательно, R2 падает. Уменьшение R2 снижает фактор безопасности и, соответственно, скорость проведения. При некоторых условиях уменьшение R2 может привести к полному блокированию нервного импульса.
Расчеты показали, что потенциал действия легко проходит трехкратное расширение, с трудом пятикратное и полностью блокируется при шестикратном. Причиной развития блока является резкое снижение амплитуды распространяющегося ПД вблизи области расширения волокна.
Трофическая функция нервных волокон.Трофической функцией обладают афферентные и эфферентные волокна.
Аксональный транспорт.Описаны две системы аксонального транспорта – медленный, со скоростью 1-3 мм/день, и быстрый, со скоростью примерно 400 мм/день.
Аксоплазматический транспорт можно зарегистрировать по накоплению веществ после нарушения непрерывности аксона и по наблюдению за продвижением меченых соединений после введения их в нейрон.
Белки, синтезируемые в теле клетки, синаптические медиаторные вещества и низкомолекулярные факторы спускаются по аксону к нервной терминали вместе с клеточными органеллами, в частности митохондриями. Для большинства веществ и органелл обнаружен ретроградный транспорт (по аксону к телу клетки): вирус полиомиелита, вирус герпеса, столбнячный токсин, а также ферменты – пероксидаза хрена, которая широко используется в нейроанатомии в качестве маркиратора. Ретроградный транспорт, видимо, является главным фактором регуляции синтеза белка в клетке. После перерезки аксона через несколько дней в соме начинается хроматолиз, что свидетельствует о нарушении синтеза белка. Быстрый аксонный транспорт зависит от достаточного снабжения метаболической энергии. Возможность транспорта создают микротрубочки диаметром 25 мкм, состоящие из белка тубулина, и некоторые нейрофибриллы, состоящие из белка актина, образующие транспортные нити. Транспортные нити скользят вдоль микротрубочек. При этом они взаимодействуют с выступами микротрубочек, происходит расщепление АТФ, которое и обеспечивает энергию для транспорта. Более медленно транспортируются крупные белки. Но считают, что сам транспортный механизм не является более медленным, однако вещества время от времени попадают в клеточные компартменты, которые не участвуют в транспорте. Медленный ток имеет, по-видимому, также отношение к аксональному росту. Аксоплазматический ток прекращается колхицином, что объясняется влиянием этого вещества на микротрубочки.
Физиология синапсов
Синапс (от греч. synapsis) обозначает соединение, связь – это специализированная зона контакта между нейронами или нейронами и другими возбудимыми образованиями, обеспечивающая передачу возбуждения с сохранением, изменением или исчезновением ее информационного значения. Данный термин был предложен Ч. Шеррингтоном (1897) для обозначения функционального контакта между нейронами. Справедливости ради нужно отметить, что еще в 60-х годах XIX столетия И.М. Сеченов подчеркивал, что вне межклеточной связи нельзя объяснить происхождение даже самых простых рефлексов.
Синапсы различают: 1) по их местоположению; 2) по способу передачи сигналов.
1) По местоположению выделяют синапсы центральные и периферические. Центральные синапсы – это синапсы, которые осуществляют контакт между нейронами в центральной нервной системе. К ним относятся аксо-аксональные синапсы, аксо-дендритические, аксо-соматические, дендро-дендритические (обнаружены гистологически; функциональное значение не вполне ясно). Центральные синапсы классифицируют также по знаку их действия – возбуждающие и тормозные. Кроме того, распространено деление синапсов по тому медиатору (передатчику), который осуществляет посредничество: адренергические синапсы, холинергические синапсы и др.
К периферическим синапсам относят нервно-мышечные, синапсы вегетативных ганглиев (синапсы, образованные преганглионарными и постганглионарными волокнами).
2) По способу передачи синапсы классифицируются как химические и электрические.
Для всех этих образований характерно наличие пресинаптической мембраны, синаптической щели (10-50 нм), постсинаптической мембраны. Пресинаптическая мембрана является мембраной пресинаптического окончания отростка нейрона (чаще всего аксона).
У человека и высших позвоночных животных наибольшее распространение получили химические синапсы. Химические синапсы в пресинаптическом окончании содержат везикулы с медиатором, химическим передатчиком. Ширина синаптической щели в среднем составляет 20 нм. На постсинаптической мембране содержатся рецепторы к данному медиатору, ферменты, разрушающие данный медиатор. Таким образом, постсинаптическая мембрана является рецепторной частью синапса, ею может быть специфически дифференцированный участок дендрита, тела нейрона и его аксона.
В электрическом синапсе не вырабатывается медиатор. Синаптическая щель несколько меньше, чем у химического синапса (2-4 нм). В синаптической щели между пре- и постсинаптической мембранами имеются белковые мостики-каналы шириной 1-2 нм, где движутся ионы и небольшие молекулы. Это способствует более низкому, чем у пресинаптической мембраны, сопротивлению постсинаптической мембраны. Поэтому возбуждение от пресинаптической мембраны к постсинаптической мембране в электрических синапсах передается электрическим путем, т.е. осуществляется эфаптическая передача. В отличие от химических синапсов, электрические синапсы отличаются большей скоростью проведения возбуждения, высокой надежностью передачи, возможностью двустороннего проведения.
Электрические синапсы обнаружены у крыс в вестибулярном ядре продолговатого мозга, в структурах дыхательного центра продолговатого мозга (при этом обсуждается их роль в механизмах автоматического ритмогенеза дыхания); у кошки электрические синапсы обнаружены между нейронами нижних олив, в структурах таламуса, между фоторецепторами сетчатки и горизонтальными клетками у рыб и др.
Но все-таки наибольшее распространение в процессе эволюции получили химические синапсы. Это обусловлено рядом свойств этих образований, которые имеют большое значение в организации деятельности нервной системы (рис. 1.4).
Рис. 1.4. Синапс (рисунок взят из книги: Мозг / под ред. П.В. Симонова. М.: Мир, 1984)
Читайте также:


