Болезнь кори гликогеноз студопедия
Гликогеноз I типа (болезнь Гирке) — не истинная миопатия, а заболевание, обусловленное дефицитом печеночного фермента глюкозо-6-фосфатазы, который в норме не присутствует в мышце, тем не менее у детей с этим заболеванием выявляется гипотония и умеренно выраженная мышечная слабость неизвестной этиологии. Гликогеноз II типа (болезнь Помпе) — аутосомно-рецессивно унаследованный дефицит гликолитического лизосомного фермента кислой мальтазы. Из 12 известных типов гликогенозов только II тип обусловлен дефектом лизосомного фермента. Аномальный ген картирован в локусе 17q23. Описано две формы заболевания.
Младенческая форма характеризуется тяжелой генерализованной миопатией и кардиомиопатией. У пациентов выявляется кардиомегалия, гепатомегалия, диффузная гипотония и мышечная слабость. Активность КФК в крови значительно повышена. Мышечная биопсия выявляет вакуолярную миопатию в сочетании с нарушением активности ферментов лизосом, таких как кислая и щелочная фосфатазы. Смерть обычно наступает в младенческом или раннем детском возрасте.
Поздняя детская или взрослая форма представлена миопатией с более легким течением, без увеличения сердца и печени. Клинические проявления могут отсутствовать до позднего детского или раннего зрелого возраста, однако возможно появление признаков мышечной слабости (обусловленной миопатией) и гипотонии даже в раннем младенческом возрасте. Активность КФК в крови значительно повышена, результаты мышечной биопсии имеют диагностическое значение даже на пресимптомной стадии заболевания.
Диагноз гликогеноза II типа подтверждается при количественном анализе активности кислой мальтазы при биопсии мышц или печени. При редком варианте дефицита кислой мальтазы с легким течением ее активность при биопсии мышц может находиться на нижней границе нормы с периодическим снижением до субнормального уровня, при этом результаты мышечной биопсии напоминают гликогеноз II типа, но изменения выражены более умеренно.
Другая форма — болезнь Данона — характеризуется Х-сцепленным рецессивным типом наследования, аномальный ген картирован в локусе Xql4. В основе заболевания лежит первичный дефицит протеина-2 мембран лизосом (LAMP2), который приводит к развитию гипертрофической кардиомиопатии, миопатии с поражением мышц проксимальных отделов конечностей и умственной отсталости.
Гликогеноз III типа (болезнь Форбса-Кори) обусловлен дефицитом фермента, расщепляющего гликоген (амило-1,6-глюкозидаза). Это наиболее распространенный гликогеноз с наименее тяжелыми клиническими проявлениями по сравнению с другими типами гликогенозов. В младенческом возрасте часто встречаются такие симптомы, как гипотония, мышечная слабость, гепатомегалия, гипогликемия при исследовании крови натощак, однако эти симптомы часто спонтанно исчезают и в детском возрасте, а также у взрослых клинические проявления могут отсутствовать.
В других случаях отмечается медленное прогрессирование атрофии мышц дистальных отделов конечностей, цирроза печени и сердечной недостаточности. При мышечной биопсии обнаруживаются минимально выраженные миопатические изменения, включающие вакуолизацию мышечных волокон.
Гликогеноз IV типа (болезнь Андерсена) обусловлен дефицитом фермента, участвующего в синтезе гликогена, приводящего к синтезу аномальных молекул гликогена — амилопектина — в печени, ретикулоэндотелиальных клетках, скелетной мускулатуре и сердечной мышце. Гипотония, генерализованная мышечная слабость, атрофия мышц и контрактуры — характерные признаки миопатического процесса. Большинство пациентов умирает до 4-летнего возраста в связи с развитием печеночной или сердечной недостаточности. Описаны отдельные случаи заболевания у детей без признаков нервно-мышечного заболевания.
Гликогеноз V типа (болезнь Мак-Ардла) обусловлен дефицитом мышечной фосфорилазы, наследуемым по аутосомно-рецессивному типу, аномальный ген картирован в локусе 1lql3. Основным клиническим проявлением заболевания служит непереносимость физической нагрузки, которая вызывает болезненный мышечный спазм (крампи), мышечную слабость и миоглобинурию; однако между приступами мышечная сила не снижена. Активность КФК в крови повышена только во время физической нагрузки. Характерным клиническим признаком служит отсутствие наблюдаемого в норме повышения уровня лактата в крови во время физической нагрузки, приводящей к ишемии.
Это обусловлено невозможностью превращения пирувата в лактат при анаэробных состояниях in vivo. Дефицит миофосфорилазы можно обнаружить с помощью гистохимических и биохимических методов в мышечном биоптате.
Редкая неонаталъная форма дефицита миофосфорилазы вызывает бульбарные расстройства в раннем младенческом возрасте, которые могут быть настолько выражены, что приводят к летальному исходу в периоде новорожденное™. В других случаях возможно медленное прогрессирование мышечной слабости, напоминающее мышечную дистрофию.
Отдаленный прогноз благоприятный. Пациенты должны научиться контролировать свой уровень физической нагрузки; тяжелой инвалидизации вследствие хронической миопатии или поражения сердца не отмечается.
Гликогеноз VII (болезнь Таруи) представляет собой дефицит мышечной фосфофруктокиназы. Хотя это заболевание встречается реже, чем гликогеноз V типа, оба заболевания характеризуются непереносимостью физической нагрузки, похожим клиническим течением и невозможностью превращения пирувата в лактат. Биохимическое исследование мышечных биоптатов позволяет дифференцировать эти два типа гликогенозов. Заболевание наследуется по аутосомно-рецессивному типу, аномальный ген картирован в локусе lcenq32.
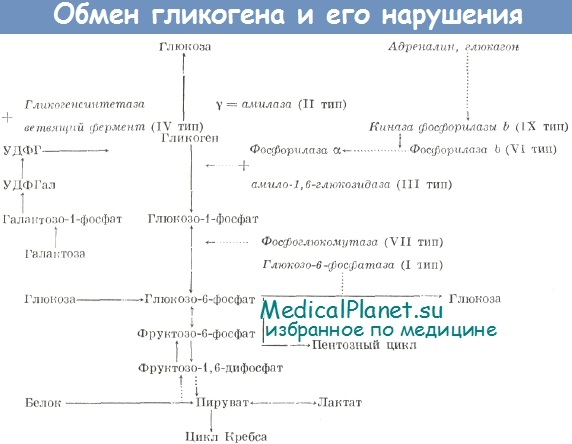
III тип гликогеноза (болезнь Кори) вызван полным отсутствием или снижением активности амило-1,6-глюкозидазы — фермента, расщепляющего а-1,6-глюкозидные связи в точках ветвления гликогена. Этот фермент вместе с фосфорилазой способствует полному распаду гликогена. Заболевание наследуется по аутосомно-рецессивному типу.
Известно, что фосфорилаза расщепляет наружные ветви молекулы гликогена, оставляя при этом по 3—4 глюкозных остатка. Дальнейшее ферментативное расщепление гликогена осуществляется в два этапа:
1) перенос двух или трех глюкозных остатков с цепи А на цепь В молекулы гликогена (олиго-1,4-1,4-трансглюкозилазная активность) и
2) собственно отщепление остатка глюкозы, связанного с цепью В а-1,6-глюкозидной связью (амило-1,6-глюкозидазная активность). Лимитирующей реакцией является гидролиз а-1,6-глюкозидных связей.
Больные с III типом гликогеноза могут быть отнесены к различным подтипам в зависимости от того, отсутствуют ли обе активности фермента или одна из них, а также от того, в каких органах и тканях отсутствует ферментативная активность.
Van Hoof и Hers предложили следующую классификацию III типа гликогеноза.
По клинической картине подтипы А, В и D III типа гликогеноза относят к печеночной форме заболевания.
Усиливается распад белков, при этом часть аминокислот используется для образования глюкозы (глюкогениые аминокислоты), а часть аминокислот образует ацетил-КоА (кетогенные аминокислоты). Нарушаются ферментативные процессы цикла Кребса, что приводит к избыточному синтезу ацетона и кетоновых тел. У больных происходит усиленный распад жиров натощак, вызванный гипогликемией, что также способствует образованию в организме избытка кетоновых тел и ацетона.
Активность гликогенсинтетазы снижена из-за накопления значительных количеств гликогена в гепатоцитах. Поступающая экзогенным путем глюкоза используется для синтеза жиров, а не для синтеза гликогена.
Клиническая картина заболевания характеризуется гипогликемией и ацетонемией натощак, а также характерным внешним видом детей.
При анализе крови обнаруживают умеренно выраженную нормохромную анемию, повышенное содержание липидов, ацетона и кетоновых тел. Концентрация лактата в крови соответствует норме.
При анализе мочи отклонений от нормы не наблюдают.
Гликемические кривые в ответ па пероральное введение глюкозы необычны и имеют двух- или трехгорбный вид, что, по всей видимости, характерно для этого типа заболевания. Содержание НЭЖК в крови падает сразу после приема глюкозы, а к концу 3-го часа вновь повышается.
При введении галактозы, по данным ряда авторов, происходит увеличение концентрации глюкозы и лактата в крови. Такой же характер гликемических и лактатемических кривых наблюдается и при введении фруктозы.
Результаты, полученные при проведении адреналиновой и глюкагоновой нагрузок, зависят от того, через какой промежуток времени после еды проводится нагрузка. Так, например, если проводить исследование через 12—14 ч после еды, то за такой срок наружные ветви гликогена под действием фосфорилазы укорачиваются и образуется фосфорилазпый конечный декстрин, который не может использоваться клетками печени, и введение адреналина или глюкагона не вызывает подъема содержания глюкозы в крови.
Если же нагрузочную пробу с адреналином или глюкагоном проводить у больных с III типом гликогеноза через 3—5 ч после еды, когда успевают образоваться более длинные наружные ветви гликогена, то наблюдается такое же, как в норме, увеличение концентрации глюкозы в крови.
Так как глюкогеногенез у больных болезнью Кори не нарушен, при нагрузочной пробе с пероральным введением аминокислот или белка наблюдается повышение концентрации глюкозы в крови, которое может сохраняться на протяжении 3—4 ч (Fernandes, Van de Kamer).
Для окончательного диагноза заболевания необходимо проведение биохимического исследования пораженной ткани больного. Исследуется как общая активность фермента, так и отдельно его трансглюкозилазная и гидролитическая активности. Для установления подтипа заболевания необходимо определение обеих ферментативных активностей во всех органах и тканях больного.
При III типе гликогеноза наиболее часто наблюдается дефект активности как амило-1,6-глюкозидазы, так и глюкозо-6-фосфатазы, однако это не двойной генетический дефект, так как подавление глюкозо-6-фосфатазной активности вторично. В некоторых случаях мы наблюдали также снижение активности фосфорилазы, что усложняло диагноз заболевания и утяжеляло течение болезни.
Важным в диагностике гликогеноза III типа является определение концентрации и структуры полисахарида в органах и тканях больного.
С помощью различных методов исследования удалось выяснить, что у больных с дефицитом амило-1,6-глюкозидазы накапливается в клетках большое количество фосфорилированного декстрина гликогена (лимитдекстрина), который не вступает в обменные реакции.
Иногда активность амило-1,6-глюкозидазы отсутствует не только в гепатоцитах, но и в лейкоцитах, и эритроцитах, что приводит к накоплению в них лимитдекстрина. Факт отсутствия активности амило-1,6-глюкозидазы в форменных элементах крови широко используется в диагностике заболевания. В ряде случаев гликогеноза III типа отсутствие активности амило-1,6-глюкозидазы в печени не сопровождается отсутствием активности фермента и накоплением аномального по структуре гликогена в эритроцитах и лейкоцитах.
В культуре фибробластов кожи больных с III типом гликогеновой болезни активность амило-1,6-глюкозидазы в некоторых случаях может отсутствовать, что дает основание считать возможной пренатальную диагностику III типа гликогеноза.
При гистохимическом исследовании гепатоцитов находят их жировую инфильтрацию и накопление полисахарида в цитоплазме. При электронно-микроскопическом исследовании гепатоцитов полисахарид находится в цитоплазме в виде b-частиц. В мышцах значительное накопление полисахарида имеется в саркоплазме, между миофибриллами, а также в виде р-частиц.
Прогноз печеночной формы III типа гликогеновой болезни, как правило, благоприятен. Данное заболевание наиболее опасно в возрасте 4—5 лет, когда часты приступы гипогликемии, сопровождающиеся метаболическим ацидозом и ацетонемией. В более зрелом возрасте симптомы заболевания сглаживаются.
Болезнь Герса
Болезнь Герса (гепатофосфорилазная недостаточность) — гликогеноз, вызванный недостаточностью фосфорилазы печени.
Фосфорилаза печени катализирует фосфорилирование(расщепление) гликогена с образованием глюкозо-1-фосфата. Нарушение этого механизма приводит к избыточному отложению гликогена в печени.
Наследуется предположительно по аутосомно-рецессивному типу.
Проявляется обычно на первом году жизни.
Характерны значительное увеличение печени в результате гликогенной инфильтрации гепатоцитов, задержка роста, кукольное лицо, гиперлипемия, гипергликемия после внутривенного введения галактозы, повышенное содержание гликогена в эритроцитах.
Причина заболевания гликогенозом типа III - дефект амило-1,6-глюкозидазы. Поскольку боковые цепи гликогена полностью не отщепляются, главные цепи оказываются недоступными для фосфорилазы . В результате продукция глюкозы резко снижается, в печени и других органах накапливается остаточный декстрин .
Гликогеноз III типа ( лимитдекстриноз ; болезнь Форбса или болезнь Кори ) характеризуется отсутствием деветвящего фермента; в результате накапливается характерный разветвленный полисахарид (остаточный декстрин ).
Предполагают, что гликогеноз типа III может быть обусловлен дефектом 4-альфа-D-глюканотрансферазы либо сочетанием дефектов амило-1,6-глюкозидазы и 4-альфа-D-глюканотрансферазы .
У новорожденных, грудных детей и у детей младшего возраста продукция глюкозы при гликогенозе типа III нарушена не полностью, поскольку глюкоза образуется под действием фосфорилазы из боковых цепей гликогена , а также путем глюконеогенеза . Поэтому клинические проявления гликогенозов типа III и типа I существенно различаются:
- дети с гликогенозом типа III способны переносить более длительное голодание, чем дети с гликогенозом типа I, и гипогликемия у них не такая тяжелая; у новорожденных и грудных детей гликогеноз типа III нередко протекает бессимптомно, а нарушения режима кормления и сопутствующие инфекции не приводят к таким тяжелым последствиям, как при гликогенозе типа I;
- у грудных детей с гликогенозом типа III при голодании отмечается выраженная кетонемия ; уровни лактата и мочевой кислоты в плазме остаются нормальными, поскольку гликолиз в печени не усиливается, а глюконеогенез не нарушен; напротив, при гликогенозе типа I уровень кетоновых тел не повышается или повышается незначительно (несмотря на увеличение содержания свободных жирных кислот ), а уровни лактата и мочевой кислоты сильно возрастают;
- гиперлипопротеидемия при гликогенозе типа III выражена меньше, чем при гликогенозе типа I;
- характерны задержка роста и гепатомегалия ; у детей 3-6 лет с фиброзом печени отмечается спленомегалия ; почки не увеличены, их функция не нарушена; у 70% больных детей наблюдается мышечная слабость , обусловленная накоплением остаточного декстрина в мышцах; с возрастом миопатия исчезает, но у части больных она прогрессирует; накопление остаточного декстрина в миокарде приводит к кардиомиопатии .
У детей старшего возраста и взрослых клиническая картина гликогеноза типа III выглядит следующим образом. Проявления болезни с возрастом обычно исчезают, но у части больных прогрессирует миопатия. Тяжелая миопатия и кардиомиопатия наблюдаются между 20 и 40 годами. Размеры печени уменьшаются и в пубертатном периоде нормализуются, однако в большей части случаев при биопсии обнаруживают фиброз печени, а у некоторых больных развивается цирроз. Без лечения задерживаются рост и половое развитие .
При лабораторной диагностике гликогеноза типа III проводятся:
- обязательные исследования, в которых определяют уровни глюкозы и других метаболитов, а также активность ферментов печени натощак; для гликогеноза типа III характерны гипогликемия , кетонемия , умеренная гиперхолестеринемия и гипертриглицеридемия ; уровни лактата и мочевой кислоты нормальные. Активность АсАТ и АлАТ у детей постоянно повышена; у взрослых она в пределах нормы;
- провокационные пробы: введение глюкагона в/м или в/в в дозе 30 мкг/кг (максимум 1 мг) после ночного голодания не нормализует уровень глюкозы и не повышает уровень лактата ; если пробу проводят через 2 ч после приема богатой углеводами пищи (за это время удлиняются боковые цепи гликогена), уровень глюкозы возрастает;
- специальные исследования, которые проводят для окончательного диагноза, определяя активность амило-1,6-глюкозидазы и 4-альфа-D-глюканотрансферазы в биоптатах печени или мышц; исследование лейкоцитов ненадежно; содержание гликогена в печени и мышцах значительно повышено, его структура нарушена: укорочены боковые цепи ( остаточный декстрин ).
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет

Что такое гликоген и для чего он нужен?

Гликоген является сложным углеводом, который синтезируется путем соединения между собой молекул глюкозы, которая поступает с пищей. Он представляет собой стратегический запас глюкозы в клетках. Хранится преимущественно в печени и мышцах с той особенностью, что гликоген из печени при своем расщеплении обеспечивает глюкозой весь организм человека, а гликоген из мышц – только лишь сами мышцы. Гликоген в печени может составлять 8% от ее веса, а в мышцах – всего 1% . Но при этом за счет того, что общая мышечная масса в организме значительно больше, чем масса печени, мышечный запас превышает печеночный. Небольшое количество гликогена содержится в почках.
Как только человек приступает к какому-то роду деятельности (физическому или умственному), ему требуется энергия, которую он черпает при расщеплении гликогена и глюкозы. Поначалу расщепляется глюкоза, содержащаяся в крови, однако когда ее запасы исчерпываются (а поступления извне нет), в расход идет гликоген. Израсходованный запас гликогена затем вновь пополняется (при поступлении пищи).
Этапы превращения глюкозы в гликоген и его расщепление в обратном направлении осуществляются с помощью различных ферментов, причем в печени и мышцах они различные. Нарушения деятельности таких ферментов и приводят к развитию гликогенозов.
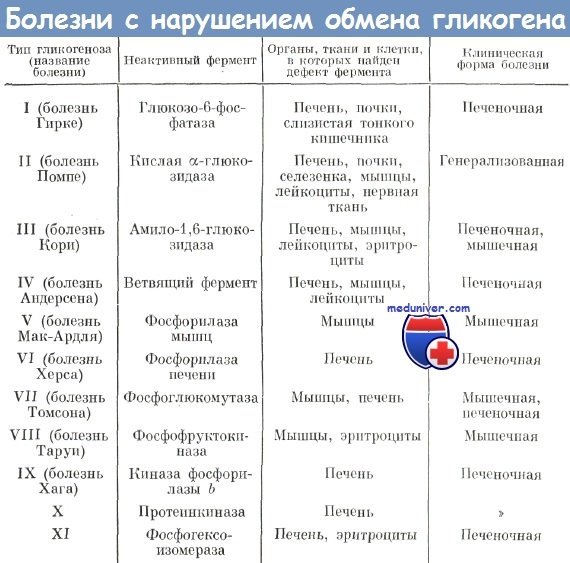
Гликогенозы встречаются, в среднем, с частотой 1 случай на 40-68 000 населения. Они всегда носят наследственный характер, то есть возникают тогда, когда в результате генных нарушений изменяется количество или активность одного из ферментов, необходимых для биохимических процессов создания и расщепления гликогена. Тип наследования, в основном, аутосомно-рецессивный (не связан с полом, и для его появления необходимо совпадение патологических генов, полученных от отца и от матери). Из всех 12 разновидностей гликогенозов, известных на сегодняшний день, 9 являются печеночными формами, 2 – мышечными, 1 – либо мышечной, либо генерализованной (с поражением практически всего организма). У каждой из разновидностей гликогенозов имеются свои отличительные особенности.
Виды гликогенозов
Этот вид гликогеноза возникает при дефекте фермента, задействованного в создании гликогена из глюкозы, в результате чего гликоген просто не образуется в достаточном количестве. То есть возникает дефицит гликогена, поэтому этот гликогеноз стоит под нулевым номером, как бы обособленно от остальных.
При агликогенозе как только весь сахар, имеющийся в крови, израсходуется, развивается гипогликемический синдром с утратой сознания вплоть до комы. Заболевание проявляет себя практически с первых дней жизни, особенно при отсутствии у матери достаточного количества молока при грудном вскармливании. Большие перерывы между кормлениями, ночной промежуток становятся причинами развития коматозного состояния.
Кома развивается в результате отсутствия достаточного энергетического обеспечения мозга. Весьма велика вероятность смертельного исхода в раннем детском возрасте. Если же им удается выжить, то развитие таких детей, как умственное, так и физическое значительно отличается от сверстников в худшую сторону. Введение глюкозы внутривенно выводит таких больных из коматозного состояния, однако при этом довольно долго сохраняется гипергликемия (поскольку не синтезируется гликоген).
Источником этой разновидности является дефицит глюкозо-6-фосфатазы. Последствием становится избыточное аккумулирование гликогена в печени и почках. В крови наблюдается низкое содержание глюкозы (гипогликемия). Возникает своеобразный парадокс: гликогена избыток, но расщепить его нечем, поэтому возникает дефицит глюкозы. Больные требуют очень частых приемов пищи, чтобы концентрация глюкозы в крови была достаточной для обеспечения энергетических нужд.
Болезнь проявляет себя в первые годы жизни. У таких деток нет аппетита, возникают частые рвоты. Наблюдаются проблемы с дыханием из-за обменных нарушений: одышка, кашель. Гипогликемии могут приводить к развитию ком с судорогами. Часто повышается температура без инфекционных причин.
Эта разновидность может быть представлена в виде двух форм: генерализованной (недостаток фермента наблюдается в печени, почках, мышцах) и мышечной (дефицит фермента только в мышцах).
Генерализованная форма дает о себе знать в первые полгода жизни. Связана с дефицитом α-глюкозидазы. Плохой аппетит, беспокойство, вялость, низкий мышечный тонус, задержка развития, нарушения дыхания становятся первыми симптомами. Постепенно увеличиваются в размерах сердце, печень, почки, селезенка. Со стороны дыхательной системы развиваются частые бронхиты и пневмонии. Развивается сердечная недостаточность. Поражение нервной системы проявляется параличами, нарушением глотания. Прогноз для жизни при генерализованной форме неблагоприятный.
Мышечная форма имеет более благоприятное течение. Является результатом дефицита кислой α-1,4-глюкозидазы только в мышцах. Заявляет о себе позже: приблизительно в 15-25 лет. Основным проявлением мышечной формы являются слабость и снижение тонуса мышц. Помимо мышечных проблем, возникают нарушения осанки (сколиотическая деформация грудного отдела позвоночника), явления незначительной сердечной недостаточности. Больные с этой формой заболевания доживают до старости.
Иногда после периода полового созревания болезнь протекает менее агрессивно. При этом нарушения печени отходят на второй план, а доминирующей симптоматикой становится мышечная слабость и истончение мышц (преимущественно икроножных).
Становится результатом дефицита амило-(1,4-1,6)-трансглюкозидазы. Это приводит к образованию неправильного гликогена. Эта разновидность гликогеноза может наследоваться сцепленно с полом, а не только аутосомно. С первых дней жизни начинается отложение неправильного гликогена в печени. Это быстро приводит к нарушению деятельности клеток печени, застою желчи, развитию гепатита, а затем и цирроза печени. Желтуха, повышенная кровоточивость, увеличение живота в размерах с накоплением жидкости в брюшной полости (асцит), кожный зуд, интоксикация организма, – все это следствия развившегося цирроза печени. Развиваются генерализованная мышечная гипотрофия и тяжелая кардиомиопатия. Часто присоединяются бактериальные инфекции. Смертельный исход наступает на 3-5 году жизни.
Это исключительно мышечный гликогеноз, потому что в основе лежит изъян такого фермента, как мышечная фосфорилаза. В мышечной ткани происходит отложение нерасщепленного гликогена, из-за чего мышцы уплотняются и утолщаются, однако при этом становятся очень слабыми, быстро утомляющимися. Возникают болезненные мышечные спазмы при физической нагрузке, которые могут сопровождаться повышенной потливостью и бледностью кожных покровов, тахикардией. С мочой может выделяться мышечный белок. Все эти проявления возникают до подросткового периода и постепенно нарастают. Возможно формирование контрактур крупных суставов. По сравнению с другими разновидностями гликогенозов, гликогеноз V типа является доброкачественным заболеванием.
В основе такого гликогеноза лежат проблемы с фосфорилазой печени. В результате гликоген накапливается в печени. Уже у младенцев наблюдается увеличение размеров печени, отмечается отставание ребенка в развитии, дети слабо набирают вес. Вместе с другими обменными нарушениями в крови выявляют повышенное содержание жира. Отмечается увеличенное содержание гликогена в красных кровяных тельцах (эритроцитах).
Заболевание связано с дефицитом миофосфофруктокиназы мышц, из-за чего в них возникает отложение гликогена. По своим клиническим признакам гликогеноз VII типа практически не отличается от гликогеноза V типа и также имеет относительно доброкачественное течение.
Это разновидность гликогеноза передается с половой хромосомой. Источником является дефицит фермента в печени. Накопление гликогена приводит к печеночной недостаточности.
Эта разновидность описана всего лишь единственный раз во всем мире. Тип наследования установить не удалось. Заболевание протекало с увеличением печени, сопровождалось болью и напряжением мышц при вовлечении их в работу.
Гликогеноз с неустановленным механизмом передачи. Ферментные дефекты обнаружены в печени и почках. Этой разновидности гликогенозов свойственно увеличение размеров и уплотнение печени, отставание в росте. Отличием от других разновидностей гликогенозов является уменьшение количества фосфатов в крови и развитие в связи с этим рахита. По достижении периода полового созревания наблюдается тенденция к некоторому улучшению состояния: печень уменьшается в размерах, содержание фосфора нормализуется, дети начинают расти.
Лечение
Гликогенозы, как и практически все генетические заболевания, являются неизлечимой патологией. Все меры медицинской помощи, по существу, являются симптоматическими. Тем не менее, поскольку ряд гликогенозов имеет благоприятный прогноз для жизни при соблюдении ряда условий (в частности мышечная форма II типа, III, V, VI, VII, IX, XI тип), то лечебные мероприятия способствуют уменьшению ряда симптомов и улучшению состояния здоровья пациента.
В основу лечения при гликогенозах положена диетотерапия, позволяющая избежать гипогликемии и второстепенных нарушений метаболических процессов в организме. Суть диеты заключается в изучении гликемического профиля больного и подборе такого режима приема пищи, который позволит избежать прогрессирования биохимических нарушений (нарушений метаболизма жиров, молочной кислоты) и обеспечит достаточный уровень глюкозы в крови. Частые, в том числе ночные, кормления у маленьких детей помогают избежать гипогликемии. Обычно назначается пища, содержащая много белков и углеводов, а жиры ограничиваются. Процентное соотношение приблизительно следующее: углеводы — 70%, белки – 10%, жиры – 20%.
Для того чтобы не приходилось кормить ребенка несколько раз за ночь, может использоваться сырой кукурузный крахмал (назначается детям старше 1 года), который разводят водой в соотношении 1:2. Начинают введение с дозы 0,25 мг/кг, затем ее постепенно увеличивают настолько, чтобы введенной дозы крахмала хватало для обеспечения организма глюкозой на 6-8 часов, то есть на всю ночь. Таким образом, прием крахмала на ночь позволяет отказаться от ночных кормлений, что обеспечивает детям полноценный сон без перерывов.
В тех случаях, когда маленькие дети страдают от частых приступов гипогликемии, и повлиять на это только соблюдением диеты не удается, назначается дополнительное введение чистой глюкозы или смеси, обогащенной мальтодекстрином.
При гликогенозе I типа требуется значительно ограничить продукты, содержащие галактозу и фруктозу (молоко, большинство фруктов). При III типе гликогеноза таких ограничений нет. При VII типе нужно ограничить поступление сахарозы.
В ряде случаев (особенно при возникновении других, интеркуррентных заболеваний у таких детей) одного энтерального питания становится недостаточно, поскольку потребность организма в энергии повышается. Тогда прибегают к кормлению через назогастральный зонд и внутривенным инфузиям в условиях стационара.
Те разновидности гликогенозов, при которых дефекты ферментов локализованы только в мышцах, требуют употребления фруктозы внутрь по 50-100 г в день, комплекса витаминов, аденозинтрифосфорной кислоты.
Из медикаментозных препаратов при гликогенозе I типа используют препараты кальция, витамин Д и В1, аллопуринол (для предотвращения подагры и отложения уратов в почках), никотиновую кислоту (для снижения риска калькулезного холецистита и предотвращения панкреатита). Если с почками начинает выводиться белок, тогда назначают ингибиторы ангиотензинпревращающего фермента (Лизиноприл, Эналаприл и другие).
Для гликогеноза II типа разработана специфическая ферментная терапия (заместительная). Препарат Миозим вводится по 20 мг/кг каждые две недели. Миозим представляет собой созданный с помощью генной инженерии искусственный человеческий фермент α-глюкозидазу. Естественно, эффект тем больше, чем раньше начато лечение. Но пока что препарат разрешен к применению только в некоторых странах Европы, в Японии и США. Генная инженерия продолжает разработки в этом направлении, пытаясь синтезировать и другие ферменты, необходимые для нормального синтеза и расщепления гликогена, чтобы помочь больным с остальными формами гликогенозов.
Некоторым больным помогает введение глюкокортикоидов, анаболических гормонов и глюкагона. Препараты стимулируют некоторые биохимические процессы (например, глюконеогенез, то есть процесс синтеза глюкозы из неуглеводных веществ), тем самым уменьшая проявления заболевания.
Из хирургических методов лечения при некоторых формах гликогенозов используют наложение портокавального анастомоза или трансплантацию печени. Портокавальный анастомоз накладывают больным с тяжелой формой гликогеноза I и III типов. Он позволяет уменьшить обменные нарушения, способствует регрессу размеров печени, улучшает переносимость гипогликемии. Пересадка печени от донора осуществляется при I, III, IV типах гликогенозов. При гликогенозе I типа операция проводится только при неэффективности мероприятий диетотерапии, при гликогенозе III типа – когда печень больного уже не спасти.
Таким образом, гликогенозы – это довольно обширная группа болезней обмена веществ с генетическими истоками. На сегодняшний день, медицина не располагает 100%- ми методами эффективного лечения сего недуга, перспективы в этом направлении принадлежат генной инженерии.
Читайте также:


