Персистирующая герпесная что это
Герпес-вирусные инфекции (от греч. herpes — ползучий) — группа инфекционных заболеваний, вызываемых представителями семейства герпес-вирусов (Herpesviridae). Антигенных серотипов, выделенных от человека, восемь: вирус простого герпеса 1-го и 2-го типов, вирус ветряной оспы — опоясывающего герпеса или вирус герпеса человека 3-го типа, вирус герпеса человека 4-го типа — вирус Эпштейна–Барр (ВЭБ) — вызывает инфекционный мононуклеоз; вирус герпеса человека 5-го типа — цитомегаловирус (ЦМВ), вирус герпеса человека 6-го, 7-го типов — вызывают внезапную экзантему и синдром хронической усталости, вирус герпеса человека 8-го типа ассоциирован с саркомой Капоши [1]. Все герпес-вирусы являются ДНК-содержащими и сходны по морфологии, типу нуклеиновой кислоты, способу репродукции в ядрах инфицированных клеток.
В РФ сохраняется высокий уровень детской инфекционной заболеваемости [2]. Отмечается возрастание роли инфекций, вызванных вирусами цитомегалии, ВЭБ, герпеса 1-го, 2-го, герпеса 6-го и 8-го типов. Среди детской популяции герпетическая инфекция широко распространена. Так, 70–90% детей 3-летнего возраста имеют достаточно высокий титр вируснейтрализующих антител к вирусу простого герпеса 1-го типа [3]. Эти инфекции у детей часто принимают хроническое течение вследствие персистенции возбудителя и формирования необратимых изменений в органах и системах.
За последние пять лет увеличилось число детей в возрасте до одного года, умерших от генерализованных вирусных инфекций [4]. Велика роль герпес-вирусных инфекций, особенно цитомегаловирусной, в формировании перинатальной патологии и младенческой смертности. Риск развития внутриутробной инфекции зависит от характера взаимоотношений между организмом беременной женщины и микроорганизмом (первичное заражение во время беременности или реактивация ранее приобретенной инфекции).
Проблема врожденной инфекционной патологии является приоритетной для России [5].
Иммуногенез герпес-вирусной инфекции. Длительное нахождение герпес-вируса в организме человека становится возможным благодаря сложной стратегии противоборства и ускользания от иммунной системы хозяина. В достижении этого состояния можно выделить три пути стратегии возбудителя:
Вирус простого герпеса. В инфицированных клетках вирус простого герпеса образует внутриядерные включения и гигантские клетки, оказывает выраженное цитопатическое действие, проявляющееся округлением и образованием многоядерных клеток. Вирус является слабым индуктором интерферона, в связи с чем инактивация вирусной ДНК внутри клеток не наступает и он сохраняется внутри клеток длительное время, периодически вызывая рецидивы заболевания.
ЦМВ. Сущность проблемы ЦМВ-инфекции в том, что последняя относится к так называемым оппортунистическим инфекциям, клинические проявления которых возможно в условиях первичного или вторичного иммунодефицита.
ЦМВ поражает разнообразные клетки, чаще всего лейкоциты (лимфоциты, моноциты), эпителиальные клетки (дыхательных путей, слюнных желез, почек). С клеток крови ЦМВ с большим постоянством переходит на эндотелий, тропизм к которому у него весьма выражен. Поврежденные эндотелиальные клетки постоянно обнаруживаются в токе крови при активной/реактивированной ЦМВ-инфекции. Повреждение эндотелия сосудов имеет собственное патогенетическое значение в формировании органных поражений, так как вызывает ишемию или кровоизлияния в различные ткани [6].
В раннем неонатальном периоде (0–7 дней) у детей с ЦМВ-инфекцией наблюдались симптомы интоксикации, серый колорит кожи, выраженная мышечная гипотония, большая первоначальная потеря массы тела, синдром рвоты или срыгиваний, признаки угнетения ЦНС. В позднем неонатальном периоде (от 7 дней до одного мессяца) анализ клинических проявлений острой ЦМВ-инфекции выявляет поражение многих органов и систем. Так, у всех детей обнаруживаются гипоксически-ишемическая энцефалопатия с трансформацией синдрома угнетения в синдром гипервозбудимости, проявления анемии, патологическая гипербилирубинемия, увеличение печени и селезенки.
ВЭБ относится к подсемейству бета-герпес-вирусов. Вирусный геном заключен в нуклеокапсид, который покрыт гликопротеидным тегументом gp350, являющимся фактором рецепторного взаимодействия [7]. Проникновение вируса в В-лифоциты осуществляется через рецептор этих клеток CD21-рецептор к C3d-компоненту комплемента. ВЭБ-инфекция широко распространена среди людей, причем первичное инфицирование, как правило, происходит в антенатальном или детском возрасте, но манифестация ВЭБ-инфекции в виде отчетливых клинических проявлений инфекционного мононуклеоза в большинстве случаев происходит в школьном возрасте при различного рода иммунопатологических реакциях. Манифестация инфекции в виде инфекционного мононуклеоза может осложняться поражением печени, слизистой оболочки желудка, ткани почек, лимфоидного аппарата.
Особый характер взаимодействия микро- и макроорганизма при хронических персистирующих инфекциях обусловливают трудности лабораторной диагностики. Обнаружение возбудителя не может быть единственным критерием подтверждения диагноза. Необходима комплексная оценка клинических и лабораторных данных для постановки диагноза.
Цель исследования. Определить клинические особенности течения персистирующих герпес-вирусных инфекций у детей и оценить значимость комплекса лабораторных исследований, в том числе показателей общей иммунологической реактивности у больных при персистирующем у них инфекционном процессе.
Материал и методы исследований. Под наблюдением находилось 63 пациента в возрасте от одного месяца до 7 лет, из них детей до одного года было 25, от одного года до трех лет — 22 и старше трех лет — 15 больных. Среди обследованных детей преобладали пациенты первых двух лет жизни — 47 детей (74,6%) и старше двух лет было 15 больных (25,4%).
Результаты. В клинической диагностике персистирующих инфекций у детей следует отводить первостепенное значение неблагополучию акушерского анамнеза матерей больных детей.
Беременность и роды были осложненными у большинства матерей наблюдаемых детей, чаще всего у них отмечались гестозы и угроза выкидыша, рождение недоношенных, в родах гипоксия плода, преждевременная отслойка плаценты, кесарево сечение и др. У 32 женщин из 63 (50,7%) были различные соматические заболевания (хронический пиелонефрит, кольпит, анемия, аутоиммунный тиреоидит и др.). При обследовании беременных женщин было выявлено как моноинфицирование (у 30 из 63–47,6%), так и сочетания инфекций (у 16 из 63–25,4%). Наиболее часто обнаруживались герпес-вирусы и цитомегаловирусы (суммарно у 27 женщин из 63–43%) и реже другие возбудители — хламидии, микоплазмы (у 11 беременных — 17,4%). Высокая частота вышеуказанных осложнений свидетельствует о несомненной роли инфекции как отягощающего фактора в течение гестационного периода и родов.
Заподозрить внутриутробную или персистирующую инфекцию у детей можно было по высокой степени поражения у детей различных органов и систем: ЦНС (71,4%), органов дыхания (88,8%), желудочно-кишечного тракта (95,2%), поражению глаз (31,7%), лимфатического аппарата (15,9%).
В процессе наблюдения за детьми в недалеком прошлом все дети обследовались на состояние микробиоценоза кишечника.
У всех детей обнаруживались нарушения как в основных компонентах биоценоза, так и в составе условно-патогенной флоры. Следует отметить, что у всех пациентов проводилась коррекция микробиоценоза повторными курсами пре- и пробиотиков, однако восстановления микрофлоры до нормобиоценоза не наблюдалось ни у одного пациента. Следовательно, без выявления и адекватного лечения основного заболевания не удается курировать дисбиотические нарушения в организме ребенка.
Закономерен вопрос о правильности выбора комплекса диагностики внутриутробной и персистирующей инфекции у детей. В зависимости от возраста пользуются разными методами диагностики. Важное значение отводится сбору семейного анамнеза. Диагностика внутриутробных инфекций у детей должна опираться на клинические проявления как общего характера, так и на типоспецифические ее признаки, а также основываться на анализе комплекса лабораторных методов обследования [8].
При оценке клинических анализов крови у наблюдаемых детей обращали на себя внимание значительные отклонения в различных показателях гемограммы: выраженная анемизация (у 31,7% пациентов), нейтропения (у 19%), лимфоцитоз (у 27%), лейкопения с лимфоцитопенией (36,5%), ускорение СОЭ (у 27%), что в совокупности свидетельствовало о наличии воспалительного процесса в организме с выраженным снижением иммунореактивности у детей.
При скрининговом серологическом обследовании методом ИФА на внутриутробные инфекции у детей наиболее часто выявлялись положительные титры типоспецифических антител класса IgM и/или IgG к герпес-вирусам. Диагностические титры антител класса IgM и IgG определялись к ЦМВ (у 9 детей), к HV 1-го, 2-го типа (у 9 детей). Антитела к антигенам ВЭБ обнаруживались у 20 детей, из них у 10 детей были антитела класса IgG к раннему антигену ВЭБ и антитела класса IgM к капсидному антигену ВЭБ, что свидетельствовало об активной фазе ВЭБ-инфекции. Остальные 10 пациентов имели антитела класса IgG к нуклеарному (ядерному) антигену ВЭБ, что расценивалось как поздняя стадия инфекции.
У детей при персистирующем течении с реактивацией инфекции, которое чаще возникало после провоцирующих воздействий (ротавирусные диареи, ОРВИ, профилактические прививки) ПЦР-тесты при исследовании биосубстратов: кровь, осадок мочи, секрет из зева давали положительные результаты с последующим нарастанием титра типоспецифических антител по данным ИФА.
Совокупность проведенных исследований позволила выделить у обследованных больных следующие формы инфекций: моноинфекции были у 21 пациента — 31,8% (ЦМВ — у 5 детей, HV 1-го, 2-го типа — у 6 детей и ВЭБ — у 10), у 42 детей из 63 (68,2%) обнаруживались микст-инфекции. У 23 детей была ассоциация ЦМВ с герпес-вирусами (у 9 детей с HV 1-го, 2-го типа, у 3 детей — с HV 6-го типа и у 11 детей — с C. albicans и хламидиями). Микст-формы герпеса 1-го, 2-го типа были выявлены у 9 больных, у них были ассоциации с микоплазмами и хламидиями. Ассоциации ВЭБ были обнаружены у 10 детей (5 больных имели ассоциацию с ЦМВ, пациента — с HV 6-го типа и 2 больных — с Yersinia pseudotuberculosis).
Из 63 больных у 21 (33,3%) с моноинфекцией течение заболевания расценивалось как латентное (с ЦМВ-инфекцией у 5 и HV 1-го, 2-го типа у 6) и как персистирующее (у 10 детей с ВЭБ-инфекцией). У 14 детей из 42 с микст-инфицированием (у 1/3) было персистирующее течение инфекционного процесса (у 3 детей с ЦМВ-инфекцией в ассоциации с HV 6-го типа и у 11 детей с ЦМВ-инфекцией в ассоциации с C. albicans и хламидиями). У 28 детей из 43 (у 2/3) наблюдалось персистирующее течение с реактивацией инфекции (у 9 детей с ЦМВ-инфекцией в ассоциации с HV 1-го, 2-го типа; у 9 детей с HV 1-го, 2-го типа в ассоциации с хламидиями или микоплазмами и у 10 детей с ВЭБ инфекцией в ассоциации с ЦМВ, HV 6-го типа и ВЭБ в ассоциации с Y. pseudotuberculosis).
Коэффициент фагоцитарной защиты у детей с моноинфицированием и микст-формами герпесвирусной инфекции оказался достоверно сниженным по сравнению со средневозрастной нормой для здоровых детей (0,634 ± 0,05 усл. ед. и 0,540 ± 0,03 усл. ед. соответственно при норме 0,946 ± 0,03, Р1–2 и Р2–3 0,05). Недостаточность защиты клеточно-фагоцитарного звена иммунитета играет важную роль в патогенезе герпес-вирусных инфекций, что должно учитываться в лечении этих заболеваний.
Отклонение величины показателя ИЛМП имело противоположную направленность, она оказывалась достоверно повышенной как при моноинфекции, так и при микст-формах герпес-вирусных инфекций по сравнению с контролем (Р1–3 и Р2–3 0,05. Увеличение показателя ИЛМП у детей с герпес-вирусной инфекцией еще раз подтверждает лимфотропность вирусных антигенов.
ЛИИ оказался достоверно повышенным у больных с микст-формами герпес-вирусной инфекции по сравнению со средневозрастной нормой в контроле (Р2–3 0,05), они имели лишь тенденцию к повышению. Однако при оценке индивидуальных показателей ЛИИ у детей с моноинфицированием герпес-вирусами выявились существенные особенности. У 13 детей из 21 (61,9%) ЛИИ был ниже возрастной нормы, что отражало фазу положительной анергии к совершенно определенному антигену. Это свидетельствует, что организм защищен сейчас только от специфических антигенов, однако он остается уязвимым в отношении других патогенов, то есть низкий индекс интоксикации отнюдь не указывает на полное благополучие организма.
Полученные результаты исследований подтверждают выраженность иммунного дисбаланса как в клеточно-фагоцитарном звене иммунитета, так и в гуморальном, а также свидетельствуют о значимости эндогенной интоксикации у больных с микст-формами герпес-вирусной инфекции и уязвимости иммунной защиты у детей и при моноинфицировании.
Клинический пример. Андрей С., 2 года 5 мес., поступил в стационар с жалобами на высокую температуру — 39 °С, однократную рвоту, сниженный аппетит и жидкий стул 5 раз в сутки. Болен в течение двух недель ОРВИ, получил амбулаторно симптоматическое лечение. К концу второй недели ухудшилось состояние, рецидив лихорадки — 39 °C и дисфункция кишечника. Направлен на госпитализацию.
Анамнез жизни. От первой беременности, протекала с угрозой выкидыша, нефропатией, преэклампсией в родах. Во время беременности перенесла ОPВИ с лимфаденитом. Обследование на пренатальные инфекции, обнаруживались антитела класса IgG к антигенам ЦМВ и вирусу герпеса 1-го, 2-го типа. Лечение не проводилось. Роды в срок, масса при рождении 3500 г, длина 51 см. К груди приложен сразу, сосал активно, грудное вскармливание до года, прикормы вводились в 5 и 6 месяцев. Адаптация к пище нормальная. В массе прибавки достаточные, в 2 г. 5 мес — масса 14 кг 810 г, рост 93 см.
Состояние здоровья в течение первого года жизни неблагополучное. Длительно держалась желтуха, в возрасте 3 недель: общий билирубин — 315,1 мкмоль/л, непрямой — 297,3 мкмоль/л, прямой — 17,8 мкмоль/л. Одновременно с желтухой был неустойчивый стул. В 1-месячном возрасте неврологом установлен диагноз перинатального поражения ЦНС, гипоксическо-ишемического генеза, гипертензионный синдром.
К возрасту 6 мес были обнаружены изменения в гемограмме: гемоглобин — 112 г/л, эритроциты — 4,2 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, сегментоядерные нейтрофилы — 12%, лимфоциты — 67%, моноциты — 12%, эозинофилы — 8%, базофилы — 1%, СОЭ — 3 мм/час. В повторных анализах крови во 2-м полугодии продолжала выявляться нейтропения. Консультирован гематологом, установлен диагноз доброкачественной нейтропении детского возраста. В 10 мес в анализе крови выявлена анемия (гемоглобин — 107 г/л, эритроциты — 3,81 × 10 12 /л, цветовой показатель — 0,84, тромбоциты — 280 × 10 9 /л, сегментоядерные нейтрофилы — 11%, лимфоциты — 76%, моноциты — 90%, эозинофилы — 3%, базофилы — 1%). Гематологом назначено лечение Сорбифером дурулесом, курс 1 месяц.
Осмотрен ортопедом: отмечено ограниченное отведение бедер. В один год на УЗИ органов брюшной полости определялся перегиб в области шейки желчного пузыря, холестаз. Осмотр генетика: диагностирована недифференцированная дисплазия соединительной ткани с поражением костно-мышечной системы. В 1 г. 5 мес перенес острый энтероколит неуточненной этиологии, госпитализировался в стационар на 10 дней, получал лечение метронидазолом и Энтеролом. В течение 1,5 лет переносит частые ОРВИ с повышением температуры до 38,8 °С в течение 3–4 дней и катаральными явлениями.
Объективные данные. При последней госпитализации отмечались явления назофарингита в течение 5 дней, лихорадка до 39 °С 2 дня, кожные покровы без сыпи. При осмотре — гиперемия зева и увеличение подчелюстных, передних и заднешейных лимфоузлов, стул учащенный до 3 раз в сутки, с 5 дня лечения — оформленный. ЛОР-врачом диагностирован хронический тонзиллит и аденоидит, в фазе обострения.
Обследование. В мазке из зева — высев гемолитического стрептококка. Посевы на патогенную кишечную флору отрицательные. ИФА на ротавирус — отрицательный. Реакция непрямой гемагглютинации (РНГА) с кишечными диагностикумами — отрицательные.
Гемограмма при поступлении: гемоглобин 104 г/л, эритроциты — 3,7 × 10 12 /л, цветовой показатель — 0,85, лейкоциты — 6,4 × 10 9 /л, палочкоядерные нейтрофилы — 4%, сегментоядерные — 72%, лимфоциты — 18%, моноциты — 4%, эозинофилы — 2%, СОЭ — 4 мм/час.
Гемограмма в динамике: гемоглобин — 109 г/л, эритроциты — 3,4 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, палочкоядерные нейтрофилы — 19%, сегментоядерные — 42%, лимфоциты — 28% (широкоплазменные лимфоциты), моноциты — 8%, плазматические клетки — 1%, эозинофилы — 2%, СОЭ — 13 мм/час. В дальнейшем — красная кровь оставалась без динамики, число лейкоцитов не изменялось, нарастал лимфоцитоз до 43% (широкоплазменные формы), моноцитов до 12%, СОЭ повысилась до 20 мм/час.
Анализ мочи без отклонений от нормы (пятикратно). В биохимическом анализе крови — умеренная гипоальбуминемия, печеночные пробы — в норме. ИФА на специфические антитела к антигенам ЦМВ класса IgM — отрицательный, класса IgG — положительный. Маркеры ДНК-ЦМВ в осадке мочи и в секрете из зева методом ПЦР не найдены. ИФА на специфические антитела к хламидийному антигену (Chlamydia pneumoniae) — положительный в титре 1:80. Маркеры ДНК Ch. pneumoniae в мазке из носоглотки методом ПЦР — положительный. ИФА с микоплазменным антигеном — IgM и IgG — отрицательные, с герпес-вирусами 1-го, 2-го типа — IgM и IgG отрицательные. ИФА на специфические антитела к антигенам ВЭБ: IgM к капсидному антигену — отрицательный, IgG к раннему антигену — положительный и IgG к ядерному антигену (IgGNA) — положительный (> 0,5 ед.). Совокупность данного анализа была индикатором активной фазы мононуклеозной инфекции.
После проведенного обследования ребенку была назначена адекватная комплексная терапия (Cумамед, Ликопид с последующим переходом на Виферон, витамины А, Е, Пиридоксин, пробиотики — курс Примадофилуса). Наблюдение за ним продолжается.
Выводы
- В пользу диагностики персистирующих инфекций у детей свидетельствует отягощенный акушерско-гинекологический и соматический анамнез, а также инфекционный фактор беременных женщин.
- Заподозрить внутриутробное инфицирование у детей раннего возраста можно по высокой степени поражения различных органов и систем: ЦНС, органов дыхания, пищеварения, лимфатического аппарата.
- Диагностика внутриутробных инфекций должна базироваться на клинических проявлениях болезни и основываться на комплексе лабораторных и иммунологических методов исследования с их оценкой в динамике (в 1 мес, 3 мес, 6 мес и в 1 год жизни).
- Правильность выбора комплекса клинических и лабораторных тестов (ИФА в динамике, ПЦР-тесты с различными биосубстратами) приводит к своевременной диагностике внутриутробных инфекций и позволяет выявить моноинфицирование или микст-формы при их длительной персистенции.
- Для суждения о состоянии общей иммунологической реактивности детей с персистирующими герпесвирусными инфекциями может использоваться оценка интегральных показателей (КФЗ и ИЛМП): чем меньше величина КФЗ, тем больше выражен риск прорыва защитного барьера на пути инфекции.
- Наиболее неблагоприятное персистирующее течение имеют микст-формы герпесвирусной инфекции (ЦМВ, герпес, ВЭБ) или их сочетания с внутриклеточными возбудителями.
Литература
Ф. Н. Рябчук, кандидат медицинских наук, доцент
З. И. Пирогова, кандидат медицинских наук, доцент
СПбМАПО, Санкт-Петербург
[youtube.player]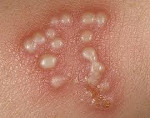
Герпетическая инфекция — хроническая рецидивирующая инфекция, вызываемая вирусом простого герпеса и характеризующаяся преимущественным поражением покровных тканей и нервных клеток. Основной путь передачи герпетической инфекции контактный, но возможна воздушно-капельная и трансплацентарная передача вируса. Отличительной особенностью герпетической инфекции является способность вирусов длительно персистировать в нервных ганглиях. Это приводит к возникновению рецидивов герпеса в периоды снижения защитных сил организма. К проявлениям герпетической инфекции относятся герпес лабиалис, генитальный герпес, висциральный герпес, генерализованный герпес, герпетический стоматит и конъюнктивит.
Общие сведения
Герпетическая инфекция — хроническая рецидивирующая инфекция, вызываемая вирусом простого герпеса и характеризующаяся преимущественным поражением покровных тканей и нервных клеток. В настоящее время различают два типа вируса простого герпеса. I тип вируса преимущественно поражает слизистые оболочки и кожные покровы рта, носа, глаз, передается преимущественно контактно-бытовым путем, II тип вызывает генитальный герпес, передается преимущественно половым путем. Резервуаром и источником герпетической инфекции является человек: носитель или больной. Выделение возбудителя может продолжаться весьма длительное время.
Механизм передачи – контактный, вирус выделяется на поверхность пораженных слизистых оболочек и кожных покровов. Помимо основных путей передачи для I типа вируса может так же реализоваться воздушно-капельный, воздушно-пылевой, а тип II может передаваться вертикально от матери к ребенку (трансплацентарно и интранатально). Вирусы, проникшие в организм, склонны к длительному сохранению (преимущественно в клетках ганглиев), вызывая рецидивы инфекции в периоды ослабления защитных сил организма (простуды, авитаминозы). Чаще первичная инфекция протекает латентно, заболевание проявляется позднее, острая инфекция отмечается только у 10-20 % заразившихся.
Герпетическая инфекция классифицируется по преимущественному поражению тех или иных тканей: герпес кожи, слизистой оболочки рта, глаз, ОРВИ, генитальный герпес, висцеральный герпес, герпетическое поражение нервной системы, герпес новорожденных, генерализованная форма.

Симптомы герпетической инфекции
Инкубационный период герпетической инфекции обычно составляет 2-12 дней, начало может быть как острым, так и постепенным, часто первичная инфекция вовсе остается незамеченной больным, течение заболевания становится рецидивирующим. Рецидивы могут возникать как 2-3 раза в год, так и крайне редко – 1-2 раза в 10 лет и реже. Рецидивы склонны развиваться на фоне ослабления иммунитета, поэтому нередко клинические проявления герпеса сопровождают ОРВИ, пневмонии, другие острые инфекции.
Герпетические поражения кожи локализуются преимущественно на губах и крыльях носа. Сначала субъективно ощущается зуд и жжение в локализованной области кожи, затем эта область уплотняется, на ней формируются везикулы, наполненные прозрачным содержимым, постепенно мутнеющим. Пузырьки вскрываются, оставляя после себя неглубокие эрозии, корочки, заживающие через несколько дней без последствий. Иногда через поврежденные покровы проникает бактериальная флора, вызывая вторичное нагноение и затрудняя заживление. Может отмечаться регионарный лимфаденит (узлы увеличены, слегка болезненны). Общей симптоматики не наблюдается, либо заболевание протекает на фоне других инфекций, вызывающих дополнительную клинику.
Герпетические поражения слизистой оболочки рта характеризуется возникновением острого или рецидивирующего стоматита. Заболевание может сопровождаться явлениями общей интоксикации, лихорадкой. Слизистая оболочка ротовой полости покрывается группами мелких везикул, наполненных прозрачным содержимым, быстро вскрывающихся и оставляющих болезненные эрозии. Эрозии в ротовой полости могут заживать до 2 недель. Заболевание может протекать в виде афтозного стоматита (происходит формирование афт – единичных, медленно заживающих эрозий слизистой оболочки полости рта). При этом общие клинические проявления (интоксикация, гипертермия), как правило, отсутствуют. Герпетический стоматит склонен к рецидивированию.
Герпес по типу ОРВИ нередко протекает без характерных пузырьковых высыпаний на слизистых и коже, напоминая по клинике другие респираторные вирусные заболевания. В редких случаях герпетическая везикулярная сыпь формируется на миндалинах и задней стенке глотки (герпетическая ангина).
Генитальный герпес обычно проявляется как местными высыпаниями (везикулы преимущественно образовываются на головке полового члена и внутренней поверхности крайней плоти у мужчин и на больших и малых половых губах у женщин), так и общими признаками (лихорадка, интоксикация, регионарный лимфаденит). Больные могут отмечать боль внизу живота и в области поясницы, в местах локализации сыпи - жжение и зуд.
Высыпания при генитальном герпесе могут прогрессировать, распространяясь на слизистую влагалища и шейку матки, уретры. Хронический генитальный герпес может стать причиной рака шейки матки. Во многих случаях генитальным высыпаниям сопутствует герпес слизистых оболочек рта и глаз.
Офтальмогерпес проявляется высыпанием на роговице, в последующем вызывает образование язвенных дефектов, снижение чувствительности роговицы, что способствует ухудшению зрения. Герпес задних отделов глазного яблока встречается редко. Хронический рецидивирующий герпес глаза может привести к стойкому помутнению роговицы, слепоте.
Герпетическая инфекция нервной системы протекает по типу серозного менингита (выражается в виде общей и менингеальной симптоматики, протекает доброкачественно), либо энцефалита (выраженная интоксикация, лихорадка достигает крайне высоких цифр, отмечается судорожный симптом, разнообразные парезы, параличи и расстройства сознания). Герпетический энцефалит в 30% случаев приводит к летальному исходу, после излечения оставляет тяжелые последствия в виде стойких параличей и парезов, деменции.
Висцеральные формы герпеса протекают в соответствии с клиникой воспалительных заболеваний пораженных органов. Это могут быть герпетические пневмонии, гепатиты, панкреатиты, нефриты, эзофагиты, герпес надпочечников. При герпетическом поражении полых органов, доступных для эндоскопии, на слизистой оболочке могут отмечаться везикулярные высыпания и эрозии.
У новорожденных и больных с выраженной иммунной недостаточностью может развиться генерализованная форма герпетической инфекции, характеризующаяся высокой распространенностью кожных проявлений, поражений слизистых оболочек и внутренних органов на фоне общей интоксикации и лихорадки. Генерализованная форма у больных СПИД нередко протекает в виде герпетиформной экземы Капоши.
Опоясывающий лишай
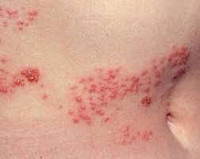
Одной из форм герпетической инфекции является опоясывающий лишай. Началу заболевания нередко предшествуют продромальные явления – общее недомогание, головные боли, подъем температуры до субфебрильных цифр, диспепсические симптомы. Могут отмечаться жжение и зуд в области проекции периферических нервных стволов. Продромальный период протекает от одного дня до 3-4 суток, может отличаться различной интенсивностью признаков в зависимости от состояния организма больного. Во многих случаях отмечается острое начало: температура резко поднимается до фебрильных цифр, отмечается общая интоксикация, появляются герпетиформные высыпания на коже по ходу иннервации спинальных ганглиев.
Процесс может распространяться в пределах одного или нескольких нервных стволов. Чаще всего высыпания локализуются вдоль проекции межреберных нервов или ветвей тройничного нерва на лице, реже отмечается поражение конечностей, гениталий. Высыпания представляют собой группы везикул с серозным содержимым, располагающиеся на участках гиперемированной уплотненной кожи. В зоне высыпаний отмечается жжение, интенсивные боли вегетативного характера. Боли возникают приступообразно, чаще по ночам. Могут отмечаться расстройства тактильной чувствительности в зоне иннервации пораженных нервов, корешковые парезы лицевого и глазодвигательного нервов, сфинктера мочевого пузыря, мышц брюшной стенки и конечностей. Лихорадка отмечается на протяжении нескольких дней, после чего стихает, вместе с ней исчезает симптоматика интоксикации.
Абортивная форма опоясывающей герпетической инфекции протекает в виде кратковременной папулезной сыпи без формирования везикул. При буллезной форме герпетические везикулы сливаются, образуя крупные пузыри – буллы. Буллезная форма нередко может прогрессировать в буллезно-геморрагическую, когда содержимое булл приобретает геморрагический характер. В некоторых случаях буллы сливаются по ходу нервного волокна, формируя единый протяженный в виде ленты пузырь, оставляющий после вскрытия темный некротический струп.
Тяжесть течения опоясывающего лишая зависит от локализации поражения и состояния защитных сил организма. Особенно тяжело протекает лишай в области иннервации нервов лица и головы, при этом часто поражаются веки, роговица глаза. Длительность течения может составлять от нескольких дней (абортивная форма), до 2-3 недель, в некоторых случаях затягиваясь на срок до месяца и более. После перенесения опоясывающего лишая рецидивы герпетической инфекции в такой форме отмечаются довольно редко.
Диагностика герпетической инфекции
Диагностику герпетической инфекции проводят с помощью вирусологического анализа содержимого везикул и соскоба эрозий. Кроме того, возбудитель может быть выделен из крови, мочи, слюны, спермы, смывов из носоглотки, ликвора. В случае посмертной диагностики возбудителя выделяют из биоптатов тканей. Выделение вируса простого герпеса не дает достаточных диагностических данных об активности процесса.
К дополнительным методикам диагностирования можно отнести РНИФ мазков-отпечатков (выявляются гигантские многоядерные клетки с включениями Коудри типа А), РСК, РН, ИФА в парных сыворотках. Исследование иммуноглобулинов: нарастание титра иммуноглобулинов М говорит о первичном поражении, а иммуноглобулина G – о рецидиве. В последнее время распространенным методом диагностики герпетической инфекции является ПЦР (полимеразная цепная реакция).
Лечение герпетической инфекции
Разнообразие клинических форм герпетической инфекции обуславливает широкий круг специалистов, которые занимаются ее лечением. Лечение генитального герпеса проводят венерологи, у женщин - гинекологи. Лечением герпетической инфекции нервной системы занимаются неврологи. Тактика лечения герпетической инфекции выбирается в зависимости от клинической формы и течения заболевания. К этиотропной терапии можно отнести ацикловир, другие противовирусные препараты. В легких случаях применяют местное лечение (мази с ацикловиром, жидкость Бурова). Глюкокортикостероидные мази противопоказаны.
Общее лечение противовирусными препаратами назначают курсами, при первичном герпесе - до 10 дней, хронический рецидивирующий герпес является показанием к длительному лечению (до года). Генерализованные, висцеральные формы, герпес нервной системы лечат с помощью внутривенного введения противовирусных препаратов, желательно начинать курс лечения в максимально ранние сроки, длительность его составляет обычно 10 дней.
При часторецидивирующем герпесе рекомендована иммуностимулирующая терапия на период ремиссии. Назначаются иммуномодуляторы, адаптогены, иммуноглобулины, вакцинация, внутривенное лазерное облучение крови (ВЛОК). Широко используется физиотерапия: УФО, инфракрасное облучение, магнитотерапия, КВЧ и др.
Прогноз и профилактика герпетической инфекции
Неблагоприятный прогноз имеет герпетическая инфекция с поражением центральной нервной системы (герпетический энцефалит имеет высокий риск летального исхода, после него остаются тяжелые стойкие расстройства иннервации и работы ЦНС), а также герпес у лиц, страдающих СПИД. Герпес роговицы глаза может способствовать развитию слепоты, герпес шейки матки – раку. Опоясывающий герпес нередко оставляет после себя на некоторое время различные расстройства чувствительности, невралгии.
Профилактика герпеса типа I соответствует общим мерам предупреждения респираторных заболеваний, герпеса типа II – профилактике заболеваний, передающихся половым путем. Вторичная профилактика рецидивов герпеса заключается в иммуностимулирующей терапии и специфическом вакцинировании инактивированной герпетической вакциной.
[youtube.player]Читайте также:


