Пригнічення функції кори надниркових залоз
Кора надниркових залоз виділяє три групи гормонів: пучкова зона виділяє глюкокортикоїди (гідрокортизон, кортизон і кортикостерон) - стероїди з різноманітним впливом на метаболізм вуглеводів та білків; клубочкова - мінералокортикоїди (альдостерон, дезоксикортикостерон), необхідні для підтримання балансу натрію та об'єму позаклітинної рідини; сітчаста - статеві гормони (андрогени, естрогени, прогестерон) і, частково, глюкокортикоїди.
Глюкокортикоїди свою назву отримали через здатність підвищувати рівень цукру в крові шляхом стимуляції утворення глюкози в печінці. Цей ефект є наслідком глюконеогенезу - дезамінування амінокислот у разі посилення розпаду білків. За такої умови вміст глікогену в печінці може навіть підвищуватися. Крім того, посилюється мобілізація жиру з депо і використання його для утворення АТФ.
Кортизон впливає і на інші види метаболізму, що багато в чому визначається його рівнем у крові. Так, він може впливати навіть на мінеральний обмін, хоча для цього концентрація кортизону повинна бути набагато вищою, ніж основного мінералокортикоїду альдостерону. І взагалі, чим вища концентрація кортизону в крові, тим різноманітніший його вплив. Наприклад, у невеликій концентрації глюкокортикоїди активують, а у великій, навпаки, пригнічують імунні механізми організму. Високий рівень кортизону в крові зумовлює використання амінокислот для утворення глюкози і виявляє антианаболічну дію. Особливо значно знижується синтез білків м'язів, у такому разі може виникати і катаболічний ефект - розщеплення м'язових білків для вивільнення із них амінокислот.
Глюкокортикоїди й АКТГ також впливають на нервову систему (збуджують її, спричиняють безсоння, ейфорію), на імунні та інші системи організму. Про комплексний вплив кортизону на різноманітні функції організму можна судити за такими змінами, що зумовлені його недостатністю: 1) гіперчутливістю до інсуліну; 2) зниженням запасів глікогену в тканинах; 3) зниженням активності глюконеогенезу; 4) недостатньою мобілізацією білків периферійних тканин; 5) ослабленням реакції жирових клітин на звичайні ліполітичні стимули; 6) гіпотензією; 7) затримкою росту; 8) м'язовою слабкістю і швидкою стомлюваністю; 9) зниженням здатності до посиленого виділення води в разі водного навантаження, 10) психічними та емоційними зрушеннями.
У фізіологічних умовах зазначені метаболічні ефекти глюкокортикоїдів збалансовані. За необхідності вони швидко забезпечують потреби організму в енергетичному матеріалі. Тому під час гострих стресових станів гіпоталамо-гіпофізарно-надниркова система активується в першу чергу і рівень глюкокортикоїдов у крові підвищується. Під час повторної і тривалої дії стресового чинника реакція поступово згасає.
Важливою властивістю глюкокортикоїдів є їх протизапальна дія, пов'язана з тим, що вони знижують проникність судинної стінки і блокують секрецію серотоніну, гістаміну, кінінів та систему плазмін-фібринолізин, а також пригнічують утворення антитіл.
Протизапальна дія глюкокортикоїдів застосовується у клінічній практиці, наприклад, для лікування хворих на ревматизм. Розроблено низку мазевих препаратів для зовнішнього застосування (фторокорт, преднізолон тощо)
У регуляції секреції глюкокортикоїдів бере участь гіпоталамус. У ядрах переднього гіпоталамуса продукується кортиколіберин, який через ворітну систему надходить до аденогіпофіза і сприяє синтезу АКТГ, що стимулює утворення кортикостероїдів. У свою чергу, продукування АКТГ залежить від рівня глюкокортикоїдів у крові (за механізмом негативного зворотного зв'язку) і від рівня гіпоталамічного рилізинг-гормону.
Мінералокортикоїди беруть участь у регуляції мінерального обміну і водного балансу організму. Найактивнішим з них є альдостерон. Під його впливом посилюється реабсорбція натрію і зменшується реабсорбція калію у ниркових канальцях, а це призводить до затримки іонів натрію і хлору в організмі і до збільшення виділення іонів калію та водню.
На відміну від глюкокортикоїдів, мінералокортикоїди посилюють розвиток запальних процесів за рахунок підвищення проникності капілярів і серозних оболонок. Вони також беруть участь у регуляції тонусу кровоносних судин і сприяють підвищенню артеріального тиску.
Посилення синтезу і секреції мінералокортикоїдів здійснюється, по-перше, під впливом ангіотензину II, по-друге - під впливом АКТГ, що, у свою чергу, відбувається під впливом кортиколіберину гіпоталамуса. Інгібіторами синтезу і секреції мінералокортикоїдів є дофамін, передсердний натрій-уретичний гормон, значне підвищення концентрації іонів натрію у крові.
Статеві гормони кори надниркових залоз мають значення для розвитку статевих органів у ранньому дитячому віці і для появи вторинних статевих ознак у той період, коли секреторна функція їх ще незначна. Крім того, естрогени проявляють антисклеротичний ефект (насамперед у жінок). Статеві гормони (особливо андрогени) сприяють обміну білків, стимулюючи їх синтез в організмі.
| | | следующая лекция ==> | |
| Надниркові залози | | | Гормони щитоподібної залози |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
[youtube.player]Кора надниркових залоз має три шари клітин, або три зони. Зовнішній шар, або клубочкова зона, продукує гормони мінералокортикоїди – альдостерон і дезоксикортикостерон. Основним гормоном є альдостерон. Середній – або пучкова зоно – синтезує переважно глюкокортикоїди (кортизол). Внутрішній шар, або ретикулярно зона, переважно продукує андрогени – дигідроепіандростерон і андростендіон (рис. 6.51).
Гормони кори наднирників – це стероїдні гормони, попередником яких є прогестерон. Синтез гормонів починається з холестеролу, який переважно транспортується кров'ю, проте може утворюватись із ацетату в корі наднирників.
Прегненолон синтезується в мітохондріях, після чого він надходить до ендоплазматичної сітки, де перетворюється на 17-тідроксипрогестерон, який транспортується в мітохондрії, де й утворюється кортизол <рис. 6.52).
Альдостерон і андрогени утворюються ланцюгом подібних ферментних реакцій.
У неспецифічній адаптації при стресових реакціях організму регуляція здійснюється завдяки секреції глюкокортикоїдів – кортизолу, в меншій мірі – мінералокортикоїдів.

РИС. 6.51. Розташування зон кори і мозкової речовини надниркових залоз та їх гормони
Глюкокортикоїди, регуляція їх секреції
Основний глюкокортикоїд – це кортизол. У плазмі крові близько 75 % кортизолу зв'язано з кортикостероїдзв'язуючим глобуліном (КЗГ) – транскортином, 15 % – з альбуміном, до 10 % кортизолу не зв'язано з білками й транспортується в активному стані. Синтез транспортних білків відбувається в печінці. Майже 90 % кортизолу плазми знаходиться в неактивному стані, бо гормон зв'язаний з транспортними білками плазми, інактивація кортизолу відбувається у печінці.
Глюкокортикоїди є гормонами, які дозволяють забезпечити адаптацію організму при дії стресових чинників, щоб відповідно до ситуації підтримати гомеостаз.
Стійкість організму до дії стресових чинників не збільшується після введення глюкокортикоїДів. Основну роль в адаптації до стресової ситуації відіграє активація усієї гіпоталамо-гіпофізарно-наднирникової системи.
Регуляція секреції кортизолу здійснюється за участю гормону гіпоталамуса кортиколіберину. Кортиколіберин синтезується у паравентрикулярних ядрах гіпоталамуса й надходить з кров'ю через портальні судини до аденогіпофіза, де стимулює утворення й секрецію адренокортикотропіну (АКТГ) кортикотропними клітинами.
АКТГ стимулює стероїдогенез у пучковій та ретикулярній зонах наднирників. Він взаємодіє з мембранними рецепторами клітин кори наднирників і через G^-протеїн активує аденілатциклазу, наслідком чого є утворення внутрішньоклітинного посередника цАМФ. Внутрішньоклітинний посередник цАМФ активує фосфопротеїнкінази, які каталізують утворення прегненолону з холестеролу й здійснюють подальший ланцюг хімічних реакцій синтезу кортизолу.
АКТГ також стимулює синтез ДНК, РНК і білка в корі наднирників, впливає на власні рецептори в аденогіпофізі, збільшуючи їх чутливість. У пучковій зоні кори наднирників під впливом АКТГ утворюється кортизол.

РИС. 6.52. Шляхи утворення глюкокортикоїдів, мінералокортикоїдів та андрогенів корою надниркових залоз. Знак "+" - стимуляція процесу
Регульованим параметром у контурі регуляції є концентрація кортизолу, який шляхом каналу негативного зворотного зв'язку пригнічує секрецію кортиколіберину в гіпоталамусі й АКТГ – в аденогіпофізі (рис. 6.53).
Секреція кортизолу має добовий (циркадний) ритм: його концентрація у плазмі крові досягає максимуму від 5 до 7 години, проте вночі – з 24 до 4 години – вона найменша. Цей ритм синхронізований з іншим циркадним ритмом: "сон – неспання". Циркадний ритм секреції кортизолу порушується під час стресової реакції організму, коли концентрація гормону збільшується.
Стимулюють секрецію кортизолу цитокіни – тканинні гормони, що утворюються у вогнищі запалення, а також фактор некрозу пухлин (ФНП) та інтерлейкіни. Вони збільшують секрецію кортиколіберину в гіпоталамусі, що призводить до зростання секреції АКТГ і відповідно – кортизолу. Таким чином, регуляція секреції кортизолу здійснюється в організмі завдяки таким механізмам:
■ пригнічення секреції викликається кортизолом завдяки каналу негативного зворотного зв'язку.
Призначення екзогенних глюкокортикоїдів як фармакологічних препаратів може призвести до функціональних та морфологічних змін гіпоталамо-гіпофізарно-наднирникової системи – атрофії кори наднирників. Тривала стресова реакція, наявність вогнища запалення та інші чинники, що стимулюють функцію системи, можуть призвести до гіпертрофії кори наднирників.
Механізм дії глюкокортикоїдів. Кортизол є стероїдним гормоном, який проходить крізь мембрану клітини й взаємодіє з рецепторами цитоплазми. Комплекс

РИС. 6.53. Контур регуляції секреції кортизолу. Знак "+" – стимуляція, знак – гальмування
"гормон – рецептор" мігрує до ядра, де зв'язується з ДНК і підсилює процеси транскрипції мРНК, кодованої геном. На рибосомах транслюється мРНК, що призводить до синтезу білків-ферментів. Рецептори до глюкокортикоїдів є практично у всіх тканинах.
[youtube.player]Гіпокортицизм. Зниження продукції гормонів корою наднирників може відбуватися в результаті руйнування наднирників різного генезу (первинна надниркова недостатність) або дисфункції гіпоталамуса або гіпофіза (вторинна надниркова недостатність).
Основа патогенезу – дефіцит кортизолу, що приводить до гіперпродукції АКТГ гіпофізом (згідно з принципом негативного зворотного зв’язку), що пояснює появу гіперпігментації. Прогресуючий дефіцит кортизолу та альдостерону також призводить до порушень вуглеводного, білкового, ліпідного та водно-сольового обміну. Зокрема, розвивається гіпонатріеміческая дегідратація з гіперкаліємії, гіперкальціємією, гіпохлоремія, гіпоглікемією і кетозом. Зменшення об’єму циркулюючої крові призводить до наростання внутрішньоклітинної дегідратації з розвитком метаболічного ацидозу, вираженої гіпотензії (аж до колапсу), зниженням серцевого викиду і клубочкової фільтрації (аж до анурії).
Гіпофункція кори надниркових залоз призводить до підвищення стомлюваності, м’язової слабкості, зниження маси тіла, анорексії,
гіперпігментації шкіри і зниження артеріального тиску. У чоловіків, які страждають на хворобу Аддісона (первинна надниркова недостатність, як правило, аутоімунного генезу), знижується лібідо, у жінок зберігається здатність до зачаття, а також до виношування дитини, тому що гормони, які утворюються в плаценті і у плода, захищають матір від стероїдної недостатності . У жінок також відзначають випадання волосся на лобку і в пахвовій області (внаслідок зменшення вироблення андрогенів у надниркових). У чоловіків подібної симптоматики не відзначають, оскільки більша частина андрогенів синтезується в яєчках. У дітей відзначають помітне відставання в рості і схильність до гіпоглікемічних станів.
Дефіцит кортизолу наднирковими знижується також при туберкульозі нирок і адреногенітальному синдромі.
Адреногенітальний синдром (вроджена дисфункція кори надниркових залоз) – аутосомно-рецесивне захворювання, обумовлене дисфункцією кори надниркових залоз внаслідок порушення вироблення того чи іншого ферменту стероїдогенезу, зазвичай супроводжується надмірною секрецією андрогенів і ознаками вірилізації. Дефіцит кортизолу вже внутрішньоутробно стимулює вироблення АКТГ, що призводить до гіперплазії кори надниркових залоз і надлишкової продукції АКТГ-залежних стероїдів, синтез яких при даній недостатності ферменту не порушений (в основному надниркових андрогенів – дегідроепіандростерона, андростендиона). Найбільш відома форма синдрому обумовлена частковою або повною недостатністю 21-гідроксилази.
Рівень кортизолу в крові підвищується не тільки при синдромі (хвороби) Кушинга, але також при стресі, больовому шоці, алкоголізмі, вагітності та гіпотиреозі (так званий функціональний гиперкортицизм).
Гіпоальдостеронізм може бути ізольованим, поєднуватися з дефіцитом інших кортикостероїдів (наприклад, при хворобі Аддісона або адреногенітальному синдромі) або викликатися зниженням чутливості рецепторів до дії альдостерону, синтез якого не порушений (псевдогіпоальдостеронізм). Розрізняють первинний і вторинний гіпоальдостеронізм. В обох випадках недостатність альдостерону призводить до зниження реабсорбції натрію і води в ниркових канальцях і підвищенню реабсорбції калію і хлору з розвитком гіпотензії і метаболічного ацидозу.
• Первинний гіпоальдостеронізм у грудних дітей зумовлений недостатністю двох ферментних систем – 18-оксидази і 18-гид- роксілази. Він може поєднуватися з полігландулярна аутоімунним синдромом I типу. Втрата натрію і артеріальна гіпотензія підвищують продукцію реніну (гіперренінеміческій гіпоальдостеронізм).
• Вторинний гіпоальдостеронізм спостерігають у дорослих. Він пов’язаний з недостатньою продукцією реніну нирками або зниженою його активністю (гіпоренінеміческій гіпоальдостеронізм). Часто ускладнює перебіг цукрового діабету і хронічного нефриту з нирково-канальцевий ацидоз з ураженням судин нирок. Може виникати при тривалому прийомі певних лікарських препаратів (гепарин, нестероїдні протизапальні препарати, β-адреноблокатори та інгібітори АПФ). Може розвинутися після видалення альдостероми одного з надниркових в результаті атрофії клубочкової зони іншого, при гострої алкогольної інтоксикації або хвороби Аддісона.
• Псевдогіпоальдостеронізм може бути спадкоємною і набутим. Набутий псевдогіпоальдостеронізм може розвиватися внаслідок ураження нирок при системний червоний вовчак та серповидноклітинній анемії, амілоїдозі, интерстициальном нефриті, обструктивної нефропатії, застосуванні тріамтерену, амилорида або спіронолактону.
Гіперальдостеронізм може бути первинним і вторинним. Первинний гіперальдостеронізм розвивається внаслідок альдостеронпродуцірующей аденоми (синдром Конна) або гіперплазії наднирників (ідіопатичний гіперальдостеронізм) і проявляється артеріальною гіпертензією, гіпокаліємією і низьким рівнем реніну в сироватці крові. Вторинний гіперальдостеронізм (на відміну від первинного) обумовлений причинами, локалізованими поза надниркових залоз (стеноз ниркових артерій, злоякісна гіпертензія, ренінсекретірующіе пухлини, ектопічні вогнища секреції АКТГ, нефротичний синдром, серцева недостатність, цироз печінки, кровотечі), при цьому вміст реніну значно підвищено. Становить більшу частину випадків гіперальдостеронізма.
[youtube.player]У статті наведено кілька прикладів наслідків застосування гормональних мазей. Вам достатньо прочитати малу частину нижче опублікованої інформації, щоб зрозуміти, яку небезпеку можуть нести безконтрольно використовуються гормональні препарати. Тому не варто передчасно захоплюватися неперевершеною ефективністю засобів, які викликають залежність, і які неможливо безболісно скасувати.
Поширені побічні ефекти
Мазі, що містять стероїдні гормони (синоніми: топічні стероїди, глюкокортикостероїди, місцеві кортикостероїди), використовують для лікування широкого спектру захворювань шкіри. Існування препаратів різної інтенсивності впливу робить лікування запаленої шкіри менш трудомістким і більш ефективним. Але саме ця позитивна сторона гормональних лікарських засобів стала двосічним мечем, що провокує збільшення випадків зловживань мазями, що призводить до серйозних локальних, системним і психологічним побічних ефектів.
Терапія гормональними мазями — невід’ємна частина комплексного лікування різного виду дерматитів, спрямована на позбавлення від гострих і підгострих симптомів захворювань шкіри. Її застосування дозволяє усунути алергію, свербіж, відновити пошкоджений епітелій, позбутися від вторинної інфекції шкіри і навіть забезпечити їй захист від дії пошкоджуючих факторів.
Але в дерматологічній практиці все частіше зустрічаються ситуації, коли люди, використовуючи для лікування шкірної висипки на чутливих ділянках тіла (обличчя, пахви, пахова область) найбільш сильні гормональні мазі, потрапляють на прийом до лікаря з опіками, хворобливими відчуттями і непроходящим сверблячкою.
Побічні ефекти, пов’язані із застосуванням гормональних мазей, поділяють на локальні та системні.
Локальні (вогнищеві) побічні ефекти
Прояви побічних ефектів осередкового типу залежать від інтенсивності ліки та місця його нанесення. Вони можуть виникати у вигляді:
- непроходящего свербежу шкірного покриву;
- оніміння, відчуття повзання мурашок або поколювань (парестезія);
- хронічної вугрової висипки, запалення волосяних фолікулів;
- атрофія шкірного покриву, розм’якшення і набрякання шкіри;
- розширення дрібних кровоносних судин, світлі плями на шкірі;
- надмірне оволосіння по тілу, на місці пушкового волосся виростають термінальні.
Найпоширенішим побічним ефектом, який може виникнути в результаті лікування будь гормональної маззю, є атрофія шкіри. При цьому незворотні зміни стосуються як верхнього шару шкіри (епідермісу), так і сполучної її частини (дерми).
Вже після 3-7 днів лікування вдається помітити за допомогою мікроскопа процес руйнування верхнього шару шкіри. Він стає тонким із-за зменшення розміру епідермальних клітин, що в свою чергу викликає зниження метаболічної активності в епідермісі.
Після тривалого впливу гормональних мазей відбувається пригнічення функцій клітинних шарів, зернистий шар сильно стоншується, або зовсім зникає, а роговий — стає тоншою.
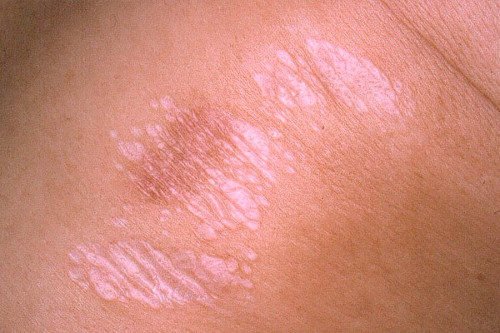
Повторне використання гормональної мазі в тій же області викликає эпидермальное витончення і зміни сполучної тканини дерми. Все це призводить до прозорої, зморщеною і блискучою шкірі, через яку добре проглядаються вени.
Втрата підтримки сполучної тканини для дермальной судинної мережі обертається еритемою (аномальне почервоніння), телеангиэктазией (стійке розширення дрібних судин) і мікроскопічним крововиливом в шкіру.
Важливо! Атрофія оборотна при грамотній скасування гормональних мазей, але нормалізація може зайняти кілька місяців.
Терапія гормональними мазями (кортикостероїдами) в деяких випадках здатна спровокувати акнеобразные ураження шкіри. Висипання являють собою невеликі і поодинокі (мономорфние) запалені папули та пустули, розташовані переважно на тулубі і кінцівках, рідше на шкірі обличчя.
Протизапальна дія гормонального засобу спочатку пригнічує запальні ураження і еритему, але при його скасування починаються спалахи хвороби.
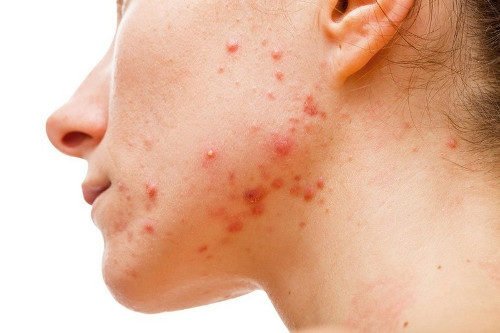
Стероїдні мазі провокують формування комедонов шляхом підвищення концентрації вільних жирних кислот у поверхневому ліпідному шарі шкіри і збільшення числа бактерій у волосяному каналі.
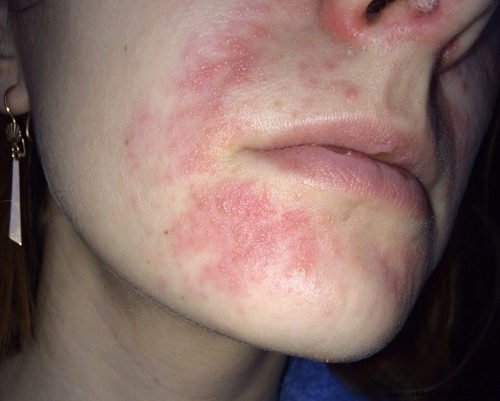
Тривале використання сильних гормональних мазей також може призвести до периоральному дерматиту. Висипання утворюються навколо рота і являють собою фолікулярні папули і пустули на еритематозний основі (аномально почервонілою шкірі).
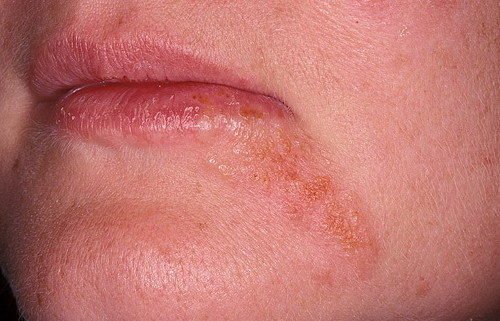
Нерідко після лікування гормональних засобом екземи або іншої патології шкіри навколо рота з’являються висипання. У результаті пацієнт починає застосовувати для лікування цієї висипки стероїдну мазь, вважаючи її симптомом екземи або алергією, навіть не підозрюючи, що так про себе дає знати побічний ефект від раніше проведеної терапії. Часто після відміни мазі висипання навколо рота виявляють себе ще сильніше.
Системні побічні ефекти
Після лікування зовнішніми гормональними мазями системні побічні ефекти (зачіпають внутрішні органи і системи) виникають рідше, в основному через лікування чутливої шкіри або запаленої поверхні сильнодіючими засобами. Проявляються вони у вигляді:
- недостатність кори надниркових залоз;
- сповільнення або зупинення росту дитини;
- дрібного крововиливи під шкірою (петехії);
- зниження кісткової маси (остеопороз), перелому кісток;
- помутніння кришталика ока, внутрішньоочного тиску;
- розлади психіки;
- метаболічного синдрому.
Увага! Нераціональне застосування топічних стероїдів обов’язково призведе до розвитку побічних ефектів локального та системного характеру.
Наднирники об’єднані з гіпоталамусом (відділ проміжного мозку, пов’язаний з ЦНС) і гіпофізом (ендокринна залоза розташовується біля основи головного мозку, що відповідає за метаболізм, ріст і розвиток організму).
Разом ці органи утворюють ГГН-вісь (гіпоталамо-гіпофізарно-надниркова вісь), яка у здоровому стані забезпечує адаптацію організму до стресів, тривог і проблем. Як тільки ГГН-вісь з якої-небудь причини перестає нормально функціонувати, людина впадає в тривалий стресовий стан.
Виявлено, що функціонування надниркових залоз можуть пригнічувати всі мазі на стероїдної основі, для цього достатньо:
Зверніть увагу! Ризик розвитку зазначених ускладнень підвищується у дітей, особливо якщо мова йде про використання мазі під оклюзійну пов’язку, в якості якої може виступати памперс або звичайна пелюшка.
Немовлята мають високе співвідношення площі поверхні шкіри до об’єму тіла, отже, у них висока вірогідність пригнічення ГГН-осі з-за системної абсорбції глюкокортикостероїдів.
Про правила застосування гормональних мазей у дітей, зокрема при атопічному дерматиті, розповість наступний відеоматеріал:
Зверніть увагу! У дерматологічній практиці також має місце інформація про ятрогенному синдромі Кушинга (симптоми: ожиріння, підвищення артеріального тиску, остеопороз, слабкість м’язів), кризі Аддісона (недостатність кори надниркових залоз), уповільнення росту кісток і летального результату, що виникають внаслідок тривалого застосування глюкокортикоїдів.
Тахіфілаксія (відсутність реакції на повторне лікування) характеризується зниженням ефективності властивостей гормональних мазей при тривалому лікуванні.
Це відбувається зазвичай у людей хворих на псоріаз, може стосуватися пацієнтів, які не дотримуються призначений дерматологом лікування, або нездатності застосовуваної стероїдної мазі повністю впоратися з хворобою. Скасування гормонального зовнішнього засобу супроводжується спалахом хвороби.
Оскільки тканини шкіри стають менш чутливими, для досягнення потрібного ефекту потрібні все більш сильні препарати, які в свою чергу призводять до більш серйозних наслідків.
Відомо, що стероїдна залежність виникає після ненавмисного застосування сильних гормональних мазей. Її прояви найчастіше видно на обличчі.
Пацієнти з стероїдної залежністю мають прищі, розацеа (рожеві вугри), періоральний дерматит або телеангиэктазию (стійке розширення судин). Вони не можуть припинити використовувати мазі побоюючись більш сильного спалаху захворювання.
У дерматології етапи впливу гормональних зовнішніх засобів на шкіру описані наступним чином:
У третьому пункті присутні ознаки синдрому відміни гормональної мазі. Найбільше зло, яке здатне завдати людині психологічну травму і навіть призвести до смерті.
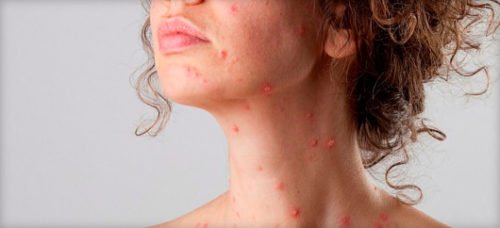
При такому стані вважається нормою аномальне почервоніння шкірного покриву, з дрібними прищиками і гнійниками. Зазвичай, якщо лікування проводилося на обличчі, з’являється сильний біль в області підборіддя і поблизу вух. Крім болю періодично виникає свербіж.
Питання — відповідь
Стан, при якому організм людини перестає правильно реагувати на ліки. Його застосування дає зворотний ефект (виникає спалах захворювання), тобто патологія повертається з більшою силою.
Наскільки важким може бути синдром відміни?
Ступінь тяжкості синдрому відміни залежить від того, наскільки пошкоджена кора надниркових залоз. В легкому випадку, коли гормональні препарати використовувалися короткий час (2-3 тижні), для стану скасування характерні м’язові болі, загальна слабкість, відсутність апетиту.
Якщо гормональні мазі застосовувалися 6 і більше місяців, то синдром відміни проявляється кризою Аддісона. Кора наднирників перестає виробляти кортикостероїди, які штучно поставлялися в організм одночасно з мазями.
У хворого з’являється блювання і судоми, він може загинути від серцево-судинної недостатності, якщо не отримає хоча б мінімальну дозу скасованого ліки.
Після застосування гормональної мазі шкіра стала тонкою, з’явилися зморшки, чи можна щось зробити?
[youtube.player]ВИЗНАЧЕННЯ ТА ЕТІОПАТОГЕНЕЗ
Сукупність клінічних симптомів, що викликані довготривалим дефіцитом гормонів кори надниркових залоз, в основному кортизолу, внаслідок безпосереднього пошкодження наднирників. Причини:
1) аутоімунізація (найчастіше) — аутоантигенами є ферменти, що беруть участь у стероїдогенезі: найчастіше 21-гідроксилаза, рідше 17-гідроксилаза і 20–22-ліаза; можуть супроводжуватись іншими аутоімунними хворобами, найчастіше — щитоподібної залози → аутоімунні синдроми полігляндулярної недостатності →розд. 12.2; на ранній стадії хвороби надниркові залози можуть бути збільшеними (лімфоцитарні інфільтрати), на пізніх стадіях — зменшеними (атрофія);
2) туберкульоз та інші інфекційні захворювання (гістоплазмоз, криптококоз, бластомікоз, кокцидіоїдомікоз; опортуністичні інфекції при СНІДі, найчастіше ЦМВ) — симптоми хвороби Аддісона, якщо деструкції зазнає ≈90 % тканини кори надниркових залоз (раніше субклінічна хвороба Аддісона); туберкульозні та грибкові гранульоми можуть кальцифікуватись (зміни видно при РГ і КТ);
3) новоутвори (лімфоми, дуже рідко двосторонній рак, метастази, напр., рак нирки та рак легень) — симптоми хвороби Аддісона тільки у випадку масивного ураження обох наднирників;
4) метаболічні порушення — амілоїдоз, адренолейкодистрофія, гемохроматоз;
5) вроджені порушення — вроджена гіперплазія надниркових залоз, нечутливість рецептора АКТГ, синдром Оллгрова з ахалазією стравоходу і алакрімією (відсутність сліз), гіпоплазія наднирників;
6) постмедикаментозне зменшення синтезу гормонів кори надниркових залоз — мітотан, аміноглютетимід, кетоконазол, метирапон, етомідат; має інтермітуючий характер і регресує після відміни ЛЗ; найдовше триває після лікування мітотаном.
КЛІНІЧНА КАРТИНА тА типовий ПЕРЕБІГ
1. Суб'єктивні симптоми: постійна слабкість, втрата свідомості (внаслідок ортостатичної гіпотензії або гіпоглікемії), погана толерантність до фізичного навантаження, схуднення, відсутність апетиту, інколи — нудота (рідше — блювання), бажання вживати солену їжу, рідкий кал, біль у м'язах і суглобах. Симптоми часто з'являються в стресових ситуаціях: інфікування, важка травма та ін. При субклінічній хворобі Аддісона епізоди загальної слабкості, втрати апетиту та болю у м'язах виникають тільки тимчасово, у стресових ситуаціях, особливо, після значного фізичного навантаження.
2. Об'єктивні симптоми: гіперпігментація шкіри, особливо у ділянках, що зазнають інсоляції або стиснення, з коричневим забарвленням ліктів, згинальних ліній на долонях і тильній поверхні рук, ареол сосків та рубців, а в деяких випадках також коричневі плями на слизовій оболонці ротової порожнини, що спричинені надлишком АКТГ і меланотропіну (МТГ), секреція яких недостатньо зворотньо гальмується кортизолом; низький артеріальний тиск і ортостатична гіпотонія.
3. Супутні аутоімунні порушення інших органів можуть змінювати клінічну картину та перебіг хвороби. Приєднання вторинної недостатності кори надниркових залоз призводить до зникнення гіперпігментації покривів. До повного знебарвлення шкіри може також призвести генералізоване вітиліго.
Наведені значення лабораторних параметрів стосуються досліджень проведених апаратом Immulite 2000.
1. Основні дослідження крові:
1) загальний аналіз — нейтропенія, лімфоцитоз, моноцитоз і еозинофілія;
2) біохімічний аналіз — гіперкаліємія, гіпонатріємія, інколи гіпоглікемія (особливо під час довших перерв між прийомами їжі та після значного фізичного навантаження), рідко — гіперкальціємія, інколи — підвищені концентрації сечовини та креатиніну (внаслідок зниження клубочкової фільтрації).
2. Гормональні дослідження: якщо вони виконуються з метою підтвердження діагнозу → слід відмінити гідрокортизон на 24 год перед обстеженням
1) золотим діагностичним стандартом при первинному гіпокортицизмі вважається короткий стимуляційний тест з використанням синтетичного кортикотропіну (АКТГ, тетракозактид 250 мкг в/в (або в/м); хворобу Аддісона виключає рівень кортизолемії ≥500 нмоль/л (18,1 мкг/дл) на будь-якому етапі цього тесту (0, 30, 60 хв);
2) якщо не можливо виконати наведеного вище тесту → слід визначити концентрації кортизолу (скринінгове дослідження) і потім АКТГ у зразку крові, відібраному зранку; знижена концентрація кортизолу ( концентрація АКТГ у плазмі (що найчастіше ≥2 × ВМН) при одночасному заборі зразків крові зранку — це типове гормональне порушення; підвищення концентрації АКТГ є першим симптомом (якщо кортизолемія в нормі, діагностується субклінічна форма). На подальших етапах діагностики слід зважити можливість підтвердження діагнозу за допомогою короткого тесту з синтетичним кортикотропіном.
3) знижена концентрація ДГЕА-С [дегідроепіандростерону сульфат], андростендіону (за винятком вродженої гіпертрофії кори надниркових залоз) і альдостерону; підвищена активність РАП [ренінової активності плазми] або концентрації реніну (ранній симптом).
3. Імунологічні дослідження: найчастіше специфічні антитіла до надниркових залоз (анти-21-гідроксилазні, рідше антидесмолазні чи анти 17-гідроксилазні); з часом кількість антитіл зменшується внаслідок зменшення аутоантигенів; у випадку аутоімунного синдрому полігландулярної недостатності (→розд. 12.2) — антитиреоїдні антитіла або антитіла до інших органів.
4. ЕКГ: ознаки гіперкаліємії →розд. 25.1.1.
5. Візуалізаційні дослідження: РГ, КТ і УЗД черевної порожнини можуть виявити двосторонні пухлини наднирників (напр., метастази, крововиливи в наднирники) або кальцифікати у ділянці надниркових залоз після перенесеного туберкульозу або мікозу наднирників; КТ або МРТ на пізній стадії аутоімунної хвороби Аддісона виявляють атрофічні надниркові залози. Двосторонні пухлини, найчастіше, свідчать про метастази у надниркові залози або лімфому.
Підвищена концентрація АКТГ в плазмі, знижена концентрація кортизолу в сироватці крові у звичайних умовах і аномальний результат стимуляційного тесту з використанням синтетичного кортикотропіну; клінічні симптоми →вище.
Лікування первинного гіпокортицизму полягає в безперервній, пожиттєвій замісній терапії глюкокортикостероїдами (ГК), мінералокортикостероїдами (МКС) і, іноді, андрогенами. Слід проінформувати пацієнта про правила дозування гідрокортизону в умовах підвищеного стресу (інфекцій, травм, дрібних операцій, напр., екстракції зуба та ін.) →нижче; пацієнт повинен отримати і завжди мати з собою письмову інформацію про дозування ЛЗ. Слід запланувати контрольні обстеження.
1. Замісна терапія ГК: полягає у прагненні відтворити добовий ритм секреції кортизолу (найбільша доза — вранці), слід взяти до уваги тривалість дії одиночної дози (4–8 год), масу тіла та зріст, а також підвищену потребу у ГК при стресових ситуаціях. Правильність підбору замісних доз оцінюється на підставі самопочуття і фізичної активності, а також концентрацій натрію та калію в сироватці. Призначайте гідрокортизон у дозах, які відповідають його добовій продукції (5–10 мг/м 2 п. т.), напр., 20–30 мг/добу у 2 прийоми, напр., вранці та близько 15:00 (15–20 мг + 5–10 мг), або у 3 прийоми, тобто вранці, близько 13:00 і близько 18:00 (10–15 мг + 5–10 мг + 5 мг). При підборі дози слід враховувати масу тіла і зріст.
Препарат гідрокортизону в формі таблеток 5 і 20 мг з модифікованим вивільненням може забезпечити більш стабільну концентрацію кортизолу в крові при прийомі один раз на день натще. Не слід рутинно призначати преднізон, дексаметазон або інші синтетичні аналоги кортизолу, з огляду на їх нижчу, у порівнянні з гідрокортизоном, замісну цінність.
Правила дозування гідрокортизону:
1) у стресовій ситуації помірної інтенсивності (напр., стоматологічне лікування, інфекційний процес, що вимагає антибіотикотерапії) пацієнт повинен збільшити дозу у 2 рази або на 10–30 мг/добу;
2) у разі лікування в домашніх умовах захворювання, що супроводжується гарячкою >38 °С → пацієнт повинен збільшити дозу гідрокортизону у 2 рази (або у 3 рази, якщо гарячка >39 °С) та пити розчини, що містять електроліти; терапію підвищеною дозою гідрокортизону п/о пацієнт може застосовувати до 3 днів, якщо не виникне загострення захворювання, що вимагатиме звернення до лікаря;
3) у випадку блювання або діареї пацієнт повинен звернутись до лікаря → слід вводити 50 мг гідрокортизону в/м кожні 12 год. В особливих випадках (напр., у випадку артеріальної гіпертензії, набряків) гідрокортизон можна замінити преднізолоном в еквівалентній дозі (20 мг гідрокортизону = 5 мг преднізолону).
4) захворювання з тяжким перебігом, зокрема тяжка травма чи оперативне лікування, вимагає в/в чи в/м застосування гідрокортизону;
5) перед значним фізичним навантаженням пацієнт має додатково прийняти 5–10 мг гідрокортизону;
6) при гіпертиреозі може знадобитися підвищення дози гідрокортизону;
7) у пацієнтів з цукровим діабетом додаткова доза 5 мг увечері може запобігати розвитку нічної гіпоглікемії.
2. Замісна терапія МКС: флудрокортизон 0,025–0,2 мг/добу, вранці (під час спеки — верхня межа раніше підібраної дози) та не обмежуйте споживання натрію. Необхідним є індивідуальний підбір дози. Пацієнти, що перебувають у жаркому кліматі, повинні збільшити вживання солі (з огляду на підвищену втрату натрію з потом), а в деяких випадках також і дозу флудрокортизону. Слід зменшити дозу або розглянути відміну ЛЗ при артеріальній гіпертензії та набряках, особливо у осіб старшого віку. Пам'ятайте, що гідрокортизон також має слабше виражену мінералокортикостероїдну дію. При прийомі правильно підібраної дози МКС не не має виникати ортостатична гіпотензія. При первинній артеріальній гіпертензії додатково потрібно призначити відповідне гіпотензивне лікування, не змінюючи замісної терапії (напр., інгібітори АПФ чи блокатори рецепторів ангіотензину [БРА], а при потребі, як ЛЗ наступного ряду — дигідропіридинові блокатори кальцієвих каналів; застосування антагоністів альдостерону непоказанo). Не призначайте сечогінні препарати, бо можна спровокувати різкі падіння артеріального тиску, пов’язані з гіповолемією. Доза 40 мг гідрокортизону забезпечує мінералокортикоїдний ефект, що відповідає 100 мкг флудрокортизону.
3. Замісна терапія андрогенами: дегідроепіандростерон (ДГЕА) у жінок 5–25 мг після сніданку, найчастіше — 10 мг/добу, призначається при схильності до депресії, зниженні лібідо, або при загальній слабкості, що зберігається попри повну компенсацію дефіциту кортизолу та МКС. Дозу 25 мг/добу можна розглянути особливо у жінок зі схильністю до депресії, при цьому слід виявити обережність, щоб не викликати симптомів андрогенізації. Якщо протягом 6 міс. пробна замісна андрогенна терапія не дає покращення, можна її не продовжувати. Корисним є визначення концентрації ДГЕА-С у сироватці.
Найважливіше значення має зникнення симптомів, нормалізація артеріального тиску і електролітних порушень, а також покращення самопочуття. Призначте найнижчі ефективні дози гідрокортизону і флудрокортизону.
Ефективність замісної терапії ГК оцінюється на основі самопочуття і фізичної форми. Збільшення маси тіла і безсоння можуть вказувати на занадто високу добову дозу гідрокортизону. Слабкість, нудота, втрата апетиту, зниження маси тіла та гіперпігментація шкіри свідчать про недостатню замісну терапію. Визначення АКТГ мало інформативне, оскільки може перевищувати норму — якщо вранці знаходиться на нижній границі норми або нижче, це свідчить про надлишок гідрокортизону → слід знизити його дозу.
Для моніторування терапії МКС, крім клінічної оцінки (контроль артеріального тиску, обстеження на предмет ортостатичної гіпотензії, пошук периферичних набряків) використовують визначення концентрацій натрію, калію і реніну, або активності реніну плазми.
Як правило, не потрібно модифікувати дозування гідрокортизону; у випадку появи відчуття слабкості у III триместрі вагітності може виникнути потреба підвищення дози гідрокортизону на 20–40 % (напр., з 25 мг/добу до 30 мг/добу). У випадку виникнення артеріальної гіпертензії, слід зменшити дозу флудрокортизону. Із замісною метою у вагітних не слід призначати дексаметазон, оскільки він у незміненій формі проникає через плацентарний бар’єр. При сумнівах щодо адекватності забезпечення МКС варто визначити концентрації натрію та калію у сироватці крові. Дослідження рівня реніну непридатне, оскільки його концентрація фізіологічно зростає під час вагітності.
Застосування гідрокортизону під час пологів та післяпологового періоду у жінок з гіпокортицизмом: від моменту початку пологів — 100 мг в/в + 50 мг в/в або в/м кожні 6 год; при зниженні артеріального тиску додатково 100 мг в/в краплинно у 500 мл 0,9 % NaCl; 1-а і 2-а доба після пологів — 50 мг в/м кожні 6–8 год; між 3-ю та 6-ю добою — 40–60 мг/добу п/о, у 3 прийоми, від 7-ї доби — дозування як перед пологами. Слід пам’ятати про в/в інфузії 0,9 % NaCl.
Застосування гідрокортизону під час великих хірургічних втручань під загальною анестезією у пацієнтів з гіпокортицизмом: за день до операції — 40 мг/добу п/о; у день операції — 100 мг у в/в інфузії, потім 200 мг/24 год шляхом безперервної в/в інфузії (або 50 мг в/в кожні 6 год); 1-а і 2-а доба після операції — 50 мг в/м кожні 6 год, а у випадку зниження артеріального тиску додатково 100 мг у в/в інфузії. Такої тактики необхідно дотримуватися до моменту, коли хворий зможе їсти та пити; тоді слід розпочати лікування гідрокортизоном п/о — впродовж 2 діб у вдвічі більшій дозі, ніж перед втручанням, надалі дозу зменшують поступово таким чином, щоб під кінець 1-го тиж. повернутися до базової дози, яку пацієнт приймав перед втручанням.
Застосування гідрокортизону під час невеликих хірургічних втручаннях у пацієнтів з гіпокортицизмом: як правило, слід підвищити дозу п/о замісної терапії гідрокортизоном у 2–3 рази протягом 1–2 днів. Перед екстракцією зуба додатково призначте 20 мг гідрокортизону п/о за 1 год перед втручанням та збільшіть у 2 рази наступну дозу, що приймається у цей же день.
Профілактика гідрокортизоном у пацієнтів з гіпокортицизмом, яким виконується колоноскопія: необхідно госпіталізувати пацієнта; увечері ввести в/в або в/м 50 мг гідрокортизону та призначити в/в інфузію з метою нормалізації водного балансу; перед початком дослідження слід знову ввести в/в або в/м 50–100 мг гідрокортизону.
У пацієнтів з відповідною замісною терапією хвороба Аддісона не впливає на тривалість життя, проте розвиток адреналового кризу підвищує летальність серед пацієнтів з гіпокортицизмом; у випадку відсутності лікування, неминуче призводить до смерті. У випадку туберкульозного генезу прогноз залежить від поширеності інфікування, однак, у випадку двосторонніх метастазів у надниркові залози або лімфом, прогноз — несприятливий.
[youtube.player]Читайте также:


