Микозы и микотоксикозы методы лабораторной диагностики








Лабораторная диагностика микозов и микотоксикозов
Запасы кормов сравнительно часто могут быть поражены различного рода грибами. Пораженные грибной или другой микрофлорой корма могут быть источником тяжелых и часто массовых отравлений сельскохозяйственных животных. Различными видами грибов и разнообразной бактериальной микрофлорой могут заражаться или живые растения на корню во время роста, или уже заготовленные запасы кормов при их хранении.
В зависимости от механизма воздействия грибов на организм кормовые заболевания (или микотические заболевания) животных разделяются на микозы и микотоксикозы [4].
Для микозов характерным является го, что грибы, попадающие в организм с кормом, прорастают и размножаются в их или иных органах и тканях его и оказывают как местное, так и общее действие на организм. Микотоксикозы отличаются тем, что воздействие оказывают токсины, выделяемые развивающимися на кормах грибами [2].
При оценке санитарного качества кормов зооветеринарные врачи должны учитывать следующие обстоятельства:
1) является ли отобранная проба типичной для данного вида корма. В момент возникновения микотоксикозов пробы кормов или фуража, предназначенных для анализа или опытов со скармливанием подозреваемых кормов, должны отражать все имеющиеся источники кормления. Воздействие на животных микотоксинов, содержащихся в небольших концентрациях в кормах, может быть не совсем четким и проявиться через несколько недель или даже месяцев после их скармливания. Степень поражения кормов грибами может быть различной внутри одного хранилища и даже среди зерен одного кукурузного початка, поэтому очень важна техника взятия проб;
2) отвечает ли проба взятых кормов необходимым вкусовым качествам и действительно ли корм был скормлен пораженным животным. Достаточно выраженный признак поражения корма плесневым грибом — отказ животных от его потребления и в дальнейшем снижение продуктивности;
3) необходимо учитывать технологический процесс изготовления или обработки кормов, изменяющий их токсичность. Тепло, химические вещества и солнечный свет — факторы, нарушающие первоначальную структуру и активность метаболитов плесневых грибов.
Методика токсико-микологического контроля качества кормов включает следующие приемы:
• отбор проб кормов для исследований;
• органолептический анализ кормов;
• токсико-биологический анализ кормов;
• микологический анализ кормов с определением токсичности выделенных культур грибов;
• заключение и оценка кормов по результатам исследований, возможные методы обезвреживания [5].
Взятие проб кормов. Необходимо учитывать, что грибы неодинаково распределены на растениях в поле или кормах внутри хранилища. Исследованиями установлено, что наибольшее количество ошибок (до 33%) при определении токсинов в различных кормах возникает в процессе взятия проб. Учитывая это, необходимо руководствоваться следующими рекомендациями:
• пробы кормов следует брать в различных стадиях процесса их получения — из растущих культур, во время транспортировки и хранения;
• если зараженные участки смешались с нормальными недавно, нужно брать большую пробу;
• небольшие пробы берут периодически, через определенные промежутки времени, а затем соединяют, перемешивают и уже из этой смеси берут пробы для анализа [1].
Органолептический анализ — это определение запаха, цвета корма. Для усиления ощущения запаха зерна, клочка сена или соломы в стакан с образцом корма заливают горячую воду (60-70°) и, покрыв стакан стеклом, оставляют на 2-3 минуты; затем воду сливают и определяют запах корма.
Для определения цвета грубые корма, зерно, жмыхи и шроты исследуют на белой бумаге при рассеянном свете. При осмотре комбинированных и мучнистых кормов (отруби и др.) определяют их сыпучесть.
На грубых кормах при развитии грибов наблюдается потемнение, побурение, слежавшиеся пласты, в случае зерновых кормов — зерна становятся тусклыми и часто потемневшими.
Токсико-биологический анализ кормов включает в себя определение токсичности корма путем введения экстракта в желудок белым мышам и алиментарные фобы на малоценном животном [3].
Определение токсичности выделениях культур грибов включает в себя вычленив грибов из корма, количественны учет и дифференциацию их, выделение чистых культур из первичных посевов и определение их токсичности.
2. Горина О.В. Зоогигиеническая оценка микологического пейзажа подстилочных материалов при выращивании молодняка птицы [Текст] // Известия с/х науки Тавриды. – 2014. - №160. – С. 7.
4. Зыкин, Л. Ф. Клиническая микробиология для ветеринарных врачей [Текст] : учеб. пособие для студ. вузов, обуч. по спец. "Ветеринария" / Л. Ф. Зыкин, З. Ю. Хапцев ; Международная ассоциация "Агрообразование". - М. : КолосС, 2006. - 96 с.
Микозы — группа болезней, вызываемых патогенными микроскопическими грибами, активно паразитирующими в организме животного. К микозам относят и дерматофитозы — заразные заболевания кожи, характеризующиеся образованием на коже округлых шелушащихся, покрытых корками пятен с обломанными волосами.
К возбудителям дерматофитозов относят микроскопические грибы родов Microsporum и Trichophyton.
Источник возбудителей — больное животное. Факторы передачи возбудителя инфекции — контаминированные предметы ухода за животными, подстилка, навоз, переносчиками могут быть эктопаразиты. Заражение происходит контактным способом. Случаи заболевания наиболее часты осенью и зимой. Считается, что в 85 % случаев заболевания людей микроспорией связаны с заражением от кошек.
Различают следующие формы трихофитии: поверхностную, глубокую (фолликулярную), стертую (атипичную). Микроспория протекает преимущественно в поверхностной и стертой формах.
Диагноз устанавливается комплексно. Лабораторные исследования включают люминесцентное исследование и микроскопию патологического материала (соскоба кожи), выделение культуры возбудителя, его идентификацию.
С лечебной целью применяют противотрихофитийные вакцины для каждого вида животных. В настоящее время существуют следующие вакцины против трихофитии животных:
ТФ-130, ЛТФ-130, ТФ-130К для крупного рогатого скота;
СП-1 для лошадей; ментавак для пушных зверей и кроликов;
триховис для овец;
ателвак-ТС для верблюдов;
миколам, поливак-ТМ, вакдерм для собак, кошек, пушных зверей.
К микозам относят также аспергиллез (возбудитель — грибы из рода Aspergillus), мукоромикоз (возбудитель из рода Мисог), кокцидиоидомикоз (Coccidioidesimmi), кандидамикоз (возбудитель из рода Candida — дрожжеподобный гриб), пеницеллез (возбудитель из рода Penicillium), эпизоотический лимфангит (Histoplasma farciminosus). Возбудители широко распространены в природе и обнаруживаются на слизистых оболочках млекопитающих.
Микозы часто возникают при ослаблении резистентности макроорганизма, на фоне других инфекций.
Аспергиллез — инфекционная болезнь птиц, реже млекопитающих. При заболевании отмечаются характерные поражения в основном органов дыхания, образование фибринозных узелков различной формы и цвета.
Мукоромикоз — хронический микоз животных и человека, характеризующийся поражением органов дыхания и лимфатических узлов с образованием казеино-известковых гранулем. Болеют многие виды животных и человек, заражение происходит аэрогенным и алиментарными путями.
Кокцидиоидомикоз — глубокий микоз, протекающий в виде доброкачественной гранулемы дыхательных путей и лимфатических узлов. Восприимчивы крупный рогатый скот, собаки, овцы, ослы, кошки, кролики, обезьяны и т.д. Источник возбудителя — больные животные. Заражение происходит аэрогенным путем, иногда алиментарным путем.
Кандидамикоз (молочница, оидомикоз) — заболевание животных и человека, характеризующееся поражением слизистых оболочек пищеварительного тракта с образованием творожистых пленок, грануломатозных процессов во внутренних органах. Обнаруживают поражения ротовой полости, молочной железы у коров, кишечника у свиней, иногда и кожи. Грибы рода Candida в естественных условиях патогенны для домашней птицы, млекопитающих и рыб (преимущественно поражается молодняк).
Ведущий фактор в патогенезе кокцидозной инфекции — состояние макроорганизма. Снижение резистентности организма ведет к активации, размножению гриба, который входит в состав нормальной микрофлоры слизистых оболочек.
Леницеллез — микоз человека и животных, сопровождающийся поражением ногтей, уха, верхних дыхательных путей, легких. Возможна генерализованная инфекция. Поражаются многие сельскохозяйственные животные и человек.
Специфическая профилактика и терапия отсутствуют.
Эпизоотический лимфангит — хроническая инфекционная болезнь однокопытных, характеризующаяся воспалением лимфатических сосудов кожи и подкожной клетчатки с образованием гнойных фонусов и язв. Возбудитель попадает в организм через поврежденную кожу. Переболевшие животные приобретают пожизненный иммунитет.
Диагностика микозов основывается на патологоанатомических данных, клинических признаках, аллергической пробе и лабораторных исследованиях, включающих микроскопию патологического материала, получение чистой культуры гриба.
Микотоксикозы — болезни сельскохозяйственных животных, возникающие после скармливания им кормов, загрязненных токсинами грибов, паразитирующих на вегетативных растениях, и отравления токсинами грибов-сапрофитов, поражающих корма во время их хранения.
Возбудитель: Claviceps paspali — вызывает клавицепстоксикоз — алиментарный токсикоз сельскохозяйственных животных, возникающий при поедании кормов растительного происхождения, пораженных спорыньевыми грибами. Токсин обладает нейротропным действием, содержится только в склероциях гриба, из которых выделяются алкалоиды.
Восприимчивы овцы, ослы, лошади, крупный рогатый скот, свиньи, гуси всех возрастов. Диагноз устанавливается на основании клинических признаков, анализа кормов, при выявлении склероциев и микотоксинов. Специфические средства профилактики отсутствуют, лечение симптоматическое.
Эрготизм — алиментарный микотоксикоз, возникающий при поедании хлебных, дикорастущих злаков, продуктов переработки с примесью рожков спорыньи. Возбудители эрготизма — Claviceps purpure и Claviceps microcephala, поражающие рожь, ячмень, овес, пшеницу в период вегетации. Чувствительны к ним животные многих видов, чаще поражаются крупный рогатый скот, овцы, свиньи, лошади. Токсины спорыньи вызывают у животных нервные симптомы, гангрену, диарею, сужение кровеносных сосудов, паралич, гибель.
Диагностика. В спорных случаях зараженность кормов определяют люминисцентным и химическим методами.
Стахиботриотоксикоз — остро или подостро протекающий микотоксикоз сельскохозяйственных животных, возникающий при поедании кормов, пораженных токсичным грибом Stachybotrys alternaus, растущим на сене и соломе. Восприимчивы лошади, свиньи и жвачные. Вспышка стахиботриотоксикоза отмечена у буйволов, лосей, бизонов. Стахиботриотоксин поражает центральную нервную и кровеносную систему.
Диагноз устанавливается на основании лабораторных исследований, которые заключаются в микроскопии патологического материала, выделении S. alternaus из кормов и определении его токсичности методом кожной пробы на кроликах.
Специфические средства терапии и профилактики отсутствуют.
Дендродохиотоксикоз — это остро протекающий микотоксикоз сельскохозяйственных животных вследствие поедания грубых кормов, пораженных грибом Dendrodochium toxicum. Дендродохины — цитоплазматические яды. Болеют лошади, овцы, собаки, кошки, куры, кролики. Диагноз устанавливается комплексно.
Специфические средства терапии и профилактики не разработаны.
Аспергиллотоксикоз — алиментарный микотоксикоз сельскохозяйственных животных, возникающий при скармливании кормов, пораженных грибом, чаще всего Aspergillus fumigatus (аспергиллофумигатотоксикоз), Aspergillus flavus (аспергиллофлавитоксикоз, афлатоксикоз). Токсины аспергиллов обладают местным (воспалительным) и общим (поражение центральной нервной системы, нарушение иммуногенеза) действием. Токсичность грибов устанавливают на лабораторных животных. Обнаружение афлатоксинов проводят методом тонкослойной хроматографии.
Фузариотоксикоз — алиментарный микотоксикоз, вызываемый грибами рода Fusarium: F. sporotrichiella, F. graminearum, F. nivale.
К фузариотоксикозам восприимчивы сельскохозяйственные животные всех видов. Токсины грибов поражают центральную нервную систему, желудочно-кишечный тракт, паренхиматозные органы, костный мозг. Токсичность корма проверяют на кроликах кожной , реакцией или подкожным заражением белых мышей, аквариумных рыбок, 1,5 —2-месячных цыплят, 9-дневных куриных эмбрионов.
Для диагностики разработаны серологические реакции.
Специфические средства терапии и профилактики не разработаны.
Инфекционный кератоконъюнктивит — острая инфекционная болезнь животных, характеризующаяся поражением глаз с развитием конъюнктивита и кератита. Восприимчивы крупный рогатый скот, овцы, козы, верблюды, свиньи и птицы. Источник возбудителя — больное животное. Насекомые являются механическими переносчиками возбудителя.
Окончательный диагноз устанавливается после микроскопического исследования мазков-соскобов с поверхности пораженной конъюнктивы.
ДИАГНОСТИКА МИКОТОКСИКОЗОВ
Диагностика микотоксикозов животных включает предварительный и заключительный диагнозы, подтверждающие или опровергающие первоначальное заключение.
При постановке предварительного диагноза учитывают квалифицированный анамнез, эпизоотические сведения по тому или иному заболеванию, характерные клинические признаки микотоксикоза, данные патологоанатомического вскрытия с учетом гематологических сведений, а также гистологического исследования патологического материала.
Например, при постановке диагноза на стахиботриотоксикоз обращают внимание па лейкопению, геморрагический диатез некрозы кожи, слизистых оболочек й ретракцию кровяного сгустка. Токспкомнкологичеекое исследование служит для уточнения и подтверждения предварительного диагноза.
Однако естественное течение микотоксикозов не всегда характеризуется ярко выраженной клинической и патологоапато-мическои картинами, что затрудняет постановку диагноза Схожесть клинических признаков микотоксикозов разной этиологии также затрудняет постановку диагноза.
Заключительный диагноз ставят на основании комплексных исследований: анамнеза, эпизоотической обстановки, клинических, гематологических данных, патологоанатомического и мико-гоксикологичеекого исследований.
При дифференциальной диагностике микотоксикозов необходимо исключить отравления бактериальной природы, инфекционные и инвазионные заболевания, отравления ядовитыми рас-Iсиними (лютиком, чемерицей, хвошом, клещевиной, белладонной, болиголовом и др.). В последние годы нередко причиной отравлений служат минеральные удобрения и гербициды при их небрежном хранении
Для подтверждения диагноза на микотокенкозы отбирают среднюю пробу корма, пораженного грибами, общей массой не более I кг и отправляют в региональную ветеринарно-бактерио-логическую лабораторию. Лаборант для исследования отбирает среднюю пробу в количестве 200 г.
При отборе средних ппоб на местах нужно учитывать, что сено, солома, мякина и зерно, пораженные токсическими штаммами грибов, часто по органолептическим показателям не отличаются от доброкачественных. Но в стогах, скирдах, амбарах и складах болезнетворные грибы развиваются в местах наибольшего увлажнения в виде гнезд в сене, мякине, соломе или комков в зерне, отрубях и комбикормах. Пробы из этих мест высылают па анализ отдельно. Отобранные пробы грубых кормов подсушивают при температуре не выше 50 °С и только после этого отправляю) в бумажных пакетах или чистых матерчатых мешках.
Зеленые растения на пастбищах собирают вместе с цветами и листьями и тоже отправляют в бумажных пакетах.
При отправлении кормов ветеринарный специалист, зоотехник, заведующий фермой, отделением или бригадир пишет со-проводительное письмо по установленной форме, в котором сообщает сведения о длительности скармливания животным пораженного корма, его количестве, а также о составе рациона в целом. Каждый отправляемый на экспертизу материал должен быть снабжен этикеткой с указанием наименования материала, даты отбора пробы, названия хозяйства и его адрес;). Одновременно сообщают основные признаки заболевания животных, а в случае падежа описывают патологоанатомическую картину.
Для выявления токсических штаммов грибов средние пробы кормов высевают в бактериологические чашки на агар Чапека и на фильтровальную бумагу, увлажненную стерильной водой. Посевы ставят а термостат и выдерживают при 25—37 °С. На 3—5-е сутки появляются колонии гриба* которые пересевают в пробирки на агар Чапека для получения чистой культуры.
Культуру гриба, выделенного из корма, проверяют на токсичность путем подкожного введения белым мышам культуральной жидкости гриба и кожной пробы на кролике. Экзотоксин гриба может вызвать у мышей нарушение координации движений, титанические судороги с летальным исходом. От эфирных экстрактов токсических штаммов культуры, нанесенной на выбритую поверхность кожи кролика, появляются гиперемия, утолщение и некроз.
Для культивирования грибов в лабораторных условиях используют различные твердые и жидкие питательные среды. Для их приготовления необходимо взять определенное количество порошкообразного или нарезанного кусочками агара, поместить в колбу, добавить необходимое количество дистиллированной воды, поставить на слабый огонь и, постоянно помешивая, довести до полного растворения агара. Полученную среду фильтруют в колбочки вместимостью 100—150 мл и стерилизуют в автоклаве при 5 атм в течение 20—30 мин. Кислотность (рН) среды проверяют в отдельной пробирке вместимостью 15—20 мл, которую стерилизуют в автоклаве вместе с питательной средой.
Твердые питательные среды. Агар Чапека. В состав среды входят: глюкоза — 30 г, нитрат натрия — 2 г, дегидрофосфат калия — 1 г, сульфат магния — 0,5 г, сульфат железа — 0,0012 г, хлорид калия — 0,5 г, агар-агар — 20 г, вода дистиллированная — 1 л. Среду стерилизуют под давлением 0,5 атм в течение 30 мин; рН среды естественный (после стерилизации 5,6-5,9).
Среду широко используют для выделения и культивирования многих грибов.
Картофельный агар. 200 г очищенного картофеля нарезают ломтиками, заливают 1 л водопроводной воды и помещают на 40 мин в текучий пар. Жидкость отфильтровывают, объем восстанавливают до I л и добавляют 20 г агара. После растворения агара среду разливают по пробиркам и стерилизуют в автоклаве 30 мин под давлением 0,5 атм. После стерилизации рН среды 6,0—6,2.
Используют для изучения спороношений грибов рода Fusarium.
Рисовая среда. Отобранные промытые целые зерна риса насыпают в пробирки (до 17—20 мм высотой), заливают двумя объемами водопроводной воды и стерилизуют в течение 30 мин под давлением 0,5 атм.
Применяют для выявления пигмента грибов рода Fusarium и спороношений Microsporum lanosum.
Жидкие питательные среды. Среда Ван-Итерсона. В состав среды входят: нитрат аммония — 0,5 г, однозамещенный дигидрофосфат калия — 0,5 г, вода водопроводная — 1 л. Среду стерилизуют в колбах по 100—150 мл под давлением 1 атм в течение 30 мин. Затем средой увлажняют стерильные чашки Петри с фильтровальной бумагой.
Используют для выделения из кормов токсичных грибов, вызывающих стахиботриотоксикоз, дендродохиотоксикоз и др.
Среда Чапека. В состав среды входят: глюкоза — 30 г. нитрат натрия — 2 г, однозамещенный дигидрофосфат калия — 1 г, сульфат магния — 0,5 г, хлорид калия — 0,5 г, сульфат железа — 0,001 г, вода дистиллированная — 1 л. Стерилизация в автоклаве под давлением 0,5 атм в течение 30 мин или текучим паром 3 сут подряд по 1 ч. После стерилизации рН среды 5,9— 6,2.
Жидкая среда может быть использована для увлажнения фильтровальной бумаги в чашках Петри при выявлении1 в кормах различных грибов.
Среда Годен а и Готье.В состав среды входят: глюкоза — 30 г, пептон — 10 г, вода дистиллированная — 1 л.
Используют для культивирования и накопления токсинов многих грибов.
Умелое и рациональное использование вышеуказанных питательных сред позволит в какой-то степени работникам ветери-нарно-бактериологических и других лабораторий успешно диагностировать токсические штаммы грибов и уточнять предварительный диагноз.
Понятие о микотоксикозах и виды микотоксинов. Действие на микотоксины физических и химических факторов. Клинические признаки и классификация возбудителей микотоксикозов. Схема лабораторной микологической диагностики с токсикологическим анализом.
| Рубрика | Сельское, лесное хозяйство и землепользование |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 15.10.2015 |
| Размер файла | 67,0 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
1. Понятие о микотоксикозах
2. Виды микотоксикоз
3. Классификация возбудителей болезней
4. Общая характеристика болезней
Список использованной литературы
Микотоксикозы (греч. mykзs гриб + токсикоз (Токсикозы беременных) заболевания, обусловленные попаданием в организм микотоксинов, которые образуются в процессежизнедеятельности ряда микроскопических (плесневых) грибов.
Выделено более 300 микотоксинов, продуцируемых представителями 350 видов микроскопических грибов,однако практическое значение как загрязнители пищевых продуктов имеют лишь около 20. Среди нихнаиболее распространены и опасны для здоровья человека афлатоксины В1, В2, G1, G2, М1 (продуценты--грибы рода Aspergillusj, трихотеценовые микотоксины (в т.ч. дезоксиниваленол) и зеараленон (продуценты --грибы рода Fusarium), охратоксины, цитринин, цитреовиридин (продуценты -- грибы рода Aspergillus иPenicillium), алкалоиды спорыньи, в т.ч. лизергиновая кислота и агроклавин.
Микотоксины чаще обнаруживаются в растительных продуктах. Поражение их грибками происходить периодсозревания и уборки урожая при неблагоприятных метеорологических условиях и неправильном хранении.Сельскохозяйственные продукты и корма, пораженные грибками, изменяют свой внешний вид, что помогаетустановить их недоброкачественность. Такие продукты и корма могут стать причиной тяжелых заболеванийлюдей и животных вследствие накопления в них микотоксинов.
1. Понятие о микотоксикозах
Микотоксикозы (греч. mykзs гриб ) -- заболевания, обусловленные попаданием в организм микотоксинов, которые образуются в процессе жизнедеятельности ряда микроскопических (плесневых) грибов.
Проблема микотоксинов известна с глубокой древности. Периодически случались отравления людей и животных при употреблении продуктов, содержащих микотоксины. Наиболее известна гибель 14 тысяч человек в Париже в 1129 году от употребления хлеба, содержащего микотоксин (эрготоксин) спорыньи злаков. В России также отмечены случаи массового отравления людей и животных зерном и хлебом, содержащим микотоксины возбудителя фузариоза.
Приблизительно с 60-х годов 20-го века проблема микотоксинов приобрела глобальный характер в связи с нарушением экологического равновесия при интенсивных технологиях возделывания сельскохозяственных культур, а также из-за повышения содержания фотооксидантов в атмосфере (воздушного загрязнения), из-за чего растения теряют устойчивость к фитопатогенам. Возрастание микотоксикоза сельскохозяственных продуктов связано также с широким применением азотных удобрений и пестицидов. Имеет значение и ограниченное количество генотипов сортов сельскохозяственных культур.
2. Виды микотоксикоз
Выделено более 300 микотоксинов, продуцируемых представителями 350 видов микроскопических грибов, однако практическое значение как загрязнители пищевых продуктов имеют лишь около 20. Среди них наиболее распространены и опасны для здоровья человека афлатоксины В1, В2, G1, G2, М1 (продуценты-- грибы рода Aspergillus), трихотеценовые микотоксины (в т.ч. дезоксиниваленол) и зеараленон (продуценты -- грибы рода Fusarium), охратоксины, цитринин, цитреовиридин (продуценты -- грибы рода Aspergillus и Penicillium), алкалоиды спорыньи, в т.ч. лизергиновая кислота и агроклавин.
Грибы, продуценты микотоксинов, заражают сельскохозяйственные культуры, особенно зерновые и масличные, в период роста, при сборе урожая, а также во время хранения и переработки. Этому способствуют неблагоприятные метеорологические условия и неправильное хранение продовольствия. Концентрация спор грибов может увеличиваться при использовании целинных земель под зерновые. Сельскохозяйственные продукты и корма, пораженные грибками, изменяют свой внешний вид, что помогает установить их недоброкачественность.
С практической точки зрения, микотоксины являются грибными метаболитами, вызывающими нежелательное воздействие при попадании в организм человека и животных. Обычно они попадают в организм при потреблении контаминированного корма или пищи. Микотоксины вызывают множество биологических эффектов у животных: токсикоз печени и почек, воздействие на центральную нервную систему и редко упоминаемый эстрогенный эффект.
Это приводит к поражению многих органов и систем, что вызывает рвоту, понос, кровотечения, потерю веса, нервные расстройства, нарушения в функционировании сердечно-сосудистой системы, подавление иммунной системы, дезорганизацию гомеостаза, снижение репродуктивной способности и повреждение костного мозга
Концентрация микотоксина в фураже и в пищевых продуктах чаще всего бывает ниже той, что вызывает острое заболевание. При низких концентрациях отмечаются торможение роста, снижение общей устойчивости организма, что является следствием ослабления иммунной системы. В частности, на птицах показано, что Т-2 токсин неблагоприятно действует на иммунокомпетентные органы.
По оценке Управления по Продовольствию и Сельскому хозяйству ООН (ФАО) ежегодно приблизительно 25% мирового урожая зерновых поражается микотоксинами. Виды и количества микотоксинов варьируют год от года, что связано изменением погоды и наличием различных стрессовых факторов для растений. Оптимальные условия для роста плесени и производства микотоксинов зависят от вида гриба.
Особое внимание следует обращать на обнаружение микотоксинов в продуктах животного происхождения (мясо, молоко, молочные продукты, яйца), которые могут попасть в них вследствие скармливания с.-х. животным и птице кормов, зараженных микотоксинами; последние частично накапливаются в тканях и органах животных, у яйценесущих птиц -- также в яйцах, из организма лактирующих животных микотоксины, метаболизируясь, выделяются с молоком. Такие продукты представляют наибольшую опасность для здоровья человека, т.к. микотоксины могут присутствовать в них без видимого роста плесени. Однако прямой зависимости между поражением пищевого субстрата грибками и образованием в нем микотоксинов не отмечается. Очень часто в зараженных грибками продуктах микотоксины отсутствуют.
Микотоксины устойчивы к действию физических и химических факторов. Поэтому разрушение их в пищевых продуктах представляет трудную задачу. Общепринятые способы технологической и кулинарной обработки лишь частично уменьшают содержание микотоксинов в продукте. Высокая температура (свыше 200°), замораживание, высушивание, воздействие ионизирующего и ультрафиолетового излучения оказались также малоэффективными.
Известно несколько видов микотоксинов: пищевые (алиментарные), респираторные (пневмомикотоксикозы), дерматомикотоксикозы.
микотоксин микотоксикоз заболевание диагностика
3. Классификация возбудителей болезней
Классификация возбудителей и вызываемые ими болезни

Дальнейшее развитие метод получил под названием высокоэффективной тонкослойной хроматографии (ВЭТСХ, HPTLC). Уменьшение толщины слоя неподвижной фазы (до 100 мкм) и величины частиц (до 5 мкм), привело к лучшему разделению веществ за более короткий период времени.
Методы ТСХ доступны почти для всех микотоксинов. Обнаружение и специфическая идентификация разработана для каждого отдельного микотоксина, используя молекулярные свойства или реакции трансформации веществ.

Главные недостатки тонкослойной хроматографии:
§ малая производительность;
§ большинство образцов нуждается в этапах экстракции и очистки для удаления потенциальных помех и матричных соединений перед анализом;
§ концентрация анализируемого вещества должна быть в диапазоне 0,01-0,1 %;
§ использование токсичных и летучих веществ в качестве растворителя.
Методы высокоэффективной жидкостной хроматографии (ВЭЖХ) в области исследования микотоксинов главным образом используются для заключительного отделения матричных соединений и обнаружения интересующего анализируемого вещества. В настоящее время методы ВЭЖХ широко распространены из-за их превосходящих характеристик и надежности по сравнению с тонкослойной хроматографией. Методы ВЭЖХ были разработаны для большинства основных микотоксинов в зерновых культурах и другой сельскохозяйственной продукции. Большинство методов надежны и стабильны.
Метод ВЭЖХ основан на разделении анализируемого экстракта в неподвижной фазе хроматографической колонки (рисунок 3) (для анализа микотоксинов чаще используются колонки С8 и С18) и дальнейшей их идентификации и количественном определении с помощью специальных детекторов. Наиболее распространенными детекторами для анализа микотоксинов в настоящее время являются ультрафиолетовый и флюоресцентный.
Пределы чувствительности методов ВЭЖХ с применением данных детекторов могут доходить до 1 мкг/кг образца.
В литературе сообщалось о разработке методов ВЭЖХ для одновременного анализа нескольких микотоксинов. Особенно успешно таким образом анализируются трихотеценовые микотоксины, в частности трихотецены.

На практике для исследования кормов и продуктов питания в полевых условиях, условиях производственных и испытательных лабораторий требуются методы, позволяющие количественно и быстро исследовать большое число образцов на наличие микотоксинов, по возможности с наименьшими затратами сил и финансовых средств.
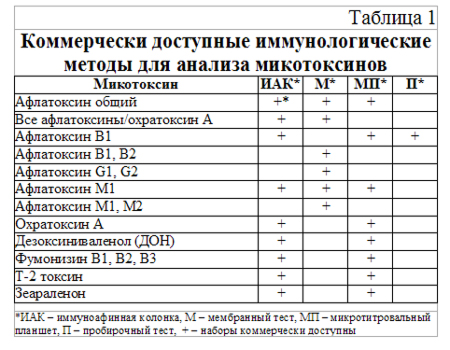
Всем этим характеристикам отвечают методы на основе иммунологических реакций. Коммерчески доступные иммунологические методы для анализа микотоксинов базируются на применении специфических моноклональных и поликлональных антител против определенных токсинов, и в целом делятся на:
§ метод на основе иммуноафинных колонок (ИАК, IAC);
§ иммуноферментный анализ (ИФА, ELISA) (таблица 1).
Обычно, иммуноафинные колонки фактически используются для очистки образца от матричных соединений и позволяют провести выделение и концентрирование определенного микотоксина.
Следующая за этим элюция токсина из ИАК позволяет провести количественное определение с использованием классических аналитических методов. В случае проведения иммуноферментного анализа, процедуры очистки обычно не столь интенсивны как при других аналитических методах. Гомогенат или экстракт образца, содержащий микотоксин, или непосредственно исследуется количественно, используя стандартный микротитровальный планшет или пробирочный анализ формата ИФА, или используется иммуноферментный мембранный тест для проведения качественного или полуколичественного определения наличия микотоксинов.
Другие методы по исследованию микотоксинов, использующие иммунологический подход, о которых сообщается в литературе, включают оптические и акустические биосенсоры, капиллярный электрофорез.
Образец, содержащий микотоксин, льют по иммуноафинной матрице Образец с микотоксином фильтруется через матрицу и микотоксин связывается на шариках Элюирующий буфер льют по матрице, и очищенный микотоксин вымывается в кювету для проб.

Иммуноафинные колонки обычно используются для очистки исследуемого образца от сложных матриц и концентрации токсинов перед обнаружением и оценкой содержания микотоксина, используя ряд классических аналитических методов, таких как ВЭЖХ, газовая хроматография, масс-спектрометрия, флуорометрия, ВЭТСХ и ТСХ. Метод заключается во введении экстракта образца в колонку, содержащую иммуноафинную матрицу, содержащую твердую фазу (например, гранулы агарозы), к которой ковалентно присоединены антитела против микотоксина (рисунок 4). Молекула токсина, содержащаяся в образце, присоединяется к соответствующему иммобилизированному антителу. Последующие шаги включают удаление несвязанных матричных компонентов и экстрагента, элюцию токсина, изменяя элюирующий состав и, наконец, обнаружение токсина, используя аналитические методы. Как альтернатива, микотоксин, связанный в колонке, может быть элюирован и непосредственно измерен флюорометрией, основанной на собственной флюоресценции микотоксинов.
Мембранный тест позволяет за короткий период времени (около 10-15 мин) дать ответ на вопрос: присутствуют ли в испытуемом образце микотоксины выше уровня предела чувствительности данного теста? То есть фактически это качественное определение наличия/отсутствия микотоксинов в пробе. Метод требует экстракции, фильтрации, очистки (через колонку) и разведения образца. Далее раствор наносится на мембрану сенсибилизированную моноклональными антителами, куда также добавляется ферментный конъюгат микотоксина. Если концентрация микотоксинов в образце превышает предел чувствительности теста, все антитела на поверхности связываются с ними и весь добавленный конъюгат удаляется на этапе отмывки. При добавлении бесцветного субстрата конъюгат на поверхности мембраны катализирует цветную реакцию, в результате которой на месте связывания конъюгата образуется цветное пятно. Окрашивание аналитической зоны мембраны говорит об отсутствии микотоксинов в образце.
Иммуноферментный анализ обычно используется для мониторинга наличия микотоксинов выше определенного уровня (или их отсутствия) в испытуемом образце. В настоящее время доступен ряд качественных, полуколичественных и количественных методов. Основываясь на результатах ИФА подозрительные образцы должны быть перепроверены классическими методами. Доступны различные варианты ИФА для анализа микотоксинов (например, мембранные тесты, микротитровальные планшеты и пробирочные методы). Как правило, метод ИФА основан на конкурентом анализе, который использует или связанные с ферментным конъюгатом микотоксины, или антитела против определенного анализируемого токсина (рисунок 5). Типичная последовательность реакций, используя готовые реактивы в формате микротитровального планшета следующие:
1. ферментный конъюгат добавляется к экстракту испытуемого образца;
2. смесь добавляется к соответствующим антителам, нанесенным на поверхность лунок планшета (например, микротитровальный планшет, сенсибилизированный антителами);
3. количество соединенного с токсином конъюгата, связываемое иммобилизированными антителами зависит от количества токсина в образце; чем выше количество токсина в образце, тем ниже будет количество ферментного конъюгата присоединившегося к антителам, нанесенным на поверхность лунок планшета и наоборот;
4. ферментативная активность связанного с поверхностными антителами конъюгата определяется добавлением соответствующего субстрата, что приводит к образованию окрашенных продуктов, концентрация которых обратно пропорциональна концентрации токсина в испытуемом образце.

На базе Белорусского государственного ветеринарного центра нами в течение 2004-2006 г.г. проводился анализ содержания микотоксинов в кормах с использованием иммуноферментного метода. Для исследования применялись готовые тест-системы производства компании R-Biopharm, Германия. Этой компанией выпускается ряд наборов для количественного определения микотоксинов: афлатоксины В, G, М, зеараленон, охратоксин А, Т-2 токсин, дезоксиниваленол, фумонизин В1, цитринина. Следует отметить, что практически для всех перечисленных микотоксинов существуют варианты тест-систем для определения особо малых концентраций этих токсичных соединений с пределом чувствительности на уровне хроматографических методик (RIDASCREEN® Mycotoxins) (время инкубации 1-2 часа) и экспресс-методы, позволяющие определять практически такие же концентрации в течение 15-30 минут (RIDASCREEN® FAST Mycotoxins). Все методики прошли утверждение в Республике Беларусь и могут использоваться в лабораториях, входящих в структуру Министерства сельского хозяйства и продовольствия.
Организация анализа микотоксинов в кормах и пищевых продуктах иммуноферментным методом возможна минимальными средствами и в самые короткие сроки. Простота эксплуатации и незначительная стоимость необходимого оборудования выгодно отличают иммуноферментный метод от классических методов анализа (таблицы 2, 3) и делают его особенно привлекательным для лабораторий с ограниченными финансовыми возможностями.
Необходимо отметить, что при практически равных показателях пределов обнаружения методы иммуноферментного анализа являются более производительными и позволяют проводить избирательное исследование только подозрительных по ИФА образцов инструментальными методами. Например, методом ИФА один лаборант может провести исследование 10-100 образцов за одну рабочую смену, в то время как при использовании ВЭЖХ – только 1-10 проб. При этом на проведение иммуноферментного анализа затрачивается от 15 минут до 3 часов (пробоподготовка до 1 часа), а методом ВЭЖХ – 2-4 часа при 1-3-дневной пробоподготовке.


Выводы. Проведение исследований по выявлению загрязнения кормов микотоксинами за этот период позволило диагностировать внезапно возникшие вспышки заболеваний в нескольких хозяйствах республики, что дало возможность применить адекватные меры и тем самым снизить экономические потери производителей.
Затраты на своевременное исследование кормов собственного производства, а тем более закупаемых в других странах, всегда окажутся ниже, чем затраты на проведение экстренной диагностики вспыхнувшего заболевания, принятие необходимых мер по использованию или утилизации загрязненных кормов, а также потери от снижения продуктивности и гибели животных.
Читайте также:


