Остеоартроз коленных суставов алексеева л и
Презентация была опубликована 6 лет назад пользователемЛидия Циолковская
Презентация на тему: " Клиника, диагностика и современное лечение остеоартроза Л.И. Алексеева НИИР РАМН." — Транскрипт:
1 Клиника, диагностика и современное лечение остеоартроза Л.И. Алексеева НИИР РАМН
2 Остеоартроз Самое частое заболевание суставов, существенно возрастающее с возрастом Чаще всего поражаются нагрузочные суставы - коленные - тазобедренные - кисти - позвоночник
3 Активаторы хондроцитов, синовиоцитов Выход фрагментов в синовиальную жидкость Активация субхондральных остеобластов Резорбция субхондральной кости, склероз Воспалительныемедиаторы:цитокины.эйкосаноиды (PGE2, лейкотриены) Деструктивные энзимы хряща (MMPs) Оксид азота (NO) Компоненты синтеза матрикса хряща (коллаген, протеогликаны Патогенез остеоартроза
4 БОЛЬ ДЕФОРМАЦИЯ СУСТАВОВ НАРУШЕНИЕ ФУНКЦИИ
5 Классификация остеоартроза: Первичный (идиопатический) артроз Локальный (кисти, стопы, коленные, тазобедренные суставы) Генерализованный (поражение 3-х и более различных суставных групп) Вторичный артроз (посттравматический, развивающийся в результате эндокринологических, метаболических и других заболеваний)
6 Диагностические классификационные критерии ОА Коленные суставы Клинические Клинические, лабораторные, рентгенологические Тазобедренные суставы Клинические Клинические, рентгенологические Суставы кистей Клинические
7 Клинические методы для оценки боли и функции при ОА Функциональный индекс WOMAC (коленный и тазобедренный суставы) Индекс Lequesne для оценки тяжести поражения коленного и тазобедренного сустава Функциональный индекс DREISER или AUSCAN (для суставов кистей) Опросники качества жизни (HAQ, SF 36)
8 Перпендику лярная точка Измерение осей Методы диагностики РентгенологическийРентгенологический КомпьютернаяКомпьютерная томография и ЯМРТ томография и ЯМРТ УЗИУЗИ АртроскопияАртроскопия
9 Общие принципы лечения больных ОА Образование больных Уменьшение болевого синдрома Улучшение функции суставов Предотвращение развития инвалидности Модификация течения остеоартрозного процесса EULAR и OARSI рекомендации по управлению ОА включают не фармакологические, фармакологические и хирургические методы
10 Симптоматическая терапия ОА Диагноз Не фармакологические методы, образование больных медикаментымедленные быстрые Анальгетики Противовоспалительные Хирургические методы р/о Антирезорбтив- ные препараты, Глюкозамин, Хондроитин сульфат в/с гиалуронат Локальные НПВП в/с депостероиды р/о НПВП Локально Капсаицин лидокаин р/о Ацетоминофен, Трамадол, опиоиды, Антиконвульсанты, антидепрессанты Другие Миорелаксанты, Антитела к фактору Роста нерва IV Altman, 2010
11 НЕ МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ НЕ МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ Обучение больных (контакты по телефону, общества больных) 1 А,В ЛФК (улучшение функции суставов, силы мышц, снижение риска потери равновесия) 1В Коррекция веса Ортопедическая коррекция 1В Физиотерапия (применение тепла, холода и др)
12 Фармакотерапия ОА Быстрый per os анальгетики, НПВП в/с кортикостероиды Mедленный per os ХС, ГС, Диац, ASU (SYSADOA) в/с гиалуроновая к-та Симптоматический эффект Структурно-модифицирующий эффект –Хондроитин сульфат – Глюкозамин сульфат – Диацереин – ASU
14 Противовоспалительные препараты НПВП Стероиды Где они работают ?
15 Ткани желудка COX-1 PGE 2 гастропротекция Tolerability Слабая ингибиция повреждение Очаг воспаления Молекулы адгезии Миграция нейтрофилов COX-2 PGE 2 Провоспалительные цитокины Ингибиция продукции COX-2 COX-2 селективные Свободные радикалы Efficacy воспаление Антиоксидантный эффект X X X X X X TOLERABILITY EFFICACY Мультифакториальный механизм действия НПВП ПереносимостьЭффективность
18 New Guidelines Issued for Management of Hip and Knee ОА Фармакологические методы: ацетоминофен ( меньше 4 грамм в сутки, разовая доза 650 мг); селективные и неселективные НПВП используются в наименьшей эффективной дозе, необходимо избегать их длительного применения; локальные средства на основе НПВП и капсаицина; внутрисуставные инъекции кортикостероидов и гиалуронатов; симптоматически действующие глюкозамин и хондроитин сульфаты; возможный структурно-модифицирующий эффект, связанный с глюкозамин сульфатом, хондроитин сульфатом и диацереином; показания для использования слабых опиоидов и наркотических анальгетиков для лечения рефрактерной боли. W. Zhang, et al,Osteoarthr Cartil. 2008;16: ; 2010;18,
19 Динамика суммарного индекса WOMAC и дозы НПВП на фоне приема мидокалма у больных гонартрозом Л.И. Алексеева с соавт.
20 Локальные НПВП при ОА (1А,В) Этофеномат Флюрбипрофен Ибупрофен Кетопрофен Пироксикам Индометацин Диклофенак Салицилаты Диклофенак Плацебо Локальные НПВП Moore. Br. Med J. 1998; 316: 333
21 Симптоматические препараты замедленного действия (SYSADOA) Хондротин сульфат (1А) Глюкозамин сульфат (1А) Диацереин (1В) Авокадо/соя (1В) Гиалуроновая кислота (1В) Терафлекс (хондроитин сульфат + глюкозамин гидрохлорид) Артра (хондроитин сульфат + глюкозамин гидрохлорид) Кондро нова (хондроитин сульфат + глюкозамин сульфат)
22 Структурно-модифицирующие свойства Хондроитин сульфата и Глюкозамин сульфата Хондроитин сульфат замедляет сужение суставной щели при остеоартрозе коленного сустава Michel et al, 2001 Kahan A, et al., EULAR 2006 (STOPP исследование) P=0.01 P=0.03 сужение минимальной ширины суставной щели через 2 года Глюкозамин сульфат (1500 мг/день) замедляет прогрессирование остеоартроза коленного сустава [1,2] NNT= 7 1.Lancet 2001;357: Arch Intern Med 2002; 162: выраженное сужение суставной щели (>0.5 мм) через 3 г. P=0,013 0.5 мм) через 3 г. P=0,013">
24 Суммарный функциональный индекс WOMAC (2 схемы лечения терафлексом) P
25 Отмена ибупрофена в группах больных, получавших постоянную или интермиттирующую терапию терафлексом Отмена ибупрофена 1 группа (постоянное лечение) 2 группа (интермит. лечение) Через 1 месяц лечения 2%0% Через 3 месяца лечения 18,3%12% Через 6 месяцев лечения 23%7,1% Через 9 месяцев лечения 34,4%34,1%
26 Динамика индекса WOMAC (терафлекс адванс) *достоверность показателей р
27 Диацереин при остеоартрозе Проведено 2 мета-анализа: - Fidelix TS, Soares BG,Trevisani VF. (2.069 больных)Fidelix TSSoares BGTrevisani VF Cochrane Database Syst Rev Jan 25;(1):CD B Rintelen; K Neumann; BF Leeb (2.637 больных)B Rintelen; K Neumann; BF Leeb Arch Intern Med. 2006;166: Диацереин достоверно значимо уменьшал боль по сравнению с плацебо при ОА коленных и тазобедренных суставов. Структурно модифицирующий эффект доказан для ОА тазобедренных суставов. Fidelix, 2006 Ингибитор интерлейкина–1 - артрокер
28 Мета-анализ контролируемых клинических исследований НСАС R Christensen, E M Bartels, A Astrup, H Bliddal R ChristensenE M BartelsA AstrupH Bliddal Osteoarthritis Cartilage Nov 23; : (P,S,E,B,D) Отобрано 4 исследования, в которые были включены 664 больных ОА (коксартроз %, гонартроз % Получены доказательства симптом- модифицирующего действия НСАС Структурно модифицирующий эффект доказан для ОА тазобедренных суставов. Lequesne M., 2002
29 Hyalgan® (гиалуронат Na) Mв Suplasyn Мв 0,5-0,73 mln Da Fermathron Мв 1,1 mln Da Ostenil Мв 1,2 mln Da Supartz® Мв 0.6-1,7 mln Da Synocrom Mв 1,6 mln Da Orthovisk Мв 1,1-2.9 mln Da SYNVISC ® Mв 6 million Гиалуроновая кислота Систематический обзор Включено 5 мета-анализов Низко и высоко молекулярная ГК обладают равными результатами Все препарата ГК эффективно влияют на симптомы ОА коленных суставов: уменьшают боль, припухлость и скованность Однако размер эффекта небольшой Ни один препарат не имеет преимущества над другим Трудно проводить сравнительные исследования Divine JG et al. Clin Orthop Relat Res, 2007;455:
30 ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ Эндопротезиро- вание суставов Артроскопические манипуляци Остеотомия Выраженный болевой синдром, не поддающийся консервативному лечению Наличие остеонекроза Наличие серьезного нарушения функций сустава ОА коленных суставов, резистентный к консервативному лечению и внутрисуставному введению ГК
31 Хрящс/х костьСин.мембр Ингибиция катаболизма Ингибиторы костной резорбции Цитокины и IL-1S ингибиторы: Ингибиторы ММП и ADAMTS Бисфосфонаты, Стронция ранелат, Кальцитонин ICE ингибиторы, агонисты PPAR и др. Ингибитор iNOS Ингибиторы ММП 13 и катепсина К Комбин. ингибитор эйкосаноидов (5-LOX и COX) OPG и ингибиторы RANKL Стимуляция анаболизма Стимуляция костеобразования Факторы роста: TGF-S, BMPs, FGF PTH, SERM и др. Перспективы модификации остеоартроза
Ключевые слова: остеоартроз коленных суставов, хроническая суставная боль, нейропатический компонент боли, прегабалин, ацеклофенак.
Для цитирования: Филатова Е.С., Туровская Е.Ф., Алексеева Л.И. Применение антиконвульсанта прегабалина в практике ревматолога: терапия остеоартроза коленных суставов // РМЖ. 2017. №25. С. 1893-1897
Scientific Research Institute of Rheumatology named after V.A. Nasonova, Moscow
The main manifestation of osteoarthritis (OA) of the knee joints is chronic pain syndrome. It reduces the quality of life of patients, forcing them to seek treatment.
Aim: To evaluate the efficacy of pregabalin in patients with knee osteoarthritis.
Patients and Methods: 60 patients with OA of knee joints with a neuropathic pain component (DN4> 4) were included in the study. The patients are divided by the random numbers method into two groups: 1-st group – received therapy with aceclofenac; 2nd group — received aceclofenac + pregabalin for 5 weeks. All the patients included in the study had clinical and neurological examination with assessment of WOMAC functional index, pain intensity at movement, the diagnosis of neuropathic pain (NP) (by questionnaire DN4 and Pain DETECT), pain intensity according to the VAS at rest.
Results: the patients of group 1 had a more severe and prolonged course of the disease, a more pronounced neuropathic component of the pain syndrome (NCPS), however, radiologic changes in the joints, pain intensity according to the VAS (both at rest and at movement), quality of life, the severity of anxiety and depression on the hospital scale were the same in both groups. The study showed a positive dynamics in both groups regarding the NCPS, but complex therapy with the use of a drug from the group of anticonvulsants (pregabalin) showed a more significant positive effect not only in relation to NCPS, but also with respect to functional activity (according to WOMAC) and the severity of pain according to the VAS.
Conclusion: patients with OA of knee joints should be examined before beginning the therapy for central sensitization using questionnaires of neuropathic pain (DN4). Complex therapy with anticonvulsants in patients with OA of knee joints with signs of NP allows not only to effectively reduce the severity of the pain syndrome, but also to improve the functional activity of patients, and therefore, the quality of life.
Key words: osteoarthritis of knee joints, chronic articular pain, neuropathic pain component, pregabalin, aceclofenac.
For citation: Filatova E.S., Turovskaya E.F., Alekseeva L.I. The use of anticonvulsant pregabalin in rheumatologist practice: therapy of knee osteoarthritis // RMJ. 2017. № 25. P. 1893–1897.
Представлены результаты исследования эффективности прегабалина у пациентов с остеоартрозом коленных суставов. Показано, что комплексная терапия с применением антиконвульсанта позволяет не только эффективно уменьшить выраженность болевого синдрома, но и улучшить функциональную активность пациентов.
Основным проявлением остеоартроза коленных суставов является хронический болевой синдром. Именно он снижает качество жизни пациентов, заставляет обращаться за медицинской помощью. Согласно исследованию, проведенному ВОЗ, скелетно-мышечные боли, которые наблюдаются и при ОА, входят в первую десятку более чем 300 заболеваний с наибольшим количеством лет жизни, потерянных вследствие заболевания [1].
Давно отмечено, что большинство средств, которые хорошо действуют при лечении острой боли, неэффективны или недостаточно эффективны при хронической. Хроническая боль отличается от острой не только своей длительностью, но и патогенезом, клиническими проявлениями, лечением и прогнозом [2]. Если острая боль имеет сигнальное значение, то хроническая боль утрачивает это значение и переходит в иную категорию. Она как бы отрывается от конкретных местных патологических процессов и начинает существовать по своим закономерностям. В генезе хронической боли большую роль играют психосоциальные и когнитивно-поведенческие аспекты. Если острая боль рассматривается как симптом, то хроническая боль приобретает черты самостоятельной болезни, которая проявляется не только болью, но и вегетативными, эмоциональными и другими психическими нарушениями, формированием неадаптивного болевого поведения.
Согласно современным представлениям патогенез хронической боли ‒ это сложная многоуровневая система, в которой участвуют механизмы периферической сенситизации, обусловленные активацией болевых рецепторов на периферии за счет воспаления. При продолжающейся периферической сенситизации включаются центральные механизмы: центральные болевые нейроны становятся гипервозбудимыми, снижается порог их активации, они начинают воспринимать неболевые стимулы как боль (аллодиния), сами генерировать болевые импульсы (вторичная гипералгезия) ‒ это явление называют центральной сенситизацией (ЦС). Также снижается активность антиноцицептивных систем, чему способствует как ЦС, так и многочисленные психосоциальные факторы (тревога, страх, неверные копинг-стратегии и др.).
Источники боли при ОА коленных суставов хорошо изучены ревматологами: ими являются структурные и биохимические изменения, возникающие в кости, синовии, периартикулярных тканях, мышцах. Сам хрящ ‒ это аваскулярная и неиннервируемая ткань, не являющаяся источником боли. При ОА источники боли представлены нехрящевыми структурами сустава, включающими синовиальную оболочку, кость и периартикулярные ткани [3].
Воспалительные стимулы инициируют каскад биохимических событий: выделение SP, брадикинина, фактора некроза опухоли α, интерлейкинов, хемокинов, фактора роста нервов, симпатических аминов, лейкотриенов простагландинов и др. Этот воспалительный процесс индуцирует гипералгезию периферических ноцицепторов. Сопровождающий воспалительные изменения ангиогенез стимулирует прорастание новых сенсорных волокон в ткани поврежденного сустава и может способствовать хронизации боли даже после стихания воспаления [4]. Итак, механизмы периферической сенситизации при ОА хорошо изучены и известны.
Однако хроническая боль – это прежде всего заболевание ЦНС: в ее патогенезе участвуют такие центральные механизмы, как ЦС и снижение активности нисходящих антиноцицептивных систем или дезингибиция.
Процессы, происходящие в ЦНС при ОА, в настоящий момент менее известны. Однако имеющиеся данные проясняют роль центральных механизмов. Прежде всего, изучение хронического болевого синдрома при ОА выявило ряд противоречий: отсутствуют корреляции между степенью структурных изменений в области пораженного сустава и интенсивностью боли; у 40% пациентов, имеющих изменения в суставах и окружающих тканях, боль вовсе отсутствует [5], а до 44% пациентов после адекватно выполненного эндопротезирования коленного сустава продолжают испытывать боль [6].
На сегодняшний момент проведены исследования, которые показали, что около трети пациентов с ОА коленного сустава имеют качественные характеристики нейропатической боли: онемение, жжение, аллодинию, прострелы, сравнимые с ударом тока, и др. [7‒9].
Особенности хронического болевого синдрома при ОА коленных суставов, возможно объяснить наличием выраженной ЦС у ряда пациентов. При прогрессировании заболевания происходит изменение процессов контроля и модуляции боли, которое приводит к возникновению ряда сенсорных проявлений, ассоциирующихся с типичной нейропатией: локальной и отраженной гипералгезии, аллодинии, дизестезии и гипестезии. Каскад механизмов воспаления усиливает активность периферических ноцицепторов, это явление носит название периферической сенситизации. Длительно существуя, она приводит к спонтанной активности центральных ноцицпетивных нейронов и дезингибиции, т. е. ЦС и хронизации процесса [10]. Функциональная МРТ головного мозга показала, что множество областей в головном мозге участвуют в патогенезе хронической боли при ОА: ствол мозга, передняя поясная зона, правая дорзолатеральная префронтальная кора, левая средняя фронтальная извилина и левая латеральная затылочная область [11]. Следовательно, сенситизация центральных ноцицептивных нейронов может быть причиной разницы между степенью повреждения сустава и клинической интенсивностью боли.
Для терапии хронической боли при ОА наиболее часто используют нестероидные противовоспалительные препараты (НПВП), однако от 27% до 61% пациентов продолжают испытывать хроническую боль и не удовлетворены лечением [12].
Согласно современным рекомендациям лечения хронической боли, при наличии нейропатической боли или в тех случаях, когда имеются качественные характеристики нейропатической боли, рекомендовано применение препаратов центрального действия, а именно прегабалина из группы антиконвульсантов.
Цель исследования: оценить эффективность прегабалина в терапии хронического болевого синдрома у больных ОА коленных суставов.
В исследовании приняли участие 60 пациенток с ОА коленных суставов, жительницы Москвы и Московской области, они были разделены на две группы. Средний возраст их составил 59,82±4,46 года (от 49 лет до 65 лет). Клиническое неврологическое исследование не выявило поражения периферической соматосенсорной нервной системы и центральных ее отделов, способного объяснить появление нейропатических болевых феноменов. Клинические особенности пациенток и исходные данные в обеих группах представлены в таблице 1.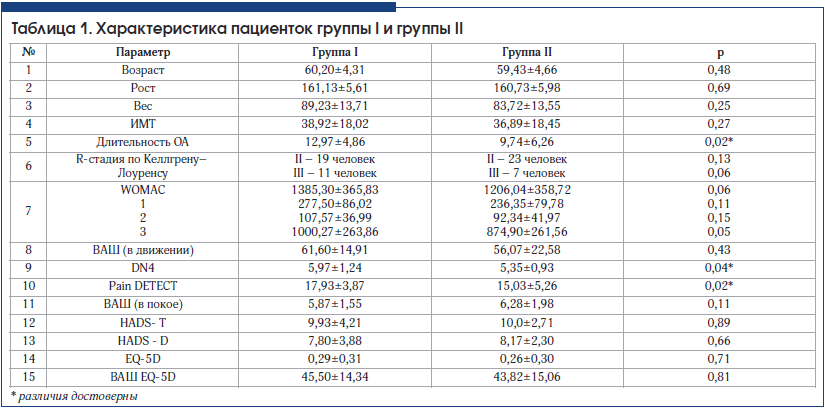
Критерии включения в исследование:
• первичный ОА коленных суставов согласно критериям АРА;
• женщины возраста 45‒65 лет;
• жительницы Москвы и Московской области;
• боль нейропатического характера по опроснику DN4;
• подписанное информированное согласие.
Критерии исключения:
• наличие сопутствующих заболеваний, сопровождающихся хроническим болевым синдромом, не связанным с ОА (корешковый синдром, диабетическая или алкогольная полинейропатия и др.);
• наличие психических заболеваний, затрудняющих адекватную оценку болевого синдрома, эмоционального состояния и заполнение опросников;
• пациенты, имеющие противопоказания к назначению прегабалина;
• хондропротективная терапия, принимаемая пациентом не менее чем за 3 мес. до начала исследования;
• неподписание информированного согласия.
После обследования и подписания информированного согласия все пациентки были разделены на две группы по 30 человек. Группы были сформированы на основании порядкового номера: нечетные номера образовали группу I, четные – группу II. Группа I получала терапию НПВП ацеклофенак (100 мг 2 р./сут – 42 дня) + прегабалин (75 мг 2 р./сут ‒ 14 дней, 150 мг 2 р./сут – 28 день), группа II получала только монотерапию НПВП ацеклофенаком (100 мг 2 р/сут ‒ 42 дня).
Дизайн исследования включал три визита: визит 1 (включение в исследование, клинико-неврологическое обследование, функциональный индекс WOMAC, оценка интенсивности боли при движении, диагностика нейропатической боли (опросник DN4 и Pain DETECT), оценка эмоционально-аффективной сферы (опросник HADS), оценка интенсивности боли по ВАШ в покое, оценка качества жизни (опросник EQ-5D), визит 2 на 14-й день (функциональный индекс WOMAC, оценка интенсивности боли в движении), визит 3 на 42-й день (аналогичный визиту 1).
При назначении терапии хронического болевого синдрома следует учитывать его механизмы. Так, при ОА коленных суставов ноцицептивный механизм является очевидным и обусловлен воспалительным и дегенеративным процессом в области пораженного сустава. В недавно проведенном исследовании Е.Ф. Туровской было показано, что нейропатические черты при отсутствии каких-либо признаков поражения нервной системы были обнаружены у 37% пациентов [13]. Эти данные подтверждаются также рядом зарубежных исследований.
Показана эффективность дулоксетина у 30% пациентов с ОА коленных суставов по сравнению с плацебо [14], подтверждена роль супраспинальных механизмов в патогенезе хронической боли при ОА коленных суставов с помощью функциональной МРТ [11]. Суммируя эти данные, можно полагать, что в ряде случаев боль при ОА коленных суставов носит смешанный характер: ноцицептивный и дисфункциональный и основным механизмом, поддерживающим в этих случаях боль в хроническом состоянии, является ЦС. Нейропатические черты и недостаточную эффективность НПВП можно объяснить именно ЦС как ведущим механизмом.
Направленная терапия является залогом успеха подавления хронической боли. В связи с этим нами было проведено исследование эффективности комбинированной терапии (ацеклофенак + прегабалин) и монотерапии (ацеклофенак), направленных на оба механизма ‒ ноцицептивный и дисфункциональный. Отбор пациенток осуществляли с помощью опросника нейропатическй боли DN4. Этот опросник выявляет клинические характеристики нейропатической боли у пациентов с ОА коленных суставов, однако неврологический осмотр не выявлил признаков поражения нервной системы, поэтому эти характеристики были расценены в качестве признаков ЦС как ведущего механизма. Проведенное исследование показало, что комбинированная терапия, в состав которой входил НПВП (ацеклофенак) и антиконвульсант (прегабалин), была более эффективной при наличии признаков ЦС у пациентов с ОА коленных суставов и действовала более длительно – на протяжении всего курса (42 дня) терапии.
Таким образом, проведенное исследование позволяет сформулировать следующие практически рекомендации для более эффективного лечения ОА коленных суставов:
• пациентов с ОА коленных суставов необходимо до начала терапии обследовать на наличие выраженной ЦС с помощью опросников нейропатической боли (DN4);
• при оценке >4 баллов по опроснику DN4 целесообразно назначение комбинированной терапии, включающей НПВП и прегабалин в дозе 150–300 мг/сут для более эффективного контроля боли.
Полный текст:
- Аннотация
- Об авторах
- Литература
- Cited By
1. Cunningham LS, Kelsey JL. Epidemiology of musculoskeletal impairments and associated disability. Am J Public Health. 1984 Jun; 74(6):574-9. 2. Branco JC, Rodrigues AM, Gouveia N, et al. Prevalence of rheumatic and musculoskeletal diseases and their impact on healthrelated quality of life, physical function and mental health in Portugal: results from EpiReumaPt – a national health survey. RMD Open. 2016 Jan 19;2(1):e000166. doi: 10.1136/rmdopen-2015-000166.
2. Grotle M, Hagen KB, Natvig B, et al. Рrevalence and burden of osteoarthritis: results from a population survey in Norway. J Rheumatol. 2008 Apr;35(4):677-84. Epub 2008 Feb 15.
3. Wallace IJ, Worthington S, Felson DT, et al. Knee osteoarthritis has doubled in prevalence since the mid-20th century. Proc Natl Acad Sci U S A. 2017 Aug 29;114(35): 9332-9336. doi: 10.1073/pnas.1703856114. Epub 2017 Aug 14.
4. Балабанова РМ, Эрдес ШФ. Динамика распространенности ревматических заболеваний, входящих в XIII класс МКБ-10, в популяции взрослого населения Российской Федерации за 2000-2010 гг. Научно-практическая ревматология. 2012;50(3): 10-2. doi: 10.14412/1995-4484- 2012-702
5. Галушко ЕА, Большакова ТВ, Виноградова ИБ и др. Структура ревматических заболеваний среди взрослого населения России по данным эпидемиологического исследования (предварительные результаты). Научно-практическая ревматология. 2009;47(1):11–7. doi: 10.14412/1995-4484-2009-136
6. Comas M, Sala M, Romаn R, et al. Impact of the distinct diagnostic criteria used in population-based studies on estimation of the prevalence of knee osteoarthritis. Gac Sanit. 2010 Jan-Feb;24(1):28-32. doi: 10.1016/j.gaceta. 2009.06.002. Epub 2009 Sep 11.
7. Kim C, Linsenmeyer KD, Vlad SC, et al. Prevalence of radiographic and symptomatic hip osteoarthritis in an urban United States community: the Framingham osteoarthritis study. Arthritis Rheumatol. 2014 Nov; 66(11): 3013-7. doi: 10.1002/art.38795.
8. Zhang Y, Niu J, Kelly-Hayes M, Chaisson CE, et al. Prevalence of symptomatic hand osteoarthritis and its impact on functional status among elderly: the Framingham Study. Am J Epidemiol. 2002 Dec 1;156(11):1021-7.
9. Bijlsma J, Berenbaum F, Lafeber P. Osteoarthritis: an update with relevance for clinical practice. Lancet. 2011;377(9783): 2115-26. doi:10.1016/S0140-6736(11)60243-2.
10. Кашеварова НГ, Алексеева ЛИ, Аникин СГ и др. Остеоартроз коленных суставов: факторы риска прогрессирования заболевания суставов при пятилетнем проспективном заболевании. Материалы III Евразийского конгресса ревматологов, (Минск, Республика Беларусь, 26-27 мая 2016 г.). Вопросы организации и информатизации здравоохранения. 2016; Прил:144-9.
11. Alekseeva LI, Anikin SG, Kashevarova NG, et al. Risk factors predicting radiological progression of knee osteoarthrosis. Ann Rheum Dis. 2018;77(Suppl):A797. doi: 10.1136/annrheumdis-2018-eular.2089
12. French HP, Smart KM, Doyle F. Prevalence of neuropathic pain in knee or hip osteoarthritis: a systematic review and metaanalysis. Semin Arthritis Rheum. 2017 Aug; 47(1):1-8. doi: 10.1016/j.semarthrit.2017. 02.008.
13. Kellgren JH, Lawrence JS. Radiological assessment of osteoarthrosis. Ann Rheum Dis. 1957 Dec;16(4):494-502.
14. Смирнов АВ. Рентгенологическая диагностика изменений в тазобедренном суставе при ревматических заболеваниях. Consilium Medicum. 2003;5(8):442-6.
15. Charles HC, Kraus VB, Ainslie M, Hellio Le Graverand-Gastineau MP. Editorial Optimization of the fixed-flexion knee radiograph. Osteoarthritis Cartilage. 2007 Nov;15(11):1221-4. Epub 2007 Oct 31.
16. Смирнов АВ. Атлас рентгенологической диагностики первичного остеоартроза. Москва: ИМА-ПРЕСС; 2010. 21 с.
17. Altman R, Asch E, Bloch D, et al. Development of criteria for the classification and reporting of osteoarthritis. Classification of osteoarthritis of the knee. Diagnostic and Therapeutic Criteria Committee of the American Rheumatism Association. Arthritis Rheum. 1986 Aug;29(8):1039-49.
18. Муравьев ЮВ. Диагностические и классификационные критерии в ревматологии: когда их применять и чем они различаются? Научно-практическая ревматология. 2017;55(1):8-11. doi: 10.14412/1995-4484-2017-8-11
19. Zhang W, Doherty M, Peat G, et al. EULAR evidence-based recommendations for the diagnosis of knee osteoarthritis. Ann Rheum Dis. 2010 Mar;69(3):483-9. doi: 10.1136/ard.2009.113100.
20. Altman R, Alarcn G, Appelrouth D, et al. The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hand. Arthritis Rheum. 1990 Nov;33(11):1601-10.
21. Zhang W, Doherty M, Leeb BF, et al. EULAR evidence-based recommendations for the diagnosis of hand osteoarthritis: report of a task force of ESCISIT. Ann Rheum Dis. 2009 Jan;68(1):8-17. doi: 10.1136/ard.2007. 084772. Epub 2008 Feb 4.
22. Altman R, Alarcon G, Appelrouth D, et al. The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hip. Arthritis Rheum. 1991 May;34(5):505-14.
23. Алексеева ЛИ, Аникин СГ, Шарапова ЕП и др. Исследование эффективности, переносимости и безопасности препарата Хондрогард у пациентов с остеоартрозом. Русский медицинский журнал. 2013;(32):1624-7.
24. Шарапова ЕП, Алексеева ЛИ, Кашеварова НГ и др. Оценка эффективности, переносимости и безопасности хондрогарда у больных остеоартрозом коленных суставов и коморбидностью. Научно-практическая ревматология. 2017;55(Прил 1): 138.
25. Алексеева ЛИ, Шарапова ЕП, Кашеварова НГ и др. Сравнительное исследование эффективности и безопасности препарата Хондрогард® при комбинированном (внутрисуставное и внутримышечное) и внутримышечном введении у пациентов с остеоартритом коленных суставов. Современная ревматология. 2018;12(2):44–49. doi: 10.14412/1996-7012-2018-2-44-49
26. Каратеев АЕ, Насонов ЕЛ, Ивашкин ВТ и др. Рациональное использование нестероидных противовоспалительных препаратов. Клинические рекомендации. Научно-практическая ревматология. 2018;56(Прил 1):1-29. doi: doi.org/10.14412/rjtao20180
27. Derry S, Conaghan P, Da Silva J, et al. Topical NSAIDs for chronic musculoskeletal pain in adults. Cochrane Database Syst Rev. 2016 Apr 22;4:CD007400. doi: 10.1002/ 14651858.CD007400.pub3.
28. Derry S, Wiffen PJ, Kalso EA, et al. Topical analgesics for acute and chronic pain in adults – an overview of Cochrane Reviews. Cochrane Database Syst Rev. 2017 May 12;5:CD008609. doi: 10.1002/14651858. CD008609.pub2.
29. Jü ni P, Hari R, Rutjes AW, et al. Intraarticular corticosteroid for knee osteoarthritis. Cochrane Database Syst Rev. 2015 Oct 22;(10): CD005328. doi: 10.1002/14651858. CD005328.pub3.
30. He WW, Kuang MJ, Zhao J, et al. Efficacy and safety of intraarticular hyaluronic acid and corticosteroid for knee osteoarthritis: A meta-analysis. Int J Surg. 2017 Mar; 39:95-103. doi: 10.1016/j.ijsu.2017.01.087.
31. De Girolamo L, Kon E, Filardo G, et al. Regenerative approaches for the treatment of early OA. Knee Surg Sports Traumatol Arthrosc. 2016 Jun;24(6):1826-35. doi: 10.1007/s00167-016-4125-y. Epub 2016 Apr 27.
32. Filardo G, Kon E, Longo UG, et al. Non-surgical treatments for the management of early osteoarthritis. Knee Surg Sports Traumatol Arthrosc. 2016 Jun;24(6):1775-85. doi: 10.1007/s00167-016-4089-y. Epub 2016 Apr 4.
33. Uchio Y, Enomoto H, Alev L, et al. A randomized, double-blind, placebo-controlled Phase III trial of duloxetine in Japanese patientswith knee pain due to osteoarthritis. J Pain Res. 2018 Apr 18;11: 809-821. doi: 10.2147/JPR.S164128. eCollection 2018.
34. Филатова ЕС, Туровская ЕФ, Алексеева ЛИ. Комплексная терапия хронического болевого синдрома у пациентов с остеоартритом коленных суставов. Эффективная фармакотерапия. 2018;(19):18-25.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


