Что такое отравление катализаторов
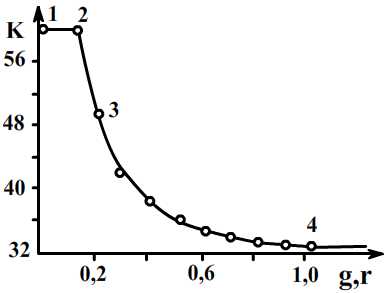
Зависимость константы скорости окисления SO2 на ванадиевом катализаторе от количества поданного мышьяка g.
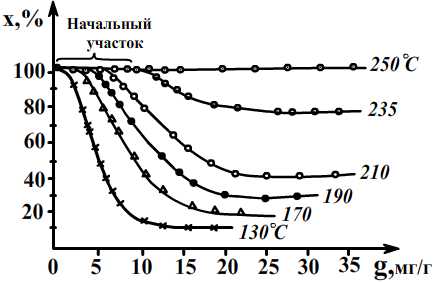
Изменение степени превращения H2S от количества его (g), поданного на палладиевый катализатор, и температуры.
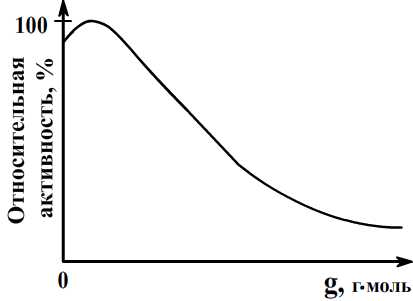
Влияние аниона AS03 3- (g) на активность платинового катализатора в процессе гидрирования коричной кислоты.
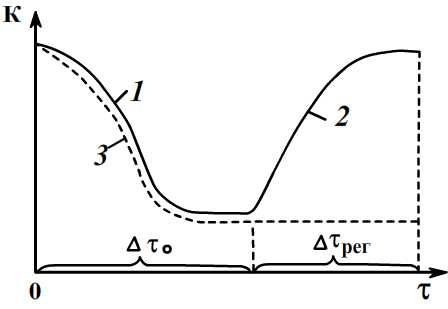
Изменение константы скорости реакции во времени: 1- при обратимом отравлении; 2-при восстановлении активности (поступает без яда); 3 – при необратимом отравлении; Δτ0 -период отравления; ΔτРЕГ -период регенерации активности.
Если потенциально ядовитый элемент находится в состоянии, при котором невозможно образование им связей с катализатором (экранирован от катализатороа), то такие соединения не ядовиты. Такой факт может быть в случаях, когда токсичный элемент обладает полностью поделенным электронным октетом, его валентные связи полностью насыщены. Если же элемент содержит неподеленные внешние электронные пары или неиспользованные валентные орбиты, то он может образовывать поверхностные соединения с катализатором. Так, при каталитическом гидрировании на Ni, Pt или Pd токсичны фосфин (РН3), сульфит-ион (SO3 -2 ), органический сульфид. Известно, что в гомеополярных (атомных) молекулах сущность ковалентной связи заключается в том, что соединяющиеся атомы восполняют свои наружные электронные слои до 8 электронов (устанавливается состояние, приближающееся к оболочке инертных газов) путем образования общих пар. Два электрона, общих для двух атомов, называют поделенной электронной парой.
Отравление полупроводниковых катализаторов.
Добавление к бензолу обработанного серой хинолина или бромтиофена позволяет остановить реакцию на стадии альдегида (C6H5CHO).
Селективность Ni и Pt катализаторов в реакции неполного гидрирования тройных связей усиливается в результате дезактивации небольшими добавками ряда веществ или их ионов (солей): Ag, Cu, Cd, Hg, Al, Sn, Pb, Th, As, Sb, Bi, S, Se, Te.
Внешним признаком процесса спекания кристаллического пористого, в частности дисперсного, тела служит уменьшение его внешних размеров, соответственно и уменьшение пористости и увеличение плотности. Сущность явления заключается в самопроизвольном заполнении веществом, в результате повышения подвижности элементов его решетки при достаточно высоких температурах, свободного пространства внутри зерен и между ними. При этом уменьшается площадь поверхности гранул и возрастает поверхность контакта между ними. Движущей силой процесса спекания является уменьшение термодинамического потенциала системы за счет уменьшения поверхности и снятия искажений и напряжений в кристаллической решетке. Снижение поверхности в процессе спекания уменьшает поверхностную и, следовательно, полную энергию системы. Удельная поверхность пор обратно пропорциональна квадрату ее радиуса, поэтому при наличии в теле пор разного размера движущая сила процесса зарастания мелких пор больше, чем крупных. При этом возможно уменьшение объема мелких пор и их количества за счет увеличения объема крупных пор, поскольку это приводит к уменьшению термодинамического потенциала.
По Френкелю процесс спекания состоит из двух этапов: 1) первый - протекает с постоянной скоростью и зависит лишь от поверхностного натяжения (s), вязкости (m) и характера среды, окружающей пору:
dr/dt = 3/4×s/m, где r – радиус поры; t - время.
Время полного зарастания поры: t =4/3×m× r0/s, где r0 – первоначальный радиус поры.
Однако эта теория не учитывает: 1) разнообразие гранулометрического состава; 2) наличие пор разных размеров; 3) различие в вязком течении кристаллических и жидких тел.
Пинес показал, что скорость изменения радиуса поры в процессе спекания может быть выражена уравнением:
dr/dt = - (2×s/r 2 ) × [d 3 ×D/(k×T)], где d- постоянная кристаллической решетки; D – коэффициент диффузии; k - постоянная Больцмана; Т-температура. По этому уравнению значение скорости примерно в (d 1,5 /r) 2 меньше, чем по уравнению Френкеля. Если по Френкелю со временем линейно меняется радиус поры, то по Пинесу – линейно изменяется объем пор.
V=4/3×p×r 3 , dV= K×dt, 4/3×p×3×dr 2 = K×dt
По Пинесу: r 2 ×dr = -2×s ×d 3 ×D/(k×T) × dt
Зарастание пор может привести к уменьшению их количества в единице объема материала и к соответствующему замедлению процесса спекания в целом. Скорость спекания значительно уменьшается при интенсивном росте зерен.
Отравление - катализатор
Отравление катализаторов вызывается специфическим действием некоторых веществ, малые количества которых ( следы) случайно попадают в реакционную смесь и с ней - на поверхность катализатора. [31]
Отравление катализатора вызывается примесями, содержащимися в ацетилене. Закупоривание пор носителя катализатора образующимися полимерами влияет на работу катализатора. Экстрагирование, например, бензолом или обработка щелочью и кислотой оживляет катализатор и возвращает ему почти полную активность ( 97 % первоначальной), однако такое оживление катализатора возможно не более трех раз. Срок службы катализатора может быть увеличен, если вести реакцию при ступенчатом подъеме температуры. [32]
Отравление катализатора микрометаллами может быть двух типов: а) отравление тяжелыми металлами, не оказывающее влияния на кислотность катализатора, но приводящее к протеканию наряду с нормальными реакциями крекинга реакций дегидрирования и коксообразования, и б) отравление натрием, при котором металл вступает в структуру алюмосиликата, замещая кислотный протон и тем самым уменьшая возможность протонного обмена между катализатором и карбоний-ионом. [33]
Отравление катализатора ядом может быть обратимым и необратимым. При обратимом отравлении катализатор быстро восстанавливает свою первоначальную активность после удаления яда из реакционной смеси. Такой яд является сильно ингибирующим компонентом, находящимся в равновесии с катализатором и реакционной смесью. При необратимом отравлении активность катализатора после удаления яда из смеси не восстанавливается. Чтобы восстановить активность отравленного таким ядом катализатора, необходима жесткая обработка, часто разрушающая структуру катализатора. [34]
Отравление катализатора - это частичная или полная потеря активности в результате действия небольшого количества веществ, называемых контактными ядами. Потеря активности происходит вследствие частичного или полного выключения активной поверхности катализатора. Механизм отравления специфичен для данного яда и катализатора и многообразен. Оно наступает в результате химического взаимодействия яда с катализатором с образованием каталитически неактивного-соединение, активированной адсорбции яда на активных центрах катализатора, кристаллизации яда или его производного на поверхности катализатора. [36]
Отравление катализатора сернистыми соединениями в значительной степени обратимо. При температурах выше 700 С активность катализатора после перехода на работу с очищенным газом восстанавливается. Однако регенерированный катализатор стано вится более чувствительным к соединениям серы, чем свежий. [37]
Отравление катализатора принято считать обратимым, если каталитическая активность восстанавливается в результате обработки поверхности реагентом, способным к устранению причин дезактивации. При необратимом отравлении катализатора требуется его замена. [38]
Отравление катализатора углеводородами возможно при значительно большем содержании их в газе, чем СО и С02, вызывающих резкое падение активности железных катализаторов. Причиной отравления их углеводородами является разложение последних до углерода в условиях процесса синтеза аммиака. Выделившийся углерод отлагается в порах зерен катализатора, закрывая его поверхность для реагирующих газов. [39]
Отравление катализатора вызвано тем, что некоторые вещества легко им адсорбируются; молекулы яда займут все выступы на поверхности катализатора и тем самым лишат молекулы возможности быть адсорбированными. [40]
Отравление катализатора , как известно, бывает временным и постоянным. Такие вещества, как кислород, окись углерода, углекислый газ и пары воды вызывают временное отравление катализатора. Последний под действием этих веществ теряет свою активность и вновь восстанавливает ее при пропускании чистой азотоводородной смеси, не содержащей указанных веществ. Постоянное отравление катализатора является необратимым. Оно наступает при действии мышьяка, фосфора и соединений серы. [41]
Отравление катализаторов является по преимуществу избирательным адсорбционным эффектом, зависящим от образования необычных сильных адсорбционных связей между катализатором и некоторыми типами адсорбированных веществ; последние обычно, хотя и не всегда, являются посторонними для катализируемой реакционной системы. Как это более подробно показано гз дальнейшем, в большинстве случаев оказывается, что адсорбционная связь, посредством которой яд удерживается на катализаторе, весьма специфична, а химическая природа образования таких связей зависит частично от определенных типов электронной конфигурации и в катализаторе и в яде. Хотя токсичность, конечно, является понятием относительным, на практике как яды рассматриваются только те вещества, которые заметно ослабляют катализ даже тогда, когда присутствуют в очень малых концентрациях. Вышеупомянутое понятие отравления не включает механического покрытия поверхности катализатора во время течения органических реакций при высоких температурах менее специфично удерживаемыми слоями, например слоем смол или вос-ков или налетом углерода. [42]
Отравление катализаторов металлами или производными металлов в случае никелевых контактов исследовано в меньшей степени, чем в случае платиновых. Одна из ранних работ в этой области принадлежит Уэно [27], который изучал токсичность мыл, образуемых рядом металлов, по отношению к никелевому катализатору гидрирования. Он нашел, что мыла тяжелых металлов - цинка, кадмия, свинца, ртути, висмута и олова - токсичны; однако такие вещества, как мыла, обычно находящиеся в коллоидном состоянии или s виде несовершенных растворов, могут, весьма вероятно, отравлять контакт не только вследствие сильной специфической адсорбции, но и вследствие обволакивания поверхности, так что список токсичных и нетоксичных мыл, составленный Уэно, возможно, следует пересмотреть с этой точки зрения. Это в особенности касается мыл щелочных металлов, магния и бария, которые, как установлено, могут снижать активность катализаторов. [43]
Отравление катализаторов свинцом при дожигании отработавших газов автомобилей описано в разд. [44]
Отравление катализатора углеводородами возможно при значительно большем содержании их в газе, чем количества СО и О2, вызывающие резкое падение активности железных катализаторов. Причиной отравления их углеводородами является разложение последних до углерода в условиях процесса синтеза аммиака. Выделившийся углерод отлагается в порах зерен катализатора, закрывая его поверхность для реагирующих газов. [45]
Часто введение очень небольшого количества (долей процента) какой-либо посторонней добавки к основному катализатору приводит либо к резкому повышению его активности, либо, наоборот, к снижению активности на несколько порядков. В первом случае говорят о промотировании, во втором – об отравлении.
Механизм промотирования твердых катализаторов может быть различным. Добавки могут вступать с основным катализатором в химическое взаимодействие, образуя на поверхности продукты, обладающие более высокой каталитической активностью. Они могут изменять условия взаимодействия с реагентами в местах контакта основного компонента и промотора, а также увеличивать дисперсность или стабилизировать пористую и кристаллическую структуру катализатора и т.п.
Например, каталитическая активность V2O5 по отношению к реакции окисления диоксида серы повышается в сотни раз при добавлении небольших количеств сульфатов щелочных металлов; введение 2-3 % А12О3 в катализатор синтеза аммиака (пористое железо) позволяет создать стабильную геометрическую структуру, не меняющуюся под воздействием реакционной среды в течение длительного времени.
Практическому использованию каталитических процессов часто препятствует снижение активности катализатора при воздействии на него веществ, называемых каталитическими ядами. Это объясняется в соответствии с теорией активных центров, согласно которой каталитическую активность проявляет не вся поверхность катализатора, а лишь некоторые ее участки, обладающие определенным энергетическим и геометрическим соответствием реагирующим молекулам – активные центры. Каталитические яды блокируют эти активные центры, образуя с ними поверхностные химические соединения.
Отравление бывает обратимым и необратимым. При обратимом отравлении активность катализатора постепенно восстанавливается, если в реакционной смеси больше не содержится каталитического яда. При необратимом отравлении действием свежей реакционной смеси активность восстановить не удается. Одно и то же вещество может вызвать как обратимое, так и необратимое отравление в зависимости от продолжительности его действия, концентрации в реакционной смеси, температуры процесса. С целью удлинения срока службы промышленных катализаторов в технологических схемах предусматривают тщательную очистку реагирующих веществ от примесей, являющихся каталитическими ядами.
Часто ядами выступают соединения серы, сероводород, диоксид серы, мышьяк.
Для железного катализатора синтеза аммиака каталитическими ядами являются кислород и кислородосодержащие соединения (СО, СО2, Н2О). При содержании
1∙10 –2 % СО в газовой смеси, поступающей на катализатор, работающий при давлении 30 МПа и температуре 450°С, через 6 сут. активность катализатора уменьшается на 25 %. Его активность можно полностью восстановить за 1 сут. работы с чистым газом. При содержании 5∙10 –2 % СО в исходном газе через 3 сут. активность катализатора падает на 67 %, а через 4 сут. работы на чистом газе полностью восстанавливается. При температуре 500°С и содержании 5∙10 –3 % О2 концентрация в газе на выходе падает на 4 % и применение чистого газа уже не восстанавливает прежнюю активность катализатора.
В ряде случаев катализатор отравляется побочными продуктами реакции. Так, в реакциях органических соединений (крекинга, дегидрирования, изомеризации) отравление катализаторов часто происходит в результате образования высокоуглеродистых полимерных соединений – так называемого кокса, покрывающего поверхность катализатора. Для его удаления цикл каталитической реакции сменяют циклом регенерации – катализатор продувают при высокой температуре около 500-700 о С воздухом для выжига кокса (перевода в СО2).
4. Основные стадии гетерогенно-каталитических процессов
Гетерогенно-каталитическая реакция на поверхности твердого катализатора - это сложный многостадийный процесс. Наблюдаемая общая скорость каталитической реакции зависит от относительных скоростей нескольких различных по своей физической и химической природе стадий. Основные стадии взаимодействия газообразных реагентов с зерном пористого катализатора показаны на рис. 2.
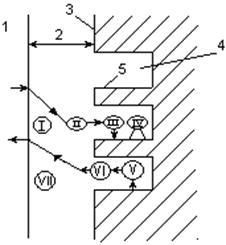
Рисунок 2 – Элементарные стадии гетерогенного катализа в системе Г–Т
Общая скорость гетерогенно-каталитического процесса лимитируется наиболее медленной из перечисленных элементарных стадий. Иногда наиболее медленной стадией оказывается химическое взаимодействие на поверхности катализатора, а иногда – диффузионные процессы. В зависимости от лимитирующей скорость стадии различают каталитические процессы, происходящие в кинетической, внутридиффузионной и внешнедиффузионной области.
В кинетической области (стадии 3-5) протекают, как правило, процессы на малоактивных катализаторах с малыми размерами зерен и крупными порами при турбулентном режиме движения потока реагентов и сравнительно низких температурах. Увеличение скорости каталитических процессов в кинетической области достигается, прежде всего, повышением температуры.
Во внутридиффузионной области (стадии 2 и 6) ускорить процессы можно путем применения катализаторов с меньшим размером зерен и более крупными порами. Однако при увеличении размеров пор резко уменьшается удельная поверхность катализатора. Поэтому надо находить оптимальную структуру катализатора, при которой поры достаточно доступны для участников реакции. Внутридиффузионная область характерна для проведения процессов в стационарном (фильтрующем) слое катализатора.
Во внешнедиффузионной области (стадии 1 и 7) протекают процессы на высокоактивных катализаторах. Для увеличения скорости процесса применяют высокие линейные скорости потока реагентов, создают его турбулизацию путем перемешивания.
Дата добавления: 2018-04-04 ; просмотров: 234 ;
На практике поверхность катализатора быстро становится неактивной вследствие загрязнений, попадающих вместе с газообразными реагирующими веществами. Достаточно очень малого количества некоторых загрязнений, чтобы вывести катализатор из строя. Такие вещества называются каталитическими ядами.
Платиновый катализатор, применяющийся в сернокислотном производстве, очень чувствителен к мышьяку. Даже следы мышьяка, попадая на катализатор, быстро выводят его из строя, как говорят, отравляют. Ядами для катализаторов являются такие элементы, как фосфор, селен, ртуть, сера и другие.
Для синтеза аммиака обычно употребляются железные катализаторы с небольшими добавками различных металлов. Железо при этом берётся очень чистое. Достаточно присутствия в нём 0,01 % серы, чтобы значительно снизить его каталитическую способность. А увеличение содержания серы до 0,1% делает катализатор совершенно непригодным.
Для реакции окисления аммиака (При окислении аммиака образуются окислы азота, растворением которых в воде получают азотную кислоту) применяется платиновый катализатор. Достаточно присутствия в газе 0,0002% фосфористого водорода, чтобы вывести катализатор из строя.
Так же легко отравляются и биокатализаторы. Некоторые яды не только уменьшают их каталитическую способность, но и вовсе прекращают их действие. Для многих ферментов особенно сильным ядом оказывается синильная кислота (HCN). Из металлов, наиболее угнетающе действующих на ферменты, можно назвать серебро, медь и ртуть.
Какова же причина угнетающего действия ядов, и почему достаточно даже небольшого их количества, чтобы нарушить нормальную работу катализатора?
Одна маленькая молекула выводит из строя один активный центр, а одна большая молекула, имеющая длинные и разветвлённые цепочки атомов, может отравить сразу несколько активных центров. Предполагают, что частица яда прилипает к активному центру одним из своих атомов, а оставшаяся свободная часть молекулы ложится на поверхность катализатора и закрывает собой ещё несколько центров. Возможно, атомы цепочек не просто закрывают центры, но и взаимодействуют с ними.
А можно ли активизировать сам катализатор, продлить срок его службы? Можно. Добавление некоторых веществ к катализатору вызывает значительное усиление его активности. Например, в производстве аммиака из водорода и азота, как уже упоминалось, применяется железный катализатор. Но одно металлическое железо — плохой катализатор, так как образование аммиака быстро прекращается. Если же к нему добавить всего несколько процентов соли алюминия, то получается интенсивно и долго работающий катализатор.
Другой пример. Для синтеза газа метана (СН4) из углекислого газа и водорода служит никелевый катализатор. Прибавление к никелю 0,5% окиси металла церия повышает действие катализатора в 10 раз.
Вещества, которые даже в незначительных количествах повышают активность катализаторов, называют промоторами, или активаторами.
В науке уже накопились факты, которые позволяют сделать некоторые предположения о роли промоторов.
При формировании катализатора, например металлического никеля или железа из их соединений, атомы или молекулы промоторов, входя во внутрь кристаликов катализатора или располагаясь на их поверхности, влияют на структуру образующейся поверхности.
Обычно считают, что промоторы скапливаются главным образом на поверхности катализаторов и этим способствуют образованию большого количества активных центров. Было определено, что для чистого железа один активный центр приходится на 2000 атомов железа, а для железа с окисью алюминия — уже только на 200 атомов железа.
Что касается удлинения срока службы катализатора, то здесь, очевидно, дело заключается в следующем. Атомы или молекулы промотора, находясь на поверхности крис-таликов катализатора, мешают их переходу в более крупные кристаллы и тем самым сохраняют активную структуру всей массы катализатора.
В процессе каталитического риформинга используют дорогостоящий платиновый катализатор.

Подготовка и переработка углеводородного сырья - процесс очень сложный в аппаратном и технологическом исполнении, требующий больших интеллектуальных и материальных затрат, а также постоянного контроля и совершенствования.
Значимым пунктом расхода является замена и регенерация катализаторов. В процессе каталитического риформинга используют дорогостоящий платиновый катализатор, главной причиной выхода из строя которого являются отложения кокса и отравление ядами (мышьяк, ртуть, железо, медь, кремний, кобальт, хром). Так откуда же берутся металлы на НПЗ в процессе каталитического риформинга.
Для того чтобы дальнейшее доказательство присутствия металлов нефти имело смысл, рассмотреть опытные образцы катализаторов каталитического риформинга, которые были исследованы при помощи электронного микроскопа на базе Санкт - Петербургского Горного Университета.

Электронное изображение 100мкм
Рис. 1 Исследование спектров катализатора каталитического риформинга (проба 1).
Таблица 1. Результаты исследования спектров катализатора каталитического риформинга


Электронное изображение 80 мкм
Рис. 2 Исследование спектров катализатора каталитического риформинга (проба 2).
Таблица 2. Результаты исследования спектров катализатора каталитического риформинга


Электронное изображение 100 мкм
Рис.3 Исследование спектров катализатора каталитического риформинга (проба 3).
Таблица 3. Результаты исследования спектров катализатора каталитического риформинга

Данные исследования подтверждают наличие металлов в катализаторах риформинга. Для того чтобы разобраться в вопросе как они туда попадают, нужно более подробно рассмотреть химический состав нефти, ее свойства, а также процессы первичной подготовки и дальнейшей переработки углеводородного сырья.
Нефть представляет собой смесь углеводородов, которые содержат кислородные, сернистые и азотистые соединения. Если в нефти преобладают углеводороды метанового ряда ,то она называется метановой; нафтенового ряда - нафтеновой, а при доминировании ароматического ряда - ароматической. По фракционному составу нефти бывают легкие (бензиновые), тяжелые (топливные). А при наличии более 20% масел нефть называется масляной. Товарные качества нефти зависят от содержания парафинов. Чем больше парафина, тем выше температура ее застывания.
По содержанию парафина нефти классифицируются на беспарафинистые (не более 1 %), слабопарафинистые (от 1 до 2 %) и парафинистые (более 2 %). Наличие парафина в нефти усложняет процессы добычи, перекачки и переработки, а также сказывается на конечной стоимости конечных продуктов. [2][4]
В нефти также могут содержаться серные, азотистые и смолистые соединения. Сера может встречаться не только в виде соединений (сульфидов, меркаптанов), но и в свободной форме. При содержании в нефти серы 0,5 % она относится к классу малосернистых, а с большим ее содержание - к сернистым. [2]
В сырой нефти обычно содержится большое количество примесей неорганического происхождения.
В таблице 4 представлены данные о содержании микроэлементов в различных классах нефти.[2]
Таблица 4. Содержание микроэлементов в нефтях.

Более подробно остановимся на металлах, исследованием которым занимаются с прошлого века, но в промышленности данные исследования и разработки нигде не используются. Исследования С. Качеткова подтверждают наличие металлов в нефтях Тимано-Печорской нефтегазовой провинции (ТПП). Т.е. можно сделать вывод, что советские ученые уже в 1959 году заявили и доказали, единичными исследованиями проб нефти, что углеводородное сырье является альтернативным источником добычи металлов.
В рамках систематического изучения металлоносности нефтей ТПП были проведены определения металлов на единой методической основе, а также собраны сведения из литературных и фондовых источников. К настоящему времени определена металлоносность нефтей по 37 месторождениям, в том числе по 50 залежам провинции.
Гидрогеологическая обстановка чреды нахождения наиболее металлоносных нефтей провинции может быть двух типов. Первый связан с зонами гипергенеза, умеренно минерализованными водами в зонах повышенной инфильтрации и в условиях малых глубин - до 1,5 км. Второй - с мигрирующими глубинными пластовыми водами, распространяющимися по зонам тектонических дислокаций с больших глубин. Эти воды, как правило, гидрокарбонатного типа, обогащенные микрокомпонентами. Нефти, связанные с первым типом вод, приурочены к верхней части разреза. В их числе металлонефтяная пермо-карбоновая залежь Усинского месторождения, Лемьюское месторождение и др. Нефти, связанные со вторым типом, распространены на больших глубинах, вплоть до 3,5 км, например, зона Среднемакарихинского месторождения. Тектонически, месторождения металлоносных нефтей, как правило, приурочены к региональным и локальным разломам, зонам разуплотнения, способствующим миграции металлоносных флюидов или нефтяных залежей.
В основе процесса накопления рудных концентраций металлов в нефтях лежат 3 основных фактора:
- Источник металлов, это могут быть как кларковые, так и аномальные содержания в коренных или осадочных горных породах;
- Механизм переноса, от перевода металлов в подвижное состояние до миграции накопителя;
- Коллектора (продуктивные толщи преимущественно пермо-карбонового возраста) и гидрохимическая обстановка, в которых имеет место сорбция металлов на углеводородном геохимическом барьере.
Источниками металлов в нефтях могут являться горные породы с высоким кларковым содержанием металлов. Ими могут быть как осадочные породы чехла, так и кристаллические фундаменты. Примером может служить накопление металлов в нефтях Ярегского месторождения и нефтях Варадей - Адьзвинской структурной зоны. Но могут быть также и гидротермальные металлосодержащие флюиды - яркий пример такого рода источника - Среднемакарихинское месторождение (доказательство на промыслах).[1][3]
Также в нефтях встречаются олефины (непредельные углеводороды), нафтены и ароматические углеводороды. Нафтены впервые были обнаружены и детально изучены (В. В. Марковников и др.) в нефтях Бакинского района, для которых они характерны. Они присутствуют также в других нефтях СССР, например в грозненской. В эмбенских и калужских нефтях (Майкопский район) они находятся в больших количествах.
Металлы прочно уплотняются на поверхности катализатора, блокируя тем самым его действующую активную часть. Даже после регенерации активность катализатора часто не восстанавливается до первоначального уровня из - за того, что основная масса металлов остается в порах.
На установке обессеривания мощностью 7950 м 3 /сут на катализаторе за 1 год может осаждаться 209 т металлов при их содержании в сырье 0,01%; в отработанном катализаторе содержание метллов сставляет 8 - 25%. Поэтому целесообразнее отработанные катализаторы крекинга, гидроочистки использовать в качестве сырья для получения ряда ценных металлов (ванадия, никеля, кобальта, молибдена и др.), чем их восстанавливать или пускать в отвалы. [2]
Таблица 5. Результаты исследования свойств нафтенатов металлов

Исходя из представленных результатов и доказательств можно сделать вывод, что темепература кипения нафтенатов металлов варьируется от 100 до 250 о C , поэтому большое количество солей нафтеновой кислоты вместе с керосино-лигроиновой фракцией, температура которой составляет 120-250 о C, попадает в реактор риформинга, где происходит взаимодействие с дорогостоящим платиновым катализатором, что приводит к его выходу из строя.
Данная статья является вводно-фундаментальной - в ней доказывается, что нефть содержит металлические примеси в том или ином виде, это видно из анализа нефти на промыслах, а также после исследования оборудования на нефтеперерабатывающих заводах.
Подводя итог, можно сделать вывод, что металлоносные нефти являются большой проблемой для оборудования и катализаторов нефтяной отрасли, хотя в тоже время являются альтернативным источником получения металлов и их примесей для металлургической промышленности.
Список использованной литературы:
- Э. А. Конторович. Геология нефти и газа. Геология нефти и газа Сибири. Том 1. Новосибирск, 2008 г.
- Академик И. М. Губкин. Учение о нефти. Москва, 1937 г.
- Гл. редактор А. И. Кривцов. Советская геология. Москва, 1989 г.
- В. П. Гаврилов. Происхождение нефти. Москва, 1986 г.
- Справочник химических свойств.
М. А. Неежко, аспирант каф. Металлургии, e-mail: maxim.neezhko@yandex.ru
Н. М. Теляков, д.т.н., профессор кафедры металлургии, e-mail: 9418960@mail.ru
А. Н. Теляков, к.т.н.,доц. кафедры металлургии, e-mail:9418960@mail.ru
В. Ю. Бажин, д.т.н., профессор каф. АТПП, e-mail: bazhin-alfoil@mail.ru
(199106, Санкт-Петербург, Васильевский остров, 21 линия д.2)
Читайте также:


