Беэр с а биология возбудителя описторхоза
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Либерман Елизавета Львовна, Медведева Инна Николаевна, Волосников Глеб Игоревич
Либерман Елизавета Львовна
Г. Тюмень, Российская Федерация Тобольская комплексная научная станция УрО РАН Г. Тобольск, Российская Федерация E-mail: psih30@mail.ru
РЕТРОСПЕКТИВНЫЙ АНАЛИЗ РАСПРОСТРАНЕНИЯ ВОЗБУДИТЕЛЯ ОПИСТОРХОЗА OPISTHORCHIS FELINEUS (RIVOLTA, 1884) НА ТЕРРИТОРИИ РОССИЙСКОЙ ФЕДЕРАЦИИ
В статье приведен ретроспективный анализ эпизоотической ситуации по инвазированию рыб семейства карповых. Рассмотрены данные по заболеваемости населения описторхозом в различных регионах страны. Чаще всего заражены метацеркариями описторхид язь, плотва, красноперка, лещь и елец.
Opisthorchis felineus, экстенсивность инвазии, карповые рыбы, описторхоз.
Природно-очаговые инвазии наносят ощутимый вред промежуточным хозяевам паразитов, а особенно дефинитивным. Одним из таких заболеваний является описторхоз. Трематода Opisthorchis felineus (Rivolta, 1884), кошачья двуустка - широко распространенный гельминт на территории Российской Федерации и ряде сопредельных стран [7]. Изучение описторхид, как биологического объекта, их эволюционных приспособлений, цикла паразитирования, степени поражения промежуточных и дефинитивных хозяев ведется на протяжении многих лет [7, 21, 35]. Opisthorchis felineus (Rivolta, 1884) - биогельминт, относится к семейству Opisthorchiidae (Braun, 1901) рода Opisthorchis (Blanchard, 1895), вызывает природно-очаговое заболевание плотоядных животных и человека. В цикле развития участвуют два промежуточных (моллюски рода Bithynia и рыбы сем. Cyprinidae) и один дефинитивный хозяин. Заражение дефинитивных хозяев происходит при употреблении в пищу сырой, малосоленой, вяленой, не достаточно термически обработанной рыбы, содержащей метацеркарии O. felineus, а также при не соблюдении норм обеззараживания рыбной продукции [27]. Марита O. felineus, паразитируя в печени, желчных ходах, желчном пузыре и поджелудочной железе, наносит значительный вред всему организму в целом, нарушая его физиологическое и функциональное состояние [6, 13, 27].
Заболеваемость населения описторхозом в Российской Федерации достаточно высока [20]. Ежегодно на территории Российской Федерации регистрируется около 35 тыс. больных описторхозом, на его долю приходится 74,4% от других гельминтозов. Наиболее неблагополучными являются Ханты-Мансийский (614,1 на 100 тыс. населения), Ямало-Ненецкий (279,8) автономные округа, Тюменская (211,6), Томская (222,2), Новосибирская (116,6), Омская (158,9) области. [36]. Основные очаги описторхоза расположены в бассейнах рек Оби, Иртыша, Волги, Камы и рек Крайнего Севера [25]. Так, в Тюменской области
эпидемиологическая ситуация остается довольно напряженной, показатель заболеваемости на 100 тыс. населения составил 437,7 в городе и 230,4 на селе [4]. По данным Чиглинцева В. М. на территории г. Нижневартовска и Нижневартовского района у взрослого населения описторхоз занимает ведущее место. Заражение достигало в 2010 году 98,6%, в 2011 - 86,81% и 2012 - 88,5% в структуре паразитарной заболеваемости населения [43]. В Уральском регионе по данным на 2011 год заболеваемость описторхозом на 100 тыс. населения в Челябинской области составила 20,5, в Свердловской области - 15,5 [30]. Также описторхоз у населения регистрируется в Красноярском крае, у жителей Центральной России, Пермской области, Чечне, Татарстане, в странах Европы, таких как Украина, Австрия, Венгрия, Германия и другие [17, 27, 42].
Из диких плотоядных природным резервуаром описторхоза являются лисица обыкновенная, бобр, норка, енотовидная собака, выдра [2, 32, 33, 37]. Так, в Воронежской области лисица заражена описторхозом с экстенсивностью инвазии 11,1%, американская норка - 33,4% [33]. В Рязанской области ЭИ O. felineus у лисицы обыкновенной составила 6,25 % [2].
Основными промежуточными хозяевами возбудителя описторхоза являются рыбы семейства карповых. Представители данного семейства очень популярны у населения и употребляются в пищу в соленом, вяленом, копчёном и других видах. На территории Астраханской области в дельте реки Волга у красноперки отмечено инвазирование личинками возбудителя описторхоза с экстенсивностью инвазии (ЭИ) 30,77%, у леща - 8,33% [1]. Также заражение метацеркариями описторхид у красноперки и леща установлено в реках Липецкой области [41]. В Тайшетском районе Иркутской области изучен новый очаг описторхоза на реке Бирюса, установлена зараженность ельца (5,5%) и восточного леща (50%) [34]. В Новосибирской области в устье Оби наиболее инвазированы метацеркариями язь и верховка, экстенсивность инвазии (ЭИ) составляет 80,6% и 100% соответственно [8]. Исследовано инвазирование карповых рыб описторхидами в бассейнах рек Тара, Тартас, Кама и Урез, где у ельца, плотвы, верховки и пескаря зафиксировано поражение с ЭИ 11,1 до 100% [19]. В реке Томь Кемеровской области у рыб уклейка и чебак отмечена ЭИ O. felineus 10,17% и 55,56% соответственно, рыбы в возрасте 3+-4+ показывали большую степень инвазированности по сравнению с молодью [24]. В реке Белой на территории Республики Башкортостан личинки описторхид обнаруживались у язя, леща, густеры, сорожки, плотвы, пораженность которых достигала 51,1; 48,4; 43,5; 39,6; 36,4% соответственно [26]. Рыбное население представителей карповых в водоемах Воронежской области, таких как плотва, уклея, красноперка, язь, лещь, инвазировано метацеркариями описторхид от 16,7 до 79,5% [31]. Описторхоз у рыб также зафиксирован в Западно-Казахстанской области, в различных водоемах экстенсивность инвазии у язя варьирует от 89,3 до 100%, у красноперки от 32,4 до 69,6% [18]. Установлена инвазированность метацеркариями кошачьей двуустки представителей карповых рыб в водоемах Томской, Курской, Курганской, Пензенской и Омской областях, образуя природные очаги описторхоза [9, 10, 38-40].
На территории Тюменской области Обь-Иртышский бассейн входит в природный очаг описторхоза. Так, пораженность язя метацеркариями O. felineus в Нижней Оби составляет 95%, а плотвы и леща 30% и 15% соответственно. Тогда как в Средней Оби ЭИ язя составила 100%, плотвы - 55% и леща - 10% [16, 29]. В реке Иртыш заражение леща метацеркариями составляет 13,3% [29]. В реке Ишим плотва инвазирована личинками описторхид на 4,8%, а в реке Алабуга данный показатель равен 8,33% [15]. Лещ в р. Алабуга инвазирован метацеркариями на 5,9% с ИИ - 2 особи [14]. Исследования проведенные в Тобольском и Уватском районах Тюменской области в 2002-2009 гг., выявили зараженность карповых рыб метацеркариями O. felineus в нижнем течении Иртыша: язь - 96,3%, елец - 98,0%, лещ - 36,2%, плотва - 31,7% [28]. На территории юга Тюменской области установлено заражение O. felineus плотвы и верховки в таких водоемах как о. Кривое, о. Андреевское и пруд Чистый [12]. Также зафиксированы очаги описторхоза в реках Тавда, Тобол, Тура и Исеть Тюменской области, где отмечено заражение карповых рыб метацеркариями описторхид [5]. Отмечено увеличение зараженности рыбы метацеркариями с возрастом, что повышает возможность инвазирования дефинитивных хозяев [23, 28].
У инвазированной метацеркариями O. felineus рыбы снижается пищевая и биологическая ценность, при этом повышается ее бактериальная обсеменённость, что может послужить причиной пищевой
токсикоинфекции. Содержание белка, жира, золы и энергетическая ценность мяса у зараженной рыбы меньше, чем у не инвазированной. Так, у пораженной описторхисами рыбы количество белка снижается от 1,26 до 1,8%, жира от 0,35 до 0,55%, с повышением интенсивности инвазии содержание влаги у пораженной рыбы увеличивается на 2,18%, что приводит к уменьшению других химических показателей [3, 11, 22]. Снижается энергетическая ценность мяса рыбы, зараженной метацеркариями Opisthorchis felineus, а также ее калорийность как продукта [1].
Таким образом, анализируя данные по распространению возбудителя описторхоза в карповых рыбах и среди населения, можно сделать вывод, что на территории Российской Федерации практически повсеместно существуют природные очаги описторхоза. Доступность данных видов рыб при любительском рыболовстве повышает риск заражения людей данным видом паразита. Необходимо в большей степени придавать значение просветительской работе среди населения о степени опасности данного заболевания, способах заражения, а самое главное о правилах обеззараживания рыбы перед употреблением в пищу, т.е. основным способам профилактики. Разрабатывать методы предотвращения заражения промежуточных хозяев - рыб, метацеркариями, путем регулирования численности первых промежуточных хозяев - моллюсков.
Список использованной литературы:
1. Адиатулин И.Ф. Распространение описторхоза и определение качественных показателей мяса рыб // Ветеринарная патология, 2007 - № 3. - С. 178-187.
2. Андреянов О.Н., Горохов В.В., Сафиуллин Р.Т. и др. Возбудитель описторхоза Opisthorchis felineus на территории Рязанской области / О.Н. Андреянов, В.В. Горохов, Р.Т. Сафиуллин, А.В. Хрусталев, А.С. Москвин // Российский паразитологический журнал, 2013. - № 2. - С. 6-9.
3. Балуева А.И., Чернигова С.В. Определение процентного содержания белка и жира в рыбе, зараженной и не зараженной O. felineus / А.И. Балуева, С.В. Чернигова // Электронный научный журнал, 2016. - № 10-1(13). - С. 13-15.
4. Беляева М. И. Заболеваемость описторхозом в Тюменской области / М. И. Беляева // Санитарная охрана территории. 2012. Т. 2. № 1-2. С. 119.
5. Беляева М.И. Эколого-паразитологические и социальные особенности очагов описторхоза в Южных районах Тюменской области: дис. . канд. биол. наук. Тюмень, 2002. - 157 с.
6. Беэр С. А. и др. Описторхоз: теория и практика / С.А. Беэр, Ю.А. Бочков, А.М. Бронштейн, В.Д. Завойкин, Г.П. Николаевский, Н.А. Романенко, В.П. Сергиев, Л.С. Яроцкий. Москва, 1989. - 200 с.
7. Беэр С.А. Биология возбудителя описторхоза // М.: Товарищество научных изданий КМК, 2005. - 336 с.
9. Бочарова Т.А., Макарова Т.С., Герасимова О.И. Паразитофауна некоторых видов рыб водоемов бассейна средней Оби // Паразитология в изменяющемся мире. Материалы V Съезда Паразитологического общества при РАН: Всероссийской конференции с международным участием г. Новосибирск, 23-26 сентября 2013. -С. 31.
10.Буряк М.В., Малышева Н.С. Роль эколого-паразитологического мониторинга в снижении циркуляции описторхозной инвазии на территории Курской области / М.В. Буряк, Н.С. Малышева // Сибирский медицинский журнал, 2008. - № 7. - С. 88-89.
11.Бутко М. П., Абиатулин И. Ф. Ветеринарно-санитарные показатели и безопасность рыбы, пораженной описторхозом / М. П. Бутко, И. Ф. Абиатулин // Ветеринария Кубани. 2010. №2. С. 4-7.
12.Вепрева В.В., Фаттахов Р.Г. Оценка зараженности карповых рыб метацеркариями трематод сем. Opisthorchidae в водоемах города Тюмени. // Вестник ОГУ, 2008. - №85. - С. 137-141.
13.Григорьева И.Н, Описторхоз: традиции и инновации / И.Н. Григорьева // Экспериментальная и клиническая гастроэнтерология, 2012. - №4. - С. 54-59.
14.Жукова Т.С., Глазунова Л.А. Биотические особенности инвазирования леща (Abramis brama Linnaeus, 1758) трематодами / Т.С. Жукова, Л.А. Глазунова // Молодой ученый, 2016. - № 23 (127). - С. 165-169. 15.Зубков А.Л., Осипов А.С. Сравнительная характеристика зараженности гельминтами рыб малых рек (р. Алабуга, р. Ишим) на территории Казанского района / А.Л. Зубков, А.С. Осипов // Молодой ученый, 2015. -№ 6-5 (86). - С. 163-167.
16.Ильин В.С., Пай И.С., Осипов А.С. Мышечные трематоды карповых рыб в различных водоемах Ямало-Ненецкого и Ханты-Мансийского автономных округов / В.С. Ильин, И.С. Пай, А.С. Осипов // Инновационное развитие АПК Северного Зауралья, Тюмень, 18 апреля 2013. - С. 305-307.
17.Исханов И.В. Роль домашних животных в распространении описторзоза в бассейне реки Терек. // Экология и биология паразитов, 2012. - С. 39-42.
18.Кармалиев Р.С., Кереев Я.М. Описторхоз рыб в Западно-Казахстанской области / Р.С. Кармалиев, Я.М. Кереев // Российский паразитологический журнал, 2013. - № 3. - С. 11-15.
19.Карпенко С.В., Чечулин А.И., Юрлова Н.И. и др. Характеристика очагов описторхоза юга Западной Сибири // С.В. Карпенко, А.И. Чечулин, Н.И. Юрлова, Е.А. Сербина, С.Н. Водяницкая, А.В. Кривопалов, К.П. Федоров // Сибирский экологический журнал, 2008. - Т. 15. - № 5. - С. 675-680.
21.Колчанов Н.А., Мордвинов В.А. Паразитоз от А до Т / // Наука из первых рук, 2008. - Т. 20. - № 2. - С. 2841.
22.Крыгин В.А., Швагер О.В. Ветеринарно-санитарная экспертиза и показатели качества и безопасности рыбы при описторхозе / В.А. Крыгин, О.В. Швагер // Аграрная наука: поиск, проблемы, решения. Материалы международной научно-практической конференции, 08-10 декабря, Волгоград, 2015. - Т. 2. - С. 240-244.
23.Ларцева Л.В., Проскурина В.В., Воробьев В.И. Паразиты рыб, опасные для человека / Л.В. Ларцева, В.В. Проскурина, В.И. Воробьев // Проблемы региональной экологии и природопользования. Естественные науки, 2012. - № 1(38). - С. 74-81.
24.Маниковская Н.С., Кориневская Е.О., Расковалова Е.П. Изучение зараженности метацеркариями Opisthorchis felineus Rivolta, 1884 (Trematoda) рыб семейства карповые (Cyprinidae) / Н.С. Маниковская, Е.О. Кориневская, Е.П. Расковалова // Теория и практика борьбы с паразитарными болезнями, Москва, 19-20 мая, 2015. - С. 243-246.
25.Мерзлова Н.Б., Шепелева А.А. Медицинская география биогельминтозов - описторхоза / Н.Б. Мерзлова,
26.Мусыргалина Ф.Ф., Кудакаева Т.Г. Изучение зараженности рыб сем. Карповые метацеркариями описторхид на реке Белой Республики Башкортостан / Ф.Ф. Мусыргалина, Т.Г. Кудакаева // Общество XXI века: итоги, вызовы, перспективы, 2015. - № 4. - С. 3-6.
27.Николаева Н., Николаева Л., Гигилева Н. Описторхоз (эпидемиология, клиника, диагностика, лечение) / Н. Николаева, Л. Николаева, Н. Гигилева // Врач, 2005. - № 7. - С. 17-20.
28.Пельгуновым А.Н. Проблемы описторхоза и дифиллоботриоза в нижнем течении Иртыша. // Эпизоотология, эпидемиология и мониторинг паразитарных болезней, 2012. - № 3. - С. 68-73.
29.Петрачук Е.С., Пай И.С., Осипов А.С., Янкова Н.В. Паразитофауна леща Обь-Иртышского бассейна / Е.С. Петрачук, И.С. Пай, А.С. Осипов, Н.В. Янкова // Молодой ученый, 2013. - № 2(49). - С. 98-100.
30.Ратникова Л.И., Борзунов В.М. Описторхоз - актуальная инвазия Уральского региона / Л.И. Ратникова,
B.М. Борзунов // Известия высших учебных заведений. Уральский регион, 2011. - № 2. - С. 87-90.
31.Ромашова Е.Н. Карповые рыбы как источник заражения человека и домашних животных описторхозом в Воронежской области / Е.Н. Ромашова // Вестник Воронежского государственного аграрного университета. - 2015. - № 3 (46). - С. 81-88.
32.Ромашова Е.Н., Кулешов А.А., Ромашов Б.В. Некоторые аспекты морфологической изменчивости Opisthorchis felineus / Е.Н. Ромашова, А.А. Кулешов, Б.В. Ромашов // Теория и практика борьбы с
паразитарными болезнями. Материалы докладов научной конференции, Москва, 19-20 мая, 2015. - С. 370372.
33.Ромашова Е.Н., Рогов М.В., Ромашов Б.В., Никулин П.И. Гельминты диких плотоядных Воронежской области: эколого-фаунистический анализ / Е.Н. Ромашова, М.В. Рогов, Б.В. Ромашов, П.И. Никулин // Российский паразитологический журнал, 2014. - № 1. - С. 23-33.
34.Русинек О.Т., Кондратистов Ю.Л. Изучение зараженности карповых рыб метацеркариями трематод в очаге описторхоза (Тайшетский район, Иркутская область, Россия) / О.Т. Русинек, Ю.Л. Кондратистов // Известия ИГУ, 2010. - Т. 3. - № 1. - С. 132-142.
35.Скрябин К.И. Трематоды животных и человека. Основы трематодологии // М.: Академия наук СССР, 1950. - 496 с.
36.Старостина О.Ю., Панюшкина И.И. Сравнительная характеристика методов лабораторной диагностики описторхоза. // Клиническая лабораторная диагностика, 2014. - №4. - С. 44-46.
37.Стрельчик В.А., Иванюшина А.М., Марач Ю.Н., Медведева К.О. Гельминтофауна диких плотоядных животных. // Вестник ОмГАУ, 2016.- № 3 (23). - С. 125-127.
38.Трошина А. С., Стойко Т. Г. Экологические предпосылки появления и распространения Opisthorchis felineus (Rivolta, 1884) в Пензенской области / А. С. Трошина, Т. Г. Стойко // Вестник Пензенского государственного университета, 2016. - № 2 (14). - С. 80-85.
39.Фаттахов Р.Г., Степанова Т.Ф., Кряжнева Е.С., Летюшев А.Н. Инвазированность карповых рыб личинками возбудителя описторхоза в бассейне Иртыша на территории Омской области / Р.Г. Фаттахов, Т.Ф. Степанова, Е.С. Кряжнева, А.Н. Летюшев // Wschodnioeuropejskie Czasopismo Naukowe, 2016. - Т. 7. - № 1.- С. 156-159.
40.Фаттахов Р.Г., Ушаков А.В. Зараженность карповых рыб личинками описторхид в бассейнах рр. Тобол и Исеть в пределах Курганской области // Паразитология в изменяющемся мире. Материалы V Съезда Паразитологического общества при РАН: Всероссийской конференции с международным участием г. Новосибирск, 23-26 сентября 2013. - С. 200.
41.Федотов А.А., Гусева Т.В., Жуков И.В. Эпизоотическая ситуация по болезням рыб в Липецкой области / А.А. Федотов, Т.В. Гусева, И.В. Жуков // Ветеринарная патология, 2008. - № 1. - С. 194-196. 42.Чемидич Н.Д., Ильиной Н.И., Захлебаевой В.В., Шолоховой С.Е. Особенности описторхоза в природном очаге // Актуальная инфектология, 2014 - № 2(3). - С. 72-77.
43.Чиглинцев В. М. Современная эпидемиологическая обстановка распространенности описторхоза в г.Нижневартовске и Нижневартовском районе. // CETERIS PARIBUS, 2015. - №3. - С. 14-16.
Долгое время возбудитель описторхоза – широко распространенного паразитического заболевания, вызванного потреблением инфицированной рыбы, изучался главным образом медиками и паразитологами. Однако современные молекулярно-генетические методы в сочетании с биоинформационными подходами позволяют получить принципиально новые данные о биологии и структурно-функциональной организации генома этого паразита, в том числе определить молекулярные основы его патогенной и канцерогенной активности. Это открывает широкие перспективы для разработки новых методов профилактики и лечения описторхоза
Описторхоз – это тяжелое паразитическое заболевание, с очаговым характером распространения, которое вызывается печеночными сосальщиками. Эти паразитические трематоды (иначе – плоские черви) принадлежат к семейству Opishtorchiidae. Интерес к описторхозу не случаен – он продиктован высокой социальной значимостью этого заболевания для нашей страны, особенно для Западной Сибири.
Здесь, в Обь-Иртышском речном бассейне, еще в 1929 г. был обнаружен крупнейший природный очаг описторхоза. И за прошедшие десятилетия эпидемиологическая ситуация ничуть не улучшилась: по данным Роспотребнадзора, в 2010 г. в нижнем течении Иртыша и среднем течении Оби было заражено до 90—95 % сельского населения, в том числе дети дошкольного возраста. Показатели заболеваемости в разных населенных пунктах этого очага превышают общероссийские в 3—28 раз (О санитарно-эпидемиологической обстановке…, 2008 г.).
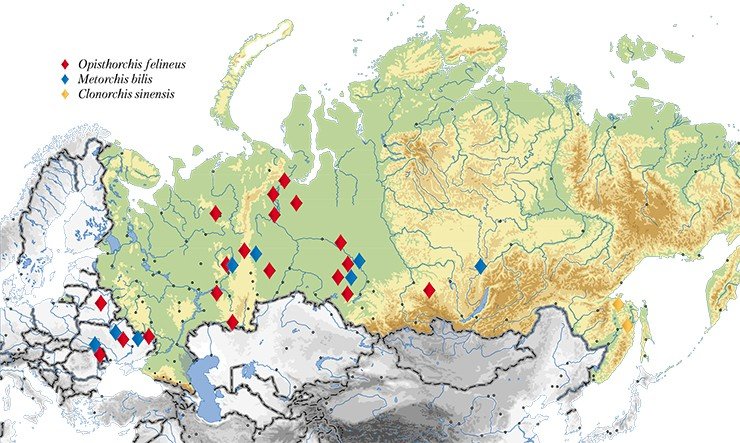
Учитывая широкую географию распространения паразита, для специалистов представляет несомненный интерес выяснить, существуют ли генетические различия, характеризующие популяции из разобщенных зон его ареала. Эти, с первого взгляда, сугубо теоретические исследования имеют и выраженный прикладной аспект. Поскольку именно генетические отличия между паразитами могут обусловливать такие значимые медицинские характеристики, как разнообразие клинических проявлений заболевания, разную вероятность формирования лекарственной устойчивости у паразита, а также его различную иммуногенность (способность вызывать наработку специфических антител). Все эти сведения будут полезны для прогнозирования течения заболевания и формирования иммунного ответа у зараженного человека, а также для разработки диагностических средств и создания вакцин.
Именно такое комплексное исследование проблемы описторхоза и его возбудителей проводится с 2005 г. в Институте цитологии и генетики СО РАН (Новосибирск). Работа по анализу популяционно-генетической структуры гельминтов началась с формирования уникальной коллекции описторхов из разных географических зон – Западной Сибири, европейской части России и Северного Казахстана. На сегодня в ней представлено около 300 образцов Opisthorchis felineus – основного возбудителя описторхоза в нашей стране, и около 300 других видов описторхид, включая эпидемиологически значимые.
Метод как основа
Для оценки генетического разнообразия гельминтов из разных мест обитания был использован метод сравнительного анализа геномных маркеров, в качестве которых выступают фрагменты ДНК. Этот метод, широко использующийся в современной молекулярной биологии, позволяет достаточно надежно судить о степени родства как отдельных индивидов, так и их групп. Поэтому его используют для определения близкородственных видов и реконструкции их эволюционной истории.
10 –8 —10 –12 на клетку за поколение. Поэтому в качестве геномных маркеров выбирают участки генома с высокой скоростью накопления мутаций, а это характерно для тех из них, которые по тем или иным причинам не попадают под действие отбора, т. е. селективно нейтральны.
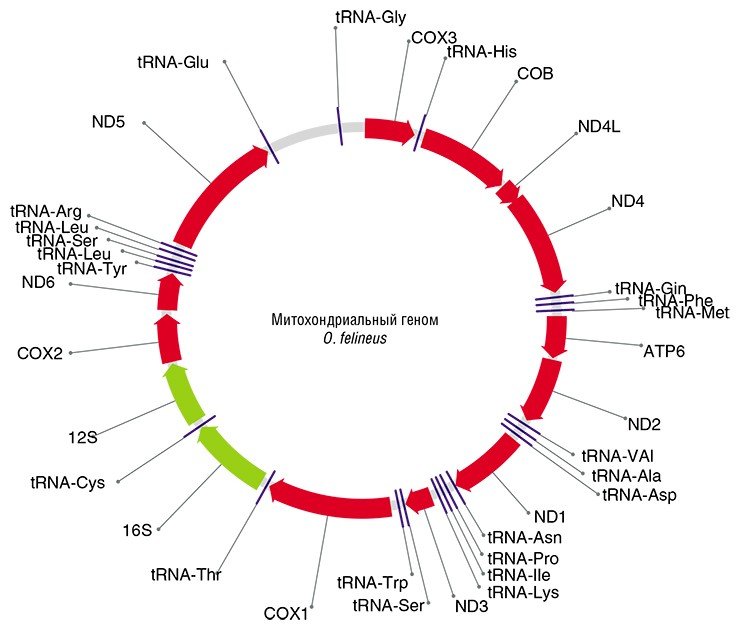
Этому требованию отвечают не кодирующие белок последовательности ядерной ДНК, а также собственная ДНК клеточных органелл – митохондрий. Последняя наследуется строго по материнской линии с цитоплазмой яйцеклетки и не участвует в рекомбинационном процессе (обмене участками хромосом при клеточном делении). Скорость накопления нейтральных мутаций в митохондриальных генах в 5—10 раз выше, чем в генах ядерной ДНК.

Принято считать, что число накопленных однонуклеотидных замен в селективно нейтральных участках ДНК линейно зависит от времени. Следовательно, произведя подсчеты этих замен, можно получить приблизительную датировку эволюционных событий.
В результате было найдено восемь подходящих генетических маркеров, из них три (два митохондриальных и один ядерный) были выбраны для генотипирования коллекционных образцов описторхид. Нужно добавить, что хотя в последнее десятилетие аналогичные маркеры использовались при исследованиях популяционной структуры и филогеографии других паразитических трематод в Европе, Восточной и Юго-Восточной Азии, Африке, и Америке, исследования такого рода в отношении O. felineus ранее не проводились.
Последующая эволюционная история O. felineus, по-видимому, была весьма драматичной. Дело в том, что ранее было высказано предположение о существовании трех подвидов описторха – сибирского, казахского и восточно-европейского, обитающих соответственно в Обь-Иртышском и Енисейском, Нура-Сарысукском, Волжском, Донском и Уральском речных бассейнах (Беэр, 2005). Поэтому ожидалось, что коллекционные образцы из столь разнесенных в пространстве популяций продемонстрируют заметные генетические различия, поскольку экологически условия обитания также значительно разнятся. Но вопреки предположениям исследованные выборки описторхов характеризовались крайне низким генетическим разнообразием, в отличие от других уже изученных видов трематод (Брусенцов и др., неопубликованные данные).
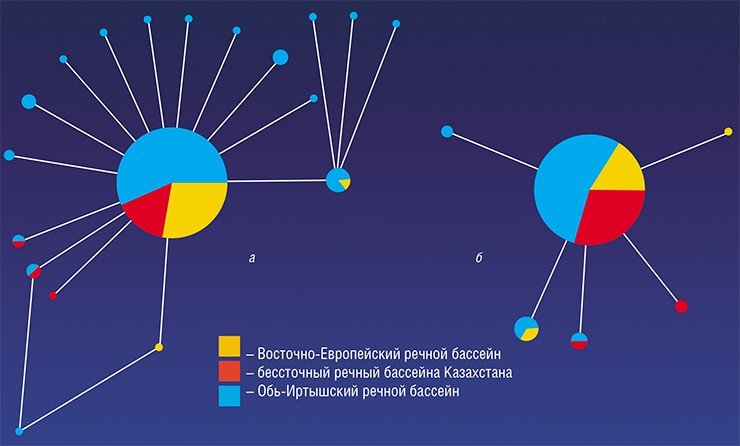
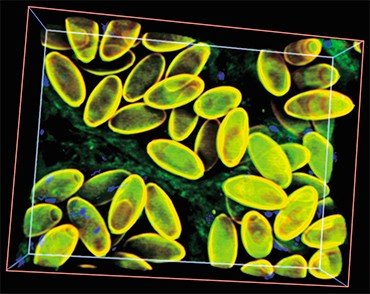
С наступлением потепления и формированием новых речных бассейнов последовало восстановление численности предковой популяции. Согласно расчетам, 21—25 тыс. лет назад в истории вида начался (и продолжается до сих пор) период демографического взрыва, которому, вероятно, в немалой степени способствовал факультативно гермафродитный способ размножения описторха.
К сожалению, проведенное исследование не дает возможности точно указать локализацию предковой популяции и проследить пути расселения паразита. Но, учитывая сложный жизненный цикл O. felineus, представляется очевидным, что направление и скорость его экспансии определялись миграционными способностями его хозяев. Тот факт, что описторхоз сегодня распространен только в некоторых географических зонах, во многом обусловлен средовыми предпочтениями его первого промежуточного хозяина – пресноводных моллюсков битиний, которые в морской воде погибают. Однако одним из окончательных хозяев описторха является человек, для которого географические изолирующие барьеры практически отсутствуют.
В одной пробирке
С помощью метода генетических маркеров удалось решить и актуальную медицинскую задачу точной видовой идентификации описторхид. Дело в том, что, наряду с описторхом, в России, а также в Казахстане и странах Восточной Европы встречается еще один эпидемиологически значимый вид – меторх (Мetorchis bilis). А на Дальнем Востоке – еще и клонорх (C. sinensis), о котором упоминалось выше, обычный для стран Юго-Восточной Азии.
Все эти трематоды вызывают заболевания с очень сходной клинической картиной, поэтому на основе одних лишь симптомов врач не может поставить точный диагноз. Под микроскопом же яйца этих гельминтов практически неразличимы между собой, так что результат микроскопического анализа фекалий или содержимого двенадцатиперстной кишки, взятого при дуоденальном зондировании, во многом зависит от квалификации лаборанта. Ситуацию усугубляет возможность одновременного заражения разными видами описторхид.
Сегодня наиболее точной является ДНК-диагностика трематодозов. За рубежом такие эффективные тест-системы начали интенсивно разрабатываться еще в 1990-е гг. Российские ученые начали подобную работу позже, но в последние годы и у нас, в частности в ИЦиГ СО РАН, активно идет процесс создания ПЦР-дигностикумов, с помощью которых можно выявлять в лабораторном материале генетические фрагменты, строго специфичные для определенного вида возбудителя. Поскольку метод позволяет использовать одновременно генетические маркеры на разных гельминтов, для точной диагностики паразитических агентов достаточно одного анализа.
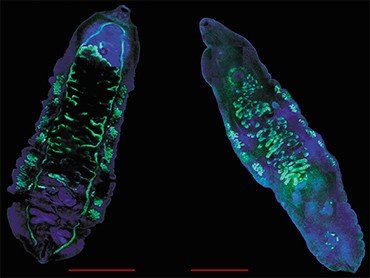
Установление вида паразита может иметь большое значение. Например, оно позволяет определить источник и место заражения. Но самое главное – возбудители описторхоза – меторхоза и клонорхоза различаются по ряду биологических характеристик, что может влиять на течение и прогноз заболевания, возникновение осложнений и степень чувствительности паразитов к лекарственным препаратам.
Так, недавно в эксперименте на золотистых хомячках было показано, что два вида описторхид – наш O. felineus и O. viverrini, встречающийся в странах Юго-Восточной Азии, различаются по агрессивности воздействия на организм хозяина (Lvova et al., 2012). Кстати сказать, в той же Юго-Восточной Азии помимо высокопатогенной O. viverrini широко распространена еще одна похожая трематода – Haplorchis taichui, заражение которой не вызывает тяжелого заболевания (Lovis et al., 2009). Этот пример показывает, насколько важна дифференциальная диагностика трематодозов для назначения адекватного лечения.
Кроме того, даже при низкой степени зараженности хроническая инвазия описторхидами может приводить к серьезным последствиям для здоровья. Однако, как правило, врачи бессильны обнаружить яйца описторхид в лабораторном материале таких пациентов с помощью обычной световой микроскопии, и диагноз зачастую ставится только посмертно (Müller et al., 2007). ПЦР-диагностика же является в этом случае гораздо более чувствительным методом.
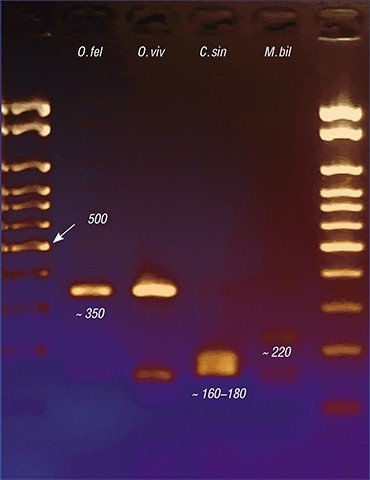
Итак, несмотря на свою драматическую эволюционную историю, паразитическая трематода O. felineus не только выжила, но, даже потеряв часть своего генофонда, сегодня является весьма процветающим видом с высокими адаптационными способностями, в том числе высокой инвазионностью – способностью внедряться в организм хозяина.
Разработанные новосибирскими учеными наборы для ПЦР-диагностики описторхоза прошли стадию лабораторных испытаний, сейчас завершается их тестирование на клиническом материале. С их помощью уже удалось успешно выявить у группы пациентов случаи смешанных трематодных инвазий (Brusentsov et al., 2010), что, несомненно, говорит о необходимости их включения в арсенал методов лабораторной диагностики описторхоза. Ведется разработка производственной технологии выпуска диагностикумов.
Повысить точность ИФА можно путем клонирования генов, кодирующих специфичные для описторха антигены. В ИЦиГ СО РАН уже получены такие генно-инженерные белки-антигены О.felineus, пригодные для создания диагностикумов нового поколения. Их можно использовать для детекции даже незначительного количества специфических антипаразитарных антител в сыворотке крови. Однако в медицинскую практику такие ИФА-диагностикумы поступят еще не скоро.
Внедрение новых диагностических технологий, несомненно, повлияет на качество лечения и продолжительность реабилитации пациентов. Этому есть много примеров, наиболее яркие из которых связаны с диагностикой бактериальных инфекций, перешедшей из чашек Петри в пробирки для ПЦР. Новые технологии не отменят традиционные, но позволят намного повысить чувствительность и точность анализов, особенно в сложных клинических случаях.
Юрлова Н. И. Обская болезнь описторхоз // Наука из первых рук. 2008. №2 (20). С. 12—21.
Пальцев А. И. Системному заболеванию – системный подход // Наука из первых рук. 2008. №2 (20). C. 22—27.
Колчанов Н. А., Мордвинов В. А. Паразитоз от А до Т // Наука из первых рук. 2008. №2 (20). C. 28—41.
Беэр С. А. Биология возбудителя описторхоза. КМК, 2005. 336 с.
Брусенцов И. И., Катохин А. В., Сахаровская З. В. и др. ДНК-диагностика микст-инвазий Opisthorchis felineus и Metorchis bilis с помощью метода ПЦР // Медицинская паразитология и паразитарные болезни. 2010. № 2. С.10—13.
Читайте также:


