Госты на молоко определение кишечной палочки
Санитарно-бактериологическое исследование молока и молочных продуктов Ф. К. Черкес, Н. А. Бельская
Молоко и молочные продукты являются благоприятной средой для размножения микроорганизмов.
При изготовлении некоторых молочных продуктов: творога, кефира, простокваши, ряженки и других используют специальную микрофлору, например молочнокислые стрептококки, молочно-кислые ацидофильные палочки и др. Микрофлора, используемая для приготовления этих продуктов, является для них специфичной и не учитывается.
Неспецифической микрофлорой, встречающейся в молоке и молочных продуктах, являются аэробные бактерии: БГКП, стафилококки и др.
С молоком могут передаваться возбудители туберкулеза, бруцеллеза, сальмонеллеза, сибирской язвы, вирус полиомиелита, анаэробные бациллы и т. д.
Обсеменение молока и молочных изделий неспецифической микрофлорой может произойти в момент удоя, транспортировки, хранения и т. д.
Исследование молока и молочных продуктов проводят согласно ГОСТу 9225-68.
Отбор проб. Пробы жидких и полужидких продуктов после тщательного их перемешивания отбирают в количестве 50-100 мл в стерильные колбы. Пробы сливочного масла, сыра, творога отбирают с помощью стерильного щупа из глубины продукта. Перед взятием пробы масла, творога верхний слой продукта тщательно зачищают, а поверхность сыра в месте отбора пробы прижигают раскаленным ножом. Из расфасованных продуктов берут по 2 образца в оригинальной упаковке. Взятые образцы сопровождают документом, в котором указывают:
1. Номер образца.
2. Наименование и сорт продукта.
3. Дату изготовления.
4. Дату и час отбора пробы.
5. Объем необходимых исследований.
6. Должность и подпись лица, отобравшего пробу.
Микробиологическое исследование продукта должно производиться не позднее чем через 4 ч с момента отбора пробы. При транспортировке температура не должна превышать 6° С.
ГОСТ для молока и молочных изделий предусматривает определение общего числа бактерий в 1 г (мл) и определение титра цитратотрицательных (цитратнегативных) разновидностей БГКП (коли-титр).
Подготовка образцов для исследования. Из молока и других молочных продуктов готовят десятикратные разведения (по общепринятой методике). Количество разведений для каждого вида продукта готовят с учетом наиболее вероятного микробного обсеменения (табл. 56).

Таблица 56. Разведение молока и молочных продуктов
Примечание. Для определения общего количества бактерий следует выбирать те разведения, при посевах которых на чашках вырастает не менее 50 и не более 300 колоний.
Посев. По 1 мл каждого разведения вносят в 2-3 стерильные чашки Петри и заливают 12-15 мл растопленного и остуженного до 45° С питательного агара. Предварительно чашки маркируют. Сразу после заливки содержимое чашки перемешивают (путем легкого вращательного покачивания) для равномерного распределения посеянного материала. Посевы ставят в термостат при 37° С на 48 ч.
По истечении срока инкубации чашки вынимают и подсчитывают число колоний при помощи счетчика. Число колоний, выросших на каждой чашке, умножают на соответствующее разведение. Полученные результаты по отдельным чашкам складывают, делят на количество чашек и получают среднее арифметическое, которое является показателем общего числа бактерий в 1 г (мл).
Соответствующие ГОСТы регламентируют качество продуктов, что устанавливают по допустимым показателям: общему числу микробов и коли-титру. Пример для двух видов продуктов представлен в табл. 57.

Таблица 57. Показатели общего числа бактерий и коли-титра в молоке
Примечание. Для других молочных продуктов также имеется ГОСТ обусловливающий допустимое количество микробов в 1 мл (г) продукта. Буквы А и Б обозначают категорию продукта.
В кисломолочных продуктах (кефир, простокваша, творог, сметана и др.), содержащих обильную специфическую микрофлору, общее количество бактерий не определяют, а контролируют состав микрофлоры. Для этого из кисломолочных продуктов готовят препараты и красят метиленовым синим. В поле зрения препарата должны находиться только специфические для данного продукта микроорганизмы. Например, для простокваши - молочно-кислые стрептококки и палочки; для кефира - молочно-кислые стрептококки и палочки, единичные дрожжи. Микроскопия позволяет выявить микроорганизмы порчи (плесени и большое количество дрожжей).
Обсемененность молока и молочных продуктов бактериями группы кишечной палочки определяют бродильным методом. Бродильный титр - это то наименьшее количество продуктов, выраженное в граммах или миллилитрах, в котором присутствует кишечная палочка. Согласно ГОСТу 9225-68 учитываются только цитратнегативные разновидности кишечной палочки (рис. 57).
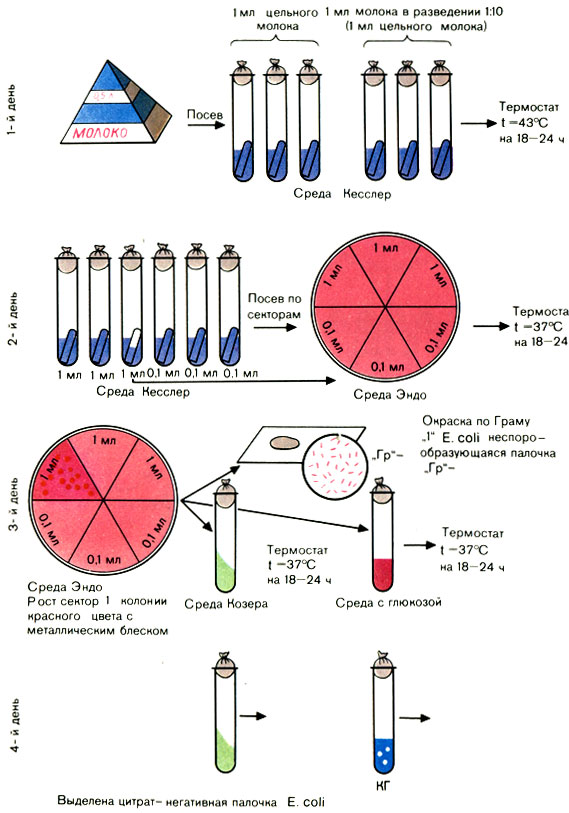
Рис. 57. Определение коли-титра молока
Посев молока и молочно-кислых продуктов производят в 6 пробирок с 5 мл среды Кесслер. В 3 пробирки засевают по 1 мл цельного продукта, в другие 3 пробирки по 1 мл из разведения 1:10 (0,1 мл). Посевы инкубируют в термостате при 43° С 18-24 ч.
Из каждой забродившей пробирки производят посев на сектор среды Эндо и инкубируют при 37° С 18-24 ч.
При отсутствии типичных для БГКП колоний продукт считают незагрязненным кишечной палочкой.
При наличии типичных для БГКП колоний делают мазки, окрашивают по Граму и микроскопируют. При обнаружении грамотрицательных палочек ставят пробу на оксидазу и производят посев на среду с глюкозой и среду Козера.
Производят учет результатов. Наличие кислоты и газа на среде с глюкозой и отсутствие роста на среде Козера свидетельствует о наличии цитратнегативных разновидностей кишечной палочки. Коли-титр вычисляют по табл. 58.
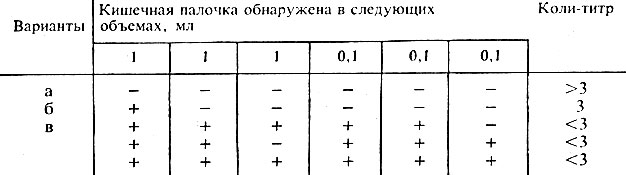
Таблица 58. Вычисление коли-титра в пастеризованном молоке, сливках, кефире, простокваше, ацидофильном молоке
Примечание. Вычисление коли-титра для масла, сыра, творожных изделий, мороженого и молочных консервов проводят по другим таблицам, указанным в ГОСТе.
Присутствие патогенных микроорганизмов в молоке и молочных продуктах недопустимо.
1. Как определяют в молоке и молочных продуктах общее число микробов?
2. Как определяют коли-титр?
3. Какие микроорганизмы могут встречаться в молоке и молочных продуктах?
Среда Кесслер. См. с. 484.
Среда Козера. К 1 л дистиллированной воды добавляют 1,0 г фосфата однозамещенного калия, 0,2 г сульфата магния, 2,5-3,0 г цитрата натрия. Раствор стерилизуют в автоклаве при 1 атм в течение 15 мин, добавляют 10 мл 0,5% спиртового раствора бромтимолового синего и разливают в стерильные пробирки.
Среда глюкозой. См. главу 7.
Желточно-солевая среда. См. главу 14.

Группа компаний "Униконс"
Продвижение и реализация пищевых добавок, антисептиков и другой продукции НПО Альтернатива.

"Бесплатные образцы"
Комплексные пищевые добавки "Униконс".
Для всех отраслей пищевой промышленности!

"Петритест"
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
- Вы здесь:
- Библиотека технолога

- Молочная промышленность

- Микробиология молока и молочных продуктов
5.3. БАКТЕРИИ ГРУППЫ КИШЕЧНЫХ ПАЛОЧЕК (БГКП) КАК ОСНОВНЫЕ САНИТАРНО-ПОКАЗАТЕЛЬНЫЕ МИКРООРГАНИЗМЫ
В группу БГКП входят представители нескольких родов семейства Enterobacteriaceae, в том числе Escherichia, Citrobacter, Enterobacter, Klebsiella, Serratia. Эти микроорганизмы обладают многими общими морфологическими, культуральными и биохимическими свойствами.
Бактерии группы кишечных палочек - короткие (длина 1-3 мкм, ширина 0,5-0,8 мкм) полиморфные подвижные и неподвижные грамотрицательные палочки, не образующие спор. Бактерии этой группы хорошо растут на простых питательных средах: мясопептонном бульоне (МПБ), мясопептонном агаре (МПА). На МПБ дают обильный рост при значительном помутнении среды; осадок небольшой, сероватого цвета, легкоразбивающийся. Образуют пристеночное кольцо, пленка на поверхности бульона обычно отсутствует. На МПА колонии прозрачные с серовато-голубым отливом, легко сливающиеся между собой. На среде Эндо образуют плоские красные колонии средней величины. Красные колонии могут быть с темным металлическим блеском (Е. coli) или без блеска (Е. aerogenes). Для лактозоотрицательных вариантов кишечной палочки (В. paracoli) характерны бесцветные колонии. Им свойственна широкая приспособительная изменчивость, в результате которой возникают разнообразные варианты, что усложняет их классификацию.
Большинство бактерий группы кишечных палочек (БГКП) не разжижают желатина, свертывают молоко, расщепляют пептоны с образованием аминов, аммиака, сероводорода, обладают высокой ферментативной активностью в отношении лактозы, глюкозы и других Сахаров, а также спиртов. Не обладают оксидазной активностью. По способности расщеплять лактозу при температуре 37°С БГКП делят на лактозоотрицательные и лактозоположительные кишечные палочки (ЛКП), или колиформные, которые нормируются по международным стандартам. Из группы ЛКП выделяются фекальные кишечные палочки (ФКП), способные ферментировать лактозу при температуре 44,5°С. К ним относится Е. coli, не растущая на цитратной среде.
На этих свойствах основано определение БГКП в молочных продуктах в средах Кесслер (в соответствии с 32901-2014 по образованию газа) или Кода (по изменению цвета индикатора) после термостатирования при температуре 37±1°С в течение 24 ч, а для мороженого - 48 ч. Дифференциально- диагностическая - среда Эндо, на которой Е. coli образует красные колонии с металлическим блеском. Образование полупрозрачных бесцветных или бледно-розовых колоний говорит о принадлежности микроорганизмов к лакгозоотри- цательным, в том числе патогенным энтеробактериям.
Санитарно-показательное значение родов неодинаково: наличие эшери хий свидетельствуют о свежем фекальном загрязнении, цитробактер и энтеробактер (иногда их считают измененными эшерихиями под влиянием пребывания во внешней среде) - показатели давнего или нефекального загрязнения.
В молоке БГКП хорошо размножаются, доводя его кислотность до 50- 80°Т и образуя в нем неровный ноздреватый сгусток. Молочнокислые микроорганизмы замедляют развитие БГКП. При режимах пастеризации, принятых в молочной промышленности, БГКП гибнут. Обычные дезинфицирующие средства полностью обеззараживают оборудование, инвентарь, руки от БГКП.
Дифференциацию БГКП можно проводить с помощью специальных тестов (комплекс признаков ТИМАЦ + Л):
Т - температурный тест (тест Эйкмана, выявляет способность эшери- хий ферментировать глюкозу, лактозу, маннит с образованием газа при 44- 45°С, другие не обладают такой способностью);
И- индолообразование (способность эшерихий расщеплять аминокислоту триптофан с выделением индола);
М - реакция с метиловым красным, заключается в определении кислотообразования при ферментации глюкозы: если индикатор изменяет светло-желтый цвет на красный, это свидетельствует о снижении рН до 5 и о наличии эшерихий и цитробактер, энтеробактер не изменяет цвет индикатора;
А- реакция на ацетилметилкарбинол (ацетоин), выявляет способность микроорганизмов образовывать это вещество в среде с глюкозой; проводится качественная реакция с гидроксидом калия и креатином, дающая розовый цвет, такой способностью обладают только представители рода цитробактер;
Ц - цитратный тест (способность микроорганизмов усваивать в качестве единственного источника углерода лимонную кислоту или ее соли, используют среду Козера с цитратами, цитробактер и энтеробактер растут на таких средах, называются цитратположительными бактериями, эшерихии - нет);
Л - лактозный тест (способность ферментировать лактозу).
Основные (наиболее стабильные) тесты - температурный и цитратный.
При воздействии факторов внешней среды (например, в присутствии антибиотиков) свойства БГКП могут меняться. Для дифференциации видов дополнительно определяют уреазную активность, рост на средах с цианистым калием, ферментацию различных углеводов, используют специальные таблицы.
Критерии санитарной оценки молочных продуктов и других объектов по присутствию СПМ предусмотрены действующими ГОСТ и СанПиН. Использовавшийся ранее показатель бродильного титра заменен показателем отсутствия БГКП в определенной массе продукта. Так, например, в пастеризованном молоке БГКП должны отсутствовать в 0,01 см, в ультрапастеризованном молоке - в 10 см 3 , ряженке - в 1 г, в кефирной закваске - в 3 мл, в твороге - в 0,001 г.
ГОСТ 30518-97/ГОСТ Р 50474-93
Группа Н09
Методы выявления и определения количества бактерий группы
кишечных палочек (колиформных бактерий)
Food products. Methods for detection and quantity determination of coliformes
МКС 07.100.30
ОКСТУ 9109
Дата введения 1994-01-01
1 РАЗРАБОТАН И ВНЕСЕН Всероссийским научно-исследовательским институтом консервной и овощесушильной промышленности (ВНИИКОП) и Техническим комитетом по стандартизации ТК 93 "Продукты переработки плодов и овощей"
2 ПРИНЯТ Межгосударственным Советом по стандартизации, метрологии и сертификации (протокол N 11 от 23 апреля 1997 г.)
3 Настоящий стандарт соответствует ИСО 4831-78 "Микробиология. Общее руководство по подсчету колибактерий. Методика расчета наиболее вероятного значения после инкубации при 30 °С" и ИСО 4832-78 "Микробиология. Общее руководство по подсчету колиформ. Метод подсчета колоний при температуре 30 °С" в части сущности методов
4 Постановлением Госстандарта России от 16 апреля 1998 г. N 122 ГОСТ 30518-97 введен в действие в качестве государственного стандарта Российской Федерации с момента принятия указанного постановления и признан имеющим одинаковую силу с ГОСТ Р 50474-93 на территории Российской Федерации в связи с полной аутентичностью их содержания
За принятие проголосовали:
Наименование национального органа
по стандартизации
Госстандарт Республики Беларусь
Госстандарт Республики Казахстан
5 ВВЕДЕН ВПЕРВЫЕ
6 ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка
5.1.2, 5.5, 6.3, 6.4, 6.5
Настоящий стандарт распространяется на пищевые продукты и устанавливает метод выявления в определенной навеске пищевого продукта колиформных бактерий и три метода определения их количества: метод наиболее вероятного числа (НВЧ) и методы посева в или на агаризованные селективно-диагностические среды.
Метод определения НВЧ колиформных бактерий предназначен для пищевых продуктов, содержащих в 1 г твердого продукта менее 150 или в 1 см жидкого продукта менее 15 клеток колиформных бактерий.
Метод определения количества колиформных бактерий посевом в агаризованные селективно-диагностические среды предназначен для пищевых продуктов, содержащих в 1 г твердого продукта более 150 или в 1 см жидкого продукта более 15 колониеобразующих единиц (KОЕ) колиформных бактерий.
Метод определения количества колиформных бактерий посевом на агаризованные селективно-диагностические среды предназначен для пищевых продуктов, содержащих в 1 г твердого продукта более 1500 или в 1 см жидкого продукта более 150 KОЕ колиформных бактерий.
1 Сущность методов
1 Сущность методов
Методы выявления и определения наиболее вероятного числа колиформных бактерий основаны на высеве определенного количества продукта и (или) разведений навески продукта в жидкую селективную среду с лактозой, инкубировании посевов, учете положительных пробирок (колб), пересеве, при необходимости, культуральной жидкости на поверхность агаризованной селективно-диагностической среды для подтверждения по биохимическим и культуральным признакам роста принадлежности выделенных колоний к колиформным бактериям.
Методы определения количества колиформных бактерий посевом в (на) агаризованные селективно-диагностические среды основаны на высеве определенного количества продукта или его разведений в или на агаризованную селективно-диагностическую среду с лактозой, инкубировании посевов, подсчете типичных колоний, подтверждении, при необходимости, по биохимическим признакам принадлежности выделенных колоний к колиформным бактериям.
2 Отбор и подготовка проб
Отбор и подготовка проб - по ГОСТ 26668, ГОСТ 26669.
3 Аппаратура, материалы, реактивы и питательные среды
3.1 Для проведения испытания применяют аппаратуру, материалы и реактивы по ГОСТ 10444.1 со следующими дополнениями:
весы лабораторные общего назначения с метрологическими характеристиками по ГОСТ 24104* с наибольшим пределом взвешивания 200 г, 2-го класса точности (для взвешивания реактивов);
весы лабораторные общего назначения с метрологическими характеристиками по ГОСТ 24104* с наибольшим пределом взвешивания 1 кг, 4-го класса точности (для взвешивания продукта);
_____________
* С 01.07.2002 г. вводится в действие ГОСТ 24104-2001.
микроскоп световой биологический с увеличением 900-1000 ;
петля бактериологическая;
поплавки (трубки Дархема);
стекла предметные по ГОСТ 9284;
термостат с диапазоном рабочих температур 28-55 °С, позволяющий поддерживать заданную температуру с допустимой погрешностью ±1 °С.
бриллиантовый зеленый;
генцианвиолет;
желчь говяжья сухая или натуральная;
метиловый фиолетовый;
феноловый красный.
3.2 Для проведения испытания применяют питательные среды:
агар лактозный с бриллиантовым зеленым и феноловым красным;
бульон лактозный с бриллиантовым зеленым и желчью;
бульон Мак-Конки;
бульон Кесслер;
среду Эндо.
4 Подготовка к испытанию
4.1 Приготовление растворов
4.1.1 Щелочной раствор бромкрезолового пурпурного концентрацией 10 г/дм : 1 г бромкрезолового пурпурного переносят в фарфоровую ступку с 19 см раствора гидроокиси натрия (NaOH)=0,1 моль/дм и после растворения добавляют 80 см дистиллированной воды.
4.1.2 Раствор бриллиантового зеленого концентрации 5 г/дм : 0,5 г бриллиантового зеленого переносят в фарфоровую ступку и постепенно растворяют в дистиллированной воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят дистиллированной водой до метки.
4.1.3 Раствор генцианвиолета или кристаллического фиолетового, или метилового фиолетового концентрацией 10 г/дм : 1 г одной из анилиновых красок переносят в фарфоровую ступку и постепенно растворяют в дистиллированной воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят дистиллированной водой до метки.
4.1.4 Раствор фенолового красного концентрации 2 г/дм : 0,2 г фенолового красного переносят в фарфоровую ступку и постепенно растворяют в дистиллированной воде. Раствор переливают в мерную колбу вместимостью 100 см и доводят дистиллированной водой до метки.
4.1.5 Растворы, приготовленные по 4.1.1-4.1.4, хранят в закрытых сосудах из темного стекла при комнатной температуре не более 3 мес.
4.1.6. Растворы и реактивы для окраски по Граму готовят по ГОСТ 10444.1.
4.2 Приготовление питательных сред
4.2.1 Агар лактозный с бриллиантовым зеленым и феноловым красным: 3,0 г мясного экстракта, 10,0 г пептона, 10,0 г лактозы, 5,0 г хлористого натрия, 0,5 г фосфорнокислого двузамещенного калия, 15,0 г агара добавляют к 1000 см дистиллированной воды. При отсутствии мясного экстракта допускается использовать вместо мясного экстракта, пептона и дистиллированной воды мясопептонный бульон по ГОСТ 10444.1. Смесь нагревают до полного растворения компонентов, охлаждают до 45-55 °С, устанавливают рН так, чтобы после стерилизации она составляла при 25 °С (7,0±0,1). Среду стерилизуют в течение 20 мин при температуре (115±1) °С, затем охлаждают до 45-55° и прибавляют 40 см раствора фенолового красного, приготовленного по 4.1.4, и 2 см раствора бриллиантового зеленого, приготовленного по 4.1.2, тщательно перемешивают и разливают в стерильные чашки Петри, колбы или флаконы.
4.2.2 Бульон лактозный с бриллиантовым зеленым и желчью: 10,0 г пептона, 5,0 г лактозы, 6,45 г двузамещенного фосфорнокислого безводного натрия, 2,0 г однозамещенного фосфорнокислого безводного калия, 20,0 г сухой говяжьей желчи или 200 см натуральной желчи, 3 см раствора бриллиантового зеленого, приготовленного по 4.1.2, добавляют к 1000 см дистиллированной воды (в случае использования натуральной желчи к 800 см дистиллированной воды), тщательно перемешивают, нагревают на слабом огне до кипения, кипятят 1-2 мин, фильтруют через ватно-марлевый фильтр, охлаждают до 45-55 °С и устанавливают рН таким образом, чтобы она составляла при 25 °С (7,2±0,1), после чего среду вновь доводят до кипения. Среда не подлежит стерилизации в автоклаве, ее разливают с соблюдением правил асептики по 10 см в стерильные пробирки с поплавками или по 100 см в колбы.
4.2.3 Бульон Мак-Конки: 20,0 г пептона, 10,0 г лактозы, 5,0 г хлористого натрия, 5,0 г сухой говяжей желчи или 50 см натуральной желчи, 1 см раствора бромкрезолового пурпурного, приготовленного по 4.1.1, добавляют к 1000 см дистиллированной воды (в случае использования натуральной желчи к 950 см дистиллированной воды), нагревают на слабом огне до кипения, кипятят 1-2 мин, фильтруют через ватно-марлевый фильтр, охлаждают до 45-55 °С и устанавливают рН таким образом, чтобы после стерилизации она составляла при 25 °С (7,2±0,1). Среду разливают по 10 см в пробирки с поплавками или в колбы по 100 см и стерилизуют 15 мин при температуре (121±1) °С.
4.2.4 Среда Кесслер: 10,0 г пептона, 2,5 г лактозы, 5,0 г сухой говяжьей желчи или 50 см натуральной желчи, 2 см раствора генцианвиолета или кристаллического фиолетового, или метилового фиолетового, приготовленного по 4.1.3, добавляют к 1000 см дистиллированной воды (в случае использования натуральной желчи к 950 см дистиллированной воды), тщательно перемешивают, нагревают на слабом огне до кипения, кипятят 1-2 мин, фильтруют через ватно-марлевый фильтр, охлаждают до 45-55 °С, устанавливают рН таким образом, чтобы после стерилизации она составляла при 25 °С (7,3±0,2). Среду разливают по 10 см в пробирки с поплавками или в колбы по 100 см и стерилизуют 20 мин при температуре (115±1) °С,
4.2.5 Среда Эндо: выпускается Дагестанским НПО "Питательные среды" и готовится по прописи, указанной на этикетке.
4.2.6 Жидкие среды двойной концентрации готовят по 4.2.2-4.2.4, но при приготовлении берут удвоенную массу (объем) ингредиентов, кроме дистиллированной воды, и разливают в посуду с учетом последующего количества добавляемого жидкого продукта.
5 Проведение испытания
5.1 Посевы для определения количества колиформных бактерий
5.1.1 Из навески продукта готовят исходное и ряд десятикратных разведений по ГОСТ 26669 так, чтобы можно было определить в 1 г (см ) продукта предполагаемое количество колиформных бактерий или их количество, указанное в нормативном документе на конкретный продукт.
5.1.2 При определении количества колиформных бактерий посевом на агазированные селективно-диагностические среды по 0,1 или 0,2 см навески продукта или его разведения наносят на поверхность одной из сред, приготовленных по 4.2.1 или 4.2.5 и разлитых в две параллельные чашки Петри. Подготовку чашек Петри со средой к посеву и посев проводят по ГОСТ 26670.
При применении метода мембранных фильтров по ГОСТ 26670 фильтры переносят на поверхность агаризованной селективно-диагностической среды, избегая образования пузырьков воздуха между средой и фильтром. Поверхность фильтра с осевшими на ней бактериями должна быть обращена вверх.
При определении количества колиформных бактерий посевом в агаризованные селективно-диагностические среды по 1 см навески продукта или его разведения вносят в две параллельные чашки Петри. Посевы заливают по ГОСТ 26670 на поверхность одной из агаризованных сред, приготовленных по 4.2.1 или 4.2.5.
5.1.3 При определении количества колиформных бактерий по методу НВЧ высевают три последовательные навески продукта и (или) его разведения, отличающиеся по количеству продукта в них в 10 раз.
Каждую навеску продукта и (или) его разведение в трехкратной повторности высевают в колбы или пробирки с одной из питательных сред, приготовленной по одному из следующих пунктов: 4.2.2, 4.2.3, 4.2.4.
Соотношение между количеством высеваемого продукта или его разведения и питательной средой 1:9, а для сред двойной концентрации - 1:1.
5.2 Посев для выявления колиформных бактерий в определенной навеске продукта
При выявлении колиформных бактерий в определенной навеске продукта или его эквивалентном разведении эту навеску или разведение вносят в одну из питательных сред, приготовленную по одному из следующих пунктов 4.2.2, 4.2.3, 4.2.4. Соотношение между количеством высеваемого продукта или его эквивалентным разведением и питательной средой 1:9, а для сред двойной концентрации - 1:1.
5.3 При испытании высококислотных продуктов для предотвращения резкого снижения рН (на 0,5 и более) питательных сред при внесении в них продукта или его разведений рН питательных сред доводят до допустимых значений с помощью стерильного раствора гидроокиси натрия, приготовленного по ГОСТ 10444.1, или при приготовлении питательных сред рН устанавливают выше заданного с учетом ее последующего снижения при внесении продукта. Количество добавляемого раствора гидроокиси натрия или величину, на которую необходимо увеличить рН при приготовлении питательных сред, устанавливают опытным путем.
5.4 Посевы на агаризованных и жидких средах инкубируют при температуре (36±1) °С в течение 24-48 ч. Чашки Петри с посевами инкубируют дном вверх. Посевы просматривают через (24±3) ч, отмечают положительные посевы в жидкие среды, а окончательный учет проводят через (48+3) ч.
Положительными считают посевы в жидкие среды, в которых имеет место интенсивный рост микроорганизмов, проявляющийся в помутнении среды, образовании газа, подкислении среды (то есть изменении цвета среды).
5.5 При необходимости, для подтверждения принадлежности микроорганизмов, выросших на жидких средах, к колиформным бактериям делают пересевы по ГОСТ 26670 на поверхность одной из агаризованных селективно-диагностических сред, приготовленных по 4.2.1 или 4.2.5. Посевы инкубируют при температуре (36±1) °С в течение (24±3) ч.
5.6 Посевы на агаризованных средах по 5.1 и 5.5 после инкубирования просматривают и отмечают рост характерных колоний.
На агаре лактозном с бриллиантовым зеленым и феноловым красным колиформные бактерии образуют ярко-желтые колонии диаметром 2-4 мм с желтой прозрачной зоной диаметром 1-3 мм вокруг колонии.
На среде Эндо колиформные бактерии образуют колонии бледно-розового или красного цвета, часто с металлическим блеском.
В посевах по 5.1.2 отбирают чашки, на которых выросло от 15 до 150 характерных колоний. При посеве методом мембранных фильтров на них подсчитывают количество колоний и в том случае, если их менее 15.
5.7 При необходимости подтверждения принадлежности выросших микроорганизмов к колиформным бактериям из чашек Петри с посевами по 5.1 и 5.5 отбирают не менее чем по пять колоний. Из каждой отобранной колонии приготавливают мазки и окрашивают по Граму (по ГОСТ 30425).
Колиформные бактерии являются грамотрицательными палочками.
6 Обработка результатов
6.1 Результаты оценивают по каждой пробе отдельно.
6.2 К колиформным бактериям относят аэробные и факультативно-анаэробные не образующие спор грамотрицательные палочки, сбраживающие лактозу с образованием кислоты и газа.
6.3 При определении НВЧ или при выявлении колиформных бактерий в определенной навеске продукта посевы в жидких средах считают положительными, если при последующем пересеве и подтверждении характерных колоний хотя бы в одной колонии будут обнаружены колиформные бактерии.
НВЧ колиформных бактерий в 1 г (см ) продукта определяют по количеству положительных колб (пробирок) по ГОСТ 26670.
6.4 Если при подтверждении характерных колоний в 80% случаев, то есть не менее чем в 4 из 5 колоний, подтвержден рост колиформных бактерий, то считают, что все характерные колонии, выросшие на чашке Петри (см. п.5.6), принадлежат к колиформным бактериям. В остальных случаях количество колиформных бактерий определяют, исходя из процентного отношения подтвержденных колоний к общему количеству характерных колоний, взятых для подтверждения.
Пересчет количества колиформных бактерий, определенного посевом в или на агаризованные среды, на 1 г (см ) продукта проводят по ГОСТ 26670.
6.5 Результаты определения количества колиформных бактерий и выявления их в определенной навеске продукта записывают по ГОСТ 26670.
Средства для стирки. Общие технические условия
Товары бытовой химии в аэрозольной упаковке. Общие технические условия
Приобретая в супермаркетах, на рынке и централизованных точках продажи мясо, молоко, рыбу, консервы, мы хотим быть уверенными, в том они соответствуют санитарно-эпидемиологическим нормам. Как происходит контроль над качеством продукции по ГОСТу?
Представители группы БГКП
Выявление БГКП (бактерий группы кишечной палочки) происходит в результате исследования в лабораторных условиях с применением косвенных методов. Что это за группа бактерий и какова их морфология?
Бактерии этого рода включают в себя более 100 представителей, местом обитания которых является воздух, почва, кишечник живых организмов. Они опасны для человека тем, что долгое время могут находиться в почве, воде и погибают только при температуре 60 0 С при нагревании в течение 15 минут. ГОСТом установлены нормы, при которых показатель этой группы считается допустимым. При обсемененности бактериями выше установленного показателя или при наличии патогенных представителей этой группы возможны пищевые отравления.
К представителям БГКП относят такие виды:
- Эшерихиозы. Данный вид обладает высокой устойчивостью к неблагоприятным условиям и способен сохранять жизнеспособность в молоке до 35 дней, на предметах обихода от 3 до 5 месяцев. Попадает в организм через воду, пищу, грязные руки. Особенно к нему восприимчивы маленькие дети и люди с ослабленным иммунитетом.
- Клебсиеллы. Распространены в почве, воде, зерне, в овощах. Выделяются в молоке и питьевой воде. Являются возбудителями заболеваний верхних дыхательных путей, суставов и урогенитальных органов.
Нормы ГОСТа
Нормы ГОСТа распространяются на все продукты питания. При санитарной экспертизе на наличие патогенных микроорганизмов применяют косвенные методы, которые позволяют выявить уровень содержания патогенных микроорганизмов. Чем выше этот уровень, тем вероятнее заражение человека инфекционными заболеваниями.
Существует два микробиологических показателя, по которым проводится экспертиза пищевых продуктов.
1. КМАФАнМ ─ это показатель общей обсемененности продуктов. Высокий процент показателей КМАФАнМ (различная группа микроорганизмов на поверхности пищевых продуктов) говорит о таких нарушениях:
- плохой термической обработке продуктов;
- неправильном хранении и транспортировке;
- отсутствии дезинфекции оборудования.
КМАФАнМ определяют в молоке и молочных продуктах, где не применяются специальные закваски. Для выявления КМАФАнМ в молоке используют специальные питательные среды на основе мясопептонного агара.
2. Показатель БГКП является индикатором загрязнения воды, почвы через выделения человека. В ГОСТах обозначается масса изделия и допустимые нормы обнаружения БГКП. Чтобы определить количество бактерий рода кишечной палочки, применяют среду Кесслера, а их опознание проводят с применением среды Эндо.
Индекс чистоты питьевой воды характеризуется коли-титром и коли-индексом. Титр является основным при определении показателей чистоты воды. При присутствии кишечной палочки в 1 мл воды она считается относительно пригодной для питья. Коли-индекс ─ нахождение кишечной палочки в 1 л воды. Индекс присутствия кишечной палочки, согласно ГОСТу 2874-82, не должен превышать 3. Коли-индекс выше нормы свидетельствует о загрязнении питьевой воды отходами жизнедеятельности живых организмов.
Методы выявления микроорганизмов в мясе
Для исследования на наличие КМАФАнМ на мясе применяют метод смыва. Берется кусок мяса или тушка птицы и помещается в стерильный пакет. Туда наливают стерильную воду и встряхивают пакет с содержимым несколько раз. В результате смывов получается исходный материал, который в дальнейшем применяют для определения наличия микроорганизмов. Результатом исследования является количество микроорганизмов на 1 мл смыва. В соответствии с нормами с применением метода смыва в мясе индекс общего количества микроорганизмов не должен превышать 10 тысяч КОЕ/г.
Установление БГКП основано на методе высева материала в среду Кесслера (лактозосодержащая среда). Посевы выращивают в течение 2 суток и после по морфологическим признакам определяют тип бактерий.
На крупных предприятиях по переработке мяса, молока, рыбы существуют свои лаборатории, где осуществляют контроль над качеством выпускаемой продукции, определяют уровень БГКП и общее обсеменение бактериями. При отсутствии возможности проверять продукцию непосредственно в местах ее выпуска пробы сдают в другие специализированные лаборатории.
Образование высшее филологическое. В копирайтинге с 2012 г., также занимаюсь редактированием/размещением статей. Увлечения — психология и кулинария.
Читайте также:


