Кишечная палочка окрашивание по граму
1. На фиксированный мазок нанести карболово-спиртовой раствор генцианового фиолетового через полоску фильтровальной бумаги. Через 1—2 мин ее снять, а краситель слить.
2. Нанести раствор Люголя на 1—2 мин.
3. Обесцветить этиловым спиртом в течение 30—60 с до прекращения отхождения фиолетовых струек красителя.
4. Промыть водой.
5. Докрасить водным раствором фуксина в течение 1—2 мин, промыть водой, высушить и микроскопировать.
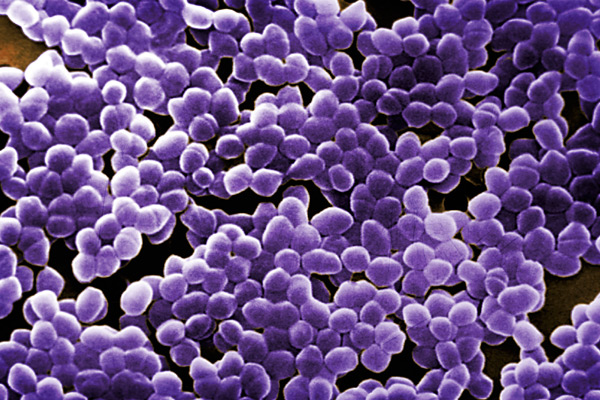
Грамположительные бактерии окрашиваются в темно-фиолетовый цвет, грамотрицательные — в красный (рис. 2.2.1; на вклейке). В основе этого метода лежит избирательное обесцвечивание — удаление комплекса генцианового фиолетового с
йодом под действием спирта. Результат окраски по методу Грама определяется особенностями строения и химического состава клеточной стенки бактерий и зависит от способности удерживать образовавшийся в процессе окраски комплекс ген-цианового фиолетового с йодом.
Фирмикутные бактерии окрашиваются грамположительно, поскольку имеют многослойный пептидогликан, связанный с тейхоевыми кислотами. Последние обусловливают прочную фиксацию красителя и резистентность к обесцвечиванию спиртом. Грациликутные бактерии окрашиваются грамотрица-тельно.
Окраска по методу Грама имеет важное дифференциально-диагностическое значение и широко используется в микробиологии. К грамположительным бактериям относятся стафилококки, стрептококки, коринебактерии дифтерии и др., к грам-отрицательным — гонококки, менингококки, кишечная палочка и др. Некоторые виды бактерий (клостридии, гарднереллы) могут окрашиваться по методу Грама вариабельно в зависимости от возраста культуры, особенностей культивирования и других факторов, воздействующих на структуру клеточной стенки.
Основная ошибка, допускаемая при окраске по методу Грама, заключается в "переобесцвечивании" мазка этиловым спиртом. Грамположительные бактерии при этом могут утрачивать первоначальную окраску генциановым фиолетовым и приобретать красный цвет (характерный для грамотрицатель-ных бактерий) в результате последующей докраски мазка фуксином. Грамотрицательные бактерии в свою очередь могут сохранять сине-фиолетовый цвет генцианового фиолетового. Для правильной окраски следует строго соблюдать технику обесцвечивания.
Окраска кислотоустойчивых бактерий по методу Циля—Нильсена
1. На фиксированный мазок нанести карболовый раствор фуксина через полоску фильтровальной бумаги и подогреть 3—5 мин до появления паров.
2. Снять бумагу, промыть мазок водой.
3. Нанести 5 % раствор серной кислоты или 3 % раствор смеси спирта с хлористоводородной кислотой на 1 —2 мин для обесцвечивания.
4. Промыть водой.
5. Докрасить мазок водным раствором метиленового синего в течение 3—5 мин.
6. Промыть водой, высушить и микроскопировать.
В основе метода лежат протравливание (разрыхление) клеточной стенки бактерий для усиления поглощения красителя и избирательное обесцвечивание под действием кислоты. Кис-лотоустойчивость бактерий обусловлена особым строением их клеточной стенки с повышенным содержанием липидов: раз-
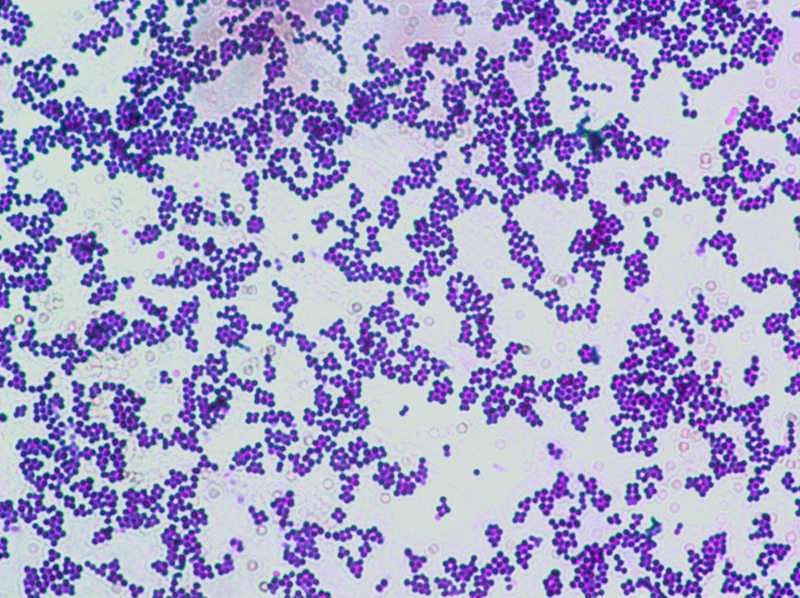
ветвленных жирных кислот (миколовых кислот), глико- и фос-фолипидов, восков. Клеточная стенка кислотоустойчивых бактерий имеет очень низкую проницаемость, поэтому они плохо воспринимают красители. Раствор карболовой кислоты разрыхляет клеточную стенку и тем самым повышает ее тинк-ториальные свойства, а высокая концентрация красителя и нагревание в процессе окраски усиливают реакцию взаимодействия красителя с бактериальными клетками, которые при этом окрашиваются в красный цвет. При обработке препарата серной кислотой некислотоустойчивые бактерии обесцвечиваются и в дальнейшем окрашиваются метиленовым синим в голубой цвет, а кислотоустойчивые бактерии остаются окрашенными фуксином в красный цвет (рис. 2.2.2; на вклейке).
Не нашли то, что искали? Воспользуйтесь поиском:
Окрашивание по Граму широко распространено в микробиологии, так как это один из самых простых способов дифференциации бактерий в зависимости от состава их клеточной стенки. По Граму все бактерии можно разделить на грамположительные (Грам(+)) и грамотрицательные (Грам(-)). Метод окрашивания по Граму был разработан в 1884 году, и с того времени не утратил популярности, хотя и неоднократно модифицировался.

Структура клеточной стенки
Окрашивание по Граму позволяет выявить, к грамположительным или грамотрицательным относится та или иная бактерия. Деление бактерий на Грам(+) и Грам(-) осуществляется в соответствие со строением их клеточной стенки.
Клеточная стенка в наибольшем количестве содержит пептидогликан (муреин) - сложное вещество, в состав которого входят пептапептид и гликан. Гликан состоит из чередующихся остатков N-ацетилглюкозамина и N-ацетилмурамовой кислоты, соединенных друг с другом β-1,4-гликозидными связями. Пептидогликан обеспечивает поддержание формы клетки, осмотическую защиту, а также антигенные функции.
Основные различия грамположительных и грамотрицательных бактерий
У различных бактерий толщина слоя пептидогликана не одинакова. У бактерий, которые относят к грамположительным, она составляет от 15 до 80 нм, в то время как у грамотрицательных - от 2 до 8 нм. В то же время у грамотрицательных бактерий под слоем пептидогликана есть особая структура, которой нет у грамположительных бактерий - периплазматическое пространство. Это пространство заполнено гидролитическими ферментами - β-лактамазой, рибонуклеазой 1, фосфатазой. Именно эти ферменты ответственны за резистентность грамотрицательных бактерий в отношении многих антибиотиков.
Слой пептидогликана Грам(-) бактерий связан с липополисахаридом - антигенной структурой, содержащей эндотоксин. У Грам(+) бактерий похожие функции выполняют тейхоевые кислоты.
У грамотрицательных бактерий присутствует дополнительная структура - внешняя мембрана.
Суть метода окрашивания
Перед тем как начать окрашивание, готовят мазки исследуемых бактерий. Для этого на предметное стекло капают воду и бактериальной петлей добавляют туда культуру микроорганизмов. Затем, после полного высыхания воды, мазок фиксируют - предметное стекло проносят несколько раз над пламенем горелки. Окрашивание мазков по Граму более эффективно, чем окрашивание живых бактерий - с мертвыми клетками лучше связываются молекулы красителя.
Окрашивание производится в несколько этапов:
- На фиксированный мазок накладывают небольшие кусочки фильтровальной бумаги и наливают основной краситель - генцианвиолет или метиленовый синий.
- Спустя 3-5 минут снимают окрашенную фильтровальную бумагу и заливают мазок раствором Люголя на 1 минуту. При этом препарат темнеет.
- Сливают раствор Люголя и обрабатывают мазок чистым этиловым спиртом: капают несколько капель на препарат, спустя 20 секунд сливают. Процедуру повторяют 2-3 раза.
- Промывают стекло с исследуемым препаратом дистиллированной водой.
- Производят дополнительное окрашивание - докрашивают препарат фуксином. Спустя 1-2 минуты краситель смывают.
- После высыхания воды изучают мазок под микроскопом. Грамположительные бактерии будут иметь сине-фиолетовый цвет, грамотрицательные - розовый или красный.

Причины различного характера окрашивания
Как было описано выше, при окрашивании бактерий по Граму грамположительные бактерии окрашиваются в сине-фиолетовый цвет, а грамотрицательные - в красный или розовый. Причина дифференциального окрашивания бактерий по этому методу состоит в том, что после попадания в клетку растворимой формы генцианвиолета краситель переходит в нерастворимую йодную форму. Во время обработки бактерии этиловым спиртом под действием этого неполярного растворителя из мембраны экстрагируются липиды. После этого мембрана становится пористой и больше не является существенным препятствием для вымывания красителя. Однако пептидогликан более устойчив к действию неполярных растворителей, в том числе и спирта. Именно он препятствует вымыванию красителя, поэтому бактерии с толстым муреиновым слоем окрашиваются в сине-фиолетовый цвет (грамположительно), и после обработки спиртом свой цвет не меняют.

Тонкий муреиновый слой грамотрицательных бактерий не может удержать в клетке молекулы красителя, поэтому после действия спирта они становятся бесцветными - окрашиваются грамотрицательно.
После воздействия на мазок фуксином при окрашивании по Граму грамположительные бактерии остаются сине-фиолетовыми, а грамотрицательные приобретают розово-красный оттенок.

Примеры Грам(+) и Грам(-) бактерий
К грамотрицательным относятся цианобактерии, серобактерии, железобактерии, хламидии, риккетсии, уксусные бактерии, многие метилобактерии, тионовые бактерии, арсенитобактерии, карбоксидобактерии.
Грамположительными являются бифидобактерии, многие водные бактерии, стрептококки и стафилококки.
Для этого надо знать:
1. Окраска по Граму имеет важное дифференциально-диагностическое значение при исследовании бактерий и широко используется в микробиологии. Различают грамположительные и грамотрицательные бактерии.
2. Сущность окраски по Граму. Различное отношение бактерий к окраске по Граму определяется различным строением и химическим составом клеточной стенки грамположительных и грамотрицательных бактерий.
Т.к. грамположительные бактерии содержат в клеточной стенке мало липидов, красители хорошо впитываются клеточной стенкой, при этом комплекс генцианового фиолетового и йода прочно связывается с большим количеством пептидогликана и присутствующими тейхоевыми кислотами. После обработки спиртом поры в клеточной стенке суживаются, что задерживает красители, и клеточная стенка приобретает сине-фиолетовую окраску.
К грамположительным бактериям относятся стафилококки, стрептококки, коринебактерии дифтерии, микобактерии туберкулеза, бациллы сибирской язвы, клостридии столбняка, ботулизма, газовой гангрены, актиномицеты.
Из-за большого содержания липидов в клеточной стенке грамотрицательных бактерий, она менее проницаема для красителей, а вследствие меньшего содержания пептидогликана и отсутствия тейхоевых кислот образуется менее прочный комплекс этих соединений с генциановым фиолетовым и йодом. После же обработки спиртом поры в клеточной стенке остаются широкими, и комплекс генцианового фиолетового с йодом вымывается, а при последующей окраске фуксином клеточная стенка приобретает красный цвет.
К грамотрицательным бактериям относятся гонококки, менингококки, кишечная палочка, сальмонеллы, шигеллы, холерный вибрион, спирохеты, риккетсии, хламидии.
3. Способность окрашиваться по Граму – достаточно постоянный видовой признак, но некоторые виды бактерий окрашиваются по Граму вариабельно, что зависит от возраста, особенностей культивирования и др. факторов, изменяющих структуру клеточной стенки.
4. Техника окраски по Граму.На фиксированный мазок накладывают бумажки, пропитанные генциановым фиолетовым, и заливают небольшим количеством воды. Окраску проводят 2 мин., затем бумажку удаляют пинцетом. Не промывая препарат водой, сливают краску и наносят раствор Люголя на 30-60 с. до почернения препарата, затем раствор Люголя сливают. Не промывая водой, погружают препарат в 96 % этанол на 20-30 с. до отхождения фиолетовых струй краски. Препарат тщательно промывают водой для удаления спирта. Окрашивают мазок водным фуксином 2 мин. Промывают водой до тех пор, пока струи воды не станут бесцветными. Высушивают препарат фильтровальной бумагой.
Задача 8. ОХАРАКТЕРИЗОВАТЬ СТРОЕНИЕ И ЗНАЧЕНИЕ КАПСУЛ У БАКТЕРИЙ, МЕТОДЫ ИХ ОКРАСКИ.
Для этого надо знать:
1. Некоторые бактерии (как сапрофиты, так и паразиты) способны создавать снаружи клеточной стенки скопление слизистого вещества.
2. Если слизистый слой достаточно толст, имеет определенную форму и четко очерченные границы, то его называют капсулой. Капсула прочно связана с клеточной стенкой и имеет упорядоченное фибриллярное строение.
3. Многие бактерии образуют микрокапсулу – слизистое образование, выявляемое при электронной микроскопии.
4. От капсулы следует отличать слизь – малоструктурное слизистое образование, не имеющее четких внешних границ. Слизь состоит из мукоидных экзополисахаридов, их еще называют гликокаликсом; он участвует в прилипании к субстрату.
5. У большинства бактерий капсула состоит из гомо- или гетерополисахаридов, а у некоторых – из полипептидов, образованных Д-глутаминовой кислотой (бациллы сибирской язвы, возбудители чумы).
6. Полисахариды капсулы синтезируются бактериями при действии внеклеточных ферментов на дисахариды, или их компоненты образуются внутри клетки, а затем секретируются на поверхность клетки.
7. Капсула – это необязательная структура, ее образование происходит при определенных условиях среды. Патогенные бактерии образуют капсулу внутри организма хозяина (например, пневмококки, бациллы сибирской язвы) и утрачивают это свойство при культивировании на питательных средах. Бактерии кишечно-тифозной группы образуют капсулу при низкой температуре (10-20° С) и при наличии сбраживаемых углеводов.
Для некоторых бактерий образование капсулы является постоянным признаком (группа "капсульных бактерий").
8. Капсулы для бактерий являются полезным образованием. Они предохраняют от повреждений, высыхания, т.к. гидрофильны и хорошо связывают воду. Благодаря своей гидрофильности капсула препятствует фагоцитозу патогенных бактерий в макроорганизме. Образование капсулы – есть признак вирулентности этих бактерий.
Капсулы бактерий не нарушают их обмена веществ, т.к. капсульный слой не препятствует проникновению веществ из внешней среды и обратно.
9. Капсулы выявляются при специальных методах окраски. Для этого используются методы Бурри и Бурри-Гинса, создающие негативное контрастирование вещества капсулы. На край предметного стекла помещают каплю разбавленного водой (1:1) карболового фуксина Циля, в которую вносят петлей исследуемую культуру. Через 2-3 мин. к ней добавляют каплю туши, тщательно перемешивают и готовят препарат "мазка крови". Мазок полностью высушивают на воздухе и микроскопируют в иммерсионной системе. Клетки окрашиваются в красный цвет, капсулы бесцветные, тушь создает темный фон.
ЗАНЯТИЕ № 2. ТЕМА: СТРУКТУРА БАКТЕРИАЛЬНОЙ КЛЕТКИ (ПРОДОЛЖЕНИЕ). характеристика необязательных структур бактериальной клетки. СЛОЖНЫЕ МЕТОДЫ ОКРАСКИ: МЕТОД ЦИЛЯ-НИЛЬСЕНА, МЕТОД ОЖЕШКИ. ВЫЯВЛЕНИЕ ЖГУТИКОВ.
Дата добавления: 2018-05-09 ; просмотров: 264 ;
В микробиологии окраска по Граму имеет большое значение. Ее применяют для диагностики инфекционных заболеваний, выявления патогенности бактерий. Метод позволяет определить сходные по форме и размеру бактерии, которые относятся к различным видам и родам.
Особенности окраски
Окраска бактерий по Граму – сложный метод, в котором применяют два вида окраса: основной и дополнительный. В процессе выполнения манипуляции применяют обесцвечивающие вещества, к которым относятся спирты и кислоты.
Вам будет интересно: Какая у вас степень владения языком?
В микробиологии окраску по Граму проводят трифенилметановой группой красителей. К ней относятся генциановые, метиловый синий, кристаллвиолет. Разные виды бактерий дают разные окрасы, образуя прочные соединения с красителями.

Окрасы
В микробиологии окраска по Граму бывает двух видов: грамположительная и грамотрицательная. В первом случае микроорганизмы дают прочные соединения с красителями и йодом. Во время анализа они не обесцвечиваются при воздействии со спиртом, из-за чего не изменяют своего первоначального фиолетового оттенка.
Грамотрицательные окрасы образуются при воздействии с йодом и легко разрушаются под действием йода. В результате микробы обесцвечиваются, а затем приобретают красный оттенок.
Подготовка материала
По правилам микробиологии, окраска по Граму требует предварительной подготовки материалов. Его необходимо распределить тонким слоем по поверхности стекла. Затем мазок подсушивают и после полного высыхания фиксируют. При этом мазок закрепляется на стекле, что позволяет исключить смывание бактерий красителями. К тому же мертвые микроорганизмы окрашиваются лучше, чем живые.
После подготовки материала подбирают метод окрашивания: физический или химический. Первый предполагает воздействие высокой температуры на микробную клетку. Во время химического способа применяют различные химические вещества, которые вызывают коагуляцию протеинов цитоплазмы.
Подготавливают набор для окраски по Граму, предметные стекла с бактериями. Их берут пинцетом или аккуратно пальцами за ребра мазком вверх, затем проводят пару раз над верхом пламени горелки. Процесс должен занимать пару секунд.
Процесс фиксации химическим методом предполагает использование ацетона, спирта, специальных смесей, жидкость Карнуа. Предметное стекло с высушенным мазком погружают в фиксирующее вещество на пятнадцать минут, затем просушивают на воздухе.
Окрашивание
Окраска мазков по Граму проводится по определенному алгоритму.
Чтобы определить, есть ли в мазке грамотрицательные бактерии, проводят дополнительно окрашивание фуксином или сафранином. Препараты наносят на две минуты. В конце процедуры стекло промывают, высушивают.
Результаты
Все грамположительные микроорганизмы окрашиваются в темно-фиолетовый цвет, а грамотрицательные – в красный. Шарообразные формы обычно относятся к грамположительным видам, а извитые формы – отрицательно окрашиваются. Палочковидные бактерии могут быть грамотрицательными и грамположительными.
Чтобы получить максимально достоверные результаты исследований, рекомендуется применять суточные культуры, а также свежеприготовленные растворы для окрашивания.
Механизм окраски позволяет увидеть и оценить физико-химические особенности строения цитоплазмы, клеточные стенки грамположительных и грамотрицательных бактерий. У первых содержится много рибонуклеиновой кислоты, белков в цитоплазме, а в клеточных стенках – пептидогликана. Из-за этого во время обработки мазков генцианвиолетом и Люголем у грамположительных видов бактерий образуется прочное соединение ионов йода и красителя.
При обработке спиртами грамположительные микроорганизмы удерживают краситель, а грамотрицательные – обесцвечиваются и окрашиваются дополнительно разведенным фуксином в красный оттенок. Некоторые бактерии способны окрашиваться только на стадии роста.
Применение
Окраску по Граму проводят при анализе вида микроорганизмов в мазках из влагалища и слюны. Этот способ позволяет определить вид микроорганизмов в кале, в плевральной, перитонеальной жидкости и не только. Любые жидкости, где могут содержаться бактерии, исследуют данным методом. После проведения окрашивания врачи подбирают метод лечения, назначая препараты, способные воздействовать на грамположительные или грамотрицательные бактерии.
Наиболее широко в микробиологической практике применяется сложный метод окраски по Граму (предложен впервые в 1884 г. датским ученым X. Грамом). Метод является одним из важнейших опознавательных признаков при определении вида бактерий.
Сущность метода окраски по Граму заключается в том, что все бактерии по способности окрашиваться красителями (генциан-виолет или кристалл-виолет с йодом) делятся на две группы. К одной относятся бактерии, в клетках которых комплекс, образуемый указанными красителями, сохраняется после обработки их спиртом. Такие клетки в результате окраски приобретают темно-фиолетовый цвет и получили название грамположительных (грам+). Например, спорообразующие бактерии родов - Bacillus, Clostridium, среди бесспоровых – Lactobacillus, Micrococcus, Staphylococcus, Sarcina, Leuconostok и др.
К другой группе относятся виды, которые не способны удерживать красящий комплекс и обесцвечиваются при обработке спиртом. Их называют грамотрицательными (грам-). К числу их принадлежат многие виды неспорообразующих палочковидных бактерий, в т.ч. роды Pseudomonas, Escherichia, Salmonella, Proteus и др.
Способность или неспособность клеток удерживать красящий комплекс в настоящее время связывают с химическим составом и структурой клеточных стенок бактерий. В оболочках грам + бактерий содержится больше гликопептида муреина, полисахаридов и тейхоевые кислоты. Они имеют достаточно плотную многослойную структуру. В клетках грам+ бактерий генциан-виолет и йод образуют прочное соединение с цитоплазмой, которое не извлекается спиртом. Они сохраняют фиолетовый цвет генциан-виолета и при дополнительном окрашивании фуксином Пфейффера.
Оболочки грам- бактерий однослойны, в них отмечено высокое содержание липидов в виде липопротиидов и липополисахаридов. Грам- бактерии при обработке спиртом обесцвечиваются, т.к. у них генциан-виолет не фиксируется в цитоплазме. При дополнительном окрашивании фуксином клетки бактерий окрашиваются только в бледнорозовый цвет.
Грам+ отличаются от грам- не только своим отношением к окраске, но и рядом биологических свойств и особенностей. Большинство грам+ видов обладают повышенной устойчивостью к обезвоживанию, термической обработке, радиоактивным и другим типам излучений. В тоже время грам-бактерии более устойчивы к действию щелочей и протеолитических ферментов, а также антибиотиков.
Окраску по Граму используют при определении степени загрязнения пищевых продуктов посторонней, в т.ч. условно патогенной (кишечная группа) микрофлорой, для выяснения диапазона действия антибиотиков и др. целей. Следует учитывать, что некоторые виды бактерий будучи грам+ в молодом возрасте, в старых культурах не все интенсивно красятся по Граму. Поэтому для окраски следует брать односуточные или двухсуточные культуры и, кроме того, пользоваться для сравнения контрольными культурами (стандартами), отношение которых к окраске по Граму заранее известно.
Окраска по Граму проводится следующим образом:
1. На одном предметном стекле готовят три мазка из бактериальных культур: заведомо известной Грамположительной, исследуемой и заведомо известной Грамотрицательной.
2. Мазки высушивают и фиксируют пламенем.
3. Окрашивают карболовым раствором генциан-виолета в течение 1-2 мин.
4. Краску удаляют стряхиванием, на мазки наносят раствор Люголя (раствор J и КJ) и выдерживают 1-2 мин. до почернения мазка.
5. Сливают раствор Люголя и на препарат наносят несколько капель 96% спирта и слегка покачивая стекло, выдерживают его до осветления мазка. (20-30 сек).
Препарат немедленно промывают водой. От обработки мазка спиртом зависит результат всего окрашивания: при недостаточной обработку все бактерии сохраняют окрашивание, при излишней – все клетки обесцвечиваются.
6. Дополнительно окрашивают препарат фуксином Пфейффера (разведенный фуксин) в течение 2 мин.
7. Краску смывают, препарат подсушивают и смотрят с иммерсионным объективом 90х.
Если препарат приготовлен правильно, то в поле зрения видны грам + темно-фиолетовые клетки и рядом с ними хорошо различаются бледно-розовые грам- клетки.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Цель занятия. Усвоить правила отбора и пересылки патологического материала в лабораторию, а также освоить методику проведения бактериологического исследования патматериала.
Задание:
1. Сделать посев взвеси бактерий из пробирок на МПБ по 2 пробирки, МПА, МПЖ, среда
Левина, агар Эндо.
2. На засеянных пробирках и чашках Петри поставить № исходной культуры и поставить
3. Приготовить мазки из исходной культуры, окрасить по Граму, микроскопировать и
Материалы и оборудование. Пробирки со взвесью микробных культур, обозначенных цифрой (шифр),— бактерий Е. coli и Salmonella; питательные среды — МПБ, МПА, МПЖ в пробирках, среды с лактозой, глюкозой и индикатором, агар Эндо и агар Левина в чашках Петри, кровяной агар, пастеровские пипетки, реактивные бумажки для определения индола, среда с сернокислым железом для определения сероводорода.
Для демонстрации: таблица-схема хода исследования пат.материала на колибактериоз, а также биопрепараты.
Классификация:
Секция – 5, грамотрицательные факультативные анаэробы.
Вид – Escherichia coli (животные и человек), E.blatta (насекомые).
Возбудитель эшерихиозов (колибактериоза, отечной болезни свиней) - Е. coli (кишечная палочка). Колибактериоз - это остропротекающее инфекционное заразное заболевание молодняка разных видов животных (включая птиц и пушных зверей). Характеризуется, как правило, диареей (профузным поносом), обезвоживанием организма, депрессией, нарастающей слабостью и смертельным исходом. Колибактериоз протекает в трех формах: септической, энтеротоксемической и энтеритной. При последних двух формах сепсис отсутствует. Телята восприимчивы в первые часы и дни после рождения; поросята заболевают как в период новорожденности, так и после отъема. Кроме того, у поросят встречается еще одна форма эшерихиоза — отечная болезнь. Ягнята заболевают с первых дней после рождения до 5—6-месячного возраста. Птица поражается в основном в первые 2 - 4 месяца Взрослые животные колибактериозом не болеют, но являются бактерионосителями патогенных штаммов Е.coli. Кишечная палочка может быть также возбудителем эндометрита и мастита у коров.
Патологический материал. Для бактериологического исследования прижизненно в лабораторию направляют фекалии от больных животных. Для посмертной диагностики: свежий труп или трубчатая кость, доля печени с желчным пузырем, селезенка, почка, сердце у аорты, перевязанное лигатурой, брыжеечные лимфоузлы, отрезок тонкого отдела кишечника, перевязанного с двух сторон (упаковка отдельно от остального материала).
В лаборатории при вскрытии трупа теленка (поросенка, ягненка), помимо указанного материала, исследуют еще и головной мозг. Трупы (целиком) направляют в лабораторию в водонепроницаемой таре. Если не представляется возможным доставить материал в кратчайший срок (4 часа), его консервируют (кусочки органов) стерильным 30 %-ным водным раствором глицерина или 10 %-ным раствором NaCl. В лаборатории материал исследуют соблюдая правила асептики: проводят посевы на питательные среды — МПБ, МПА, среды Эндо или Левина. В пробирки со средами посевы проводят пастеровскими пипетками (2—3 капли), а на плотные питательные среды в чашках Петри материал наносят шпателем. Кроме того, посевы из печени, почки, лимфоузлов, селезенки и головного мозга осуществляют методом отпечатков на поверхности агара в чашках (Эндо и др.). Для этого, придерживая стерильным пинцетом, стерильными ножницами вырезают кусочек ткани, фламбируют его и разрезанной поверхностью касаются поверхности среды. Посевы помещают в термостат. После посевов из исследуемого материала готовят мазки-отпечатки из печени, селезенки, крови из сердца, фиксируют и окрашивают по Граму.
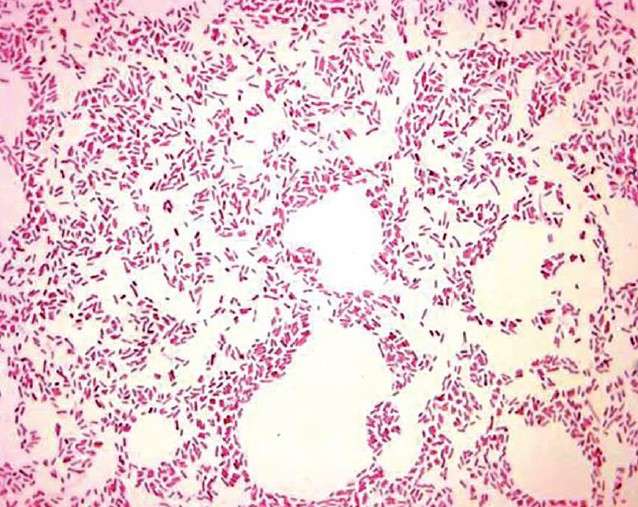
Рис.12 Кишечная палочка. Окраска по Граму.
После инкубирования засеянных пробирок и чашек Петри в термостате выросшие культуры бактерий вновь просматривают под микроскопом. Типичные колонии на средах Эндо (или Левина) пересевают для получения чистой культуры в пробирках с МПБ и МПА. Полученную чистую культуру пересевают на специальные дифференциально-диагностические среды для определения биохимических и антигенных свойств возбудителя колибактериоза (посредством РА), а также его патогенности (биопробой).
Культуральные свойства. Е.coli хорошо растет на всех широко используемых в лабораторной практике питательных средах. Оптимальная температура роста 37—38 0 С, рН среды 7,0—7,2. По типу дыхания — аэроб (и факультативный анаэроб). В жидкой среде рост эшерихий проявляется в виде равномерного помутнения среды с образованием легко разбивающегося осадка. На МПА через 16—20 ч вырастают влажные, круглые колонии с ровными краями и гладкой поверхностью, серовато-белого цвета. Существуют штаммы Е.coli, обладающие гемолитическими свойствами (вокруг колонии на кровяном агаре проявляется зона гемолиза). Для установления родовой и видовой принадлежности культур большое значение имеет выявление биохимических свойств. С этой целью чистую культуру высевают на ряд специальных сред. На среде Эндо в чашках Петри Е.coli образует 2 типа колоний: темно-вишневого цвета с металлическим блеском и малиново-красные с розовым ободком. На среде Левина колонии темно-фиолетовые или черные.
Ферментные (биохимические) свойства. Это объясняется тем, что кишечная палочка сбраживает лактозу, содержащуюся в среде, при этом образуется молочная кислота, под действием которой происходит восстановление цвета фуксина, также входящего в состав среды, но обесцвеченного сульфитом натрия. Глюкозные и лактозные среды с индикатором Е. coli сбраживает, и среда в пробирках становится розового или красного цвета. Встречаются лактозонегативные штаммы (сероварианты) Е. coli, не сбраживающие лактозу. Многие штаммы ферментируют маннит, дульцит. Е. coli образует индол, не образует H2S, дает положительную реакцию с метиловым красным (среда окрашивается в розово-красный цвет) и отрицательную реакцию Фогеса — Проскауэра (среда окрашивается в желтый цвет). Последние две пробы ставят с двухсуточной культурой, выращенной на среде Кларка (раствор пептона, глюкозы, двухфосфорнокислого калия в дистиллированной воде). В пробирку с культурой на среде Кларка пипеткой добавляют 5 капель спиртового раствора метилового красного, пробирку встряхивают. При ферментации глюкозы происходит розовое окрашивание, при отсутствии ферментации углевода — желтое окрашивание, отрицательный результат. В другой пробирке с культурой на среде Кларка проводят пробу Фогеса — Проскауэра: добавляют 0,2 мл 40 %-ного КОН и 0,5 мл 6 %-ного спиртового раствора альфа-нафтола, учитывают результат через 3—5 минут. Если культура сбраживает глюкозу с образованием ацетилметилкарбинола, последний с индикатором дает розовое окрашивание, положительный результат. На жидкой синтетической среде Козера и плотной среде Симмонса с индикатором бромтимолблау Е. coli не растет потому, что не усваивает цитратно-аммонийные соли сред. Е. coli желатину не разжижает, мочевину не расщепляет.
Родовую дифференциацию семейства Enterobacteriaceae проводят на основе культурально-морфологических и биохимических свойств бактерий. Учитывая, что биологические свойства разных штаммов эшерихий неодинаковы, в связи с их различной вирулентностью и антигенной структурой выделенную из исследуемого материала чистую культуру подвергают серологической типизации в РА, используя набор типоспецифических агглютинирующих 0-колисывороток.
Антигенное строение Е. coli. Клетка содержит три вида антигенов: О — соматический, К— оболочечный, капсульный и Н— жгутиковый. О-антиген термостабильный, расположен в клеточной стенке, состоит из липидо-полисахаридо-протеинового комплекса. К-антиген- это кислый полисахарид, реже протеины. Н-антиген- белковой природы, термолабильный.
Патогенность Е. coil (при проведении бактериологической диагностики) определяют внутрибрюшинным заражением молодых белых мышей массой 13— 15 г. Хотя белые мыши малочувствительны к Е. coli, но в большинстве случаев эти микробы, выделенные из органов трупов (или из фекалий) больных колиинфекцией животных, патогенны для мышей. Е. coli, выделенные от здоровых животных (и людей), обычно непатогенны. Патогенность для белых мышей зависит от вирулентности штамма, дозы вводимых бактерий, веса (возраста) мышей, метода заражения и индивидуальной иммунологической реактивности, а также от условий кормления и содержания.
Характеризуя биологические свойства Е. coli, следует отметить, что у патогенных штаммов отмечается продуцирование двух типов токсинов — термолабильного экзотоксина и термостабильного эндотоксина. Имеются штаммы Е. coli (как патогенные, так и непатогенные), продуцирующие антибиотические вещества — колицины, подавляющие рост некоторых других штаммов эшерихий и не действующие на бактерий других видов. Колицины термостабильны.
Помимо общепринятого метода микробиологической диагностики, используют и некоторые дополнительные ускоренные методы:
- реакция нейтрализации антител (РН),
- реакция пассивной гемагглютинации (РПГА), позволяющая обнаружить возбудителя болезни в фекалиях больных животных.
- люминесцентная серодиагностика – используют как ориентировочный метод для определения патогенных серотипов кишечной палочки при массовых вспышках желудочно-кишечных заболеваний. Этот метод позволяет в кратчайшие сроки получить предварительный результат.
Контрольные вопросы:
1. Патологический материал для бактериологической диагностики колибактериоза.
2. Морфология, тинкториальные и культурально-биохимические свойства Е. coli
3. Дифференциально-диагностические среды, применяемые для выделения и
идентификации Е. coli.
4. Патогенность Е. coli для лабораторных животных.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Читайте также:


