Кишечная палочка при сахарном диабете
КИШЕЧНАЯ МИКРОФЛОРА И САХАРНЫЙ ДИАБЕТ

МИКРОФЛОРА И ДИАБЕТ 1 ТИПА
Примечание: Диабет (сахарный диабет) классифицируется в медицине, как нарушение метаболизма. Подробнее об этом заболевании, а также о роли инсулина в развитии ожирения, повышающего в свою очередь риск возникновения диабета, см. по ссылке: "Диабет - расстройство метаболизма"
При диабете 1-го типа иммунная система ошибочно атакует клетки поджелудочной железы, производящие инсулин. В результате концентрация инсулина в крови падает, а уровень глюкозы растет. Хотя точная причина диабета 1-го типа остается не известной, ученые считают, что некоторые люди с особым набором генов больше подвержены развитию заболевания. Новые исследования показывают, что кишечные бактерии тесно связаны с развитием диабета.
Диабет 1 типа (T1D или СД1) - это аутоиммунное заболевание, характеризующееся иммуноопосредованным разрушением бета (β)-клеток. Генетические и экологические взаимодействия играют важную роль в сбое иммунной системы, вызывая агрессивный адаптивный иммунный ответ против β-клеток. Микробы, обитающие в кишечнике человека, тесно взаимодействуют с иммунной системой слизистой оболочки кишечника. Колонизация кишечной микробиоты и созревание иммунной системы происходят параллельно в первые годы жизни; следовательно, нарушения в микробиоте кишечника могут нарушать функции иммунных клеток и наоборот. Нарушения микробиоты кишечника (дисбиоз) часто выявляются у пациентов с СД1, особенно у тех, у кого диагностированы множественные аутоантитела в результате агрессивного и неблагоприятного иммунореагирования. Патогенез СД1 включает активацию аутореактивных Т-клеток, что приводит к разрушению β-клеток Т-лимфоцитами CD8 + . Становится также очевидным, что кишечные микробы тесно взаимодействуют с Т-клетками. Обнаружено, что устранение дисбактериоза кишечника с использованием специфических пробиотиков и пребиотиков связано со снижением аутоиммунного ответа (с уменьшением воспаления) и целостности кишечника (за счет повышенной экспрессии белков с плотным соединением в кишечном эпителии). В этом обзоре обсуждаются потенциальные взаимодействия между микробиотой кишечника и иммунными механизмами, которые участвуют в прогрессировании T1D, и рассматриваются потенциальные эффекты и перспективы применения модуляторов кишечной микробиоты, включая пробиотические и пребиотические вмешательства, при улучшении патологии T1D как у человека, так и у животных моделей. Подробнее см. статью по кнопке-ссылке:
Кишечные бактерии защищают от диабета. Предыстория.
Ученые обнаружили, что бактерии, живущие в кишечнике, играют большую роль в защите от сахарного диабета 1 типа. Этот эффект обусловлен сложным взаимодействием иммунитета и симбиотической кишечной микрофлоры .
Еще в 90-х было замечено, что у мышей, генетически предрасположенных к диабету 1 типа, это заболевание развивается с большей вероятностью, если животные растут в стерильных условиях. Группа исследователей из Университета Чикаго под руководством Александра Червонски (Alexander Chervonsky) решила изучить механизм этого явления. Для этого ученые лишили мышей, предрасположенных к диабету, гена белка MyD88 – ключевого регулятора иммунного ответа на симбиотическую микрофлору.
Оказалось, что мыши без гена MyD88 диабетом не заболевают. Однако если их выращивали в стерильных условиях, болезнь все же развивалась. Мыши, которым после выращивания в стерильных условиях вводили смесь кишечных бактерий, заболевали менее часто – 34% по сравнению с 80%. На основании полученных данных ученые предположили, что действие MyD88 снижает возможность бактерий предотвращать развитие диабета.
О роли кишечной микрофлоры в развитии сахарного диабета 1-го и 2-го типов см. по ссылке:
О роли кишечной микрофлоры в защите от развития сахарного диабета 1-го типа см. по ссылке:
О роли кишечной микрофлоры в здоровье проджелудочной железы:

В тонком кишечнике человека обитает огромное количество бактерий и других микроорганизмов, которые играют важную роль в сохранении и поддержании нашего здоровья. Они помогают переваривать пищу и снабжают нас энергией и витаминами.
Cимбиотические бактерии, обитающие в тонком кишечнике, предотвращают внедрение болезнетворных микроорганизмов. Биологические реакции, протекающие в нашем организме и поддерживающие постоянство его внутренней среды, зависят от населяющих тонкий кишечник бактерий и особенностей взаимодействия с ними клеток организма.
Одно из проведенных исследований указало на взаимосвязь между сосоянием микрофлоры тонкого кишечника и риском развития СД 1 типа:

Новое исследование было проведено под руководством профессора Джейне Данска (Jayne Danska) из Детской клиники при Университете Торонто ( Sick Children’s Hospital of the University of Toronto , Канада) и профессора Эндрю Макферсона (Andrew Macpherson) из Клиники Висцеральной Хирургии и Медицины Инзельшпиталь ( Clinic for Visceral Surgery and Medicine at the Inselspital ) при Бернском Университете ( University Bern , Швейцария).
Результаты исследования показали, бактерии, обитающие в тонком кишечнике, влияют на степень вероятности развития у их хозяина сахарного диабета. Поддержание нормального баланса микрофлоры за счет регулирования соотношения штаммов полезных микроорганизмов, является крайне важным фактором в профилактике данного заболевания.
Сегодня сахарный диабет все чаще диагностируют у людей молодого возраста, и медики уже говорят о настоящей эпидемии сахарного диабета
Увеличение распространенности этого заболевания наблюдается в последние сорок лет, когда отмечено повышение чистоты и гигиенического состояния наших домов и окружающей среды. У детей и пациентов молодого возраста развитие сахарного диабета обусловлено нарушением функционирования клеток иммунной системы, которые повреждают специализированные клетки поджелудочной железы, вырабатывающие гормон инсулин. В настоящее время после диагностирования у ребенка сахарного диабета он нуждается в пожизненном лечении.

Тридцать лет назад японские ученые обратили внимание на то, что лабораторные мыши штамма NOD (прим.: Мыши NOD - это модель у лабораторных животных аутоиммунного диабета человека, характеризующаяся разрушением b-клеток) имеют склонность к развитию сахарного диабета, так как в их геноме присутствуют гены, обусловливающие у человека предрасположенность к развитию сахарного диабета.
Еще раз отметим, что такая разновидность диабета, по мнению ученых, связана с образованием дефектов в иммунной системе организма. При возникновении этих процессов начинают формироваться специальные структуры - антитела, которые действуют отрицательным образом в поджелудочной железе на размножение и деятельность клеток, производящих инсулин. Развитие аутоиммунного диабета получает дополнительный толчок при распространении различных инфекционных заболеваний вирусного типа, а также влияния на организм человека ряда канцерогенных веществ.
Благодаря специальному оборудованию из Университета Берна и Канады исследовательские команды на данной модели на мышах смогли продемонстрировать, что бактерии, обитающие в тонком кишечник е , могут синтезировать биохимические соединения и гормоны, предотвращающие развитие сахарного диабета.
Подробнее об исследовании см:
По словам Эндрю Макферсон из Бернского Университета, ученые надеются, что полученные результаты расширят представления ученых о механизмах, позволяющих бактериям, обитающим в тонком кишечнике, защищать организм от развития сахарного диабета. Он считает, что новые данные о причинах развития диабета и о роли здоровой кишечной микрофлоры, препятствующей его появлению путем продукции определенных веществ, помогут создать инновационные методы лечения пациентов и предотвратить развитие заболевания у детей.
Еще об одном исследовании см.:

Возможно, больным диабетом 1-го типа удастся помочь, восстановив состав микрофлоры кишечника.
Как показало новое исследование, таргетирование конкретной микробиоты в кишечнике может быть одним из способов защиты от диабета 1 типа. Исследователи из Квинслендского Университет (University of Queensland) в Австралии обнаружили явные изменения микробиоты кишечника у грызунов и людей, которые подвергаются высокому риску диабета 1 типа.
Подробнее об исследовании см:
По матералам статьи в Microbiome
Соавтор исследования Доктор Эмма Гамильтон Уильямс (Dr. Emma Hamilton-Williams) из Института Трансляционных Исследований в Университете Квинсленда и ее коллеги говорят, что их результаты показывают, что таргетирование кишечной микробиоты может иметь потенциал для предотвращения диабета типа 1.
МИКРОФЛОРА КИШЕЧНИКА И САХАРНЫЙ ДИАБЕТ 2 ТИПА

Поджелудочная железа вырабатывает недостаточно инсулина или инсулин не перерабатывается.
Сахарный диабет 2-го типа - это метаболическое заболевание, которое проявляется нарушением обмена углеводов. Организм не производит достаточного количества инсулина для надлежащей функции, или клетки в теле не реагируют на инсулин (устойчивость к инсулину или инсулинорезистентность). Приблизительно 90% всех случаев диабета во всем мире - это диабет 2 типа. В результате приобретения инсулинорезистентности, то есть невосприимчивости клеток организма к этому гормону, - развивается гипергликемия (увеличение концентрации глюкозы в крови). Простыми словами, в организме - нормальный уровень инсулина и повышенный уровень глюкозы, которая по каким-то причинам не может попасть в клетки.


На рисунке: Влияние инсулина на поглощение и метаболизм глюкозы. Инсулин связывается со своим рецептором (1), который, в свою очередь, запускает несколько каскадов активации протеина (2). К ним относятся: транслокации транспортёра GLUT4 к плазматической мембране и приток глюкозы (3), синтез гликогена (4), гликолиз (5), синтез жирных кислот (6).
Ученые подтвердили роль микробиоты на инсулинорезистентность экспериментально путем пересадки микрофлоры от здорового донора к пациенту с сахарным диабетом 2 типа. В результате эксперимента у пациентов увеличилась чувствительность к инсулину на несколько недель.
Подробнее по ссылке:
Уже ни у кого не вызывает сомнения тот факт, что биохимические реакции, протекающие в нашем теле и фактически определяющие наше здоровье, напрямую зависят от состояния желудочно-кишечного тракта и взаимодействия его микрофлоры с клетками нашего организма. Если учесть, что пробиотики обладают иммуномодулирующими свойствами, способствуют нормализации микрофлоры ЖКТ, в т.ч. снижению избыточной массы тела , повышающей риск развития СД, то систематическое потребление в пищу пробиотических продуктов функционального питания и прием пробиотиков может рассматриваться как одно из перспективных средств в профилактике и комплексной терапии сахарного диабета.
ПОЧЕМУ РАСТИТЕЛЬНАЯ КЛЕТЧАТКА ЗАЩИЩАЕТ ОРГАНИЗМ ОТ САХАРНОГО ДИАБЕТА

С помощью кишечной микрофлоры пищевые волокна превращаются в жирные кислоты, которые кишечник потом использует для синтеза собственной глюкозы. Последняя служит для мозга сигналом о том, что нужно подавить чувство голода, повысить энергетические расходы и уменьшить выброс сахара из печени.
Вы ведь слышали о пользе клетчатки, верно? О тех самых пищевых волокнах, что защищают нас от ожирения и диабета. Волокна эти в изобилии есть в овощах и фруктах, но сам кишечник расщепить их не может, а потому ему на помощь спешит микрофлора. Положительный метаболический и физиологический эффект клетчатки подтверждён многочисленными опытами: животные на такой диете накапливали меньше жира, и у них снижался риск развития диабета. Однако нельзя сказать, что мы понимаем, как именно эти волокна действуют. Известно, что кишечные бактерии расщепляют их с образованием короткоцепочечных жирных кислот , пропионовой и масляной, которые потом всасываются в кровь. Учёные из Национального центра научных исследований (CNRS) во Франции предположили, что эти кислоты как-то влияют на синтез глюкозы кишечником. Его клетки действительно могут синтезировать глюкозу, выбрасывая её в кровь между приёмами пищи и по ночам. Нужно это вот для чего: сахар связывается с рецепторами воротной вены, которая собирает кровь, идущую от кишечника, и рецепторы эти подают соответствующий сигнал в мозг. Мозг реагирует, подавляя чувство голода, повышая расход запасённой энергии и заставляя печень сбавить производство глюкозы.
То есть за счёт небольшой порции глюкозы из кишечника подавляется выброс глюкозы из печени, и предпринимаются меры против поглощения новых — ненужных и опасных — калорий.
Оказалось, что активность генов в клетках кишечника, отвечающих за синтез глюкозы, зависит от тех самых волокон, а также от пропионовой и масляной кислот. Кишечник использовал пропионовую кислоту как сырьё для синтеза глюкозы. Мыши, поглощавшие много жира и углеводов, меньше набирали вес и реже болели диабетом, если вместе с жиром и сахаром съедали достаточно клетчатки. При этом у них повышалась чувствительность к инсулину (которая, как известно, снижается при диабете второго типа).
Прим.: Стоит заметить, что пропионовая кислота является одним из основных продуктов жизнедеятельности пропионовокислых бактерий , которая наряду с пропионатами и пропиоцинами, способна подавлять рост патогенных микроорганизмов. А, к примеру, масляную кислоту продуцируют клостридии , входящие в состав нормальной микрофлоры человека.
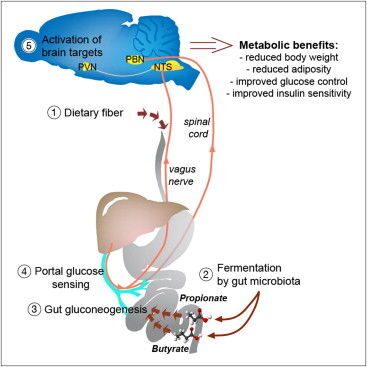
В другом эксперименте использовались мыши, у которых была выключена способность синтезировать глюкозу в кишечнике. В этом случае никакого полезного эффекта от пищевых волокон не было. То есть просматривается такая цепочка: мы едим клетчатку, микрофлора перерабатывает её до жирных кислот, которые потом клетки кишечника могут использовать для синтеза глюкозы-регулятора. Эта глюкоза нужна, чтобы ограничивать наше неуместное стремление пожевать что-нибудь ночью, а также для поддержки правильного баланса глюкозы в организме.
С одной стороны, это очередной аргумент в пользу того, что кишечная микрофлора нужна нам для того, чтобы оставаться здоровыми, причём сей аргумент обзавёлся конкретным биохимическим механизмом. С другой стороны, возможно, с помощью этой биохимической цепочки удастся в будущем искусственно пресекать нездоровые процессы, которые могут довести нас до ожирения и диабета. / Результаты исследования опубликованы в журнале Cell.

*О практическом использовании свойств пробиотических микроорганизмов в создании инновационных препаратов для лечения и профилактики дислипидемии и диабета см. в описании к пробиотику "Бификардио":
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
Для начала минутка анатомии. Моча образуется в почке, далее по тонкой трубочке, мочеточнику, она поступает в мочевой пузырь. Когда достаточное количество мочи скапливается в мочевом пузыре, при нашем непосредственном усилии моча выводится из организма через трубочку номер два - уретру. У женщин уретра короткая и расположена близко к влагалищу, что облегчает попадание инфекции в мочевые пути. Из-за этой анатомической особенности инфекции мочевыводящих путей (ИМП) у женщин встречаются в 10 раз чаще, чем у мужчин.
Какими бывают инфекции мочевыводящих путей?
- Инфекции нижних мочевых путей - воспаление уретры (уретрит) или мочевого пузыря (цистит). Симптомы: болезненное мочеиспускание, задержка мочи или частые позывы к мочеиспусканию, боли внизу живота.
- Инфекции верхних мочевых путей - воспаление ткани почки (пиелонефрит). Симптомы: повышение температуры, боли в пояснице.


Как протекают инфекции мочевыводящих путей у людей с диабетом?
При сахарном диабете инфекции мочевыводящих путей встречаются чаще, чем у людей без сахарного диабета, например, риск пиелонефрита при диабете выше в 4 раза. На то есть причины:
- Сниженная активность иммунной системы;
- Неполное опорожнение мочевого пузыря, что бывает при автономной нейропатии. В результате, у микроорганизмов достаточно времени, чтобы успешно расти и размножаться в мочевых путях;
- Глюкоза, часто выявляемая в моче при сахарном диабете, является отличной пищей для возбудителей инфекции. При диабете 2 типа применяют ингибиторы SGLT-2 типа - лекарства, снижающие сахар крови за счет выведения глюкозы с мочой. Доказано, что использование этих препаратов несколько повышает риск возникновения инфекций нижних мочевых путей. Поэтому ингибиторы SGLT-2 типа не рекомендуют принимать людям с хроническими ИМП.
Кроме диабета и принадлежности к женскому полу факторами риска развития ИМП являются:
- Использование мочевых катетеров
- Пожилой возраст
- Диабетическая нейропатия
- Диабетическая нефропатия
Для женщин выделяют дополнительные факторы риска:
- Наличие половой жизни, новый сексуальный партнер, использование спермицидов в качестве противозачаточного средства
- Инфекции мочевых путей в прошлом
- Инфекции мочевых путей у матери
- Наступление менопаузы
ИМП могут протекать остро и полностью проходить после своевременного лечения. В некоторых случаях они могут приобретать хроническую форму с периодическими обострениями. При отсутствии своевременного лечения, очень слабом иммунитете или очень сильном микробе инфекция в мочевых путях может приобретать осложненное течение. Важно знать, что только некомпенсированный сахарный диабет является риском осложненного течения ИМП. Вот и еще один повод держать уровень глюкозы под контролем!

Чтобы поставить диагноз необходимо:
- Оценить имеющиеся симптомы: при сахарном диабете, наряду с типичными симптомами, необъяснимо высокий или низкий сахар в крови может оказаться признаком начинающейся инфекции;
- Общий анализ мочи: более 10 лейкоцитов, обнаруженных врачом в 1 поле зрения микроскопа, укажет на высокую вероятность инфекции. Напомню, что перед сдачей анализа мочи требуется подготовка - тщательный гигиенический душ паховой области с мылом и получение средней порции мочи. Иначе возможно попадание в мочу бактерий с кожи, а в результате – не нужное вам лечение.
- Посев мочи, который покажет рост достаточного количества виновников инфекции на специальной питательной среде и определит, к каким именно антибиотикам чувствительны эти микроорганизмы.
- УЗИ почек при подозрении на инфекцию верхних мочевыводящих путей.
Дополнительные методы обследования могут потребоваться в случае осложненного течения заболевания.

Лечить или не лечить?
Инфекции мочевыводящих путей лечат антибиотиками, которые выводятся вместе с мочой и эффективно работают именно в мочевых путях. Чаще всего это фосфомицин, препараты из группы фторхинолонов и нитрофуранов. Для того, чтобы начать лечение, достаточно наличия типичных симптомов и обнаружения лейкоцитов в общем анализе мочи. Конечно, выбрать подходящий антибиотик может только ваш врач, желательно, уролог. В случае хронического течения ИМП урологом подбирается схема приема антибиотиков для профилактики обострений болезни.
При осложненном течении ИМП может потребоваться хирургическое лечение.
Стоит ли бояться бессимптомной лейкоцитурии?
И наконец, несколько слов о бессимптомной бактериурии. Это состояние (не заболевание!) при котором симптомов ИМП нет, но лейкоциты в моче повышены, а потенциальные возбудители при посеве мочи растут в приличном количестве. До 27% людей с сахарным диабетом переносят бессимптомную бактериурию. Но требует ли это состояние лечения?
По данным исследований лечение бессимптомной бактериурии не снижает риск развития ИМП и их осложнений, а так же вероятность наступления диабетической нефропатии у людей с хорошо контролируемым сахарным диабетом. Напротив, бессимптомное обитание бактерий в мочевых путях, вероятно, препятствует их заселению более агрессивными микроорганизмами.
Лечение бессимптомной бактериурии не рекомендовано также в пожилом возрасте, при нарушениях опорожнения мочевого пузыря и перед операциями (за исключением операций на мочевых путях). Важно понимать, что злоупотребление антибактериальными препаратами повышает устойчивость бактерий к лечению и может привести к более тяжелому течению инфекционных болезней в будущем.

Исключением является беременность. Лечение бессимптомной бактериурии во время беременности уменьшает риск развития инфекций мочевых путей. Поэтому большенство специалистов, в том числе из Британского национального института качества медицинской помощи (NICE) и Американской коллегии акушеров и гинекологов (ACOG), рекомендует обследовать беременных женщин на предмет бессимптомной бактериурии с последующим лечением антибактериальными препаратами.

Профилактика инфекций мочевыводящих путей:
- Регулярное измерение уровня глюкозы, подсчет углеводов - берем под контроль сахарный диабет;
- Соблюдение личной гигиены;
- Направление движений спереди назад при мытье паховой области у женщин;
- Нижнее белье из натуральных тканей;
- Своевременное мочеиспускание, в том числе, после полового акта;
- Отказ от использования спермицидов в качестве средства контрацепции;
- Употребление достаточного количества жидкости.

Кишечная палочка – палочковидная патогенная бактерия, она относится к факультативным анаэробам. Она размножается в условиях, где нет прямого доступа кислорода. Кишечная палочка содержит очень много разновидностей (штаммов), которые содержаться в естественной кишечной микрофлоре.
Описание
Эту палочку в восемнадцатом веке открыл Теодор Эшерих, потому кишечная палочка была названа Escherichia coli. Она помогает избежать появления опасных микроорганизмов и в то же время, синтезирует витаминные соединения, но с другой стороны, некоторые виды бактерий доставляют человеку серьезные проблемы, провоцируя сильные отравления, что способствует возникновению колибактериоза и дисбактериоза, нарушая работу желудка, кишечника, а в особо тяжелых случаях приводят к образованию сепсиса.
Разновидности кишечной бактерии могут быть безвредными, но чтобы не допустить осложнений, кишечную палочку нужно своевременно пролечить.
Микрофлору кишечника в большом количестве населяют разные микроорганизмы (энтерококки, лактобактерии, стрептококки). При нарушении баланса их жизнедеятельности, начинают плодиться патогенные микроорганизмы. Эти процессы могут появиться впоследствии развития процессов гноения, брожения или возникновении тяжелых заболеваний.
Некоторые разновидности бактерий могут спровоцировать развитие:
- патологий желудка, кишечника;
- простатита;
- цистита;
- кольпита;
- болезни мочеполовой системы;
- мастита;
- перитонита;
- сепсиса;
- пневмонии.
Кишечные палочки могут сохраняться в почве, воде или фекалиях на протяжении длительного периода. Хорошо размножаются в продуктах питания, особенно в молоке. Они не боятся высушивания, хотя попадание прямых солнечных лучей может уничтожить их за несколько минут. Они также уничтожаются кипячением или дезинфицирующими средствами (хлорная известь, формалин).
Причины
Кишечные палочки можно разделить на патогенные и условно-патогенные. Патогенные штаммы подразделяются на четыре класса:
Все эти виды могут вызвать развитие инфекционных заболеваний, и, согласно статистических данных, они чаще всего поражают детей и женщин (особенно они опасны для беременных, так как несут угрозу для развития плода).
Спровоцировать нарушение микрофлоры кишечника может применение антибактериальных препаратов, которые уничтожают патогенные бактерии. Чтобы предотвратить развитие дисбактериоза и не нарушить кишечную микрофлору, антибактериальные препараты нужно подбирать правильно, а их дозировку нужно внимательно рассчитывать.
Дисбактериоз и нарушение работы кишечника могут быть следствием таких болезней, как энтероколит и колит, панкреатит.
Заражение вредными разновидностями кишечной палочки может происходить фекально-оральным способом, когда человек не соблюдает гигиенические требования при готовке пищи, употребляя немытые овощи и фрукты, поливая огород грязной водой.
Внимание! Животные, мясо и молоко, которых человек употребляет в пищу, могут быть носителями штаммов кишечной палочки, поэтому мясные и молочные продукты должны подвергаться тепловой обработке.
Если причиной отравления явилась кишечная палочка, то у человека в тканях и слизистых желудка, кишечника могут начать появляться опасные токсины, в некоторых случаях, они могут представлять смертельную опасность.
Симптомы
Симптомы заражения могут быть разными, и зависит это от того, к какой группе относится бактерия и как быстро она размножается.
При заражении энтеропатогенными бактериями, появляется:
- рвота;
- водянистый понос;
- потеря аппетита;
- беспокойный сон.
Этот вид обычно проявляется у грудничков, и его можно определить еще в роддоме.
Если заражение произошло из-за энтеротоксигенных бактерий, то симптомами будут:
- водянистая диарея без примеси крови;
- тошнота;
- приступы боли в животе.
Кишечные палочки этой группы цепляются к слизистой оболочке кишечника, парализуя его работу. Эту инфекцию можно подцепить через грязные руки или немытые продукты.
При инфицировании энтерогеморрагическими бактериями, появляется:
- понос с примесью крови, который сопровождается острой гемолитической анемией;
- в испражнениях появляются зеленые примеси и слизь.
- все заканчивается разрушением кровяных телец и смертью больного.
Инфицирование энтероинвазивными бактериями можно встретить у детей, оно характеризуются болезненными ощущениями внизу живота и сильным поносом (редко с примесью крови).
Общими симптомами являются:
- болезненные ощущения в животе;
- диарея;
- тошнота;
- вздутие живота;
- неприятный запах изо рта;
- слабость;
- потеря аппетита.
Лечение
Чтобы установить правильный диагноз и для определения разновидности возбудителя, специалист назначает анализ на посев бактериальной инфекции. В зависимости от выявленного возбудителя, местонахождения бактерии, особенностей организма пациента, назначается курс лечения. Он должен быть комплексным.
Больному рекомендуют специальную диету, назначают пробиотики, для восстановления кишечной микрофлоры. В зависимости от вида штамма, назначаются антибиотики (амоксицилин, левофлоксацин, фуразолидон, ципрофлоксацин). Зачастую, это медпрепараты группы аминогликоизидов. Чтобы добиться положительных результатов, пациенту могут назначить посев микрофлоры кишечника.
Если бактерия стала причиной дисбактериоза, то методику лечения выбирают с учетом восстановления водно-электролитного баланса. Когда больной полностью пройдет весь курс лечения, его направляют сдавать повторные анализы. Берегитесь кишечной палочки!
Читайте также:


