Кишечная палочка в ветеринарии

Кишечная палочка попадает в организм молодняка через грязное вымя. Телята заболевают колибактериозом во время сосания молока. Заболевание приводит к стремительному обезвоживанию организма. Колибактериоз телят сопровождается общей интоксикацией.
Описание
Возбудителем заболевания является кишечная палочка, которая относится к семейству Enterobacteriaceae. Анаэробные микроорганизмы отличаются высокой ферментативной активностью. После заражения у телят развивается интенсивный понос и сепсис.
Причины возникновения
Инфекция поражает молодняк в возрасте от 1 до 7 дней. Чаще всего кишечная палочка попадает в организм телят от взрослых особей. Носителями инфекции могут быть переболевшие коровы.
Риск заражения колибактериозом повышается, если владелец не следит за питанием скота. Отсутствие молозива приводит к проникновению инфекции в пищеварительный тракт. Зачастую владельцы животных держат коров и телят в одном помещении, и это увеличивает вероятность передачи инфекции.
Инфекция быстро распространяется в стаде из-за несоблюдения гигиенических правил. Необходимо своевременно проводить дезинфекцию помещений, в которых содержатся животные. Склонность к колибактериозу среди молодняка связана с высокой проницаемостью стенок кишечника.
У телят ещё не сформирована иммунная система. Заражение возбудителем колибактериоза происходит из-за физиологических особенностей. В молозиве присутствуют вещества, повышающие иммунитет. Они защищают организм новорожденного от кишечных инфекций. Однако некоторые владельцы животных не дают молозиво телятам. Это приводит к увеличению риска инфицирования вредоносными бактериями.
Можно выделить 3 разновидности заболевания:
- Признаком септической формы является общая слабость и разрушение сосудов. Интенсивный понос лишает теленка необходимых для жизни веществ. Дефицит иммуноглобулинов приводит к активному размножению патогенных микроорганизмов.
- Энтеритная форма сопровождается повышенной секрецией жидкости в кишечнике.
- При энтеротоксическом колибактериозе у теленка начинается токсикоз.
В первые часы после появления на свет теленок нуждается в поступлении молозива. Слизистые кишечника новорожденного отличаются высокой проницаемостью к микрофлоре.
Важно! Благодаря выпаиванию молозивом можно предотвратить развитие колибактериоза. В нём присутствуют иммуноглобулины, которые защищают теленка от вредоносных бактерий.
Симптомы колибактериоза
Продолжительность инкубационного периода может колебаться от 1 часа до 3 дней. Скорость размножения вредоносных бактерий зависит от возраста телёнка и состояния его организма. Можно выделить несколько признаков заболевания:
- Острая форма колибактериоза проявляется в виде интенсивной диареи.
- В испражнениях животного можно увидеть следы крови и слизи.
- Теленок мучается от обезвоживания.
- У больных особей западают бока и веки.
- Ослабленное животное с трудом передвигается по помещению.
- Септическая форма приводит к учащению пульса и дыхания.
- У теленка резко повышается температура.
- Животное теряет прежнюю активность.
Диагностика
Чтобы помочь больному теленку, специалисты ветеринарной лаборатории исследуют содержимое кала. Таким способом можно определить разновидность возбудителя, ставшего причиной развития заболевания. Специалисты исследуют ткани печени, селезенки и кишечника умерших животных. Благодаря забору биологических материалов можно определить тип патогенного микроорганизма.
Методы лечения
Больного теленка необходимо посадить на строгую диету. Полностью исключите молоко, так как в нём могут присутствовать вредоносные бактерии. Молодняку дают антибактериальные препараты, которые подавляют деятельность вредоносных бактерий (Хлортетрациклин, Неомицин). Выбор метода лечения зависит от результатов анализов.
Для устранения колибактериоза ветеринары применяют следующие препараты:
Чтобы восстановить баланс микрофлоры в кишечнике молодняка, используются пробиотики (Энтеробифидин, Бифидумбактерин). Размножение патогенных микроорганизмов сопровождается выделением большого количества токсинов. Организм теленка пытается избавиться от вредных компонентов. Понос является ответной реакцией на проникновение бактерий.
Ускорить выведение токсических веществ можно с помощью льняного или овсяного отвара. Они обволакивают стенки кишечника телят и защищают от раздражающих компонентов.
Интенсивная диарея приводит к быстрой потере жидкости, в которой нуждается новорожденный. Для восстановления водно-солевого баланса можно использовать травяные отвары с вяжущими свойствами. Помочь больному теленку можно с помощью настоев шалфея, зверобоя или цветков ромашки.
В отличие от антибиотиков, травы не оказывают негативного воздействия на полезные микроорганизмы. Чтобы справиться с дефицитом витаминов, используются комплексные препараты.
Профилактика
Чтобы уменьшить риск заражения колибактериозом, необходимо проводить своевременную вакцинацию коров перед отёлом. Взрослые особи являются потенциальными носителями опасной инфекции. Заводчикам рекомендуется дезинфицировать помещения. Инвентарь необходимо содержать в чистоте. Возбудители колибактериоза могут присутствовать в воде и корме.
Колибактериоз у телят сопровождается интенсивным поносом. Переболевшие животные являются носителями опасной инфекции. Риск заражения повышается, если новорожденные в первые часы своей жизни не получают молозива. Это лишает телят защиты от проникновения патогенных микроорганизмов. Избавиться от кишечной палочки можно путем применения антибактериальных препаратов.
Новикова О.Б., к.в.н., Зав. Отделом микробиологии ВНИВИП - филиал ФНЦ ВНИТИП РАН
С. Орлов, технический специалист отдела по работе с ключевыми клиентами, птицеводство и диагностика, Зоэтис
Колибактериоз является распространенной и затратной болезнью птиц бактериальной этиологии в птицеводческих хозяйствах промышленного типа.Escherichiacoli присутствует практически на всех птицеводческих предприятиях, большинство штаммов не патогенно и находится в кишечном тракте в качестве комменсалов.Те штаммы, что вызывают заболевания, зачастую не только колонизируют кишечник, но и адаптировались к тому, чтобы жить за пределами кишечного тракта, что ведет как к локализованным, так и системным проявлениям заболевания. Это один из наиболее значимых бактериальных патогенов, обнаруживаемых у цыплят первой недели жизни и приводящий к проблемам на протяжении всего жизненного цикла поголовья, включая ухудшение производственных показателей, разнородность стада и увеличение падежа [1][2].
Наиболее частыми проявлениями для родстада бройлеров и коммерческой несушки включают септицемию, перитониты и сальпингиты; у коммерческих бройлеров аэросаккулиты и септицемия, целлюлиты и воспалительные процессы приводят к отбраковке тушек. Так же встречается синдром опухшей головы у бройлеров и реже у родстада[3][4][5].
Экономический ущерб, причиняемый колибактериозом, весьма значителен и определяется он гибелью эмбрионов и цыплят, снижением привесов и яйценоскости, неудовлетворительным развитием переболевшего молодняка. Взрослые куры редко болеют колибактериозом в клинической форме, но в кишечнике их могут персистировать патогенные варианты кишечной палочки и усиление любого предрасполагающего фактора, при отсутствии специфического иммунитета, влечет за собой развитие заболевания[3].
Колибактериоз у птиц – это системная вторичная (секундарная) инфекция, возникающая при иммунодепрессивном состоянии птицы, а также при вирусных болезнях, связанных с поражением респираторного тракта.
Колонизация возбудителя в тонком кишечнике - значимый этап развития колибактериоза любой формы. Эшерихии с помощью адгезивных антигенов прочно связываются с ворсинками слизистой кишечника, и их нельзя устранить механическим путем. В патогенезе болезни адгезивные антигены эшерихий играют ведущую роль, большое значение имеют и токсины, которые накапливаются в кишечнике. Высокая восприимчивость птицы к колибактериозу связана с физиологической незащищенностью тонкого отдела кишечника против колонизации эшерихиями [3].
Доминирующая роль E.coli в инфекционной патологии птиц значительно осложняет эпизоотическую ситуацию в хозяйстве вследствие того, что кишечная палочка является фундаментом для развития смешанных инфекций. Колибактериоз часто протекает в ассоциации с пастереллёзом, гемофилёзом, стафилококкозом. Особенно ощутимый ущерб наблюдают при сочетанном течении колибактериоза и микоплазмоза[3][5].
Анализ спектра микрофлоры, выделенной в течение последних лет от птиц разных видов из разных объектов в хозяйствах различного технологического направления, убедительно показывает доминирующую роль кишечной палочки, удельный вес которой составляет 41,2%. На долю другой кишечной микрофлоры приходится 24%, и кокковой микрофлоры – 26%[3].
Научными сотрудниками ВНИВИП Новиковой О.Б. с соавторами в 2016 году было изучено выделение E.coli из различных органов павшей птицы. Культуры E. coli были выделены из сердца, легких, печени, селезёнки, почек и желточных фолликул. Выделение кишечной палочки из желточных фолликул указывает на возможный трансовариальный путь передачи инфекции.
У выделенных культур изучали вирулентные свойства на моделях заражения развивающихся куриных эмбрионов (РКЭ) 7-8-дневного срока инкубации, интраорбитального заражения цыплят первых дней жизни и на моделях внутривенного и внутримышечного заражения 60-дневных цыплят или взрослых кур.
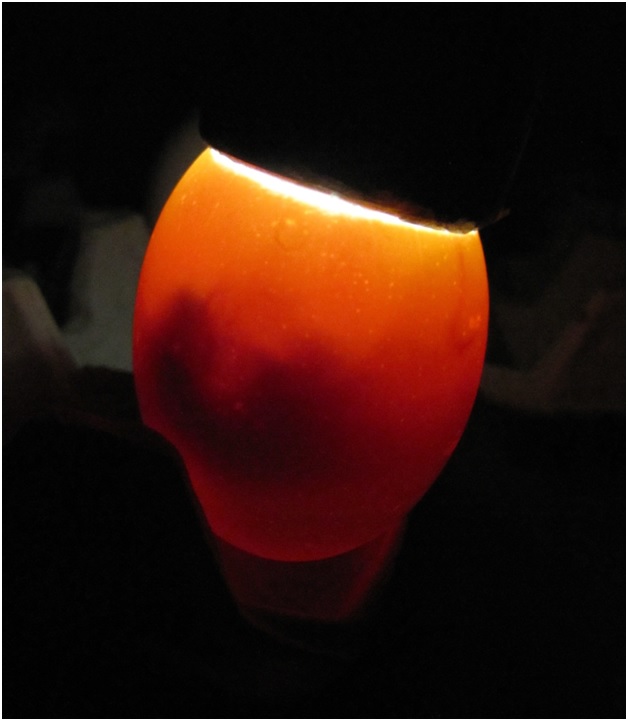
Вирулентные культуры E.coli вызывали гибель эмбрионов в течение 24-48 часов (фото 1), а цыплят первых дней жизни - в течение 24-72 часов с признаками острого сепсиса (серозный перикардит и геморрагический дуоденит).
Фото 1. Гибель эмбриона вследствие воздействия вирулентной культуры E. coli.
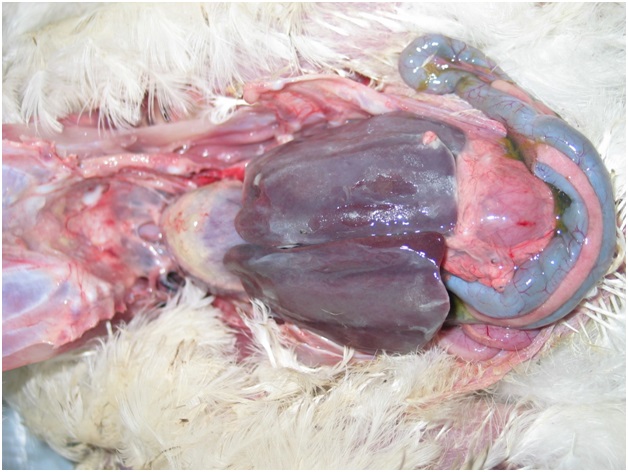
У цыплят более старшего возраста отмечали длительное течение болезни с патологоанатомическими признаками фибринозного перикардита и перигепатита (фото 2).
Фото 2. Фибринозный перикардит и перигепатит, вызванныеE. coli.
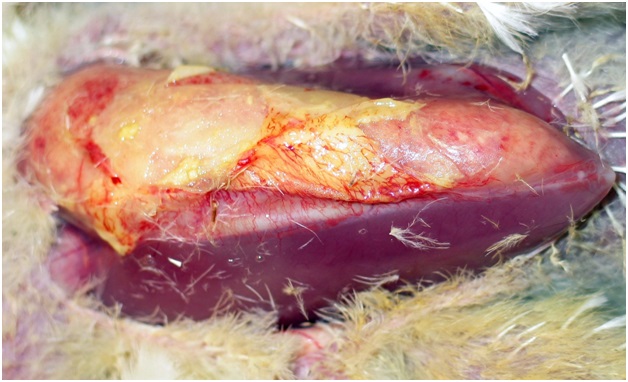
При внутримышечно заражении наблюдали обширный разлитой некроз на месте введения культуры (фото 3).
Фото 3. Обширный разлитой некроз на месте введения культуры вирулентной E. coli
От павших эмбрионов, а также от цыплят из крови сердца и печени выделяли исходные культуры заражающего штамма.
При заражении слабовирулентными культурами кишечной палочки цыплят первых дней жизни отмечали отставание в росте и развитии по сравнению с контрольными незаражёнными (фото 4)[3].
Фото 4. Отставание цыпленка, пораженного вирулентным штаммом E. coli, в росте и развитии в сравнении с незараженным контролем.

Снижение присутствия E. coli инфекции за счет вакцинации.
Опосредованно снизить риск развития колибактериоза возможно за счёт устранения воздействия предрасполагающих факторов, прежде всего борьбой с первичными респираторными заболеваниями, включая Ньюкаслскую болезнь, инфекционный бронхит, ларинготрахеит, микоплазмоз и иммуносупрессивными вирусными инфекциями - инфекционной бурсальной болезнью, анемией цыплят, болезнью Марека. В дополнение, необходимо контролировать иные факторы, которые так же влияют на развитие заболевания,– стресс, связанный с нарушением температурного режима содержания, вентиляцией, микотоксинами, загрязнением питьевой воды[5].
В ряде стран для борьбы с колибактериозом до сих пор широко применяются антибиотики, однако потеря их эффективности требует поиска иных решений. В некоторых странах использование антибиотиков ограничено на законодательном уровне, но даже если подобных ограничений нет – препятствием является резистентность возбудителя к терапевтическим агентам. Становится очевидным, что для решения проблемы колибактериоза целесообразно использовать вакцины, специально разработанные для стимуляции иммунного ответа против патогенныхE. coli в качестве естественного дополнения программы вакцинации против первичных респираторных и иммуносупрессивных патогенов. В дополнение, отказ от постоянного и чрезмерного использования антибиотиков улучшит качество продукции для потребителя и снимет нарекания со стороны контролирующих органов.
Достижения в молекулярной биологии позволили создать вакцинный штамм, эффективный против колибактериоза, который стал основой для коммерческой вакцины Пулвак E. coli. Данная вакцина стимулирует оба типа иммунитета: тканевой (клеточный) и гуморальный (циркулирующие антитела)[5].
Пулвак E. coli представляет собой лиофилизированный порошок для приготовления суспензии. Содержит в своем составе бактерию E. coliштамм EC34195, серотипа О78, которая не имеет факторов патогенности, вызывающего заболевание, что делает возможным её применение в качестве вакцины. Применяется методом крупнокапельного спрея или выпойкой.
Вакцина полностью апатогенна, она не сохраняется в птице и окружающей среде сколь либо длительный период времени. Особенность вакцинального штамма не допускает invivo размножение, он оставляет после себя лишь активированные макрофаги, готовые вступить в борьбу с патогенными штаммами E. coli[1].
В дополнение, Пулвак E. coli совместим с кокцидиостатиками и вакцинами против ИБК и НБ [5].
Применение Пулвак E. coli на родстадах и товарной несушке.
На молодке и несушках применимы живые и инактивированные вакцины. Не зависимо от типа используемой вакцины, клиническое заболевание, вызываемое E. coli инфекцией, менее выраженно проявляется у вакцинированной в сравнении с не вакцинированной птицей.
· Обеспечивает защиту только от гомологичных E. coli штаммов
· Нет перекрестной защиты
· Инъекция в грудку
· Снижение заболеваемости и падежа из-за E. coli инфекции
Коммерческая живая модифицированная
· Пулвак E. coli 078 (Зоэтис)
· Перекрестная защита от О1, О2 и О18
· Снижение заболеваемости и падежа из-за E. coli инфекции
· Повышение продуктивности птицы
Обзор мировой литературы свидетельствуют о глобальной актуальности проблемы колибациллеза у родстад и промышленной несушки, ниже приведены свидетельствапрактиков и мнения международных экспертов.
E. coli инфекция влечёт за собой ряд проблем, в числе которых перитониты и сальпингиты, снижение продуктивности и увеличение падежа или поражений, приводящих к выбраковке. Применение Пулвак E. coli обеспечивает не только лучшую сохранность и продуктивность птицы, но и уменьшает вертикальную передачу возбудителя.
Дионн Рауф из лаборатории Дельтамун, Южная Африка, указал навозрастающую проблему передачи E. coli от родстада к потомству. Применение антибиотиков на бройлерах не достаточно эффективно, потому что повышенный падёж отмечается уже в первые дни после инкубации.
Кроме того, серотипирование E. coli не получило широкого распространение в Южной Африке, по этому при иммунизации птицы очень важно обеспечить перекрёстную защиту.
По наблюдениям Ван Билджона, период с 22 по 32 неделю для родстада бройлеров является особо стрессовым, что способствует развитию E. coli инфекции. В ходе этого периода птица не только активно набирает массу, но и выходит на яичную продуктивность с 0% до примерно 89%.
В дополнение, птице необходимо адаптироваться к новой среде обитания ввиду перевода из помещения для реммолодки в зал для содержания взрослой птицы. Стресс от начала продуктивного периода усиливается за счёт изменения светового режима и смены рациона. Возрастает риск развития перитонитов и сальпингитов, вызываемых E. coli.
Вакцинация родительских стад бройлеров против E. coli позволяет получать более здоровое потомство, отмечают специалисты из Южной Африки
У цыплят от вакцинированного родстада падёж в 7 дней составил 1,18% в сравнении с 1,44% у цыплят от невакцинированной птицы. Вакцинация так же способствовала увеличению веса цыплят, который составил 188 г в 7 дней в сравнении с 183 г у цыплят, полученных от невакцинированной птицы.
С января 2011 Ван Билджон для защиты бройлерного родстада и их потомства от E. coli инфекции использует Пулвак E. coli, заменив данной вакциной применявшийся ранее инактиват.
В сравнении с инактивированной вакциной, живая вакцина менее затратна и не даёт побочных эффектов, отмечает Ван Билджон.
Схема вакцинации против E. coli может отличаться на различных фермах, использование живой вакцины в раннем возрасте, например, может дополняться последующей вакцинацией инактиватом в продуктивный период.
Вакцина не является магическим средством, которое избавляет от необходимости осуществлять надлежащий уход за птицей и обеспечивать биобезопасность, но позволяет увеличивать прибыльность за счёт минимизации негативного влияния E. coli, подчеркивает Аллен Болл, эксперт государственной ветеринарной практики Великобритании [10].
С точки зрения экономики предприятия, в качестве примера, доктор Симон М. Шейн приводит случай, когда колибактериоз являлся причиной 10% падежа в стандартной ферме по содержанию родстада бройлеров с 20 до 65 недель. Из-за инфекции среднее ожидаемое количество цыплят на несушку сокращалось с 125 до 110 цыплят. Для того, чтобы обеспечить получение 100000 цыплят в неделю, необходимо прибавлять 3000 несушки к имеющимся 30000. Затраты, связанные с содержанием дополнительной птицы (от выращивания реммолодки до содержания несушек), составляло € 40000 в год. Стоимость двукратной обработки вакциной Пулвак E. coli - €420 в год. Если за счёт вакцинации сократить 50% потерь от падежа ассоциированного с колибактериозом, соотношение выгоды к затратам составит 50:1 [5].
В другом исследовании, в США, вакцина применялась на коммерческой несушке с суточного возраста, с ревакцинацией в 12 недель* с заражением E. coli на 23 неделю. Опыт показал снижение падежа на 13 % по сравнению с птицей из не вакцинированного контроля.
В стаде с 75000 несушек подобное снижение падежа означает, что 3000 голов были спасены от падежа, что дало дополнительно 900000 яиц.
В США, где Пулвак E. coli доступен на рынке в течение 11 лет, полевой опыт показал значительные выгоды. На среднем Западе у несушек 50 недельного возраста в среднем падеж составлял 2,31%, и был понижен до 1,51% трёхкратной дозой вакцины.* На Востоке Соединенных Штатов падёж среди поголовья, в сравнении с уровнем падежа за предыдущие пять циклов выращивания, снизился с более чем трёх процентов до одного процента.
Полевые испытания в США с более чем 300000 голов родительского стада бройлеров, вакцинированных перед периодом яйцекладки, показали снижение падежа с 2,8% до 1,9%, и только двум стадам из 28 потребовалась антибиотикотерапия, в сравнении с 13-ю из 28 не вакцинированных стад [1].
*Важно отметить, что в данных исследованиях, осуществленных в США, назначалась более чем 1 доза вакцины, график вакцинации был откорректирован ветеринарным врачом.
Применение Пулвак E. coli на бройлерах.
Полевые опыты продемонстрировали успех вакцины в защите от различных гетерогенных серотипов на бройлерных фабриках в США, в истории которых отмечались проблемы с E. coli, показывая, что определение серотипов не критично для эффективной вакцинации [1].
Потенциал Пулвак E. coli был продемонстрирован в опыте, осуществлённом в Университете Оберна. При экспериментальном подкожном заражении, провоцирующем развитие целлюлита, вакцина на 16% снизила негативное влияние инфекции на привесы, на 32% уменьшила проявление общего колибациллёза, на 51% падеж и на 60% индекс целлюлитных поражений [5].
В полевых испытаниях в Джорджии на бройлерах более четырёх миллионов голов были вакцинированы в инкубаторе Пулвак E. coli. У вакцинированной птицы была лучше конверсия корма (1,79 против 1,84 у контроля) и со снижением уровня загрязнения на линии забоя с 1,22% до 0,73%, снижение затрат составило 0,51 цент на кг живого веса.
На другом испытании на бройлерах с участием более чем двух миллионов голов птицы в Арканзасе, сохранность улучшилась с 95,20 до 95,77 процентов и конверсия корма улучшилась с 1,95 до 1,90, что дало экономию 0,45 центов на кг живого веса [1].
Суммируя данные от использования Пулвак E. coli на 2 миллионах бройлеров в проблемной по E. coli птицефабрике в сравнении с 2 миллионами не вакцинированных бройлеров в аналогичных условиях откорма, получены следующие результаты: вакцина обеспечила 40% защиту против септицемии и 63% против аэросаккулитов. Индекс целлюлитных поражений снизился на 58%[5].
Полевой опыт из Марокко, получен из 15 ферм на 112000 бройлерах, вакцинированных Пулвак E. coli в инкубаторе или в первый день жизни на ферме, и сопоставлен с иными 112000 головами, выращенными на тех же фермах в качестве не вакцинированного контроля.
У вакцинированной птицы были лучше показатели по всем исследуемым параметрам. Падеж составил 7,7% против 8,8 у не вакцинированного контроля, проявления колибациллёза 1,7% против 3,5%. Среднесуточный привес увеличился с 59 до 61,3 граммов, в то время как конверсия улучшилась с 2,20 до 2,16.
Также у вакцинированной птицы значительно снизилась необходимость в антибиотикотерапии – 0,54 лечебных дня, в сравнении с 1,97 у контроля.
Применение Пулвак E. coli на индейке.
Индейка в высокой степени подвержена колибациллёзу, особенно в присутствии предрасполагающих факторов, присутствующих практически на каждом предприятии – вирус геморрагического энтерита и иммуносупрессивных агентов.
Доктор ветеринарной медицины Тура Бру и её коллеги осуществили опыт по использованию Пулвак E. coli на SPF индейке, с применением вакцины в возрасте 1 и 21 день. В опыте участвовало 80 голов, половина из которых получила вакцину. В последствии обе группы были заражены вирулентным O78 штаммом и содержались совместно. В первые 2 дня после заражения от колибациллёза пало 56% невакцинированной и 35% вакцинированной птицы.
В течение 7 дней из выживших голов 61,5% невакцинированной и 34,4% вакцинированной птицы имели выраженную клинику или пали от колибациллеза.
Опыты в Германии показали высокую степень защиты индейки, вакцинированной Пулвак E. coli методом крупнокапельного спрея, против интратрахеального заражения полевыми вирулентными штаммами E. coli.Использование Пулвак E. coli на индейке позволяет не только выращивать более здоровое поголовье, но и снизить использование антибиотиков [12].
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Вастесон И.
E.coli is a normal inhabitant of the gastrointestinal tract of all warm-blooded animals, but variants of this species is also among the important etiological agents of enteritis and several extraintestinal diseases. The E. coli strains that cause diarrhoeal illness are categorised into pathogenicity groups based on virulence properties, mechanisms of pathogenicity, clinical symptoms and antigenic properties. The five main categories include enterotoxinogenic E. coli (ETEC), enteropathogenic E. coli (EPEC), enteroaggregative E. coli (EAggEC), enteroinvasive E. coli (EIEC) and Shiga (Vero) toxin-producing E. coli (STEC/VTEC). From a zoonotic point of view, STEC is the only E. coli pathogenicity group of major interest, as the shiga toxin-producing strains are able to cause severe disease in humans when being transmitted through the food chain from their animal reservoirs. The focus of this manuscript is therefore on STEC; pathogenicity factors, disease, the reservoirs and on-farm ecology, transmission into the food chain, growth and survival in food and in the environment. (BMC OA)
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Вастесон И.
1. Зароза В.Г. Эшерихиоз телят. - М.: Агропромиздат, 1991.
2. Мнацаканов С.Т. Энтеротоксигенность и антигены адгезии у энтеробакте-рий, выделенных от крупного рогатого скота. Биол. журн. Армении, 1987, 2, 152—154.
3. Светоч Э.А., Баннов В.А., Гусев В.В., Борзенков В.Н. Распространенность E. coli с антигенами адгезии F18 и К88 у поросят-отъемышей. Ветеринария, 2006, 5, 24—27.
4. Шульга Н.Н., Яковлева Н.В. Ситуация по колибактериозу телят в Амурской области. Ветеринария, 2006, 7, 21—23.
5. DeRycke J. Role des souches Escherichia coli non enterotoxinogenes (K99 sup (-), ST sup (-) DaNS La patnologie -neonatale du ea. Ann Rech Vet, 1984, 15, 1, 75—95.
6. Garabal J.I., Gonzalez E.A., Vazquez F. et al. Toxigenic E. coli in Spanish piggeries from 1986 to 1991. Vet Microbiol, 1995, 47, 1/2, 17—25.
УДК 619:579.842.11:636 - 053.2 (470.620) СПОНСОР ПУБЛИКАЦИИ
7. Garabal J.I., Vazquez F., Blanco J. et al. Colonization antigens of enterotoxigenic Escherichia coli strains isolated from piglets in Spain. Vet Microbiol, 1997, 54, 3/4, 321—328.
8. Osek J. Virulence factors and genetic relatedness of Escherichia coli strains isolated from pigs with post-weaning diarrhea. Vet Microbiol, 2000, 71, 3/4, 211—222.
9. Smith H.R., Scotland S.M., Willshaw G.A. et al. Vero-cytotoxin production and presence of VT-genes in Escherichia coli strains of animal origin. Microbiol, 1988, 134, 3, 531—533.
10. Sueyoshi J. Diarrhea due to attachiung and effacing Escherichia coli (026) infection in a calf Japan J Vet Sci, 1990, 52, 6, 1347—1350.
V.I. Terekhov, Y.M. Karaev, N.V. Kogdenko, N.V. Kotkova. Antigenic structure and pathogenic properties of E. coli isolated from calf and pigs in Krasnodar territory
Зооантропонозные штаммы кишечной палочки
И. Вастесон, Norwegian School of Veterinary Science (г. Осло, Норвегия)
Сокращения: ВПШ — веротоксигенные штаммы; КРС — крупный рогатый скот; с/х — сельскохозяйственный
E. coli впервые описал бактериолог Т. Эшерих в 1885 г. Изолированную из фекалий здорового ребенка бактерию он назвал Bacterium coli commune. До 50-х годов минувшего столетия микроорганизм в большей или меньшей степени считали нормальным непатогенным обитателем кишечника теплокровных животных и человека. Однако большое количество исследований, проведенных в последние 5 десятилетий, показало, что E. coli является этиологическим агентом энтеритов и целого ряда внекишечных болезней (урогенитальных, раневых инфекций, мастита, септицемии и менингита).
Диареегенные штаммы E. coli
Для дифференциации полезных и патогенных вариантов E. coli ее штаммы, способные вызывать диарею, делят на пять групп, различающихся вирулентными и иммунологическими свойствами, механизмами патогенеза и характером симптоматики вызываемых заболеваний: энтеротоксигенную, эн-теропатогенную, энтероаггрегативную, энтероинвазивную и веротоксинпродуцирующую [18].
Наиболее важным фактором вирулентности энтеропато-генных штаммов E. coli является способность прикрепляться к клеткам и индуцировать в них изменения, обеспечивающие инвазию возбудителя. В развивающихся странах эти штаммы служат основной причиной диареи детей. Частым источником заражения людей и животных энтеротоксигенными и
энтеропатогенными штаммами кишечнои палочки служит питьевая вода, контаминированная сточными водами или экскрементами.
Патогенность энтероаггрегативных штаммов E. coli признается не всеми исследователями, но их нередко выделяют от детеИ с хронической диареей. Они способны прикрепляться к клеткам перевиваемой линии HEP2, а некоторые энтероаггре-гативные штаммы образуют термостабильный энтеротоксин, который может быть ассоциирован с их патогенностью.
Энтероинвазивные штаммы E. coli вызывают у людей болезнь, клинически сходную с шигеллезом. В отличие от других вариантов кишечной палочки они способны инвазировать эпителиальные клетки ободочной кишки и размножаться в них.
Единственным вариантом E. coli, который можно считать опасным зооантропонозным возбудителем, являются ВПШ. Эти штаммы способны передаваться от животных по пищевой цепочке, вызывая у людей тяжелую болезнь. Им и посвящена данная публикация.
ВПШ кишечной палочки
Серотип O157:H7 можно считать прототипом ВПШ E. coli, патогенных для человека. Этот серотип ответственен за многочисленные вспышки пищевых токсикоинфекций, первые из которых, по всей видимости, произошли в США в 1992. 93 гг. В Европе причиной таких вспышек стали также серогруппы O26, 0103, O111 и O145. Очевидно, важно знать резервуары этих возбудителей.
Основу вирулентности ВПШ обеспечивают токсины, вызывающие цитотоксические изменения в клетках перевиваемой линии Vero. Веротоксины E. coli бывают двух типов. Веротоксины stx1 идентичны шигатоксину, синтезируемому Shigella dysenteriae [17]. Веротоксины stx2 — гетерогенная группа токсичных субстанций, вариабельно отличающихся структурой и свойствами от шигатоксина S. dysenteriae. В настоящее время их дифференцируют преимущественно в полимеразной цепной реакции.
У ВПШ E. coli найдены и другие факторы вирулентности. Например, установлено, что они способны сглаживать поверхность клеток хозяина, к которым прикрепились, и се-кретировать гемолизины, информация о которых хранится в плазмидах. У людей они вызывают диарею вариабельной тяжести (от легкой до тяжелой кровянистой) [17], а также в
спорадических случаях гемолитический уремический синдром и тромбогемолитическую тромбоцитопеническую пурпуру [17]. Гемолитический уремический синдром может сопровождаться хроническим поражением почек. Для спасения жизни пациентов с такой патологией приходится прибегать к диализу и трансплантации почек. Второй из упомянутых синдромов после 3. 4-дневного инкубационного периода также проявляется геморрагическим колитом, но в последующем осложняется неврологическими нарушениями [3]. Группой максимального риска по этим патологиям являются дети дошкольного и младшего школьного возраста — 0,6 % из них умирает. Минимальная заражающая доза возбудителя очень низка — около 50 бактерий.
Традиционные подходы к борьбе с инфекционными болезнями, основанные на уничтожении неблагополучного поголовья или выявлении и выбраковке носителей возбудителя, при данной инфекции не нашли применения. Более практичным представляется применение таких технологий выращивания скота, при которых снижается риск контаминации агентом воды и кормов, что неизбежно ведет к уменьшению распространения инфекции в стаде.
В Норвегии, как показали обследования скотоводческих хозяйств, проведенные в 1995 и 1998/99 гг., распространение серотипа O157:H7 не превышает 0,35.1 % [10, 21]. Аналогичное обследование 60 датских ферм, проведенное в 1999 г. в Южной Ютландии, выявило неблагополучие 10 (17 %) стад [19]. Штаммы данного серотипа, образующие токсины stx2, чаще находили в фекалиях норвежского скота на фермах, где практикуется его беспривязное содержание; продажа скота и контакты во время пастбищного периода животных разных стад признали при этой инфекции эпизоотически незначимыми [21].
В опытах, проведенных на овцах и КРС, установили, что кормление сеном в большей степени предрасполгает к длительному носительству серотипа O157:H7, чем рацион, богатый концентратами [9, 11]. Изменение рациона также оказывает влияние на пролиферацию в кишечнике и экскрецию с фекалиями данного серотипа [12].
В пищевой индустрии все сильнее проявляется тенденция
применения щадящих методов консервации продуктов. Чтобы это не привело к повышению риска заражения населения ВПШ E. coli, необходимо владеть информацией о их выживании в различных субстратах. Установлено, что ВПШ E. coli длительно сохраняют жизнеспособность в фекалиях, особенно при низкой температуре и высокой влажности [2, 14]. Фекалии служат важнейшим субстратом, в котором ВПШ E. coli сохраняются в окружающей среде, через который происходит контаминация урожая растений и источников питьевой воды, приводящая к заражению людей. Низкая заражающая доза ВПШ E. coli делает такие объекты опасными источниками инфекции. В условиях эксперимента контаминация серотипом O157:H7 почвы, обогащенной остатками травы, сохранялась на протяжении нескольких месяцев. В теплой бедной органическими веществами воде бактерия быстро погибает, но при низкой температуре и значительной контаминации воды фекалиями она сохраняется месяцами.
Гены, кодирующие синтез веротоксинов ВПШ E. coli, локализуются в лизогенных бактериофагах [22]. Они могут циркулировать между различными штаммами E. coli [1]. Можно предположить, что генотип фага влияет на передачу им генов веротоксинов между бактериями и тем самым на распространение ВПШ E. coli. Установлено, что Stx-бакте-риофаги длительнее сохраняют жизнеспособность в воде, чем кишечная палочка, и резистентны к хлорированию сточных вод [15, 16].
В заключение отметим, что ВПШ E. coli представляют серьезную угрозу для здоровья людей. Их токсигенность служит причиной возникновения тяжело протекающих синдромов, которые в ряде случаев завершаются летальным исходом. Контаминация фекалиями инфицированных животных воды, почвы и растений служит основным фактором, обеспечивающим сохранение ВПШ E. coli в окружающей среде и заражение ими животных и людей. В связи с этим наиболее эффективный способ предотвращения распространения ВПШ E. coli состоит в снижении риска такой контаминации.
1. Acheson D.W., Reidl J., Zhang X. et al. Infect Immun, 1998, 66, 4496—4498.
2. Bolton D.J., Byrne C.M., Sheridan J.J. et al. J Appl Microbiol, 1999, 86, 407—411.
3. Coia J. FEMS Immunology and Med Microbiol, 1998, 20, 1—9.
4. Hancock D.D., Besser T.E., Rice D.H. Ecology of Escherichia coli O157:H7 in cattle and impact of management practices. In: Kaper J.B., O'Brien A.D. (Ed.), E. coli and other Shiga toxin-producing E. coli strains. Washington D.C., ASM Press, 1998, 85—91.
5. Hancock D.D., Besser T.E., Rice D.H. et al. Prev Vet Med, 1998, 35, 11—19.
6. Hancock D.D., Rice D.H., Herriott D.E. et al. J Food Prot, 1997, 60, 363—366.
7. Hancock D.D., Rice D.H., Thomas L.A. et al. J Food Prot. 1997, 60, 462—465.
8. Hancock D.D., Besser T., Lejeune J. et al. Int J Food Microbiol, 2001, 66, 71—78.
9. Hovde C.J., Austin P.R., Cloud K.A. et al. Appl Environ Microbiol, 1999, 65, 3233—3225.
10. Johnsen G., Wasteson Y., Heir E. Int J Food Microbiol, 2001, 65, 193—200.
11. Kudva I.T., Hunt C.W., Williams C.J. et al. Appl Environ Microbiol, 1997, 63, 3878—3886.
12. Magnuson B.A., Davis M., Hubele S. et al. Infect Immun, 2000, 68, 3808—3814.
13. Mainil J. Vet Res, 1999, 30, 235—257.
14. Maule A. Intern Food Hygiene, 1999, 9, 21—23.
15. Muniesa M., Jofre J. Appl Environ Microbiol, 1998, 64, 2443—2448.
16. Muniesa M., Lucena F., Jofre J. Appl Environ Microbiol, 1999, 65, 5615— 5618.
17. Nakao H., Takeda T. J Natur Toxins, 2000, 9, 299—313.
18. Nataro J.P., Kaper J.B. Clin Microbiol Rev, 1998, 11, 142—201.
19. Nielsen E.M. Acta Vet Scand, 2001, 95.
20. Vold L., Wasteson Y., Skjerve E. Acta Clin Belgica, 1999, 1, 50-54.
21. Vold L., Klungseth J.B., Kruse H. et al. Epidemiol Infect, 1998, 120, 21—28.
22. Wagner P.L., Acheson D.W.K., Waldor M.K. Infect Immun, 1999, 67, 6710—6714.
Y. Wasteson. Zoonotic Escherichia coli. Acta Vet Scand, 2001, Suppl. 95, 79—84.
Читайте также:


