Назовите антигены кишечной палочки и их локализацию в бактериальной клетке
Антигены бактерий по локализации подразделяют на капсульные, соматические, жгутиковые и антигены экзопродуктов (рис. 9.6).

Рис. 9.Б. Схема расположения антигенов у бактерии:
К — капсульный, 1 — вирулентности, Н — жгутиковый, 0 — соматический
Капсульные антигены, или К-антигены, являются самыми внешними постоянными структурами поверхности микробной клетки. По химическому строению их идентифицируют в основном как полисахариды, хотя прежнее подразделение К-антигенов эшерихий на Ь- и В-термолабильные антигены допускало и белковую природу этих структур. Их основу у пневмококков составляют повторяющиеся сахара: Э-глюкоза, О-галактоза и Ь-рамноза.
В антигенном отношении капсульные полисахариды неоднородны. У пневмонийных стрептококков, например, различают более 80 серологических вариантов (сероваров), что широко используется в диагностической и лечебно-профилактической работе. К более однородным К-антигенам полисахаридной природы относят Уьанти- гены энтеробактерий, бруцелл, франциселл; полисахарид-белковой природы — У-У-антигены иерсиний; белковой природы — М-про- теин стрептококков группы А, протеин А стафилококков, антигены К-88 и К-99 эшерихий.
Из других внешних структур, обладающих антигенными свойствами, можно назвать корд-фактор микобактерий, полипептидные капсулы сибиреязвенного микроба, но их из-за непостоянства не относят к капсульным антигенам.
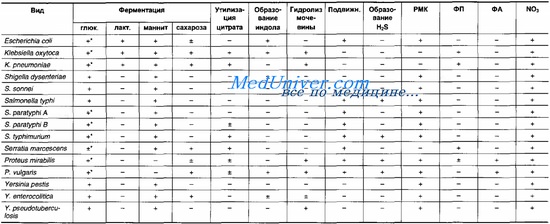
Соматические антигены, или О-антигены, представляют собой боковые олигосахаридные цепи липополисахаридов (эндотоксина), выступающие над поверхностью клеточной стенки грамотрицательных бактерий. Концевые углеводные остатки в боковых олигосахаридных цепях могут различаться как порядком расположения углеводов в оли- госахаридной цепи, так и стерически. Фактически они и являются антигенными детерминантами. У сальмонелл насчитывают около 40 таких детерминант, до четырех на поверхности одной клетки. По их общности сальмонелл объединяют в О-группы. Однако специфичность О- антигена сальмонелл связана с дидезоксигексозами, в числе которых выявлены паратоза, колитоза, абеквоза, тивелоза, аскарилоза и др. Уникальные концевые углеводные остатки, которые входят в структуру олигосахарида, являются наиболее удаленными от поверхности клетки и непосредственно связываются с активными центрами антител.
Наружная полисахаридная часть О-антигена (точнее, эндотоксина) ответственна за антигенные связи энтеробактерий, т.е. за неспецифические серологические реакции, с помощью которых может быть выявлен не только вид, но и штамм энтеробактерии.
О-антигены были названы соматическими, когда их точная локализация еще не была известна. Фактически же и К- и О-антигены являются поверхностными, разница состоит в том, что К-антиген экранирует О-антиген. Отсюда следует: прежде чем выявить О-анти- ген, необходимо взвесь исследуемых бактерий подвергнуть температурной обработке.
Жгутиковые антигены, или Н-антигены, имеют все подвижные бактерии. Эти антигены представляют собой термолабильные белковые комплексы жгутиков, которыми обладают многие энтеробактерии. Таким образом, энтеробактерии обладают двумя наборами антигенных детерминант — штаммоспецифической (О-антиген) и группоспецифической (Н-антиген и К-антиген).
Полная антигенная формула грамотрицательных бактерий записывается в последовательности О: Н : К. Антигены при этом являются наиболее стабильными маркерами определенных возбудителей, благодаря чему удается сделать серьезный эпизоотологический или эпидемиологический анализ.
Антигенными свойствами обладают также бактериальные споры. Они содержат антиген, общий для вегетативной клетки, и собственно споровый антиген.
Таким образом, постоянные, временные структуры и формы бактерий, а также их метаболиты обладают самостоятельными антигенными свойствами, характерными, однако, для определенных видов микроорганизмов. Поскольку все они являются маркерами особого строения ДНК у данного вида бактерий, часто на поверхности микробной клетки и в ее метаболитах содержатся общие антигенные детерминанты.
Последний факт имеет важное значение для совершенствования способов идентификации микроорганизмов. Так, например, вместо трудоемкой, дорогостоящей и не всегда воспроизводимой реакции нейтрализации для определения сероваров ботулинического микроба можно применять экспресс-метод, основанный на выявлении поверхностных детерминант при помощи иммунофлуоресценции.
В отличие от антигенов другого происхождения среди бактериальных антигенов выделяют так называемые протективные, или защитные, антигены. Выработанные на эти антигены антитела защищают организм отданного патогенного микроорганизма. Протективными свойствами обладают капсульные антигены пневмококков, М-проте- ин стрептококков, А-протеин стафилококков, белок второй фракции экзотоксина сибиреязвенных бацилл, белковые молекулы нижних слоев стенки некоторых грамотрицательных бактерий и др. Очищенные протективные антигены не обладают пирогенными, аллергенными свойствами, хорошо сохраняются и поэтому приближаются к идеальным вакцинным препаратам.
Протективные антигены обусловливают иммуногенность микробных антигенов. Антигены не всех микроорганизмов способны создавать одинаково выраженный иммунитет. Для повышения имму- ногенности в ряде случаев антиген смешивают с адъювантами — неспецифическими стимуляторами иммуногенеза минеральной или органической природы. Чаще с этой целью используют гидроокись алюминия, алюминиево-калиевые квасцы, ланолин, вазелиновое масло, липополисахарид бактерий, препараты бордетелл и др. Наиболее популярным у исследователей является адъювант Фрейнда, состоящий из вазелинового масла, ланолина (неполный адъювант) и микобактерий туберкулезной палочки (полный адъювант). Прививка людей инактивированными вакцинами против гриппа и полиомиелита с неполным адъювантом Фрейнда подтвердила их эффективность. Аналогичные адъюванты с успехом использовали для усиления иммуногенности вирусных вакцин против ящура, парагриппа типа 3, болезни Ауески, чумы плотоядных, инфекционного гепатита собак, болезни Гамборо, ньюкаслской болезни, гриппа лошадей, ро- тавирусной диареи телят и других болезней. Такие вакцины вызывают выраженный и продолжительный иммунный ответ. Благодаря этому значительно повышается эффективность вакцинации и сокращается количество ежегодных прививок. Каждый адъювант вводится в организм согласно прилагаемой к нему инструкции: подкожно, внутримышечно, внутрибрюшинно и т.д.
Сущность адъювантного действия названных препаратов заключается в сдерживании поступления смешанного с ними антигена в организм, что пролонгирует его иммунизирующее действие, снижает реактогенность, а в некоторых случаях вызывает бласт-трансформа- цию (рис. 9.7).

Рис. 9.7. Сдерживающее воздействие адъюванта на распространение антигена
Большинство адъювантов способны депонировать антиген, т.е. адсорбировать его на своей поверхности и длительное время сохранять в организме, что увеличивает продолжительность его влияния на иммунную систему. Однако при изготовлении антисыворотки для им- мунохимического анализа, особенно в целях установления природы антигенов или антигенных связей, избегают использования микробных адъювантов, поскольку они снижают специфичность антисыворотки. Происходит это за счет гетерогенности (или гетерофильнос- ти) антигенов, т.е. антигенной общности микробов различных таксономических групп, тканей растений, животных и человека.
Генетически чужеродные вещества, которые при внедрении в организм способны стимулировать иммунный ответ (клеточную реакцию, образование антител, аллергию, толерантность) и специфически реагировать с образовавшимися антителами как in vivo, так in vitro, называют антигенами.
Антиген должен быть чужеродным веществом для данного вида животного, иначе образование им специфи- ческих антител не произойдет. При определенных условиях (мутации, различные повреждающие действия) чужеродными могут стать и собственные клетки организма. Антиген вызывает в организме образование антител и реагирует с образовавшимися антителами как в живом организме, так и в пробирке. Антигенами могут быть белки, полисахариды, полипептиды, липополисахариды или нуклеиновые кислоты, клетки другого организма, микробы и продукты их жизнедеятельности.
| Полноценные антигены |
Полноценные антигены вызывают в организме синтез антител или сенсибилизацию лимфоцитов и вступают с ними в реакцию как in vivo, так и in vitro. Для полноценных антигенов характерна строгая специфичность, т. е. вызывают в организме выработку только специфических антител, вступающих в реакцию только с данным антигеном. К таким антигенам относят белки животного, растительного и бактериального происхождения.
| Неполноценные антигены (гаптены) |
Неполноценные антигены (гаптены)представляют собой сложные углеводы, липиды и другие вещества, не способные вызывать образование антител, но вступающие с ними в специфическую реакцию. Гаптены приобретают свойства полноценных антигенов лишь при условии введения их в организм в комплексе с белком.
Типичными представителями гаптенов являются липиды, полисахариды, нуклеиновые кислоты, а также простые вещества: краски, амины, йод, бром и др.
| Конъюгированные антигены |
Конъюгированные антигены- белки, которые приобрели новую антигенную специфичность благодаря присоединению к ним с помощью химической связи новой химической группировки.
| Аутоантигены |
Аутоантигены. Иногда белки собственных тканей (сердца, печени, почек и др.) при соединении с бактериальным белком, токсинами и ферментами бактерий, лекарственными веществами, под влиянием физических факторов (облучение, ожог и др.) изменяют свои физико-химические свойства и становятся чужеродными для собственного организма. На эти антигены организм вырабатывает антитела, возникают аутоиммунные болезни.
Антигены бактерий по локализации подразделяют на капсульные (К), соматические (О), жгутиковые (Н) и антигены экзопродуктов. В свою очередь К - антигены разделяют на (L, В) термолабильные и (А, М) термостабильные антигены.
| Капсульные антигены |
Капсульные антигены представлены белками, полисахаридами
| Соматические антигены |
Соматические антигены. Расположены не только в цитоплазме, а в основном на поверхности микробной клетки, имеют разнообразный химический состав, отличаются термостабильностю. В практике для обнаружения 0-антигенов микроорганизмы подвергают температурной обработке.
| Жгутиковые антигены |
Жгутиковые антигены. Представляют собой термолабильные белковые комплексы жгутиков, обладающих у многих энтеробактерий специфической и неспецифической (групповой) фазой.
| Антигены экзопродуктов |
Антигены экзопродуктов. Включают метаболиты бактериальной клетки, среди которых наиболее полно изучены экзотоксины.
Все типы антигенов у многих видов патогенных микробов отличаются неоднородностью. На этом основании их подразделяют на варианты обозначаемые цифрами или буквами. Полная антигенная формула включает все обнаруженные у данного штамма микроорганизма варианты антигенов. Например, у кишечной палочки может быть такая антигенная формула: 0 17: К 6: Н 5.
Среди бактериальных антигенов выделяют так называемые протективные или антигены главного действия, защитные антигены. Выработанные на них антитела защищают организм от данного микроба. Очищенные протективные антигены могут быть "идеальными" вакцинными препаратами.
Антигены обладают детерминантами-участками молекул, определяющими специфичность реакции антиген-антитело. Это концевые структуры антигена, имеющие сравнительно небольшие размеры (5-7 аминокислот).
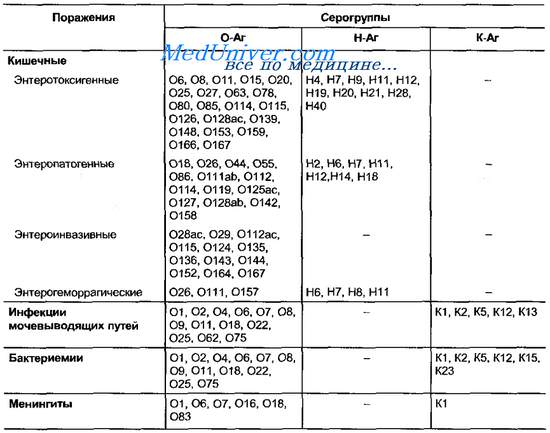
Существуют следующие разновидности бактериальных антигенов: группоспецифические (встречаются у разных видов одного рода или семейства); видоспецифические (встречаются у различных представителей одного вида); типоспецифические (определяют серологические варианты – серовары).
В зависимости от локализации в бактериальной клетке различают:
1) жгутиковые Н-АГ, локализуются в жгутиках у бактерий, основа его белок флагеллин, термолабилен;
2) соматический О-АГ связан с клеточной стенкой бактерий. Его основу составляют ЛПС, по нему различают сероварианты бактерий одного вида. Он термостабилен, не разрушается при длительном кипячении, химически устойчив (выдерживает обработку формалином и этанолом);
3) капсульные К-АГ располагаются на поверхности клеточной стенки. По чувствительности к нагреванию различают 3 типа К-АГ: А, В, L. Наибольшая термостабильность характерна для типа А, тип В выдерживает нагревание до 60 0 С в течение 1 часа, тип L быстро разрушается при этой температуре. На поверхности возбудителя брюшного тифа и др.энтеробактерий, которые обладают высокой вирулентностью можно обнаружить особый вариант капсульного АГ –Vi-антиген;
4) антигенными свойствами обладают также бактериальные белковые токсины, ферменты и некоторые др. белки.
Антигены вирусов:
1) суперкапсидные АГ – поверхностные оболочечные;
2) белковые и гликопротеидные АГ;
3) капсидные – оболочечные;
4) нуклеопротеидные (сердцевидные) АГ.
Существует 5 классов иммуноглобулинов у человека:
1) иммуноглобулин класса G – это мономер, включающий в себя 4 субкласса (IgG1, IgG2, IgG3, IgG4), которые отличаются друг от друга по аминокислотному составу и антигенным свойствам, имеет 2 антигенсвязывающих центра. На долю его приходится 70-80% всех сывороточных Ig. Период полураспада 21 день. К основным свойствам IgG относятся: играют основополагающую роль в гуморальном иммунитете при инфекционных заболеваниях; проникает через плаценту и формирует антиинфекционный иммунитет у новорожденных; способны нейтрализовать бактериальные экзотоксины, связывать комплемент, участвовать в реакции преципитации. Хорошо определяется в сыворотке крови на пике первичного и при вторичном иммунном ответе. IgG4 участвует в развитии аллергической реакции 1 типа.
2) иммуноглобулин класса М – пентамер, который имеет 10 антигенсвязывающих центров. Период полураспада 5 дней. На его долю приходится около 5-10% всех сывороточных Ig. Образуется в начале первичного иммунного ответа, также первым начинает синтезироваться в организме новорожденного – определяется уже на 20-й неделе внутриутробного развития. Свойства: не проникает через плаценту; появляется у плода и участвует в антиинфекционной защите; способны агглютинировать бактерии, нейтрализовать вирусы, активировать комплемент; играют важную роль в элиминации возбудителя из кровеносного русла, активации фагоцитоза; образуются на ранних сроках инфекционного процесса; отличаются высокой активностью в реакциях агглютинации, лизиса и связывания эндотоксинов грамотрицательных бактерий.
3) иммуноглобулин класса А –существует в сывороточной и секреторной формах. На долю сывороточного Ig приходится 10-15%, мономер, имеет 2 антигенсвязывающих центра, период полураспада 6 дней. Секреторный Ig существует в полимерной форме. Содержатся в молоке, молозиве, слюне, слезном, бронхиальном, желудочно-кишечном секрете, желчи, моче; участвуют в местном иммунитете, препятствуют прикреплению бактерий к слизистой, нейтрализуют энтеротоксин, активируют фагоцитоз и комплемент.
4) иммуноглобулин класса Е-мономеры, на долю которых приходится 0,002%. К этому классу относится основная масса аллергических антител – реагинов. Уровень IgЕ значительно повышается у людей, страдающих аллергией и зараженных гельминтами.
5) иммуноглобулин класса Д –это мономер, на долю которого приходится 0,2%. Плазматические клетки, секретирующие IgД локализуются преимущественно в миндалинах и аденоидной ткани. Участвует в развитии местного иммунитета, обладает антивирусной активностью, в редких случаях активирует комплемент, участвует в дифференцеровке В-клеток, способствуют развитию антиидиотипического ответа, участвует в аутоиммунных процессах.
Способность синтезировать АТ макроорганизм приобретает довольно рано. Уже на 13 неделе эмбрионального периода развития возникают В-лимфоциты, синтезирующие IgМ, а на 20 неделе этот Ig можно определить в сыворотке крови. Концентрация антител достигает максимума к периоду полового созревания и сохраняется на высоких цифрах в течение всего репродуктивного периода. В старческом возрасте содержание антител снижается. Повышение количества Ig наблюдается при инфекционных заболеваниях, аутоиммунных расстройствах, снижение его отмечено при некоторых опухолях и иммунодефицитных состояниях. Антителопродукция в ответ на антигенный стимул имеет характерную динамику. Выделяют латентную, логарифмическую, стационарную фазы и фазу снижения. В латентную фазу антителопродукция практически не изменяется и остается на базальном уровне. Во время логарифмической фазы наблюдается интенсивный прирост количества антиген-специфичных В-лимфоцитов и происходит нарастание титра АТ. В стационарной фазе количество специфических антител и синтезирующих их клеток достигает максимума и стабилизируется. В фазе снижения наблюдается постепенное уменьшение титров антител. При первичном контакте с антигеном развивается первичный иммунный ответ. Для него характерны длительная латентная (3-5 суток) и логарифмическая (7-15 суток) фазы. Первые диагностически значимые титры антител регистрируются на 10-14-е сутки от момента иммунизации. Стационарная фаза продолжается 15-30 суток, а фаза снижения – 1-6 месяцев. В итоге первичного иммунного реагирования формируются многочисленные клоны антигенспецифичных В-лимфоцитов: антителопродуцирующих клеток и В-лимфоцитов иммунологической памяти, а во внутренней среде макроорганизма в высоком титре накапливаются IgG и/или IgА (а также IgЕ). Со временем антительный ответ угасает. Повторный контакт иммунной системы с тем же антигеном ведет к формированию вторичного иммунного ответа. Для вторичного ответа характерна укороченная латентная фаза (от нескольких часов до 1-2 суток). Логарифмическая фаза отличается более интенсивной динамикой прироста и более высокими титрами специфических антител. При вторичном иммунном ответе организм сразу же, в подавляющем большинстве синтезирует IgG. Характерная динамика антителопродукции обусловлена подготовленностью иммунной системы к повторной встрече с антигеном за счет формирования иммунологической памяти.
Явление интенсивного антителообразования при повторном контакте с антигеном широко используется в практических целях, например при вакцинопрофилактике. Для создания и поддержания иммунитета на высоком защитном уровне схемы вакцинации предусматривают первичное введение антигена для формирования иммунологической памяти и последующие ревакцинации через различные интервалы времени.
Этот же феномен используют при получении высокоактивных лечебных и диагностических иммунных сывороток (гипериммунных). Для этого животным или донорам производят многократные введения препаратов антигена по специальной схеме.
Иммунный статус – это структурное и функциональное состояние иммунной системы индивидуума, определяемое комплексом клинических и лабораторных иммунологических показателей.
На иммунный статус оказывают влияние следующие факторы: 1) климато-географические (температура, влажность, солнечная радиация, длина светового дня); 2) социальные (питание, жилищно-бытовые условия, профессиональные вредности); 3) экологические (загрязнение окружающей среды радиоактивными веществами, применение пестицидов в сельском хозяйстве); 4) влияние диагностических и лечебных манипуляций, лекарственная терапия; 5) стресс.
Иммунный статус можно определить путем постановки комплекса лабораторных тестов, включающих оценку состояния факторов неспецифической резистентности, гуморального (В) и клеточного (Т) иммунитета. Оценка иммунного статуса проводится в клинике при трансплантации органов и тканей, аутоиммунных заболеваниях, аллергиях, для контроля эффективности лечения болезней, связанных с нарушением иммунной системы. Оценка иммунного статуса чаще всего базируется на определении следующих показателей:
1) общего клинического обследования (жалобы больного, профессия, осмотр);
2) состояния факторов естественной резистентности (определяют фагоцитоз, комплемент, интерфероновый статус, колонизационную резистентность);
3) гуморального иммунитета (определение иммуноглобулинов класса G, М, А, Д, Е в сыворотке крови);
4) клеточного иммунитета (оценивается по количеству Т-лимфоцитов – реакция розеткообразования, определение соотношения хелперов и супрессоров Т4 и Т8 лимфоцитов, которое в норме составляет примерно 2);
5) дополнительных тестов (определение бактерицидности сыворотки крови, титрование С3, С4 компонентов комплемента, определение содержания С-реактивного белка в сыворотке крови, определение ревматоидных факторов.
|