Паразитарные болезни человека при иммунодефиците
Паразитарные инфекции представляют собой разнообразный спектр симптомов и заболеваний, которые вызваны попаданием яиц или взрослой особи паразита в организм человека. Зачастую первые признаки заболевания невозможно обнаружить на протяжении нескольких дней, а в некоторых случаях нескольких месяцев и даже лет. Это связано с жизненным циклом паразитов и их основными функциями: хорошая маскировка и поддержание собственной жизни за счет получения питательных веществ от организма носителя.
Виды паразитов и их характеристика
Паразитарные инфекции в зависимости от определенных свойств их проявления делятся на три группы:
Основной локализацией служит поверхность тела человека. К ним относятся вши, блохи, клещи и клопы. Питаются преимущественно кровью человека, хотя в отдельных случаях, как, например, с клещами, которые вызывают демодекоз, основное питание – секрет сальных желез или отмершие клетки эпителия (кожи).
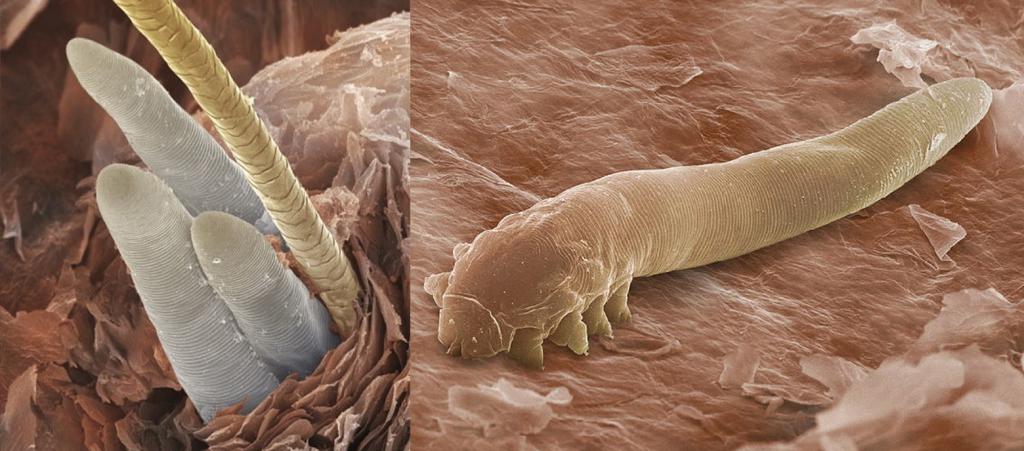
Первые признаки паразитарной инфекции достаточно легко распознать, так как они вызывают зуд и жжение в местах своего обитания. Некоторые эктопаразиты являются переносчиками серьезных заболеваний: тиф, сибирская язва, энцефалит и трипаносомоз. Они наносят огромный ущерб человеческому здоровью, вплоть до летального исхода.
2. Эндопаразиты (простейшие).
В основном поражают внутренние органы. По своей структуре являются одноклеточными, отсюда и название – простейшие. Несмотря на это, они способны привести к тяжелым формам болезней. Основными заболеваниями данной группы являются паразитарная инфекция крови, вызванная токсоплазмой, и кишечные инфекции, спровоцированные амебой или лямблиями.
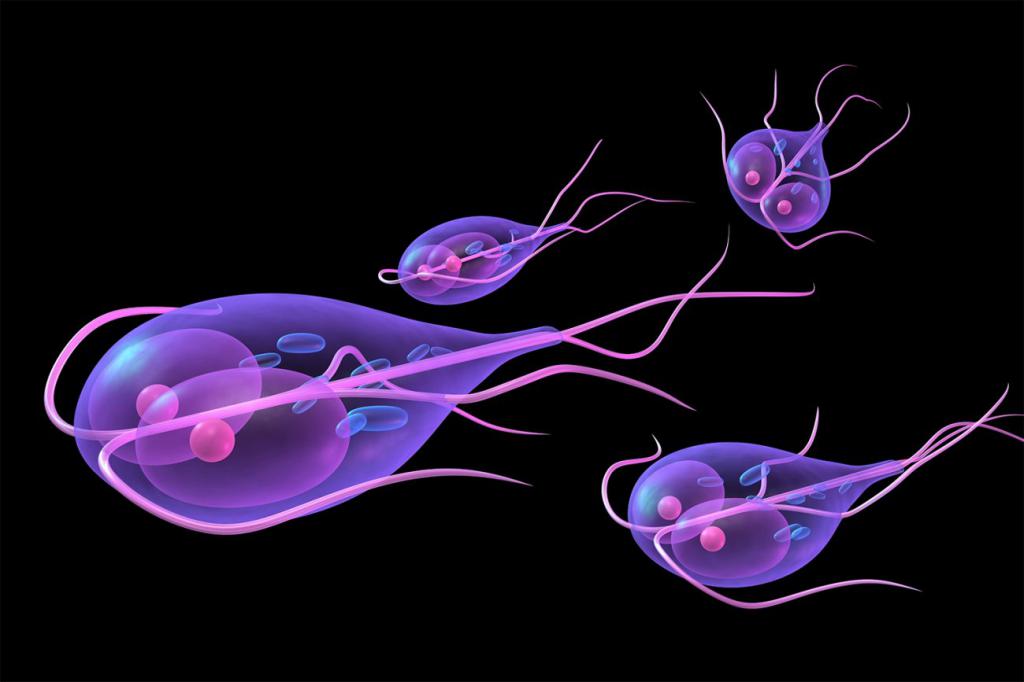
Являются возбудителями наиболее распространенных форм паразитарных инфекций. В организме человека их циклы развития в основном проходят в кишечнике и тканях, где и начинается проявление симптомов заболеваний.
Круглые черви (нематоды)
Это паразиты, тело которых в поперечном разрезе круглой формы. Легко различимы половые признаки. Самки, как правило, крупнее самцов. Но также у представителей данного класса встречаются гермафродиты. Все нематоды проходят стадии развития: яйцо, личинка, взрослая особь. К этому классу относятся:
- Острица. Вызывает заболевание энтеробиоз. Преимущественно поражает детей дошкольного и младшего школьного возраста.
- Власоглав. Вызывает заболевание трихоцефалез. Имеет отличительную форму тела. 2/3 длины тела имеет тонкий диаметр, напоминающий человеческие волосы или нить. Другой конец тела более крупного диаметра, в нем располагается кишечник.
- Аскарида. Вызывает заболевание аскаридоз. Взрослые особи достигают размеров 25 см (самцы) и 40 см (самки). После попадания личинки в организм человека она проходит желудок, попадает в тонкий кишечник. Оттуда через поры с током крови попадает в печень, далее в сердце и затем в легкие, где развивается в течение 7-10 дней. Затем личинки начинают подниматься к гортани. Достигнув ротовой полости, они повторно заглатываются. После попадания в тонкий кишечник личинки уже не могут повторно проникнуть через поры в кровоток из-за своего большого размера. Там они растут до взрослых особей в течение 2-3 месяцев. После этого начинается размножение и цикл повторяется. Самка может откладывать более 200 тыс. яиц за сутки.

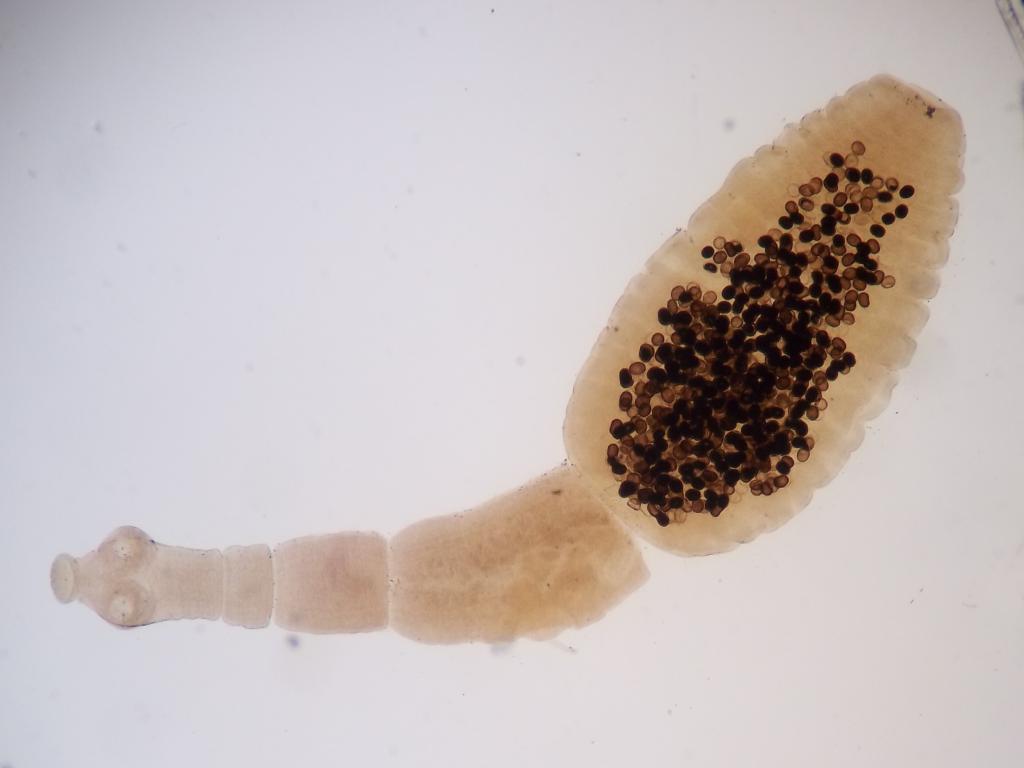
Ленточные черви (цестоды)
Это паразиты, тело которых напоминает форму ленты. Отличительной особенностью у данного класса является отсутствие пищеварительной системы. К ним относятся:
- Эхинококк. Вызывает заболевание эхинококкоз. Этот паразит имеет небольшой размер (2-9 мм) и состоит из нескольких члеников и присосок. В матке половозрелой особи содержится большое количество яиц, внутри которых находятся личинки. Основные места локализации эхинококка – печень и легкие. Там он вызывает хроническое заболевание, которое называется эхинококковой кистой.
- Бычий цепень. Вызывает заболевание тениаринхоз. На стадии личинки имеет промежуточного хозяина – крупнорогатый скот. Попадая в организм человека, развивается в тонком кишечнике до ленточной стадии. Тело взрослой особи паразита имеет до 1000 члеников, и в длину он может достигать 4-10 метров.
- Свиной цепень. Вызывает заболевание тениоз. Внешне очень похож на бычьего цепня. Также имеет промежуточных хозяев: свиньи, собаки, верблюды, зайцы и кролики. У человека паразитирует в кишечнике. Размеры взрослой особи в длину не превышают 4 метров.
- Лентец широкий. Вызывает заболевание дифиллоботриоз. Обитает в пресноводных водоемах. В качестве промежуточного хозяина использует рачков и рыб. В организме человека паразитирует в тонком кишечнике. В длину взрослая особь может достигать нескольких метров.
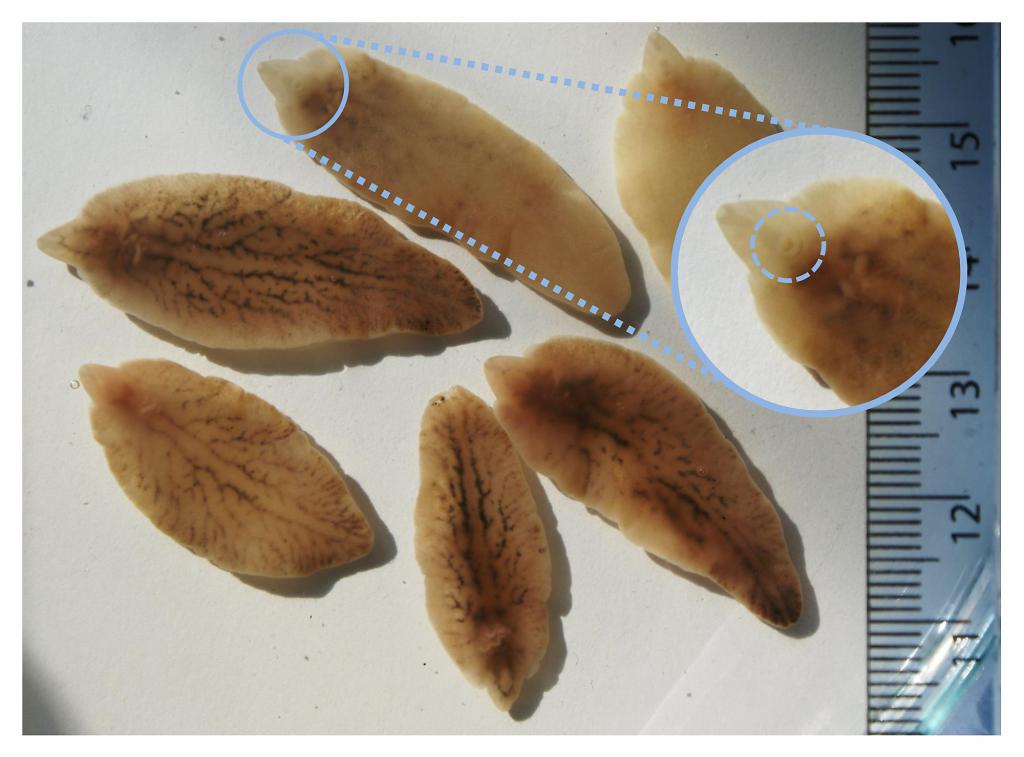
Плоские черви (трематоды)
За свой жизненный цикл эти паразиты могут менять нескольких промежуточных хозяев. У человека могут паразитировать в любом органе. В данную группу входят:
- Шистосомы. Вызывают заболевание шистосомоз. В организм человека могут попасть при контакте с зараженным пресным водоемом. Паразит проникает через кожу и попадает в кровеносную систему, где начинает активно размножаться. В сутки самки могут производить от 300 до 3000 яиц. Далее, с током крови, яйца разносятся по всему организму и продолжают свое развитие в любом органе. Длина их тела не превышает 0,1-0,2 см.
- Печеночные сосальщики. Вызывают заболевание описторхоз. Длина взрослой особи колеблется от 3 до 5 см. При попадании в организм человека паразитирует в желчных протоках, желчном пузыре, печени и поджелудочной железе. Закрепляется в этих органах с помощью присосок, расположенных на теле.
Пути проникновения паразитов в организм человека
- Алиментарный путь заражения считается самым распространенным. Человек заражается паразитом при употреблении в пищу плохо промытых овощей и фруктов. Особенную опасность несет мясо, которое не прошло достаточную термическую обработку. Также заражение человека паразитарной инфекцией имеет место, если не соблюдать правила личной гигиены. Например, не помыть руки перед едой.
- Трансплацентарный путь. Паразитарная инфекция передается от беременной женщины через плаценту к ребенку. Например, это такие заболевания, как токсоплазмоз, малярия или анкилостомоз.
- Перкутанный путь. Паразит проникает в организм человека через кожу. В основном это шистосомы и анкилостомы.
- Контактный путь. Паразит передается через грязные руки, загрязненные личные принадлежности, белье. Так чаще всего передаются вши, чесоточный зудень, острицы.
- Трансмиссивный путь. Заражение происходит после укуса насекомых, которые являются носителями паразитов. Например, малярия.
Симптомы
Многие паразитарные заболевания на ранних стадиях не имеют симптоматики. Это связано со стадиями развития возбудителя. Каждый отдельный вид паразита по мере своего роста проявляет себя по-разному. К часто встречающимся общим симптомам паразитарной инфекции относятся:
- Зуд.
- Покраснение кожи по типу крапивницы.
- Диарея.
- Запор.
- Метеоризм.
- Тошнота, рвота.
- Спазмы и болезненные ощущения в желудочно-кишечном тракте.
- Снижение массы тела без применения диет и повышенных физических нагрузок
- Лихорадочное состояние.
- Высокая температура тела (38-40 ˚С) в течение продолжительного периода.
- Продолжительные приступы сухого кашля.
- Увеличение лимфатических узлов.
- Болезненные ощущения в мышцах.
- Нарушения психоэмоционального характера.
Диагностика

При подозрении на наличие паразитарных заболеваний необходимо сдать ряд анализов. Диагностика паразитарных инфекций позволяет определить наличие или отсутствие паразита, его вид и место локализации в организме. Полученные данные помогут врачу поставить правильный диагноз и назначить корректное лечение.
К методам диагностики относятся:
I. Исследование кала. Позволяет определить наличие большинства видов паразитов, которые обитают в кишечнике. С фекалиями выделяются их яйца, личинки и сегменты тела. Существует два вида анализа:
- Исследуется образец кала на яйца и личинки гельминтов. Анализ доставляется в лабораторию, где врач делает мазки и рассматривает их под микроскопом. Такой метод применяется часто, но он не является достаточно точным. Для того, чтобы поставить окончательный диагноз, пациенту необходимо сдавать этот анализ до трех раз с небольшими временными промежутками. Это связано с жизненным циклом паразитов и откладыванием яиц, которые обнаруживаются данным методом исследования.
- Соскоб (смыв) со складок анального прохода. Этот анализ применяют для обнаружения только одного вида гельминтов – остриц. У детей паразитарная инфекция встречается чаще, чем у взрослых. По этой причине такой анализ проводят преимущественно детям. Лаборант смачивает ватную или стеклянную глазную палочку в воде или глицерине и делает смыв с перианальных складок. Далее наносит полученный материал на предметное стекло и рассматривает под микроскопом. Также этот анализ делается другим методом: лаборант приклеивает кусочек липкой ленты к анальному проходу, прижимает и отклеивает. Затем липкая лента приклеивается к предметному стеклу и также рассматривается под микроскопом. Диагностируется паразит достаточно точно. Применяя эти методы, лаборанту удается рассмотреть не только яйца гельминтов, но иногда и взрослых особей.
II. Исследование спинномозговой жидкости, мокроты, дуоденального содержимого (желчи), мочи. Назначают по результатам опроса пациента с целью определения наличия паразита и определения его локализации. Анализ этих биологических жидкостей исследуют с применением микроскопии и макроскопии. Сначала полученный образец рассматривают на предмет наличия взрослых особей, а после проводят микроскопию для обнаружения яиц и личинок паразитов.
III. Исследование крови. Современные методы исследования крови на паразитарные инфекции позволяют определить наличие и вид возбудителя с высокой точностью. Применяются три вида такой диагностики:
- Серологические реакции. Позволяют определить наличие антител паразитов в сыворотке крови пациента. Этот метод считается высокоспецифичным, но уступает ПЦР-диагностике.
- ПЦР-диагностика. Данный метод основывается на выявлении ДНК паразитов в любой биологической жидкости, которую взяли для анализа.
- Генетическое исследование. Заключается в обнаружении генома паразита в образце крови пациента. Этот метод применяется гораздо реже всех остальных, но имеет высокую точность.
IV. Исследование биопсийного материала и лимфоузлов. Для этого анализа врач проводит иссечение небольшого участка органа, ткани или целый лимфатический узел и отправляет на гистологическое исследование. Таким образом диагностируется наличие или отсутствие паразитов.
Рекомендации по подготовке к сдаче анализов
Прежде чем сдавать анализы на паразитарные инфекции, необходимо правильно к ним подготовиться. При соблюдении рекомендаций повышается точность диагностики, так как в материале отсутствуют мешающие факторы, влияющие на эффективность методов исследования.
Подготовка к сдаче анализа кала:
- Следует прекратить прием антибиотиков, противовоспалительных средств и антацидов. Также недопустимо применение лекарственных и других препаратов, содержащих висмут и железо.
- Если проводилось рентгенологическое исследование с применением бария или колоноскопия, при которой проводилась очищающая кишечник клизма, то анализ кала можно будет сдавать только спустя 2-3 дня.
- Не рекомендуется сдавать кал в случае начала менструальных кровотечений или обострения геморроя.
Подготовка к сдаче анализа крови:
- Необходимо прекратить прием фармакологических препаратов, которые влияют на формулу крови.
- За три дня до сдачи анализа следует соблюдать легкую диету, не употреблять жирные продукты, отказаться от алкоголя.
- Анализ крови на паразитарные инфекции сдают натощак. Разрешается употребление небольшого количества чистой питьевой воды.
Для остальных анализов чаще всего не требуется особенная подготовка. Необходимо будет только соблюдать рекомендации врача.
Лечение
К сожалению, симптомы паразитарных инфекций не всегда можно обнаружить на начальных этапах заболевания. В таких случаях лечение начинается с опозданием. Важно понимать: чем дольше паразит находится в организме, тем сложнее будет от него избавиться.
Терапия инфекционных и паразитарных инфекций разделяется на два направления:
- Симптоматическое лечение. Направлено на устранение клинических проявлений заболевания. К ним относятся снижение температуры тела, избавление от покраснений и зуда, нормализация работы желудочно-кишечного тракта.
- Этиологическое лечение паразитарных инфекций направлено на избавление от возбудителя заболевания.
В некоторых случаях может возникнуть необходимость в хирургическом вмешательстве. Оно применимо при альвеококкозе, эхинококкозе и некоторых видах заражения трематодами.
Только врач может назначить лечение паразитарных инфекций, основываясь на данных лабораторных исследований и опроса пациента.
Профилактика
Очень важно соблюдать профилактику паразитарных инфекций. В большинстве случаев это поможет избежать попадания в организм болезнетворных возбудителей.

К профилактическим мерам относятся:
- Соблюдение правил личной гигиены: необходимо мыть руки перед употреблением пищи, после посещения туалетной комнаты, заходя домой с улицы.
- Следует хорошо промывать овощи и фрукты.
- Обязательно нужно проводить достаточную термическую обработку мяса, рыбы и морепродуктов.
- В качестве питьевой воды не стоит использовать воду из-под крана, так как она не всегда может быть очищена от паразитов. Не поможет в качестве дополнительной очистки применение домашних фильтров. Оптимальным вариантом будет употребление кипяченой или бутилированной воды.
- Если дома живут домашние животные, то им необходимо проводить дегельминтизацию один раз в полгода. Также следует ограничить контакт с питомцем при наличии у него признаков паразитарных заболеваний и обратиться в ветеринарную клинику.
- Следует гладить нижнее белье (особенно детское) после стирки.
- После посещения экзотических стран, при работе с землей, а также сотрудникам детских учреждений рекомендуется обследоваться раз в год на предмет наличия паразитарных инфекций и при необходимости проводить профилактику лекарственными средствами.
Вторичные иммунодефициты возникают вследствие какого-либо другого заболевания.
Иммунодефициты при инфекциях и инвазиях.
Речь идет о паразитарных инвазиях (гельминтах, протозоях), бактериальной (туберкулез, сифилис, бруцеллез, пневмо- и менингококковая инфекция, скарлатина, коклюш и др.) и вирусной (вирусы, вызывающие корь, краснуху, гепатит, паротит, вирус иммунодефицита человека — ВИЧ) инфекции.
Иммунодефицит при паразитарных инвазиях может быть обусловлен следующими патогенетическими факторами:
- • угнетением функции макрофагов (например, при малярии);
- • нарушением иммунорегуляции;
- • выработкой лимфоцитотоксинов (трихинеллез, описторхоз) или супрессивно действующих факторов (шисто- и трипаносомоз).
Важную роль в развитии иммунодефицита при бактериальной инфекции играют липополисахариды (эндо- или экзотоксины бактерий) и элементы цитоплазмы бактерий, нарушающие функцию вилочко- вой железы, подавляющие функцию моноцитарно-макрофагальной системы и изменяющие клеточную кинетику и уровень внутриклеточного цАМФ.
Наиболее активное воздействие на иммунную систему оказывают вирусные инфекции. Снижение реакций клеточного иммунитета может быть причиной рецидивов бактериальных инфекций. Механизмы формирования иммунодефицита довольно разнообразны, но наиболее важными из них являются:
- • непосредственное поражение вирусом лимфоцитов или макрофагов (вирус Эпштейна — Барр, вирус иммунодефицита человека и др.);
- • иммуносупрессия, опосредованная вирус-индуцированными Т-клетками-супрессорами;
- • модификация мембран лимфоцитов, вызванная вирусом, иммунными комплексами, лимфоцитотоксическими антителами, интерфероном;
- • интерференция вирусной инфекции и дифференцировки.
Синдром приобретенного иммунодефицита (СПИД).
Впервые описан в 1981 г. в США, однако аналогичные наблюдения на Гаити и в США прослеживаются ретроспективно по крайней мере до 1978 г. В Центральной Африке аналогичные инфекции были известны намного раньше, причины их были неясны, а исход — предрешен. Число заболевших ежегодно удваивается, а соотношение инфицированных к заболевшим соответствует показателю 50—100:1. Возбудитель принадлежит к группе ретровирусов, его обозначают как HIV (ВИЧ) — вирус иммунодефицита человека (или ЛАВ-вирус, ассоциированный с лим- фаденопатией). Вирус передается через поврежденную слизистую оболочку (например, у гомосексуалистов), а также посредством инъекций (у наркоманов и др.). Другая возможность заражения — переливание крови или полученных из нее препаратов.
Вирус, прежде всего, поражает Т-хелперы (очевидно, их СБ4-маркер функционирует в качестве вирусного рецептора). Вирус проникает в клетку, затем его РНК посредством транскриптазы трансформируется, получает доступ к ДНК и встраивается в геном хозяина. Этими действиями начинается репликация вируса. Вирус также инфицирует клетки ЦНС, значительно реже его обнаруживают в В-клетках и макрофагах. Содержащие этот вирус клетки экспрессируют целый ряд специфических антигенов. В основе гибели или дисфункции пораженных клеток лежит цитопатогенный эффект. Примерно через 3—6 недель от начала инфекции развиваются общие симптомы: лихорадка, артрал- гия, миалгия, иногда экзантемы и желудочно-кишечные расстройства, лимфоцитарный плеоцитоз и менингит. В целом же характерными проявлениями заболевания являются иммунодефицит (поражение Т-хелперов) и энцефалопатия. Антитела удается выявить лишь через 8—12 недель [3].
Ряд клинических проявлений развивается с интервалом от нескольких месяцев до 6 лет:
- • синдром хронической лимфаденопатии;
- • симптомокомплекс: лихорадка, потеря массы тела, ночная потливость, лимфома, дискретный иммунодефицит;
- • характерная для СПИД клиническая картина с выраженным иммунодефицитом, тяжело текущими оппортунистическими инфекциями (в легких, желудочно-кишечном тракте, коже, ЦНС) и злокачественными опухолями, в особенности саркомой Калоши.
В иммунограмме отмечается нарастающая лимфоцитопения за счет уменьшения количества Т-хелперов (СЭ4-клеток). Если при синдроме лимфаденопатии снижение уровня Т-хелперов выражено умеренно, то при полной картине СПИДа — исключительно резко! Число Т-супрессоров (СЭ8-клеток) обычно несколько увеличено и лишь в терминальной стадии их количество уменьшается. Резко снижается (до 0,1—0,2) соотношение Т-хелпер/Т-супрессор, в норме равное или свыше 2,0. Нарушается функциональная активность и других клеток, опосредующих Т-клеточную цитотоксичность и проявление аллергических реакций Т-клеточного типа. Количество В-клеток остается в пределах нормы. Под влиянием оппортунистических инфекций (цитоме- галовирус, вирус Эпштейна — Барр) повышается их функциональная активность, обусловливающая гипергаммаглобулинемию, прежде всего IgG и IgA, и появление аутоиммунных антител: ревматоидный фактор, антинуклеарные антитела, широкий спектр антител при системной красной волчанке.
Количественные изменения макрофагов определяются редко, однако нарушения хемотаксиса, внутриклеточного киллинга и механизма презентации ими антигенов весьма характерны для СПИДа, особенно на этапе прогрессирующих стадий заболевания. NK-клетки обнаруживают функциональную несостоятельность при цитотоксическом эффекте.
Снижение продукции IL-2 коррелирует с низким уровнем Т-хелперов. Остается до сих пор неизученным происхождение гуморальных супрессорных факторов, блокирующих HLA нормальных лимфоцитов и снижающих индуцированное а-интерфероном увеличение активности нормальных киллеров. Продукция у-интерферона в отличие от а-интерферона угнетается. В крови повышается концентрация циркулирующих иммунных комплексов, которые содержат частично вирусный антиген и в значительной мере антигены возбудителей вторичных инфекций. Четко прослеживается повышение уровня |32-микроглобулина (свыше 2,5 мг/л). У 2/3 выявляются антитела к ДНК, направленные против лимфоцитов и тромбоцитов (тромбоци- топения).
Прогностически неблагоприятными факторами служат значительное снижение С04-клеток, низкий титр ВИЧ-антител и инфекционное заражение от больного СПИДом. Около 5—20% инфицированных демонстрируют эту тяжелую форму с летальным исходом (более 50% случаев) в течение первого года после установления диагноза от инфекции (60—70%) или злокачественного новообразования, прежде всего саркомы Капоши.
Диагноз считается строго установленным при доказательности присутствия вируса. С этой целью лимфоциты больного культивируют с митогеном в течение недели и идентифицируют вирус с помощью радиоиммуноферментного метода или генной инженерии. С учетом значительных материальных затрат эти методы не вполне приемлемы для клинической практики. Более широкое практическое применение получил тест на выявление антител к вирусу-ВИЧ (они выявляются спустя 8—12 недель от начала инфицирования) и иммунофермен- тный метод с использованием антигена, полученного из вирус-инду- цированных Т-клеток, а также радиоиммунный тест преципитации с применением внутриклеточных протеинов вируса. Чувствительность и специфичность этих методов составляет 95—99%. До 1% приходится на ложноположительные реакции. Они обнаруживаются, как правило, у многорожавших, реципиентов с множественными гемотрансфузиями и при аутоиммунных расстройствах. В качестве теста подтверждения служит доказательство продукции антител по крайней мере к двум вирусспецифическим антигенам посредством Blot-техники.
Окончательная диагностика предполагает доказательство иммунодефицита на основании определения содержания лимфоцитов, соотношения Т-хелперы/Т-супрессоры с митогеном, уровня Ig, (32-микроглобулина, циркулирующих иммунных комплексов и С-реактивного белка.
Общие принципы коррекции преследуют три цели:
- 1) лечение и предотвращение вторичных инфекций и опухолей;
- 2) воздействие на вирусную инфекцию;
- 3) восстановление иммунологической компетенции.
Теоретически можно обосновать такие способы воздействия
на вирусную инфекцию:
- • блокада СБ4-рецепторов посредством моноклональных антител или специального олигопептида;
- • подавление репликации вируса, прежде всего, путем воздействия на транскриптазу. Очевидно, предпочтительнее терапия, точкой приложения которой являются процесс посттранскрипции, трансляция и ресинтез вируса.
Результаты проведения заместительной терапии с учетом выраженного иммунодефицита не обнадеживают. Это относится к сообщениям о применении у-нитерферона, IL-2, фактора переноса, препаратов из тимуса, вплоть до трансплантации костного мозга. Очевидно, эти лечебные мероприятия наиболее эффективны на ранних стадиях заболевания.
Вторичные или приобретенные иммунодефициты возникают вследствие какого- либо тяжелого заболевания (т.е. как правило при ранее нормальном иммунном статусе). К основным причинам возникновения вторичных иммунодефицитов можно отнести следующие.
1. Паразитарные и протозойные болезни (описторхоз, малярия, шисто- и трипаносомозы, трихинеллез и др.).
2. Вирусные инфекции - наиболее крупная группа инфекционных агентов, вызывающих иммунодефициты:
- внутриутробные инфекции (цитомегаловирусная инфекция, краснуха);
- острые инфекции (корь, грипп, краснуха, паротит, ветряная оспа, вирусные гепатиты);
- персистирующие (гепатит В и С, герпес);
- инфекции иммунной системы (ВИЧ, ЦМВ, вирус Эпштейн - Барр).
3. Бактериальные инфекции (туберкулез, сифилис, лепра).
4. Хирургические вмешательства, травмы.
6. Нарушения обмена веществ (сахарный диабет) и истощение (голодание).
7. Заболевания органов выделения (уремия).
9. Хронические соматические заболевания.
10. Действие лекарств, экологических и производственных факторов, радиации.
Кратко дадим характеристику основных видов вторичных иммунодефицитов.
Дефекты иммунного статуса при паразитарных и протозойных заболеваниях связаны с рядом механизмов :
- угнетением функции макрофагов (малярия);
- выработкой лимфоцитотоксинов (описторхоз, трихинеллез);
- выработкой супрессивно действующих факторов (трипано- и шистосомозы);
- различными нарушениями иммунорегуляции.
Иммунодефициты при бактериальных инфекциях. Часто наблюдается снижение Т- лимфоцитов и митогенной активности на фитогемагглютинин (ФГА)- лепра, туберкулез, сифилис, пневмококковые инфекции, коклюш, бруцеллез, скарлатина). При стрепто- и стафилококковых инфекциях подавление Т- звена иммунитета часто сочетается с повышением функции В- системы и формированием инфекционно- аллергических и аутоиммунных осложнений (заболеваний).
Иммунодефициты при вирусных инфекциях. Многие вирусывызывают резкое угнетение Т- звена иммунитета ( вирусы кори, краснухи, гриппа, паротита). При кори и гриппе это нарушение сочетается с дефектами фагоцитоза, что еще более угнетает противомикробную защиту и способствует присоединению бактериальных осложнений. Однако наиболее существенные нарушения иммунной системы вызывают вирусы, непосредственно поражающие иммунную систему.
1. Вирус иммунодефицита человека (ВИЧ) вызывает заболевание, которое называют “синдром приобретенного иммунодефицита (СПИД)”. Этот вирус относится к ретровирусам и имеет тропизм к клеткам иммунной системы и некоторым другим клеткам, несущим CD4+ рецептор. CD4 является фактически рецептором для ВИЧ, благодаря которому РНК вируса попадает (инфицирует) клетки, формирует ДНК- копию, которая встраивается в ДНК (геном) клетки хозяина и получает возможность реплицироваться. Вирус оказывает на клетки цитопатический эффект, вызывая поражение Т- хелперов и других СД4+ клеток, снижение индекса CD4/CD8, глобальный дефект гуморального и клеточного иммунитета в сочетании с поликлональной активацией В- лимфоцитов, резкое ослабление противоинфекционной и противоопухолевой защиты. Парадокс- прогрессирование болезни (иммунодефицита) на фоне активного антительного ответа и ГЗТ на ВИЧ. На этом фоне присоединяются оппортунистические (СПИД- ассоциированные) вторичные инфекции и инвазии (ЦМВ, гепрес, пневмоцистоз, токсоплазмоз, микоплазмоз и др.).
2. Цитомегаловирус. ЦМВ инфекция приводит к резкому снижению CD4+ Т- лимфоцитов и гиперактивности CD8+ Т- клеток, угнетению клеточного иммунитета. ЦМВ относится к семейству герпес- вирусов , часто вызывающих персистентные инфекции и развитие вторичных иммунодефицитов.
3. Вирус Эпштейн- Барр вызывает инфекционный мононуклеоз. Рецептором для этого вируса является CD21- рецептор, поэтому поражаются преимущественно В- клетки. Эти же рецепторы имеются на дендритных клетках лимфоидных фолликулов, цервикальном эпителии. СД21 рецептор является местом присоединения С3d- компонента комплемента. Присоединение к рецептору вируса Эпштейн- Барр вызывает экспрессию на мембране В- лимфоцитов особого антигена, распознаваемого СД8+ лимфоцитами как чужеродного. В результате В- клетки становятся мишенью для собственных Т- клеток. В крови определяется атипичный Т- лимфоцитоз, бласттрансформация В- клеток, выработка гетерофильных антител. Формируется сложный иммунодефицит с элементами аутоагрессии.
Иммунодефициты при ожогах усугубляют опасность инфекционных осложнений. В первые дни преобладает снижение иммуноглобулинов основных классов (особенно IgG). В дальнейшем действие ожоговых антигенов приводит к В- клеточной стимуляции. Отмечено снижение ряда показателей Т- клеточного иммунитета в результате действия ожоговых токсинов- CD3+ и CD4+ клеток, ингибируется фагоцитоз, снижается активность комплемента. Прогностически неблагоприятен дисбаланс соотношения CD4/CD8.
Иммунодефициты, связанные с недостаточностью питания, голоданием, нарушениями обмена веществ.
При сахарном диабете возникает предрасположенность к бактериальным инфекциям, связанная с нарушением функций лейкоцитов- хемотаксиса, адгезивных и бактерицидных свойств.
Дефицит белка в организме также повышает восприимчивость к инфекциям. Угнетается первичный иммунный ответ (синтез IgM), фагоцитарная активность клеток, митогенная активность (по данным РБТЛ с ФГА).
Дефицит микроэлементов существенно сказывается на иммунной системе. Дефицит железа ведет к снижению активности железосодержащих ферментов, Т- звена, уровня миелопероксидазы и АФК. Дефицит цинка ведет к гипофункции тимуса со снижением CD4+ Т- лимфоцитов, ответа на митогены, активности NK клеток, фагоцитарного звена. Дефицит лития ведет к недостаточности Т- лимфоцитов, особенно CD8+ клеток. Существенно сказывается на иммунную систему дефицит меди, селена, кальция, магния. С дефицитом магния связаны нарушения синтеза антител, активации системы комплемента.
Лекарственные иммунодефициты связаны преимущественно с их иммунотоксическим действием. Достаточно часто отмечается активация Т- супрессоров, уменьшение количества В- клеток, снижение IgA. Существенное влияние на иммунный статус оказывают антибиотики, даже при коротких циклах применения, прежде всего - пенициллины, тетрациклины, стрептомицин, противотуберкулезные и антигрибковые препараты. Они вызывают :
- дефекты формирования первичного иммунного ответа (скорости образования клона плазматических клеток и антителообразования);
- снижение противовирусной защиты;
- снижение цитотоксической активности Т- лимфоцитов;
- уменьшение фагоцитарной активности нейтрофилов и макрофагов.
Около 70 тысяч химических соединений, связанных с производственной деятельностью и нарушениями экологической обстановки относятся к разряду токсических и оказывают разнообразное действие на иммунную систему.
Существенное влияние на иммунную систему оказывает стресс. Начальный период острого стресса характеризуется снижением противоопухолевого и противоинфекционного иммунитета, в дальнейшем могут присоединяться аутоиммунные и аллергические реакции. Хронический стресс неизбежно приводит к формированию вторичного иммунодефицита.
Существенное меняется иммунный статус при старении. Отмечается инволюция тимуса, снижается уровень тимического фактора. С возрастом снижается активность клеточного иммунитета, страдают этапы распознавания антигена, пролиферативная активность Т- клеток, изменяется CD4/CD8 индекс в сторону супрессорной активности, страдают надзорные функции противоопухолевой защиты.
В отличии от первичных иммунодефицитов, вторичные иммунодефициты в большинстве случаев не носят необратимого характера и функции иммунной системы могут восстанавливаться, если прекращается действие факторов, обословивших иммунодефицит.
Не нашли то, что искали? Воспользуйтесь поиском:
Читайте также:


