Посев воды на кишечную палочку как делать
С целью охраны здоровья населения, для предупреждения желудочно-кишечных инфекций советским санитарным законодательством предусмотрены необходимые мероприятия по содержанию в надлежащем санитарном состоянии источников водоснабжения. Показатели качества воды постоянно действующих водопроводных сооружений и артезианских скважин нормируются Государственным общесоюзным стандартом - ГОСТ 2874-54.
При лабораторно-производственном контроле микробиологическое исследование воды из действующей водопроводной сети и постоянно действующих артезианских скважин должно производиться не реже 1 раза в месяц. Использование новых скважин допускается в тех случаях, когда коли-титр воды укладывается в нормы, допускаемые ГОСТом. Анализ воды таких скважин в первый год их эксплуатации проводят чаще.
Порядок отбора проб
Для выполнения микробиологического анализа воды бактериологическая лаборатория должна иметь запас стерильной посуды: бутылки емкостью 0,5 л, пипетки на 100, 10 и 1 мл, мерные цилиндры и чашки Петри. Тщательно вымытые и высушенные бутылки закрывают ватными пробками, накрывают бумажными колпачками и завязывают шпагатом или толстыми нитками. Помещают бутылки в бумажные пакеты и стерилизуют в сушильном шкафу при температуре 160 °С в течение 1 ч или в автоклаве при 120°С в течение 30 мин. При стерилизации бутылок с притертыми пробками бутылки и пробки стерилизуют отдельно: бутылки перед стерилизацией плотно закрывают ватной пробкой, а для стеклянной пробки делают небольшой пакетик из бумаги и привязывают ее к горлышку бутылки.
Пробу воды для исследования на фекальное загрязнение отбирают в количестве 0,5 л. При исследовании нескольких скважин или колодцев пробы отбирают от каждого объекта отдельно в часы наибольшего расхода воды. Из вновь сооруженной скважины или колодца при отсутствии постоянного отлива воды пробы отбирают после предварительной откачки воды в течение не менее 12 ч.
Отбор пробы воды из водопроводного крана производят следующим образом. Водопроводный кран обжигают в пламени горящего ватного тампона, смоченного спиртом. Затем кран открывают на 10-15 мин, давая воде стечь. Бутылку вынимают из пакета, развязывают бумажный колпачок, вынимают пробку, захватив ее между ладонью и двумя последними пальцами правой руки, и держат ее, стараясь не загрязнить. Подставляют бутылку под струю воды так, чтобы не замочить ее снаружи и не замочить пробку. Наполнив бутылку водой, закрывают ее пробкой над пламенем горелки, завязывают колпачок и делают запись для данной пробы: откуда взята проба, дата и час отбора пробы, цель исследования и фамилия лица, производившего отбор пробы.
Вода должна быть исследована тотчас же после взятия пробы, но не позднее 2 ч после ее отбора. При невозможности выполнения этого условия анализ должен быть произведен не позднее чем через 6 ч после отбора пробы при условии сохранения воды при температурах от 1 до 5°С. Пробы следует предохранять от резких толчков, чтобы не замочить пробок. При санитарно-гигиенической оценке воды по действующему ГОСТу 2874-54 исходят из следующих бактериологических показателей: общего количества микробов в воде (микробное число), коли-титра, коли-индекса.
Воду артезианских скважин и водопроводную, поступающую в городскую сеть, анализируют в количествах от 500 до 10 мл, воду открытых водоемов в зависимости от предполагаемой степени загрязнения - до 0,001 мл.
Определение микробного числа, или общей микробиальной обсемененности воды
Под микробным числом воды понимают количество колоний, вырастающих на мясопептонном агаре в чашке Петри из 1 мл исследуемой воды после инкубации посева при 37 °С в течение 24 ч. У питьевой воды микробное число должно быть не более 100. В воде колодцев и открытых водоемов микробное число допускается до 1000.
При микробиологическом исследовании заведомо чистой воды вносят 1 мл ее в стерильную чашку Петри, заливая 15 мл расплавленного и охлажденного до 45°С мясопептонного агара. При исследовании загрязненных вод делают разведение в 10 или в 100 раз и высевают 1 мл соответствующего разведения.
На крышках чашек делают надпись с указанием номера пробы, разведения и даты посева. После инкубации посевов производят подсчет колоний по обычной методике.
Определение показателей фекального загрязнения воды
Показателями фекального загрязнения воды являются коли-титр и коли-индекс. Под титром кишечной палочки (коли-титром) подразумевается наименьшее количество исследуемого материала (воды), выраженное в миллилитрах (или граммах), в котором обнаруживается хотя бы одна кишечная палочка. Для питьевой воды титр кишечной палочки должен быть не ниже 300 (для Москвы и Ленинграда - не ниже 500).
Коли-индекс кишечной палочки - количество особей кишечной палочки, обнаруженное в 1 л жидкости (воды) или в 1 г плотного вещества. Установив коли-титр исследуемого вещества, можно произвести перерасчет на коли-индекс, и наоборот. Для получения коли-индекса нужно разделить 1000 на коли-титр.
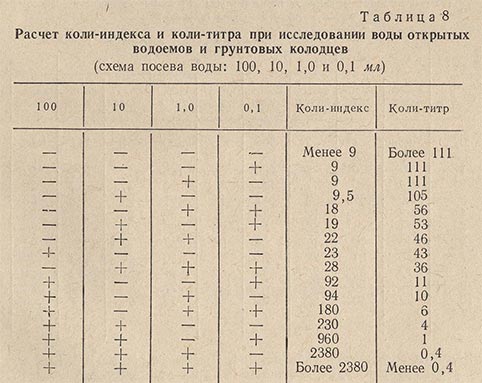
Вода колодцев и открытых водоемов признается доброкачественной при коли-титре не менее 90 и коли-индексе не более 11. Определение коли-титра чаще всего производится трехфазным методом бродильных проб.
1-й этап - первый день (первая бродильная проба). Исследуемую воду засевают (с соблюдением правил стерильности) в бродильные сосуды с глюкозо-пептонной средой (ГПС). Для выявления газообразования в посевах на дно бродильных сосудов перед заполнением их питательной средой предварительно должны быть опущены поплавки - маленькие пробирочки, перевернутые вверх дном (см. стр. 192). В каждый бродильный сосуд помещают по одному поплавку. Во время стерилизации поплавки заполняются средой.
Если микроорганизмы при развитии на данной питательной среде образуют газ, то он, скапливаясь в поплавке, вытесняет из него жидкость и поплавок поднимается над поверхностью среды в пробирке или флаконе.
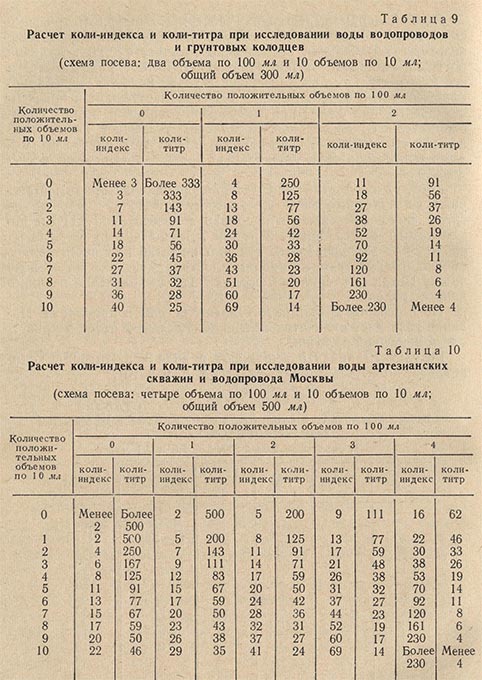
В зависимости от характера источника для посева берут 300-500 мл исследуемой воды. Посев 300 мл воды производят следующим образом: два объема воды по 100 мл засевают в два флакона с 10 мл концентрированной глюкозо-пептонной среды и 10 объемов воды по 10 мл засевают в 10 пробирок, содержащих по 1 мл ГПС. При посеве 500 мл воды 4 объема засевают во флаконы по 100 мл и 10 объемов по 10 мл в пробирки.
При исследовании сильно загрязненных вод необходимо засевать меньшие объемы воды - от 10 до 0,0001 мл и даже 0,00001 мл (по 1 мл из соответствующих разведений). В этом случае посев производится в пробирки, содержащие по 10 мл разведенной глюкозо-пептонной среды. Посев производят по схеме - четыре десятикратно убывающих объема исследуемой воды, например: 100, 10, 1 и 0,1 или 10, 1, 0,1 и 0,01 мл (в зависимости от предполагаемого загрязнения воды).
2-й этап - второй день. Из сосудов с признаками микробного роста (помутнение или помутнение и газообразование) производят высев петлей на среду Эндо в чашки Петри. Засеваемый материал наносят на поверхность среды в виде пересекающихся штрихов или растирают шпателем для получения изолированных колоний. Посевы выращивают при 37 °С в течение 24 ч. Во избежание расплывчатого роста колоний чашки со средой Эндо перед посевом следует слегка подсушить в термостате в течение 30 мин.
По окончании выращивания посевы в чашках Петри просматривают. Отсутствие роста дает окончательный отрицательный ответ: фекальное загрязнение отсутствует. При наличии роста приготовляют мазки, окрашивают их по Граму, исследуя все подозрительные на кишечную палочку колонии - как ярко-красные, так и бесцветные или с розовым оттенком и красным центром. Обнаружение при микроскопировании в мазках грамотрицательных неспороносных палочек указывает на возможное наличие бактерий кишечной группы. В этом случае необходимо провести вторую бродильную пробу - третий этап исследования.
3-й этап - третий день (вторая бродильная проба). Материал из подозрительных на кишечную палочку колоний со среды Эндо пересевают в пробирки с разведенной ГПС и поплавками и выдерживают 24 ч при температуре 43°С. Если на среде Эндо изолированных колоний не было или наблюдалась смешанная культура, необходимо повторить пересев на свежую чашку Петри со стерильной средой Эндо до получения изолированных колоний.
По истечении 24 ч просматривают посевы в пробирках. Наличие газа дает окончательный положительный ответ о присутствии кишечной палочки. Результаты анализа выражают в виде коли-титра и коли-индекса, пользуясь таблицами (табл. 8, 9 и 10).
При исследовании водопроводной воды предпочтительнее производить определение коли-индекса путем посева воды на мембранные фильтры (рис. 82). Этот метод позволяет концентрировать микрофлору, содержащуюся в значительном объеме воды, на небольшом участке поверхности плотной питательной среды.
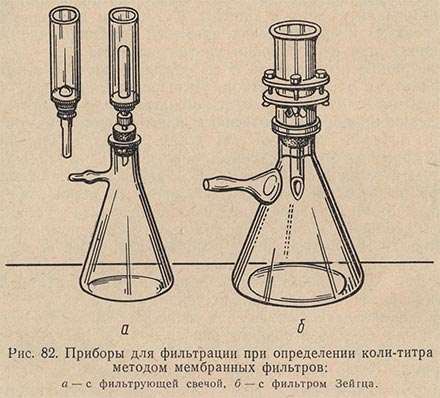
Исследование воды на фекальное загрязнение методом мембранных ультрафильтров в последние годы получило довольно широкое распространение в бактериологических лабораториях благодаря следующим преимуществам:
1) срок анализа сокращается до 24 ч, что значительно экономит время;
2) экономятся среды;
3) обнаруживаются самые незначительные количества микробов в воде;
4) проводится прямой и достаточно точный подсчет количества колоний;
5) метод позволяет выделить каждый микроб в чистой культуре.
Мембранные фильтры (ультрафильтры) - это пористые нитроцеллюлозные пленки, которые выпускаются в виде кружков диаметром 35 мм и толщиной 0,1 мм с различным диаметром пор. Для исследования воды применяют фильтры № 3. В сухом виде мембранные фильтры пригодны к использованию в течение одного года. Для более продолжительного хранения их помещают в герметически закрытую склянку с притертой пробкой, в которую наливают 30%-ный водный раствор спирта.
Техника выполнения анализа следующая:
1-й день. Мембранные фильтры перед употреблением помещают в стакан с дистиллированной водой, подогревают воду до 50-60°С, меняя ее 2-3 раза. Затем снова наливают чистую дистиллированную воду и кипятят 20-30 мин до полного удаления воздуха и органических примесей (растворителей), применявшихся при изготовлении ультрафильтров.
Фильтрацию исследуемой воды осуществляют на металлических фильтрах Зейтца с сеткой. Непосредственно перед фильтрованием металлические фильтры обжигают или кипятят. После охлаждения прибора в него укладывают на сетку мембранный фильтр матовой поверхностью вверх. Укладывание фильтра нужно производить осторожно обожженным и охлажденным пинцетом с гладкими краями. Во избежание повреждения фильтра на него накладывают кружочки стерильной фильтровальной бумаги, предварительно смоченные стерильной дистиллированной водой. На фильтре закрепляют воронку и приступают к фильтрованию отобранной пробы исследуемой воды. Объемы воды, подлежащие фильтрации, варьируют от 300 до 500 мл в зависимости от общей предполагаемой характеристики источника водоснабжения.
При анализе загрязненных вод следует производить фильтрование после предварительного разведения: в 100 мл стерильной воды вводят 1 мл исследуемой пробы и приступают к фильтрации после тщательного перемешивания. Для фильтрации прибор необходимо подсоединить к водоструйному или вакуумному насосу. Вакуум в колбе Бунзена должен быть не менее 0,5 ат (4,9 * 10000 н/м2).
По окончании фильтрации снимают воронку с прибора, фильтр захватывают обожженным пинцетом и накладывают на поверхность среды Эндо в чашки Петри. Чашки помещают в термостат при 37 °С на 24 ч.
2-й день. Через 24 ч инкубации посевы просматривают и выявляют на поверхности фильтров колонии, типичные для группы кишечной палочки: ярко-красные колонии с металлическим блеском - колонии Е. coli commune; слабо-розовые или бесцветные без блеска, выпуклые, слизистые - колонии Е. paracoli. Подсчет колоний производят при помощи лупы.
Из колоний, характерных для кишечной группы, делают мазки и окрашивают по Граму. При обнаружении в мазках грамотрицательных палочек материал из этих колоний пересевают в пробирки с разведенной глюкозо-пептонной средой. Посевы помещают в термостат при 43 °С на 24 ч.
3-й день. После инкубации посевы просматривают и отмечают наличие или отсутствие газообразования. Газообразование свидетельствует о наличии кишечной палочки и наоборот. Расчет коли-титра и коли-индекса производится следующим образом.
Вода является одним из основных факторов внешней среды.
Она необходима для построения клеток организма. Без воды в клетках не могут нормально протекать химические и физиологические процессы. Без воды невозможно проводить мероприятия по санитарному благоустройству населенных пунктов, поддерживать чистоту в жилищах, готовить пищу и пр.
Наряду с этим вода может явиться фактором передачи возбудителей инфекционных болезней.
Загрязненная вода может сыграть определенную роль в возникновении и распространении кишечных инфекций, туляремии, инфекционного гепатита, Ку-лихорадки, амебиаза, микозов.
Вода не должна содержать патогенных микроорганизмов.
Эпидемиологическая безопасность воды определяется степенью общего бактериального загрязнения и содержанием бактерий группы кишечной палочки.
Для оценки качества питьевой воды используются такие количественные показатели как коли – титр, коли – индекс, общее микробное число.
По бактериологическим показателям питьевая вода должна соответствовать следующим требованиям: общее количество бактерий в 1 мл неразбавленной воды не более 100, коли – индекс (количество бактерий группы кишечной палочки в 1 л воды) не более з3 особей, коли – титр (количество воды, содержащей 1 бактериальную клетку кишечной палочки ) – 300 мл.
Коли – титр в питьевой воде определяется методом мембранных фильтров и двух- или трехфазным бродильным методом.
Выбор метода определяется количеством и качеством исследуемой воды.
При исследовании чистой, хорошо фильтрующейся воды, удобнее использовать метод мембранных фильтров.
При исследовании воды, содержащей коллоидные вещества и посторонние примеси, затрудняющие фильтрацию, пользуются бродильным методом.
При определении титра кишечной палочки методом мембранных фильтров необходимо выполнить три этапа: подготовить мембранные фильтры, подготовить фильтровальный аппарат, произвести фильтрование и вырастить посевы.
1. Подготовка мембранных фильтров. Для фильтрования воды отбираются мелкопористые нитроцеллюлозные мембранные фильтры №3 (без изъянов) и помещаются в химический огнеупорный стакан с подогретой до 50 – 60 градусов по Цельсию дистиллированной водой. После этого воду в стакане необходимо нагревать на слабом огне до ее закипания. Кипячение фильтров производится трижды по 15 минут. После первого и второго кипячения вода из стакана сливается и заменяется свежей. После последнего кипячения вода не сливается и фильтры остаются в ней до употребления.
2. Подготовка фильтровального аппарата. Воронку и столик фильтровального аппарат Зейтца стерилизуют кипячением или обжиганием. На охлажденный столик аппарата, прокаленным на огне и остуженным пинцетом с гладкими кончиками, помещают мембранный фильтр. На столик с фильтром устанавливают и закрепляют верхнюю часть прибора – воронку.
3. Фильтрование воды и выращивание посевов. В воронку фильтровального аппарата стерильно наливают исследуемый объем воды и с помощью насоса создают вакуум в приемном сосуде.
Бактерии, находящиеся в пробе воды, задерживаются на фильтре.
По окончании фильтрации снимают воронку фильтра, осторожно стерильным пинцетом снимается фильтр и переносится в чашку Петри с питательной средой.
Выращивание фильтра на той или иной питательной среде позволяет выделить определенную группу микроорганизмов.
Для выявления эшерихий фильтр накладывается на агар Эндо или на другую среду (среда Плоскирева), используемую для выявления микробов этой группы.
Чашки Петри крышками вниз помещаются в термостат на 24 часа при 37 градусах по Цельсию. По окончании выращивания фильтры просматривают при помощи лупы.
Результат считается отрицательным, если на агаре Эндо отсутствуют ярко – красные колонии – это значит, что кишечной палочки в данном объеме воды нет.
При наличии красных колоний с металлическим блеском (характерным для колоний кишечной палочки) из колоний делают мазки и окрашивают их по методу Грамма.
При наличии грамотрицательных палочек средних размеров, не образующих споры, из колоний производят отсев в пробирки в пробирки с глюкозопептонной средой Эйкмана. Посевы помещают в термостат на 24 часа при 43 градусах (температура, при которой прорастают особи, выделяемые теплокровными).
Помутнение питательной среды и наличие газообразования свидетельствует о присутствии кишечной палочки в данном объеме исследуемой воды.
Определение коли – титра бродильным методом проводится в три этапа.
В первый день в зависимости от степени загрязнения производят посев различных объемов исследуемой воды на среду Булира с поплавками.
Объемы воды обратно пропорциональны степени ее загрязнения.
Как правило засевают четыре десятикратно уменьшающихся объема воды (например: 1; 0,1; 0,01; 0,001 мл).
Посевы выдерживают 24 часа при 43 градусах по Цельсию.
На второй день после изъятия посевов из термостата отбирают те колбы, в которых изменился цвет индикатора в среде Булира, а в поплавках скопился образовавшийся газ. Из этих колб делают отсев в чашки Петри с агаром Эндо. Посевы помещают в термостат на 24 часа при 37 градусах.
На третий день посевы извлекают из термостата и макроскопически исследуют выросшие колонии. Наличие ярко красных колоний с металлическим блеском указывает на присутствие в данном объеме воды кишечной палочки.
Для подтверждения из отобранной колонии делают мазок и производят отсев в пробирку со средой Булира.
Мазок окрашивают по Грамму и микроскопируют, а пробирку с посевом ставят в термостат на 24 часа при 43 градусах.
Наличие в микропрепарате грамотрицательных палочек, изменение окраски среды Булира и наличие газа в поплавке являются доказательством присутствия кишечной палочки.
При определении микробного числа стерильными пипетками отбирают и засевают в чашки Петри с МПА 1 мл; 0,1 мл (или еще большее разведение) исследуемой воды.
Получение различных объемов достигается разведением исследуемой воды стерильной водой. Из одной пробы производят посев не менее двух разведений. При этом каждый объем воды отбирается отдельной стерильной пипеткой.
Посевы помещают в термостат при 37 градусах на 24 часа. Затем производят подсчет колоний, выросших на питательной среде в чашке. Колонии подсчитываются с помощью лупы на черном фоне. Для того, чтобы получить число колоний в 1 мл воды, полученное число необходимо умножить на разведение. Все полученные результаты суммируются и выводится средняя арифметическая величина.
При изучении бактериальной флоры в открытых водоемах с целью выявления влияния каких – либо загрязнителей может быть применен метод пластинок обрастания.
Метод основан на свойстве микроорганизмов прикрепляться к поверхности стекла. Этот метод позволяет получить сведения об экологических взаимоотношениях микроорганизмов, их реакцию на изменения во внешней среде.
Для получения пластинок обрастания, тщательно обезжиренные предметные стекла прикрепляют каким – либо способом через определенные промежутки на тросе. Трос, несущий стекла, с грузом на нижнем конце и поплавком на верхнем опускают в водоем.
Стекла должны быть пронумерованы, а в журнале необходимо записать какие номера стекол какому горизонту соответствуют.
Установку со стеклами в водоеме выдерживают 3- 4 суток, после чего ее извлекают из воды и аккуратно вынимают стекла. Стекла высушивают и фиксируют смесью Никифорова (равные объемы этилового спирта и эфира) или метиловым спиртом, окрашивают по Грамму, а также другими сложными методами окраски для выявления железо- и серобактерий и других видов микроорганизмов.
Микропрепараты изучают с помощью иммерсионного микроскопа, что дает возможность характеризовать видовой состав микрофлоры на разных горизонтах водоема.
При подсчете микробов на площади один квадратный сантиметр определяется их количественное содержание.
При учете бактерий по физиологическим группам производя посевы на питательные среды для выявления десульфурирующих бактерий, бактерий участвующих в процессах аммонификации, нитрификации и денитрификации. Производят посевы для выявления облигатных аэробов и анаэробов, участвующих в фиксации азота и разложении клетчатки.
Цель работы: изучение методов оценки санитарнобактериологического состояния питьевой воды и воды из естественных водоемов.
Вода, используемая на предприятиях пищевой промышленности, должна отвечать требованиям, предъявляемым к питьевой воде действующими нормативными документами. Безопасность воды в эпидемиологическом отношении определяют по общему числу микроорганизмов и количеству бактерий группы кишечных палочек в ее определенном объеме.
Качество воды централизованных систем питьевого водоснабжения определяют в соответствии с санитарными правилами и нормами. Питьевая вода должна быть безопасна в эпидемиологическом и радиационном отношениях, безопасна по химическому составу и иметь благоприятные органолептические свойства (табл. 12.1).
Таблица 12.1. Безопасность питьевой воды в эпидемиологическом отношении (по микробиологическим и паразитологическим показателям) СанПиН 2.1.4.1074-01
Общее микробное число (ОМЧ)
Число КОЕ в 1 см 3
Термотолерантные колиформные бактерии
Число бактерий в 100 см 3
Общие колиформные бактерии
Число бактерий в 100 см3
Число БОЕ* в 100 см 3
Споры сульфитредуцирующих бактерий
Число спор в 20 см 3
Число цист в 50 дм 3
* БОЕ - бляшкообразующие единицы.
12.1. Отбор проб и подготовка их к анализу
Воду для санитарно-бактериологического контроля отбирают в количестве 500 см 3 в бутылки, предварительно простерилизованные в бумажных пакетах, с ватно-марлевой пробкой, покрытой сверху бумажным колпачком.
Перед отбором пробы кран или край трубы обжигают зажженным ватным тампоном, пропитанным спиртом. Открывают кран и в течение 10-15 мин воду спускают, затем производят отбор пробы. Вода подлежит анализу не позже чем через 2 ч после отбора.
Пробы воды из открытых водоемов - колодцев, бассейнов, рек, озер - отбирают с помощью батометров, представляющих собой металлический каркас с массивным свинцовым дном - грузилом. В металлический каркас вставлена бутылка. Батометр погружают на заданную глубину и открывают бутылку, потягивая за веревку, привязанную к пробке. После наполнения бутылки батометр извлекают и закрывают ее стерильной пробкой.
Пробы хлорированной воды берут во флаконы с дехлоратором, так как под действием хлора микробы в воде погибают. В качестве дехлоратора используют серноватистый натрий из расчета 10 мг на 500 см исследуемой воды.
К отобранным пробам воды прилагают сопроводительный документ с указанием соответствующих данных. Доставку проб питьевой воды осуществляют в контейнерах-холодильниках при температуре от 4 до 10 °С.
12.2. Определение общего микробного числа воды
Общее микробное число (ОМЧ) - это количество мезофильных аэробных и факультативно-анаэробных микроорганизмов, образующих колонии на мясопептонном агаре при посеве 1 см 3 воды с последующей инкубацией посевов при температуре 37±0,5 °С в течение 48 ч. ОМЧ должно быть не более 50 КОЕ/см 3 .
В зависимости от степени предполагаемого загрязнения производят посев не менее двух различных объемов воды, выбранных с таким расчетом, чтобы на чашках вырастало от 30 до 300 колоний. Водопроводную и артезианскую воду засевают в неразведенном виде по 1 см 3 . При бактериологическом исследовании загрязненных вод делают посевы разведенной воды. Разведения готовят так, как указано в разделе 8.3.
Из исследуемого образца и из пробирок с его разведениями в соответствии со степенью предполагаемого микробного загрязнения отбирают по 1 см 3 , вносят в стерильные чашки Петри и заливают 10-12 см расплавленного и остуженного до температуры 45 °С мясопептонного агара. Круговыми движениями руки, вращая чашки по горизонтальной поверхности стола, распределяют их содержимое равномерным слоем по всей площади дна. После застывания агара чашки с посевами помещают на 24 ч в термостат при температуре 37 °С. После инкубации подсчитывают число выросших колоний.
Определение микробного числа указанным методом позволяет выявить лишь мезофильные аэробные и факультативно-анаэробные микроорганизмы.
12.3. Определение содержания колиформных бактерий в воде
С эпидемиологической точки зрения особенно важным является обнаружение в воде патогенных микроорганизмов - возбудителей кишечных инфекций (брюшного тифа, дизентерии, холеры и др.) Однако в связи с большой трудностью обнаружения патогенных микроорганизмов при бактериологических анализах ограничиваются определением так называемых санитарно-показательных микроорганизмов (СПМ). К санитарно-показательным относят микроорганизмы, постоянно находящиеся в естественных полостях человека или животных. Присутствие СПМ в различных объектах внешней среды является индикатором их загрязнения человеком. Чем больше СПМ во внешней среде, тем более вероятным становится присутствие специфических возбудителей инфекционных заболеваний.
В качестве СПМ наибольшее значение имеют бактерии группы кишечных палочек (БГКП). К группе кишечных палочек относят колиформные бактерии родов Escherichia, Enterobacter, Citrobacter, Klebsiella, Serratia.
При определении количества СПМ в воде используют следующие характеристики:
• коли-титр - наименьший объем воды, в котором обнаружена одна кишечная палочка. Для питьевой воды, прошедшей очистку, титр кишечной палочки должен быть не менее 300 см 3 ;
• коли-индекс - количество кишечных палочек в 1 дм 3 воды. Коли-индекс для питьевой воды должен быть не более 3.
Колиформные бактерии определяют в воде методом мембранных фильтров или бродильным методом.
Бродильный метод. Сущность бродильного метода заключается в посеве определенных объемов исследуемой воды, инкубации
посевов при температуре 37 °С в средах накопления с последующим высевом на среду Эндо, дифференциацией выросших колоний и определением наиболее вероятного числа БГКП в 1 дм 3 воды.
При исследовании воды централизованного водоснабжения исследуемый материал дважды засевают в три объема: 100, 10 и 1 см 3 . Для исследования речной, озерной, прудовой воды готовят десятикратные разведения 1:10, 1:100, 1:1000 и засевают еще 10 см 3 и 1 см 3 без разведения. Посев воды производят в бродильные сосуды (колбы, бутылки, пробирки с поплавками), заполненные глюкозопептонной средой Эйкмана. Посевы инкубируют в термостате при температуре 37 °С в течение 24 ч.
Обработка результатов анализа. По окончании инкубации посевы просматривают и делают следующие выводы:
а) при отсутствии газообразования и изменения цвета среды дают отрицательный ответ на наличие БГКП в исследуемом объеме воды, дающим право закончить исследование через 24 ч;
б) при образовании кислоты и газа производится высев материала из бродильных сосудов на среду Эндо. Высев делается бактериологической петлей густым штрихом для получения изолированных колоний. Чашки с посевами инкубируют при температуре 37 °С в течение 24 ч. После инкубации посевы просматривают. Отсутствие на среде Эндо характерных для кишечных палочек колоний дает основание на выдачу отрицательного ответа и окончание исследования;
в) при обнаружении на среде Эндо лактозоположительных темно-красных колоний, с металлическим блеском или без него, необходимо установить принадлежность выросших микроорганизмов к семейству кишечных бактерий. С этой целью производится микроскопирование препарата из колоний и постановка оксидазного теста.
Оксидазный тест предложен для дифференциации бактерий семейства Enterobacteriaceae от грамотрицательных бактерий семейства Pseudomonodaceae и других водных сапрофитов, которые, в отличие от кишечных бактерий, вырабатывают фермент оксидазу.
Для постановки оксидазного теста со среды Эндо снимают петлей по 2-3 колонии каждого типа. Микробную массу наносят штрихом на фильтровальную бумагу, смоченную специальным реактивом (30 г α-д-нафтола растворяют в 2,5 см 3 этанола, прибавляют 7,5 см 3 дистиллированной воды и 40 мг диметил-парафенилендиамина. Раствор готовят непосредственно перед определением).
При отрицательном результате оксидазного теста бумага при контакте с колонией цвета не меняет. Если же бумага синеет в течение 1 мин при контакте с колонией, то оксидазный тест считают положительным.
Наличие в препарате грамотрицательных неспорообразующих палочек, не обладающих оксидазной активностью, позволяет немедленно дать ответ о наличии в воде БГКП.
При обнаружении на среде Эндо розовых и бесцветных колоний ведут подсчет и пересевают 2-3 изолированные колонии каждого типа в глюкозо-пептонную среду Эйкмана. Посевы инкубируют при температуре 37 °С в течение 3-4 ч. При образовании кислоты (изменение цвета среды) и газа, накапливающегося в поплавке, результат считается положительным, при отсутствии кислото- и газообразования - отрицательным.
После проведения анализа записывают в лабораторный журнал окончательные результаты (положительные и отрицательные) по каждому засеянному объему и определяют коли-титр и коли-индекс.
Метод мембранных фильтров. Сущность метода заключается в концентрировании бактерий из определенного объема воды на мембранных фильтрах с последующим выращиванием их на среде Эндо при температуре 37 °С, дифференцированием выросших колоний и подсчетом количества БГКП в 1 см 3 воды.
Подготовка мембранных фильтров. Для фильтрования воды отбирают мембранные фильтры № 3, помещают их в подогретую до температуры 80 °С дистиллированную воду и ставят на небольшой огонь для кипячения. Кипячение проводят трижды по 10 мин. После первого и второго кипячения воду сливают, а после третьего фильтры оставляют в воде до употребления.
Подготовка фильтровального аппарата. Фильтровальный аппарат стерилизуют в автоклаве или протирают ватным тампоном, смоченным в спирте, и обжигают в целях стерилизации. На столик фильтровального аппарата стерильным пинцетом помещают мембранный фильтр. Во избежание повреждения фильтра под него подкладывают кружок стерильной фильтровальной бумаги. На фильтровальный столик с положенными на него фильтрами устанавливают и закрепляют верхнюю часть прибора - воронку (рис. 12.1).
Рис. 12.1. Определение количества микроорганизмов методом мембранных фильтров

Фильтрование воды и выращивание микроорганизмов. В воронку фильтровального аппарата стерильно наливают исследуемый объем воды и с помощью водоструйного насоса создают вакуум в приемном сосуде. При анализе питьевой воды, поступающей в водопроводную сеть, необходимо брать объем не менее 333 см 3 . По окончании фильтрования мембранный фильтр профламбированным пинцетом переносят на поверхность питательной среды Эндо в чашки Петри. В настоящее время выпускают фильтры, пропитанные соответствующими питательными средами. Посевы инкубируют в термостате при температуре 37 °С в течение 18-24 ч.
Обработка результатов анализа. По окончании инкубации посевы просматривают и делают следующие выводы:
а) отсутствие микробного роста на фильтрах или обнаружение на них колоний, не характерных для БГКП, позволяет закончить исследования на этом этапе анализа с выдачей отрицательного результата на присутствие БГКП в анализируемом объеме воды;
б) при обнаружении на фильтре колоний, характерных для БГКП, исследование продолжают. Из нескольких колоний каждого типа готовят мазки, окрашивают их по Граму и микроскопируют. Отсутствие в мазках мелких грамотрицательных неспороносных палочек является основанием для прекращения анализа с выдачей отрицательного результата на присутствие БГКП в исследуемом объеме воды;
в) при наличии в мазках грамотрицательных палочек, морфологически сходных с кишечными, ставится оксидазная проба. При обнаружении на мембранных фильтрах однотипных лактозоположительных колоний (темно-красных с металлическим блеском или без него), не вырабатывающих оксидазы, анализ воды на этом этапе заканчивают и подсчитывают число выросших на мембранном фильтре колоний кишечных палочек. Результат выражают в виде коли- индекса в пересчете на 1 дм 3 воды;
г) при обнаружении на мембранных фильтрах розовых и бесцветных колоний подсчитывают их число и пересевают 2-3 изолированные колонии каждого типа в глюкозо-пептонную среду Эйкмана. После инкубации в течение 3-4 ч при температуре 37 °С отмечают изменение цвета среды за счет образования кислоты и накопления газа в поплавке. В этом случае результат считается положительным. Если изменений в среде нет, то дают отрицательный результат на присутствие БГКП.
Пример определения колииндекса: профильтровано три объема воды по 100 см 3 . На первом и втором фильтрах выросло по три колонии, на третьем - девять колоний. Всего выросло пятнадцать колоний. Таким образом, колииндекс исследуемого образца воды равен: (1000 х 15):300 = 50. Колииндекс переводится в колититр следующим образом: 1000:50 = 20.
Контрольные вопросы
1. Какие Вы знаете показатели эпидемиологической безопасности питьевой воды?
2. Что такое общее микробное число, колититр и колииндекс?
3. Какие роды микроорганизмов входят в БГКП?
4. Какими методами определяют колиформные бактерии?
5. Каковы основные критерии, по которым устанавливают присутствие колиформных бактерий в питьевой воде?
6. С какой целью проводят тест на оксидазу?
Биологическая библиотека - материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Читайте также:


