Учебное пособие определение паразитарной чистоты пресноводных рыб
Похожие темы научных работ по наукам о здоровье , автор научной работы — Алмухамбедова А.Р., Салтереева С.Р.
факторов, усугубляющих нервно-психическое здоровье воспитанников. Совершенствование оздоровительной работы должно включать строгое соблюдение физиолого-гигиенических регламентов, направленных на обеспечение оптимального режима дня и условий воспитания. Литература
1. Сигунова Д.А., Кузнецова У.Е. О негативном влиянии на здоровье сверхнормативного дополнительного школьного образования: бремя успеха//Студенческая наука-2018. СПб., 2018. С. 139.
2. Щерба Е.В. Здоровье и адаптация детей-инвалидов с нарушением слуха//Вестник РГМУ. 2011. Специальный выпуск № 1. С. 192.
3. Щерба Е.В. Гудинова Ж.В. Результаты лонгитудинального исследования здоровья детей с нарушением слуха в контексте оценки эффективности системы реабилитации/Современные проблемы науки и образования. 2013. № 6. С. 610-617.
влияние шума на работоспособность студентов спбгпму
Алехина А.Д., Будько А.А.
Научный руководитель: к.м.н., доцент Васильева И.В. Кафедра общей гигиены
Санкт-Петербургский государственный педиатрический медицинский университет
Актуальность исследования: шум является постоянным стрессором и запускает каскад реакций организма, приводящих к снижению его резистентности. Чувство беспокойства, раздражение, головные боли, а также снижение работоспособности и качества труда являются характерным проявлением ответной реакции на шум [1].
Цель исследования: выяснить влияние шумов различной природы на работоспособность студентов
Результаты: уровень естественного шума превышен в общежитиях № 1 и № 2. В общежитии № 3 уровень шума соответствует норме. Даже в условиях повышенного естественного шума результаты, полученные в ходе тестов, соответствуют норме. Примерно у 80% процентов испытуемых наблюдалось снижение концентрации на фоне искусственного шума.
Выводы: в результате наших исследований мы выяснили, что естественная шумовая среда, в которой испытуемый находился продолжительное время, не оказывает существенного влияния на функциональное состояние ЦНС. Но, находясь в условиях искусственно повышенной шумности, способность студентов справляться с тестами снизилась. Абсолютно все испытуемые согласились с тем, что шум помешал им эффективно пройти тесты.
1. Алексеев С.В., Львов С.Н., Васильева И.В., Бисенкова Т.Н. Гигиена трудового и профессионального обучения подростков. Учебно-методическое пособие для студентов. СПб., 1998. 45 с.
паразитарная чистота рыб и рыбной продукции
Алмухамбедова А.Р, Салтереева С.Р.
Научный руководитель: к.м.н., доцент Аракельян Р.С Кафедра инфекционных болезней и эпидемиологии Астраханский государственный медицинский университет
Актуальность исследования: в последние годы наблюдаются негативные тенденции в динамике алиментарно-зависимых заболеваний [1,2]. Рыбная продукция относится к наиболее
том 2 спецвыпуск 2019
значимым в эпидемическом плане продуктов питания, являясь источником паразитарных заболеваний [3].
Цель исследования: проанализировать санитарно-паразитологическое состояние рыбной продукции Астраханской области за период 2015-2018 гг.
Материалы и методы: исследования рыбы и рыбопродуктов проводились согласно методическим указаниям МУК 3.2.988-00 «Методы санитарно-паразитологической экспертизы рыбы, моллюсков, ракообразных, земноводных, пресмыкающихся и продуктов их переработ-
Результаты: для исследования на паразитарную чистоту были доставлены рыбы 12 отрядов, исследовались 16 видов рыбной продукции. Пробы рыбы холодного и горячего копчения, вяленая рыба, консервы, филе, стейки и фарши соответствовали гигиеническим нормативам. Наиболее часто положительные находки отмечались в мороженой (34,9%) рыбе — обнаружены метацеркарии Rossicotrema donicum, Apophallus muehlingi и Posthodiplostomum cuticol, наибольший процент положительных проб был выявлен в отряде карповых 3,6% (25 проб). В большинстве случаев рыба была поражена Apophallus muehlingi (в 72,5% от числа неудовлетворительных проб).
Выводы: мониторинг качества и безопасности позволяет выявлять и изымать из оборота не соответствующие гигиеническим требованиям партии рыбной продукции. Содержание метацеркариев обусловливает тщательную обработку рыбы, соблюдая все рекомендации. Литература
1. Аракельян Р.С., Курганова М.В., Иванова Е.С., Кузьмичев Б.Ю. Санитарно-паразитоло-гическое состояние объектов окружающей среды в 2014году // В сборнике: Профилактическая медицина как научно-практическая основа сохранения и укрепления здоровья населения. Сборник научных трудов под общей редакцией М.А. Поздняковой. Нижний Новгород, 2014. С. 121-123.
2. Бедлинская Н.Р., Аракельян Р.С., Карпенко С.Ф., Иванова Е.С., Мартынова О.В., Имамутди-нова Н.Ф., Донскова А.Ю., Калашникова Т.Д., Соколова Я.О., Кузьмичев Б.Ю., Мельникова К.Ю. Санитарно-паразитологическое состояние объектов окружающей среды Астраханской области//Пест-Менеджмент. 2016. № 3 (99). С. 5-8.
3. Иванова Е.С., Кузьмичев Б.Ю., Мартынова О.В., Имамутдинова Н.Ф., Донскова А.Ю., Аракельян Р.С. Санитарно-паразитологическое состояние объектов окружающей среды Астраханской области//Молодежный инновационный вестник. 2016. Т. 5. № 1. С. 238-239.
Атаманиченко А.П., Бочарова Д.М.
Научные руководители: ассистент Козлов А.К., к.м.н., доцент Пузырев В.Г., к.м.н., доцент Бурэ Н.П., д.м.н., профессор Суслова Г.А. Кафедра общей гигиены Кафедра Реабилитологии ФП и ДПо
Санкт-Петербургский государственный педиатрический медицинский университет
Цель исследования: определение значения и отсроченного эффекта раннем плавании у детей первого года жизни.
Материалы и методы: проведен анализ катамнестических данных детей первого года жизни, практиковавших раннее плавание в клиниках СПб ГПМУ с 2016 г. по 2018 г. [1]. Были использованы результаты наблюдений за 160 здоровыми детьми, практикующие раннее пла-
Паразитологическое исследование
Для паразитологического исследования используют живых или только что уснувших рыб всех возрастных категорий. Берут следующее количество рыб: мальков - 25 экз., сеголетков-15-25 экз., годовиков-10-15 экз., остальных возрастных групп по 3-5 экз.
Исследование проводят в следующем порядке: кожа, плавники, ротовая полость, жабры, глаза, кровь, сердце, брюшная полость (печень, селезенка, плавательный пузырь, мочевой пузырь, желчный пузырь, почки, половые железы, кишечник), мышцы, головной и спинной мозг.
Результаты исследований вносят в рабочий журнал, где указывают дату, место вылова рыбы, пол, возраст, массу и длину рыбы, данные паразитологического исследования с предварительным и окончательным определением паразитов.
Для обнаружения трипанозом и криптобий у рыбы берут кровь из сердца и делают мазки.
Для предотвращения свертывания крови добавляют 1 %-ный раствор лимоннокислого натрия, накрывают покровным стеклом и микроскопируют. Чтобы мазок не высыхал, края покровного стекла смазывают вазелином. Одновременно несколько мазков крови высушивают на воздухе, фиксируют в метиловом спирте, окрашивают по Романовскому - Гимзе или гематоксилином и микроскопируют.
Кожный покров. При наружном осмотре кожного покрова и плавников собирают всех паразитов, видимых простым глазом: паразитических ракообразных, пиявок, нематод и других (их предварительно определяют и фиксируют для последующего изучения). Затем скальпелем снимают слизь со всей поверхности тела (мальки, сеголетки, годовики) или с нескольких участков (крупные рыбы) и с плавников, микроскопируют, помещают ее на предметное стекло и смешивают с 2-3 каплями прокипяченной и остуженной воды. Накрывают покровным стеклом и просматривают сначала под лупой, а затем под малым увеличением микроскопа. Возбудителя костиоза можно обнаружить только при среднем увеличении микроскопа. Кроме возбудителей костиоза, на коже рыб паразитируют другие жгутиконосцы, инфузории, моногенетические сосальщики и др. Обнаруживают также споровиков, локализирующихся в дермальных бугорках. Под кожей, в подчешуйных кармашках и в лучах хвостового и спинного плавников иногда находят нематод.
Крупных паразитов (рачков, гельминтов) подсчитывают в абсолютных числах, а мелких (споровиков, инфузорий и других простейших) - в относительных, то есть учитывают число паразитов в десяти полях зрения микроскопа и определяют средние показатели. При этом высчитывают экстенсивность и интенсивность заражения каждым паразитом в отдельности для рыб каждого вида и возраста.
При осмотре кожного покрова можно видеть пигментированные пятна (черного цвета). В этих местах в толще кожи локализуются метацеркарии Posthodiplostomum cuticula. На плавниках встречаются цисты сосальщика Bucephalus.
После кожного покрова обследуют жаберный аппарат. Жаберные дужки помещают на предметное стекло, всех паразитов, видимых простым глазом, подсчитывают и фиксируют. С жаберных лепестков делают соскоб или берут жаберные дужки и с несколькими каплями воды зажимают между двумя предметными стеклами до прозрачности и исследуют под малым увеличением микроскопа.
Споровики, некоторые инфузории и личинки сосальщиков могут быть и в соединительных образованиях (бугорках); обнаружить и извлечь их можно только после разрыва стенки бугорка с помощью препаровальной иглы. В кровеносных сосудах жабр встречаются яйца сангвиникол, споры и мицелий гриба.
Глаза. Для обнаружения паразитов (личинок сосальщиков) глаза извлекают из глазных впадин, кладут на предметное стекло и вскрывают острыми ножницами с внутренней стороны. Стекловидное тело, хрусталик и содержимое передней камеры глаза помещают между двумя предметными стеклами и просматривают под малым увеличением микроскопа.
Брюшная полость. Вскрывают брюшную полость по методике, описанной в разделе "Бактериологическое исследование", с той только разницей, что при паразитологическом исследовании нет необходимости соблюдать условия стерильности. Дугообразный разрез к основанию левого грудного плавника ведут от анального отверстия, вводят непосредственно в него тупой конец одной из бранш ножниц. Вскрытую брюшную полость осматривают, крупных паразитов (лигуна и др.) извлекают, а имеющиеся на серозных покровах и брыжейке бугорки микроскопируют.
Сердце вынимают вместе с крупными сосудами, помещают бактериологическую чашку с физилогическим раствором, вскрывают его полости, промывают образовавшийся осадок и микроскопируют на наличие возбудителя сангвиниколеза и некоторых метацеркариев.
Печень. При наружном осмотре печени можно обнаружить на ее поверхности личинок круглых червей и белые бугорки с заключенными в них личинками ленточных червей. Чтобы обнаружить паразитов, обитающих внутри печени, ее делят на небольшие кусочки, компрессируют и исследуют под лупой, а затем под малым увеличением микроскопа. Желчный пузырь вырезают, помещают на предметное стекло, разрезают ножницами, делают соскоб с внутренней оболочки стенки пузыря. Соскоб и сам желчный пузырь помещают между двумя предметными стеклами и исследуют под лупой или микроскоп. В желчном пузыре можно обнаружить простейших сосальщиков и личинок ленточных червей.
Селезенку исследуют так же, как печень.
Почки. Для обнаружения паразитов кусочки органа помещают между стеклами и исследуют под микроскопом. В почках можно найти крупных паразитов, споровики, яйца сосальщиков, занесенных током крови.
Плавательный пузырь. Наружную волокнистую оболочку плавательного пузыря снимают. Паразиты, находящиеся в его стенке и полостях. Обычно хорошо видны. Их извлекают и исследуют. Иногда берут соскоб с внутренней оболочки пузыря больной рыбы и тщательно микроскопируют.
Мочевой пузырь. Методика исследования сходна с исследованием желчного пузыря. В мочевом пузыре обнаруживают сосальщиков, споровиков и инфузорий.
Половые железы. Для обнаружения паразитов железу частями компрессируют между двумя стеклами и просматривают под микроскопом. В половых железах встречаются микроспородии и крупные плероцеркоиды, окруженные фиброматозными сумками.
Желудочно - кишечный тракт. Пищевод, желудок и кишечник извлекают, освобождают от жира, расправляют и вскрывают, начиная с пищевода. Обнаруженных крупных паразитов (ленточных и круглых червей, сосальщиков) помещают в физиологический раствор. Содержимое из разных отделов желудочно - кишечного тракта исследуют компрессорным методом под микроскопом. Затем с помощью скальпеля делают глубокий соскоб со слизистой оболочки из нескольких мест и исследуют на наличие микроскопических паразитов.
Мысшцы. Для обнаружения зараженности рыб плероцеркоидами, лентецами и другими крупными паразитами мысшцы разрезают на пластинки толщиной 5 мм и просматривают. Чтобы найти мелких паразитов, берут небольшие кусочки мышц из различных частей тела и исследуют компрессорным методом под лупой и под малым увеличением микроскопа.
Головной и спинной мозг исследуют компрессорным методом. В этих органах можно обнаружить споровиков Myxosoma cerebralis Tetrocotyle variegateu.
Хрящи. Для обнаружения возбуителя миксозомоза (вертежа лососевых) компрессорным методом исследуют черепные и межпозвоночные хрящи.
Мазки крови окрашивают азур-эозином по Романовскому - Гимзе. Готовую краску Романовского перед окрашиванием разводят нейтральной дистиллированной водой из расчета 2 - 3 капли краски на 1 мл воды.
Растворметиленовой сини перед употреблением разводят дистиллированной водой 1:10 и окрашивают мазки 30 с, затем промывают водой и дифференцируют в течении нескольких секунд 5 - 10%-ным раствором танина. Эритроциты окрашивают в красновато-фиолетовый цвет, плазма простейших кровепаразитов - в ярко-голубой, ядра лейкоцитов - в фиолетовый.
Для изучения морфологии паразитических инфузорий их окрашивают железным гематоксилином по Гейденгайну, а также гематоксицилином Делафильда или квасцовыми кармином.
Паразитических жгутинконосцев окрашивают железным гематоксилином или по Романовскому - Гимзе.
Слизистых споров окрашивают 1%-ным водным раствором метиленового синего 30 - 60 мин, затем препарат промывают в воде, последовательно проводят через спирты возрастающей крепости (70, 80, 96%-ный и абсолютный) и просветляют ксилолом.
Трематод и цестод окрашивают квасцовым кармином. Фиксированные в спирте препараты промывают в течении нескольких часов в проточной или часто сменяемой воде и помещают в краску от одной минуты до нескольких часов (в зависимости от толщины гельминта). Продолжительность окраски можно контролировать микроскопией препаратов. Окрашенные препараты переносят в дистиллированную воду, где в течении нескольких минут их тщательно отмывают от краски. Отмытых паразитов осторожно сушат фильтрованной бумагой и проводят через спирты возврастающей крепости (70, 80, 96%-ным), выдерживая в них несколько часов. Обезвоженных паразитов просветляют маслом и ксилолом.
Мелких цестод мождно окрашивать молочнокислым кармином по Блажину. Молочную кислоту разводят в 2 раза дистиллированной водой, добавляют небольшое количество кармина (в зависимости от желаемой степени окраски). Жидкость кипятят. Красить лучше свежие, нефиксированные объекты. Продолжительность окраски контролируют под микроскопом, а в случае перекрашивания объект переносят в цельную молочную кислоту для обесцвечивания. Окрашенный препарат промывают 20-60 мин водопроводной водой и помещают в бальзам.
При окраске крупных цестод этот способ модифицировали. Цестод промывают в проточной или часто сменяемой водопроводной воде при комнатной температуре летом один день, в холодное время года - 3-4 дня. Затем их помещают на 4-6 ч в краску (0,3 г кармина на 100 мл 30 %-ной молочной кислоты). Интенсивность прокрашивания контролируют под микроскопом. После этого на сутки их переносят в дистиллированную воду, в которую добавляют 3 капли раствора сернокислого железа и 2 капли 1%-ного раствора фенола. Далее цестод переносят на чистое предметное стекло, расправляют и высушивают при температуре 30-37°. Высохший очень плотно приставший к стеклу препарат заливают канадским бальзамом или канифолью, растворенной в смеси, состоящей из равных частей хлороформа и абсолютного спирта.
Для приготовления временных препаратов нематод не окрашивают, а кладут для просветления в неразведенную молочную кислоту или лактофенольный раствор (2 части глицерина, 1 часть молочной кислоты, 1 часть фенола и 1 часть воды) на 3-10 дней. Мелких гельминтов на 1-2 дня помещают в молочную кислоту (1-2 капли) и накрывают покровным стеклом.
Постоянные препараты для микроскопического исследования нематод готовят так. Фиксированных в 70 %-ном спирте живых гельминтов через сутки помещают на несколько часов (в зависимости от величины нематод) в 96 %-ный, а затем в абсолютный спирт на 3-5 мин. После этого их переносят в гвоздичное или хеноподиевое масло или карбоксилол на 2-5 мин, а затем кладут на чистое предметное стекло и заливают бальзамом.
Скребней (акантоцефалов) для изучения хоботка и крючков просветляют. Для этого их из 70 %-ного спирта переносят сначала в 50 %-ный глицерин, а затем в чистый. Структуру других органов изучают после полного обезвоживания гельминтов путем постепенного проведения их через спирты возрастающей крепости. Из абсолютного спирта гельминтов переносят на предметное стекло в каплю кедрового масла, покрывают покровным стеклом и микроскопируют.
Паразитических рачков исследуют в той же жидкости, в которой хранят. Красить их не обязательно. Иногда прибегают к окраске борным кармином, эозином, сафранином и др.
Идентификацию паразитов проводят по "Определителю паразитов пресноводных рыб СССР" (Изд-во АН СССР, 1984-1985 гг., т. 1-3).
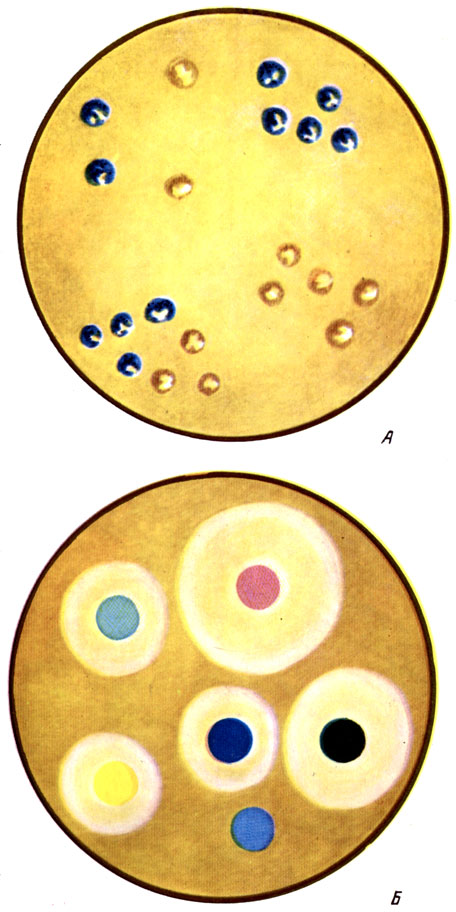
Таблица I. Колонии бактерий, положительно реагируют на цитохромоксидазу (окрашены в сине - голубой цвет) (А); Б - определение чувствительности бактерий к антибиотикам методом бумажных дисков на агаре
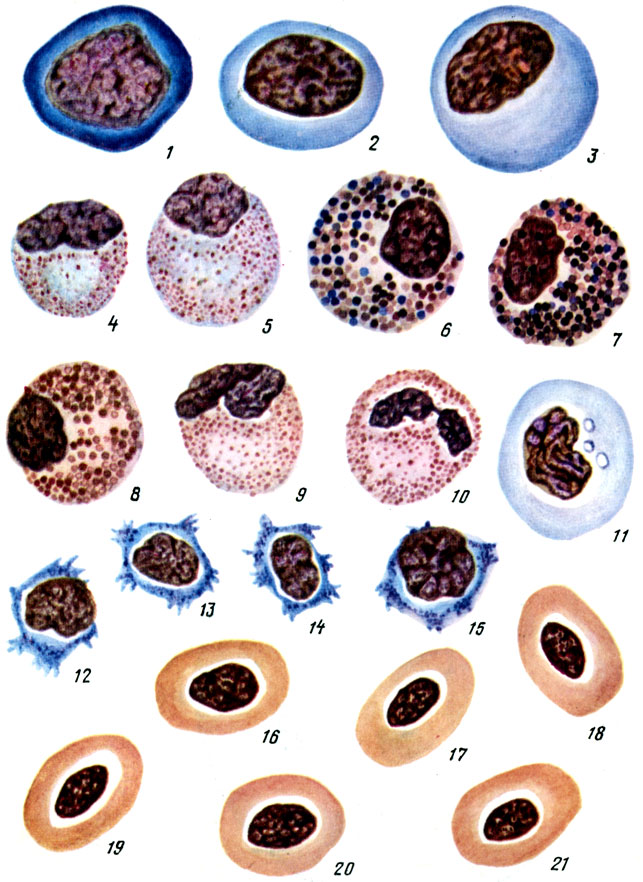
Таблица II. Кровь карпа в норме: 1 - гемоцитобласт; 2 - миелобласт; 3- промислоцит; 4 - нейтрофильный миелоцит: 5 - нейтрофильный, 6, 7 - базофильные и 8 - псевдозоэозинофильный метамиелоциты; 9, 10 - налочкоядерный и сегментноядерный нейтрофилы; 11 - моноцит; 12 - 15 - лимфоциты; 16 - 21 - эритроциты

Таблица III. Вирусная геморрагическая септицемия форели (по Гиттино): 1 - анемия и кровоизлияния в жабрах; 2 - геморрагии в мышцах и висцеральной жировой ткани; 3 - множественные геморрагии в мускулатуре, плавательном пузыре

Таблица IV. Аэромоноз (краснуха) карпов: 1,2- асцитная форма; 3 - язвенная форма
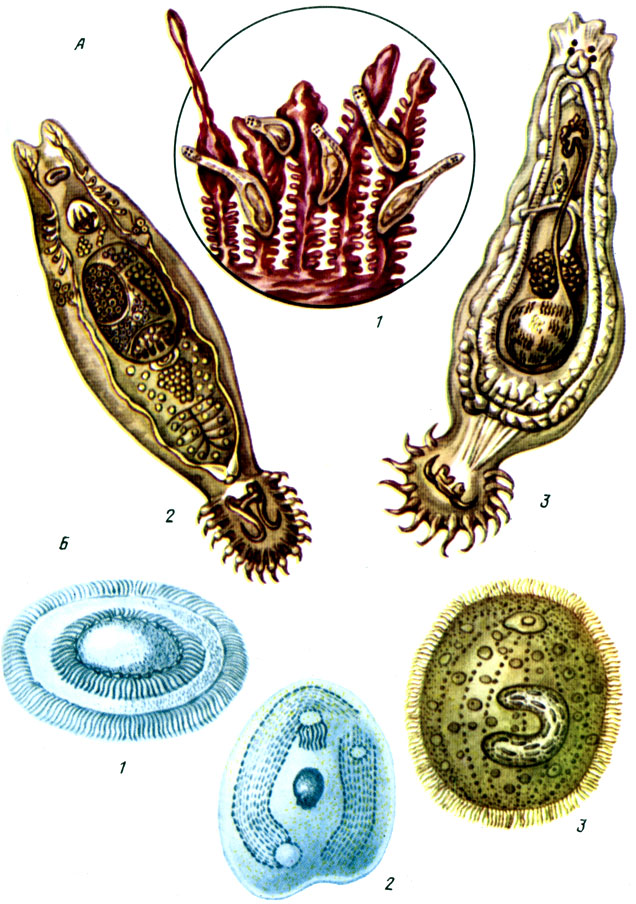
Таблица V. Гиродактилез и дактилогироз рыб (А): 1 - паразиты на жабрах; 2 - гидродактилюс; 3 - дактилогирус; Б - возбудители протозоиных болезней рыб: 1 - триходина; 2 - хилодонелла; 3 - ихтиофтириус

Таблица VI. Возбудители гельминтозов рыб: 1 - ботриоцефалюс: 2 - кавиа: 3 карп со зрелыми филометроидесами
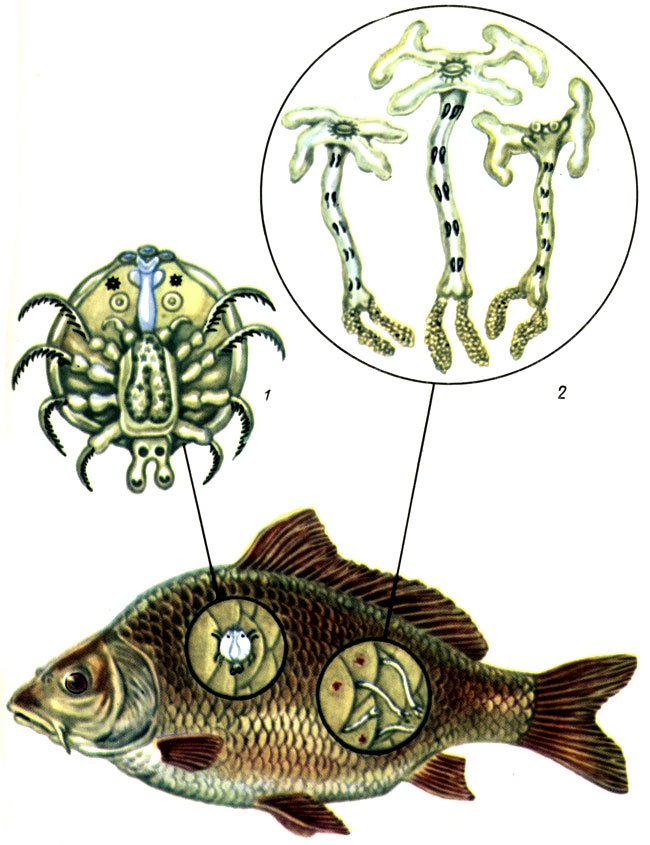
Таблица VII. Возбудители крустацеозов рыб: 1 - аргулюс: 2 - лернеа; 3 - пораженная рыба

Таблица VIII. Воспаление плавательного пузыря карпов (1); 2 - пузырь при остром и 3 - хроническом течении болезни
студент, Омского государственного аграрного университета имени П.А. Столыпина,
канд. ветеринар. наук, доцент Омский государственный аграрный университет имени П.А. Столыпина,

В последние годы к рыбохозяйственному комплексу и рыбалке обращено пристальное внимание. Рыбалка является одним из наиболее древних видов человеческой деятельности. И по сей день рыболовство имеет большое значение в обеспечении всего населения продуктами питания [2].
При вылове, продаже и употреблении в пищу рыбы необходимо учитывать тот факт, что многие виды рыб могут быть подвержены паразитарным заболеваниям, и выпуск подобной продукции на рынок неприемлем и сопровождается несением судебной ответственности. Именно поэтому проверка на паразитную чистоту достаточно значима для здоровья всего человечества в целях недопущения заражения людей и животных.
Целью данной работы является исследование рыбы на паразитные заболевания. Задачи исследования:
- Оценка ихтиофауны озера Салтаим.
- Исследование мяса карася на описторхоз, дифиллоботриоз, лигулез.
- Мониторинг встречаемости паразитарных болезней.
Материал для исследования: рыбы из семейства карповых (карась). Для исследования было отобрано три карася. Образцы, выловленные из озера Салтаим Крутинского района, были куплены на Ленинградском рынке.
Данные исследования проводились на кафедре ветеринарно-санитарной экспертизы продуктов животноводства и гигиены сельскохозяйственных животных Омского ГАУ.
Компрессионный метод использовался для обнаружения метарцеркариев в тканях рыб. После исследований всей поверхности мускулатуры рыбы, тщательно отделяющейся от кожи и плавников вместе с подкожно-жировой клетчаткой, были получены более точные результаты.
Описторхоз ( felineus). Для исследования были взяты пробы следующих групп мышц: три пробы было взято из спинной части и две из брюшной части мышц с каждой стороны вместе с подкожной клетчаткой. Пробы мышц брались отдельно с площади 1-2 см 2 на глубине 2-3 мм. Мышечную ткань, подлежащую исследованию, измельчали и порциями по 1-1,5 г раскладывали между двумя стеклами размером 6-8 х 12-15 см. Готовые компрессионные препараты просматривали под бинокуляром при увеличении в 16 раз [4].
Ветеринарно-санитарная оценка. Как только мускулатура подвергается множественному поражению метацеркариями описторхиса, рыбу отправляют на техническую утилизацию. В регионах, неблагополучных по описторхозу, рыбу необходимо технически обрабатывать: варить в течение 30 минут или замораживать при температуре -15°С до 30 суток, 28°С до 42 часов и при температуре -35°С около 10 часов [3].
Плероцеркоид Diphyllobothrium latum (лентец широкий). Исследование заключается в визуальном осмотре. Как и при исследовании на описторхоз, использовался компрессионный метод.
Ветеринарно-санитарная оценка. Запрещено употреблять рыбу в пищевых целях, если она заражена плероцеркоидами. Она может быть использована только после обеззараживания проваркой не менее 30 минут или для изготовления консервов. Обеззараживание наступает также после замораживания при температуре -18°С в течение 48 часов, а при -12°С – не менее 6 суток [3].
Рыбу также можно обезвредить и в микроволновой печи. Продолжительность обработки зависит от массы рыбы. Так, при массе 400 г достаточно 3 минут, 500 г – 5 минут, 850-900 г – 10 минут, 1000-1100 г – 12 минут.
В регионах, где реализуется рыба, подверженная дифиллоботриозу, в обязательном порядке требуется выставление плакатов, оповещающих о необходимости тщательной проварке тушек рыб [2].
Лигулёз (Ligula intestinalis). Как и дифиллоботриоз, легулёз осматривался визуально. У поражённой лигулами рыбы, как правило, наблюдается вздутое брюшко. У образцов для исследования вздутия не было выявлено. Вскрытие и исследование компрессионным методом проводили так же, как при исследовании на описторхоз и дифиллоботриоз.
На основании вскрытия рыбы и обнаружения в брюшной полости плероцеркоидов ремнецов ставят диагноз [5].
Рыба может допускаться к употреблению в пищу в потрошенном виде только при отсутствии патологических изменений. Истощённую же рыбу при отрицательных результатах бактериологического исследования скармливают животным после тщательной термической обработки [1].
Результаты исследований на паразитарную чистоту занесены в таблицу 1.
Таблица 1
Результаты исследования мяса карася
Методы санитарно-паразитологической экспертизы рыбы
Исследование рыбы на наличие метацеркарий описторхисов проводится в соответствии с МУК 3.2.988-00 "Методы санитарно-паразитологической экспертизы рыбы, моллюсков, ракообразных, земноводных, пресмыкающихся и продуктов их переработки" при соблюдении режимов работы с инвазионным материалом, регламентированных СП 1.2.731-99 "Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами".
Отбор и объем проб рыбы и продуктов её переработки осуществляется в соответствии с требованиями:
- ГОСТ 7631-85 "Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Правила приемки, органолептические методы оценки качества, методы отбора проб для лабораторных испытаний";
Приказом Ростехрегулирования от 18 августа 2008 г. N 178-ст взамен ГОСТ 7631-85 в части определения органолептических и физических показателей с 1 января 2009 г. введен в действие ГОСТ 7631-2008
Приказом Ростехрегулирования от 27 декабря 2006 г. N 501-ст взамен ГОСТ 7631-85 в части правил приемки и методов отбора проб с 1 июля 2008 г. введен в действие ГОСТ 31339-2006
- МУ 3.2.1756-03 "Эпиднадзор за паразитарными болезнями".
Объектами исследований являются пресноводные рыбы семейства карповых и продукты их переработки. Метацеркариями описторхиса могут быть заражены: язь, елец, линь, красноперка, плотва, верховка, голавль, лещ, чехонь, синец, гольян (обыкновенный и Чекановского), подуст, белоглазка, уклейка, густера, пескарь, щиповка, жерех, усач, в ряде мест - золотой и серебряный карась.
Для исследования на наличие метацеркарий Opisthorchis felineus целесообразнее отбирать рыб старших возрастов, т.к. личинки паразитов живут несколько лет и их число увеличивается с возрастом рыб.
Сохранять свежевыловленную рыбу до исследования следует в охлажденном состоянии (в холодильнике), не допуская кристаллизации, либо в слегка подвяленном на воздухе виде не более 3-5 дней. Замороженная рыбопродукция (сырье, полуфабрикаты и готовые изделия) до исследования хранится при температуре и в условиях согласно нормативно-технической документации на нее.
Непосредственно перед исследованием мороженую рыбную продукцию размораживают до температуры не ниже 0° в толще тела рыбы. При исследовании вяленой, соленой и копченой рыбы ее предварительно вымачивают в течение суток до размягчения мышц, меняя воду каждые 4-6 ч.
Метацеркарии трематод не видны невооруженным глазом, поэтому выявление личинок производят с использованием оптических средств путем исследования органов и тканей рыб - мест наиболее вероятной их локализации. Личинки описторхисов чаще всего инцистируются в подкожной клетчатке и верхнем слое мышечной ткани (2-4 мм) в области спины рыбы, реже в плавниках, на жабрах, в чешуе. Уточнение видовой принадлежности личинок гельминтов ведется с применением световых микроскопов типа МБС, Биолам или других.
Для исследования мышечной ткани используют компрессорный метод и метод переваривания в искусственном желудочном соке.
Исследуемый участок тела рыбы освобождают от чешуи, затем скальпелем надрезают кожу по средней линии спины и двумя надрезами от первого надреза до боковой линии выделяют участок средней трети спины. Кожу с вычлененного участка поднимают пинцетом и с помощью скальпеля отделяют ее так, чтобы подкожная клетчатка осталась на поверхности мышц. Острым скальпелем соскабливают или срезают тонкие пластинки поверхностного слоя мышц толщиной не более 2-3 мм, размещают их на нижнем стекле компрессория, накрывают другим стеклом и сдавливают их. Наиболее удобно использовать компрессорные стекла, нарезанные из обычного оконного стекла с краями, обработанными наждаком. Размеры стекол 6-8 х 12-15 см, нижнее стекло немного больше верхнего, толщина 3-5 мм. Срезы просматривают с помощью микроскопа типа МБС, используя увеличение в 16-48 раз (окуляр 8х, 12х, объектив 2х, 4х). Для уточнения диагноза кусочки тканей с личинками переносят на предметные стекла, накрывают покровными и исследуют при большем увеличении (например, объектив 8х, 10х, окуляр 7х или 10х, бинокулярная насадка 1,5х) с помощью микроскопа типа Биолам, Бимам.
При обнаружении личинок можно ограничиться просмотром мышц с одной стороны тела. При отсутствии личинок необходимо просмотреть срез и с другой стороны. При исследовании молоди рыб длиной до 20-25 мм их компрессуют целиком. Более крупных сеголеток распластывают на две половинки и просматривают в компрессории со стороны разреза, не снимая кожи и не освобождая от чешуи.
Подсыхающие срезы, препараты увлажняют водой или физиологическим раствором из пипетки.
Метод переваривания в искусственном желудочном соке
Метод основан на том, что в кислой среде метацеркарии освобождаются от наружной оболочки, а окружающая их мышечная ткань переваривается в искусственном желудочном соке.
Приготовление искусственного желудочного сока. На 1 000 мл дистиллированной воды (при ее отсутствии можно использовать кипяченую остывшую до температуры 37-38°С водопроводную воду) добавляют 7 г пепсина, 9,0 г поваренной соли (NaCl) и 10 мл концентрированной соляной кислоты (НСl).
Для выделения метацеркарий трематод берут подкожную мышечную ткань (до 0,5 см). Ее отделяют от кожи, измельчают ножом или в мясорубке. Затем ее заливают в соотношении 1:10 приготовленным искусственным желудочным соком (1 часть фарша и 10 частей искусственного желудочного сока). Пробу помещают в термостат на 3 ч при температуре 36-37°С, после чего содержимое фильтруют в стеклянные цилиндры через металлический фильтр с размером ячеек 1x1 мм или однослойный бинт. Через 15-20 мин верхний слой желудочного сока с переваренной мышечной тканью сливают, а осадок переносят в чашку Петри (или глубокое часовое стекло) и микроскопируют. Для лучшего отделения личинок в чашку Петри наливают физиологический раствор, делают несколько круговых движений, в результате которых метацеркарий концентрируются в центре чашки Петри (часового стекла), а излишки физраствора с остатками мышечной ткани удаляют пипеткой. Процедуру повторяют до полного исчезновения остатков не переваренной мышечной ткани.
Эффективность метода переваривания в сравнении с компрессорным в 1,5 раза выше. Метацеркарий трематод, выделенные этим способом из свежей рыбы, сохраняют свою структуру и жизнеспособность в физрастворе в течение 10-24 ч при температуре 20-25°С и 5-7 дней при температуре 1-4°С и могут быть использованы для биопробы.
Этим методом рекомендуется исследовать такие продукты переработки рыбы, как фарш, жареная, заливная, вяленая рыба.
Большинство метацеркарий трематод, встречающихся в рыбе, не опасно для здоровья человека. Для выявления возбудителей заболеваний человека необходима дифференциальная диагностика. В первую очередь ориентируются на размер и форму обнаруженной цисты, характер ее оболочек; положение личинки в цисте (подвижность*) и ее строение, в т.ч. размер, цвет и форму экскреторного пузыря (рис. 1).
Определение трематод до вида по строению цисты возможно только при достаточном навыке исследователя. В противном случае для уточнения видовой принадлежности трематод целесообразно извлечь метацеркарию из цисты.
Тщательно отделенную от окружающих тканей цисту помещают на стекло в каплю воды или физиологического раствора. Оболочку ее разрывают тонкими иглами (лучше энтомологическими булавками N 00) или легким надавливанием покровного стекла. Если при этом личинка сама не выходит из цисты, то ее вымывают водой из пипетки. Выход метацеркарий из цист можно стимулировать, воздействуя дуоденальным содержимым человека или животных или трипсином.
При обнаружении личинок описторхисов в рыбной продукции, в т.ч. при оценке эффективности ее обеззараживания, необходимо определить их жизнеспособность, т.к. потенциальную опасность для здоровья человека представляют только живые личинки гельминтов.
В первую очередь можно ориентироваться на морфологические признаки и двигательную активность. Метацеркарий описторхисов, выделенных из тканей рыбы с помощью препаровальной иглы, помещают в каплю теплой воды или физиологического раствора (37-40°С) на предметное стекло, накрывают покровным стеклом и исследуют под малым и большим увеличением микроскопа. Явное нарушение целостности оболочек цист, грубые изменения внутреннего строения личинки, распад ее содержимого, разрушение экскреторного пузыря являются признаками гибели метацеркарий. Наличие даже самых слабых самостоятельных движений личинки свидетельствует о ее жизнеспособности. Отсутствие движения еще не свидетельствует о гибели. Движение можно стимулировать слабым придавливанием метацеркарий покровным стеклом.
Далее можно воспользоваться методом химического воздействия (с использованием химических раздражителей). Вызвать движение личинок можно, воздействуя дуоденальным содержимым, полученным при зондировании человека, либо желчью животных, либо трипсином (0,5% раствор, приготовленный на физрастворе: 0,5 г трипсина растворяют в 100 мл физраствора). На выделенных метацеркарий наносят несколько капель химического реагента так, чтобы полностью покрыть личинок. Для ускорения эксцистирования предметное (часовое) стекло с личинками можно слегка подогреть над пламенем спиртовки, или внести предварительно подогретый до 37-40°С трипсин (или желчь), либо поставить в термостат с t = 37°С на 10 мин. Через несколько секунд под воздействием химического раздражителя начинается выход личинок из цист и их активное движение, что служит показателем жизнеспособности. Процесс эксцистирования личинок контролируют под микроскопом типа МБС. Отсутствие в течение 30 мин всякой двигательной реакции свидетельствует о гибели личинок. Для определения жизнеспособности личинок гельминтов можно использовать и метод переваривания тканей рыбы в искусственном желудочном соке.
Кроме того, определить жизнеспособность метацеркарий трематод можно окрашиванием 0,3%-м раствором розоловой кислоты (аурина) (0,3 г розоловой кислоты растворяют в 100 мл 70° спирта).
Кусочки мышц с личинками освобождают от жира. На ткань наносят 2 капли розоловой кислоты, а через 2 мин - 0,1 N раствор KОН, равномерно распределяя его по ткани. Избыток жидкости с препарата снимают фильтровальной бумагой. Накрывают покровным стеклом и микроскопируют.
Ткань рыбы окрашивается в розовый цвет, живые личинки совершенно не окрашиваются, а мертвые становятся розовыми.
* Характерная для метацеркарий описторхисов подвижность внутри цисты может быть выявлена не только в свежевыловленной рыбе, но и в течение нескольких дней после, подвижность может восстанавливаться и после промораживания рыбной продукции, недостаточного по времени для гибели личинки, при повышении температуры до 37°С.
| > Патогенез и клиника описторхоза |
| Содержание Методические указания МУ 3.2.2601-10 "Профилактика описторхоза" (утв. Главным государственным санитарным врачом. |
Откройте актуальную версию документа прямо сейчас или получите полный доступ к системе ГАРАНТ на 3 дня бесплатно!
Если вы являетесь пользователем интернет-версии системы ГАРАНТ, вы можете открыть этот документ прямо сейчас или запросить по Горячей линии в системе.
Читайте также:


