Что такое токсоплазмозный менингоэнцефалит
- Что такое Токсоплазмозный энцефалит
- Что провоцирует Токсоплазмозный энцефалит
- Патогенез (что происходит?) во время Токсоплазмозного энцефалита
- Симптомы Токсоплазмозного энцефалита
- Диагностика Токсоплазмозного энцефалита
- Лечение Токсоплазмозного энцефалита
- Профилактика Токсоплазмозного энцефалита
- К каким докторам следует обращаться если у Вас Токсоплазмозный энцефалит
Что такое Токсоплазмозный энцефалит
Возбудитель - Toxoplasma gondii относится к простейшим. Тип Protozoa. Подтип Sporozoa (обычно образуют споры; реснички, жгутики или псевдоподии отсутствуют). Класс Telosporea (имеется фаза полового размножения). Подкласс Coccidea (трофозоиты располагаются внутриклеточно, имеют "верхушечный комплекс"). Отряд Eucoccideia (жизненный цикл включает чередование бесполого - шизогония и полового размножения - спорогония). Подотряд Eimeriina (половая стадия в эпителии кишки у позвоночных животных; один хозяин или чередование двух хозяев; спорозоиты находятся в "споре"). Вид Toxoplasma gondii. Существует в трех основных формах: трофозоиты (эндозоиты), цисты и ооцисты. Трофозоиты имеют размеры 4-7 мкм в длину и 2-4 мкм в ширину, по форме напоминают полумесяц, хорошо окрашиваются по Романовскому. Они размножаются внутриклеточно во всех клетках млекопитающих за исключением безъядерных (эритроциты) и обнаруживаются в тканях в острой стадии инфекции. Скопление трофозоитов внутри одной клетки называют псевдоцистой. На трофозоиты активно воздействуют различные химиопрепараты (хлоридин, сульфаниламиды, макролиды и др.), они нестойки вне клетки и во внешней среде, быстро погибают при высушивании, прогревании, под влиянием дезинфицирующих средств.
Цисты формируются в организме хозяина, имеют собственную плотную оболочку. Размеры их до 100 мкм, внутри содержится 3000-5000 паразитов и более. Через плотную оболочку цист не проникают ни антитела, ни лекарственные препараты. Они очень устойчивы к различным воздействиям и в организме хозяина сохраняются десятки лет. Большая часть их локализуется в скелетных мышцах, миокарде, центральной нервной системе.
Ооцисты представляют собой образования овальной формы диаметром 10-12 мкм. Они формируются в слизистой оболочке тонкой кишки некоторых представителей семейства кошачьих и выделяются с испражнениями. Сроки появления ооцист в испражнениях кошки зависят от характера инфицирования и составляют от 3 до 24 дней. Экскреции продолжаются от 7 до 20 дней, за сутки с испражнениями может выделяться до 10 млн ооцист. Споруляция в выделенных фекалиях происходит через 2-3 дня (при температуре 24°С); она не реализуется при температуре ниже 4°С и выше 37°С. Ооцисты при благоприятных условиях сохраняются во внешней среде до 1 года и более. Именно они играют основную роль в передаче инфекции.
Культивируются токсоплазмы путем заражения лабораторных животных (белые мыши, морские свинки, кролики, хомяки), в развивающихся куриных эмбрионах, а также в культуре тканей. Имеются различные штаммы токсоплазм, некоторые из них отличаются высокой вирулентностью (штамм RH) и быстро приводят к гибели лабораторных животных, другие - маловирулентные (авирулентные) обычно не вызывают заметных клинических проявлений болезни.
Воротами инфекции чаще служат органы пищеварения, хотя известны случаи внутрилабораторных заражений высоковирулентными штаммами токсоплазм при повреждении кожи (пипеткой или шприцем с культурой токсоплазм). Внедрение возбудителя происходит в нижних отделах тонкой кишки, затем с током лимфы токсоплазмы достигают регионарных (мезентериальных) лимфатических узлов. Здесь развиваются воспалительные изменения с формированием инфекционных гранулем, напоминающих по клеточному составу туберкулезные или бруцеллезные гранулемы. Мезентериальные лимфатические узлы значительно увеличиваются. Затем токсоплазмы попадают в кровь, разносятся по всему организму и фиксируются в различных органах и тканях (печень, селезенка, лимфатические узлы, нервная система, глаза, миокард, скелетные мышцы). В этих органах образуются скопления паразитов в виде цист, которые могут сохраняться в организме десятки лет и даже пожизненно. В местах фиксации возникают воспалительные очаги, а в некоторых органах (нервная система, скелетные мышцы) - очажки некроза, в которых затем откладываются соли кальция и образуются кальцинаты.
В результате жизнедеятельности паразита и выделения антигенов и аллергенов наступает аллергическая перестройка организма (по типу реакций гиперчувствительности замедленного типа) и вырабатываются антитела, которые выявляются в различных иммунных реакциях (РСК, реакция с красителем Сэбина-Фельдмана, РПГА, ИФА и др.). В развитии иммунитета большое значение имеют как клеточные, так и гуморальные факторы. Наличие антител предохраняет от нового заражения даже высоковирулентными штаммами токсоплазм и обусловливает бессимптомное (латентное) течение токсоплазмоза у большинства инфицированных лиц. При ослаблении защитных сил организма и снижении напряженности иммунитета может наступить обострение заболевания (переход латентной формы в манифестную).
Обострение хронического токсоплазмоза, как правило, провоцируется интеркуррентными заболеваниями (грипп, ОРЗ, пневмонии и др.) и может наблюдаться иногда спустя длительное время (до 10-20 лет) после инфицирования. Описаны обострения с развитием тяжелого токсоплазмозного энцефалита после лечения лиц с латентным токсоплазмозом цитостатиками и иммунодепрессантами. В последние годы важное значение приобрела проблема генерализации латентного токсоплазмоза у ВИЧ-инфицированных. В этих случаях токсоплазмоз приобретает острое злокачественное течение с развитием некротического локализованного или диффузного менингоэнцефалита, в процесс вовлекаются глаза и многие органы (сердце, печень, легкие). На фоне развернутой картины СПИДа наслоившееся обострение (генерализация токсоплазмоза) может приводить к гибели больных.
Основная роль в развитии токсоплазмоза у лиц с иммуносупрессией отводится нарушениям продукции цитокинов. Показано, что при развитии токсоплазмоза на фоне ВИЧ-инфекции резко снижается как концентрация сывороточного гамма-интерферона, так и его способность активировать макрофаги. К факторам защиты относят интерлейкин-12, ФНО-, CD-8+, к факторам, способствующим генерализации заболевания - интрелейкины-4, -6, -10.
В патогенезе манифестных форм хронического токсоплазмоза основную роль играет развитие реакций гиперчувствительности замедленного типа к антигенам токсоплазм и продуктам их жизнедеятельности.
Токсоплазмозный энцефалит служит основной причиной заболеваемости и смертности у больных со СПИДом. Заболеваемость токсоплазмозным энцефалитом среди больных этой категории, имеющих антитела к токсоплазмам, колебалась от 6 до 12%. На основании этого полагают, что имелось приблизительно 170 случаев токсоплазмозного энцефалита среди 7000 больных СПИДом, о которых сообщалось в 1984 г., а развитие еще 150 случаев ожидается среди 7000 больных, которые должны заболеть СПИДом по прогнозу на 1985 г.
Частота случаев токсоплазмозного энцефалита у больных со СПИДом и энцефалитом, как сообщалось, колебалась от 25 до 80%. Диагноз токсоплазменного энцефалита следует иметь в виду у лиц с заболеванием центральной нервной системы, не относящихся к группе риска по СПИДу, так как гетеросексуальная передача вируса лейкоза Т-клеток человека (HTLV III) приводит к развитию СПИДа у лиц, не относящихся к типичным группам повышенного риска.
К внешним признакам и симптомам токсоплазменного энцефалита у больных со СПИДом относят озноб, лихорадку, головную боль, припадки, депрессию и неврологические нарушения; эти проявления могут возникать в сочетании с хориоретинитом. У большинства больных со СПИДом и токсоплазмозным энцефалитом в сыворотке отсутствуют специфические антитела, указывающие на наличие острого токсоплазмоза. Демонстрация повышения титра антител к токсоплазмам в спинномозговой жидкости, но не в сыворотке свидетельствует о токсоплазмозном энцефалите у больных со СПИДом.
В спинномозговой жидкости выявляют плеоцитоз, повышение содержания белка и гипогликорахию; в препаратах из центрифугата спинномозговой жидкости могут быть обнаружены тахизоиты. При исследовании спинномозговой жидкости (или тканей мозга) на наличие вирусов методами культивирования необходимо тщательно контролировать клеточные культуры с целью обнаружения токсоплазм, также способных вызывать формирование бляшек или обширные цитопатические эффекты. Клеточные культуры могут быть окрашены красителем Гимзы.
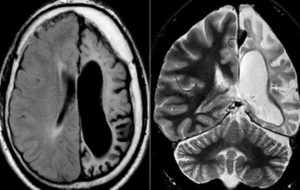
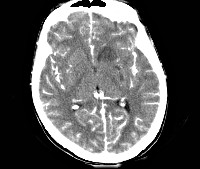
При компьютерной томографии головного мозга наблюдаются признаки диффузного энцефалита и/или одного или нескольких очагов объемного поражения. Внутривенное введение контрастного вещества может выявить кольцевидные, узелковые, мишеневидные поражения в коре или белом веществе, при этом отмечается тенденция к локализации этих поражений глубоко в пределах базальных ганглиев. В начальной фазе инфекционного процесса отклонения от нормы на сканограммах головного мозга выявляются не всегда; иногда первые признаки нарушений впервые могут появиться спустя несколько недель после заражения.
Исследования с задержкой в 1 ч с двойной дозой контрастного вещества помогают выявить поражения, неразличимые на простых сканограммах. При возможности следует произвести биопсию пораженных участков головного мозга, обнаруженных на сканограммах, так как дифференциальная диагностика этих поражений включает энцефалиты, вызываемые грибками родов Candida и Aspergillus, микобактериями и Cryptococcus neoformans, равно как и многоочаговую лейкоэнцефалопатию и лимфому.
При стандартных методах окраски токсоплазмы обнаруживаются только в 50% биоптатов головного мозга от больных с токсоплазмозным энцефалитом. Однако при использовании специфических иммуногистологических методов окрашивания тахизоиты, цисты и/или антигены токсоплазм обнаруживают в биоптатах, полученных от большинства зараженных больных.
Если у больных СПИДом появляются неврологические признаки или симптомы, а на сканограмме головного мозга очаговых изменений не выявляется, однако отмечается положительный тест Сейбина-Фельдмана или высокий уровень IgG в реакции непрямой флюоресценции антител (НФА), целесообразно проведение пробного лечения токсоплазмозного энцефалита. Если при компьютерной томографии на сканограммах выявляются очаговые нарушения, антитела к токсоплазмам, а проведение биопсии затруднено локализацией очагов поражения или клиническим состоянием больного, следует начать предварительное лечение токсоплазмоза.
В подобных случаях положительный эффект от проводимого лечения, наблюдающийся в течение первых 7- 10 дней, подтверждает диагноз токсоплазмозного энцефалита. Если лечение осуществляли с применением кортикостероидов, признаки улучшения, выявленные рентгенографическими методами, не обеспечивают надежного свидетельства в пользу терапевтического эффекта.
При установлении диагноза энцефалита больной должен быть госпитализирован в специализированное (инфекционное) или неврологическое отделение. Назначают строгий постельный режим. Больной нуждается в постоянном наблюдении.
На догоспитальном этапе показано применение дегидратационных средств (лазикс, диакарб).
При выраженных менингеальных и энцефалитических симптомах (сильная головная боль, боль в мышцах, токсикоз, рвота, очаговые симптомы) вводят изотонический раствор натрия хлорида, раствор Рингера-Локка. Одновременно подкожно или внутримышечно вводят витамины группы В, аскорбиновую кислоту (не менее 1,5 г в сутки).
Если стандартная схема лечения с применением хлоридина (по 25 мг в сутки), трисульфапиримидина (по 6 - 8 г) или сульфадизина неэффективна, суточную дозу хлоридина следует увеличить до 50 мг. В случае развития у больного неблагоприятной реакции на сульфаниламидный препарат рекомендуется использовать только пириметамин в дозе 50 мг в сутки. Необходимо применять фолиевую кислоту в дозе до 15 мг в сутки, особенно когда отмечается депрессия костного мозга в результате воздействия хлоридина. Однако если депрессия костного мозга у больных со СПИДом обусловлена иммунными механизмами, профилактический прием фолиевой кислоты не устраняет лейкопению.
Меры по профилактике инвазии включают вмешательство в цикл передачи, и их соблюдение особенно важно для больных с иммунодефицитом и серонегативных беременных женщин. Очень важно, чтобы больные из групп риска знали о том, как можно избежать заражения цистами (плохая кулинарная обработка мяса) и спорулированными ооцистами (при контактах с домашними кошками).
Для уничтожения цист мясо следует прогревать до 60°С или замораживать при - 20°С. (Бытовые морозильные камеры не способны создавать и поддерживать такую температуру.) После приготовления пищи из сырого мяса руки следует тщательно мыть; необходимо также мыть фрукты и овощи, которые могут быть загрязнены ооцистами. Обработка продуктов сухим жаром (66°С) или кипящей водой делает ооцисты неинфективными. Следует избегать контактов с экскрементами кошек.
Данных, позволяющих дать четкие рекомендации относительно использования цельной крови, переливания лейкоцитов или трансплантации органов в случае обнаружения у донора антител против токсоплазм нет. Вместе с тем не следует использовать кровь или продукты крови, полученные от лиц с наличием антител против токсоплазм, для переливания больным с иммуносупрессией, а органы для трансплантации серонегативным реципиентам следует брать от лиц с отрицательными серологическим реакциями на токсоплазмоз.
Токсоплазменный энцефалит – угрожающее жизни заболевание, которое регистрируют преимущественно у ВИЧ-инфицированных или больных СПИДом лиц.
Патогенез заболевания
Заболевание провоцирует Toxoplasma gondii, относящаяся к простейшим. Микроорганизм проникает в тело человека через желудочно-кишечный тракт, однако существует вероятность заражения через поврежденную кожу.
Из тонкого отдела кишечника токсоплазма попадает в лимфатическую систему, внедряясь в регионарные узлы, провоцируя гранулематозное воспаление.
Из увеличенных лимфатических узлов возбудитель проникает в кровь, распространяясь по организму и образуя в органах и тканях своеобразные скопления (цисты).
В местах агломерации развиваются воспалительные процессы, в том числе с последующей кальцинацией.
Паразит выделяет антигены, в ответ на которые, иммунная система синтезирует антитела. Эти антитела препятствуют новому инфицированию. Они подавляют, но, как правило, не уничтожают инфекцию, которая уже закрепилась в организме, что обуславливает ее латентное течение. В таком состоянии паразит может существовать в теле человека десятки лет и никогда не проявляться.
Обострение возникает в связи с развитием другого инфекционного недуга на фоне хронического токсоплазмоза (пневмония, грипп, простуда) или в результате применения препаратов, подавляющих иммунитет.
В особую группу риска попадают ВИЧ-инфицированные люди, у которых обострение токсоплазмозной инфекции ведет к развитию менингоэнцефалита с вовлечением в процесс внутренних органов. Таким пациентам, болезнь грозит серьезными осложнениями, вплоть до летального исхода.
У людей с поражениями иммунной системы нарушается синтез цитокинов, что позволяет возбудителю активироваться. Токсоплазмоз, который развивается при наличии ВИЧ-инфекции, способствует снижению концентрации гамма-интерферона в плазме крови и подавляет активацию макрофагов.
В таких условиях простейшие бесконтрольно размножаются, что приводит к манифестации болезни.
Симптомы токсоплазмозного энцефалита
Данная патология широко распространена среди людей, больных СПИДом. Для большинства заболевших токсоплазмозный энцефалит заканчивается летально. Среди больных СПИДом, у которых зарегистрирован энцефалит, в 25- 80% случаев он обусловлен наличием токсоплазмы.
Первыми признаками заболевания выступает лихорадка, которая сопровождается помрачением сознания, психическими и неврологическими нарушениями. В некоторых случаях лихорадка отсутствует, а патология проявляется эпилептическим приступом без другой характерной симптоматики.
Больные жалуются на головную боль на фоне повышения температуры до субфебрильных или фебрильных показателей. Позднее появляются неврологические и поведенческие нарушения, депрессивные состояния.
Менингеальные симптомы проявляются:
- интенсивной головной болью;
- общей слабостью;
- ригидностью мышц затылка;
- тошнотой и рвотными позывами;
- симптомами Бехтерева, Кернинга, Брудзинского.
У некоторых больных токсоплазмозный менингоэнцефалит протекает в атипичной форме, что затрудняет постановку диагноза.
Диагностика токсоплазмозного энцефалита
Диагностика должна быть комплексной. Лечащий врач собирает анамнез больного, проводит осмотр и направляет пациента на дополнительные обследования и анализы.
Для выявления признаков инфекции проводят пункцию спинномозгового канала и исследуют ликвор. При наличии возбудителя обнаруживают повышенное количество лейкоцитов, белка и пониженное содержание сахара в спинномозговой жидкости. Посев на питательные среды и последующее исследование микроорганизмов под микроскопом выявляет токсоплазму. В некоторых случаях паразита удается выявить в центрифугате ликвора.

Проводят исследование головного мозга при помощи компьютерной томографии или магнитно-резонансной томографии. Энцефалит токсоплазмозной этиологии проявляется признаками диффузного воспаления тканей мозга с очагами поражения. В некоторых случаях очаги могут отсутствовать. Исследование с контрастным веществом выявляет в тканях головного мозга дефекты в форме узелков или колец, преимущественно в области базальных ганглиев.
На ранних этапах заболевания структурные изменения в мозге могут отсутствовать, но спустя несколько недель они будут отчетливо видны на снимках. При первых клинических проявлениях болезни целесообразно проводить исследование с задержкой и увеличенной дозой контраста, что позволяет выявить минимальные дефекты.
Желательно взять биопсию из пораженных участков, чтобы дифференцировать болезнь от воспалительных процессов, провоцируемых патогенными грибами и микобактериями, а также от новообразований. Биоптат направляют на гистологическое исследование, проводят окраску срезов. Стандартное окрашивание позволяет выявить возбудителя в половине случаев. Для увеличения достоверности метода используют иммуногистологические методики, выявляющие не только простейших и цисты, но и антигены.
Серологические исследования плазмы крови выявляют высокие титры иммуноглобулина G в НФА, а реакция Сейбина-Фельдмана дает положительный результат. Это позволяет своевременно начать лечение токсоплазмоза при отсутствии явных структурных изменений на КТ или МРТ снимках.
Если все проведенные исследования дают сомнительный результат, однако токсоплазмозный энцефалит не был исключен, то назначают пробное лечение и следят за динамикой состояния пациента.
Токсоплазмозный менингоэнцефалит: лечение заболевания
Лечение проводится в условиях стационара неврологического отделения. Больной должен соблюдать постельный режим, а терапия осуществляется под постоянным наблюдением специалистов. Для предотвращения отека мозга используют мочегонные средства, выводящие лишнюю жидкость из организма.
Энцефалические и менингеальные симптомы устраняют при помощи инфузионного введения физиологического раствора и раствора Рингера, витамина С и витаминов В.
Для борьбы с токсоплазмой используют следующие схемы:
- Внутрь 1-1,5 г сульфадиазина четыре раза в сутки, в сочетании с 0,05 г пириметамина два раза в сутки. Препараты необходимо принимать в вышеуказанных дозах в течение трех дней, после чего дозировку сокращают в два раза. Дополнительно следует принимать по 0,045 г фолината кальция один раз в семь дней.
- Внутривенно 0,6 г Клиндамицина четыре раза в сутки, и внутрь 0,05 г пириметамина два раза в сутки. Через три дня дозировку уменьшают в два раза + 0,045 г фолината кальция один раз в семь дней.
- Внутрь суспензию Атовакона по 1,5 г и Пириметамин по 0,05 г по два раза в сутки. После трех дней лечения дозу снижают в два раза. Фолинат кальция по 0,045 г один раз в семь дней.
Учитывая сложность лечения менингоэнцефалита, курс рассчитан на 4-6 недель. Как правило, при своевременно начатой терапии, улучшения наступают спустя несколько суток после применения противомикробных препаратов. Параллельно с этиотропной терапией проводят симптоматическое лечение противовоспалительными, обезболивающими, противосудорожными препаратами.
Профилактика заболевания
Профилактика заключается в недопущении инфицирования токсоплазмозом, особенно людей с ВИЧ-инфекцией и беременных женщин, своевременной диагностике и лечении несложной формы заболевания.
Токсоплазма попадает в организм человека после контакта с домашними животными, или при употреблении в пищу недостаточно обработанных продуктов животного происхождения.
- Людям с иммунодефицитом желательно отказаться от общения с питомцами, либо строго соблюдать правила гигиены. Чистку кошачьего туалета следует осуществлять в резиновых перчатках.
- Важно избегать употребления в пищу мяса, не прошедшего полноценную термическую обработку.
- ВИЧ-инфицированным с обнаруженными антителами к токсоплазме назначают профилактическое лечение сульфаметоксазолом или Дапсоном.
- Больным, перенесшим токсоплазмозный энцефалит надо пожизненное поддерживающее лечение. Без постоянного приема антибактериальных препаратов у подавляющего большинства больных случаются рецидивы.
При необходимости гемотрансфузии ВИЧ-инфицированным пациентам, надо использовать донорскую кровь без антител к токсоплазмам.
Менингоэнцефалит — нейроинфекционное заболевание, протекающее с сочетанным поражением церебрального вещества и оболочек. Проявляется инфекционными, оболочечными, вариабельными очаговыми симптомами. Диагностируется в результате неврологического осмотра, церебральной МРТ/КТ, исследования ликвора, лабораторной диагностики, направленной на поиск возбудителя. Лечение базируется на этиотропной терапии (антибиотики, антивирусные, антимикотические, противопаразитарные фармпрепараты) в комбинации с патогенетическими, симптоматическими средствами.
Общие сведения

Причины менингоэнцефалита
Основной этиофактор заболевания — инфекция. Первичное инфицирование церебральных структур обусловлено непосредственным проникновением в них нейротропных возбудителей. Вторичное инфицирование происходит при распространении инфекционного процесса из расположенных поблизости очагов (отит, синусит), при общих инфекционных заболеваниях (кори, краснухе, гриппе). Основными возбудителями энцефалита выступают вирусы, бактерии, реже — простейшие, патогенные грибы. Инфицирование возможно вследствие:
- Попадания возбудителя в носоглотку. Происходит воздушно-капельным, алиментарным способами. Проникновение в полость черепа реализуется гематогенным путём, провоцирует воспалительные изменения поражённых тканей, приводящие к развитию менингоэнцефалита.
- Укуса насекомого. Трансмиссивный путь передачи характерен для ряда вирусных менингоэнцефалитов и энцефалитов (японского комариного энцефалита, клещевого энцефалита, энцефалита Сент-Луис). Насекомое является переносчиком возбудителя, который при укусе попадает в кровоток и заносится в церебральные ткани, провоцируя заболевание.
- Наличия инфекции в организме. При существовании туберкулёзных, сифилитических очагов, хронического гнойного отита, гнойных процессов челюстно-лицевой области, околоносовых пазух возможно гематогенное распространение бактериальной инфекции. Вирусный менингоэнцефалит может возникнуть как осложнение отдельных ОРВИ.
- Черепно-мозговой травмы. При открытой травме с нарушением целостности костей черепа инфицирование происходит контактным путём. По различным данным, посттравматический менингоэнцефалит наблюдается у 1,3-3,5% пациентов с ЧМТ.
- Вакцинации. Введение живой вакцины на фоне ослабленного иммунитета осложняется развитием инфекционного процесса. Поствакцинальное осложнение с проникновением возбудителей через гематоэнцефалический барьер приводит к возникновению менингоэнцефалита.
При попадании возбудителей в организм человека заболевание возникает далеко не всегда. Факторами, способствующими развитию болезни, считают ослабленное состояние организма, наличие первичного или вторичного иммунодефицита, незрелость системы иммунитета, массивность инвазии.
Патогенез
В ответ на внедрение возбудителя в мозговых тканях развивается воспаление, характер которого (серозное, гнойное) зависит от вида инфекционного агента. Формирующиеся периваскулярные воспалительные инфильтраты ухудшают церебральное кровообращение. Возникает ишемия, выступающая вторичным повреждающим фактором. Усиливается продукция ликвора, что обуславливает развитие внутричерепной гипертензии. Поражение оболочек сопровождается их раздражением, приводящим к появлению менингеального синдрома. Воспаление церебрального вещества протекает с образованием различных по размеру воспалительных фокусов. Нарушение функции расположенных в очагах нейронов вызывает формирование соответствующего неврологического дефицита — очаговой симптоматики. Массовая гибель нервных клеток является причиной стойкого характера возникшего дефицита.
Классификация
В клинической неврологии используется разделение менингоэнцефалитов на различные типы по нескольким критериям: этиологии, характеру морфологических изменений, типу течения. Верификация заболевания осуществляется на диагностическом этапе, необходима для корректного подбора лечения.
По этиологии различают следующие виды энцефалита:
- Вирусный. Возбудителями выступают вирусы гриппа, простого герпеса, кори, бешенства, цитомегаловирус, энтеровирусы. Преобладает серозный характер воспалительных изменений.
- Бактериальный. Обусловлен стрепто-, менинго-, пневмококками, клебсиеллой, гемофильной палочкой. Воспаление имеет гнойный характер.
- Протозойный. Встречается крайне редко. Инфекционными агентами являются амебы, токсоплазмы и другие простейшие.
- Грибковый. Наблюдается преимущественно у иммунокомпрометированных лиц. Может диагностироваться в рамках нейроСПИДа.
По типу воспалительного процесса менингоэнцефалит классифицируют на:
- Серозный. Воспаление сопровождается образованием серозного отделяемого. Цереброспинальная жидкость прозрачная, типичен лимфоцитоз.
- Гнойный. В результате воспалительного процесса образуется гной, обуславливающий мутность ликвора. Преобладают лейкоциты.
- Геморрагический. Протекает с нарушением проницаемости стенок мозговых сосудов. В результате в тканях образуются петехиальные кровоизлияния.
По особенностям клинического течения менингоэнцефалит бывает:
- Молниеносный — имеет быстрое развитие в течение нескольких часов. Большинство случаев оканчивается летальным исходом.
- Острый — симптоматика нарастает медленнее, чем при молниеносной форме, в течение 24–48 часов.
- Подострый — заболевание возникает постепенно, симптомы усугубляются на протяжении от нескольких суток до 1 недели.
- Хронический — воспалительный процесс длится несколько месяцев, лет. Возможны периоды ремиссии и обострения. В хроническую форму может трансформироваться острый и подострый менингоэнцефалит.
Симптомы менингоэнцефалита
Клиническая картина складывается из сочетания общеинфекционных, ликворно-гипертензионных, менингеальных, очаговых симптомов. Типичными признаками инфекции являются повышение температуры тела, недомогание, отсутствие аппетита. Возможны высыпания на кожных покровах. В ряде случаев признаки поражения мозга возникают на фоне текущего инфекционного заболевания. Ликворная гипертензия проявляется интенсивной головной болью, тошнотой, не приносящей облегчения рвотой. Быстро нарастающее повышение внутричерепного давления приводит к расстройству сознания: пациент возбуждён или сонлив, плохо ориентирован, при молниеносном течении впадает в кому.
Менингеальный синдром характеризуется общей гиперестезией — повышенной световой, звуковой, тактильной чувствительностью, гипертонусом задних мышц шеи, мышц-сгибателей конечностей. У некоторых пациентов возникают судорожные приступы. Очаговый неврологический дефицит варьируется в широких пределах в зависимости от локализации и вида воспалительного процесса. Наблюдаются гемипарезы, нарушения чувствительности, сенсомоторная афазия, гиперкинезы, мозжечковый синдром, вестибулярная атаксия, когнитивные нарушения. При поражениях черепно-мозговых нервов отмечаются глазодвигательные и зрительные расстройства, перекос лица, опущение верхнего века, снижение слуха, нарушения глотания, дизартрия.
Осложнения
Массивная бактериальная инфекция сопровождается выделением в кровь большого количества погибших клеток, бактериальных токсинов и продуктов жизнедеятельности, что способно провоцировать развитие бактериально-токсического шока. Воспалительные процессы протекают с накоплением экссудата в межклеточном пространстве церебральных тканей, приводят к отёку головного мозга. Интракраниальная гипертензия и нарастающий отёк мозга осложняются смещением мозговых структур с ущемлением ствола и развитием прогрессирующего бульбарного паралича, опасного сердечной и дыхательной недостаточностью.
Диагностика
Диагностический поиск начинается с опроса пациента и его близких относительно текущей или недавно перенесенной инфекционной болезни, выявления в анамнезе ЧМТ, факта вакцинации, укуса клеща и т. п. Дальнейшие диагностические исследования включают:
- Неврологический осмотр. Позволяет неврологу выявить менингеальные симптомы, очаговый неврологический дефицит, оценить состояние сознания больного. Полученные данные свидетельствуют о вовлечении в патологический процесс одновременно оболочек и мозгового вещества.
- Лабораторные анализы. Картина выраженных воспалительных изменений в клиническом анализе крови (лейкоцитоз, ускоренная СОЭ) характеризует острый бактериальный менингоэнцефалит. Посев крови на стерильность, ПЦР-диагностика позволяют верифицировать возбудителя.
- КТ, МРТ головного мозга. Определяется утолщение, уплотнение оболочек мозга, диффузные изменения церебральных тканей. Наличие воспалительных очагов визуализируется не всегда. При паразитарной этиологии характерны округлые очаги гетерогенной структуры с кольцевидным усилением по периферии.
- Люмбальную пункцию. Проводится для получения спинномозговой жидкости. При гнойном воспалении жидкость мутная с хлопьевидным осадком, при серозном — прозрачная, при геморрагическом — с элементами крови. С целью выявления возбудителя производится исследование цереброспинальной жидкости под микроскопом, посев на различные питательные среды, ПЦР-диагностика.
- Стереотаксическую биопсию головного мозга. Необходима в сложных диагностических случаях, позволяет диагностировать менингоэнцефалит паразитарной этиологии, исключить опухолевый процесс.
Дифференцировать менингоэнцефалит необходимо от опухолей головного мозга, обширных инсультов, протекающих с оболочечным синдромом, токсических поражений ЦНС, прогрессирующих дегенеративных процессов. Дифференциальная диагностика осуществляется среди менингоэнцефалитов различной этиологии. Окончательно определить возбудителя позволяет только его выделение из ликвора, церебральных тканей, крови.
Лечение менингоэнцефалита
Терапия проводится комплексно в условиях отделения реанимации или интенсивной терапии, включает этиотропную, патогенетическую, симптоматическую составляющие. Этиотропное лечение осуществляется соответственно этиологии:
- Антибиотиками. Наиболее часто применяются цефалоспорины, их комбинация с ампициллином. В последующем назначения корректируются в соответствии с результатами определения чувствительности выделенной флоры.
- Противовирусными фармпрепаратами. В случае герпетической этиологии назначается ганцикловир, арбовирусной — рибавирин. Антивирусная терапия сочетается с введением препаратов интерферона.
- Противогрибковыми средствами. Наиболее эффективны амфотерицин В, флуконазол. В тяжёлых случаях используется их комбинация.
- Антипаразитарными препаратами. Противопаразитарные фармпрепараты применяются в сочетании с противогрибковыми средствами или антибиотиками.
Основу патогенетического лечения составляет борьба с церебральным отёком: мочегонные, глюкокортикостероиды. Сохранение жизнедеятельности нейронов осуществляется нейропротекторными, нейрометаболическими средствами. Симптоматическая терапия направлена на купирование основных проявлений заболевания, включает поддержание жизненно важных систем организма (сердечно-сосудистые препараты, оксигенотерапию, ИВЛ), противосудорожные средства, антипиретики, психотропные фармпрепараты. В стадии регресса симптоматики начинают реабилитационную терапию, направленную на максимальное восстановление нарушенных нервных функций (массаж, ЛФК, физиотерапия, акупунктура).
Прогноз и профилактика
Своевременно начатая этиотропная терапия повышает шансы на выздоровление, однако исход болезни зависит от этиологии, формы течения, возраста пациента, состояния его иммунной системы. Самый высокий процент летальности имеет молниеносный менингоэнцефалит. У большинства выживших пациентов наблюдаются резидуальные явления: парезы, нарушения речи, хроническая интракраниальная гипертензия, эпилепсия, психоорганический синдром. У детей младшего возраста менингоэнцефалит провоцирует задержку психического развития.
К профилактическим мерам относятся мероприятия, направленные на укрепление иммунитета (витаминизированное питание, пребывание на свежем воздухе, закаливание, занятия физкультурой), своевременное лечение инфекций, ликвидация хронических инфекционных очагов в организме. Предотвратить посттравматический менингоэнцефалит позволяет корректная обработка ран, ликвидация ликвореи, профилактический приём антибиотиков. Предупредить поствакцинальный менингоэнцефалит можно путём тщательного отбора вакцинируемого контингента.
Читайте также:


