Лучевой фиброз мягких тканей
ВОССТАНОВИТЕЛЬНАЯ РЕАБИЛИТАЦИЯ ОБЛУЧЕННЫХ ТКАНЕЙ
Лучевая терапия, несомненно, обладает эффективным противораковым воздействием и составляет неотъемлемую часть противораковой терапии. Приблизительно 2 третьих всех пациентов получают лучевую терапию в объеме лечения. Однако лучевая терапия способна оказывать нежелательное воздействие на здоровые ткани, включенные в поля облучения, в особенности на костную ткань. Некротические изменения костной ткани, именуемые остеорадионекрозом, относятся к наиболее неблагоприятным постлучевым осложнениям. Механизм повреждения ткани связан с развитием ишемии, клеточного апоптоза и фиброза в месте облучения. Также у пациентов с продолжительным сроком жизни, повышен риск развития постлучевой саркомы, он превышает 0,8% при сравнению с группой, перенесшей лучевую терапию без осложнений.
Клинические наблюдения. Лечение опухолей головы и шеи позволяет достичь хороших онкологических результатов, однако в ряде случаев оно приводит к развитию эстетических и функциональных дефектов. Применение и польза реконструктивной хирургии в лечении постлучевых повреждений неоспорима, особенно техника Коле-мана, которая включает пересадку жировой ткани в облученные зоны. У нас имеется опыт выполнения данной пластики у 13 пациентов, обратившихся в наш центр для реконструкции постлучевых дефектов кожи и слизистой. Достигнут как эстетический, так и функциональный результат, качество жизни пациентов было улучшено. Эти клинические улучшения были сопоставлены с морфологическими данными. Таким образом, мы предположили, что клиническое улучшение были вызваны усиленным кровоснабжением и как следствие улучшенной тканевой регенерацией. Такой клеточный состав, как жировые и ме-зенхимальные стволовые клетки, содержащиеся в жировой клетчатке, потенцирует ангиогенез, что приводит к реваскуляризации и улучшению кровоснабжения в ишемизированных облученных тканях. Что бы более подробно изучить клеточный и тканевой механизмы, лежащие в основе данных изменений мы провели исследование.
Экспериментальные данные. С целью имитации постлучевого повреждения была разработана экспериментальная модель радио-ин-дуцированного дефекта с использованием животных. В качестве объекта исследования были использованы крысы, которым было выполнено билатеральное облучение задней конечности в дозе от 30 до 50 Гр. Оценка в динамики осуществлялась с помощью последовательной регистрации изменений при помощи сцинтиграфии. Также производилось гистологическое, иммуногистохимическое исследование и оценка факторов роста (IL-1, IL-2, IL-6, IL-10, IFN-y, TNF-a, VEGF, GM-CSF, TGF-pU методом иммуноанализа. После облучения, у всех животных развивались острые и отдаленные постлучевые повреждения, интенсивность этих эффектов была значительно выше у группы, облученной дозой 50 Гр. При этом развивался острый некроз стопы, распространяющийся постепенно на всю нижнюю конечность. Количественный анализ осуществлялся с помощью оценки поглощение 99m Tc-этилцистеиного димера методом фотонно-эмиссионной компьютерной томографии.
Кровоснабжение у животных, облученных дозой 30гр было одинаковым с контрольной группой. Однако, при оценке кровоснабжения в ишемизированной конечности (спустя 2 месяца) у животных, облученных дозой 50гр, при сравнении с контрольной группой было отмечено значительное снижение интенсивности кровоснабжения. Также отмечено значительное снижение поглощения 99 m TC-HDP костной тканью в обеих 30гр и 50гр группах. При сравнении с нормальной конечностью, скорость снижения поглощения препарата костной тканью, в группе животных, облученных дозой 50гр оказалось снижено и составило (-29% за 8 месяцев). В 50гр группе, максимальное снижение поглощения препарата было отмечено через 2 месяца и составило (-31%), затем скорость снижения уменьшилась и стабилизировалась к 8 месяцев (-21%). При гистологическом исследовании группы, облученной дозой 30гр, были выявлены такие изменения как отек и фиброз, сосудистая склероз и альтерация.
При гистологическом исследовании костной ткани группы, облученной дозой 50гр, в ткани костного мозга было обнаружено почти полное снижение ростка гемопоэтических клеток, и замещение их адипоцитами. Также был выявлен периваскулярный фиброз, отмечено исчезновение эндотелиальных клеток, колагеновых волокон в сосудистой стенке, и сужение сосудистого просвета. В области мягких тканей были отмечены такие изменения как воспалительная инфильтрация, отек и некротические изменения. При исследовании клеточных маркеров выявлена повышенная экспрессия GM-CSF фактора.
Также была отмечена повышенная экспрессия (VEGF) особенно в коже, маркеры воспаления (IL-1, IL-2 и TNF) были значительно повышены в начальной фазе воспаления, несмотря на незначительную стабилизацию к шести месяцам, мы выявили сохранение воспаления в течение 1 года. Во время нашего долгосрочного 12 месячного исследования, также были зафиксированы случаи развития сарком в области облученных тканей. В заключении, хочется отметить, что постлучевые изменения в тканях зависят от времени, прошедшего с момента облучения и от дозы воздействия.
Оценка постлучевого повреждающего воздействия на ткани производилась также на биологических моделях с использованием крыс. После облучения в дозе 50 Гр, у животных были выявлены тканевые изменения, структурно схожие с человеческим остеорадионекрозом, как в in vivo, так и в in vitro. Разработка животной модели является существенным шагом как для исследования патогенеза постлучевой тканевой дегенерации, так и для оценки эффективности лечения.
Увеличение трансляции GM-CSF подтверждает возможность использования стволовых клеток с целью реабилитации.
Во-вторых, реабилитация постлучевого повреждения ткани с помощью клеточной терапии с использованием мезенхимальных стволовых клеток (BMSCs), основана частично на их высокой способности к ангиогенезу, что представляет новый терапевтический подход. Клеточная терапия была исследована на биологической модели, перенесшей облучение в дозе 30 Гр, с выполнением двух условий: высокое качество культуру прививаемых BMSCs клеток и быстрый срок переноса культуры клеток на поврежденную ткань. Культура стволовых клеток была забрана из костного мозга, заблаговременно до облучения, оценка их характеристик (CD34-, CD45-, CD44+, CD+90) осуществлялась методом серийной флоу цитометрии.
В экспериментах на клеточной культуре, сравнительные характеристики мезенхимальных клеток стали проявляться с третьего пассажа. Спустя два месяца после облучения, животным с костными дефектами были инъецированы в область диафиза большеберцовой кости клетки BMSC (2x106). В течении одной недели с целью определения места локализации имплантированных стволовых клеток и места дефекта производилась синхронная регистрация распределения 99 m Tc/111. После клеточной трансплантации, двойной 99 m Tc/111 анализ подтвердил специфическую локализацию привитой BMSCs клеточной культуры в зоне дефекта. Процентное выражение активности сохранялось на уровне 70% (в течение 2ух часов) и на уровне 40% (в течение 2 и 7 последующих дней).
Заключение. В настоящий момент мы продолжаем оценивать возможное благоприятное действие стволовых клеток (BMSCS) в облученной области. В случае если результаты будут положительны и обоснованы, мы планируем организовать рандомизированное клиническое исследование, что внесет неоценимый вклад в профилактику остеорадионекроза, сосудистой дегенерации и повысит возможность реабилитации постлучевых изменений ткани.
ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ОПУХОЛЯМИ ОСНОВАНИЯ ЧЕРЕПА
За прошедшие 40 лет произошло значительное улучшение и совершенствование хирургических методик удаления злокачественных опухолей, распространяющихся на основание черепа.
Основным показанием для хирургического вмешательства на области основания черепа является наличие как доброкачественных, так и злокачественных опухолей, исходящих из слизистой оболочки полости носа и околоносовых пазух, кожных, костных и хрящевых структур черепно-лицевой области, также опухолей сосудистого и нервного генеза и образований орбиты и твердой мозговой оболочки.
С целью доступа к переднему отделу основания черепа применяется стандартная бифронтальная краниотомия, либо передний подчерепной доступ. Для доступа к опухолям, расположенным более латерально используется черепно-орбито-скуловой доступ, поражения средней черепной ямки требует выполнения краниотомии через основную кость и последующей лицевой транслокации. Современным подходом считается применение эндоназальной хирургии для осуществления доступа к опухолевым поражениям центральной части основания черепа.
Смертность при вмешательствах на черепно-лицевой области сохраняется значительной, с количеством осложнений, приближающимся к 30-40% случаев. В большинстве операционная смертность сохраняется ниже 10%.
Согласно большинству авторов, выживаемость при опухолевых поражениях основания черепа составляет 60%. Отдаленные сроки выживаемости , однако, зависят от гистологического типа опухоли. Эстезионейробластома и малодифференцированные саркомы демонстрируют лучшие отдаленные результаты выживаемости, при сравнении с меланомами слизистой оболочки и низкодифференци-рованным раком. Наиболее худшие показатели продолжительности жизни демонстрируют высокодифференцированные саркомы. Такие признаки как, распространение опухоли на орбиту, либо твердую мозговою оболочку относятся к неблагоприятным прогностическими факторами.
Хирургический метод остается основным и базисным элементом лечения большинства твердых опухолей.
Приблизительно 70% пациентов получающие терапию по поводу рака головы и шеи нуждаются в хирургическом лечении на начальном этапе. В свою очередь, целью и задачами многокомпонентного лечения рака является улучшение продолжительности жизни, безрецидивного периода пациентов и снижение риска развития отдаленных метастазов и возникновения новых первичных опухолей. В достижении этих целей многокомпонентное лечение неоспоримо. С другой стороны, хирургия остается единственным возможным методом лечения пациентов с рецидивами после предшествующей лучевой терапии или химиотерапии.
Роль хирургии области головы и шеи притерпивает синхронные изменения параллельно развитию новых достижений в многокомпонентном лечении. Внедрение лучевой и химиотерапии на начальном этапе многокомпонентного лечения позволило снизить радикальность хирургических вмешательств, однако широкие спасительные операции являются приоритетом при лечении рецидивных опухолей после химиолучевой терапии.
Усовершенствования технологий визуализации и навигации, также как и развитие робототехники и внутритканевой лучевой терапии расширили роль современного хирурга в лечении опухолей головы и шеи. Аналогично, все чаще применяются минимально инвазив-ные операции при лечении опухолей паращитовидных и щитовидных желез. Применение эндоскопии расширило возможности лазерного удаления опухолей гортани, также как и эндоназальная хирургия оптимальна для доступа к опухолевым поражениям центральной части основания черепа. Совершенствование методики гистологического анализа с применением иммуногистохимических техник и генетических маркеров привело как, к более точной диагностики опухоли, так и к оценке ее генеза и выбора тактики лечение.
Роль хирурга занимает значимое место на протяжении всего срока лечения пациентов с опухолями головы и шеи. Она важна как на этапе постановке правильного диагноза и выборе метода лечения, так и неоценима в лечении послеоперационных осложнений и дальнейшей реабилитации и паллиативном симптоматическом лечении пациентов.
Прогностические факторы в выборе тактики лечения рака щитовидной железы были определены во многих крупных исследованиях. Выделяются как пациент, так и опухоль ассоциированные факторы. Возраст и пол пациента относятся к независимым параметром, влияющим на прогноз. Размер опухоли, гистологическое строение, экстратиреоидное распространение, наличие отдаленных метастазов относятся к опухолевым факторам. На основании данных прогностических факторов были выделены три группы риска. К низкой группе риска относятся пациенты молодого возраста с благоприятными опухоль ассоциированными факторами, к группе высокого риска относятся пожилые пациенты с неблагоприятными опухоль ассоциированными факторами. Молодые пациенты с благоприятными опухоль ассоциированными факторами и пожилые пациенты с неблагоприятными относятся к промежуточной группе риска.
Хирургический метод лечения является основным для большинства пациентов низкой группы риска, при этом наблюдается хорошие результаты продолжительности жизни больных. Иногда встречаются метастазы в регионарные лимфатические узлы, и реже локальные рецидивы. Тиреоглобулин сыворотки крови доказал свою эффективность в оценке проведенного лечения и наблюдении за пациентами. Пациентам с малым значением тиреоглобулина и низкой группой риска, лечение радиоактивным йодом не показано. С другой стороны, пациентам с наличием высоких значений тиреоглобулина, свидетельствующем об остаточной ткани щитовидной железы либо метастатическом поражении, назначение радиойодтерапии может быть эффективно. В свою очередь, пациенты промежуточной и высокой групп риска являются кандидатами для облигатной послеоперационной терапии радиоактивным йодом. Пациентам с радиойодрезистентным низкодифференцированным раком щитовидной железы, для достижения местного и регионарного контроля рекомендуется проведение наружной лучевой терапии.
Определение остаточной либо рецидивной опухоли выполняется с исследованием уровня тиреоглобулина сыворотки крови и ультразвукового исследования шеи. С другой стороны, пациенты с низко-дифференцированным раком не демонстрируют высокое значение тиреоглобулина. Диагностика болезни у этих пациентов облегчается с использованием ПЭТ сканирования. Дальнейшее лечение рецидива у пациентов с положительным ПЭТ сканированием, зависит от места и степени распространенности опухоли.
Пациентам с радиойодрезистентным низкодифференцированным раком щитовидной железы, для достижения местного и регионарного контроля рекомендуется либо проведение наружной лучевой терапии, либо добровольное участие в программах и исследованиях использования ингибиторов тирозин-киназы и блокаторов ангиогенеза в качестве таргетной терапии.
а) Терминология:
1. Сокращения:
• Лучевые повреждения легких (ЛПЛ)
2. Определение:
• В основе лучевой терапии (ЛТ) лежит повреждение клеток ионизирующим излучением, которое в зависимости от дозы может приводить к нарушению митоза или гибели клетки
• Лучевая терапия (ЛТ) играет важную роль в предотвращении местно-регионарного распространения множества типов злокачественных новообразований органов грудной клетки:
о Злокачественные новообразования легких, пищевода и молочных желез; эпителиальные опухоли тимуса; злокачественная мезотелиома плевры; лимфома
3. Современные методики лучевой терапии:
• 3D конформная ЛТ (3D-КЛТ):
о Использование нескольких пучков излучения позволяет подвергнуть опухоль наибольшей лучевой нагрузке, не оказывая воздействия на здоровые ткани
• 4D-КЛТ:
о Позволяет учитывать дыхательные движения
• Лучевая терапия с модулированной интенсивностью (ЛТМИ):
о По сравнению с 3D-КЛТ обеспечивает более высокую степень соответствия между зоной облучения и опухолью
• Стереотаксическая ЛТ (СЛТ):
о Высокие дозы суммарного облучения с низкой дозой на фракцию обеспечивают высокую степень соответствия между зоной облучения и опухолью
о В основном используется при раке легких на ранней стадии
• Протонная терапия:
о Вследствие физических особенностей протонов обеспечивает доставку терапевтической дозы к опухоли с минимальным облучением тканей, находящихся позади нее
о Применяется для облучения новообразований, прилежащих к средостению, сердцу, пищеводу и спинному мозгу
• Несмотря на усовершенствование методов таргетной лучевой терапии, облучение прилежащих нормальных мягких тканей по-прежнему может привести к их повреждению
б) Лучевые признаки:
1. Основные особенности изменений после лучевой терапии:
• Оптимальный диагностический ориентир:
о ЛПЛ: затемнение в легких с четким линейным или изогнутым контуром:
- Ограничено зоной облучения, а не анатомически
• Характерные особенности ЛПЛ:
о Облучение области шеи: консолидация легочной ткани в верхушках легких
о Мантиевидное поле облучения: участки консолидации легочной ткани в виде буквы у располагающиеся в верхушках легких и вдоль средостения
о Тангенциальное поле облучения молочной железы: затемнения в субплевральных отделах легких, ориентированные параллельно гомолатеральной переднебоковой грудной стенке
2. Рентгенография после лучевой терапии:
• Лучевой пневмонит: 1-6 месяцы после ЛТ:
о Консолидация легочной ткани, альвеолярные затемнения
• Лучевой фиброз: 6-12 месяцев:
о Консолидация легочной ткани с прогрессирующим объемным уменьшением легкого, тракционные бронхоэктазы
о Затемнение в прилежащей к зоне облучения области: инфекция или рецидивирующая опухоль
3. КТ после лучевой терапии:
• Сердце и перикард:
о Перикардит:
- Острый и отсроченный (во время ЛТ и в течение двух лет после ЛТ): перикардиальный выпот, утолщение перикарда или накопление им контрастного вещества
- Хронический: утолщение перикарда ±обызвествление
- Может развиваться констриктивный перикардит
о Обызвествление коронарных артерий
• Грудная стенка:
о Перелом костей в зоне облучения:
- Переднебоковые отделы ребер в случае ЛТ молочной железы
о Постлучевая саркома:
- Объемное образование в мягких тканях грудной стенки или накопление ими контрастного вещества
- Костная деструкция
- Узловое утолщение кожных покровов или накопление ими контрастного вещества
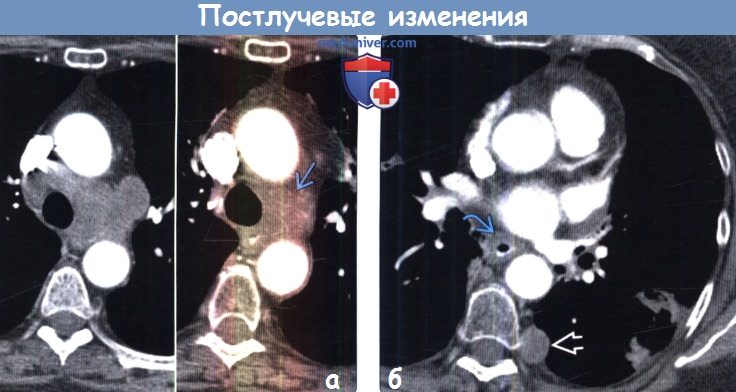
(а) У этого же пациента на совмещенных изображениях при КТ с контрастным усилением до (слева) и после (справа) ЛТМИ определяется уменьшение размеров паратрахеальных и аортопульмональных лимфатических узлов. Следует отметить нечеткость контура и уплотнение мягких тканей в левой паратрахеальной области, которые обусловлены, вероятно, лучевым фиброзом.
(б) У этого же пациента при КТ с контрастным усилением визуализируется умеренное утолщение стенки дистальных отделов пищевода, свидетельствующее в пользу эзофагита — частой находки после лучевой терапии. За пределами зоны облучения в плевре слева возник новый метастаз.
3. Методы медицинской радиологии. ПЭТ/КТ:
о Вследствие воспаления в зоне облучения может выявляться повышенный уровень накопления ФДГ:
- Может сохраняться до 15 месяцев
- Облегчает постановку диагноза сравнение результатов нескольких исследований:
Повышенный уровень накопления ФДГ, обусловленный воспалением, со временем снижается
Очаг повышенного уровня поглощения ФДГ более характерен для резидуальной или рецидивирующей опухоли
о По сравнению с КТ данный метод позволяет с большей точностью отличить ЛПЛ от резидуальной или рецидивирующей опухоли
о Облегчает оценку эффективности лечения, поскольку уменьшение размеров объемного образования или выраженности лим-фаденопатии при КТ может быть не столь очевидным
о Поглощение ФДГ пищеводом:
- Протяженный линейный участок: эзофагит
- Изолированный очаг накопления: изъязвление, стриктура, резидуальная или рецидивирующая опухоль:
Для постановки точного диагноза может потребоваться выполнение эндоскопии
о Вследствие подавления метаболической активности спинного мозга, последний в зоне облучения характеризуется относительно более низким уровнем поглощения ФДГ
4. Рекомендации к проведению лучевых исследований:
• Оптимальный метод лучевой диагностики:
о ПЭТ/КТ облегчает дифференцирование между рецидивирующей опухолью в зоне облучения и ЛПЛ, а также позволяет выявлять отдаленные метастазы или вторую первичную злокачественную опухоль
• По причине высокой вероятности получения ложноположительный результатов не следует выполнять ПЭТ в течение как минимум трех месяцев после ЛТ
в) Дифференциальный ряд заболеваний:
2. Рецидивирующая злокачественная опухоль:
• Повышение плотности или увеличение размеров участка фиброза, формирование выпуклого его контура
• Выявление содержимого в ранее свободных бронхах в зоне лучевого фиброза
• Возникновение узелков в плевре, лимфаденопатии, костной деструкции является более точным признаком рецидивирования
г) Патоморфология изменений после лучевой терапии. Микроскопические особенности:
• Лучевой пневмонит: повреждение небольших сосудов => повышение их проницаемости и инфильтрация клетками иммунной системы => содержимое в альвеолах
• Лучевой фиброз: пролиферация фибробластов, утолщение перегородок, склероз сосудов
д) Клинические аспекты изменений после лучевой терапии:
1. Лучевые повреждения легких (ЛПЛ):
• Факторы, влияющие на развитие: суммарная доза, доза на фракцию, количество рассеянного излучения, параллельное проведение химиотерапии, функциональный статус пациента перед ЛТ, его возраст и наличие заболеваний легких
• Острый лучевой пневмонит: 5-40% пациентов, перенесших лучевую терапию:
о Симптомы могут отсутствовать или выявляются кашель, субфебрилитет, одышка
о Лечение: кортикостероидные препараты ± поддерживающая искусственная вентиляция легких
• Лучевой фиброз: симптомы отсутствуют либо выявляется хроническая одышка
2. Организующаяся пневмония:
• Реакции гиперчувствительности или другие иммунные реакции => опосредованное повреждение легких вне зоны облучения
• Развивается в течение 12 месяцев после ЛТ
• Лечение: кортикостероидные препараты ± поддерживающая искусственная вентиляция легких
3. Вторая первичная злокачественная опухоль:
• Показатель заболеваемости среди пациентов, перенесших химиолучевую терапию по поводу местнораспространенного рака легкого, составляет 2,4/100 пациентолет
• Наиболее частая локализация: легкие, пищевод, желудок
4. Постлучевая саркома:
• Встречается редко; предполагаемая инцидентность составляет 0,03-0,08%
• Чаще всего возникает у пациентов молодого возраста, перенесших лучевую терапию (ЛТ) по поводу рака молочных желез или лимфомы Ходжкина, реже-рака легких
• Развивается через несколько лет после лучевой терапии (ЛТ)
• Остеосаркома, недифференцированная плеоморфная саркома
• Лечение: резекция ± химиотерапия
5. Заболевания сердца:
• Чаще всего возникает у пациентов молодого возраста, перенесших ЛТ по поводу рака молочных желез или лимфомы
• ЛТ => повреждение интимы => повреждение эндотелия => активация миофибробластов и тромбоцитов
• В последнее время риск развития снизился; сердце не включают в зону облучения или используют небольшие ежедневные дозы на фракцию
• Величина дозы облучения пропорциональна риску развития инфаркта миокарда, реваскуляризации коронарных артерий и летального исхода вследствие ишемической болезни сердца
• Острый, отсроченный (до двух лет после ЛТ) и хронический перикардиты:
о Симптомы отсутствуют или выявляется лихорадка, боли в груди, тахикардия
о Лечение: в случае необходимости выполняется дренирование перикардиальной полости или перикардэктомия
• Порок клапанов (> 10 лет после ЛТ): чаще всего обнаруживают симптомы стеноза аортального клапана
6. Эзофагит:
• Встречается часто; 2-4 недели после ЛТ
• Дисфагия, одинофагия
• Лечение: использование анестетиков и прокинетиков
7. Свищ между дыхательными путями и пищеводом:
• Встречается редко: зарегистрированы единичные случаи
• Возникает вследствие аспирации и пневмонии
• Лечение: установка стента в дыхательные пути или пищевод, хирургическая обработка свищевого хода
д) Диагностические пункты. Ключевые моменты при интерпретации изображений:
• При возникновении в легких нового уплотнения после ЛТ следует заподозрить ЛПЛ; картина должна соответствовать временным рамкам и зоне облучения
• Новое уплотнение в легких, увеличение размеров ранее выявленного уплотнения, формирование его выпуклого контура, а также обнаружение узелков или объемных образований свидетельствуют в пользу рецидивирования опухоли
е) Список литературы:
1. Viswanathan C et al: Pitfalls in oncologic imaging: complications of chemotherapy and radiotherapy in the chest. Semin Roentgenol. 50(3):183—91, 2015
- Вернуться в оглавление раздела "Лучевая медицина"
Редактор: Искандер Милевски. Дата публикации: 22.2.2019
СПОСОБ ЛЕЧЕНИЯ ЛУЧЕВЫХ М1БРОЗОВ И ПОЗДНИХ ЛУЧЕВЫХ ЯЗВ КОЖИ путем введения лекарствеиных средств, отличающийся тем, что, с целью сокращения сроков лечения, лекарственные средства вводят эд ектрофорезом , сначала раствор диметнлсульфоксида в течение 15-20 дней, за тем гепарина в течение 7-10 химопсина в течение 5-10 дней.
4 А ()9) (! l) (51)4 А 61 Н 1/30
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР
flO ДЕЛАМ ИЗОБРЕТЕНИЙ И ОТКРЫТИЙ
Н ABTOPCHOMY.ÑÎÈÄÅÒÅËÜÑTÂÓ (21) 2820776/28-13:. (22) 20.09.79 (46) 30,12.87. Бюл. Fp 48 (71) Научно-исследовательский инсти тут медицинской радиологии (72) М.С.Бардычев, Л.И.Гусева и О.С.Дунаева ,(53) 615.475(088.8) (54) (57) СПОСОБ ЛЕЧЕНИЯ ЛУЧЕВЫХ ФИБРОЗОВ И ПОЗДНИХ ЛУЧЕВЫХ ЯЗВ КОЖИ пу- тем введения лекарственных срепств, . отличающийся тем, что, с целью сокращения сроков лечения, лекарственные средства вводят айектрофорезом, сначала раствор диметилсульфоксида в течение 15-20 дней, saтем гепарина в течение 7-10. дней и химопсина в течение 5-10 дней.
Изобретение относится к области медицины, а именно к медицинской радиологии, и может быть использовано в онкологии.
Известен способ лечения лучевых
5, фиброзов и поздних язв кожи путем введения лекарственных средств.
Однако известный способ длителен (67 5 дней).
Целью изобретения является сокращение сроков лечения.
Цель достигается тем, что способ лечения лучевых фиброзов и поздних. лучевых .язв кожи осуществляют путем введения лекарственных средств электрофорезом, сначала раствора диме.гилсульфоксида в течение 15-20 дней, а затем гепарина в течение 7-10 дней и .химопсина в течение 5-10 дней.
Способ осуществляют следующим образом.
Лечение начинают с местного применения растворов диметилсульфоксида (ДМСО) электрофоретическим методом.
Для этой цели используют аппарат
"АГН-33". Десятипроцентный водный раствор ДИСО вводят с катодной прокладки при плотности тока 0 05э
0,1 мА/см в течение 20 мин ежедневно, на курс лечения 10-15 процедур.
В результате лечения достигают размягчение зоны лучевого фиброэа за счет растворения отдельных коллагеновых волокон, снижение отека и воспаления тканей на всей глубине лучевого фиброза. В последующие дни на ту же зону лучевого повреждения проводят электрофорез раствором гепарина (5000-12000 ед. на одну процедуру в зависимости от площади лучевого по- 40 вреждения), всего 8-10 процедур. Этот компонент лечения позволяет активно влиять на внутрисосудистые факторы в зоне повреждения и в сочетании с первым добиваться улучшения микроцирку- 45 ляции в зоне лучевого повреждения.
Заканчивают лечение проведением электрофореэа химопсина (по 20-50 мг на процедуру), всего 5-7 процедур. Третий компонент лекарственного электро- 50 фореза способствует снижению воспале- .ния.
Пример 1. Больная P., 55 лет,. поступила в институт по поводу выра- . женного фиброэа кожи левой подмышеч- ной и надключичной областей. По поводу рака левой молочной железы пронедена послеоперационная гаиматерапия с 4 полей в суммарной. дозе.5200 рад
4 2 на каждое поле. Через 6 месяцев в области полей облучения в подмышечной и надключичной областях развилось резкое уплотнение кожи, появились сильные боли в левой руке и отек конечности. Несмотря на проводимое лечение (новокаиновые блокады, лидаза, цигерол, глвкокортикоидные мази и т.п .) боли и отек нарастали, а затем развился парез левой верхней конечности. В отделении лечения лучевых повреждений было проведено лечение по предлагаемому способу. Проведено 10 сеансов электрофореза 10Х раствора ДИСО, 7 сеансов электрофореза гепарина, затем 8 сеансов электрофореза химопсина на каждое поле лучевого повреждения. В процессе лечения отек конечности стал уменьшаться, уменьшились боли в конечности. Больная выписана с размягчением фиброза и уменьшением отека руки на 1-5,2 см. Спустя 6 месяцев при контрольном обследовании отек конечности полностьв прошел, боли в руке исчезли, состояние больной хорошее.
Пример 2. Больной 3., 50 лет, поступил в институт по поводу поздней лучевой язвы брюшной полости. По поводу семиномы проведена телегамматерапия на парааортальные лимфатические коллекторы в суммарной поглощенной дозе на кожу 5800 рад. Спустя
5 месяцев на передней брюшной стенке вокруг пупка развился лучевой фиброэ кожи диаметром до 15 см, в средней части лучевого повреждения развилась лучевая язва диаметром 7 см. Несмотря на проводимое лечение размеры и глубина лучевой язвы прогрессировали.
В институте проведено лечение по предлагаемому способу (электрофорез
ДМСО У 12, гепарина N 10, химопсина М 10), Спустя 20 дней после лечения лучевая язва очистилась, отмечено размягчение зоны фиброза. В последующем зона лучевого повреждения иссечена и произведена свободная кожная пластика с полным приживлением трансплантата.
Предлагаемым способом лечилось 120 больных поздними лучевыми фиброзами кожи и подлежащих мягких тканей и 72 больных поздними лучевыми язвами кожи, Лучевой фиброэ и лучевые язвы развивалйсь в зоне полей облучения в сроки от 6 месяцев до 1-2 года после лучевой терапии преимущественно злокачественных опухолей. Применялась как
92681 водило к уменьшению индурации тканей, окружающих язвы, снижению в ннх интенсивности воспаления и более быстрому очищению раневой поверхности и оживлению грануляционной ткани, более быстрой эпителизации по сравнению с
I другими методами лечения.
: Результаты лечения поздних лучевых язв кожи и лучевых фиброзов элекгрофорезом
ДМСО (гепарин и химопсин) Способ лечеЭффективность лечения чувствительность к несколь ким антибиотикам дучевых язв; скорость полурезорбции йода-131 в зоне фиброэа продолжительность времени для полно
ro заживления лучевых язв (м -),деиь родолжиельность редопера ционной одготовки (м+) э, день колич ес тво больных у которых происходило пол ное заживление лучевых яэв, Х гоцитар ая актив сть лей цитов.л вых яэв
Предлагаемый способ лечения
45,0+9,5 21,012,0 59
40,0 18,3+1,3 5,6lf0,51
67+5,0 .46,0+5,5 52 з дистанционная рентгенотерапия (56 больных), так и телегамматерапия (136). Суммарная поглощенная доза в зоне лучевого повреждения составляла 4000-6000 рад. Ввиду преимущест5 венной локализации лучевого фиброза в зоне прохождения магистральных кровеносных и лимфатических сосудов и нервных стволов, такие больные, как правило, жаловались на сильные иррадиирующие боли в дистальных отделах конечностей (неврит) и нарушение крово- и лимфообращения, проявляющееся в развитии отека конечностей разной степени выраженности вплоть до слоновости. Применение у больных пред.лагаемого способа лечения вызывало размягчение индурированных тканей и снижение отечности дистальнее зоны
20 фиброза. В результате лечения улучшался отток крови и лимфы, что проявлялось в уменьшении отечности конечностей и снижении болей по ходу нервов, что приводило к нормализации сна больных. Улучшение регионарной циркуляции после курса лечения по предлагаемому способу подтверждено результатами радиоизотопного исследования. Терапевтический эффект по предлагаемому способу продолжался в по30 следукнцие 2-3 месяца.
Применение предлагаемого способа у больных поздними-лучевыми язвами приРезультаты лечения больных поздними лучевыми повреждениями по сравнению с известным способом приведены в таблице.
Предлагаемый комплекс лекарственных средств и электрофоретический способ их введения в строгой последовательности приводит к улучшению микроциркуляции в зоне лучевого повреждения, стимуляции регенеративных процессов и сокращению сроков лечения.
Как видно из таблицы, предлагаемый способ по сравнению с известным способом значительно (на 25+3,5 дня) сокращает предоперационную подготовку больных и на 7,0Х больше наблюдалось поЛного заживления лучевых язв.
Применение предлагаемого способа предоперационной подготовки улучшает результаты хирургического лечения.
Благоприятные результаты кожно-пласти-. ческой операции после предоперационной подготовки по предлагаемому способу отмечены у 98Х оперированных больных против 92Х без его применения.
Читайте также:


