Цитокины при рассеянном склерозе

Результаты магнитно-резонансной томографии здорового мозга (слева) и пациента с рассеянным склерозом (справа). Фото: Jessica Wilson/Science Photo Library
Канадские медики сообщили о результатах клинических испытаний радикального подхода к лечению рассеянного склероза стволовыми клетками, пишет New Scientist. Предлагаемый ими метод можно назвать экстремальным. Представьте, что лечение или полностью избавит вас от болезни, или убьёт.
При рассеянном склерозе собственная иммунная система человека атакует организм, нападая на защитную миелиновую оболочку нервных волокон в головном мозге, спинном мозге и зрительном нерве. Очаги болезни постепенно разрастаются. Миелин выполняет роль электрической изоляции для электропроводных нервных волокон. Повсеместное нарушение изоляции приводит к нарушениям в передаче тока по электрической цепи во всём организме. Нервная система постепенно начинает сбоить, человека поражает слепота или паралич, и в конце концов нервная система полностью выходит из строя, что означает смерть.
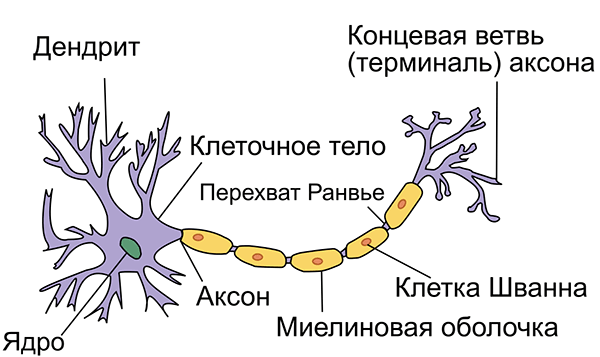
Структура нейрона. Оранжевым цветом показана миелиновая оболочка
Рассеянный склероз возникает в молодом и среднем возрасте (15-40 лет). Причины возникновения заболевания врачам до конца неизвестны, но к настоящему времени обнаружено несколько факторов, которые коррелируют с появлением рассеянного склероза.
- Расстояние от экватора (вероятно, связано со снижением выработки эндогенного и потребления экзогенного витамина D на территориях с меньшим количеством солнечного света), зона высокого риска — регионы севернее 30-й параллели на всех континентах.
- Стресс.
- Курение.
- Вакцинация против гепатита В (несмотря на результаты научного исследования, Всемирная организация здравоохранения опубликовала заявление, что анализ имеющихся сведений не подтверждает гипотезу о том, что вакцинация против гепатита B увеличивает риск развития заболевания).
- Низкий уровень мочевой кислоты.
Главной особенностью болезни является одновременное поражение нескольких различных отделов нервной системы, что приводит к появлению у больных разнообразных неврологических симптомов.
От рассеянного склероза страдает около 20 миллионов человек в мире, чаще женщины, проживающие в более северных странах, таких как Канада и Россия, северные районы США.
Существующие медикаменты могут ослабить частоту или силу атак иммунной системы на миелиновую оболочку нервных клеток, но не устраняют болезнь и не действуют на некоторых пациентов.
Радикальный подход канадских медиков предполагает лечение болезни путём полного уничтожения существующей иммунной системы и её переустановки с помощью стволовых клеток. Стволовые клетки — особый вид клеток в организме, которые способны специализироваться самостоятельно или давать потомство в виде специализированных типов клеток. В данном случае их используют для создания новой иммунной системы.
Такой метод лечения предполагает, что болезнь должна полностью исчезнуть. Иммунная система прекращает атаки на организм. Более того, как показали клинические тесты, с годами организм человека способен перестроиться и устранить повреждения, нанесённые болезнью в предыдущие годы. То есть нервная система самовосстанавливается, так что к пациенту постепенно возвращается утерянные функции.
Несмотря на рискованный подход, результаты клинических испытаний внушают оптимизм. Например, одна из принимавших участие в эксперименте пациенток Дженнифер Молсон (Jennifer Molson) из канадской провинции Онтарио решилась на экспериментальное радикальное лечение 14 лет назад, когда болезнь достигла такой стадии, что девушка находилась под круглосуточным наблюдением врачей в больнице Оттавы, передвигаясь только на ходунках, с тростью или в инвалидном кресле. Когда её отпускали на выходные, то за девушкой ухаживал её парень, и она полностью полагалась на его помощь: он резал ей еду и кормил, одевал её и купал в ванной. То есть Дженнифер уже не могла жить нормальной полноценной жизнью без посторонней помощи. К моменту максимального развития болезни девушка потеряла контроль над мочевым пузырём и кишечником.
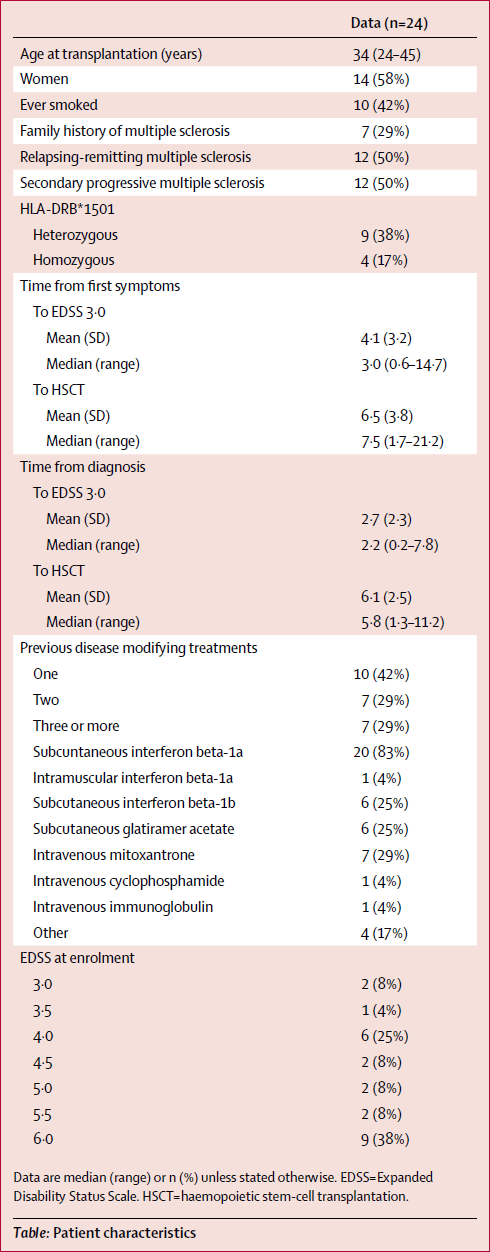
Пациенты с настолько тяжёлой формой рассеянного склероза согласятся на любое экспериментальное решение, даже очень рискованное. Поэтому Дженнифер Молсон стала одной из первых, кто принял участие в клинических испытаниях по полной переустановке иммунной системы. В 2002 году врачи начали уничтожать её иммунную систему. Она стала одним из 24 пациентов, которых отобрали для первого клинического теста этого экспериментального метода.
Интересно, что данный метод лечения рассеянного склероза был обнаружен совершенно случайно при лечении больных лейкемией, которые одновременно страдали от рассеянного склероза. Лейкемия (лейкоз) — злокачественное заболевание кроветворной системы, один из методов лечение которой предполагает извлечение клеток костного мозга с дальнейшим уничтожением иммунной системы человека при помощи интенсивной химиотерапии. Образец клеток костного мозга очищают от раковых клеток и возвращают в организм для создания новой, чистой иммунной системы. К удивлению врачей, такой метод перезапуска иммунной системы у некоторых пациентов вылечил не только лейкемию, но и рассеянный склероз.
Сегодня несколько медицинских центров в мире предлагают такое радикальное экспериментальное лечение рассеянного склероза при условии, что пациент страдает от тяжёлой формы заболевания и обычные лекарства не действуют. В случае, если у пациента болезнь средней тяжести, то врачи предлагают более мягкую форму химиотерапии, что уменьшает вероятность излечения заболевания.
Из 24 пациентов, которые приняли участие в канадском клиническом тесте, у 17 человек развитие болезни удалось остановить. Правда, переустановка иммунной системы далась им непросто: химиотерапия сопровождается потерей волос, выпадением ногтей, тошнотой, диареей, она вызывает бесплодие и раннюю менопаузу у женщин. Но самое опасное — это риск инфекции, когда у человека иммунная система полностью отсутствует в первые недели, а потом очень слаба. Именно из-за инфекции одному из пациентов пришлось пересаживать печень, и он умер из-за осложнений трансплантации.
Спустя 18 месяцев после начала лечения Дженнифер Молсон заметила первые физические улучшения, а уже через три года смогла вернуться к работе. К настоящему времени её жизнь полностью вернулась в нормальное русло, болезнь исчезла бесследно, и Дженнифер ничем не отличается от всех остальных здоровых людей. По выходным она катается на лыжах и гребёт на каяке. В будние дни Дженнифер трудится научным сотрудником в той самой больнице Оттавы, где раньше находилась в качестве неизлечимо больного пациента.
Научная работа с результатами клинических тестов в Канаде опубликована 8 июня 2016 года в журнале The Lancet (doi: 10.1016/S0140-6736(16)30169-6, pdf). Это первая в мире научная работа, которая описывает успешное лечение рассеянного склероза с долговременным положительным эффектом без использования специальных медикаментов.
В первой таблице приведены данные о 24 пациентах, которые подверглись процедуре замены иммунной системы между октябрём 2001 года и декабрём 2009 года.
Ни у одного пациента не отмечено рецидивов болезни после лечения стволовыми клетками. Всего проведено 314 процедур МРТ (отмечены штрихами на правой диаграмме), среднее время слежения за пациентами после лечения составляет 6-7 лет. Крестик означает смерть пациента, звёздочка — цензура научного исследования, когда пациент впоследствии получил дополнительное альтернативное, экспериментальное или ненадёжное лечение, так что его исключили из выборки.


Дженнифер Молсон на разных этапах восстановления после лечения
На данный момент реальная смертность при лечении составляет 1% (не 4%, как в этом клиническом тесте на 24 пациентах). Сейчас врачи хотят опробовать другой вариант химиотерапии, который с меньшей вероятностью вызовет осложнения на печень. Возможно, смертность удастся снизить. Можно попробовать и менее радикальные варианты химиотерапии, чтобы найти баланс между эффективностью и токсичностью, говорят эксперты.
Нейровоспаление – это воспаление нервной ткани, которое может быть вызвано в ответ на различные сигналы, включая инфекции, черепно-мозговую травму, токсичные метаболиты или аутоиммунные заболевания. 1) В центральной нервной системе, в том числе в головном и спинном мозге, существует микроглия – резидентные врожденные иммунные клетки, которые активируются в ответ на эти сигналы. ЦНС обычно является иммунологически привилегированным участком, поскольку периферические иммунные клетки, как правило, блокируются гематоэнцефалическим барьером (ГЭМ), специализированной структурой, состоящей из астроцитов и эндотелиальных клеток. Однако, циркулирующие периферийные иммунные клетки могут преодолеть скомпрометированный ГЭБ и столкнуться с нейронами и глиальными клетками, экспрессирующими молекулы главного комплекса гистосовместимости, закрепляя иммунный ответ. Несмотря на то, что ответ осуществляется с целью защиты центральной нервной системы от инфекционного агента, эффект может оказаться токсичным и спровоцировать широкое распространение воспаления, а также дополнительную миграцию лейкоцитов через гематоэнцефалический барьер.
Причины
Нейровоспаление – это хроническое (не острое) воспаление центральной нервной системы. 2) Острое воспаление обычно вызывается повреждением центральной нервной системы и характеризуется наличием воспалительных молекул, активацией эндотелиальных клеток, отложением тромбоцитов и отёком тканей. Хроническое воспаление представляет собой устойчивую активацию глиальных клеток и поступление других иммунных клеток в головной мозг. Это хроническое воспаление обычно ассоциируется с нейродегенеративными заболеваниями. Общие причины хронического нейровоспаления включают в себя:
Иммунный ответ центральной нервной системы
Микроглия – это врожденные иммунные клетки центральной нервной системы. Микроглия активно исследует свое окружение и значительно изменяет свою клеточную морфологию в ответ на нервную травму. 3) Острое воспаление в головном мозге, как правило, характеризуется быстрой активацией микроглии. Во время этого периода, не наблюдается никакого периферийного иммунного ответа. Со временем, однако, хроническое воспаление приводит к деградации тканей и гематоэнцефалического барьера. В это время, микроглия генерирует активные формы кислорода и высвобождает сигналы для набора периферических иммунных клеток для воспалительной реакции. Астроциты – это глиальные клетки, которые являются наиболее распространенными клетками в головном мозге. Они участвуют в обслуживании и поддержке нейронов и составляют значительную часть гематоэнцефалического барьера. После инсульта головного мозга, например, при черепно-мозговой травме, астроциты могут активироваться в ответ на сигналы, выпускаемыми поврежденными нейронами или активированой микроглией. После активации, астроциты могут высвобождать различные факторы роста и проходить морфологические трансформации. Например, после травмы, астроциты формируют глиальный рубец, состоящий из протеогликанового матрикса, что затрудняет регенерацию аксонов.
Цитокины представляют собой класс белков, которые регулируют воспаление, клеточную сигнализацию, а также различные клеточные процессы, такие как рост и выживаемость. 4) Хемокины являются подмножеством цитокинов, которые регулируют клеточную миграцию, например, привлечение иммунных клеток на место инфекции или травмы. Различные типы клеток в головном мозге могут производить цитокины и хемокины, такие как микроглия, астроциты, клетки эндотелия и другие глиальные клетки. Физиологически, хемокины и цитокины функционируют в качестве нейромодуляторов, которые регулируют процессы воспаления и развития. В здоровом мозге, клетки секретируют цитокины, производя местную воспалительную среду для набора микроглии и очищения от инфекции или травмы. Тем не менее, при нейровоспалении, клетки могут осуществлять пролонгированное высвобождение цитокинов и хемокинов, что может поставить под угрозу гематоэнцефалический барьер. Периферийные иммунные клетки призываются на участки повреждения посредством этих цитокинов и могут мигрировать через скомпрометированный гематоэнцефалический барьер в головной мозг. Общие цитокины, производимые в ответ на повреждение мозга, включают в себя интерлейкин-6 (IL-6), производимый при астроглиозе и интерлейкин-1 бета (IL-1) и фактор некроза опухоли альфа (TNF-альфа), который может индуцировать цитотоксичность нейронов. Хотя провоспалительные цитокины могут привести к гибели клеток и вторичному повреждению тканей, они необходимы для восстановления поврежденной ткани. Например, TNF-α вызывает нейротоксичность на ранних стадиях нейровоспаления, но способствует росту ткани на более поздних стадиях воспаления.
Периферийный иммунный ответ
Гематоэнцефалический барьер – это структура, состоящая из эндотелиальных клеток и астроцитов, которая образует барьер между мозгом и циркулирующей кровью. Физиологически, он осуществляет защиту мозга от потенциально токсичных молекул и клеток в крови. Астроциты формируют плотные соединения и, следовательно, могут регулировать прохождение веществ через гематоэнцефалический барьер и вхождение в тканевую жидкость. После травмы и длительного высвобождения воспалительных факторов, таких как хемокины, гематоэнцефалический барьер головного мозга может быть нарушен, став проницаемым для циркулирующих компонентов крови и периферических иммунных клеток. Клетки, участвующие во врожденном и адаптивном иммунном ответах, такие как макрофаги, Т-клетки и В-клетки, могут затем проникнуть в мозг. Это усиливает воспалительную среду мозга и способствует процессам хронической нейродегенерации и нейровоспаления.
Травматическое повреждение мозга
Черепно-мозговая травма – это травма головного мозга, вызванная значительным ударом по голове. После ЧМТ запускаются репаративные и дегенеративные механизмы, которые приводят к возникновению воспалительной среды. В течение нескольких минут после травмы высвобождаются про-воспалительные цитокины. Провоспалительный цитокин ИЛ-1β является одним из таких цитокинов, который усугубляет повреждение ткани, вызванное ЧМТ. ЧМТ может причинить значительный ущерб жизненно важным компонентам в мозгу, включая гематоэнцефалический барьер. ИЛ-1β вызывает фрагментацию ДНК и апоптоз, а вместе с TNF-альфа может привести к повреждению гематоэнцефалического барьера и инфильтрации лейкоцитов.
Старение
Старение часто связано с когнитивными нарушениями и увеличением риска нейродегенеративных заболеваний, таких как болезнь Альцгеймера. В стареющем мозге, при отсутствии очевидных заболеваний, наблюдается хронически повышенный уровень провоспалительных цитокинов и снижение уровня противовоспалительных цитокинов. Гомеостатический дисбаланс между противовоспалительными и провоспалительными цитокинами в процессе старения является одним из факторов, повышающих риск развития нейродегенеративных заболеваний. Кроме того, с возрастом в мозгу увеличивается количество активированной микроглии, благодаря чему увеличивается экспрессия главного комплекса гистосовместимости II (МНС II), ионизированного кальций связывающего адаптера-1 (Iba1), CD86, антигена макрофагов ED1, CD4 и общего лейкоцитарного антигена. 5) Активированная микроглия уменьшает способность нейронов проходить долгосрочное потенцирование (LTP) в гиппокампе, тем самым уменьшая способность формировать воспоминания.
Нейродегенеративные заболевания
Болезнь Альцгеймера исторически характеризуется двумя основными признаками: нейрофибриллярными клубками и амилоидными-бета бляшками. 6) Нейрофибриллярные клубки являются нерастворимыми агрегатами тау-белков, а бета-амилоидные бляшки являются внеклеточными отложениями бета-амилоидных белков. В настоящее время считается, что патология болезни Альцгеймера выходит за рамки этих двух типичных признаков, что позволяет предположить, что значительная часть нейродегенерации при болезни Альцгеймера связана с нейровоспалением. Активированная микроглия в изобилии наблюдается в мозге пациентов с БА после смерти. Считается, что в присутствии воспалительных цитокинов активированная микроглия не может фагоцитировать бета-амилоид, что может способствовать накоплению бляшек. Кроме того, при болезни Альцгеймера активируется воспалительный цитокин IL-1β, что связано со снижением синаптофизина и последующей синаптической потерей. Еще одним свидетельством того, что воспаление связано с прогрессированием заболевания при болезни Альцгеймера, является то, что лица, которые регулярно принимают нестероидные противовоспалительные препараты (НПВП), имеют меньший риск развития болезни Альцгеймера позже в жизни.
Рассеянный склероз является очень распространенным нейрогенным заболеванием. Он характеризуется демиелинизацией и нейродегенерацией, которые способствуют общим симптомам когнитивного дефицита, слабости конечностей и усталости. 8) При рассеянном склерозе, воспалительные цитокины нарушают гематоэнцефалический барьер и позволяют периферическим иммунным клеткам мигрировать в центральную нервную систему. При проникновении в ЦНС, В-клетки и плазматические клетки продуцируют антитела против миелина на нейронах, расщепляя миелин и замедляя проводимость в нейронах. Кроме того, Т-клетки могут проникать через гематоэнцефалический барьер, активируясь местными антигенпрезентирующими клетками, и атаковать миелиновую оболочку. Это также влияет на расщепление миелина и замедление проводимости. Как и при других нейродегенеративных заболеваниях, активированная микроглия производит цитокины, которые способствуют широкому распространению воспаления. Было показано, что ингибирование микроглии снижает выраженность склероза.
Роль нейровоспаления в качестве терапевтической мишени
Поскольку нейровоспаление связано с различными нейродегенеративными заболеваниями, ученые хотят определить, обратит ли снижение воспаления нейродегенерацию. Ингибирование воспалительных цитокинов, таких как IL-1, снижает потерю нейронов при нейродегенеративных заболеваниях. Современные способы лечения рассеянного склероза включают интерферон-B, глатирамер ацетат и митоксантрон, которые функционируют за счет уменьшения или ингибирования активации Т-клеток, но имеют побочный эффект в виде системного иммунитета. 9) При болезни Альцгеймера, использование нестероидных противовоспалительных препаратов снижает риск развития болезни. Современные методы лечения болезни Альцгеймера включают НПВС и глюкокортикоиды. НПВП блокируют преобразование простагландина Н2 в другие простагландины (ПГ) и тромбоксан (ТХ). Простагландины и тромбоксан действуют как медиаторы воспаления и повышают проницаемость капилляров.
Физические упражнение являются перспективным механизмом профилактики и лечения различных заболеваний, характеризующихся нейровоспаление. Аэробные упражнения широко используются для уменьшения воспаления на периферии. Доказано, что упражнения снижают пролиферацию микроглии в головном мозге, снижают экспрессию гиппокампом генов, связанных с иммунитетом, и снижают экспрессию провоспалительных цитокинов, таких как TNF-альфа.
Atara Biotherapeutics: T-клеточная терапия против вируса Эпштейна — Барр.
Человеческий разум относится к новой идее так же,
как тело относится к странному белку: он отвергает ее.
Питер Медавар, биолог, нобелевский лауреат
Новая научная истина торжествует не потому,
что ее противники признают свою неправоту,
просто ее оппоненты со временем вымирают,
а подрастающее поколение знакомо с нею с самого начала.
Макс Планк, физик, нобелевский лауреат
Суть проблемы
Прогрессирующий рассеянный склероз (PMS), как тяжелая форма этого демиелинизирующего заболевания, классифицируется на первично-прогрессирующий рассеянный склероз (PPMS) и вторично-прогрессирующий рассеянный склероз (SPMS). Первый справедлив при непрестанном ухудшении течения заболевания к моменту постановки его диагноза (15% случаев). Второй начинается как рецидивирующе-ремиттирующий рассеянный склероз (RRMS), который в конечном итоге превращается в SPMS у 80% пациентов.
Согласно глобальной статистике, мировая популяция пациентов с рассеянным склерозом разбивается следующим образом : на долю RRMS приходится 57% больных, тогда как PMS охватывает 43%, включая 15% пациентов с PPMS и 28% с SPMS.
Медицинская потребность в новых прорывных и, главное, высокоэффективных лекарственных препаратах для терапии прогрессирующего рассеянного склероза по-прежнему остается незакрытой. Сообщество врачей и пациентов мечтает либо об обращении инвалидизации вспять с последующим устойчивым поддержанием достигнутых успехов, либо о хотя бы стабильной остановке прогрессирования рассеянного склероза.
Гипотеза, нашедшая ответ
- У EBV-положительных иммунологически разнообразных и со здоровой иммунной системой доноров (не больных рассеянным склерозом) лейкоферезом собирают мононуклеарные клетки периферической крови (PBMC). Из них выделяют T-клетки и B-клетки, которые затем культивируют и размножают.
- B-клетки трансформируют в антигенпрезентирующие клетки (APC) путем их трансфектирования рекомбинантным аденовирусным вектором AdE1-LMPpoly, который кодирует CD8 + T-клеточные эпитопы, имеющие отношение к антигенам вируса Эпштейна — Барр — ядерному EBV-антигену 1 (EBNA1), латентному мембранному белку 1 (LMP1), латентному мембранному белку 2A (LMP2A).
- T-клетки подвергаются воздействию APC, которые экспрессируют указанные EBV-антигены. Итогом становится стимуляция и размножение EBV-специфических CD8 + T-клеток — таргетированных цитотоксических T-лимфоцитов (CTL).
- При внутривенном введении CTL пациентам с рассеянным склерозом они уничтожают персистирующие в центральной нервной системе EBV-инфицированные B-клетки, которые несут искомые EBV-антигены.
Поскольку ATA188 является HLA-совместимым только частично, создается обширная библиотека криоконсервированных ATA188-препаратов: нужный отбирается для каждого пациента сообразно соответствию хотя бы по двум HLA-аллелям, общим для ATA188 и конкретного больного.
Возможная победа над прогрессирующим рассеянным склерозом
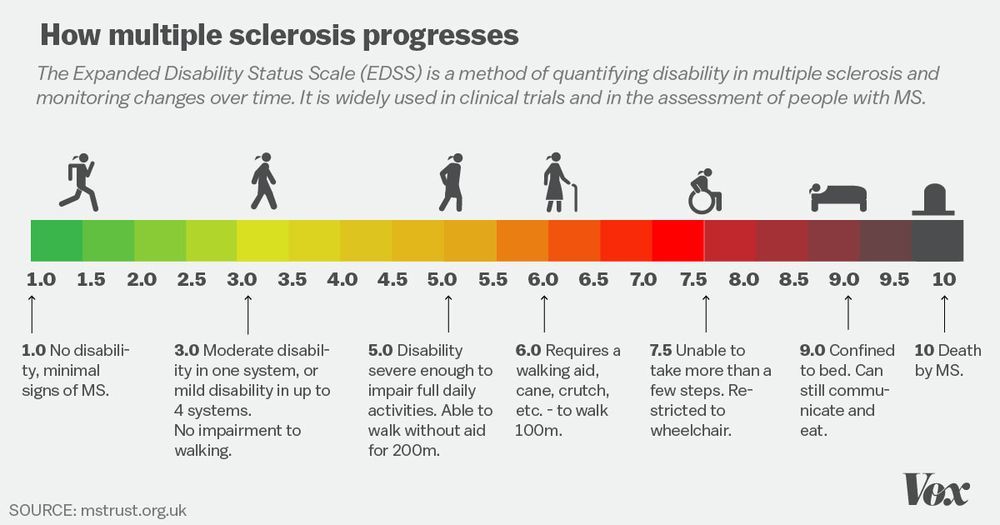
Клинические исследования NCT03283826 фазы I проверяют безопасность и эффективность ATA188, назначаемого монотерапевтически один раз в год (несколькими циклами) на протяжении пяти лет взрослым EBV-положительным пациентам (n=97) с прогрессирующими формами рассеянного склероза — первично-прогрессирующим или вторично-прогрессирующим. Испытания состоят из двух частей. Среди критериев включения: возраст 18–66 и 18–56 лет, балл по расширенной шкале степени инвалидизации (EDSS) 3,0–7,0 и 3,0–6,5 — соответственно для первой и второй частей.
В еще не начатой второй части исследований (рандомизированных, двойных слепых, плацебо-контролируемых) будут определены изменения конечных точек: EDSS, тест на время прохождения 25 футов (T25-FW), тест с девятью отверстиями и стержнями (9-HPT), МРТ-объемы шейного отдела спинного мозга и всего головного мозга, число очагов поражения головного мозга на T1-взвешенных МРТ-изображениях с контрастированием гадолинием и число новых или увеличивающихся очагов на T2-взвешенных МРТ-изображениях.
Заявлено, что с увеличением дозы ATA188 ответ на лечение углублялся. Так, по одному пациенту в когортах 1 и 2 и два пациента в когорте 3 показали SDI за период 6 месяцев, который сохранялся и по истечении 12 месяцев. Два участника в когорте 4 максимальной дозы также продемонстрировали SDI за 6 месяцев, но их 12-месячные данные еще не собраны. Основной вклад в достижение SDI поступил со стороны улучшения балла EDSS.
- шкала тяжести усталости (FSS): минимальное клиническое улучшение составляло −0,7 балла;
- шкала влияния рассеянного склероза (MSIS-29) [домен физических возможностей]: −8 баллов;
- T25-FW: −20%;
- 9-HPT: −20%;
- субъективный опросник способности передвигаться (MSWS-12): −8 баллов;
- EDSS: −1 балл (при исходном EDSS 3–5 баллов) и −0,5 балла (EDSS 5,5–7,0);
- острота зрения (VA) [по шкале LogMAR]: изменение минимум на −0,1 в каждом глазу.
Подтверждено, что длительно сохраняющаяся заявленная терапевтическая эффективность ATA188 напрямую коррелирует с увеличением дозы препарата.
Профиль безопасности ATA188 характеризуется отсутствием дозолимитирующей токсичности и фатальных побочных реакций. Все отрицательные явления, связанные с терапией, носили легко-умеренную степень выраженности. И хотя один пациент столкнулся с тяжелой побочной реакцией, приведшей к выходу из клинических исследований, она проявилась на фоне продолжающихся симптомов инфекции верхних дыхательных путей и возможной стоматологической инфекции. Насморк — единственная побочная реакция, зафиксированная у более чем одного испытуемого.
ATA188 не оказал клинически значимого эффекта на выработку цитокинов, в том числе не привел к синдрому выброса цитокинов.
Более чем надежда
И хотя развитие рассеянного склероза, вероятно, подталкивается не одним причинным фактором, вирус Эпштейна — Барр является единственным известным на сегодняшний день фактором риска, в обязательном порядке необходимым для манифестации заболевания. Доказано, что 100% пациентов с рассеянным склерозом подверглись воздействию EBV. При этом EBV-инфицированные клетки, особенно B-клетки памяти, ставшие ввиду вирусного заражения бессмертными, играют, есть мнение, важнейшую роль в иммунном каскаде, ответственном за рецидивирующие и прогрессирующие формы рассеянного склероза. Успехи существующей фармакотерапии, которая истощает пул всех периферических B-клеток, лишний раз свидетельствует о ключевой позиции этих клеток в патофизиологии рассеянного склероза. Показана оправданность продолжения экспериментов с терапией рассеянного склероза при помощи ATA188 — цитотоксическими T-клетками, селективно таргетированными против EBV-инфицированных B-клеток и плазматических клеток, как циркулирующих в организме, так и персистирующих в центральной нервной системе.
Некоторые наблюдения таковы, что эффективность ATA188 в отношении улучшения статуса инвалидизации зависит, кажется, от исходного балла по шкале EDSS: чем запущеннее заболевание, тем меньше (или медленнее) проявляется целебная сила лечения. И всё же улучшение показателя EDSS даже на один балл — уже примечательно. Ведь если пациент, к примеру, изначально передвигался с тростью, то после терапии ATA188 он обрел способность самостоятельной ходьбы.
Имеющиеся лекарственные препараты способны лишь слегка придержать ухудшение прогрессирующего рассеянного склероза — им не по силам остановить или обратить заболевание вспять. Если ATA188 добьется этого в ходе строго контролируемой части 2 клинических испытаний, нас ждет эволюция в парадигме лечения прогрессирующей и других форм рассеянного склероза.
Рассеянный склероз и вирус Эпштейна — Барр
Считается, что генетические и внешние факторы вносят определенный вклад в риск развития рассеянного склероза — хронического воспалительного демиелинизирующего заболевания центральной нервной системы, вызывающего прогрессирующую инвалидизацию. За последние четыре десятка лет появилось всё больше доказательств , что вирус Эпштейна — Барр (EBV) играет существенную роль в развитии рассеянного склероза. Предположение подкреплено рядом независимых исследований, указывающих на поголовное присутствие инфекции у пациентов и наличие высоких титров сывороточных антител против EBV как в ходе клинического течения рассеянного склероза, так и до его манифестации .
Вирус Эпштейна — Барр, или вирус герпеса человека 4 типа (HHV-4), во многих отношениях является уникальным. Так, в целях колонизации организма он заражает B-лимфоциты, активирует и способствует их клональному размножению, а затем на протяжении всей жизни человека персистирует латентной инфекцией в B-клетках памяти, несущих фенотип покоящихся клеток. Вирус, переключаясь с латентной (спящей) на литическую (репликационную) форму посредством модуляции своих ядерных генов, латентных мембранных белков (LMP) 1, 2A и 2B и вирусного предраннего белка BZLF1 (ZEBRA), реактивируется в плазматических клетках и эпителиальных клетках миндалин, организуя собственную передачу другим организмам через слюну и генитальные выделения. Несмотря на то что этим ДНК-двухцепочечным гамма-герпесвирусом заражено приблизительно 95% взрослого населения планеты, число EBV-инфицированных клеток в организме удерживается под строгим иммунным контролем, в том числе EBV-специфическими цитотоксическими T-лимфоцитами CD8 + , которые уничтожают пролиферирующие и литически инфицированные клетки.
В ряде случаев иммунологический надзор над EBV ослабевает, что отражается развитием различных болезней. Известно, что вирус Эпштейна — Барр является причиной инфекционного мононуклеоза. Он ассоциирован с определенными онкологическими заболеваниями, включая лимфому Ходжкина, лимфому Беркитта, рак желудка, карциному носоглотки. Вирус Эпштейна — Барр связан с детскими расстройствами вроде синдрома Алисы в стране чудес и острой мозжечковой атаксии. Есть мнение, что он усиливает риски развития аутоиммунных патологий, в том числе дерматомиозита, системной красной волчанки, ревматоидного артрита, синдрома Шегрена.
Касательно рассеянного склероза, считается , что у восприимчивых хозяев EBV-инфекция наделяет зараженные аутореактивные B-клетки аномальной способностью к выживаемости и пролиферации. Такие латентно инфицированные клетки аккумулируются в лимфоидных структурах и органах-мишенях, затрагиваемых при этом заболевании. Если речь идет о головном мозге, это приводит к постоянному синтезу аутоантител, которые атакуют и повреждают олигодендроциты, миелин и нейроны.
Что примечательно, 78% хронических областей мозгового поражения при рассеянном склерозе и только 33,3% образцов здорового мозга содержали плазматические клетки CD138 + в паренхиме, где быть их не должно. Не исключено, EBV-инфекция ответственна за экстравазацию последних из сосудистой сети головного мозга, наделяя воспалительный процесс постоянством.
В 46% и 44% тканях соответственно был найден белок BZLF1, притом что в случае биоптатов с рассеянным склерозом он находился преимущественно в связке с областями хронического поражения головного мозга. Считается, что BZLF1 способен подавлять выработку интерлейкина 2 (IL-2) и интерлейкина 6 (IL-6). Помимо участия в B-клеточном созревании IL-6 важен для нейро- и генеза олигодендроглии в нормальных условиях и после повреждения.
Кроме того, в 85% образцах головного мозга пациентов с рассеянным склерозом отмечалось куда более выраженное присутствие иммунных клеток с EBV-кодируемыми малыми РНК-1 (EBER1), нежели в биоптатах здоровых лиц.
Дополнительные свидетельства
Так, ассоциированный с рассеянным склерозом ретровирус (MSRV), относящийся к патогенному W-семейству эндогенных вирусов человека (pHERV-W), может трансактивироваться внешними факторами, например вирусом герпеса человека 6-го типа (HHV-6) или вирусом Эпштейна — Барр. Итогом становится генерация патогенного оболочечного белка MSRV-Env, который, сверхактивируя эндогенный толл-подобный рецептор 4 (TLR4), запускает провоспалительный каскад и подавление ремиелинизации.
Темелимаб (GNbAC1) — рекомбинантное гуманизированное моноклональное антитело, избирательно таргетированное на внеклеточный домен MSRV-Env в целях его нейтрализации.
Читайте также:


