Субпопуляции лимфоцитов клеточный иммунитет расшифровка рассеянный склероз
Данные о субпопуляциях лимфоцитов в крови и ликворе больных РС достаточно противоречивы.
Нарушение иммунорегуляции при РС проявляется также при исследовании неспецифической супрессорной активности. Получены данные о снижении супрессорной активности клеток, стимулированных Кон-А при обострении РС с возвращением до контрольных показателей при выходе из обострения (Balashov K.E., Weiner H.L., 1994; Balashov K.E. et al., 1995).
Недостаточность супрессорных систем проявляется и в снижении способности Т-клеток больных РС контролировать продукцию Ig всех классов В-клетками in vitro, особенно при активном РС (Oger J. et al., 1986). Повышение продукции иммуноглобулинов клеточными структурами больных РС можно расценивать как проявление активации В-клеток in vivo; последствиями такой активации могут быть олигоклональные Ig и наличие свободных легких цепей Ig в ликворе больных (Тотолян Н.А. и др., 1991; Тотолян Н.А., 1993). Выявление олигоклональных групп IgG в ликворе не является специфичным для РС тестом. Эти IgG могут быть выявлены у больных с различными воспалительными заболеваниями мозга, неврологическими проявлениями СПИДа и другими заболеваниями. В то же время, около 5% больных с клинически достоверным РС могут не иметь олигоклональные группы IgG в ликворе (Zemen A. et al, 1996), а специфичность олигоклональных Ig может меняться по мере развития заболевания. Повышенное содержание легких цепей Ig каппа-типа имеют от 80 до 95% больных РС. В диагностически сложных ситуациях при нарушенной проницаемости гемато-энцефалического барьера более информативен расчет индекса легких цепей. Этот тест позволяет подтвердить диагноз РС в 95% случаев, а на стадии ранних клинических проявлений (1-3 месяца) -–в 85% случаев (Sindick C., Laterre E.,1991; Тотолян Н.А., 1998).
В лаборатории нейроиммунологии Института мозга человека РАН проводится подробное изучение иммунологического статуса у пациентов с ремиттирующей формой рассеянного склероза в разные периоды течения заболевания (И.Д.Столяров и др., 1998). Мы придерживаемся следующего определения периодов заболевания (Е.И.Гусев и др., 1997):
? обострение – появление нового симптома или группы симптомов или отчетливое ухудшение уже имевшихся симптомов после того, как неврологическое состояние больного было стабильным или улучшалось на протяжении не менее месяца;
? ремиссия – отчетливое улучшение состояния больного в виде уменьшения выраженности или исчезновения симптома и/или симптомов, которое должно длиться не менее 24 часов (при длительности ремиссии более 1 месяца она может определяться как стойкая);
? стабилизация – отсутствие обострений, ремиссий или хронического прогрессирования на протяжении по крайней мере 1 месяца.
В период обострения заболевания обнаруживается незначительное снижение зрелых Т-лимфоцитов (CD3+), преимущественно за счет субпопуляции супрессорных/цитотоксических клеток (CD8+) (таблица 11), а также повышение пролиферативной и функциональной активности клеток в ответ на митогены.
В период ремиссии при нормализации количества CD3+ лимфоцитов значительно повышается уровень CD8+ субпопуляции лимфоцитов по сравнению с показателями в контрольной группе. Следствием дисбаланса регуляторных субпопуляций является снижение иммунорегуляторного индекса (отношение CD4+ к CD8+), свидетельствующее о нарушении дифференцировки иммуноцитов. При исследовании функциональных показателей обнаружено угнетение ответа лимфоцитов на митоген лаконоса (PW) на 42% и снижение спонтанного включения 3Н+-тимидина на 57% в сравнении с соответствующими показателями у доноров. Угнетение пролиферативного ответа сопровождалось повышением супрессорной активности лимфоцитов: спонтанная супрессорная активность составила 312% от нормы, Кон-А-индуцированная – 243% от нормы. Фагоцитарная активность нейтрофилов в НСТ-тесте имела следующие особенности: наблюдалось снижение резервного коэффициента на 40% по сравнению с донорами, в основном за счет повышения уровня базального НСТ, который составил 321% от нормы. Обнаружена дисиммуноглобулинемия: содержание IgA было снижено до 43%, IgM повышено до 172% от нормы. Отмечено снижение цитотоксической активности ЕК.
Субпопуляция CD22+ лимфоцитов, отражающая состояние гуморального иммунитета, претерпевала незначительные изменения, не выходя за границы нормальных значений во все периоды заболевания.
Реконституция иммунной системы завершается в период стабилизации заболевания, когда все показатели приобретают нормальные значения, достоверно не отличающиеся от значений в контрольных группах. Это касается и уровня сенсибилизации лимфоцитов к мозгоспецифическим антигенам (основному белку миелина – ОБМ, антигену нейрональных мембран, галактоцереброзидам-С 1 типа, белку S-100) в реакции торможения адгезии лейкоцитов (РТАЛ) (см. таблицу 2). В периоды обострения и ремиссии сохраняется гиперчувствительность лимфоидных клеток к этим антигенам, особенно выраженная к ОБМ, а в период стабилизации происходит нормализация данных показателей.
Уровень субпопуляций Т- и В-лимфоцитов у больных РС в разные периоды заболевания

Примечание: * - достоверное различие при сравнении результатов пациентов с РС и доноров при р ? 0,01.
Сенсибилизация лимфоцитов к нейроспецифическим антигенам у больных РС в разные периоды заболевания

Примечания: 1) Индекс адгезии выражается в условных единицах.
2) *- достоверное различие при сравнении результатов пациентов с РС и доноров при р ? 0,01.
Предполагается, что характер сенсибилизации зависит от наличия и распространенности демиелинизирующего процесса. Выраженная сенсибилизация к белку S-100, вероятно, связана с повреждением как нейронов, так и клеток глии, и свидетельствует о развертывании реакции гиперчувствительности к специфическим мозговым антигенам. Аутоиммунная реакция сопровождается разрушением оболочек аксона и глиальных клеток, продуцирующих миелин, что подтверждается выявлением гиперчувствительности лимфоцитов к основному белку миелина. Обнаружение гиперчувствительности к антигену нейрональных мембран фиксирует повреждение мембран нейронов, что не может быть выявлено и описано при МРТ, но сопровождается выраженными клиническими паттернами.
Сенсибилизация к галактоцереброзидному антигену регистрировалась в 60% случаев, что может свидетельствовать о высокой степени вовлечения в патологический процесс наружных мембран миелина и олигодендроцитов, на которых локализуются галактоцереброзиды. Подтверждением этому может служить обнаружение в сыворотке крови у большинства больных РС аутоантител к галактоцереброзидам.
Интерфероновый статус также претерпевает значительные изменения в различные периоды заболевания. Исследование показателей интерферонового статуса позволяет судить об иммунореактивности организма in situ. Например, повышение титров сывороточного ИФН может свидетельствовать об острой стадии заболевания, а нормализация показателей ИФН-статуса обычно совпадает с процессами выздоровления. Также обнаружена прямая связь между показателями ИФН-гамма и тяжестью заболевания и обратная связь с количеством ИФН-альфа.
В период обострения нами было обнаружено значительное повышение сывороточного интерферона, снижение альфа-интерферона и повышение (в сравнении с показателями в другие периоды заболевания) гамма-интерферона. В дальнейшем, при относительной ригидности напряженности уровня сывороточного интерферона определялось значительное уменьшение степени индукции гамма-интерферона (таблица 13).
Показатели интерферонового статуса у больных РС в разные периоды заболевания

Примечание: * - достоверное различие при сравнении результатов пациентов с РС и доноров при р ? 0,01.
Проанализировав результаты нейроиммунологического тестирования, мы выделили несколько основных показателей иммунного статуса, на которые рекомендуем ориентироваться при назначении пациентам иммунокорригирующих препаратов:
• содержание супрессорных/цитотоксических лимфоцитов,
• значение соотношения CD4 +/ CD8 +,
• уровень чувствительности иммуноцитов к основному белку миелина,
• уровень продукции интерферона-гамма.
Подчеркнем, что изменение показателей клеточного и гуморального иммунитета указывает на необходимость иммунологического мониторинга и иммунотерапии и в стадии ремиссии и стабилизации заболевания.
В последнее время в литературе обсуждается значение нарушения соотношения Т-хелперов первого (Тх1) и второго типов (Тх2), и нарушения баланса про- и противовоспалительных цитокинов в патогенезе рассеянного склероза. Большое внимание уделяется повышению активности Тх1-лимфоцитов и моноцитов и продукции иммунокомпетентными клетками провоспалительных цитокинов ИЛ-1, ИЛ-6, ИЛ-12, ФНО-альфа и ИФН-гамма. Nicoletti F., Patti F., Coeuzza C. et al. (1996) считают важным в патогенезе РС повышение активности Тх1-лимфоцитов и выработки ими таких провоспалительных цитокинов, как ИЛ-2, ФНО-альфа, ИФН-гамма, ИЛ-12. По мнению этих же авторов, ИЛ-12-индуцированный Тх1-обусловленный иммунный ответ вызывает демиелинизацию и повреждение олигодендроцитов.
В патогенезе РС важное место занимает нарушение цитокиновой регуляции как интратекальных, так и периферических механизмов иммунного ответа. В частности, в образцах мозга больных РС обнаружены отсутствующие в норме или при других неврологических заболеваниях невоспалительного характера клеточно-ассоциированные формы ФНО-альфа и ИЛ-1 (Hofman F.M., Hanwehr R.I., Dinarello C.A. et al.,1986; Hofman F.M., Hinton D.R., Johnson K., Merrill J.E.,1989).
Продукция ИЛ-1 была зарегистрирована в большинстве очагов и в гистологически неизмененной паренхиме мозга больных РС, но наиболее активная продукция этого цитокина отмечена именно в активных очагах (Canella B., Raine C.S., 1995). Гистохимические исследования показали, что в мозге больных РС ИЛ-1 появляется преимущественно на макрофагах в центре очагов и на микроглии (Brosnan C.F. et al., 1995).
При РС не выявляется отчетливого повышения содержания ИЛ-1 в сыворотке и ликворе, но наблюдается повышение спонтанной и митогенстимулированной продукции ИЛ-1 клетками крови и ликвора, чаще при активном течении заболевания (Imamura K. et al., 1993; Maimone D. et al., 1993; Matsuda M. et al., 1991; Оганезов В.К. и др.,1992).
В большинстве исследований отмечено повышение содержание ИЛ-6 в ликворе больных РС (Araga S. et al., 1991; Maimore D. et al., 1991; 1993). Культуры клеток крови больных РС вырабатывают повышенное количество этого цитокина (Imamura K. et al., 1993; Maimone D. et al., 1993; Navikas V. et al., 1996). Продукция этого цитокина клетками больных РС еще больше повышалась после стимуляции клеток антигенами мозга, что не наблюдалось при использовании клеток от больных с другими неврологическими заболеваниями (Navikas V. Et al., 1996). Механизмы участия ИЛ-6 в патогенезе РС могут быть связаны с характерной для этого заболевания признаками поликлональной активации В-системы иммунитета. ИЛ-6 влияет на дифференцировку нейронов, усиливает продукцию фактора роста нервов и ремиелинизацию (Satoh T. et al., 1988).
При активном РС происходит повышение продукции ИЛ-6 и ИЛ-1 (Оганезов В.К., 1992), что является признаком активации моноцитов и может приводить к повышению продукции патогенных антител. В то же время, активация гуморального иммунитета под влиянием ИЛ-6 может сопровождаться подавлением активности клеточных реакций, что при РС является благоприятным эффектом. Так как ИЛ-6 может снижать продукцию ИЛ-1 и ФНО-альфа (Schindler et al., 1990), повышать продукцию ингибиторов ИЛ-1 (Tilg H. Et al., 1994) и стимулировать регенерацию (Satoh T. еt al., 1988), то повышение его продукции может иметь противовоспалительный и компенсаторный характер.
Как уже отмечалось, ФНО-альфа является цитотоксичным для олигодендроцитов и может оказывать непосредственное повреждающее действие на миелин (Warren J.S., 1990).
Продукция ФНО-альфа в ткани мозга характерна для РС и достигает максимума в хронических очагах с реактивацией процесса по краям. Макрофаги в центре очагов и микроглия в гистологически неизмененной паренхиме также способны вырабатывать ФНО-альфа (Brosnan C.F. et al., 1995). Исследования продукции ФНО-альфа культурами клеток крови выявили более высокие уровни продукции у больных РС по сравнению с контролями (Beck J. Et al., 1988; Merill J.E. et al., 1989; Imamura K. et al., 1993). Было установлено достоверное повышение продукции ФНО-альфа у больных РС в активную стадию ремиттирующего или первично-прогрессирующего течения заболевания по сравнению с контрольными показателями или данными при стабилизации заболевания (Chofflon M. et al., 1992, Rieckman F. Et al., 1994). Клоны клеток из ликвора больных РС также продуцируют повышенное количество ФНО-альфа (Benvenuto R. Et al., 1994). Гусев Е.И., Пинегин Б.В. и др. (1991) предложили считать повышение продукции ФНО-альфа предвестником активизации иммунопатологического процесса при РС. Максимальное повышение продукции этого цитокина наблюдается за 5-14 дней до клинического обострения заболевания, снижаясь в подострую стадию. Это было подтверждено последующими исследованиями, показавшими, что повышение продукции ФНО-альфа клетками крови больных РС может быть одним из наиболее точных маркеров активации патологического процесса при РС (Rieckmann P. Et al., 1994; Navikas V. et al., 1996).
В лаборатории нейроиммунологии Института мозга человека РАН были исследованы уровни спонтанной и митоген-индуцированной продукции ИЛ-1бета, ИЛ-6 и ФНО-альфа (иммуноферментный анализ, тест-системы “Immunotech”, Франция). Группу сравнения (контрольную) составили больные другими невоспалительными неврологическими заболеваниями.
В группе больных с обострением РС было выявлено повышение спонтанной и индуцированной продукции ИЛ-1бета, которая составила соответственно 238 и 232%; ИЛ-6 – до 331 и 207%, а также повышение уровня продукции ФНО-альфа: спонтанной до 518, и индуцированной - до 396% от соответствующих показателей в группе сравнения.
В стадию ремиссии обнаружено снижение спонтанной продукции ИЛ-1? до 72% от показателей в группе сравнения. Уровень стимулированной продукции составил 150%. Наблюдалось незначительное повышение спонтанной и индуцированной продукции ИЛ-6 – до 140 и 130% соответственно от уровня в контрольной группе. Как и в период обострения, отмечалось усиление спонтанной и стимулированной продукции ФНО-?, который составил 280 и 390% от соответствующих показателей в группе сравнения.
Результаты исследования свидетельствуют, что показатели спонтанной продукции цитокинов имеют более выраженные различия в зависимости от стадии заболевания, в отличие от соответствующих показателей при ответе на индуктор, что особенно проявляется при сопоставлении уровней ИЛ-1? и ИЛ-6, и, в меньшей степени, ФНО-?. Эти данные подтверждают наличие аномалий в цитокиновой сети при рассеянном склерозе, свидетельствующие об усилении продукции провоспалительных цитокинов, особенно в период обострения заболевания. Исследование цитокинового профиля позволяет уточнить стадию патологического процесса и оптимизировать коррекцию иммунологических нарушений.
Исследование включает в себя определение абсолютных и относительных значений субпопуляционного состава лимфоцитов (CD3, CD4, CD8, CD19, CD56). Рекомендуется к назначению для контроля показателей клеточного звена иммунной системы в динамике после комплексного иммунологического обследования.
Иммунофенотипирование, клеточный иммунитет, многоцветный клеточный анализ методом проточной цитометрии, субпопуляции лимфоцитов.
Human Immune System, Immunophenotyping, Multicolor Flow Cytometry Cell Analysis, Human Leukocyte Differentiation Antigens.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Детям в возрасте от 1 до 5 лет не принимать пищу в течение 2-3 часов до исследования.
- Не принимать пищу в течение 12 часов до исследования, можно пить чистую негазированную воду.
- Полностью исключить (по согласованию с врачом) прием лекарственных препаратов в течение 24 часов перед исследованием.
- Исключить физическое и эмоциональное перенапряжение в течение 24 часов до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Оценка клеточного состава (иммунофенотипирование) лимфоцитов крови человека - основной компонент в оценке иммунного статуса - выполняется методом проточной цитофлуориметрии.
Иммунофенотипирование - характеристика клеток при помощи моноклональных антител или каких-либо других зондов, позволяющих судить об их типе и функциональном состоянии по наличию того или иного набора клеточных маркеров.
Иммунофенотипирование лейкоцитов заключается в обнаружении на их поверхности маркеров дифференциации, или CD антигенов. Лейкоциты экспрессируют ряд поверхностных и цитоплазматических антигенов, уникальных для своей субпопуляции и стадии развития. CD антигены (англ. cluster of differentiation antigens) - это антигены на поверхности клеток, маркеры, отличающие одни типы клеток от других. Дифференциации этих антигенов изучены и стандартизованы, им присвоены определенные номера. CD могут быть распознаны с помощью соответствующих моноклональных антител. Используя флюоресцентно-меченые моноклональные антитела, связывающиеся с определенными CD, можно с помощью метода проточной цитометрии произвести подсчёт содержания лимфоцитов, относящихся к различным по функции или стадии развития субпопуляциям.
В основе проточной цитофлуориметрии лежит проведение фотометрических и флюоресцентных измерений отдельных клеток, пересекающих одна за другой вместе с потоком жидкости луч монохроматического света, обычно света лазера.
Метод позволяет не только определить количественное соотношение основных популяций лимфоцитов:
- Т-лимфоциты (CD3 + CD19 - );
- Т-хелперы/индукторы (CD3 + CD4 + CD45 + );
- Т-цитотоксические лимфоциты (Т-ЦТЛ) (CD3 + CD8 + CD45 + );
- истинные "натуральные киллеры" (NK-клетки) (CD3 - CD56 + CD45 + );
- В-лимфоциты (CD19 + CD3 - );
- но и оценить малые клеточные популяции, а также изучить их функциональную активность:
- Т-лимфоциты, экспрессирующие маркеры NK-клеток(Т-NK-клетки) (CD3 + CD56 + CD45 + );
- NK-клетки, экспрессирующие α-цепь антигена CD8 (CD3 - СD8 + CD45 + ).
Когда назначается исследование?
Рекомендовано для комплексного обследования пациентов, входящих в группу риска по четырем основным иммунопатологическим синдромам.
С инфекционным синдромом:
- частые ОРВИ, хронические инфекции ЛОР-органов (гнойные синуситы, отиты, периодически встречающиеся лимфадениты, пневмонии с тенденцией к рецидивированию, бронхоплевропневмонии);
- бактериальные инфекции кожи и подкожной клетчатки (пиодермии, фурункулез, абсцессы, флегмоны, септические гранулемы, рецидивирующий парапроктит у взрослых);
- урогенитальные инфекции;
- грибковые поражения кожи и слизистых оболочек, кандидоз, паразитарные инвазии;
- рецидивирующий герпес различной локализации;
- гастроэнтеропатия с хронической диареей неясной этиологии, дисбактериозом;
- длительный субфебрилитет, лихорадка неясной этиологии;
- генерализованные инфекции: сепсис, гнойные менингиты.
С аллергическим (атопическим) синдромом:
- атопический дерматит;
- нейродермит;
- экзема с инфекционным компонентом;
- тяжелая атопическая бронхиальная астма, поллиноз, хронический астматический бронхит.
С аутоиммунным синдромом:
- ревматоидный артрит;
- рассеянный склероз;
- диффузные заболевания соединительной ткани (системная красная волчанка, склеродермия, дерматомиозит);
- аутоиммунный тиреоидит;
- неспецифический язвенный колит.
С иммунопролиферативным синдромом:
- опухолевые процессы в иммунной системе (лимфомы, болезнь Ходжкина, острый и хронический лимфолейкоз, саркома Капоши).
Что означают результаты?
Изменения различных клеточных популяций лимфоцитов в сторону повышения или понижения развиваются при различных патологических процессах в организме, таких как инфекции, аутоиммунные и онкологические заболевания, иммунодефициты, в постоперационном периоде, при трансплантации органов.
Ниже представлена таблица с клиническими ситуациями, которые могут приводить к изменениям в субпопуляционном составе лимфоцитов.
Субпопуляция лимфоцитов
Повышение показателя
Снижение показателя
Т-цитотоксические лимфоциты (CD3 + CD8 + CD45 + )
(CD3 - CD56 + CD45 + ), (CD3 - CD16 + CD45 + )
Т-"натуральные киллеры", НК-Т
(CD3 + CD56 + CD45 + )
Не имеет диагностического значения.
В совокупности с клиническими данными, симптоматикой, другими методами лабораторных исследований вышеуказанные изменения являются диагностическим признаком возникновения этих патологических процессов в организме человека.
- Результаты данного исследования необходимо сопоставлять с клиническими данными и показателями других лабораторных анализов.
- Следует отметить, что оценка показателей в динамике существенно повышает клиническую значимость исследования.

Изменения иммунологического статуса у пациентов с рассеянным склерозом находятся в зависимости от стадии заболевания, характера его течения и проводимой терапии.
Объектом иммунологического исследования при рассеянном склерозе могут служить периферическая кровь, ликвор, слюна и другие биологические жидкости.
К настоящему времени не утратили актуальности предложенные в 1997 году Д.Хайером диагностически значимымые показатели, среди которых выделяются:
1 - повышение уровня гамма-глобулинов в спинно-мозговой жидкости (СМЖ) (у 75% больных); 2 – выявление олигоклональных иммуноглобулинов G в СМЖ (у 85-90% больных) уже на ранней стадии заболевания; 3- повышение содержания основного белка миелина в ликворе, что может служить признаком обострения процесса; об активном процессе демиелинизации могут свидетельствовать значения этого показателя более 9 нг/мл.
В диагностических критериях рассеянного склероза (2005) присутствует пункт на исследование ликвора (олигоклональные группы иммуноглобулинов G или повышенный индекс иммуноглобулинов G).
Обнаружение олигоклонального иммуноглобулина G в ликворе с помощью изоэлектрофокусирования, ассоциированного с иммунодетекцией, признано наиболее чувствительным и информативным иммунологическим методом диагностики рассеянного склероза. Принцип метода состоит в изоэлектрофокусирующем электрофорезе, распределяющем белки в геле в соответствии с их изоэлектрической точкой, в которой их заряд является нейтральным. Далее места фиксации иммуноглобулина G окрашиваются с помощью иммуноблоттинга, накопление одинаковых молекул иммуноглобулина G (со строго одинаковым зарядом) создает четкие полосы в геле.
Следует подчеркнуть, что выявление олигоклональных групп иммуноглобулина G в ликворе не является строго специфичным для рассеянного склероза тестом. Иммуноглобулины G могут быть выявлены у больных с различными воспалительными заболеваниями мозга, неврологическими проявлениями СПИДа и другими заболеваниями. В то же время около 5% больных с клинически достоверным рассеянным склерозом могут не иметь олигоклональные группы иммуноглобулинов G в ликворе, а специфичность олигоклональных иммуноглобулинов может меняться по мере развития заболевания.
При получении результатов анализа ликвора необходимо также обращать внимание на следующее: у подавляющего числа больных рассеянным склерозом общий белок ликвора составляет менее 70 мг/дл; цитоз обычно не превышает 50/мм3; 90% клеток ликвора относятся к лимфоцитам, и Т-клетки составляют почти 90% из них.
Иммунологическое исследование крови является менее значимым для диагностики.
Для оценки характера течения рассеянного склероза используются менее инвазивные и более доступные методы (материалом для исследования является периферическая кровь):
- цитофлюориметрический или иммунофлюоресцентный методы определения с помощью наборов моноклональных антител (CD3+, CD4+, CD8+, CD20+; CD25+ и др.) субпопуляций Т- и В-лимфоцитов.
- метод оценки пролиферации лимфоцитов: спонтанной и под действием Т- и В-клеточных митогенов (ФГА, Кон-А, PWМ) и ОБМ - реакция бласттрансформации лимфоцитов;
- метод определения активности супрессорных лимфоцитов: спонтанной и Кон-А индуцированной;
- метод определения чувствительности к нейроспецифическим антигенам иммунокомпетентных клеток - основному белку миелина, белку S-100, антигену нейрональных мембран, галактоцереброзидам и др. - реакция торможения адгезии лейкоцитов;
- метод определения кислородзависимой бактерицидности фагоцитирующих клеток периферической крови в тесте восстановления нитросинего тетразолия (НСТ-тест);
- метод радиальной иммунодиффузии в геле для определения количества иммуноглобулинов классов A, G, M.
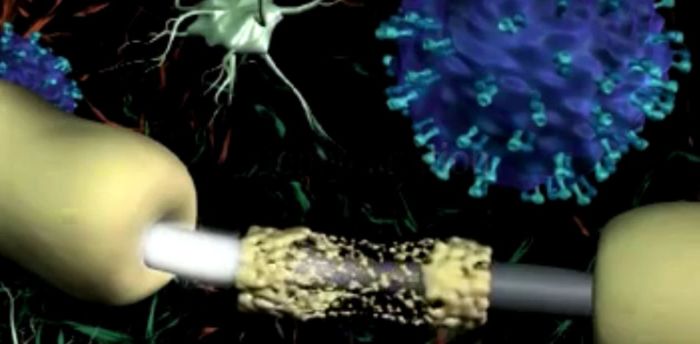
Иммунные клетки (синим цветом) разрушают миелиновую оболочку нервных волокон (бежевым цветом)
В мозге лимфатических сосудов нет, хотя там есть их аналог – сосуды так называемой глимфатической системы, которая с помощью механизма конвекции также транспортирует из тканей в кровь избыток воды и белковых молекул, в том числе и тех, накопление которых связывают с развитием нейродегенеративных заболеваний.
Несколько лет назад ученые из Университета Виргинии (США) обнаружили лимфатические сосуды в особых венозных синусах, расположенных между листками твердой мозговой оболочки. Оказалось, что эти сосуды, связанные с сосудами глимфатической системы, выполняют не только обычные для всей лимфатической системы функции, но и играют важную роль в развитии инфекционных и воспалительных патологий мозга. Включая и рассеянный склероз, аутоиммунное заболевание, при котором клетки иммунной системы начинают разрушать оболочку длинных отростков нейронов, по которым проходит нервный импульс.
По сравнению с другими лимфатическими сосудами организма, лимфатические сосуды мозговых оболочек довольно малы. Однако их размер достаточен, чтобы при воспалении по ним могли передвигаться иммунные клетки. Ученые доказали это на лабораторных мышах, у которых с помощью спровоцированного сильного воспалительного процесса в мозге был вызван экспериментальный рассеянный склероз.
Исследователи предположили, что разрушение лимфатических сосудов оболочек мозга мышей сможет подавить развитие болезни, и блокировали эти лимфатические сосуды разными способами, включая хирургические. В результате количество Т-лимфоцитов – клеток иммунной системы, участвующих в развитии патологии, в тканях мозга уменьшилось, как и тяжесть самого заболевания, хотя полного излечения добиться не удалось.
![]()
Любопытно как отбирают мышей для опытов. РС нельзя принудительно заразить.
Так написанно же - вызвали сильный воспалительный процесс в мозге, а после него и РС появился
вопрос автору поста и тем кто знает: А есть лекарства которые поддерживают ГЭБ в нормальном состоянии как можно дольше? просто пенсию в России уже отменили а ЖИТЬ овощем в РФ как то ваще нереально.
Пенсию инвалидности не отменяли, рассеянный склероз это кажется 2 группа инвалидности. К тому же пока что государство бесплатно выдаёт какие-то препараты.
паркерусы. по 2 паутины и хорошие шутки в день.
это щас занимаются, а еще лет 10 назад вообще не представляли что с ним делать, лечили всем даже пчелиным ядом
Сам более 3х лет на копаксоне.
ГЭБ - это очень тонкая и малоизученная структура и я бы с большой осторожностью отнёсся к препарату, обещающему селективность и осязаемый положительный эффект именно по отношению к ней. Есть нейропротекторы, антиоксиданты, нейрометаболиты и т.д., но их эффективность в профилактических целях, в большинстве случаев, сомнительна. ИМХО лучшее что можно придумать это регулярные занятия спортом в комбинациях с дыхательной гимнастикой и отказ от вредных привычек. Я - врач-офтальмолог :)
можно вас попросить чуть больше информации на тему как сохранить остроту зрения в старости?
Регулярно наблюдаться у офтальмолога, вести здоровый образ жизни, не запускать терапевтическую патологию (ГБ, диабет, заболевания вен нижних конечностей особенно), соблюдать режим работы за компьютером (рекомендую 40-45 мин работаете, 20-15 отдыхаете на свежем воздухе), подобрать и регулярно обновлять (1 раз в 3-4 года) пресбиопические очки. Ещё есть гимнастика для глаз (отдых на свежем воздухе расслабляет глаза лучше) - можете сами найти в интернете, чем проще, тем лучше. И витамин А с продуктами питания.
У мозга есть лимфатическая система ? Не-не, я не спорю, просто удивлен, поскольку авторитетные люди когда-то сообщили мне что у мозга она отсутствует.
Это свежее открытие.
the brain has adapted to use a unique paravascular route in which fluids may freely exchange between the brain ISF and the cerebrospinal fluid (CSF) along glial “lymphatic” (glymphatic) routes without crossing the tightly regulated endothelial cell (EC) layer (Iliff et al., 2012; Xie et al., 2013)
Спасибо за ответ. С трудом продрался через термины английского медицинского. Я не имею мед образования, я инженер-разработчик.
Но если я правильно понял, то речь идет о функциональном аналоге, но не о лимфатической системе, как таковой. Что в принципе логично, иначе ГЭБ это нечто типа роскомнадзора.
Авторитетные люди часто говорят всякую фигню :)
Нашли аналог лимфатической системы, но не лимфатическую. Лимфатическая система завязана на селезенку, а та что в мозгу на спинной мозг. Это аналог ЛС
Рассеянный склероз: как не надо делать.
Всем добрый день. После моего прошлого поста прошло уже достаточно времени, которого оказалось достаточно, чтобы поставить нормальный диагноз и начать получать терапию. В связи с этим захотелось написать свою историю, чтобы молодёжь задумалась о своём здоровье и отношении к жизни.
У меня как и у всех была бурная трудовая деятельность, включающая стрессы, недосып и неправильное питание. Только в моём случае ещё добавились частые перелёты и смена климата. Все мы хотим всего и сразу. Горят дедлайны на работе- долой сон, потом отдохнём. Коллеги и босс творят чудеса- давай начнём стрессовать. Так нельзя, это точно.
Пока врачи не знают точного механизма появления возникновения болезни, но сходятся в том, что на нас влияет целый комплекс причин. Сюда включается экология, питание, стрессы и наследственность. По последнему не скажу ничего, так как в СССР особо не диагностировали РС. Возможно кто-то из моей родни и имел данную болячку. Врач-невролог сказала, что адекватная терапия появилась только лет 20 так назад и до этого никто особо не занимался больными.
Стоит отметить, что катализатором может стать банальное пищевое отравление (как в моем случае), обычная простуда, сильные переживания и т.п. Сперва это похоже и на невралгию и на усталость и на всё подряд. Даже не задумываешься, кажется, что само пройдёт. Если у вас тремор не проходит порядка 2-3 дней или кружится голова, то это повод пойти на МРТ. Не у всех это проявляется парализацией части тела или включением зрения на один глаз.
В моем случае на фоне обезвоживания врачи ставили разные диагнозы, но нашли причину недомогания только после МРТ. До этого меня заставляли пойти домой и успокоиться. Китайские врачи (я именно там жила последний год) вообще чудеса проявляли. Поводом для обследования они посчитали только мое предобморочное состояние, когда меня трясло на полу в больнице и я тихонько начала "отъезжать". У них плохо с постановкой диагноза, а по лечению они впереди планеты всей. Это точно, врачи подтверждают. На фоне всего этого стресса я перестала есть и спала только со снотворным. Не делайте так. Это как дать приглашение болезни располагаться с комфортом в твоей голове и не стесняться грызть нервы. Лучше успокоиться и не нервничать. Хотя в такой ситуции включается паника, слёзы и мысль "умираю. ". После психолог сказал, что это нормально. Попробуй такое прими такое сразу. Жизнь делится на " до" и "после". Ничего не поделать, так устроены мы.
А теперь о позитивном:) Как бы не хаяли нашу медицину, но она у нас очень даже хорошая. Особенно если платная и знать хороших врачей. Да, меня пару раз назвали никчемным инвалидом, но да и пусть. Сами такие. В основном все поддерживают и обещают нормальную жизнь. Долго думает Минздрав при включении в программу "7 нозологий", пару раз теряли мои документы в поликлинике, но это пустяки. Все лекарства теперь со мной.
Немного об уколах. Побочные явления есть у всех препаратов. У меня это проявилось в виде зуда, синяков и покраснений в местах введения инъекции. Ещё временами тошнит и заходится сердце, но это редко. В дополнение к основной терапии назначают иногда и лекарства для поддержания вегетативной системы. Для тех, кто нервный псих(как я) и сам себя накручивает. Таблетки чудо как хороши. Это был месяц, когда я улыбалась 24/7 и любила весь мир.
Теперь о жизни после диагноза. Все симптомы прошли, абсолютно все. Может, только устаю чуть быстрее. Я вернулась в спорт, нашла работу, каждый день вижу семью и друзей. К тому же пришёл некий пофигизм и все проблемы теперь рассматриваю как временное явление и не зацикливаюсь. Если бы пришло такое отношение к жизни раньше, то и не было бы проблем.
Надеюсь, что моя писанина заставит хоть кого-то задуматься и расставить приоритеты. Здоровье важнее. Информация верна на 200 %. А для тех, кто только столкнулся с РС это наглядный пример, что жизнь не заканчивается. Также можно строить планы, работать, заводить семьи и т.д. Только перед этим теперь нужно чуть больше подумать и просчитать вероятные проблемы. Врач-невролог приводит примеры из своей практики. У них есть пациенты в возрасте 70+, которые передвигаются самостоятельно. Если соблюдать рекомендации и слушать докторов, то инвалидизация к вам не придёт. Единствеенное "но" есть для девочек. Гинекологи очень осторожно говорят о беремености, но не запрещают её. Лучше остановиться на одном ребёнке и не искушать судьбу. Во время беременности ваша имунная система перестроиться и терапия будет не нужна, однако после родов риск обострений возрастает в несколько раз. Нужно продумать, кто будет сидеть с ребенком, если вы на время попадете в больницу. Про грудное кормление говорят разное, но в основном предлагают отказаться от него в пользу лечения. И как само собой разумеющееся : беременность нужно планировать. Желательно заранее отказаться от уколов.
Получилась целая простыня текста, но очень надеюсь, что полезного. Всем хорошего дня!
Читайте также:


