Эндоваскулярное лечение артериовенозных мальформаций спинного мозга
Аннотация научной статьи по клинической медицине, автор научной работы — Пятикоп В. А., Котляревский Ю. А., Сергиенко Ю. Г., Пшеничный А. А., Вороненко К. Ю.
Похожие темы научных работ по клинической медицине , автор научной работы — Пятикоп В. А., Котляревский Ю. А., Сергиенко Ю. Г., Пшеничный А. А., Вороненко К. Ю.
ENDOVASCULAR THREATMENT OF ARTERIOVENOUS MALFORMATIONS OF CEREBRAL VESSELS
The experience of the neurosurgical clinic of Kharkov Regional Clinical Hospital for endovascular surgery arteriovenous malformations with the use of modern technologies and materials, taking into account angioarchitectonics, sizes and locations. Noted the dependence of the results of surgical treatment of AVMs of the applied adhesive composites and technical support operations. The use of endovascular treatment of arteriovenous malformations is effective for fistula type AVM, as a palliative method in large and giant AVM size, AVM when located in functionally important regions of the brain, as manifested intracranial hemorrhage.
ЭНДОВАСКУЛЯРНОЕ ЛЕЧЕНИЕ АРТЕРИОВЕНОЗНЫХ МАЛЬФОРМАЦИЙ СОСУДОВ ГОЛОВНОГО МОЗГА
В.А. ПЯТИКОП ', Ю.А. КОТЛЯРЕВСКИЙ 2,
Ю.Г. СЕРГИЕНКО А.А. ПШЕНИЧНЫЙ 2,
Ключевые слова: ангиография, артериовенозные мальформации, эмболизация, эндоваскулярное лечение.
Артериовенозные мальформации (АВМ) — это вид соустий между системой внутренней сонной артерии и венами головного мозга. Поскольку соустья в данном случае образуются между мелкими артериями и венами, симптомы АВМ мало выражены и их часто не диагностируют. Размеры сосудистых мальформаций ЦНС бывают разными. Крупные мальформации могут вызывать головную боль, сдавливать головной мозг, приводить к эпилептическим припадкам или кровоизлияниям. Наиболее частая разновидность сосудистых мальфор-
Пятикоп Владимир Александрович д. мед. н., профессор ХНМУ, зав.кафедры нейрохирургии 61001, Харьков, ул. Лебединская, 3, кв. 130 тел.: +38 (050) 303-50-92 e-mail: pyatikop@inbox.ru
маций ЦНС — артериовенозные. Они представляют собой переплетение извитых измененных тонкостенных сосудов, соединяющих между собой артерии и вены [1, 4, 5].
АВМ относятся к врожденным порокам развития сосудов и состоят из трех компонентов: приводящих артерий (афферентов АВМ), клубка измененных сосудов (ядра), дренирующих вен (эфферентов АВМ) [3]. АВМ чаще всего проявляется эпилептическими припадками или геморрагическим инсультом. Благодаря современным методам нейровизуализации все чаще удается диагностировать АВМ до развития кровоизлияния [2, 4]. Основным методом диагностики АВМ является селективная церебральная ангиография — инвазивный метод, использование которого необходимо при планировании эндоваскулярного или от-
крытого вмешательства, а также радиохирургического лечения [5].
Эволюция АВМ сопряжена с изменением риска кровоизлияния. Риск кровоизлияния из бессимптомной мальформации составляет менее 1% в год [1, 2, 6], риск рецидива — 6-33% в течение ближайшего года после кровоизлияния, в последующие годы происходит его постепенное снижение; мальформа-ции, впервые проявившиеся негеморрагическими симптомами, имеют риск кровоизлияния — 2-3% в год [1, 6]. Попытки установить связь между анатомо-функциональными характеристиками АВМ и риском кровоизлияния дали противоречивые результаты. Причины изменения риска кровоизлияния остаются непонятными [8].
Современная медицина располагает несколькими методами лечения АВМ головного мозга: хирургическим, эндоваскулярным и радиохирургическим. Оценка соотношения угрозы здоровью и жизни при естественном течении мальформации и опасности осложнений, которые могут возникнуть при проведении лечебных мероприятий, является необходимым условием успешного лечения. Реализация такого подхода требует понимания закономерностей не только естественного течения, но и течения заболевания во время и после лечебного воздействия [3, 7].
С развитием современных технологий наименее травматичным методом лечения АВМ головного мозга является эндоваскуляр-ная эмболизация. Цель эмболизации — максимальное устранение патологического арте-риовенозного сброса с минимальной ишеми-зацией неизмененных тканей. Это возможно только при селективной катетеризации и дистальной эмболизации артерий с патологическим сбросом. Окклюзия крупных афферентов спиралями эффективна только как дополнение к дистальной эмболизации, а изолированное их использование малоэффективно и ведет к рецидиву артериовенозного сброса [4, 6, 8]. Преимуществами эмболизации являются: возможность приостановить или замедлить прогрессирование заболевания; возможность дистальной окклюзии АВМ и, как следствие, меньшая частота рецидивов; минимальная травматизация и кровопотеря по сравнению с открытыми вмешательствами.
Цель исследования — оценка результатов эндоваскулярного лечения АВМ в зависимости от ее размеров, локализации, особенностей кровоснабжения и используемых тром-бирующих агентов.
Материалы и методы
Прооперировано 48 АВМ, в том числе АВМ поверхностных полушарий большого мозга — 20 (42%), глубоких полушарий большого мозга — 17 (35%), области задней черепной ямки — 11 (23%).
По характеру кровоснабжения распределение АВМ было следующим: из двух и более бассейнов — 22 (46%), поверхностными ветвями внутренней сонной артерии — 15 (31%), ветвями вертебробазиляр-ного бассейна — 11 (23%).
По характеру венозного оттока преобладал отток в единичную расширенную вену (магистральный тип), в остальных случаях отток осуществлялся по множественным венам (рассыпной тип).
В зависимости от морфометрических характеристик АВМ распределились следующим образом: малого объема — 12 (25%), среднего — 20 (42%), большого — 14 (29%), гигантского — 2 (4%).
По классификации Spetzler-Martin размер АВМ был следующим: I градация — 5 (10%), II градация — 9 (19%), III градация — 15 (31%), IV градация — 12 (25%),
V градация — 7 (15%).
Результаты и обсуждение
В наших наблюдениях результаты эндо-васкулярного лечения АВМ зависели от морфометрических характеристик мальформа-ции, характера ее кровоснабжения, а также от технического обеспечения и вида эмбо-лизирующих агентов, используемых при операции.
Больных условно распределили на две группы: в первую группу включили 20 (42%) больных с АВМ, оперированных с помощью эмбосфер и микрочастиц РУА с использованием микрокатетеров диаметром от 1ДР до 1,6^ во вторую — 28 (58%) пациентов, оперированных с использованием гистоакрила
и потоконаправляющих микрокатетеров Magic BALT.
Наилучшие результаты после эмболизации АВМ наблюдали у больных второй группы. В 10 (21%) случаях достигнуто частичное выключение АВМ из кровотока, в 14 (29%) — суб-тотальное и в 4 (8%) — тотальное выключение АВМ. Тотального выключения АВМ из кровотока добились у 4 (8%) больных с I и II градациями по классификации Spetzler-Martin, субтотального — у 8 (17%) с II, у 5 (10%) и у 1 (2%) с IV градацией, частичного выключения у 1 (2%) с III, у 7 (14,5%) с IV, у
2 (4,5%) больных с V градацией.
В первой группе в 12 (25%) случаях достигнуто частичное выключение АВМ из кровотока, в 8 (17%) — субтотальное. Тотального выключения АВМ в этой группе достигнуть не удалось. Субтотального выключения АВМ из кровотока добились у 5 (10,5%) больных со II градацией по классификации Spetzler-Martin, у 3 (6%) — с III градацией, частичного выключения — у 4 (8,5%) больных с III градацией, у 6 (12,5%) с IV градацией, у 2 (4,5%) с
1. Васильев С.А., Зуев А.А. Разрыв внутричерепных артериовенозных мальформаций: патогенез, клиника, лечение // Неврол. журн. - 2008. - Т. 12, № 5. -С. 47-51.
2. Дзяк Л.А., Зорин Н.А., Голик В.А. и др. Артериальные аневризмы и артериовенозные мальформа-ции головного мозга. - Днепропетровск: Пороги, 2003. - 137 с.
3. Страхов А.А., Шершевер А.С., Киселева Е.В. Особенности строения артериовенозных мальформаций, осложненных симптоматической эпилепсией // Поленовские чтения: Материалы юбилейной Все-рос. конф. - СПб, 2006. - С. 156-157.
4. Яковлев С.Б. Артериовенозные фистулы головы и шеи. Клиника, ангиоархитектоника, эндовас-
При кровоснабжении АВМ единственной питающей артерии тотальная эмболизация достигнута в 60% случаев, субтотальная — в 40% случаев. При наличии двух и более питающих артерий радикальность эмболизации АВМ оказалась существенно ниже: тотальная эмболизация достигнута лишь в 15% случаев, субтотальная — в 50% случаев и частичная — в 35% случаев.
1. Применение гистоакрила и потоконаправляющих микрокатетеров в эндоваскуляр-ном лечении АВМ является наиболее предпочтительным.
2. Эндоваскулярная эмболизация показана: при АВМ фистульного типа; в качестве паллиативного метода при АВМ больших и гигантских размеров, проявившихся фар-макорезистентными эпилептическими приступами; при АВМ, расположенных в функционально значимых зонах головного мозга, проявившихся интракраниальным кровоизлиянием.
кулярное лечение: Дис. . д-ра мед. наук. - М., 2009. - С. 20-38
5. Яковлев С.Б., Бочаров А.В. Эндоваскулярное лечение артериовенозных мальформаций головного мозга // IV съезд нейрохирургов России: Тез. докл. - М., 2006. - С. 312.
6. Hartmann A., Mast H., Mohr J. et al. Determinants of staged endovascular and surgical treatment outcome of brain arteriovenous malformation // Stroke. - 2005. -Vol. 36. - P. 2431-2435.
7. Jankowitz B.T., Vora N., Jovin T., Horowitz M. Treatment of pediatric intracranial vascular malformations using Onyx-18 // J. Neurosurg. Pediatrics. - 2008. -Vol. 2. - P. 171-176.
8. Khaw A.V, МоЫ- J.P. Association of infratentorial brain arteriovenous malformations with hemorrhage at initial presentation // Stroke. - 2004. - N 35. - P. 660-663.
ЕНДОВАСКУЛЯРНЕ ЛІКУВАННЯ АРТЕРІОВЕНОЗНИХ МАЛЬФОРМАЦІЙ СУДИН ГОЛОВНОГО МОЗКУ
ВО. П’ЯТИКОП, Ю.А. КОТЛЯРЕВСЬКИЙ, Ю.Г СЕРГІЄНКО, А.О. ПШЕНИЧНИЙ,
Ключові слова: ангіографія, артеріовенозні мальформації, емболізація, ендоваскулярне лікування.
ENDOVASCULAR THREATMENT OF ARTERIOVENOUS MALFORMATIONS OF CEREBRAL VESSELS
VA. PYATYKOP, YU.A. KOTLYAREVSKIY, YU.G. SERGIENKO, A.A. PSHENICHNYY,
The experience of the neurosurgical clinic of Kharkov Regional Clinical Hospital for endovascu-lar surgery arteriovenous malformations with the use of modern technologies and materials, taking into account angioarchitectonics, sizes and locations. Noted the dependence of the results of surgical treatment of AVMs of the applied adhesive composites and technical support operations. The use of endovascular treatment of arteriovenous malformations is effective for fistula type AVM, as a palliative method in large and giant AVM size, AVM when located in functionally important regions of the brain, as manifested intracranial hemorrhage.
Key words: angiography, arteriovenous malformations, embolization, endovascular treatment.
Сосудистые пороки развития редко встречаются в спинном мозге и часто неправильно диагностируются. К ним относятся врожденные каверномы, артериовенозные мальформации (АВМ), приобретенные артериовенозные фистулы твердой мозговой оболочки. АВМ включают перимедуллярные фистулы, гломерулярные АВМ и ювенильные АВМ.
Интрадуральные артерио-венозные мальформации (АВМ) кровоснабжаются спинальными артериями, в то время как дуральные мальформации кровоснабжаются менингеальными артериями, являющими ветвями корешковых артерий. 80% всех АВМ спинного мозга представляют собой дуральные фистулы с частотой возникновения 5-10 на миллион населения в год. АВМ твердой мозговой оболочки проявляются во взрослом возрасте, в то время как спинномозговые АВМ поражают молодых людей.
Клиническая картина представлена прогрессирующей миелопатией и/или радикулопатией с приступами внезапного или флуктуирующего ухудшения вплоть до поперечного поражения. Субарахноидальное кровоизлияние редко встречается при перимедуллярных фистулах и часто при ангиомах.
Клиническая симптоматика отражает поражение нижних двигательных нейронов, нарушение сфинктеров, поперечные чувствительные поражения и частично симптомы поражения верхних двигательных нейронов. Мышечные боли и боли в пояснице были зарегистрированы у 30% пациентов с артериовенозными фистулами твердой мозговой оболочки. В большинстве случаев имеет место различная степень нарушения чувствительности.
Частое несоответствие локализации дуральной фистулы клиническим симптомам поражения спинномозгового уровня также подтверждает теорию о неадекватном венозном оттоке. 50% пациентов, не получающих лечения, становятся инвалидами в течение трех лет.
Симптомы:
- Грудная сенсомоторная миелопатия.
- Спастический парапарез.
- Нарушения функции тазовых органов.
- Спинальные атаксии.
- Боль в спине и корешковые боли.

Схематическое изображение различных типов артерио-венозной мальформации (АВМ).
Левая артерио-венозная фистула ТМО, средняя перимедуллярная фистула, правая артерио-венозная мальформация (АВМ).
а) Артериовенозные фистулы твердой мозговой оболочки спинного мозга. Артериовенозные фистулы твердой мозговой оболочки локализуются сбоку в твердой мозговой оболочке вблизи места выхода корешка нерва. Она кровоснабжается радикуломенингеальной ветвью соответствующей сегментарной артерии. Венозный отток проходит по перимедуллярным венам вдоль поверхности спинного мозга с ретроградным заполнением, окклюзией и расширением венозного сплетения.
Также нарушается местный венозный отток из интрадурального пространства. Высокое венозное давление считается возможной причиной клинических симптомов, приводя к снижению перфузии, ишемии и отеку.
Артериовенозные фистулы твердой мозговой оболочки становятся симптоматическими в пожилом возрасте. Преобладают пациенты мужского пола. В большинстве случаев дуральный артериовенозный очаг находится в нижнем грудном или поясничном отделе. Направление преобладающего венозного оттока из самых артериовенозных фистул твердой мозговой оболочки является ростральным.
Хирургическое лечение состоит в прекращении интрадурального венозного оттока. Кроме того, возможно эндоваскулярное лечение жидкими эмболами.
- Кровоснабжение: менингеальные, корешковые, экстрадуральные артерии
- Локализация фистулы: сбоку в твердой мозговой оболочке вблизи точки проникновения корешка нерва
- Венозный отток: перимедуллярно, нарушение местного венозного оттока
Патофизиология. Наиболее важным патогенетическим фактором артериовенозных фистул твердой мозговой оболочки является высокое венозное давление в результате артериализации вен. Из-за отсутствия местного венозного оттока увеличивается венозное давление и уменьшается артерио-венозный градиент давления, что приводит к тромбозу спинальной микроциркуляции и к хронической спинальной гипоксии. В итоге развивается инфаркт с некрозом, демиелинизация и атрофия спинного мозга и нервных корешков.

б) Перимедуллярные фистулы спинного мозга. Перимедуллярные фистулы кровоснабжаются несколькими ветвями передней спинномозговой артерии. Отток идет в двух направлениях по венозному сплетению спинного мозга. Перимедуллярная фистула находится вне спинного мозга, она скрыта между корешками и покрыта утолщенной арахноидальной оболочкой. Фистула часто связана с аневризматическим расширением или венозными эктазиями.
Сброс артериальной крови в венозную систему вызывает венозный застой и обструкцию оттока, что приводит к хронической гипоксии.
Тяжелый предоперационный неврологический статус значительно улучшается после операции и остается стабильным. Первым этапом лечения является эмболизация со спиралями и/или жидким материалом. Эмболизация выполняется как можно ближе к фистуле. Вторым шагом является хирургическое лечение. Хирургический подход осуществляется сзади с помощью ламинэктомии или ламинотомии с окклюзией фистулы в нескольких местах за пределами спинного мозга.
- Кровоснабжение: передняя спинальная артерия
- Локализация фистулы: за пределами спинного мозга
- Венозный отток: в двух направлениях по венозному сплетению спинного мозга, венозные эктазии
в) Ангиомы спинного мозга. Ангиомы могут кровоснабжаться несколькими ветвями передней спинномозговой артерии. Венозный отток идет по двум направлениям в венозные сплетения спинного мозга.
Необходимо как эндоваскулярное, так и хирургическое лечение. Сначала выполняется эмболизация главного приводящего сосуда ангиомы для уменьшения притока крови, далее открытая хирургическая операция. Частичная эмболизация приводящего сосуда уже снижает риск кровотечения и приводит к улучшению неврологической симптоматики. Обычно некоторое ухудшение после операции с частичным восстановлением. После полного удаления рецидивы не возникают.
г) Визуализация. Основной проблемой лечения пациентов с артериовенозными фистулами твердой мозговой оболочки является своевременное установление точного диагноза.
• MPT-признаки артериовенозных фистул твердой мозговой оболочки включают гиперинтенсивный сигнал в грудном отделе спинного мозга на Т2-взвешенных изображениях, размытые поля мозга, расширенные перимедуллярные сосуды, отек в грудном отделе спинного мозга и усиление изображения спинного мозга и/или перимедуллярных сосудов при контрастировании гадолинием.
• Автоматическая эллиптически ориентированная упорядоченная трехмерная МР-ангиография с гадолинием подтверждает наличие артериовенозных фистул твердой мозговой оболочки, указывает на уровень фистулы.
• Ангиография показывает точное место артериовенозных фистул твердой мозговой оболочки и демонстрирует отсутствие нормального венозного возврата, подтверждая наличие венозной гипертензии. Отсутствие контрастирования при низком объеме сброса может привести к отрицательным данным при ангиографии. Выполнение миелографии больше не рекомендуется.
д) Эндоваскулярное лечение артерио-венозных мальформаций спинного мозга. Селективная эмболизация с поливиниловым спиртом (ПВС) дает высокую частоту рецидивов, но показывает лучшие результаты с прочным N-бутил-2-цианоакрилатом. Эндоваскулярная эмболизация с N-бутил-2-цианоакрилатом позволяет достичь хорошего, стабильного результата, равного открытой операции у 25% пациентов.
Основной проблемой при артериовенозных фистулах твердой мозговой оболочки является проникновение через фистулу в проксимальную часть шунтирующей вены, где должен быть размещен клей. При невозможности выполнения частота рецидивов возрастает до 40-70%.
• Окклюзия: 46%
• Заболеваемость: 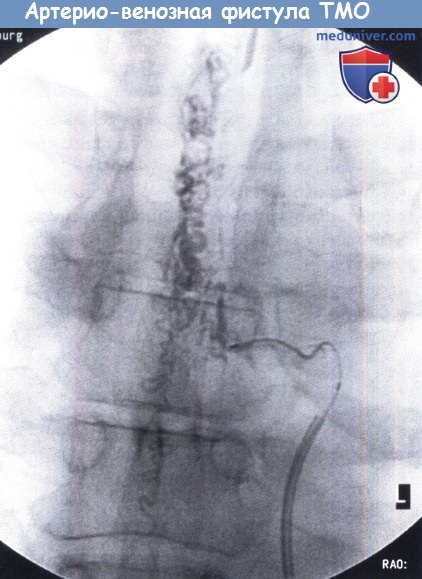
Ангиография: артерио-венозная фистулы ТМО с менингеальными питающими сосудами,
сбрасывающими кровь в расширенные корешковые вены. 
Интраоперационный вид каверномы.

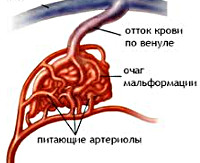
Врожденный сложный сосудистый порок развития. Образование представляет собой клубок сосудов, напрямую связывяющий артериальную и венозную системы и, таким образом, шунтирующий часть крови минуя мозговое вещество. АВМ могут проявляться внутримозговыми кровоизлияниями или эпилептическими припадками. Для решения вопроса о тактике лечения требуются точные данные о размере, типе кровоснабжения и отношении образования к различным структурам мозга.
Общие сведения
Схематическое изображение АВМ
Артерио-венозная мальформация (АВМ) — врожденный порок развития сосудов, представляющий собой конгломерат артерий и вен, лишенных промежуточного капиллярного звена. АВМ могут манифестировать кровоизлияниями, проявляющимися соответствующей симптоматикой и/или эпилептическими приступами. У большинства больных заболевание проявляется в возрасте 20–40 лет, пик кровоизлияний приходится на возраст 15–20 лет. Кровоизлияние из АВМ часто приводит к стойкой инвалидизации (до 50% случаев) и не редко летально (до 10% случаев). Риск кровоизлияния из неразорвавшейся АВМ составляет 2–4% в год, риск повторного кровоизлияния: 6-18%.
Показания и выбор метода лечения
К настоящему моменту используются три метода лечения АВМ: прямое микрохирургическое удаление, эндоваскулярная эмболизация и лучевое лечение. Показания к использованию каждого из методов в достаточной степени отработаны. В ряде случаев используется комбинация методик. Для определения возможности прямого микрохирургического иссечения мальформации используется классификация Spetzler-Martin, в которой учитывается размер АВМ, ее локализация по отношению к функционально важным зонам мозга и особенности дренирования крови.
Размер
Маленькая (
Средняя (3-6 см)
Большая (>3 см)
Локализация (по функциональной значимости)
Незначимая
Значимая
Тип венозного дренирования
Только в поверхностные вены
Так же и в глубинные вены
Принципы микрохирургического удаления АВМ
АВМ. Вид на операции
Прямые хирургические вмешательства предпочтительно проводить в холодном периоде после кровоизлияния, так как сопутствующие изменения мозга затрудняют выделение АВМ, что приводит к усугублению травмы мозга и тяжелее переносятся больным. В остром периоде паренхиматозного кровоизлияния оправдана тактика удаления больших гематом без попыток иссечения АВМ. Операция по одномоментному удалению гематомы и мальформации может быть выполнена при небольших лобарных АВМ. Следует помнить, что в условиях наличия гематомы и отека мозга, контрастирование АВМ может существенно отличаться от истинного вследствие компрессии сосудов мальформации. При глубинных АВМ, а также при АВМ больших размеров, целесообразно дождаться рассасывания гематомы. В случае вентрикулярного кровоизлияния показана установка наружного вентрикулярного дренажа. Трепанация должна быть выполнена таким образом, чтобы, помимо узла АВМ, обеспечить визуализацию афферентных артерий и основных дренажных вен мальформации на протяжении. При выделении питающих сосудов АВМ, для меньшей травматизации мозгового вещества важно использовать естественные борозды и пространства (например: широкая препаровка латеральной щели при выделении афферентов, идущих от средней мозговой артерии; межполушарные доступы для контроля афферентов, идущих от перикаллезной или задней мозговой артерий и т. п.). Выключение афферентных артерий необходимо производить на минимальном отдалении от клубка АВМ. Это связано с тем, что от питающих АВМ артерий, могут отходить ветви к мозговой паренхиме. Данное положение особенно актуально при иссечении АВМ глубинной и парастволовой локализации, когда могут пострадать ветви, кровоснабжающие функционально важные структуры. Во избежание травмы сосудов АВМ ее выделение должно осуществляться единым блоком по перифокальной зоне. У больных после кровоизлияния один из полюсов клубка АВМ может быть четко отграничен от мозга внутримозговой гематомой или постгеморрагической кистой, что упрощает хирургические манипуляции. Следует помнить, что в ряде случаев гематома может фрагментировать АВМ, в связи с чем ревизия стенок полости удаленной АВМ обязательна. Пересечение основных дренажных вен должно проводиться после полного выделения АВМ. Принцип поэтапного выключения артериального притока по мере выделения клубка, а венозного — по завершении диссекции АВМ, хорошо известен. При сокращении венозного дренирования в условиях сохраняющегося артериального притока узел АВМ становиться напряженным и кровоточивым. В определенных случаях при дисбалансе кровотока происходят самопроизвольные разрывы тонких сосудов мальформации, ведущие к интенсивному кровотечению, которое крайне сложно остановить. Единственным выходом в такой ситуации является быстрое выделение АВМ с выключением афферентов. Поскольку стенки артерий мальформации в отличие от нормальных сосудов имеют истонченный мышечный слой, коагулировать сосуды необходимо тщательно и на протяжении. К значимым интраоперационным осложнениям следует отнести воздушную эмболию.
В послеоперационном периоде ухудшение в неврологическом статусе отмечено у 30% больных при значительном регрессе выраженности симптоматики в большинстве случаев. Послеоперационная летальность составила 1,3%. Послеоперационные зрительные расстройства являются достаточно стойкими и практически не регрессируют. При речевых послеоперационных нарушениях в подавляющем большинстве случаев удается добиться значительного регресса симптоматики, а у многих больных полностью избавится от дефекта речи.
Эндоваскулярное лечение АВМ головного мозга
Основным критерием отбора больных для эндоваскулярной эмболизации является наличие доступных для суперселективной катетеризации афферентных сосудов. До недавнего времени эмболизация АВМ проводилась гистоакрилом в смеси с липиодолом. К настоящему времени эмболизация АВМ у многих больных выполнена композицией Onyx. При фистульных АВМ окклюзия приводящих сосудов выполняется с помощью микроспиралей. Объем эмболизации и количество этапов зависит от ангиоархитектоники АВМ. Тотальной эмболизации удается добиться у 30% больных. Субтотальная эмболизация АВМ выполнена у 30% больных. У 40% больных удалось добиться лишь частичной эмболизации. Стойкий неврологический дефицит после операции наблюдался в 4% случаев, летальность составила 1,3%.
Выключение мальформации вены Галена
АВМ (аневризма) вены Галена — особый вид артерио-венозных мальформаций, характерный, в основном, для детей. Патология носит врожденный характер и характеризуется формированием артерио-венозного шунта в области одного из главных венозных коллекторов — большой вены мозга. Аневризмы вены Галена составляют около 30% среди мальформаций, выявляемых в детском возрасте, и сопровождаются высокой смертностью (до 90%). Лечение заболевания осуществляется только эндоваскулярным методом. Основной задачей является прекращение или уменьшение сброса артериальной крови в венозную систему мозга, что достигается путем окклюзии афферентных сосудов трансартериальным доступом. Для окклюзии афферентов АВМ мурального типа применяются микроспирали и баллон-катетеры, при хориоидальном типе — микроспирали, клеевые композиции или их сочетание. Полного прекращения артериального притока удается достичь при муральном типе мальформации в 61 % случаев, при мальформациях хориоидального типа — 7%. Как в ближайшем, так и отдаленном периоде после эндоваскулярного лечения в подавляющем большинстве наблюдений получен положительный результат. Наиболее хорошие результаты отмечены в группе пациентов до 1 года. Стойкий неврологический дефицит развился у 5,6%, летальность составила 2,8%.
К числу редких и трудных для лечения патологий относятся АВМ спинного мозга. АВМ и дуральные артериовенозные фистулы (ДАВФ) спинного мозга встречаются с частотой до 3% в популяции, составляя около 20% от всех сосудистых мальформаций ЦНС. Эффективность эндоваскулярного лечения спинальных АВМ определяется неврологическим статусом больных после вмешательств: в нашем материале положительные результаты (значительный регресс неврологической симптоматики) были достигнуты в 91% случаев.
 |
| Иссечение АВМ после эмболизации композицией Onyx |
Лучевое лечение АВМ головного мозга
Leksell Gamma Knife
Лучевая терапия (гамма-нож, облучение протонным пучком) наиболее эффективна при маленьких компактных мальформациях диаметром не более 3 см. Так, при мальформациях менее 1 см в диаметре полной облитерации можно достичь почти в 90 % случаев, а при мальформациях диаметром более 3 см лишь — до 30%. Отрицательной стороной лучевой терапии АВМ является то, что облитерация сосудов АВМ наступает спустя 1–3 года после лечения. Как показали недавние исследования, предварительная эмболизация АВМ снижает эффективность радиохирургии. По данным НИИ нейрохирургии после стереотаксического облучения полной облитерации удается достичь в более чем 70% случаев. У 10% больных наблюдается уменьшение размеров АВМ и редукция кровотока.
Заключение
Оптимальным методом лечения АВМ следует считать мультимодальный подход с использованием комбинаций всех методов. Микрохирургическое иссечение в настоящее время остается основным радикальным методом лечения АВМ головного мозга. Благодаря дифференцированному подходу по отбору пациентов в большинстве случаев удается достичь благоприятных результатов. Эмболизация имеет существенное значение в структуре комбинированных методов лечения. Метод высокоэффективен при лечении фистульных АВМ и АВМ вены Галена мурального типа. Лучевая терапия — метод выбора при распространенных и неоперабельных АВМ, а также при частичном иссечении или неполной облитерации АВМ после ее эндоваскулярной эмболизации.
Артериовенозные мальформации спинного мозга — врождённые сосудистые образования спинальной локализации. Состоят из аномально изменённых сосудов, шунтирующих кровь из артериальной сети в венозную, минуя капилляры. Протекают латентно. Манифестируют симптомами спинального кровоизлияния, корешковыми болями, прогрессирующими двигательными нарушениями. Диагностика основана на клинических, томографических и ангиографических данных. Лечение нейрохирургическое: эндоваскулярная облитерация, открытая микрохирургическая резекция, радиохирургическое удаление.
МКБ-10
- Причины
- Патогенез
- Классификация
- Симптомы АВМ спинного мозга
- Осложнения
- Диагностика
- Лечение АВМ спинного мозга
- Прогноз и профилактика
- Цены на лечение
Общие сведения
Артериовенозные мальформации (АВМ) представляют собой участок аномальной сосудистой сети с прямым сообщением артерий и вен без связующих капилляров. Артериовенозные мальформации спинного мозга включают АВМ сосудов, расположенных внутри мозгового вещества (интрамедуллярно), в оболочках (интрадурально) и на поверхности спинного мозга (экстрамедуллярно). Спинальные сосудистые мальформации являются редкой патологией. В структуре объёмных спинномозговых образований они занимают 6-10%. Наиболее распространены экстрамедуллярные АВМ поясничного и грудного отделов. Заболевание является врождённым, проявляется чаще у лиц молодого и среднего возраста. В 40% случаев сочетается с другими пороками развития.

Причины
Сосудистые аномалии образуются в период внутриутробного развития в результате локального сбоя в формировании сосудов среднего и мелкого калибра. Наследственная связь не прослеживается. Провоцирующими дисгенез факторами выступают заболевания и интоксикации матери в период беременности, внутриутробные инфекции, гипоксия плода, неблагоприятное воздействие окружающей среды, приём беременной фармпрепаратов с побочным тератогенным эффектом. Отдельно выделяют триггеры, провоцирующие клиническую манифестацию: избыточную физическую нагрузку, подъём тяжестей, беременность, роды, травма позвоночника, посещение бани, иногда — переохлаждение.
Патогенез
Артериовенозные мальформации отличаются длительным скрытым течением. Сосудистая система в области аномалии адаптируется к работе в создавшихся условиях. Со временем возможно истончение стенок входящих в образование сосудов, возникновение аневризм (выпячиваний сосудистой стенки). Ткани спинного мозга в районе аномалии могут страдать от хронической ишемии и гипоксии в результате механизма обкрадывания, когда кровь не идёт по капиллярной сети, а сбрасывается через артериовенозные шунты. Поэтому рассматривают несколько патогенетических механизмов, обуславливающих клинику заболевания.
Провоцирующие триггеры (нагрузка, беременность, травмы) вызывают усиление метаболизма спинальных клеток, что усугубляет их гипоксию и обуславливает дисфункцию. Возникают симптомы сосудистой миелопатии. С другой стороны, под воздействием триггеров происходит увеличение кровотока, в т. ч. в АВМ. Если кровь не успевает сбрасываться из артерий в вены, возникает повышенное кровенаполнение мальформации с ростом её объёма. Увеличивающееся образование сдавливает корешки или мозговое вещество — развивается картина корешкового синдрома или миелопатии. При истончении сосудистой стенки усиление кровотока приводит к её разрыву с клиникой интрамедуллярного или субарахноидального кровоизлияния.
Классификация
Спинальные артериовенозные мальформации — группа достаточно вариабельных сосудистых аномалий. В клинической практике определяющее значение в выборе оптимального способа хирургического лечения принадлежит их морфологии и расположению. Наибольшее практическое применение нашла следующая классификация:
По строению — рассматривает морфологию АВМ, количество приводящих (афферентных) артерий и отводящих (эфферентных) вен, их взаимное положение. Позволяет разделить артериовенозные мальформации по их гемодинамическим характеристикам.
По локализации — учитывает местораспложение АВМ по отношению к спинному мозгу. Имеет значение для понимания степени инвазивности предстоящего хирургического вмешательства.
- Интрамедуллярные — расположенные в спинном мозге полностью или частично. Кровоснабжаются исключительно спинальными сосудами.
- Экстраперимедуллярные — локализуются на поверхности мозга, не проникают интрамедуллярно. Приток крови и дренирование происходит по корешковым сосудам.
- Экстраретромедуллярные — находятся на задней поверхности мозга. Афферентным сосудом выступает задняя спинномозговая артерия. Редкий вариант.
- Интрадуральные — расположены в спинномозговой (дуральной) оболочке. Приток обеспечивают радикулярные артерии, отток - спинномозговые вены.
Симптомы АВМ спинного мозга
Спинальные артериовенозные мальформации имеют продолжительный латентный период, иногда длящийся всю жизнь. У отдельных пациентов выявляться при ангиографическом обследовании по поводу другой патологии. Дебют, симптоматика, течение заболевания сильно отличаются в зависимости от реализующегося патогенетического механизма. Соответственно, выделяют апоплексический и паралитический варианты клинической картины.
Апоплексическая форма наблюдается у 15-20% больных, чаще в молодом возрасте. Обусловлена разрывом стенки одного из аномальных сосудов с излитием крови в субарахноидальное пространство или вещество спинного мозга. Характеризуется внезапным острым началом с интенсивной боли в области позвоночника, слабости в конечностях. Субарахноидальное кровотечение сопровождается гипертонусом затылочных мышц, другими менингеальными знаками. При расположении АВМ в грудном и поясничном отделе спинного мозга возникает слабость в ногах (нижний парапарез). Артериовенозные мальформации в шейном отделе проявляются слабостью всех конечностей (тетрапарез). Двигательные нарушения сочетаются с расстройством чувствительности и мышечного тонуса. Возможна дисфункция тазовых органов.
Паралитическая форма отличается постепенным развитием. Протекает с неуклонным усугублением симптоматики (прогрессирующий вариант) или с периодами улучшение/ухудшение (интермиттирующий вариант). Прогрессирующее течение наблюдается у 40% заболевших. Возможно начало с корешкового синдрома — сильной боли в позвоночнике, распространяющейся в руку, ногу или грудную клетку (в соответствии с поражённым отделом спинного мозга). Затем присоединяется мышечная слабость, чувствительные расстройства. Слабость мышц ног вызывает повышенную утомляемость при ходьбе. Со временем походка принимает спастический характер. Возникают судороги, подёргивания мышц нижних конечностей. Следующей стадией заболевания является спастическое повышение тонуса в ногах, усугубление слабости, нарушение мочеиспускания, дефекации. Симптоматика прогрессирует вплоть до полного поперечного поражения спинного мозга. Вовлечение нижнего спинномозгового утолщения проявляется снижением мышечного тонуса, выпадением рефлексов.
Осложнения
Трудности диагностики, позднее начало лечения способствуют переходу клинических проявлений из стадии обратимого неврологического дефицита в состояние стойких патологических изменений. Возникают грубые парезы и параличи, затрудняется самообслуживание, пациент утрачивает возможность ходить. При развитии выраженного тетрапареза больной постоянно находится в постели, что способствует возникновению пролежней, застойной пневмонии и др. осложнений.
Диагностика
Возможность диагностировать артериовенозные мальформации спинного мозга появилась в клинической неврологии в 60-х гг. XX века, когда в медицинскую практику начала внедрятся спинальная ангиография. До этого сосудистые мальформации выявляли при проведении миелографии как объёмные образования и достоверно диагностировали только интраоперационно. Сейчас современная диагностика спинальных АВМ включает:
- Неврологический осмотр. В ходе обследования выявляется парез, чувствительные нарушения, изменение рефлексов и тонуса. Полученные данные помогут неврологу определить примерную локализацию патологического процесса.
- Люмбальная пункция и анализ спинномозговой жидкости проводятся при апоплексическом варианте заболевания. Наличие крови в спинальной жидкости свидетельствует о кровоизлиянии.
- МРТ спинного мозга. Позволяет визуализировать артериовенозную мальформацию, диагностировать спинальное кровоизлияние, определить его объём и расположение.
- Ангиография. Может проводиться при помощи рентгенографии с введением контрастного вещества. Более информативна МРТ сосудов спинного мозга. Даёт представление о типе, месторасположении, протяжённости, гемодинамике сосудистой аномалии. Результаты спинальной МР-ангиографии помогают выбрать адекватный способ лечения, спланировать ход операции.
Дифдиагностика проводится с опухолями спинного мозга, инфекционной миелопатией, рассеянным склерозом, болезнью Штрюмпеля, БАС. Апоплексический вариант клиники АВМ спинного мозга дифференцируют с геморрагическим спинальным инсультом.
Лечение АВМ спинного мозга
Спинальные артериовенозные мальформации, не дающие клинической симптоматики, являющиеся случайной находкой и имеющие небольшие размеры, не требуют лечения, но нуждаются в регулярном наблюдении нейрохирурга. При наличии клиники необходимо хирургическое лечение. Применяются следующие методики:
Восстановительное послеоперационное лечение осуществляется реабилитологами. Обязательно проводится контрольная МРТ и ангиография. Сочетание этих исследований позволяет выявить остатки аномалии, возможно сохранившиеся после удаления, определить степень облитерации после эмболизации и радиохирургического вмешательства.
Прогноз и профилактика
Правильная диагностика и своевременно проведённое лечение позволяют предупредить кровотечение из АВМ, развитие компрессионной миелопатии, стойких двигательных расстройств. У большинства пациентов наблюдается существенное восстановление утраченных функций вплоть до полного регресса возникшего неврологического дефицита. В последующем возможен рецидив, связанный с неполным выключением порочных сосудов из кровотока. В течение нескольких лет после нейрохирургического лечения пациентам необходимо наблюдение нейрохирурга. Профилактикой возникновения АВМ служит исключение неблагоприятных влияний на плод в период беременности.
Читайте также:


