Стенозы гортани и шейного отдела трахеи в г зенгер
Группа изобретений относится к медицине, а именно к оториноларингологии, и может быть использована в хирургическом лечении пациентов с хроническим рубцовым стенозом шейного отдела трахеи или гортанно-трахеальным стенозом.
В основе рубцового стеноза гортани и трахеи лежат патологические процессы, приводящие к локальному или распространенному замещению нормальных структур рубцовой тканью с исходом в циркулярное сужение или полную атрезию просвета с развитием явлений дыхательной недостаточности, требующих хирургического лечения [1, 2, 3, 4].
Одной из основных причин рубцовых стенозов гортани и трахеи в настоящее время является длительная искусственная вентиляция легких через интубационную и трахеостомическую трубку, длительное воздействие которых может приводить к ишемическому некрозу стенки трахеи, хондроперихондриту гортани и трахеи и трахеомаляции с исходом в рубцовый стеноз [5, 6, 7, 8].
Для удаления рубцовой ткани разработаны многочисленные методики с эндоскопическим и наружным подходом через ларинготрахеофиссуру: рассечение синехий микроножницами, аппаратом ультразвуковой дезинтеграции и хирургическим лазером различных моделей, бужирование тубусом жесткого бронхоскопа [9]. В торакальной хирургии основным способом лечения рубцовых стенозов трахеи (циркулярное сужение) является одноэтапная циркулярная резекция трахеи в пределах здоровых тканей с анастомозом конец в конец. При протяженном рубцовом стенозе трахеи или распространении рубцового процесса на гортань такие операции противопоказаны [10].
Наиболее широко применяется классический этапный метод хирургического лечения хронического рубцового стеноза гортани и трахеи, заключающийся в рассечении суженого отдела наружным доступом, иссечение рубцовой ткани. Формирование нового стойкого просвета и эпителизация раневой поверхности трахеи проходит достаточно длительное время. Для поддержания просвета используются силиконовые Т-образные протезы различной конфигурации [11].
Как известно гортанная часть глотки на уровне нижнего края перстневидного хряща переходит в пищевод. В шейной его части спереди к нему прилегают перстневидный хрящ и трахея, закрывающая его почти полностью. Задняя стенка трахеи, не имеющая хрящевой ткани и состоящая из плотной волокнистой соединительной ткани, содержащей мышечные пучки, отделена от пищевода рыхлой соединительнотканной клетчаткой. Пищевод и трахея имеют общую для них фасциальную оболочку. Отсутствие анатомических ориентиров не позволяет оценить вовлеченность в рубцовый процесс стенки пищевода. Интраоперационно данное обстоятельство не позволяет максимально иссечь рубцовую ткань в области задней стенки трахеи, из-за угрозы повреждения передней стенки пищевода, что в последующем может привести к формированию трахеопищеводного свища.
Лечение стеноза гортани и трахеи чрезвычайно трудное и длительное. Алгоритм лечения развивается в двух направлениях: совершенствуются методики хирургического лечения и продолжается поиск новых факторов воздействия на ткани человека, способствующих оптимальному процессу ранозаживления. Нередко для достижения хотя бы удовлетворительного результата требуются многие месяцы, а нередко и годы.
Таким образом, поиск новых методов лечения стеноза гортани и трахеи является актуальной задачей современной реконструктивной хирургии гортани и трахеи.
Однако выход света на конце световода не дает одномоментного равномерного светового излучения для визуализации стенок полого органа на большом протяжении. По свету определяют местонахождение оперируемого органа, что обеспечивает сокращение длительности операции за счет уменьшения риска травматизации тканей и повреждений полого органа.
Достигаемым техническим результатом является обеспечение максимального иссечения рубцовой ткани гортани и трахеи в области задней ее стенки с сохранением целостности передней стенки пищевода. Это позволяет минимизировать риск повторного рестенозирования гортанно-трахеального просвета, формирования трахеопищеводных свищей и сократить сроки канюленосительства пациентов.
При этом разработанная нами методика эффективна как при рубцовом стенозе шейного отдела трахеи, так и при сочетанном гортанно-трахеальном стенозе вплоть до атрезии просвета.
Указанные результаты обеспечиваются за счет осуществления визуализации рубцового стеноза в области задней стенки подголосового отдела гортани и начального шейного отдела трахеи светодиодным зондом, установленным в просвет пищевода.
Таким образом, нами разработан способ интраоперационной визуализации зоны рубцового стеноза просвета в области задней стенки подголосового отдела гортани и начального шейного отдела трахеи с помощью созданного нами светодиодного зонда, который устанавливается в пищевод.
Светодиодный зонд (фиг.) включает:
1. Зонд из прозрачного силикона длиной 50 см , внутренним диаметром 7 мм и закрытым (запаянным) дистальным концом.
2. Силиконовый зонд длиной 60 см и диаметром 4 мм, в канале которого проходят два заизолированных медных провода.
3. 5 светоизлучающих диода, подключенных параллельно друг за другом на расстоянии 5 мм. От последнего диода отходят два заизолированных медных провода, один из которых катод ("минус"), а другой - анод ("плюс").
4. Элемент питания 4,5 В, к которому подключены медные провода, соблюдая полярность.
5. Выключатель, размыкающий электрическую цепь.
Указанные количественные значения конструктивных элементов зонда являются оптимальными, но единственно возможными. Очевидно, что в зависимости от анатомических особенностей (например, возраст пациента) данные размеры могут варьировать, не изменяя при этом достигаемый результат.
Последовательно расположенные светодиоды позволяют получить равномерное радиальное световое излучение на большом протяжении независимо от положения зонда. Данное расположение дает картину состояния задней стенки трахеи как непосредственно в области рубцовой деформации, так и ниже и выше нее, в области неизмененной ее части. Прозрачный силиконовый зонд защищает контакты светодиодов от попадания влаги и с минимальными потерями пропускает видимый свет от светодиодов.
Во время операции пациентам с рубцовым стенозом гортани и/или трахеи под наркозом через рот в просвет пищевода заводится назогастральный зонд из прозрачного силикона с запаянным дистальным концом (1). Далее в просвет зонда заводится зонд меньшего диаметра (2), на дистальном конце которого фиксированы друг за другом 5 светодиодов (3), подключенных к элементу питания 4,5 В с помощью медных проводов, проходящих в просвете зонда (4).
Под визуальным контролем светового излучения через мягкие ткани светодиоды устанавливаются на уровне рубцового стеноза гортани и/или трахеи. Непосредственно в зоне рубца по задней стенке интенсивность свечения ниже, чем в неизмененной ее части, что позволяет визуализировать его границы.
Таким образом, разработанный нами способ реализуется следующим образом.
Хирургическое лечение рубцового стеноза шейного отдела трахеи включает его визуализацию и иссечение рубцово-измененной ткани. Причем для визуализации зоны стеноза в области задней стенке трахеи используют зонд, состоящий из гибкого проводника с закрытым дистальным концом и внутренней трубки, содержащей на дистальном конце последовательно расположенные светодиоды, установленной в проводнике с возможностью продольного перемещения. Во время операции сначала через рот в просвет пищевода заводят проводник закрытым концом, а затем внутреннюю трубку. Далее, под визуальным контролем со стороны просвета трахеи, используя трансиллюминацию, располагают светодиоды на уровне стеноза и определяют зону стеноза в границах меньшей интенсивности свечения по сравнению с неизмененной тканью трахеи. Иссечение рубцово-измененных тканей в области задней стенки трахеи выполняют под контролем трансиллюминации, осуществляя визуальный контроль со стороны просвета трахеи и сохраняя расположение светодиодов в зоне стеноза до достижения интенсивности свечения в указанной зоне, равной интенсивности свечения на уровне неизмененных тканей трахеи.
Разработанный нами зонд для визуализации стеноза при выполнении хирургического лечения рубцового стеноза шейного отдела трахеи содержит: гибкий проводник в виде удлиненной трубки из прозрачного силикона с закрытым дистальным концом, внутреннюю трубку, установленную в гибком проводнике с возможностью продольного перемещения и фиксации, средства освещения в виде светодиодов, последовательно размещенных на дистальном конце внутренней трубки, и средства подключения к источнику электрического тока в виде медных проводов с электроизоляцией на наружной поверхности. Медные провода расположены во внутренней трубке и соединены с выключателем, а светодиоды соединены параллельно.
Примеры конкретного выполнения
Пациент Α., поступил с жалобами на дыхание через трахеостомическую трубку, отсутствие голоса. В анамнезе ИВЛ легких по поводу двусторонней пневмонии тяжелого течения. В отделении реанимации произведена плановая трахеостомия. После стабилизации состояния и выхода пациента на самостоятельное дыхание деканюлировать его не удалось в связи с развившимся грануляционным стенозом трахеи в области трахеостомы. Из стационара выписан с трахеостомической трубкой, с которой ходил в течение 3 месяцев.
При осмотре у пациента выявлен тубулярный рубцовый стеноз начального шейного отдела трахеи, по верхнему краю трахеостомы с просветом диаметром менее 5 мм.
Пациенту выполнена трахеопластика с установленным светодиодным зондом в просвет пищевода, благодаря которому производилось иссечение рубцово-измененной ткани в области задней стенки трахеи до равномерного светового излучения с неизмененной ее частью. В послеоперационном периоде пациент протезировался Т-образной силиконовой трубкой диметром 13 мм до момента полной эпителизации раневой поверхности и формирования стойкого просвета трахеи. Через 3 месяца протезирования при контрольном эндоскопическом контроле отмечался широкий стойкий просвет трахеи на всем протяжении, деформаций и выступов в области задней стенки не отмечалось, дыхание через естественные пути полностью восстановлено. Пациент был деканюлирован, произведена пластика трахеостомы.
Таким образом, данный способ повышает эффективность хирургического лечения, сокращает число осложнений и вероятность необходимости повторного хирургического вмешательства, сроки стационарного лечения и полной реабилитации пациентов с данной патологией.
1. Паршин В.Д., Гудовский Л.М., Русаков М.А. Лечение рубцовых стенозов трахеи // Хирургия , 2002; 3: 25-32.
2. Паршин В.Д. Хирургия рубцовых стенозов трахеи. М., 2003.
3. Тришкин Д.В. Постинтубационная болезнь трахеи (патогенез, диагностика, эндоскопическое и хирургическое лечение, профилактика) // Автореф. дис. д-ра мед. наук. Пермь, 2007.
4. Cooper J.D., Grillo H.C. The evolution of tracheal injury due to ventilatory assistance through cuffed tubes: a pathologic study // Ann Surg - 1969; 169: 334-348.
5. Зенгер В.Г., Наседкин А.Н., Паршин В.Д. Хирургия повреждений гортани и трахеи. М., 2007; 364.
6. Панферова А.В. Эндоскопические методы диагностики и лечения больных со стенозами гортани и трахеи различной этиологии: Дис. канд. мед. наук. М., 2003; 120.
7. Келехсаева А.С. Эндоскопическая диагностика постинтубационных изменений гортани трахеи и пищевода: Дис. канд. мед. наук. M., 2007; 107.
8. Bonnette Р., Colchen Α., Leroy M., Bisson A. Tracheal resectionanastomose tracheale pour stenose iatrogene. Une experience de 340 cas. Rev Mal Respir 1998; 5: 627-632.
9. Самохин А.Я. Хирургическое лечение рубцовых стенозов трахеи и бронхов: Дис. д-ра мед. наук. M., 1992; 320.
10. Цветков Э.А. Восстановительная хирургия гортани и шейного отдела трахеи при рубцовых стенозах у детей. Дис. д-ра мед. наук. M., 1990.
11. Черный С.С. Реконструктивная хирургия протяженных и мультифокальных рубцовых стенозов трахеи. Дис. д-ра мед. наук. M., 2011.
12. Патент RU №2160046 от 10.12.2000. Способ интраоперационной визуализации трубчатой структуры. Авторы: Тарасов А.Н.; Тарасов Д.А.
Трахея представляет собой трубку, которая связывает гортань с бронхами. Основной ее функцией является проведение воздуха в легкие и из легких. У взрослых трахея начинается на уровне 6-7 шейных позвонков и оканчивается на уровне тел 4-5 грудных позвонков делением на два главных бронха. Длина трахеи 10-13 см, ширина – 1,5 – 2,5 см.
Поперечный размер трахеи больше чем переднезадний. У взрослого мужчины поперечный размер составляет примерно 2,3 см, переднезадний – 1,8 см. Соответствующие размеры у женщины: 2,0 и 1,4 см. Толщина стенки 3 мм. Трахея состоит из 18-22 хрящевых колец, благодаря которым сохраняется ее просвет. Задняя часть хряща замещена соединительной тканью с эластическими и гладкими мышечными волокнами. Внутренняя слизистая оболочка трахеи состоит из многослойного реснитчатого эпителия. Наличие реснитчатого эпителия и слизистых желез способствует удалению различных примесей, попадающих с воздухом.
Различают шейную и грудную части трахеи, граница между которыми соответствует яремной вырезке грудины спереди и второму грудному позвонку сзади. В грудном отделе трахеи выделяют три части: верхнегрудную, среднегрудную и надбифуркационную. Длина шейной части трахеи примерно 5 см, что соответствует 6-8 хрящевым кольцам. При разгибании шеи длина шейной части трахеи, как и число хрящей, существенно увеличивается. Начальные кольца трахеи располагаются на глубине 1,5-2см, на уровне яремной вырезкой - на глубине 4-6 см.
Спереди и с боков начальный отдел трахеи прикрыт щитовидной железой. Ниже железы спереди трахеи располагается претрахеальное клетчаточное пространство, в котором в грудной полости находится вилочковая железа. Кзади и несколько слева от трахеи лежит пищевод. В трахеопищеводной борозде слева на передней стенке пищевода проходит левый возвратный нерв. Правый возвратный нерв проходит позади трахеи на правой боковой стенке пищевода. В средостении спереди трахеи на уровне 1 ребра проходит левая плечеголовная вена. Позади нее трахею примерно посередине пересекает плечеголовной ствол, который проходит косо слева направо, непосредственно примыкая к ее передней стенке. Справа от грудной части трахеи располагаются верхняя полая вена, непарная вена и правая плечеголовная вена. К бифуркации трахеи прилежит дуга аорты и левая общая сонная артерия. Кровоснабжение шейного отдела трахеи осуществляется преимущественно ветвями нижних щитовидных артерий, надбифуркационный отдел трахеи и главные бронхи кровоснабжаются бронхиальными артериями. Кроме того, источниками кровоснабжения трахеи являются также ветви подключичной, внутренней грудной и плечеголовной артерий. Сосуды входят в трахею по боковым стенкам несколько кпереди от трахеопищеводной борозды. Венозный отток осуществляется преимущественно через вены щитовидной железы.
История хирургии трахеи
Вмешательства на трахее известны давно. Их выполняли еще за 3500 лет до нашей эры в Древнем Египте и за 2000 лет в Индии. Старейшей и наиболее распространенной в настоящее время операцией на трахее является трахеостомия. О разрезах дыхательного горла при травме, сопровождающейся обструкцией дыхательных путей сообщалось еще за 1500 лет до нашей эры. Beatrous описал, как Александр Македонский кончиком своего меча выполнил трахеостомию солдату. Galen и Aretaeus во втором-третьем веках нашей эры также описывали эту операцию. В это время трахею именовали бурной артерией или трахеальной артерией, считая, что по ней проходит не только воздух, но и кровь. Имена хирургов, возможно выполнявших трахеостомию, не известны. До 19 века многие считали это вмешательство бесперспективным и вредным. Goodall в 1934 году провел исследование, при котором установил, что до 19 века было выполнено только 28 успешных трахеотомий. Сдерживало применение метода плохое знание анатомии и неудовлетворительные результаты. В связи с высокой смертностью до 18 века при удушье, вызванном обструкцией верхних дыхательных путей, чаще применяли кровопускание.
 |
| Рис.5. Картина Piero di Cosima в Национальной Галерее в Лондоне. |
Популяризации трахеостомии в 19 веке способствовало сообщение Trousseau о выполненной им трахеостомии при тяжелой дифтерии, позволившей спасти одного из четырех больных.
Первые резекции шейного отдела трахеи с анастомозом конец в конец выполнили на собаках Gluck и Zeller в 1881 году. Первую резекцию трахеи по поводу посттравматического стеноза шейного отдела трахеи успешно осуществил в 1886 году Kuster. В начале двадцатого века Nowakowski и Levit применяли для закрытия дефектов трахеи кожу, широкую фасцию бедра.
Циркулярная резекция трахеи наиболее долго из других вмешательств в торакальной хирургии внедрялась в практику, что было связано как с ее сложностью, так и с редкой необходимостью ее выполнения. Интерес к реконструктивным операциям на трахее возник в середине двадцатого века. Sanger во время Второй мировой войны и Griffith в 1949 году выполнили реконструктивные операции на бронхах и грудной части трахее. Одной из первых была публикация R.Belsey в 1950 году о резекции внутригрудной части трахеи. Belcher в 1950 году и Mathey в 1951 году осуществили анастомоз главных бронхов после случайного пересечения. J.Mathey в 1951 году впервые выполнил резекцию бифуркации трахеи. Увеличение в последние десятилетия числа больных с рубцовыми стенозами трахеи способствовало широкому внедрению реконструктивных операций на трахее в практику. Большое значение в становлении современной трахеальной хирургии имели работы хирургов, обладающих наибольшим опытом операций на трахее. Это работы J.Mathey, H.Eschapasse, F.G.Pearson, H.C.Grillo и в нашей стране М.И.Перельмана.
Стеноз трахеи
Стеноз трахеи может быть вызван рубцовыми изменениями стенки трахеи, сдавлением ее извне при опухолях средостения, новообразованиях щитовидной железы, аномалийными сосудами средостения и врожденной дезорганизацией тканей стенки трахеи, например при экспираторном стенозе.
Рубцовый стеноз трахеи характеризуется замещением нормальной стенки трахеи рубцовой тканью. Причиной ее появления является повреждение стенки трахеи с последующим развитием гнойно-некротического процесса обычно в месте давления манжеты интубационной трубки на стенку трахеи в процессе длительной искусственной вентиляции легких. Существенное значение в развитии стеноза имеет воспалительный процесс в области трахеостомы, давление конца трахеостомической трубки на стенку трахеи или рубцевание вследствие механического повреждения трахеи. Как правило, стеноз развивается в области трахеостомического отверстия или в области расположения манжеты трахеостомической трубки.
В крайне редких случаях причину стеноза трахеи установить не удается. Подобный стеноз носит название идиопатического. Как правило, им страдают женщины среднего возраста. Плотный келоидный рубец захватывает преимущественно адвентицию верхней трети трахеи, имеет протяженность 1-3 см.
В последние годы отмечается рост числа больных с рубцовыми стенозами трахеи. Благодаря достижением реаниматологии, длительной искусственной вентиляции легких стало возможным спасение больных, которые считались ранее безнадежными. Однако у многих из них через некоторое время развивается картина рубцового стеноза трахеи. По данным Корбера 1999г. стенозирование просвета трахеи после трахеостомии достигает 51%. Law 1993г. сообщил о 67% повреждений трахеи после трахеостомии. Морфологические изменения различны – от повреждения эпителия с образованием эрозий до трансмурального некроза стенки. Симптомы стеноза трахеи могут развиться через неделю или несколько месяцев после экстубации, но у 80% пациентов они появляются в течение первых 3 месяцев.
Профилактика – минимальная травма при трахеостомии, строгое соблюдение принципов асептики при любых манипуляциях на трахее, каждые 2 часа снижение давления в манжетке трахеостомической трубки, перемещение трубки по длине, замена трубки каждые 2 дня, антибиотикопрофилактика с учетом чувствительности микрофлоры.
Наиболее полная классификация рубцовых стенозов трахеи предложена В.Д.Паршиным. Он разделяет стенозы:
- По этиологии: постинтубационный, посттрахеостомический, посттравматический, идиопатический.
- По локализации: гортань (с поражением подскладочного отдела, голосовых складок), шейный отдел трахеи, верхнегрудной, среднегрудной, надбифуркационный отделы трахеи, комбинированные поражения.
- По степени сужения: 1 степень (просвет сужен на 1\3 диаметра дыхательного пути), 2 степень (от 1\3 до 2\3 диаметра), 3 степень (более 2\3 диаметра).
- По распространенности: ограниченный (до 2 см), протяженный (более 2 см).
- По анатомической форме поражения: переднебоковые стенки, циркулярное сужение, атрезия.
- По состоянию стенок трахеи: с трахеомаляцией, без трахеомаляции.
- По наличию трахеостомы: с трахеостомой, без трахеостомы.
Данные анамнеза и появление одышки позволяют заподозрить стеноз трахеи. Одышка носит приступообразный характер, усиливается при небольшой физической нагрузке, уменьшается после откашливания вязкой мокроты. При прогрессирования стеноза отмечается шумное, слышное на расстоянии дыхание. Основными методами подтверждения стеноза и оценки степени сужения являются бронхоскопия и компьютерная томография.
В лечении больных с рубцовыми стенозами трахеи принимают участие не только торакальные хирургии, но и отоларингологи, эндоскописты. Наибольший опыт лечения больных с данной патологией накоплен в РНЦХ им. Б.В.Петровского. Радикальным методом лечения больных с рубцовым стенозом трахеи является циркулярная резекция трахеи, однако она возможна, как правило, при ограниченных стенозах. Консервативное лечение применяют только в начальный период формирования стеноза или как паллиативное лечение при невозможности оперативного вмешательства. Оно заключается в антибиотикотерапии, аэрозольтерапии, применении стероидных и нестероидных противовоспалительных препаратов. Нормальный просвет трахеи восстанавливают с помощью ригидной бронхоскопии, удаляя избыточные грануляции или рассекая суженный участок трахеи с помощью электрокоагуляции, лазерного воздействия. Данное вмешательство можно выполнять не более 3-4 раз. Для сохранения адекватного просвета трахеи осуществляют стентирование ее на срок 4-6 месяцев. После удаления стента добиться сохранения стойкого просвета трахеи удается не более чем у трети больных. Бужирование стеноза трахеи тубусом ригидного бронхоскопа различного диаметра или дилатационным бронхоскопом применяется также при угрозе асфиксии в качестве экстренного паллиативного вмешательства.
При обширных поражениях трахеи выполнить ее резекцию не представляется возможным. В подобных случаях возможна трансплантация трахеи. В 2006 году в РНЦХ была выполнена успешная трансплантация трахеи больному с субтотальным рубцовым стенозом трахеи. Кровоснабжение трахеи осуществляется через сосуды щитовидной железы.
Трахеопищеводные свищи
Наиболее часто трахеопищеводные свищи возникают у больных раком пищевода при распаде опухоли, прорастающей в трахею. Другими причинами являются ранения пищевода и трахеи, перфорация пищевода при его бужировании по поводу рубцовых стриктур, пролежень от трахеостомической и интубационной трубок при длительной искусственной вентиляции легких.
Частота трахеопищеводных свищей не превышает 0,5% среди больных, которым проводилась длительная искусственная вентиляция легких. Как правило, трахеопищеводные свищи у этой группы больных возникают от избыточного давления манжетки интубационной трубки или давления дистального конца трахеостомической трубки на заднюю стенку трахеи при наличии в пищеводе зонда для энтерального питания, что приводит к ее ишемии, некрозу и образованию соустья между пищеводом и трахеей. Часто трахеопищеводные свищи сочетаются со стенозом трахеи, что существенно осложняет лечение таких больных. Заброс пищи в трахею приводит к гнойному трахеобронхиту с последующим развитием абсцедирующей пневмонии, что значительно ухудшает прогноз заболевания. Питание у такого рода больных через рот исключается. Адекватное питание больного обеспечивается через энтеральный зонд или гастростому. Учитывая, что консервативное лечение больных с трахеопищеводными свищами малоэффективно, единственным радикальным способом ликвидации свища неопухолевой природы является оперативное вмешательство.
Клиническая диагностика трахеопищеводных свищей, как правило, не вызывает трудностей. Проявляются они приступообразным кашлем, который возникает во время приема пищи. Однако уточнение их локализации при рентгенологическом исследовании с барием и эзофагоскопии вызывает существенные трудности, особенно при небольших размерах свища. Более информативным оказывается трахеоскопия, при которой удается определить размеры свища, расстояние от голосовых связок и карины. Кроме того, значительную помощь в выявлении трахеопищеводных свищей оказывает также компьютерная томография.
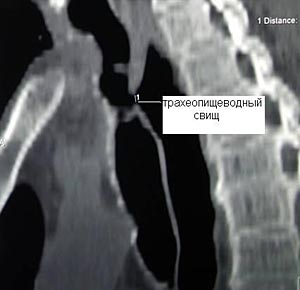 Рис.9. Компьютерная томограмма больного с трахеопищеводным свищом. | 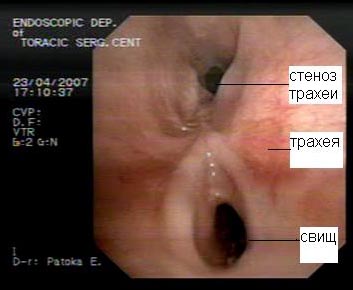 Рис. 10. Трахеоскопия больного с трахеопищеводным свищом, осложненным стенозом трахеи. |
Радикальным методом лечения трахеопищеводных свищей является разъединение пищевода и трахеи с ушиванием дефектов в них и интерпозицией мышц между ними, обычно участка грудиноключичнососцевидной мышцы.
Резекция трахеи
Радикальной операцией, позволяющей удалить стенозированный участок трахеи или опухоль, является циркулярная резекция трахеи. До недавнего времени считалось, что можно безопасно резецировать 2 см трахеи. При необходимости резекции большего участка трахеи для его замещения применяли кожу, перикард, другие ткани, а также различные протезы. Показанием к циркулярной резекции трахеи по поводу стеноза является ограниченный рубцовый стеноз. Важной задачей предоперационной подготовки является адекватное восстановление просвета дыхательного пути с целью устранения гипоксии. Для решения этой задачи выполняют бужирование трахеи жестким бронхоскопом с оставлением больного на сутки на продленной искусственной вентиляции легких через интубационную трубку.
Нецелесообразно выполнять резекцию трахеи при наличии трахеостомы. Ее необходимо предварительно ликвидировать путем эндопротезирования трахеи и ушивания дефекта за 2-3 недели до радикальной операции.
Стентирование трахеи
Различные эндоскопические методы расширения просвета трахеи широко применяются при стенозах доброкачественной и злокачественной природы. Бужирование стенозированного участка трахеи, скусывание опухоли или грануляций, лазерная резекция, фотодинамическая терапия и другие эндоскопические методы позволяют добиться быстрого, однако кратковременного восстановления просвета трахеи. Для предупреждения повторного сужения трахеи применяется ее стентирование. Этот метод является паллиативным методом лечения больных со стенозом трахеи и применяется при невозможности выполнения резекции трахеи или как этап в подготовке больного к радикальной операции. Стентирование возможно также при сужениях анастомозов после трансплантации легкого и циркулярных резекций. Наиболее часто показания для стентирования возникают при нерезектабельных злокачественных опухолях трахеи и крупных бронхов, крупных метастазах в лимфоузлы средостения, вызывающих обструкцию верхних дыхательных путей с выраженной дыхательной недостаточностью.
Обзор литературы Приобретенные гортаннотрахеальные стенозы остаются одной из сложнейших проблем детской оториноларингологии. Это связано не только с трудностью и многоэтапностью восстановления просвета дыхательных путей, но и с сочетанным с дыхательным
Приобретенные гортаннотрахеальные стенозы остаются одной из сложнейших проблем детской оториноларингологии. Это связано не только с трудностью и многоэтапностью восстановления просвета дыхательных путей, но и с сочетанным с дыхательным стенозом и длительным трахеальным канюленосительством развитием патологических изменений в других органах и системах организма. Такие изменения приводят к инвалидности и социальной неполноценности, что требует тесного взаимодействия специалистов нескольких педиатрических дисциплин, таких, как оториноларингология, анестезиология, реаниматология, хирургия, пульмонология, гастроэнтерология, генетика [5, 10, 13, 18].
При бактериологическом исследовании отделяемого из трахеи у детей, нуждающихся в восстановительном лечении по поводу рубцового стеноза гортани, отмечается полимикробная флора (до восьми типов микроорганизмов одновременно), в том числе сочетание как аэробной, так и анаэробной флоры [15]; при этом, характер микробной флоры у детей и взрослых различается. Чаще всего у детей инфицирование происходит Pseudomonas aeruginosa, Staphylococcus aureus, Acinetobacter и Haemophilus influenzae [31].
В результате повреждения дыхательных путей могут формироваться различные виды обструкции. Повреждения гортани у новорожденных и детей младшего возраста часто (до 22% случаев) протекают с явлениями хондроперихондрита, лечение которого включает в себя противовоспалительную и гормональную терапию [9]. У детей младшего возраста эндоскопическое бужирование гортани в сочетании с противовоспалительным лечением в процессе формирования рубцовой ткани при ее незрелости и остаточных воспалительных процессах на ограниченном участке может оказаться эффективным. В то же время диффузный перихондрит хрящевого каркаса гортани и сформировавшийся рубец являются противопоказаниями к проведению бужирования [11].
Наиболее тяжелое осложнение чрезгортанной интубации трахеи и трахеостомии — это развитие рубцового стеноза. Рубцы могут локализоваться в различных отделах дыхательных путей — между черпаловидными хрящами, на уровне голосовых складок, в подскладковом отделе, в шейном и грудном отделах трахеи [14, 32]. По данным Э. А. Цветкова (1996), более чем у 70% больных детей рубцовый процесс занимает подголосовой отдел гортани и гортаннотрахеальное сочленение. Согласно исследованиям А. Д. Понкратенко, Е. К. Онуфриевой (1997), среди 183 детей с рубцовым стенозом гортани рубцы локализовались в голосовом отделе у 36 больных, в подскладковом — у 118, сочетанное поражение разных отделов гортани отмечено у 29 пациентов.
Хирургическое устранение рубцового стеноза возможно двумя принципиально разными доступами — через естественные пути или с рассечением гортани и трахеи. Эндоскопические хирургические вмешательства при рубцовых стенозах всегда предпочтительнее эндоларингеальных с наружным доступом [11, 29]. Прямая микроларингоскопия и эндоларингеальная микрохирургия, особенно с использованием лазерной техники, позволяет у значительной части больных устранить рубцовый стеноз гортани и гортаннотрахеального отдела с достаточно хорошим функциональным эффектом. Лазерные операции практически бескровны, отличаются малой травматичностью и вследствие этого не сопровождаются выраженными реактивными явлениями. Другим преимуществом лазерных операций по сравнению с операцией наружным доступом является интактность хрящевого остова, что способствует более быстрому заживлению и восстановлению просвета гортани, позволяя максимально сохранить голосовую функцию [13]. Особенности процессов репарации после лазерных операций дают возможность у большинства больных, в том числе у детей младшего (до трех лет) возраста, восстанавливать просвет дыхательных путей без дополнительного применения стентов [1, 9, 13], хотя в ряде случаев их приходится использовать для поддержания воссозданного просвета [6, 48]. Лазерная хирургия рубцовых стенозов эффективна также в случаях, когда предыдущие операции с применением других методик не дали хорошего результата [37]. Катамнестические наблюдения свидетельствуют о том, что воссозданный с помощью лазерной операции просвет дыхательных путей сохраняется с ростом гортани и обеспечивает нормальную дыхательную функцию [5].
Одним из главных критериев отбора больных для эндоскопической лазерной хирургии является протяженность рубца, которая не должна превышать 1,5-2 см [1, 7, 13, 25]. Лечение оказывается малоэффективным при вовлечении в рубцовый процесс хрящевого скелета [7]. Кроме того, необходимо учитывать фазу формирования стеноза. В тех случаях, когда имеются явления хондроперихондрита, вопрос о необходимости лазерной операции целесообразно отложить до ликвидации воспалительных явлений [9]. Предпочтительнее всего проводить операцию через год и более после травматического повреждения гортани и формирования стеноза, однако положительного результата удается достичь и при лечении детей в ближайшие сроки (до двух месяцев) после травмы дыхательных путей [12]. При анализе результатов повторных операций по поводу рубцового стеноза гортани отмечается определенная связь: при неэффективном первичном хирургическом вмешательстве в 50% наблюдений результат повторной операции оказывается аналогичным. Показанием к повторной операции является хотя бы минимальный эффект от предыдущей — небольшое увеличение просвета дыхательной трубки [13, 29]. При удовлетворительном результате первичной операции повторная в 80-90% наблюдений приводит к дальнейшему улучшению [12].
Показаниями к операции по устранению рубцового стеноза гортани наружным доступом служат протяженный (более 1-3 см) рубец, потеря хрящевой опоры выше или в области трахеостомы, отсутствие эффекта от эндоскопических операций, в том числе проводимых с помощью лазера [13, 26]. В литературе имеется скудная информация об оптимальных сроках подобных операций у детей. В то же время случаи возникновения различного рода осложнений и гибели детей при случайной деканюляции или закупорке трахеотомической трубки коркой наблюдаются достаточно часто и составляют до 4,6% [49]. Ларингостомия и длительное формирование просвета гортани с применением Т-образной трубки у детей затруднены, так как относительно толстые стенки трубки суживают и без того неширокий просвет дыхательных путей, вызывая развитие дисфагических явлений, бронхитов, аспирационных пневмоний, асфиксии [41]; применение Т-образных трубок эффективно только у 50% пациентов в возрасте до 10 лет по сравнению с 80% больных старше 10 лет [20]. Реконструктивные операции у детей младшего возраста имеют высокий статистически значимый риск неудачи, несмотря даже на меньшую тяжесть повреждения дыхательных путей, по сравнению со старшими детьми [50]. В то же время некоторые авторы рекомендуют оперировать детей раннего возраста как можно раньше в целях восстановления нормального речевого общения; при этом хронические трахеоканюляры, по сравнению с ранее не трахеотомированными больными, требуют более агрессивной тактики лечения; они имеют меньше шансов на успех операции, у таких больных чаще развиваются осложнения в послеоперационном периоде [25]. Среди новорожденных и детей младшего возраста предрасполагающими факторами к развитию осложнений являются вес меньше 4 кг и гестационный срок меньше 30 недель [28].
Для формирования стойкого просвета гортани осуществляются различные варианты редрессации печатки перстневидного хряща [8, 11, 46], ларинготрахеальной декомпрессии с расширением просвета дыхательных путей (в области как передней, так и задней стенки), в том числе путем пересадки аутохряща (реберного, ушной раковины, перегородки носа) [17, 19, 40], васкуляризированного трансплантата из тела подъязычной кости с грудинно-подъязычной мышцей [11, 24, 27] и других тканей. Наиболее частыми причинами неудач операций, проведенных наружным доступом, являются недостаточная предоперационная диагностика гортаннотрахеального стеноза, интраоперационные дефекты, ошибки, связанные с выбором типа и длины стента и длительностью его использования, склонность к развитию келлоидных рубцов, недостаточное послеоперационное наблюдение [16], а также такая сопутствующая патология, как ларингомаляция, трахеомаляция и пролапс черпаловидных хрящей [38]. В ряде случаев для успешной деканюляции требуется несколько повторных операций наружным доступом; лечение может затягиваться на десятки лет [22]. Противопоказаниями к операции наружным доступом являются незаконченный процесс рубцевания, тяжелые поражения ЦНС, заболевания легких, неизлеченное первичное заболевание, невозможность послеоперационного наблюдения и лечения [11, 25].
В последние годы появились сообщения об устранении обширных стенозов гортани и трахеи у детей путем резекции стенозированного участка с последующим наложением межтрахеального и гортаннотрахеального анастомозов [30, 39]. Показанием к операции является изолированный подскладковый или трахеальный стеноз, расположенный как минимум на 10 мм ниже голосовых складок; протяженность стеноза должна быть от 1 до 6 см [45]. При формировании анастомоза между гортанью и трахеей возникают значительные трудности из-за несоответствия размеров сшиваемых концов. Эти операции в основном используются при лечении взрослых больных; к настоящему времени отдаленные результаты такого лечения у детей еще не изучены (хотя эксперимент на кроликах показал адекватный рост дыхательных путей после резекции перстневидного хряща и первого кольца трахеи [47]), у них высок риск развития дигисценций в области анастомоза, повреждения возвратных нервов; кроме того, в случае неудачи операции дальнейшее лечение крайне затруднительно [18]. Даже незначительный отек тканей в месте анастомоза может вызывать у ребенка выраженный дыхательный стеноз, связанный с малым диаметром трахеи; при этом трахея ребенка менее толерантна к растяжению, чем у взрослого, в связи с чем резекция у ребенка возможна лишь на относительно меньшей, по сравнению со взрослым, части трахеи [21]. По мнению В. Г. Зенгера (2001), при циркулярной резекции трахеи и дополнительной мобилизации подъязычной кости происходит вмешательство в очень сложный механизм, обеспечивающий одну из важнейших функций гортани — защитную, так как возникает опасность проявления аспирационных осложнений. В случае возникновения осложнений необходимо дополнительное разобщение отрезков воздухопроводящих путей, т. е. выполнение трахеостомии и введение трахеальной канюли с раздувной манжеткой, что сводит на нет все преимущества столь сложной и небезопасной для больного операции. Поэтому возможность частичной резекции дыхательных путей с наложением анастомоза должна рассматриваться лишь в качестве крайнего варианта [3].
Несмотря на использование различных по технике операций, эффективность устранения рубцового стеноза гортани и деканюляции достигает, согласно наблюдениям различных авторов, 63–64 % [5, 11, 18, 43]. На эффективность лечения влияют степень сужения дыхательных путей и протяженность стеноза: если при стенозе гортани до 70% просвета удается деканюлировать до 100% детей, то при полной атрезии органа эффективность оперативного вмешательства снижается до 67% деканюлированных больных (в том числе и после повторных операций) [46]; кроме того, чем короче стенозированный участок, тем результативнее лечение [12]. По мнению B. Benjamin (1993), при сочетанном поражении складкового и подскладкового отделов гортани, особенно при их тотальной облитерации рубцовой тканью, реконструктивные операции достигают успеха приблизительно в 50% случаев.
Читайте также:


