Дефицит аспартоацилазы (болезнь Канавана) - причины, диагностика, лечение
Добавил пользователь Alex Обновлено: 22.01.2026
Проявляющееся в раннем детстве неврологическое заболевание, сопровождающееся нарушением моторики, гипотонией мышц, приступами эпилепсии, слепотой и макроцефалией, характеризующееся дефицитом фермента аспартоацилазы, называется спонгиозной дегенерацией, или болезнью Канавана.
По какой причине развивается болезнь Канавана?
Развитие патологии ведёт к демиелинизации нервных волокон головного мозга. Заболевание имеет генномутационную природу развития. Необходимо отметить, что данная патология относится к разряду редко встречаемых неврологических заболеваний. В подавляющем большинстве случаев заболевание развивается на первом году жизни ребёнка. К сожалению, приходится констатировать неутешительные результаты современных методов терапии. Неврологи относят патологию к разряду лейкодистрофии. Причиной развития патологии является мутация гена ASPA, который находится на семнадцатой хромосоме, отвечающего за выработку фермента аспартоацилазы, расщепляющего отдельные молекулы аспарагиновый кислоты, формирующейся в тканях нервной системы. Дефицит фермента неизбежно ведёт к переизбытку аспарагиновой кислоты, в следствие чего происходит разрушение миелиновой оболочки. Данный патологический процесс оставляет нервные клетки незащищенными и значительно ухудшает передачу нейронных импульсов. Болезнь Канавана относят к группе дегенеративных неврологических заболеваний.
В качестве основных симптомов болезни Канавана выделяют:
- нарушения в фиксации взгляда;
- повышенную возбудимость;
- нарушение глотательной функции;
- приступы судорог;
- пониженный тонус мышц;
- нарушение моторики;
- запоздалое развитие ряда навыков;
- макроцефалию;
- патологии стоп и кистей.
Как правило, к двухлетнему возрасту атрофируется зрительный нерв, что приводит к полной потере зрения.
Высокую концентрацию аспарагиновой кислоты позволяет установить общий анализ мочи. Для точной диагностики необходимо провести биохимический анализ крови, диагностику ДНК, магнитно-резонансную томографию. После подтверждения диагноза болезни Канавана невролог назначает симптоматическую терапию.
Как мы уже говорили выше, прогноз неутешительный. В большинстве случаев летальный исход наступает до достижения ребёнком десятилетнего возраста. Сегодня в специализированных клиниках проводят искусственную замену матированного гена на здоровый. Это позволяет значительно продлить жизнь больному, однако летальный исход неизбежен. Все, чего пока удалось добиться врачам в области лечения болезни Канавана — это увеличить продолжительность жизни больного до двадцати лет. На сегодняшний день отсутствует также специфическая профилактика данной патологии.
Болезнь Канавана
Болезнь Канавана — это генетическая аутосомно-рецессивная нейродегенеративная болезнь, известная также под названиями Болезнь Канавана-Ван Богерта-Бертрана. Это спонгиозная дегенерация белого вещества мозга, спонгиозная младенческая дегенерация, при которой наблюдается прогрессирующее поражение нервных клеток головного мозга. Аутосомно-рецессивный тип наследственности значит, что ребенок, родившийся от родителей-носителей данного заболевания, имеет высокий риск заболеть (примерно 25%). Это заболевание редкое, но в то же время одно из наиболее распространённых у детей, связанное с нарушением работы мозга. Принадлежит к группе генетических заболеваний под названием лейкодистрофия.
Проявляется болезнь в раннем детском возрасте, распространена в большей степени среди еврейского населения ашкенази.
Причины возникновения болезни Канавана
Болезнь Канавана вызывается мутировавшим геном ASРА, который синтезирует фермент аспартоацилазы и находится в семнадцатой хромосоме.
В головном мозге в высокой концентрации из аспаргиновой кислоты образуется ацетиласпарагиновая кислота и присутствует там так же, как и глутаминовая кислота.
Роль и значение этой кислоты до конца не определено, но известно, что недостаток аспартоациллазы приводит к возникновению болезни Канавана. Тогда эта кислота выводится из организма с мочой, повышая ее концентрацию в разы. Большое количество этой кислоты появляется в крови и самом головном мозге, особенно в белом веществе, где наблюдается резкое набухание астроцитов.
При электронной диагностике выявляется деформация митохондрии. В головном мозге происходят прогрессирующие атрофические процессы, в следствие которых увеличиваются в объеме мозговые желудочки. Нарушается образование миелиновой оболочки (особенный слой жиров, покрывающий нервные клетки как бы изолируя их, не позволяя нервному импульсу переходить из одного нервного волокна в другое).
Симптомы болезни Канавана
Болезнь Канавана изначально может никак не проявляться. Только спустя месяц или три месяца после рождения ребенка вероятно поставить окончательный диагноз.
К симптомам болезни Канавана относятся:
- развитие мышечной гипотонии (ребенок не держит голову);
- повышенная сонливость;
- снижение мышечного тонуса шеи и увеличение тонуса мышц конечностей;
- тугоподвижность суставов;
- наличие судорог;
- хаотическое движение глазных яблок;
- эпилептические припадки;
- пищевой рефлюкс, нарушение функции глотания;
- паралич конечностей;
- увеличение головного мозга и образование в нем полостей;
- атрофия зрительных нервов — слепота (к двухлетнему возрасту);
- макроцефалия — увеличение головы вследствие накопления жидкости;
- тяжелое отставание в развитии.
Симптомы болезни Канавана быстро прогрессируют, поэтому продолжительность жизни пациентов сокращается. Конечная стадия развития заболевания характеризуется обездвиживанием пациента, затруднительным дыханием и кровообращением.
Диагностика болезни Канавана
Диагностика болезни Канавана — сложный процесс, потому что похожие симптомы наблюдаются и среди других врожденных или приобретенных болезней.
Для определения болезни Канавана или подтверждения диагноза проводится тщательная диагностика, включающая в себя:
- анализ крови и органический анализ мочи на кислотность;
- КТ;
- МРТ;
- генетический тест на генные мутации.
Анализ мочи и крови сразу выявляет высокую концентрацию ацетиласпарагиновой кислоты. Процесс проведения МРТ затруднителен, так как возраст пациентов очень мал, поэтому могут возникать неточности в диагностике. МРТ помогает выявить губчатую дегенерацию нервных волокон миелинового жирового слоя, а также набухание астроцитов и деформацию (удлинение) митохондрий. Концентрация аспартоацилазы в кожных фибробластах у носителей болезни Канавана приблизительно в два раза ниже нормы. Магнитно-резонансная спектроскопия показывает наивысшую концентрацию ацетиласпарагиновой кислоты в головном мозге. Особенно важен биохимический анализ крови и мочи, которые и дают заключение диагноза, играют решающую роль.
Существуют методы диагностики, позволяющие выявить данное заболевание ребенка еще в утробе матери (перинатальная диагностика). Для этого нужно установить в первую очередь деформированный патологический ген у обоих родителей. Для подтверждения или опровержения диагноза проводится амниоцентез для получения амниотической жидкости. Практикуют также трансабдоминальную или трансцервикальную биопсию хориона для получения ворсины хориона.
Генетики рекомендуют лицам, имеющим в семейной истории данное заболевание, при планировании семьи проходить тщательное обследование — скрининг на выявление модифицированного гена.
Лечение болезни Канавана
Эффективной и стандартной методики, как и лекарств для лечения болезни Канавана, на сегодняшний день не существует. Курс лечения сугубо индивидуален и имеет поддерживающий характер. Болезнь считается смертельной. Пациенты умирают зачастую в возрасте до двух лет, в отдельных случаях продолжительность жизни может быть до десяти лет, в редких случаях до двадцати. С помощью метаболической терапии возможно замедление развития болезни. Прием ряда медицинских препаратов (ацетат кальция, цитрат лития, сукцинат натрия, милидиамокс) сможет приостановить прогрессирование заболевания, но остановить его не сможет. Все препараты, необходимые для лечения — дорогостоящие.
Экспериментальное лечение
Эксперименты медиальной терапии на основе нитрата лития (проводились в лабораторных условиях на организмах животных) дали обнадёживающие результаты приостановления заболевания. Это стало основой для продолжения экспериментального лечения на основе лития.
На уровне экспериментов исследуются разнообразные методы лечения, в частности, генная терапия. Например, в желудочки мозга пациента через несколько катетеров были введены липосомы с геном аспартоациалазы в качестве раствора. Процедура проводилась как экспериментальное лечение с участием более десятка больных детей и не привела к желаемому результату — полное устранение болезни, хотя и считается наиболее успешной, так как с ее помощью удалось приостановить развитие заболевания.
Обнадёживающие результаты дали эксперименты с использованием триацетина, который расщепляют до ацетата для лучшего усвоения организмом.
Прогноз болезни Канавана
Болезнь Канавана ( Болезнь Канавана — ван Богерта , Дегенерация ЦНС губчатая , Спонгиозная младенческая дегенерация )
Болезнь Канавана (спонгиозная младенческая дегенерация) — генетическое нейродегенеративное заболевание, в основе которого лежит недостаток фермента аспартоацилазы, приводящий к демиелинизации нервных волокон головного мозга. Болезнь Канавана проявляется в раннем детском возрасте нарушениями моторики и развития ребенка, затруднениями при приеме пищи, мышечной гипотонией, макроцефалией, эпилептическими припадками, слепотой. Диагностируется болезнь Канавана по анализу мочи на N-ацетил-аспарагиновую кислоту. Эффективная терапия заболевания пока не найдена. Производятся попытки лечить болезнь Канавана при помощи метаболической терапии и путем применения генных технологий, способных заменить патологическую аберрацию на здоровый ген.
МКБ-10
Общие сведения
Болезнь Канавана была описана Миртелем Канаваном в 1931 году. А в 1991 году Рубеном Маталоном был выделен ген, отвечающий за это заболевание. Спустя несколько лет стал применяться тест, позволяющий диагностировать болезнь Канавана еще в период ведения беременности. Болезнь Канавана встречается у людей любой национальности. Однако чаще всего ею болеют евреи ашкенази. Среди них носителем генной аберрации, кодирующей болезнь Канавана, является 1 из 40 человек.
Современная неврология относит болезнь Канавана к так называемым лейкодистрофиям — генетически обусловленным дегенеративным заболеваниям нервной системы, в основе которых лежит нарушение метаболизма липидов. Чаще всего нарушения касаются миелина, который на 70-75% состоит из липидов. Распад миелина приводит к разрушению миелиновой оболочки нервных стволов и вторичной гибели нейронов. Лежащая в основе заболевания прогрессирующая демиелинизация делает болезнь Канавана и другие лейкодистрофии схожими с демиелинизирующими заболеваниями головного мозга, которые имеют приобретенный характер (рассеянным склерозом, рассеянным энцефаломиелитом, полирадикулоневропатией Гийена-Барре, болезнью Девика).
Болезнь Канавана связана с генетическим нарушением в геноме ASРА, расположенном в 17-й хромосоме. Вследствие этой генетической аберрации снижен синтез фермента аспартоацилазы, расщепляющего N-ацетил-аспарагиновую кислоту, образующуюся в процессе жизнедеятельности клеток центральной нервной системы. Патологически высокий уровень этой кислоты приводит к повреждению миелиновой оболочки нервных волокон головного мозга. Миелиновая оболочка выполняет роль своеобразного изолятора, не позволяющего нервному импульсу переходить с одного нервного волокна на другое. Таким образом, миелиновая оболочка способствует точному и быстрому проведению нервных импульсов. При ее разрушении этот процесс нарушается, что и является непосредственной причиной клинических проявлений болезни Канавана.
Болезнь Канавана передается по аутосомно-рецессивному типу наследования. Это означает, что в ситуации, когда оба родителя являются носителями патологического гена, вероятность рождения у них ребенка, имеющего болезнь Канавана, равна 25%.
При рождении ребенок, имеющий болезнь Канавана, ничем не отличается от здоровых новорожденных. Симптомы заболевания начинают проявляться спустя месяц, а чаще в период от 3 месяцев до полугода. Отмечается задержка в развитии, замедленность движений, потеря уже приобретенных двигательных навыков, снижение мышечного тонуса. Возникающие затруднения при глотании обуславливают существенные трудности при кормлении ребенка. Примерно к 4-ому месяцу жизни становиться заметно увеличение головы (макроцефалия). Прогрессирование болезни Канавана сопровождается возникновением эпилептических припадков. Демиелинизация и атрофия зрительного нерва приводит к развитию слепоты.
Болезнь Канавана представляет для невролога определенные сложности в диагностике, поскольку демиелинизирующий процесс наблюдается при целом ряде как врожденных, так и приобретенных заболеваний. Стандартные методы первичного неврологического обследования, такие как электроэнцефалография и ультрасонография не выявляют специфических изменений. Проведение МРТ головного мозга затруднено из-за слишком раннего возраста пациентов. Наиболее достоверным методом, позволяющим диагностировать болезнь Канавана, является анализ мочи на N-ацетил-аспарагиновую кислоту.
Генетики рекомендуют всем лицам еврейской национальности при планировании беременности проходить скрининг на наличие генной мутации, определяющей болезнь Канавана. Скрининг следует проходить также тем людям, в семье которых наблюдался случай этого заболевания. Разработаны методы пренатальной диагностики, позволяющие установить болезнь Канавана еще до рождения ребенка. Показанием к проведению подобного исследования является установленное носительство патологического гена у обоих родителей. Материалом для исследования на болезнь Канавана служат амниотическая жидкость, полученная в результате амниоцентеза, или ворсины хориона, взятые в ходе трансабдоминальной или трансцервикальной биопсии хориона.
В настоящее время не существует методики, при помощи которой можно было бы эффективно лечить болезнь Канавана. Замедлить развитие заболевания можно при применении метаболической терапии. Она заключается в приеме внутрь целого комплекса лекарственных препаратов: цитрата лития, ацетата кальция, сукцината натрия.
Наиболее оптимистичными среди современных экспериментальных разработок в области лечения болезни Канавана является генная терапия. Разработка метода генной терапии, способного значительно продлить жизнь имеющим болезнь Канавана пациентам, проводится в Нью Джерси (США). Ее идея заключается в клонировании и внедрении в организм здорового гена, способного заменить патологический ген. Носителями нового искусственно синтезированного гена являются непатогенные аденоассоциированные вирусы, которые в растворе водятся в головной мозг через 6 катетеров, установленных в различных его областях. Экспериментальное лечение прошли 13 детей. Их последующее обследование показало, что в результате генной терапии болезнь Канавана замедлила свое прогрессирование, произошло снижение токсичной N-ацетил-аспарагиновой кислоты и увеличение содержание миелина.
К сожалению, болезнь Канавана приводит к летальному исходу еще в младенческом возрасте. В редких случаях больные доживают до возраста 10 лет.
Кессонная болезнь ( Декомпрессионная болезнь )
Кессонная болезнь - это комплекс симптомов, формирующийся при образовании газовых пузырьков в сосудах и тканях на фоне быстрого снижения атмосферного давления. Патология может быть острой либо хронической. Проявляется болями в суставах, мышцах, синдромом Меньера, диспепсией, признаками поражения ЦНС, острой легочной и сердечно-сосудистой недостаточностью. При постановке диагноза используются анамнестические данные и результаты объективного осмотра, для оценки состояния различных органов применяется рентгенография, УЗИ, МРТ, КТ. Лечение - рекомпрессия с последующей медленной декомпрессией, симптоматическая лекарственная терапия.
Кессонная болезнь (декомпрессионная болезнь, ДКБ) - комплекс изменений, развивающихся при переходе от высокого атмосферного давления к нормальному, реже - от нормального к пониженному. Свое название патология получила от слова «кессон», обозначающего камеру, созданную в 40-х годах XIX века и предназначенную для проведения работ под водой либо в условиях водонасыщенных грунтов. ДКБ считается профессиональным заболеванием подводников и специалистов, работающих в условиях кессонных камер, в отдельных случаях диагностируется у летчиков. В последние годы из-за широкого распространения дайвинга выявляется у других групп населения. Согласно статистическим данным, частота заболевания составляет 2-4 случая на 10 000 погружений.
Причины
Непосредственной причиной кессонной болезни является быстрое снижение атмосферного давления при изменении глубины погружения в воду, реже - при подъеме самолета на значительную высоту. Чем быстрее изменяется атмосферное давление - тем больше риск возникновения данной патологии. Факторами, увеличивающими вероятность развития заболевания, считаются:
- Старение организма. По мере старения состояние всех органов ухудшается. Это становится причиной снижения компенсаторных возможностей легких и сердца в период изменения давления.
- Переохлаждение. Сопровождается замедлением кровотока в периферических сосудах. Кровь из отдаленных участков тела медленнее поступает в легочные сосуды, газ в меньшей степени выделяется из крови физиологическим путем.
- Обезвоживание. Вязкость крови при данном состоянии увеличивается, что провоцирует замедление кровообращения. При изменении внешнего давления на периферии возникает стаз, который усугубляется формированием пузырьков, блокирующих просвет сосудов.
- Физическая нагрузка. Потенцирует нарушение равномерности кровотока, вследствие чего создаются условия для интенсивного растворения газов в крови с последующим появлением «тихих» пузырьков. Характерной особенностью является отложение микропузырьков в суставах и повышение вероятности возникновения патологии при следующих погружениях.
- Липидемия, излишний вес. Жиры обладают повышенной гидрофобностью, поэтому при их высоком содержании более активно образуются пузырьки. Клетки жировой ткани интенсивно растворяют инертные газы, входящие в состав дыхательных смесей.
- Гиперкапния. Развивается при низком качестве дыхательной смеси или попытках ее «сэкономить», задерживая дыхание. Увеличение количества CO2 провоцирует сдвиг кислотно-основного состояния в кислую сторону. Из-за этого в крови растворяется больше инертных газов.
- Алкогольное опьянение. При приеме алкоголя возникает обезвоживание. Кроме того, молекулы спирта вызывают соединение мелких пузырьков в более крупные и становятся центрами, вокруг которых образуются большие пузыри, закупоривающие кровеносные сосуды.
Патогенез
При повышенном давлении газы дыхательной смеси вследствие диффузии в значительных количествах растворяются в крови капилляров легочной ткани. Когда давление снижается, наблюдается противоположное явление - газы «выходят» из жидкости, формируя пузырьки. Чем быстрее меняется давление, тем интенсивнее становится процесс обратной диффузии. При быстром подъеме кровь пациента «закипает», выделяющиеся газы образуют множество крупных пузырьков, которые могут блокировать сосуды разного калибра и повреждать различные органы.
Крупные пузырьки соединяются с мелкими, к образовавшимся пузырям «прилипают» тромбоциты, формируются тромбы, прикрепляющиеся к стенкам мелких сосудов и перекрывающие их просвет. Часть тромбов отрывается с фрагментами сосудистой стенки, мигрирует по кровеносному руслу и блокирует другие сосуды. При скоплении большого количества таких образований развивается газовая эмболия. При значительном повреждении стенок целостность артериол нарушается, возникают кровоизлияния.
Появление пузырей и образование их комплексов с тромбоцитами запускает каскад биохимических реакций, вследствие которых в кровь выбрасываются различные медиаторы, возникает внутрисосудистое свертывание. Пузырьки также образуются вне сосудистого русла, в суставных полостях и мягкотканных структурах. Они увеличиваются в объеме и сдавливают нервные окончания, провоцируя боли. Давление на мягкотканные образования становится причиной их повреждения с формированием очагов некроза в мышцах, сухожилиях и внутренних органах.
Классификация
Из-за возможности поражения различных органов, существенных различий в тяжести и прогнозе самой рациональной с практической точки зрения считается систематизация типов кессонной болезни на основании преобладающих проявлений. Клиническая классификация М. И. Якобсона представляет собой развернутый вариант выделения степеней заболевания с учетом симптоматики. Различают четыре формы патологии:
- Легкая. Превалируют артралгии, миалгии, невралгии, обусловленные сдавлением нервных окончаний газовыми пузырьками. У ряда больных выявляется ливедо, зуд, сальность кожи, вызванные закупоркой мелких поверхностных вен, протоков сальных и потовых желез.
- Средней тяжести. Преобладают расстройства со стороны вестибулярного аппарата, глаз и ЖКТ, возникающие вследствие эмболии капилляров и артериол лабиринта, скопления газовых пузырей в сосудах брыжейки и кишечнике, преходящего спазма ретинальных артерий.
- Тяжелая. Проявляется быстро нарастающими симптомами поражения спинного мозга, как правило, на уровне среднегрудных сегментов, что обусловлено склонностью миелина к поглощению азота и слабой васкуляризацией среднегрудного отдела, из-за чего активно формирующиеся пузырьки не мигрируют с кровью, а сдавливают нервную ткань. Признаки вовлечения головного мозга выявляются гораздо реже. Возможны расстройства сердечной и дыхательной деятельности.
- Летальная. Возникает при тотальном прекращении кровообращения в легких или продолговатом мозге, развитии острой сердечной недостаточности. Провоцируется образованием большого количества крупных пузырьков, одновременно блокирующих множество сосудов.
Для оценки угрозы жизни больного и определения оптимальной тактики лечения в травматологии и ортопедии также применяют упрощенную классификацию, включающую два типа острой ДКБ. Первый тип характеризуется поражением периферических структур (кожи, мышечно-суставной системы). Второй сопровождается изменениями со стороны нервной, дыхательной, сердечно-сосудистой, пищеварительной систем, при отсутствии лечения возможен смертельный исход. Кроме того, различают хронический вариант кессонной болезни, который может развиваться при наличии острой патологии в анамнезе или без предшествующих острых явлений; диагностируется у людей, продолжительное время трудившихся в условиях кессонов.
Симптомы кессонной болезни
В случае тяжелого поражения проявления могут возникать уже в первые минуты после всплытия, однако чаще клиническая картина декомпрессионной болезни формируется постепенно. У половины больных симптоматика выявляется в течение часа. Через 6 часов признаки патологии обнаруживается у 90% пациентов. Редко наблюдается отсроченное появление симптомов (на протяжении 1-2 суток). При легкой форме отмечаются боли в суставах, костных структурах, мышечной ткани, области спины. Болевой синдром обычно ярче выражен в области плечевых и локтевых суставов. Пациенты описывают ощущения как «сверлящие», «глубокие», усиливающиеся при движениях. Часто отмечается сыпь, зуд кожи, повышенная сальность, мраморность окраски кожных покровов. Возможно увеличение лимфоузлов.
При кессонной болезни средней тяжести наблюдается синдром Меньера, обусловленный поражением органа равновесия и включающий в себя головокружения, головную боль, бледность, потливость, тошноту, рвоту. Нарушения деятельности ЖКТ проявляются болями, рвотой и диареей. Спазм сосудов сетчатки сопровождается возникновением фотоморфопсий, «мушек» и «тумана» перед глазами. Тяжелая форма характеризуется нижней спастической параплегией, тазовыми расстройствами, нарушением чувствительности в нижней половине тела по проводниковому типу. Иногда наблюдаются гемипарезы или гемиплегии, головные боли, нарушения речи, психотические расстройства, имеющие преходящий характер.
Сердечно-сосудистые и дыхательные симптомы обнаруживаются при тяжелой форме и достигают наибольшей выраженности при летальном варианте заболевания. Определяется слабость, бледность, одышка, интенсивная боль в груди, кашель, падение АД. При прогрессировании симптоматики развивается отек легких, дыхание становится частым, поверхностным, пульс замедляется, кожные покровы приобретают синюшный или бледно-серый оттенок. Возможны инфаркты легких и миокарда. Летальная форма сопровождается острой сердечной недостаточностью, асфиксией вследствие блокады легочного кровообращения либо нарушения регуляции дыхания продолговатым мозгом.
Наиболее распространенным проявлением хронической декомпрессионной болезни является деформирующий артроз, обусловленный повторяющимся воздействием мелких пузырьков на костно-суставные структуры. Мнения ученых относительно миодегенерации сердца, раннего атеросклероза и частых заболеваний среднего уха у людей, занятых работами кессонным способом, расходятся. Одни специалисты считают перечисленные патологии следствием повторяющейся субклинической ДКБ, другие - результатом воздействия иных факторов, возникающих при пребывании на большой глубине.
Осложнения
Тип и тяжесть осложнений определяются формой заболевания, своевременностью и адекватностью терапевтических мероприятий. Наиболее распространенными последствиями острой декомпрессионной болезни считаются хронический синдром Меньера и аэропатический миелоз. Другими возможными осложнениями являются пневмония, миокардит, эндокардит, кардиодистрофия, кардиосклероз, парезы, параличи, нарушения чувствительности, асептический остеонекроз.
Диагностика
Острая форма кессонной болезни диагностируется на основании жалоб пациента, анамнестических данных и результатов внешнего осмотра. На рентгенограммах могут обнаруживаться пузырьки газа в суставах, мышечной ткани, фасциях, сухожильных влагалищах. Для определения состояния ЦНС назначают томографические исследования спинного и головного мозга. Подтверждением диагноза является улучшение состояния больного при проведении рекомпрессии. Программа обследования при развитии осложнений определяется характером предполагаемой патологии, может включать ЭКГ, эхокардиографию, рентгенографию, УЗИ, МРТ и КТ различных органов.
Лечение кессонной болезни
Терапию заболевания в зависимости от формы, выраженности симптомов осложнений проводят реаниматологи, врачи-травматологи, профпатологи и другие специалисты. При нерезко выраженных кожных, мышечных и суставных проявлениях допустимо наблюдение в динамике. В остальных случаях показана срочная рекомпрессия в условиях барокамеры. Вначале давление увеличивают до показателей, соответствующих глубине погружения больного. При тяжелом состоянии пострадавшего применяют давление выше исходного. Минимальная продолжительность рекомпрессии составляет 30 минут, при сохранении симптомов процедуру продолжают до нормализации состояния пациента. Затем проводят медленную декомпрессию, снижая давление на 0,1 атмосферу через каждые 10 минут. После снижения давления до 2 атмосфер используют вдыхание кислорода для ускорения процесса выведения азота. При появлении признаков ДКБ после нормализации давления выполняют повторную рекомпрессию.
По показаниям назначают симптоматическую терапию. Осуществляют инфузии раствора глюкозы, плазмы, солевых растворов. Применяют фармпрепараты для нормализации и стимуляции деятельности сердечно-сосудистой системы. При необходимости в план лечения включают сосудорасширяющие средства. При интенсивном болевом синдроме используют ненаркотические анальгетики. Наркотические фармрепараты не показаны из-за возможного угнетающего действия на дыхательный центр. При миалгиях и артралгиях рекомендуют местные согревающие и обезболивающие препараты. После выхода из барокамеры проводят физиопроцедуры: соллюкс, диатермию, лечебные ванны.
Прогноз и профилактика
Исход ДКБ определяется тяжестью поражения и временем начала рекомпрессии. У 80% пациентов отмечается полное выздоровление. Летальные исходы наблюдаются достаточно редко, обычно при экстренном подъеме или отсутствии специализированной помощи. Профилактика кессонной болезни включает использование качественного оборудования для дайвинга и профессиональных работ на глубине, строгое соблюдение правил подъема с учетом данных специально разработанных таблиц, регулярные медицинские осмотры, исключение факторов, увеличивающих риск ДКБ. Превентивные меры также предполагают установление достаточного временного интервала между первым и последующими погружениями или полетами на воздушном транспорте, ограничение времени пребывания в условиях повышенного давления для водолазов и работников кессонов.
Болезнь Канавана Симптомы, причины, лечение
Болезнь Канавана это редкое генетическое заболевание, которое возникает из-за того, что нервные клетки мозга повреждены и не могут общаться друг с другом..
Эта болезнь встречается в любом обществе и этнической группе, хотя она встречается гораздо чаще среди еврейского населения ашкенази (проживающего на востоке центральной Европы) и их потомков, где поражен 1 человек на каждые 6 400-13,00 человек. Глобальная распространенность неизвестна.
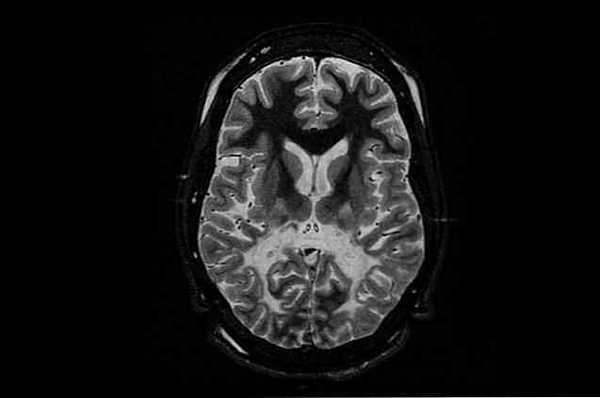
Характеристика болезни Канавана
Это заболевание относится к группе лейкодистрофий. Эта категория охватывает все генетические нарушения, при которых миелиновая оболочка, которая окружает аксоны нейронов, повреждена и, следовательно, между нейронами нет хорошей связи..
Наиболее распространенной и в то же время самой серьезной формой этого заболевания является неонатальная или детская. Эта форма болезни Канавана поражает новорожденных детей или в первые годы их жизни.
У детей, которые страдают от этой болезни, нет никаких проблем в течение первых месяцев жизни, но они начинают цвести между 3 и 5 месяцами..
Основные симптомы связаны с дефицитом развития, когда у детей возникают двигательные проблемы, которые мешают им поворачиваться, поворачивать голову или сидеть без какой-либо поддержки..
Другими общими симптомами являются мышечная слабость (гипотония), аномальное развитие головы (макроцефалия) и раздражительность. В меньшей степени они могут также иметь проблемы с едой, судорогами и проблемами со сном.
Другой менее распространенной формой является болезнь Канавана, которая начинается в среднем детстве или в подростковом возрасте. У детей и подростков с этим заболеванием есть проблемы с языковым развитием и моторными навыками, но эти проблемы часто настолько незначительны, что их не идентифицируют как симптомы болезни Канавана..
Ожидаемая продолжительность жизни людей, страдающих болезнью Канавана, очень неоднородна и значительно варьируется в зависимости от времени начала заболевания..
Дети, которые страдают от неонатальной или младенческой формы, обычно живут всего несколько лет, хотя некоторые достигают подросткового возраста и очень немного до взрослой жизни. В то время как те, кто страдает ювенильной формой, имеют нормальную продолжительность жизни.
симптомы
Как уже упоминалось, существует две хорошо дифференцированные формы болезни Канавана: неонатальное или детское начало и начало в среднем детстве или в подростковом возрасте..
Неонатальный или младенческий старт
Симптомы болезни Канавана у новорожденных или младенцев очень серьезны, обычно не замечаются до достижения возраста 3-50 месяцев и включают макроцефалию, потерю двигательного контроля головы и дефицит развития. Дефицит развития становится все более очевидным по мере роста ребенка.
Наиболее тяжелые симптомы связаны с двигательными проблемами, поскольку дети не могут сидеть или вставать без поддержки, ходьбы или разговора. Когда они становятся старше, гипотония может привести к спастичности.
Даже если у них есть все эти двигательные проблемы, они могут научиться взаимодействовать, улыбаться, указывать на предметы .
Некоторые дети также страдают от атрофии зрительного нерва, которая вызывает проблемы со зрением, хотя они все еще могут идентифицировать объекты визуально.
Когда симптомы усиливаются, они усиливаются, вызывая проблемы со сном, судороги и проблемы с питанием. Ребенок становится полностью зависимым, нуждается в помощи для выполнения любой задачи.
Ожидаемая продолжительность жизни таких детей довольно короткая, большинство из них умирают через несколько лет, хотя некоторые доживают до подросткового или взрослого возраста..
Среднее детство или юность
Болезнь Канавана, которая начинается в среднем детстве или в подростковом возрасте, протекает слабее, чем предыдущая. Симптомы включают некоторые трудности в словесном и двигательном развитии.
Хотя они обычно настолько слабы, что не идентифицируются как симптомы болезни Канавана, это заболевание обычно диагностируется после проведения анализа мочи, поскольку одним из маркеров является высокая концентрация N-ацетил аспарагиновой кислоты (НАА). , для его сокращения на английском языке) в моче.
Это заболевание вызвано мутацией в гене под названием ASPA. Этот ген контролирует фермент аспартоацилазу, которая ответственна за деградацию молекул НАА.
Мутация гена ASPA заставляет аспартоацилазу снижать свою эффективность, поэтому он не разлагает достаточно молекул NAA и будет иметь высокую концентрацию этого вещества. Чем раньше произойдет эта мутация, тем хуже будет эффект.
Хотя функционирование молекул NAA недостаточно изучено, они, по-видимому, участвуют в транспорте молекул воды через нейроны и, избыток этого вещества, предотвращает образование нового миелина и разрушает существующий. Это приводит к тому, что связи между нейронами не работают правильно, и мозг не может нормально развиваться.
Кроме того, это заболевание может наследоваться по аутосомно-рецессивному типу. Итак, если каждый член пары является носителем патогенного варианта гена ASPA, и они решают завести ребенка, они могут:
- Ребенок представляет заболевание в 25% случаев.
- Ребенок является носителем в 50% случаев, но не имеет проблем.
- Сын даже не перевозчик на 25%.
Очень важно, чтобы лица, принадлежащие к группе риска, в данном случае потомство евреев ашкенази, имели генетический анализ, чтобы проверить, являются ли они носителями гена ASPA, прежде чем иметь ребенка..
лечение
Лечение зависит от формы заболевания и симптомов, которые каждый человек представляет.
Лечение неонатальной или детской болезни Канавана
В настоящее время нет лекарства от болезни Канавана, поэтому доступные методы лечения направлены на улучшение качества жизни пациента путем оказания поддержки, питания и увлажнения, а также профилактики и лечения инфекций..
Рекомендуется, чтобы дети проходили физиотерапевтическое лечение для улучшения осанки и двигательных навыков, чтобы избежать и лечить контрактуры и проблемы с мышцами, такие как пролежни. Они также могут участвовать в терапевтических и образовательных программах для улучшения своих коммуникативных навыков..
Лечение медикаментозным лечением включает противоэпилептические препараты (AED), если ребенок страдает от судорог, ацетазоламид (торговое наименование Diamox) ® ) для снижения внутричерепного давления и инъекций ботулинического токсина (ботокса) ® ) лечить спастичность, если она присутствует.
Необходимо каждые 6 месяцев следить за состоянием ребенка и его развитием..
Лечение болезни Канавана среднего детства или юности
Люди, которые страдают от этой формы заболевания, испытывают гораздо более легкие симптомы, поэтому им обычно требуется только терапия для улучшения языка или специальные образовательные программы. Им не нужно никаких лекарств.
Ежегодный мониторинг состояния ребенка рекомендуется.
Новые методы лечения
Эффективность других методов лечения на людях и животных моделях в настоящее время изучается.
Исследования с людьми
- Невирусный вектор
Эффективность генетической трансплантации исследуется в мозге детей с болезнью Канавана с использованием невирусного вектора.
Первые результаты показывают, что этот тип трансплантата хорошо переносится детьми и вызывает некоторые биохимические, радиологические и метаболические изменения, но излечивать болезнь бесполезно, так что тесты все еще проводятся (Leone et al 2000, Janson et al. до 2002 года).
- Вектор VAAV2
Макфи и соавт. (2006) проводят исследование, в котором здоровый ген ASPA трансплантируется в нескольких местах детского организма с использованием AAV2 в качестве вектора. В одном из испытаний приняли участие 10 детей-добровольцев. В 3 из них трансплантат сработал и нейтрализовал свои антитела, но ни один из детей не улучшился.
- Цитрат лития
Цитрат лития может снизить уровень концентрации NAA в мозге, поэтому Assadi et al. (2010) решили провести эксперимент, в котором им вводили цитрат лития 6 людям с болезнью Канавана в течение 60 дней..
Было обнаружено, что уровни концентрации NAA в базальных ганглиях и в белом веществе лобной доли, хотя никаких клинических улучшений обнаружено не было..
- Глицерол триацетат
Недостаток ферментов аспартоацилазы вызывает низкий уровень ацетата в мозге, поэтому Махаварао и его команда (2009) решили назначить триацетат глицерина двум пациентам с болезнью Канавала, чтобы поднять уровень ацетата и посмотреть, увеличился ли он. также уровни аспартоацилазы.
Пациенты хорошо переносили это соединение, хотя никаких клинических улучшений обнаружено не было. В настоящее время они проводят испытания путем введения большего количества триацетата глицерина.
Занятия с животными
Один из способов создания моделей животных, которые представляют заболевание, заключается в создании животных нокаут. Эти животные, как правило, мыши, генетически модифицированы для удаления или изменения гена, который изменяется при заболевании. В этом случае модифицированный ген является геном ASPA.
Животные модели служат для лучшего понимания заболевания, изучения его биологического соотношения и проверки эффективности новых методов лечения..
Matalon et al. (2003) использовали мышей нокаут проверить эффективность генной терапии с AAV2 в качестве вектора. Они обнаружили, что имели место улучшения в миелиновых оболочках, но только в некоторых частях, а не во всем мозге..
Команда Surendran в сотрудничестве с Genzyme Corporation (2004) проверила лечение трансплантацией стволовых клеток. Они обнаружили, что были произведены новые олигодендроциты, но их недостаточно для восстановления всех миелиновых оболочек..
Другая команда попробовала терапию, которая состояла в замене ферментов аспартоациклазы, которые не очень хорошо работали, на новые, которые были введены в брюшину мышей. нокаут.
Краткосрочные результаты показали, что ферменты смогли преодолеть гематоэнцефалический барьер (достигнув своей цели) и смогли значительно снизить уровни НАА в мозге. Хотя эти результаты являются многообещающими, необходимо провести продольное исследование, чтобы проверить долгосрочные эффекты (Zano et al., 2011).
Первые признаки того, что врачи предупреждают, что что-то не так, - это физики, особенно гипотония и макроцефалия..
Обычно, если наблюдаются эти признаки, ребенку обычно проводят исследование нейровизуализации, чтобы проверить, нет ли у него признаков лейкодистрофии, таких как более низкая плотность белого вещества. Примечательно, что этот тест менее эффективен у детей с началом болезни Канавана в среднем детстве или в подростковом возрасте..
Как только доказано, что ребенок страдает лейкодистрофией, проводятся более конкретные тесты, чтобы исключить другие заболевания, к ним относятся:
- Проверьте уровни NAA с:
- Анализ мочи.
- Анализ околоплодных вод (если ребенок еще не родился).
- Культуры клеток кожи для проверки уровня фибробластов (хотя этот тест ненадежен).
- Уровни этого фермента в лейкоцитах и тромбоцитах.
- Амниоциты (эмбриональные клетки), если ребенок еще не родился.
Последним шагом для подтверждения заболевания будет проведение генетического исследования следующим образом:
Читайте также:
