Эффект парциального давления кислорода. Хеморецепторы каротидного узла
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
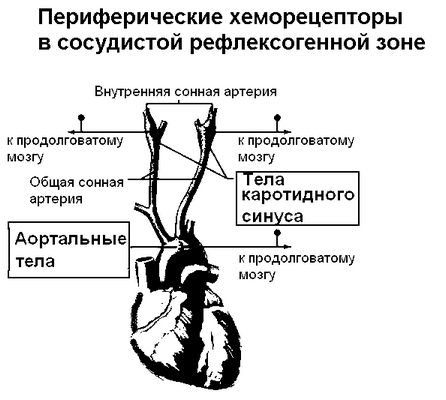
Периферические или артериальные хеморецепторы расположены в известной рефлексогенной зоне - дуге аорты и каротидном синусе (рисунки 17А и Б), и представлены каротидными и аортальными телами. Здесь же локализованы и барорецепторы, принимающие участие в регуляции артериального давления.
Рисунок 17 А. Периферические хеморецепторы
В сосудистой рефлексогенной зоне
Из двух хеморецептивных зон артериального русла - аортальной и синокаротидной - в регуляции дыхания существенную роль играет синокаротидная зона. Эта роль значительно скромнее по сравнению с ролью бульбарных структур - у человека двустороннее удаление каротидных тел не вызывает заметных изменений дыхания в состоянии покоя. Каротидные тела расположены в месте деления общей сонной артерии на внутреннюю и наружную.
Тело представляет собой образование, заключенное в соединительнотканную капсулу, чрезвычайно богато кровоснабжается и иннервируется как афферентными, так и эфферентными нервами. Кровоток через каротидное тело очень велик - до 2л/мин/г, а потребление кислорода в 3 - 4 раза больше, чем мозгом.
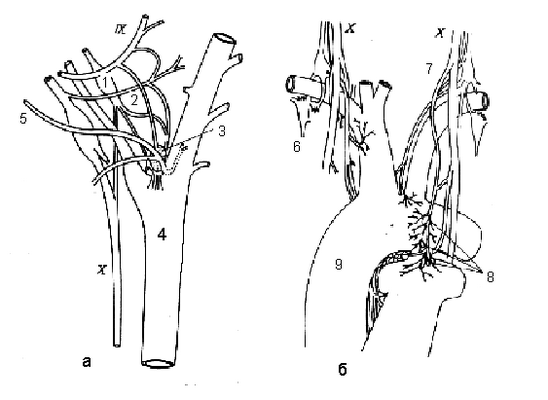
Рисунок 17 Синокаротидная (а) и аортальная (б) рефлексогенные зоны
IX и X - языкоглоточный и блуждающий нервы, 1 - верхний шейный симпатический ганглий, 2 - синусный нерв, 3 - каротидное тело, 4 - общая сонная артерия, 5 - затылочная артерия, 6 - звездчатый ганглий, 7 - аортальный нерв, 8 - аортальные тела, 9 - дуга аорты
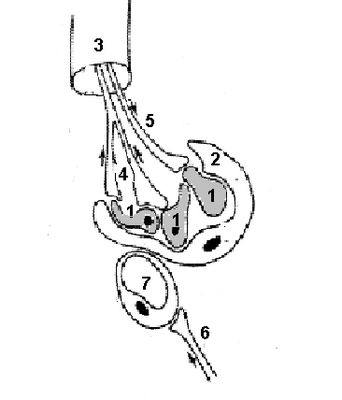
Схема строения и иннервации каротидного тела представлена на рисунке 18.
Рисунок 18. Схема строения каротидного тела
Афферентные волокна синусного нерва
Эфферентное волокно синусного нерва
В ткани каротидного тела различают два типа клеток. I тип - главные клетки, крупные клетки, имеющие эпителиальное происхождение. В клетках этого типа содержатся гранулы, которые исчезают при острой гипоксии. Непосредственно с ними контактируют окончания афферентной ветви языкоглоточного нерва (нерв Геринга, синусный нерв). Именно этим клеткам принадлежит основная роль в хемочувствительности - разрушение этих клеток прекращает хеморецептивную активность каротидного тела. Мелкие клетки II типа гомологичны глиальным клеткам и напоминают Шванновские. Своими отростками они оплетают главные клетки.
Адекватными стимуляторами хеморецепторов каротидного тела служат следующие сдвиги в составе омывающей их артериальной крови: 1) снижение напряжения кислорода, 2) увеличение напряжения СО2, 3) увеличение концентрации водородных ионов.
Главным стимулятором активности каротидного центра является гипоксия. Даже умеренная гипоксия сопровождается более выраженным увеличением частоты импульсов синусного нерва, чем сильная гиперкапния.
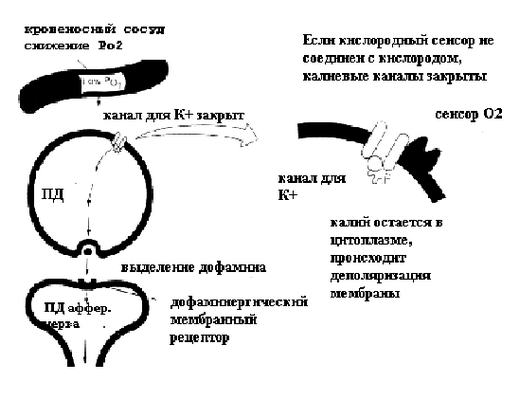
Каким же образом рецепторы воспринимают информацию о снижении напряжения кислорода в крови? Цитоплазма клеток I типа содержит гранулы, в которых накапливается дофамин. Оценка уровня кислорода осуществляется специальными рецепторами, которые расположены на мембране клеток I типа. На основании экспериментальных данных предложена гипотетическая схема работы этих рецепторов, представленная на рисунке 19.
Рисунок 19. Кислородный сенсор каротидного тела
Взаимодействие кислородного сенсора с кислородом приводит к активации калиевых каналов. В таком состоянии клетка находится практически постоянно, а ток калия из цитоплазмы поддерживает потенциал клетки на уровне мембранного потенциала покоя. Снижение напряжения кислорода в крови приводит к освобождению кислородного сенсора, калиевые каналы закрываются, мембранный потенциал уменьшается и достигает критического уровня деполяризации, в клетках I типа возникает потенциал действия. Возникновение ПД приводит к тому, что в клетках открываются кальциевые каналы и выделяется дофамин.
Артериальные хеморецепторы возбуждаются и при повышении напряжения углекислого газа в артериальной крови. Гиперкапническая стимуляция артериальных хеморецепторов, так же как и центральных, осуществляется прямым влиянием ионов Н + при снижении рН крови. Воздействие водородных ионов в клетках каротидного тела обусловлено сдвигом метаболизма за счет работы редокс-систем. Таким образом, и гипоксия, и гиперкапния различными путями приводят к изменению метаболических процессов в клетках, а стимуляторами каротидных хеморецепторов служат продукты измененного обмена. Существенная и важная разница заключается в том, что реакция на снижение напряжения кислорода наступает значительно быстрее.
Возникающий импульс возбуждения проводится по аффрентным волокнам синусного нерва и достигает дорзальной группы дыхательных нейронов продолговатого мозга. Возбуждение нейронов повышает инспираторную активность. Особенно увеличивается частота импульсации в диапазоне напряжения кислорода от 80 до 20 мм рт.ст.
Хеморецепторы каротидного синуса находятся под нервным контролем: повышение активности симпатической нервной системы и выделение норадреналина повышает их чувствительность, а парасимпатические импульсы и ацетилхолин - снижают.
Аортальные тела сходны по строению с каротидными телами, не отличаются и важнейшие функции этих образований, прежде всего как кислородных сенсоров. Расположенные в аортальной зоне хеморецепторы принимают незначительное участие в регуляции дыхания, их основная роль проявляется в регуляции деятельности сердца и тонуса сосудов.
Периферические хеморецепторы дополняют деятельность центральных. Взаимодействие центральных и периферических структур особенно важно в условиях дефицита кислорода. Дело в том, что центральные хеморецепторы очень чувствительны к недостатку кислорода. Клетки при гипоксии могут совсем потерять свою чувствительность, при этом снижается активность дыхательных нейронов. В этих условиях дыхательный центр получает основную возбуждающую стимуляцию от периферических хеморецепторов, для которых основным стимулом является именно дефицит кислорода. Таким образом, артериальные хеморецепторы служат «аварийным» механизмом стимуляции дыхательного центра в условиях снижения снабжения мозга кислородом.
Непременным условием эффективности легочного газообмена служит поддержание оптимальных вентиляционно-перфузионных отношений. Такое оптимальное соотношение обеспечивается сопряженной регуляцией систем дыхания и кровообращения. Проявлением такого сопряжения служит одновременное увеличение и вентиляции легких (МОД), и сосудистого тонуса, и деятельности сердца (МОК). Особенно выраженными такие одновременные изменения бывают во время физической нагрузки, при гипоксии, эмоциональном возбуждении. Периферические хеморецепторы расположены в тех же зонах, что и барорецепторы - нервные окончания лежащие непосредственно в стенке магистрального сосуда. Такое соседство, конечно, не случайно. Совместный контроль дыхания и кровообращения обеспечивает устойчивое снабжение кислородом жизненно важных органов, прежде всего мозга. Аортальная зона расположена у «ворот» всей артериальной системы, и здесь ведущую роль играют барорецепторы. Синокаротидная зона лежит у «ворот» всей сосудистой сети мозга, и здесь основная роль принадлежит хеморецепторам. Проекции хеморецепторных и барорецепторных афферентных волокон в ядрах ствола мозга (солитарное, парамедиальное) объединены межнейронными связями.
Итак, центральные и периферические хеморецепторы передают в дыхательный центр информацию о напряжении кислорода и углекислого газа в крови, они возбуждаются и увеличивают частоту импульсов при снижении содержания кислорода и повышении углекислого газа.
Регуляции дыхания Периферическими хеморецепторами
Периферические хеморецепторы, воспринимающие газовый состав артериальной крови, расположены в двух областях:
2) Место деления (бифуркация) общей сонной артерии (каротидный синус), т.е. в тех же зонах, что и барорецепторы, реагирующие на изменения кровяного давления. Однако, хеморецепторы представляют собой самостоятельные образования, заключенные в особых тельцах — клубочках или гломусах, которые находятся вне сосуда. Афферентные волокна от хеморецепторов идут: от дуги аорты — в составе аортальной ветви блуждающего нерва, а от синуса сонной артерии — в каротидной ветви языкоглоточного нерва, так называемом нерве Геринга. Первичные афференты синусного и аортального нерва проходят через ипсилатеральное ядро солитарного тракта. Отсюда хеморецептивные импульсы поступают к дорсальной группе дыхательных нейронов продолговатого мозга.
Артериальные хеморецепторы вызывают рефлекторное увеличение легочной вентиляции в ответ на снижение напряжения кислорода в крови (гипоксемию). Даже в обычных (нормоксических) условиях эти рецепторы находятся в состоянии постоянного возбуждения, которое исчезает только при вдыхании человеком чистого кислорода. Уменьшение напряжения кислорода в артериальной крови ниже нормального уровня вызывает усиление афферентации из аортальных и синокаротидных хеморецепторов.
Хеморецепторыкаротидного синуса. Вдыхание гипоксической смеси ведет к учащению и увеличению регулярности импульсов, посылаемых хеморецепторами каротидного тельца. Повышению напряжения СО2 артериальной крови и соответствующему подъему вентиляции также сопутствует рост импульсной активности, направляемой в дыхательный центр от хеморецепторов каротидного синуса. Особенность роли, которую играют артериальные хеморецепторы в контроле за напряжением углекислоты, состоит в том, что они ответственны за начальную, быструю, фазу вентиляторной реакции на гиперкапнию. При их денервации указанная реакция наступает позднее и оказывается более вялой, так как развивается в этих условиях лишь после того, как повысится напряжение СО2 области хемочувствительных мозговых структур.
Гиперкапническая стимуляция артериальных хеморецепторов, подобно гипоксической, носит постоянный характер. Эта стимуляция начинается при пороговом напряжении СО2 20-30 мм рт.ст и, следовательно, имеет место уже в условиях нормального напряжения СО2 в артериальной крови (около 40 мм рт.ст.).
Взаимодействие гуморальных стимулов дыхания
Механизм первого вдоха новорожденного. Легкие начинают обеспечивать организм кислородом с момента рождения. До этого плод получает 02 через плаценту по сосудам пуповины. Во внутриутробном периоде происходит бурное развитие дыхательной системы: формируются воздухоносные пути, альвеолы. Следует отметить, что легкие плода с момента их образования находятся в спавшемся состоянии. Ближе к рождению начинает синтезироваться сурфактант. Установлено, что, еще находясь в организме матери, плод активно тренирует дыхательную мускулатуру: диафрагма и другие дыхательные мышцы периодически сокращаются, имитируя вдох и выдох. Однако околоплодная жидкость при этом не поступает в легкие: голосовая щель у плода находится в сомкнутом состоянии.
После родов поступление кислорода в организм новорожденного прекращается, так как пуповина перевязывается. Концентрация 02 в крови плода постепенно уменьшается. В то же время постоянно увеличивается содержание С02, что приводит к закислению внутренней среды организма. Эти изменения регистрируются хеморецепторами дыхательного центра, который расположен в продолговатом мозге. Они сигнализируют об изменении гомеостаза, что ведет к активации дыхательного центра. Последний посылает импульсы к дыхательным мышцам — возникает первый вдох. Голосовая щель раскрывается, и воздух устремляется в нижние дыхательные пути и далее — в альвеолы легких, расправляя их. Первый выдох сопровождается возникновением характерного крика новорожденного. На выдохе альвеолы уже не слипаются, так как этому препятствует сурфактант. У недоношенных детей, как правило, количество сурфактанта недостаточно для обеспечения нормальной вентиляции легких. Поэтому у них после рождения часто наблюдаются различные дыхательные расстройства.
Вопрос 2 Автоматия и проводящая система сердца. Морфофункциональная характеристика узлов автоматии и проводящей системы сердца, природа автоматии и ее функциональная роль.
Автоматия — это способность к самовозбуждению. Доказано, что у большинства жи-вотных ее природа — миогенная, т. е. она обусловлена наличием особого механизма, лока-лизованного в миоцитах.
Клетки, способные к автоматической генерации потенциала действия, образуют узлы автоматии (водители ритма, или пейсмекеры). У млекопитающих выделяют три узла автоматии:
1) синоатриальный узел, расположенный в районе венозного входа в правом предсердии (узел Кис-Фляка). Именно этот узел является реальным водителем ритма в норме.
2)Атриовентрикулярный узел (Ашоффа-Тавара), который расположен на границе пра вого и левого предсердий и между правым предсердием и правым желудочком. Этот узел состоит из трех частей: верхней, средней и нижней.
В норме этот узел не генерирует спонтанные потенциалы действия, а «подчиняется» синоатриальному узлу и, скорее всего, играет роль передаточной станции, а также осуще-ствляет функцию «атриовентрикулярной» задержки.
3)Волокна Пуркинье—это конечная часть пучка Гиса, миоциты которой расположены в толще миокарда желудочков. Они являются водителями 3-го порядка, их спонтанный ритм — самый низкий, поэтому в норме являются лишь ведомыми, участвуют в процессе прове дения возбуждения по миокарду.
Синоатриальный узел представляет собой соединительнотканный остов, в котором расположены специализированные мышечные клетки — в основном так называемые Р-клетки, собранные в агрегаты. Каждая из клеток этого узла способна к автоматии — благодаря высокой проницаемости для ионов натрия, и способна генерировать медленную диастолическую деполяризацию. До сих пор остается неясной причина, порождающая высокую проницаемость для ионов натрия и те особенности электрической активности, которые и приводят к генерации спонтанного потенциала действия.
Единый пейсмскерный ритм строится на основе интегративного взаимодействия всех элементов гетерогенного пейсмекера.
В других узлах автоматии преобладают миоциты промежуточного типа (атриовентрикулярный узел) или миоциты, получившие название «волокна Пуркинье». Возможно, что эти две популяции клеток не способны генерировать часто ПД (атриовентрикулярный узел генерирует до 30—40 ПД в минуту, волокна Пуркинье — до 20—30 в минуту), поэтому они в норме не являются водителями ритма.
Роль водителя ритма первого порядка — синоатриального узла — огромна. Все регулирующие воздействия, меняющие ритм сердечной деятельности, оказывают свое влияние на сердце посредством воздействия на водитель ритма первого порядка. Если этот водитель «выходит» из работы, то ни симпатическая, ни парасимпатическая системы сами по себе не смогут запустить деятельность сердца. В случае, когда синоатриальный узел повреждается и при этом человеку успевают оказать квалифицированную медицинскую помощь, больному вживляют стимулятор, задающий самостоятельно ритм для работы сердца. Благодаря такому способу удалось сохранить жизнь многих пациентов.
В ней выделяют следующие узлы и пути:
1. Синоатриальный узел (Кейс-Флека). Он расположен в устье полых вен, т.е. венозных синусах.
2. Межузловые и межпредсердные проводящие пути Бахмана, Венкенбаха и Торелла. Проходят по миокарду предсердий и межпредсердной перегородке.
3. Атриовентрикулярный узел (Ашофф-Тавара). Находится в нижней части межпредсердной перегородки под эндокардом правого предсердия.
4. Атриовентрикулярный пучок или пучок Гиса. Идет от атриовентрикулярного узла по верхней части межжелудочковой перегородке. Затем делится на две ножки - правую и левую. Они образуют ветви в миокарде желудочков.
5. Волокна Пуркинье. Это концевые разветвления ветвей ножек пучка Гиса. Образуют контакты с клетками сократительного миокарда желудочков (рис).
Синоатриальный узел образован преимущественно Р-клетками. Остальные отделы проводящей системы переходными кардиомиоцитами. Однако небольшое количество клеток-пейсмекеров имеется и в них, а также сократительном миокарде предсердий и желудочков. Сократительные кардиомиоциты соединены с волокнами Пуркинье, а также между собой нексусами, т.е. межклеточными контактами с низким электрическим сопротивлением. Благодаря этому и примерно одинаковой возбудимости кардиомиоцитов, миокард является функциональным синцитием. Т.е. сердечная мышца реагирует на раздражение как единое целое.
Роль различных отделов проводящей системы в автоматии сердца впервые была установлена Станниусом и Гаскеллом. Станниус накладывал лигатуры (т.е. делал перевязки) на различные участки сердца. Первая лигатура накладывается между венозным синусом, где расположен синоатриальный узел, и правым предсердием. После этого синус продолжает сокращаться в обычном ритме, т.е. с частотой 60-80 сокращений в минуту, а предсердия и желудочки останавливаются. Вторая лигатура накладывается на границе предсердий и желудочков. Это вызывает возникновение сокращений желудочков с частотой примерно в 2 раза меньшей, чем частота автоматии синусного узла, т.е. 30-40 в минуту. Желудочки начинают сокращаться из-за механического раздражения клеток атриовентрикулярного узла. Третья лигатура накладывается на середину желудочков. После этого их верхняя часть сокращается в атриовентрикулярном ритме, а нижняя с частотой в 4 раза меньше синусного ритма, т.е. 15-20 в минуту. Гаскелл вызывал местное охлаждение узлов проводящей системы и установил, что ведущим водителем ритма сердца является синоатриальный. На основании опытов Станниуса и Гаскелла был сформулирован принцип убывающего градиента автоматии. Он гласит, что чем дальше центр автоматии сердца расположен от его венозного конца и ближе к артериальному, тем меньше его способность к автоматии. В нормальных условиях синоатриальный узел подавляет автоматию нижележащих, т.к. частота его спонтанной активности выше. Поэтому синоатриальный узел называют центром автоматии I-го порядка, атриовентрикулярный II-го, а пучок Гиса и волокна Пуркинье III-го.
Вопрос 3 Виды гипоксий, или кислородной недостаточности, Острая и хроническая гипоксия. Отрицательное влияние гипоксии и комплекса факторов высокогорья на организм человека. Горная болезнь.
Гипоксия, кислородное голодание, кислородная недостаточность - состояние, возникающее при недостаточном поступлении кислорода к тканям или нарушении его утилизации в процессе биологического окисления. Гипоксия характеризуется метаболическими нарушениями, преимущественно со стороны энергетического (дефицит макроэргических соединений) и углеводного (усиление гликолиза, увеличение концентрации молочной и пировиноградной кислот в сыворотке крови) обмена, развитием метаболического ацидоза.
Различают гипоксическую, гемическую, циркуляторную, тканевую (гистотоксическую) и смешанную формы гипоксии.
Гипоксическая гипоксия возникает вследствие снижения парциального давления кислорода во вдыхаемом воздухе или затруднения проникновения кислорода в кровь через дыхательные пути.
Гемическая гипоксия является следствием снижения количества эритроцитов в периферической крови или резкого понижения содержания гемоглобина в эритроцитах.
Циркуляторная гипоксия обусловлена нарушением функций сердечно-сосудистой системы (ослаблением работы сердца, спазмом сосудов) и ухудшением вследствие этого поступления кислорода к тканям.
Тканевая гипоксия возникает в связи с ухудшением утилизации кислорода при нарушениях процессов биол. окисления и связана с повреждением окислит, ферментных систем, мембранных структур клетки и др.
В ответ на гипоксию развивается адаптация, обусловливающая возможность нормальной жизнедеятельности организма в условиях хронического кислородного голодания. При истощении компенсаторных процессов, развивающихся при гипоксии, происходит срыв адаптации, сопровождающийся нарушением ряда физиологических функций и метаболических реакций. Гипоксия— ведущий патогенетический фактор повреждения плода и новорождённого при ряде акушерских и экстрагенитальных заболеваний беременных, обусловливающий высокую частоту перинатальной патологии, мертво-рождаемости и ранней детской смертности. Гипоксия наблюдается при поздних токсикозах беременных, приобретённых и врождённых пороках сердца, гипертонической болезни, заболеваниях лёгких (эмфизема лёгких, туберкулёз), крови (анемия), хронических инфекционных заболеваниях (токсо-плазмоз и др.), интоксикации химическими агентами, лекарств, препаратами, злоупотреблении алкоголем, курении.
Здоровый организм может оказаться в состоянии гипоксии, если потребность в кислороде (кислородный запрос) выше, чем возможность ее удовлетворить. Наиболее распространенными причинами возникновения такого состояния являются:
1.низкое содержание кислорода во вдыхаемом воздухе в условиях высокогорья;
2.временное прекращение или ослабление легочной вентиляции при нырянии на различную глубину;
3.возрастание потребности в кислороде при выполнении мышечной работы.
В первых двух ситуациях при сохраненной или даже сниженной потребности в кислороде уменьшается возможность его получения, тогда как при выполнении мышечной работы возможности обеспечения кислородом отстают от растущей потребности, связанной с повышенным расходом энергии.
При подъеме на гору (более 4,5 км) возникает горная болезнь как результат низкого парциального давления кислорода. Если человек быстро поднимается на высоту, то развивается острая гипоксия. В основе явления лежит гипервентиляция, возникающая в ответ на острую гипоксию (за счет возбуждения хеморецепторов каротидного синуса), но при этом наблюдается гипокапния, т. е. вымывание углекислого газа, и поэтому импульсация с центральных хеморецепторов резко снижается, что приводит к гипопноэ. У горцев снижена чувствительность к гипоксии, их периферические хеморецепторы снижают свою чувствительность к недостатку кислорода, т. е. наблюдается своеобразная гипоксическая «глухота». Поэтому у них МОД не возрастает, не создается снижение парциального напряжения углекислого газа. Есть, конечно, и другие механизмы, позволяющие горцам адаптироваться к таким условиям. Например, у них возрастает диффузионная способность легких, увеличивается кислородная емкость крови за счет роста содержания гемоглобина, повышается способность тканей экстрагировать кислород.
При подъеме в горы из-за падения атмосферного давления снижается парциальное давление кислорода в альвеолярном пространстве. Когда это давление снижается ниже 50 мм рт. ст. (5 км высоты), неадаптированному человеку необходимо дышать газовой смесью, в которой повышено содержание кислорода. На высоте 9 км парциальное давление в альвеолярном воздухе падает до 30 мм рт. ст., и практически выдержать такое состояние невозможно. Поэтому используется вдыхание 100% кислорода. В этом случае при данном барометрическом давлении парциальное давление кислорода в альвеолярном воздухе составляет 140 мм рт. ст., что создает большие возможности для газообмена. На высоте 12 км при вдыхании обычного воздуха альвеолярное давление = 16 мм рт. ст. (смерть), при вдыхании чистого кислорода — всего лишь 60 мм рт. ст., т. е. дышать еще можно, но уже опасно. В этом случае можно подавать чистый кислород под давлением и обеспечить дыхание при подъеме на высоту 18 км. Дальнейший подъем возможен только в скафандрах (при использовании автономного атмосферного давления).
Каротидные тельца
Каротидные тельца представляют собой парные скопления артериальных хеморецепторов, расположенных в области каротидного синуса около места разветвления сонной артерии на внутреннюю и наружную дугу, на задней стенке общей артерии. Происходят они из третьей редуцированной дуги сонной артерии и клеток нервного гребня. Функция каротидных телец сводится главным образом к обнаружению изменений парциального давления кислорода, а также косвенным образом углекислого газа, pH и температуры.
Содержание
Строение
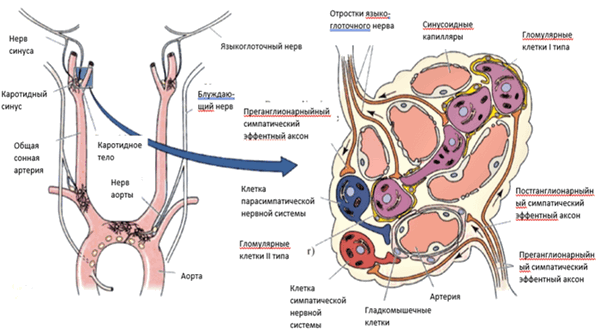
Каротидные тельца состоят из единиц - долек. Каждая долька состоит из двух типов клеток, называемых гломусными (гломерулярными), и иннервируется отростком языкоглоточного нерва.
Гломерулярные клетки I типа являются периферическими хеморецепторами, образуются из мигрировавших клеток нервного гребня, т.е. ведут происхождение из эктодермы. Они вызывают возбуждающий постсинаптический потенциал непосредственно на нервных волокнах, ведущих к дыхательному центру, выделяя нейромедиаторы, в т.ч. ацетилхолин, АТФ и дофамин. Кроме того, гломерулярные клетки электрически связаны друг с другом и с волокнами каротидного нерва Гломерулярные клетки II типа - поддерживающие клетки. Они напоминают глиальные клетки, экспрессируют белки - глиальные маркеры семейства S100. Каротидные тельца являются самыми васкуляризованными (т.е. обеспеченными кровеносными сосудами) органами в организме человека.
Функции
Каротидные тельца выполняют прежде всего хеморецепторную функцию, реагируя на понижение парциального давления О2 в крови. Оно обнаруживается клетками I типа, которые запускают потенциал действия в нервных окончаниях каротидной ветви глоссофарингеального (языкоглоточного) нерва, передающего его в ЦНС.
Механизмы рецепции
Хеморецепторы каротидного тельца, в отличие от центральных рецепторов продолговатого мозга, первично чувствительны к изменениям парциального давления (P) О2, а вторично к снижению pH и увеличению CO2. Выделение медиаторов хеморецепторами каротидных телец уменьшается при Р кислорода выше ~100мм. рт. ст. (при нормальном уровне pH), однако при насыщенности крови кислородом ниже 90% (Р О2 около 60мм. рт. ст.) быстро возрастает.
Механизмы обнаружения гипоксии
Механизм рецепции достоверно не определен, к тому же он может варьировать у разных видов. Однако доказано, что способ обнаружения снижения Р О2 связан с увеличением образования сероводорода ферментом цистатионин-гамма-лиаза. Это было показано в опытах на мышах, у которых данный фермент ингибировали фармакологическим путем. Цистатионин-гамма-лиаза взаимодействует с гемоксигеназой-2, производящей СО. Этот газотрансмиттер также может влиять на выделение нейромедиаторов. Падение уровня СО, возникающее вследствие гипоксии, приводит к закрытию кальций-активируемых калиевых каналов большой проводимости (BK-каналы), что приводит к деполяризации мембран и активации хеморецепторов. Теоретически, роль датчика гипоксии может принадлежать цитохром-с-оксидазе, которая также в норме при реакции с О2 образует СО. Согласно другой гипотезе, обнаружение гипоксии может включать в себя митохондриальные кислородные датчики и гемсодержащие цитохромы. Последние, являясь крупными мембранными белками в т.ч. митохондрий (цитохром-с), играют роль окислителя в окислительном фосфорилировании. Гем цитохрома содержит железо с переменной валентностью и обратимо связывает кислород, т.о. перенося его с III на IV комплексы дыхательной цепи, при этом также превращая большинство опасных активных форм кислорода в воду. Предполагается, что гипоксия может приводить к увеличению количества активных форм кислорода, таких как перекиси, ионы и свободные радикалы, однако это все еще не известно достоверно. Иной механизм действия возможен для «энергетического датчика» АМФ-активируемой протеинкиназы (АМФК), т.к. этот фермент используется во время значительно повышенного уровня потребления энергии клеткой (при физической нагрузке) и метаболического стресса. Во время гипоксии АМФК, по-видимому, приводит к закрытию кальций-активируемых калиевых каналов и чувствительных к кислороду TASK-подобных каналов (закрывающихся при пониженном содержании кислорода, вызывая деполяризацию). При гипоксии повышается концентрация СО2, который при поступлении в клетку увеличивает количество угольной кислоты, следовательно, увеличивает концентрацию протонов. СО2 и низкий уровень pH снижают ток калия через TASK-подобные каналы, что может приводить к деполяризации и выбросу нейромедиаторов.
Потенциал действия
Описанные выше механизмы приводят, в большинстве случаев, к закрытию калиевых каналов, что вызывает деполяризацию. Уменьшение разности потенциалов открывает кальциевые каналы, повышая концентрацию кальция в клетке. Кальций вызывает экзоцитоз везикул, содержащих нейромедиаторы, в т.ч. ацетилхолин, норадреналин, дофамин, аденозин, АТФ, вещество Р и мет-энкефалин. Они взаимодействуют с рецепторами постсинаптического окончания языкоглоточного нерва, вызывая потенциал действия. Через глоссофарингеальный нерв сигналы от каротидных телец передаются в сердечно-сосудистый и дыхательный центры в продолговатом мозге. Таким образом гипоксия вызывает усиление работы сердца и легочной вентиляции.
Артериальные хеморецепторы
Читайте также:
