Электрофизиологические механизмы наркоза. Критические концентрации инертных газов
Добавил пользователь Cypher Обновлено: 28.01.2026
Представители группы "неэлектролитов"- многочисленные соединения разного химического строения, но с близкими физико-химическими свойствами. Это неполярные, хорошо растворимые в липидах вещества, инертные в химическом отношении, не диссоциирующие в воде с образованием ионов (отсюда и их название), при нормальных условиях представляющие собой летучие жидкости или газы. Основное свойство этих веществ - способность вызывать наркоз. Любой "неэлектролит" в той или иной степени обладает наркотической активностью. Некоторые представители группы широко используются в клинической практике, как общие ингаляционные анестетики (галотан, энфлуран, метоксифлуран и др). Подавляющее же большинство "неэлектролитов" применяются в промышленности (многочисленные органические растворители и т.д.), сельском хозяйстве и для них наркотическая активность лишь один из механизмов токсического действия при случайных или преднамеренных интоксикациях. Один из известнейших неэлектролитов - этиловый спирт, в течение многих столетий используется человеком с целью вызвать транзиторную токсическую реакцию - опьянение.
Группы веществ, обладающих наркотической активностью и их отдельные представители, приведены в таблице 13.
Таблица 13. Химическая классификация веществ, обладающих наркотической активностью
| 1. Инертные газы: - ксенон - азот, криптон, аргон, неон - под повышенным давлением 2. Неорганические оксиды: - закись азота 3. Алифатические углеводороды: - метан, н-гексан - этилен, амилен - ацетилен, кротонилен 4. Циклические углеводороды: - циклопропан, циклобутан, бензол - ксилол 5. Эфиры: - диэтиловый, дивиниловый, этилвиниловий 6. Спирты: - метанол, этанол, пропанол - этиленгликоль 7. Галогенированные углеводороды: - четыреххлористый углерод, дихлорэтан, хлороформ, этилхлорид - галотан (CF3CHBrCl), норфлюран (CF3CH2F) 8. Галогенированные эфиры: - метоксифлюран, энфлюран, флюроксен 9. Другие: - сероуглерод |
Отравление "неэлектролитами" любого строения сопровождается быстрым развитием практически одинаковых эффектов. Это состояние, напоминающее опьянение, анальгезия, потеря сознания, подавление сенсорных и автономных рефлексов, кома, миорелаксация, угнетение дыхания и сердечной деятельности. Если интоксикация не приводит к гибели пострадавшего, практически все эффекты исчезают через непродолжительное время (часы) после прекращения действия токсикантов (особенно это справедливо при ингаляционном воздействии высоко летучих веществ). По выходе из тяжелого состояния наблюдается амнезия.
Очень часто в патологический процесс вовлекается не только ЦНС, но и другие органы и системы и не только в результате нарушения механизмов нейрорегуляции, но и вследствие "специфического" действия веществ или их метаболитов на печень, почки, сердечную мышцу, систему крови, легкие и т.д. Поэтому многие "неэлектролиты" в руководствах по токсикологии фигурируют как гепато-, нефро-, пульмонотоксиканты (см. соответствующие разделы). Наконец, на нервную систему, помимо седативно-гипнотического, некоторые "неэлектролиты" оказывают и иное действие, связанное с нарушением пластических и биоэнергетических процессов в нервной ткани, что приводит к развитию порой тяжелых энцефало- и нейропатий. Эти эффекты развиваются вслед за периодом неэлектролитного действия и составляют вторую, отсроченную, порой длительно текущую, фазу интоксикации.
За более чем полуторовековую историю изучения состояний наркоза, опьянения и т.д. для объяснения угнетающего действия на ЦНС (и вообще возбудимые ткани) веществ с совершенно различным строением, но обладающих общностью физико-химических свойств, были предложены самые разнообразные физиологические, биохимические и физико-химические механизмы. Некоторые гипотезы механизма действия веществ суммированы в таблице 14.
Таблица 14. Основные гипотезы механизма действия "неэлектролитов" (наркотиков)
| Год | Краткое название | Авторы |
| Растворение клеточного жира Экхимоз клеточных мембран Индурация клеточной стенки Полукоагуляция протоплазмы Корреляция с растворимостью в воде Корреляция с растворимостью в липидах Стабилизация "льдоподобной" структуры тканевой воды Гипотеза критического объема клеточных мембран Специфическое взаимодействие с белками-мишенями | von Bibra Harles Faure, Sansom Bernard Richet Meyer, Overton Pauling, Miller Lever et al Franks, Lieb |
Установлено, что все рассматриваемые токсиканты действуют на клетки, изменяя свойства возбудимых мембран и электрон-транспортных мембран митохондрий. Наиболее чувствительными оказываются нейроны ЦНС.
В классических исследованиях H. Meyera (1899), Overtona (1896), K. Meyera (1937), Н.В. Лазарева (1938) было установлено, что наркотическая активность веществ прямо пропорциональна величине их коэффициента распределения в среде масло/вода (степень гидрофобности молекулы) (смотри, в частности, данные, представленные на таблице 15). Это дало основание сформулировать правило Овертона-Мейера: "Наркоз развивается, когда любое химически инертное вещество накапливается в липидной клеточной мембране в определенной молярной концентрации". В качестве подтверждения справедливости этого правила к настоящему время приведено огромное количество фактов.
Таблица 15. Характеристика наркотической активности некоторых химических веществ (в опытах на мышах)*
| Вещество | Коэффициент (масло/вода) | Эффективная концентрация (объемные %) |
| метан этилен оксид азота пентан диэтиловый эфир хлороформ | 0,54 1,3 1,4 | 13,2 3,4 0,5 |
* По данным Meyer, Gotlier, 1926
Вместе с тем до настоящего времени не получены исчерпывающие ответы на вопросы, без которых не возможно говорить о раскрытии механизмов действия неэлектролитов:
1. Какова степень избирательности действия наркотиков на различные отделы нервной системы; какие структуры наиболее чувствительны к веществам?
2. Какова степень избирательности действия наркотиков на различные части нейрона?
3. Какие механизмы синаптической передачи нервного импульса прежде всего нарушаются?
4. Каковы молекулярные механизмы действия неэлектролдитов?
Общая характеристика феномена содержится в современной версии теории "распределения" Овертона-Мейера, согласно которой биологический эффект (угнетение ЦНС) развивается, когда концентрация вещества в липидной мембране нейрона достигает 40 - 60 мМ (мМ/кг сухого веса мембраны). При этом постулируется, что молекулярные сайты действия любого анестетика представляют собой либо с липиды, формирующие клеточные мембраны, либо гидрофобные участки белковых молекул, являющихся компонентами этих биомембран. Такие представления позволяют объяснить, почему наркотическая активность веществ возрастает при понижении температуры тела человека или экспериментального животного (примерно на 8% на градус). Снижение температуры увеличивает растворимость веществ в гидрофобной фазе и, вследствие этого, требуется меньшее количество токсиканта, для того, чтобы создать в критической области необходимую его концентрацию.
Однако интимные механизмы взаимодействия неэлектролитов с мембранами остаются не известными.
Так, как уже сказано, гидрофобными сайтами мембраны, которые взаимодействуют с неэлектролитами, могут быть как липиды, так и участки белковых молекул. Белки непосредственно контролируют функции возбудимых мембран (ионные токи, высвобождение нейромедиаторов, свойства рецепторов), в то время как физико-химические свойства окружающих липидов, влияют на активность белков. Существует большое количество исследований, в которых доказывается значение действия "неэлектролитов" именно на липиды. Липиды находятся в постоянном тепловом движении (флюидность мембраны). Показано, что растворение в биомембране неэлектролита приводит к увеличение её текучести, что, по мнению авторов, должно сказываться на функциональных свойствах мембраны в целом.
Альтернативные представления связаны с объяснением действия веществ путем их взаимодействия с определенными белковыми молекулами. В качестве таких молекул предлагаются белки особого строения (pocket-proteins; модельный белок - люцифераза,) с неизученными пока функциями, белки-регуляторы состояния натриевых каналов, холинорецепторные протеины и рецепторы ГАМК.
Ни одно из представлений не является в настоящее время окончательно доказанным. Исследователи приходят к выводу, что, по-видимому, оба механизма (действие на липиды и действие на белки) играют свою роль, а относительная значимость обратимого взаимодействия анестетика с каждым из компонентов биологической мембраны вероятно неодинакова для токсикантов с различным строением и для различных биологических мембран.
Согласно гипотезе, "критического объема" - наркоз наступает тогда, когда объем возбудимых мембран нервных клеток увеличивается примерно на 0,4% вследствие накопления в них химически инертных молекул. Доказательством справедливости этой гипотезы являются данные, полученные при прямом измерении концентрации молекул токсиканта (например, летучего анестетика) в мембранах эритроцитов при воздействии эффективных доз. Эта гипотеза подтверждается и данными Миллера и Вильсона (1978), согласно которым при действии на экспериментальное животное, находящееся в состоянии наркоза, высокого барометрического давления (более 10 атмосфер) можно восстановить его сознание. Барометрическое давление "уплотняет" мембраны, возвращая их к исходному объему. В развитии этого представления сформулирована гипотеза, согласно которой неэлектролит избирательно накапливается в ограниченном количестве сайтов мембран определенного строения и именно здесь реализует свое действие, при этом изменяется объем мембраны, свойства липидов и активность вполне конкретных белков.
В настоящее время хорошо известно, что общие анестетики (наркотики, "неэлектролиты") в действующих дозах угнетают передачу нервного импульса в синапсах, при этом проводимость по нервным волокнам не изменяется. Однако не ясно, какой из процессов, высвобождения нейромедиатора или его взаимодействие с рецептором постсинаптической мембраны, страдает в большей степени. Не ясно и какие синапсы, возбуждающие или тормозные более чувствительны к действию токсикантов. В некоторых исследованиях показана способность этанола устранять судороги, вызываемые пикротоксином и бикукуллином. Авторы (Hunt, 1983 и др.) утверждают, что эти и другие данные являются доказательством избирательности действия этилового спирта на ГАМК-рецепторы.
Электрофизиологические исследования головного мозга животных, подвергшихся действию неэлектролитов, позволили выявить структуры, наиболее чувствительные к токсикантам. Ими оказались образования вентробазального таламуса и нейроны V слоя коры головного мозга. Эти данные позволили предположить, что нейрофизиологическим механизмом седативно-гипнотического действия токсикантов является угнетение гипотетической кортико-таламической и ретикулярно-таламической нейронной петли, функция которой состоит в контроле реактивности вентробазальных клеток таламуса - основного релейного образования мозга, ответственного за восприятие сенсорных сигналов (Angel, 1984).
Таким образом, не смотря на многочисленные исследования, большое количество полученных данных, широкое использование феномена в медицинской практике, представления об интимных процессах, лежащих в основе седативно-гипнотического эффекта все еще требуют уточнения.
Острое поражение бензолом приводит к нарушению функций ЦНС, проявляющемуся возбуждением, сменяющимся угнетением сознания, комой, смертью от остановки дыхания, сердечной деятельности и сосудистого коллапса. Бензол в полной мере проявляет свойства "неэлектролита". При действии вещества в концентрации 20000 ррм смерть развивается в течение нескольких минут. Кратковременное воздействие меньших доз (3000 - 10000 ррм) сопровождается эйфорией, головокружением, головной болью, тошнотой, рвотой, потерей сознания. Отмечается выраженная индивидуальная чувствительность к токсиканту. Важным фактором, определяющим тяжесть поражения, является продолжительность действия. Ингаляция паров бензола в концентрации 7500 ррм в течение 30 мин. представляют угрозу для жизни; - 1500 ррм в течение 60 мин. приводит к тяжелой интоксикации; - 50 - 150 ррм в течение 5 часов сопровождается головной болью и слабостью; - 25 ррм в течение 8 часов не вызывает отчётливых симптомов интоксикации.
При несмертельных формах поражения нормализация состояния проходит быстро и как правило является полной. Эффекты, развивающиеся в результате специфического действия бензола, проявляются позже (см. соответствующие разделы).
Для военных формирований, участвующих в ликвидации последствий аварий с заражением территории бензолом, рекомендуемые предельные уровни воздействия составляют: 1000 ррм - в течение 10 минут, 500 ррм - в течение 30 минут, 300 ррм - в течение часа.
Таблица 16. Концентрация этанола в крови человека и соответствующие проявления интоксикации
| Концентрация этанола в крови (г/л) | Клинические проявления |
| 0,20 - 0,99 | Легкое изменение настроения, эйфория, прогрессирующее нарушение координации движений, расстройство сенсорных функций, нарушение поведения. |
| 1,00 - 1,99 | Отчетливые нарушения умственной активности, нарушение координации движений вплоть до атаксии |
| 2,00 - 2,99 | Углубление атаксии, тошнота, рвота, диплопия |
| 3,00 - 3,99 | Гипотермия, 1 стадия наркоза, по выходе из состояния - амнезия |
| 4,00 - 7,00 | Кома, нарушение дыхания, смерть |
Этиловый спирт полностью абсорбируется из желудочно-кишечного тракта в течение 30 - 120 минут после приема. Абсорбция осуществляется путем простой диффузии. После распределения вещество накапливается преимущественно в водной фазе организма. Однократный прием 15 г этилового спирта мужчиной массой 70 кг приводит к появлению в его крови этанола в концентрации 0,3 г/л. Этиловый спирт легко преодолевает гистогематические барьеры, в том числе гематоэнцефалический и плацентарный.
Метаболизм этанола в основном осуществляется в печени. Под влиянием алкогольдегидрогеназы, альдегиддегидрогеназы, каталазы и цитохром-Р-450-зависимых оксидаз вещество превращается сначала в уксусный альдегид, а затем уксусную кислоту, утилизирующуюся клетками организма. Элиминация спирта осуществляется с постоянной скоростью 0,1 - 0,2 г/л крови в час, т.е. подчиняется кинетике нулевого порядка (нелинейная кинетика).
В малых дозах вещество вызывает появление транзиторной токсической реакции, известной как состояние опьянения. Даже легчайшие формы опьянения сопровождаются снижением скорости мышления, нарушением реакции на внешние раздражители, быстрым утомленим.
При действии в более высоких дозах развивается классический "неэлектролитный" эффект (см. выше). При крайне тяжелых формах отравления может наступить смерть от остановки дыхания и сердечной деятельности
Медицинские мероприятия при оказании помощи направлены на прекращение всасывания алкоголя из желудочно-кишечного тракта, ускорение его элиминации, нормализацию функций сердечно-сосудистой и дыхательной систем, коррекцию метаболических нарушений. Антидотов этанола, как и других "неэлектролитов", не существует.
Механизм действия инертного газа ксенон на организм человека
За последнее десятилетие достигнут значительный прогресс в понимании механизмов биологического действия ксенона. Большое количество потенциально положительных свойств и отсутствие объективных данных о возможных побочных эффектах способствовали организации, как в нашей стране, так и за рубежом масштабных доклинических и клинических исследований, открывших дорогу к использованию ксенона в различных областях медицинской практики. В статье рассматриваются основные теории, которые могут объяснять способность ксенона взаимодействовать с рецепторными комплексами человеческого организма.

Как и многие общие ингаляционные анестетики, ксенон способен взаимодействовать с различными рецепторами и ионными каналами, причём достигаемые этим эффекты зачастую дополняют друг друга 5. Тем не менее, вопрос о механизме взаимодействия инертного газа с этими самыми рецепторами до настоящего времени остаётся до конца неизученным. Существует две основные теории, которые могут объяснять способность ксенона взаимодействовать с мембранными рецепторными комплексами.
Молекулярная теория наркоза Полинга утверждает, что в основе механизма биологического действия ксенона лежит его способность формировать в нервной ткани микрокристаллы клатратного типа, блокирующие синаптическую передачу импульсов 6. Следует отметить, что эта гипотеза пытается объяснить неспецифический механизм действия всех общих анестетиков, а не только инертных газов. В случае с ксеноном теория Полинга имеет один существенный недостаток, связанный с тем фактом, что клатраты ксенона при атмосферном давлении сохраняют устойчивость лишь при температуре ниже 24°С [9,10]. Возможность их образования in vivo является предметом дальнейших дискуссий 13.
Овертон-Мейеровская липоидная теория объясняет биологические эффекты инертного газа высокой растворимостью в липидах клеточных мембран, что значительно изменяет их проницаемость для ионов и тормозит возбудимость. Считается, что растворение анестетика в липидном бислое клеточной стенки вызывает перераспределение мембранного бокового давления, под которым понимается характерный для каждой клетки профиль организации фосфолипидной стенки [14,15]. Большинство мембранных белков, а особенно ионные каналы, крайне чувствительны к изменениям бокового давления, поскольку это вызывает конформационные изменения в структуре трансмембранных белковых комплексов 18. Этот механизм достаточно неспецифичен, поскольку способность анестетика оказывать биологическое действие определяется не его химическими свойствами, а характерным положением в клеточной мембране и строением конкретного типа рецепторов [15]. Данная теория подтверждается в работах Booker R.D., который объясняет гипнотические свойства инертного газа ксенона высокой его растворимостью в фосфолипидном слое, приводящей к изменениям конформации субъединиц ионных каналов, что существенно нарушает их проницаемость [1].
Наибольшее количество работ посвящено способности ксенона ингибировать глутаматергическую передачу. Глутаминовая кислота - основной возбуждающий нейротрансмиттер ЦНС, который реализует своё действие посредством активации ионотропных и метаботропных рецепторов, что приводит к открытию в них катионселективного канала и поступлению Са2+ и Na+ внутрь клетки. Ионы кальция активируют протеинкиназу CaMK-II, что становится причиной фосфорилирования ряда белков нейрона-реципиента. Этот процесс играет ключевую роль в регуляции нейрональной возбудимости и синаптической пластичности [19, 20, 246, 356]. Наибольшая плотность глутаматных рецепторов отмечается в конечном мозге, прежде всего, в гиппокампе, коре больших полушарий, миндалине и стриатуме, т.е. именно в тех структурах, которые ответственны за память, обучение, эмоциональные реакции, а также ассоциированы с сенсорной функцией [141, 231, 331].
Перевозбуждение нейронов при интенсивном воздействии глутамата сопровождается переходом нормально функционирующих клеток в состояние эпилептиформной активности [19, 227, 344, 345]. Длительная избыточная активация NMDA-рецепторов приводит к патологическому повышению внутриклеточной концентрации кальция и запускает необратимые изменения (активация Ca-зависимых протеаз, эндонуклеаз, фосфолипаз), ведущие к гибели нейронов [34, 345]. Данный процесс известен как эксайтотоксичность, и он играет определённую роль в патогенезе различных нейродегенеративных заболеваний: рассеянного склероза, болезни Альцгеймера, амиотрофического латерального склероза и др. [313, 314, 343].
В последние годы появляется всё больше доказательств прямого участия глутаминовой кислоты и рецепторов к ней в функционировании различных периферических органов, что позволяет рассматривать глутамат не только как нейротрансмиттер, но и более широко - как распространённый цитокин, способный воздействовать на клеточную активность в различных типах тканей [65, 208, 225, 229, 266, 309].
Так, показана экспрессия NMDA-, AMPA- и каинатных рецепторов в клетках островков Лангерганса поджелудочной железы [208, 295, 350], где они участвуют в межклеточном взаимодействии, регулируя секрецию глюкагона и инсулина. Методами гибридизации in situ и полимеразной цепной реакции показана экспрессия AMPA- и NMDA-рецепторов в клетках мозгового вещества надпочечников, где они являются одним из факторов стимуляции выброса катехоламинов в условиях стрессорного воздействия [65, 268, 362, 416]. В периферической нервной системе ионотропные глутаматные рецепторы участвуют в механизмах ноцицепции [204, 239, 309]. Помимо этого, рецепторы глутаминовой кислоты обнаружены в сердце [265, 266], печени [265, 400], лёгких [244, 377]. Функционально активные NMDA-рецепторы обнаружены в тромбоцитах [262], а также доказано их участие в регуляции мегакариоцитопоэза [262, 287].
В ряде работ показано, что антагонисты глутаминовой кислоты способны ингибировать пролиферацию опухолевых клеток [374, 397, 421]. Антагонисты AMPA- и NMDA-рецепторов оказывают концентрационно-зависимый антипролиферативный эффект на клетки опухолевых линий различного происхождения (тиреоидной карциномы человека, карциномы легкого, аденокарциномы толстой кишки, карциномы молочной железы и т.д.), проявляемый в снижении темпов клеточного деления и увеличении процента мёртвых клеток. Более того, антагонисты ионотропных глутаматных рецепторов ингибируют миграцию и вызывают морфологические изменения опухолевых клеток, а также усиливают противоопухолевые действие цитостатических препаратов в малых концентрациях [65, 374].
В настоящее время установлено, что ксенон является неконкурентным антагонистом NMDA-рецепторов [240, 271, 281, 282, 353, 364]. При концентрации 80% инертный газ более чем на 60% подавляет возбуждающие постсинаптические токи, вызванные активацией NMDA-рецепторов в нейронах гиппокампа [260]. При этом сколь-нибудь существенного влияния ксенона на AMPA- или каинатные рецепторы, а также на ГАМКергические синапсы первоначально выявлено не было [243, 260, 261 ]. Тем не менее, исследования, проведённые в последние годы, свидетельствуют о том, что ксенон способен ингибировать все типы ионотропных глутаматных рецепторов примерно в одинаковой степени [247, 281, 353, 364, 418]. Именно с блокадой AMPA-рецепторов в префронтальной коре головного мозга и спинном мозге некоторые исследователи связывают анестетические и нейропротективные свойства инертных газов [282, 418], в то время как блокада NMDA-рецепторов, помимо снижения обмена веществ и модуляции болевых сигналов, обусловливает различные изменения состояния сознания, когнитивных функций и эмоционального статуса [195, 241, 282].
В отличие от большинства других общих анестетиков, ксенон, по-видимому, не оказывает существенного влияния на ГАМКергическую передачу. Следует отметить, что γ-аминомасляная кислота (ГАМК), как и глицин, являются основными ингибиторными нейротрансмиттерами ЦНС. Все основные эффекты ГАМК-агонистов (например, бензодиазепинов) - седативный, анксиолитический, противосудорожный, миорелаксирующий, - реализуются именно путём активации ГАМКА-рецепторов [107, 183].
Хотя большинством авторов высказываются сомнения в способности инертных газов оказывать стимулирующее влияние на ионотропные ГАМК-рецепторы или потенцировать действие γ-аминомасляной кислоты в ЦНС млекопитающих [240, 260, 367, 378], тем не менее, некоторые исследования, проведённые в последние годы, указывают на незначительную (~15%) активацию ксеноном ГАМКА-рецепторов [21, 279, 420].
Существенный интерес представляют данные исследований, свидетельствующие о способности ксенона значительно (~65%) подавлять активность серотониновых рецепторов 5-HT3 типа [232, 404]. Хотя физиологическая роль указанных рецепторов до настоящего времени остаётся не вполне ясной, тем не менее, их активация селективными агонистами вызывает возбуждение нейронов рвотного центра, расположенного в продолговатом мозге, повышение тревожности, судорожную активность, а также способствует проведению ноцицептивной импульсации [202, 264, 371].
Как и закись азота, ксенон является агонистом двупоровых калиевых каналов TREK-1 [274, 357], которые контролируют возбудимость клеток и влияют на длительность, частоту и амплитуду потенциала действия, модулируют повторную активность и принимают участие в механизмах обучения и памяти [77, 78]. Их активация ведёт к гиперполяризации мембраны, тогда как их подавление - к деполяризации. Ингибирование двупоровых калиевых каналов является одним из механизмов действия серотонина, норадреналина, глутамата и других лигандов, увеличивающих нейрональную возбудимость [78, 267, 357].
Все инертные газы, а в особенности газовые смеси на основе ксенона, способны подавлять активность цитоплазматической Ca2+-АТФазы (PMCA), связываясь с гидрофобным участком молекулы фермента, тем самым препятствуя её конформации [258, 323, 368, 390].
PMCA является ключевым звеном в системе активного транспорта ионов кальция и обеспечивает значительный градиент концентрации Ca2+ внутри клетки и снаружи. В нейрональных тканях фермент принимает участие в регуляции синаптической активности. Блокада фермента приводит к нарушению проведения нервного импульса и препятствует высвобождению нейромедиатора из везикул [223, 245].
Снижение активности Ca2+-АТФазы в гладких мышцах стенок кровеносных сосудов приводит к повышению концентрации внутриклеточного кальция, а поскольку ионы Ca2+ запускают механизм мышечного сокращения, закономерно увеличивается тонус сосудистой стенки, что обусловливает повышение системного артериального давления [245, 407].
В быстропролиферирующих тканях блокада PMCA может стимулировать апоптоз, что представляет определённые перспективы при разработке новых методов терапии ряда онкологических заболеваний [296, 317].
Ряд отечественных и зарубежных исследователей указывают на способность ксеноно-кислородных газовых смесей блокировать Н-холинорецепторы (nAChR) α4β2-типа [49, 320, 346]. Хотя физиологическая роль данных ионных трансмембранных каналов в настоящее время изучена недостаточно, тем не менее, отмечается, что они широко представлены в центральной нервной системе, где они участвуют в процессах синаптической пластичности и, в некоторой степени, определяют уровень нейрональной возбудимости. Кроме того, nAChR данного типа определяются в автономных ганглиях ЦНС, а их стимуляция способствует изменению нейровегетативного баланса с тенденцией к преобладанию активности симпатического звена нервной регуляции [218, 275].
Было отмечено, что проведение ксеноновой анестезии практически никак не сказывалось на выраженности послеоперационного воспалительного процесса. Исследователями наблюдалось лишь незначительное снижение активности фагоцитоза, однако, никакого существенного влияния на клетки системы мононуклеарных фагоцитов выявлено не было [255].
Особый интерес представляют данные, свидетельствующие о способности ксенона повышать активность индуцируемого гипоксией фактора 1α (HIF-1α) в различных культурах клеток, при длительной их экспозиции в газовой среде, состоящей из 70% Хе и 30% О2 [320, 327, 372]. Указанный факт потенциально обладает высокой клинической значимостью, поскольку транскрипционный фактор HIF-1α стимулирует синтез большого количества белков, включая фактор роста сосудистого эндотелия (VEGF) и эритропоэтин, которые, в свою очередь, повышают устойчивость организма к гипоксии, стимулируют кроветворение и ангиогенез [316, 388, 398, 399]. С одной стороны, это обусловливает повышение устойчивости организма к экстремальным физическим нагрузкам и защитные свойства HIF-1α при ишемических заболеваниях миокарда, головного мозга и других органов, с другой стороны, в различных условиях HIF-1α может, как потенцировать неконтролируемую пролиферацию клеток, так и обеспечивать их гибель, посредством активации экспрессии р53 гена - мощного индуктора апоптоза и супрессора опухолевых клеток [197, 224, 320, 388].
Хотя стимуляция экспрессии HIF-1α при ингаляции таких анестетиков как изофлуран, севофлуран и ксенон подтверждена многочисленными исследованиями, тем не менее, величина этой активации сильно зависит от концентрации газа во вдыхаемой смеси, длительности экспозиции и выраженности сопутствующей гипоксии. При этом в случае с ксеноновым наркозом экспрессия HIF-1α, по ряду свидетельств, не сопровождается увеличением активности протеинкиназы mTOR, а потому способность инертных газов оказывать положительное влияние на пролиферацию культур клеток не наблюдалось [389, 423]. Более того, в работах Ash S.A. показана способность ксенона in vitro препятствовать размножению опухолевых клеток и снижать активность факторов ангиогенеза, благодаря механизмам ингибирования NMDA-рецепторов [200, 201].
Таким образом, за последнее десятилетие достигнут значительный прогресс в понимании механизмов биологического действия ксенона. Большое количество потенциально положительных свойств и отсутствие объективных данных о возможных побочных эффектах способствовали организации, как в нашей стране, так и за рубежом масштабных доклинических и клинических исследований, открывших дорогу к использованию ксенона в различных областях медицинской практики.
Технология проведения низкопоточной газовой анестезии
Аспекты низкопоточной анестезии активно обсуждаются специалистами на протяжении последних десятилетий. Интерес к данной проблеме появился вновь благодаря развитию новых технологий. Привлекает внимание исследователей и такие факторы низкопоточной анестезии, как экономичность, физиологичность и экологичность.
В последнее время в медицине стали использоваться весьма эффективные парообразные анестетики: десфлюран, изофлюран, севофлюран, этран. Появился и ксенон (медицинский) — газообразный анестетик последнего поколения. В связи с этим, применение высокопоточной анестезии, которая традиционно использовалась в медицинской практике, стало нецелесообразным.
Тем не менее повсеместное внедрение низкопоточной анестезии в российских клиниках осложняется из-за отсутствия современной наркозно-дыхательной техники. Как выяснилось, в нашей стране не производятся наркозные аппараты, которые могли бы обеспечить проведение анестезиологических мероприятий по минимальному газовому потоку. Справедливости ради стоит отметить, что и импортное наркозное оборудование не может обеспечить проведение анестезии с применением ксенона.
Согласно статистическим данным, в российских лечебных учреждениях за год проводится более 3 млн анестезий, большая часть из которых выполняется с использованием высокопоточных технологий, что крайне расточительно как в экономическом плане, так и нецелесообразно экологически. Более того, данный метод по своей сути противоречит физиологии человека. К тому же, большинство российских анестезиологов не владеют основами низкопоточной анестезии.
Рис. 1 Анестезиологическая рабочая станция Aisуs CS2
Немного истории
Попытки применения полностью закрытого контура в ходе анестезии предпринимались медиками уже давно, когда наркозные аппараты были далеки от совершенства. Но в полной мере оценить достоинства низкопоточного метода врачи смогли только в 70-ые годы прошлого века, с появлением более совершенного наркозного оборудования и технических средств, позволяющих осуществлять интраоперационный контроль концентрации парообразных и газовых анестетиков.
В нашей стране газовую анестезию по закрытому контуру впервые стал применять Т. М. Дарбинян, выполняя операции на сердце у детей, но более широкое использование метод получил спустя годы, в конце 90-х, и только в тех клиниках, которые имели наркозно-дыхательные системы зарубежного производства.
Минимально-поточный наркоз ксеноном впервые вошел в отечественную практику в 1992 году. Его использовали в ГКБ имени С. П. Боткина доктора Н. Е. Буров и Д. А. Джабаров. Применение ксенона показало несостоятельность отечественных наркозных установок, адаптированных исключительно к высокопоточной анестезии. До 2003 года в России сертифицированных наркозных аппаратов, пригодных для использования ксенона, не было вообще. И только к концу 2003 года такая аппаратура стала применяться.
С появлением изофлюрана, сневофлюрана, десфлюрана и других галогеносодержащих анестетиков, в России стали внедрять, хоть и не очень активно, низкопоточную анестезию с использованием аппаратов, как правило, зарубежного производства. Но сертифицированной техники под ксенон среди них по-прежнему не было. В последнее время в отечественной медицине появились и успешно используются наркозные аппараты, рассчитанные на анестезию по закрытому контуру на основе 4-х жидких и 2-х газовых анестетиков.
Серийное производство подобных наркозно-дыхательных установок в России позволит существенно сократить техническое отставание от развитых зарубежных стран в области анестезии.
Виды дыхательного контура
На основании решения Международной комиссии по стандартизации, дыхательный контур может быть реверсивным и нереверсивным. Исходя из функциональных особенностей, он бывает:
- открытым;
- полуоткрытым;
- полузакрытым;
- закрытым.
К реверсивному контуру специалисты относят: полузакрытый, маятниковый и полностью закрытый, к нереверсивному — открытый и полуоткрытый.
Самой оптимальной для проведения низкопоточной анестезии у детей и взрослых считается циркуляционная система. Ее разновидности определяет величина потока свежего газа. Если газовый поток выше метаболической потребности в кислороде и степени поглощения прочих газовых анестетиков, то наркозная система функционирует по закрытому контуру. Если же поток свежей газовой смеси более чем в 1,5 раза превышает значение МВЛ, то циркуляционная система работает по полуоткрытому контуру, что препятствует накоплению углекислого газа даже при отсутствии адсорбера.
Величина газового потока определяет следующие разновидности анестезии:
- высокопоточная, с потоком газа более 6 л в минуту;
- среднепоточная, с потоком газа более 3 л в минуту;
- низкопоточная, с потоком газа более 1 л в минуту;
- минимальная, с потоком газа менее 1 л в минуту.
Анестезия может выполняться по закрытому контуру, если поток свежего газа и его поглощение имеют равные значения.
Фармакокинетика газов
В организме человека закись азота не подвержена метаболизму. С момента поступления в контур она в течение 20 минут поглощается тканями. По мере насыщения тканей закисью азота, ее дальнейшее поглощение снижается, и останавливается на уровне пологой кривой. Поглощение закиси азота тканями рассчитывается по специальной формуле.
Ксенон имеет более низкий коэффициент растворимости, чем закись азота, поэтому он поглощается тканями в три раза меньше. Организм человека состоит из неоднородных тканей, и коэффициент растворимости у них разный, поэтому точно рассчитать объем растворимого ксенона достаточно сложно. Например, у больного 10 кг жировой ткани. В ней может дополнительно раствориться до 1700 мл ксенона, общий объем газа в этом случае составит 8400 мл. Предположительно, для достижения концентрации ксенона до 70% пациенту весом 80 кг требуется примерно 8400 мл ксенона. Затем произойдет динамическая стабилизация уровня анестезии. Данного объема анестетика будет достаточно для поддержания хирургической стадии анестезии по закрытому контуру на 2-3 часа. При этом герметичность контура не должна быть нарушена. Важно также отсутствие открытой раневой поверхности. Создается ситуация, уникальная по своей сути, когда поступивший в организм пациента анестетик удерживается в нем при стабильной наркотической концентрации и участвует в многократной рециркуляции в закрытом контуре.
Элиминация ксенона происходит достаточно быстро. По истечении всего лишь 5-ти минут через легкие пациента выделяется до 95% всего ксенона, растворенного в организме. Больной пробуждается через 2-3 минуты после прекращения подачи газового анестетика.
Важно отметить, что фармакокинетика ксенона при низкопоточной анестезии требует дальнейшего изучения и уточнения, исходя из особенностей органов и тканей. Следует учитывать их выраженную, среднюю и низкую перфузию, разную степень растворимости газа в тканях, быстроту элиминации анестетика и период его посленаркозного действия.
Особенности низкопоточной газовой анестезии
По окончании обычной премедикации и интубации выполняют денитрогенизацию чистым кислородом, общий объем которого составляет 50-60 л, концентрация альвеолярного азота снижается до 0,5%. После денитрогенизации газовый ток кислорода устанавливают из расчета 4 мл на каждый килограмм массы тела больного. Газоток анестетика (закиси азота или ксенона) рассчитывают в четырехкратном повышении по отношению к газовому току кислорода.
Спустя 15 минут, уровень закиси азота составит 65-70%, и наступит стойкая наркотическая концентрация данного анестетика. При ксеноновой анестезии стойкая наркотическая концентрация этого вещества достигается намного быстрее. На это потребуется около 5-ти минут.
Достигнув стойкой наркотической концентрации анестетика, производят коррекцию газового потока до минимальных потоков под контролем фракционной концентрации кислорода во вдыхаемой газовой смеси. Его уровень не должен быть ниже 30%. Минимальный газовый ток сохраняется на протяжении всего периода анестезии. Минут за 15-30 до окончания хирургического вмешательства подачу ксенона прекращают, но подключают аппарат ИВЛ по закрытому контуру. После операции ксенон выводится из организма пациента с помощью чистого кислорода, который подается газотоком 3-4 л в минуту. Выдыхаемый ксенон поступает в специальный адсорбирующий блок, где он утилизируется. По истечении 2-3 минут после завершения подачи ксенона пациент приходит в сознание. Низкопоточная анестезия ксеноном обходится в десятки раз дешевле, чем среднепоточная анестезия.
Технические требования к наркозному оборудованию
Исходя из конструктивных особенностей, различают два вида респираторов, входящих в состав наркозных аппаратов ингаляционного типа:
- с непрерывной подачей газа;
- с прерываемой подачей газа.
Стоит отметить, что многие модели наркозного оборудования импортного производства не в состоянии обеспечить низкопоточную анестезию, если общий поток снижается до уровня 500 мл в минуту. Это обусловлено тем, что в период экспирации при недостатке газонаркотической смеси происходит подсасывание окружающего воздуха в дыхательный контур. Этим создается угроза опасного течения газовой анестезии.
В требованиях Международной Комиссии по стандартам отражено, что при эксплуатации респираторов обязательно нужно выполнять корректировку общего газового потока. Наркоз с применением ксенона становится при этом более дорогостоящим, поскольку используется большой объем газа. По этой причине экономически более выгодным будет такая наркозно-дыхательная установка, в которой предусмотрено поступление газа в дыхательный контур в период экспираторной фазы дыхательного цикла.

× Close
Механизмы действия и виды анестетиков
Анестетики разделяют на:
- Местные
- Общие:
а) ингаляционные - летучие жидкости и газы
б) неингаляционные (внутривенные)

Таблица 1
1. Местные анестетики
Местные анестетики обратимо снижают возбудимость чувствительных нервных окончаний и блокируют проведение афферентных импульсов в нервных стволах в зоне непосредственного применения, используются для устранения боли.
Первый препарат этой группы — кокаин, был выделен в 1860 г. Альбертом Ньюманом из листьев южноамериканского кустарника Erythroxylon coca. Ньюман, как многие химики прошлого, попробовал новое вещество на вкус и отметил онемение языка. Профессор Военно-медицинской академии Санкт-Петербурга Василий Константинович Анреп в 1879г. подтвердил способность кокаина вызывать анестезию. В экспериментах на лягушках он обнаружил, что кокаин влияет «парализующим образом» на окончания чувствительных нервов. В. К. Анреп исследовал действие кокаина на себе: инъекция кокаина в дозе 1 — 5 мг под кожу сопровождалась полной анестезией — укол булавкой, прижигание тлеющей спичкой не вызывали боли. Аналогичный эффект наблюдался при закапывании раствора кокаина в глаз и нанесении его на слизистую оболочку языка.
Местные анестетики классифицируют на сложные эфиры (анестезин, дикаин, новокаин) и замещенные амиды (лидокаин, тримекаин, бупивакаин). Местные анестетики — сложные эфиры подвергаются гидролизу псевдохолинэстеразой крови и действуют в течение 30 — 60 мин. Их эффект пролонгируют антихолинэстеразные средства (прозерин). Продукт гидролиза — n-амино-бензойная кислота ослабляет бактериостатическое влияние сульфаниламидов. Замещенные амиды кислот инактивируются монооксигеназной системой печени в течение 2 — 3 ч. Бупивакин вызывает местную анестезию продолжительностью 3 — 6 ч, после ее прекращения длительно сохраняется анальгетический эффект.
С точки зрения практического применения анестетики подразделяют на следующие группы:
- Средства, применяемые для поверхностной (терминальной) анестезии: Кокаин, Дикаин, Анестезин, Пиромекаин
- Средства, применяемые преимущественно для инфильтрационной и проводниковой анестезии: Новокаин, Бупивакаин
- Средства, применяемые для всех видов анестезии: Лидокаин, Тримекаин
Местные анестетики представляют собой третичные азотистые основания. Они состоят из гидрофильной и липофильной частей, соединенных эфирной или амидной связями. Механизм действия определяет липофильная часть, имеющая ароматическую структуру. Для нанесения на слизистые оболочки и кожу и парентерального введения применяют водные растворы хлористоводородных солей местных анестетиков. В слабощелочной среде тканей (рН=7,4) соли гидролизуются с освобождением оснований. Основания местных анестетиков растворяются в липидах мембран нервных окончаний и стволов, проникают к внутренней поверхности мембраны, где превращаются в ионизированную катионную форму.
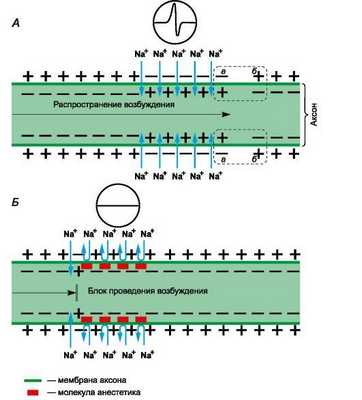
Рисунок 1 | Механизм действия местных анестетиков
Рецепторы для местных анестетиков локализованы в S6-сегменте IV домена внутриклеточной части натриевых каналов. Связываясь с рецепторами, катионы местных анестетиков пролонгируют инактивированное состояние натриевых каналов, что задерживает развитие следующего потенциала действия. Местные анестетики не взаимодействуют с закрытыми каналами в период потенциала покоя. Таким образом, в зоне нанесения местных анестетиков не развиваются потенциалы действия, что сопровождается блоком проведения нервных импульсов. Избирательное влияние местных анестетиков на чувствительные афферентные нервы обусловлено генерацией в них длительных (более 5 мс) потенциалов действия с высокой частотой.
В первую очередь местные анестетики блокируют безмиелиновые С и миелиновые Аδ и Аβ волокна (афферентные пути, проводящие болевые и температурные раздражения; вегетативные нервы). На волокна, окруженные миелиновой оболочкой, местные анестетики действуют в области перехватов Ранвье. Толстые миелиновые волокна (афферентные пути, проводящие тактильные раздражения; двигательные нервы) слабее реагируют на местные анестетики. Кроме того, устойчивость двигательных нервов к анестезии обусловлена низкочастотными короткими (менее 5 мс) потенциалами действия. В очаге воспаления в условиях ацидоза нарушаются диссоциация хлористоводородных солей местных анестетиков и образование их свободных липидорастворимых оснований, поэтому обезболивающее влияние утрачивается. Например, местная анестезия может оказаться неэффективной при удалении зуба в случае тяжелого периодонтита.
2. Общие анестетики
2.1. Ингаляционные анестетики
2.1.1 Летучие жидкости
Теории механизма действия общих анестетиков
Эффекты ингаляционных анестетиков не могут быть объяснены одним молекулярным механизмом. Скорее всего многокомпонентное действие каждого анестетика реализуется через множество мишеней. Тем не менее, эти эффекты сходятся на ограниченном числе изменений, лежащих в основе физиологических эффектов. На данный момент существуют липидная и белковая теории анестезии, но ни одна из них пока не описывает последовательность событий, происходящих от взаимодействия молекулы анестетика и ее мишеней до физиологических эффектов.

Рисунок 2 | Ингаляционные анестетики
Активность ингаляционных анестетиков оценивают по минимальной альвеолярной концентрации (МАК). Доза, создающая 1 МАК, предотвращает у половины пациентов движения в ответ на хирургическое вмешательство. Сила общих анестетиков коррелирует с их растворимостью в жирах, что говорит о важности взаимодействия с гидрофильными мишенями. В частности, обнаружение связи между силой анестетика и его липофильностью (правило Мейер-Овертона) дало начало липидной теории механизма действия анестетиков. Липидная теория анестезии утверждает, что анестетики растворяются в двойном липидном слое биологических мембран и вызывают анестезию, достигая критической концентрации в мембране. Наиболее усложненные версии липидной теории требуют, чтобы молекулы анестетиков вызывали пертурбацию (изменение свойств) мембраны.

Рисунок 3 | Правило Мейер-Овертона

Рисунок 4 | В 20 веке было показано, что сила общих анестетиков коррелируют с их способностью ингибировать активность растворимого фермента люциферазы, который физиологически не является мишенью анестетиков, но служит в качестве безлипидной модели белковой молекулы для связывания анестетика.
Современные факты позволяют утверждать, что белки в большей степени, чем липиды, являются молекулярными мишенями для действия анестетиков. Взаимодействие анестетиков с гидрофобными участками белков также объясняет правило Мейер-Овертона. Прямое взаимодействие молекул анестетиков с белками позволяет объяснить исключения из этого правила, так как любые участки связи с белком определяются как размером и формой молекулы, так и растворимостью. Многочисленные физические методы (рентгенодифракция, ЯМР-спектроскопия) подтверждают, что общие анестетики действуют путем непосредственного связывания с амфифильными полостями белковых молекул, а размер связанного участка объясняет эффект «обрубания» свойства (более длинные спирты теряют свойства анестетика).
Таким образом, общие анестетики изменяют физико-химические свойства липидов мембран нейронов и нарушают взаимодействие липидов с белками ионных каналов. При этом уменьшается транспорт в нейроны ионов натрия, сохраняется выход менее гидратированных ионов калия, в 1,5 раза возрастает проницаемость хлорных каналов, управляемых ГАМК-А рецепторами. Итогом этих эффектов становится гиперполяризация с усилением процессов торможения. Общие анестетики подавляют вход в нейроны ионов кальция, блокируя Н-холинорецепторы и NMDA-рецепторы глутаминовой кислоты; снижают подвижность Са 2+ в мембране, поэтому препятствуют кальций-зависимому выделению возбуждающих нейромедиаторов. Наиболее чувствительны к действию общих анестетиков полисинаптические системы ЦНС — кора больших полушарий (10 13 - 10 14 синапсов), таламус, ретикулярная формация, спинной мозг. К наркозу устойчивы дыхательный и сосудодвигательный центры продолговатого мозга.
Летучие ингаляционные анестетики:
- постсинаптически усиливают тормозящую передачу путем потенциирования лиганд-управляемых ионных каналов, активируемых ГАМК и глицином;
- экстрасинаптиески путем усиления ГАМК-рецепторов и ионных токов утечки;
- пресинаптически за счет повышения базального высвобождения ГАМК.
Ингаляционные анестетики подавляют возбуждающую синаптическую передачу путем снижения высвобождения глутамата и постсинаптически путем ингибирования ионотропных глутаматных рецепторов. Парализующий эффект местных анестетиков включает действие на спинной мозг, в то время как седация/наркоз и амнезия включают супраспинальные механизмы памяти, сна и сознания.
2.1.2. Газовый наркоз
В анестезиологии широко применяют ингаляционный газовый анестетик азота закись (N 2 O). В конце 1980-х гг. в зарубежную анестезиологическую практику вошел инертный газ ксенон.
Азота закись представляет собой бесцветный газ характерного запаха, хранится в металлических баллонах под давлением 50 атм в жидком состоянии, не горит, но поддерживает горение. Ее смеси с анестетиками группы летучих жидкостей в определенных концентрациях взрывоопасны. В субнаркотических концентрациях (20 — 30 %) азота закись вызывает эйфорию (веселящий газ) и сильную анальгезию. В концентрации 20 % обеспечивает обезболивание в такой же степени, как 15 мг морфина. Закись азота на ГАМК-А рецепторы не влияет. Используется только в комбинациях, так как МАК составляет 104 %.
Инертный газ ксенон считают лучшей альтернативой азота закиси, так как он обладает более выраженным наркозным действием, индифферентностью и экологической безопасностью. Способность ксенона вызвать наркоз была открыта в связи с практикой глубоководных погружений и развитием гипербарической физиологии. Ксенон бесцветен, не горит и не обладает запахом, при соприкосновении со слизистой оболочкой рта создает на языке ощущение горьковатого металлического вкуса. Отличается низкой вязкостью и высокой растворимостью в липидах, выводится легкими в неизмененном виде. Разработана технология ксенонсберегающей анестезии с включением минимального потока и системы рециклинга для повторного многократного использования газа. Такая технология успешно решает важную в практическом отношении проблему дефицита и дороговизны ксенона. В механизме наркозного эффекта ксенона имеют значение блокада циторецепторов возбуждающих нейромедиаторов — Н-холинорецепторов, NMDA-рецепторов глутаминовой кислоты, а также активация рецепторов тормозящего нейромедиатора глицина. При взаимодействии с циторецепторами ксенон выступает как протонсвязывающий кластер и образует комплексы с катионами НСО + , NH 2 + , HNCH + . Ксенон проявляет свойства антиоксиданта и иммуностимулятора, снижает выделение гидрокортизона и адреналина из надпочечников.
2.2. Неингаляционные (внутривенные) наркозные средства подразделяют на три группы:
Препараты короткого действия (3 — 5 мин)
- пропанидин (эпонтол, сомбревин)
- пропофол (диприван, рекофол)
Препараты средней продолжительности действия (20 — 30 мин)
- кетамин (калипсол, кеталар, кетанест)
- мидазолам (дормикум, флормидал)
- гексенал (гексобарбитал-натрий)
- тиопентал-натрий (пентотал)
Препараты длительного действия (0,5 — 2 ч)

Рисунок 5 | Общие анестетики для внутривенного введения
Наиболее широко используемым внутривенный анестетиком является пропофол. Его механизм действия связан с увеличение хлорной проводимости ГАМК рецепторов.
Метогекситал по скорости наступления и выхода из наркоза близок к пропофолу.
Барбитураты использовались для анестезии до введения в практику пропофола. Тиопентал вызывает быстрое наступление и быстрый выход из наркоза при разовом введении, но он быстро накапливается при повторном или пролонгированном введении и таким образом замедляет выход из анестезии. Барбитураты являются лигандами барбитуратных рецепторов. В малых дозах они аллостерически усиливают действие ГАМК на ГАМК А-рецепторы . При этом удлиняется открытое состояние хлорных каналов, возрастает вход в нейроны анионов хлора, развиваются гиперполяризация и торможение. В больших дозах барбитураты прямо повышают хлорную проницаемость мембран нейронов. Кроме того, они тормозят высвобождение возбуждающих медиаторов ЦНС — ацетилхолина и глутаминовой кислоты, блокируют АМРА-рецепторы (квисквалатные рецепторы ) глутаминовой кислоты. Барбитураты обладают церебропротективными свойствами и могут быть использованы с такой целью.
Бензодиазепины используются в основном как анксиолитики и для седации с сохранением сознания.Все бензодиазепиновые рецепторы аллостерически усиливают кооперацию ГАМК с ГАМК А-рецепторами, что сопровождается повышением хлорной проводимости нейронов, развитием гиперполяризации и торможения. Реакция с бензодиазепиновыми рецепторами происходит только в присутствии ГАМК. Ремимазолам - самый молодой бензодиазепин, имеет очень короткое время действия из-за быстрой нейтрализации эстеразами плазмы.
Кетамин химически является производным фенциклидина. Синаптические механизмы действия кетамина многообразны. Он является неконкурентным антагонистом возбуждающих медиаторов головного мозга глутаминовой и аспарагиновой кислот в отношении NMDA-рецепторов. Эти рецепторы активируют натриевые, калиевые и кальциевые каналы мембран нейронов. При блокаде рецепторов нарушается деполяризация. Кроме того, кетамин стимулирует освобождение энкефалинов и β-эндорфина; тормозит нейрональный захват серотонина и норадреналина. Последний эффект проявляется тахикардией, ростом АД и внутричерепного давления. Кетамин расширяет бронхи. При выходе из кетаминового наркоза возможны бред, галлюцинации, двигательное возбуждение (эти нежелательные явления предупреждают введением дроперидола или транквилизаторов).Важным терапевтическим эффектом кетамина является нейропротективный. Как известно, в первые минуты гипоксии мозга происходит выброс возбуждающих медиаторов — глутаминовой и аспарагиновой кислот. Последующая активация NMDA-рецепторов, увеличивая во внутриклеточной среде концентрацию ионов натрия и кальция и осмотическое давление, вызывает набухание и гибель нейронов. Кетамин как антагонист NMDA-рецепторов устраняет перегрузку нейронов ионами и связанный с этим неврологический дефицит.
Самым новым внутривенным анестетиком является дексмедетомидин. Это высокоселективный агонист а2-адренорецепторов с седативными, симпатолитическими, снотворными и анальгетическими эффектами. Его основное действие - в качестве агониста на а 2 рецепторы в голубом пятне.
Читайте также:
