Электростимуляция спинного мозга. Техника электростимуляции спинного мозга.
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
СПб ГБУЗ «Городская больница №40», Санкт-Петербург, Россия
СПб ГБУЗ «Городская больница №40», Санкт-Петербург, Россия;
ФГБОУ ВО «Санкт-Петербургский государственный университет», Санкт-Петербург, Россия
ФГБУН «Институт физиологии им. И.П. Павлова» РАН, Санкт-Петербург Россия;
ООО «Косима», Москва, Россия
Неинвазивная электрическая стимуляция спинного мозга в комплексной реабилитации больных со спинномозговой травмой
Журнал: Вопросы курортологии, физиотерапии и лечебной физической культуры. 2019;96(5): 11‑18
Проблема лечения больных, перенесших позвоночно-спинномозговую травму, является одной из самых сложных в системе нейрореабилитации. Такие пациенты психологически и/или экономически зависимы от своих близких и от социума, так как зачастую значительно ограничены в перемещениях и у них нарушено естественное функционирование жизненно важных систем организма [1, 2].
Многочисленные современные исследования продемонстрировали большие перспективы использования электрической стимуляции спинного мозга в двигательной реабилитации пациентов с отдаленными последствиями травмы спинного мозга. Доказано, что через несколько лет после травмы, после полного паралича, пациенты могут самостоятельно стоять, ходить после курса реабилитации с применением эпидуральной электрической стимуляции спинного мозга [3—5]. Доказано, что механизм действия эпидуральной и чрескожной электрической стимуляции спинного мозга (ЧЭССМ) единый [6]: ЧЭССМ также, как и эпидуральная электрическая стимуляция, может успешно применяться для восстановления двигательных функций пациентов, парализованных после травмы спинного мозга вследствие его полного моторного поражения [7—9].
Особенностью большинства предшествующих работ, показавших возможности электрической стимуляции спинного мозга в восстановлении произвольных движений и самостоятельного поддержания вертикальной позы, является то, что регулярные, часто ежедневные, стимуляционные воздействия и сопутствующие двигательные тренировки длились по 5—9 мес и все двигательные тренировки осуществлялись усилиями 2—3 методистов в присутствии физиолога или врача [4, 5, 10]. То есть впечатляющие результаты были достигнуты за длительный промежуток времени с привлечением большого числа специалистов. Фактически, подавляющее большинство работ в этой области — дорогостоящие научные исследования, проведенные в специфических экспериментальных условиях на селектированных в соответствии с требованиями конкретного исследования пациентах. Остается неясным, насколько вне ограничений и условий эксперимента эффективен курс электрической стимуляции спинного мозга для восстановления двигательной активности пациентов, перенесших травму спинного мозга.
Травма спинного мозга сопровождается не только двигательными нарушениями. Важным является оценка эффективности и безопасности процедур электрической стимуляции спинного мозга прежде всего для восстановления опорожнения мочевого пузыря, кишечника и половой функции у пациентов с травмой спинного мозга, так как наибольшие страдания спинальным пациентам приносят нарушения именно этих функций [11]. Ранее было показано, что стимуляция спинного мозга с параметрами, используемыми для восстановления двигательных функций, влияет на мочевыделительные функции [12, 13]. Недавно опубликованы результаты уродинамического исследования, показавшего, что у пациентов со спинномозговой травмой, не контролирующих функции мочевого пузыря, однократная ЧЭССМ на уровне позвонков Тh11—12 уменьшает гиперактивность детрузора, регулирует рассогласованность детрузора и сфинктера, увеличивает наполняемость мочевого пузыря и облегчает мочеиспускание [14]. Таким образом, можно ожидать, что краткосрочный курс электрической стимуляции спинного мозга, направленный на восстановление двигательной активности, может положительно влиять на реабилитацию выделительных функций.
Цель исследования — определить эффективность использования ЧЭССМ в сочетании со стандартной реабилитацией пациентов, перенесших спинномозговую травму. Дополнительная цель — оценить влияние ЧЭССМ на выделительные функции у пациентов со спинномозговой травмой.
Материал и методы
Исследования проведены на базе СПб ГБУЗ «Городская больница № 40». Цель, задачи и протокол исследования были одобрены научной проблемной комиссией (протокол № 142). От пациентов получено информированное письменное согласие на участие в исследовании.
Критерии включения в исследование: возраст от 18 лет, средне- и нижнегрудной уровень травмы, срок травмы более 9 мес, тяжесть травмы спинного мозга по шкале Американской ассоциации спинальной травмы (American Spinal Injury Association — ASIA) — В или С, тонус мышц нижних конечностей по модифицированной шкале Эшворта — 2 или 3 балла.
Критерии исключения: выраженные сопутствующие заболевания в стадии декомпенсации, повреждения кожных покровов в зоне расположения электродов, наличие нестабильности в элементах опорно-двигательного аппарата, психические заболевания.
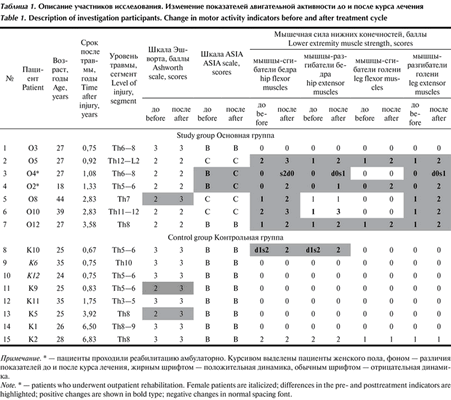
В исследовании приняли участие 15 пациентов со спинномозговой травмой в позднем периоде (табл. 1; Таблица 1. Описание участников исследования. Изменение показателей двигательной активности до и после курса лечения Примечание. * — пациенты проходили реабилитацию амбулаторно. Курсивом выделены пациенты женского пола, фоном — различия показателей до и после курса лечения, жирным шрифтом — положительная динамика, обычным шрифтом — отрицательная динамика. пациенты ранжированы внутри каждой группы по длительности периода после травмы). Все пациенты проходили стандартный курс восстановительного лечения. Восстановительный курс состоял из занятий лечебной физической культурой, механотерапии, в том числе роботизированной («Lokomat», Hocoma, Швеция), массажа, физиотерапии, выполняемых ежедневно, по 10 процедур на курс. Длительность исследования составила ~2 нед.
Основную группу (№№ 1—7 в табл. 1) составили пациенты, согласившиеся на проведение процедуры ЧЭССМ. Они получали стандартный курс терапии и процедуры ЧЭССМ. Пациенты контрольной группы (№№ 8—15 в табл. 1) получали только стандартное лечение.
Для ЧЭССМ применялся аппарат БиоСтим-5 (ООО «Косима»). Электроды (WFB02 QWER, Китай; BF4, LEAD-LOC, Inc., США) с адгезивным токопроводящим слоем фиксировали накожно. Стимулирующий электрод (катод) в виде диска диаметром 2,5 см располагали на средней линии позвоночника между остистыми отростками на 3 уровнях: С5—6, Th11—12 и L1—2. Индифферентные электроды (аноды) помещали симметрично над гребнями подвздошных костей. Стимуляция осуществлялась прямоугольными импульсами (монополярными и/или биполярными) длительностью 1 мс, заполненными несущей частотой 10 кГц. Величину тока подбирали индивидуально, чтобы он не был болезненным и в то же время вызывал сокращение мышц нижних конечностей. Диапазон амплитуды использованных токов составлял 30—120 мА. В течение процедуры величину тока постепенно увеличивали на 20—40 мА. Частота импульсов составляла 15—30 Гц. ЧЭССМ проводили одновременно с двигательной тренировкой на тренажере для активно-пассивной реабилитации верхних и нижних конечностей (Thera vital, «Medica Medizintechnik», Германия). Режим тренировки подбирали индивидуально в зависимости от функциональных способностей больных и поставленных реабилитационных задач. Также для улучшения статики использовали упражнения сидя на стуле, стоя в коленоупоре с постепенным уменьшением площади опоры. При выборе параметров стимулирующих воздействий ориентировались на результаты использования ЧЭССМ для регуляции локомоторных [8] и постуральных функций [10] у пациентов с вертебро-спинальной патологией.
Длительность комплексной процедуры составляла 30 мин, на курс 10 процедур, проводимых ежедневно 5 раз в неделю.
В оценке неврологического статуса пациентов до и после курса лечения применялись стандартные шкалы. Для определения тяжести спинальной травмы по показателям чувствительности и мышечной силы использовали шкалу ASIA/ISNCSCI (International Standards for Neurological and Functional Classification of Spinal Cord Injury — Международные стандарты неврологической и функциональной классификации повреждений спинного мозга). Для определения мышечной спастичности применяли шкалу Эшворта. Силу мышц-сгибателей и мышц-разгибателей бедер, голеней и стоп оценивали по 6-балльной шкале Британского совета медицинских исследований (Harrison scale) [15]. Также в состав стандартного неврологического осмотра входило определение уровня гипо- и анестезии, наличия глубокой чувствительности и мышечно-суставного чувства. Пациенты заполняли дневник мочеиспускания, в котором отмечали позывы к мочеиспусканию и его контроль. Количество остаточной мочи контролировали с помощью катетеризации мочевого пузыря или ультразвукового исследования. Все исследования проводили перед началом реабилитационного курса и сразу после его завершения.
Статистический анализ изменений мышечной силы и чувствительности проводили с использованием критерия Стьюдента и непараметрического критерия Вилкоксона, сравнивая значения для обеих ног пациента, не усредняя их. Различия между показателями считались статистически значимыми при р
Результаты
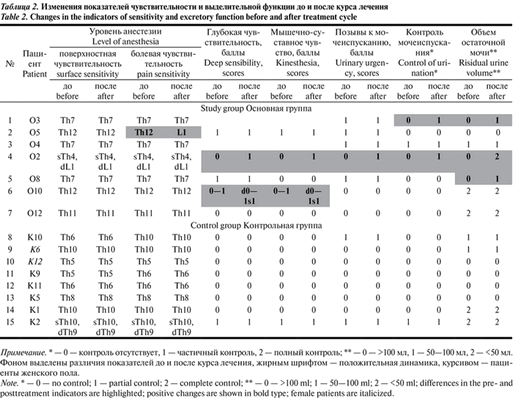
Средний возраст пациентов в контрольной группе составил 27,9±3,80 года, в основной группе — 29,9±8,07 года. Усредненный период после травмы 2,8±2,21 и 1,9±1,06 года в контрольной и основной группах соответственно. Статистически достоверных отличий между группами по этим параметрам нет. Показатели спастичности в контрольной и основной группах составили 2,7±0,39 и 2,1±0,35 балла по шкале Эшворта соответственно. Исходно по балльным оценкам мышечной силы, чувствительности, регистрируемым показателям мочевыделительной системы группы были однородны между собой, не имели статистически значимых различий (см. табл. 1 и 2). Таблица 2. Изменения показателей чувствительности и выделительной функции до и после курса лечения Примечание. * — 0 — контроль отсутствует, 1 — частичный контроль, 2 — полный контроль; ** — 0 — >100 мл, 1 — 50—100 мл, 2 —
В ходе проведения восстановительного лечения никакие нежелательные явления (болезни, травмы, незапланированные оперативные вмешательства и др.) не произошли. Отмечено увеличение спастичности на 1 балл в конце курса у 1 пациента из основной группы (О8) и 2 больных из контрольной группы (К5, К9).
По результатам исследования мышечной силы все пациенты основной группы, у которых в начале курса регистрировалась мышечная сила в нижних конечностях, отметили ее улучшение до 2—3 баллов (пациенты О5, О8, О10, О12), еще у 2 больных, у которых ранее отсутствовала мышечная активность в нижних конечностях, появилась мышечная сила до 2 баллов (пациенты О2, О4). Субъективно пациенты отмечали, что во время проведения процедуры ЧЭССМ им легче заниматься на тренажере, стоять или выполнять другие задания врача, они начали ощущать напряжение, работу мышц нижних конечностей, улучшилась их регуляция, что значительно повлияло на эмоциональный настрой пациентов и дальнейшую мотивацию к занятиям.
В контрольной группе у 1 пациента, у которого регистрировалась мышечная сила в начале курса, также отмечено ее увеличение до 2 баллов (пациент К10).
В контрольной группе изменение чувствительности после курса отмечено не было.
Прирост по шкале ASIA в основной группе составил от 1 до 8 баллов. Пациентам О2 и О4 переквалифицировали уровень и степень тяжести травмы по этой шкале с В на С (см. табл. 1).
Прирост по шкале ASIA в контрольной группе не превысил 1 балла.
После анализа дневников мочеиспускания, которые вели пациенты, было выявлено, что в основной группе у 1 из 3 больных, не контролировавших мочеиспускание, появились позывы к мочеиспусканию, также у него восстановился частичный контроль мочеиспускания (пациент О2). Еще у 1 пациента (О3) также появился частичный контроль мочеиспускания. В обоих случаях эффект ЧЭССМ на мочевыделительную функцию был отмечен после 3—5 процедур. В начале курса у 4 пациентов основной группы (О2, О3, О5, О8) количество остаточной мочи составляло более 100 мл. В конце курса ЧЭССМ у 2 пациентов (О3 и О8) после мочеиспускания оставалось от 50 до 100 мл мочи, а у 1 больного (О2) — менее 50 мл, что соответствует нормальным показателям и позволило ему реже катетеризироваться. В целом по группе различия анализируемых показателей мочевыделительной функции статистически недостоверны.
В контрольной группе анализируемые показатели мочевыделительной функции остались без изменений после курса лечения.
Основным результатом проведенного исследования является доказательство эффективности использования ЧЭССМ в двигательной нейрореабилитации. В результате проведенного курса лечения у ряда пациентов отмечалось улучшение двигательной и выделительной функций. Так, после 2-недельного курса ЧЭССМ в сочетании с двигательной терапией и стандартным курсом восстановительного лечения, состоящего из массажа, лечебной физической культуры, механотерапии, у 6 из 7 пациентов отмечено увеличение мышечной силы нижних конечностей, у 3 — улучшение показателей чувствительности. После завершения курса 2 пациентам степень тяжести травмы уменьшена с ASIA B до ASIA C.
Ранее проведенное исследование, в котором была использована ЧЭССМ в ходе короткого курса двигательной реабилитации, было направлено на изучение сочетанного влияния стимуляции спинного мозга и активации серотониновых рецепторов, поэтому в нем не было группы пациентов, которым не проводили стимуляцию [16]. Группу участников составляли как пациенты с травмой спинного мозга, так и больные с ятрогенной миелопатией, курс состоял из 16—17 получасовых процедур ЧЭССМ на фоне механотерапии, половина пациентов получали буспирон — агонист серотониновых рецепторов. В результате курса в среднем по группе было получено достоверное увеличение мышечной силы, чувствительности. Однако невозможно связать достигнутые после курса реабилитации результаты только с ЧЭССМ из-за отсутствия контрольной группы пациентов, которым ЧЭССМ не проводили.
Таким образом, мы впервые в контролируемом исследовании показали, что ЧЭССМ эффективна в краткосрочном курсе реабилитации двигательных функций у пациентов с тяжестью травмы спинного мозга ASIA В и С. Если обратиться к исследованиям, в которых было продемонстрировано, что многомесячный курс электрической стимуляции спинного мозга приводит к восстановлению самостоятельной ходьбы у пациентов с тяжелыми двигательными нарушениями [3—5], станет очевидным, что длительный процесс восстановления ходьбы состоял из переходивших один в другой коротких курсов, в ходе которых решались определенные реабилитационные задачи. У пациентов последовательно восстанавливали: произвольные движения ног в условиях их внешней поддержки (когда сила тяжести была компенсирована), способность поддержания вертикальной позы, независимой регуляции шагательных движений для правой и левой ноги по отдельности. Это дает основание полагать, что 2—3-недельные курсы ЧЭССМ можно применять в условиях стационарной или амбулаторной реабилитации спинальных пациентов для многоэтапного восстановления тяжелых двигательных нарушений, усложняя восстанавливаемые двигательные навыки на каждом последующем этапе.
Спинальные травмы в большом числе случаев вызывают нарушения произвольного мочеиспускания [19, 20]. В норме функционирование мочевого пузыря связано с сегментами спинного мозга T11—L2 и S2—S4 [21]. Для реабилитации двигательных функций нижних конечностей, как правило, проводят электрическую стимуляцию спинного мозга на уровне T12—L4 [4—6]. В связи с этим закономерны ожидания того, что, стимулируя спинной мозга для восстановления двигательных функций, возможно влиять на выделительные функции. В исследованиях на спинальных животных было показано, что электрическая стимуляция спинного мозга с параметрами, используемыми для двигательной реабилитации, влияет на функцию мочеиспускания [12, 13]. Уродинамическое исследование было проведено на спинальных пациентах в процессе процедуры ЧЭССМ на уровне позвонка Т11 [14]. В этом исследовании было получено, что стимуляция с частотой 30 Гц уменьшает гиперактивность детрузора, диссинергию детрузора и сфинктера, а стимуляция с частотой 1 Гц инициирует опорожнение мочевого пузыря. В нашем исследовании было получено, что курс ЧЭССМ с аналогичными параметрами стимуляции приводит к частичной нормализации мочевыделительной функций у 3 из 7 пациентов. Таким образом, двигательная реабилитация с применением ЧЭССМ может сопровождаться улучшением выделительных функций и очевидно, что требуются дальнейшие исследования для того, чтобы использовать ЧЭССМ для регуляции произвольного мочеиспускания после травмы спинного мозга.
Заключение
В контролируемом исследовании показано, что 2-недельный курс ЧЭССМ в сочетании с двигательной терапией и стандартным курсом восстановительного лечения приводит к достоверному увеличению мышечной силы нижних конечностей, к улучшению показателей чувствительности. У 2 пациентов степень тяжести травмы уменьшена с ASIA B до ASIA C. Увеличение спастичности на 1 балл у 1 пациента нельзя однозначно связать с ЧЭССМ. Двигательная реабилитация с применением ЧЭССМ может сопровождаться улучшением мочевыделительных функций. Следует особо подчеркнуть, что все вышеописанные кумулятивные эффекты спинальной стимуляции были получены при мультисегментарных стимулирующих воздействиях, направленных на активацию различных сомато-висцеральных систем. По-видимому, следующим шагом должен стать поиск специфичности воздействия для наиболее эффективной регуляции той или иной функции и их объединение в комплекс стимуляционных воздействий для нейрореабилитации.
Дополнительная информация
Источник финансирования. Исследование выполнено при финансовой поддержке фонда РФФИ (проект № 16−29−08277) и Программы Президиума РАН ПI.42 «Фундаментальные исследования для биомедицинских технологий» (проект «Механизмы регуляции двигательных и висцеральных функций при неинвазивной стимуляции спинного мозга»).
Участие авторов: концепция и дизайн исследования — Т.Р.М., А.М.С., редактирование — Ю.П.Г., С.Г.Щ.; сбор и обработка материала — А.А.С.; статистическая обработка данных — Т.Р.М.; написание текста — А.А.С., Т.Р.М.
Авторы декларируют отсутствие конфликта интересов, связанных с публикацией настоящей статьи.
The authors declare no conflict of interest.
Сведения об авторах
Электростимуляция спинного мозга. Техника электростимуляции спинного мозга.
Методика применяется для лечения различного рода патологических состояний сопровождающихся выраженными болями в ногах, в спине, в промежности, спастичности в нижних конечностях. Также применяется для лечения эректильной дисфункции, нарушения функции тазовых органов. Методика заключается в установке на поверхность спинного мозга электродов, к которым подаются стимулы от стимулятора, вшиваемого под кожу. Перед окончательной имплантацией стимулятора проводится тестовая стимуляция, когда электроды выводятся наружу и подключаются к внешнему стимулятору, для подбора параметров стимуляции, оценки эффективности в каждом конкретном случае.
CТИМУЛЯЦИЯ СПИННОГО МОЗГА - (SPINAL CORD STIMULATION - SCS)
Метод лечения хронического болевого синдрома, спастики, нарушения функции тазовых органов.
Эффект достигается при помощи электрических импульсов, которые доставляются электродами, имплантированными в эпидуральное пространство.
- Электрические импульсы активируют тормозящие боль нейроны в заднем роге спинного мозга, в результате чего чувство боли уменьшается;
- Стимуляция также вызывает парестезию (ощущение мягкой приятной вибрации) в зоне, откуда происходит боль, и ее округе;
- Применение SCS считается успешным, если удалось достичь более чем 50%-ного уменьшения боли по визульно-аналоговой шкале;
- Однако 30%-ное уменьшение боли также является клинически значимым
- Ежегодно более 15 000 пациентам во всем мире имплантируются нейростимуляторы для лечения хронической невропатической боли;
Электроды соединяются с нейростимулятором, который имплантируется подкожно.
На сегодняшний день консервативные методы лечения не всегда обеспечивают достаточное обезболивание.
- Фармакотерапия, как правило, является первым и главным методом лечения, однако;
- Более 50% пациентов остаются недовольными фармакотерапией, независимо от применяемого лекарства.
- Многие лекарства вызывают различные побочные эффекты.
Невропатическая боль (НБ) может быть фармакорезистентной (лекарства не приносят желаемого облегчения или вызывают непереносимые побочные эффекты).
Нейростимуляция является альтернативным методом лечения пациентов с НБ, в случае если традиционные консервативные методы лечения не приносят желаемого результата.
ТЕСТОВАЯ НЕЙРОСТИМУЛЯЦИЯ (ТН)
ТН предполагает имплантацию электрода, который является частью системы для проведения теста. Введение электрода осуществляется под местной анестезией. Благодаря ТН уже на операционном столе удается получить анальгетический (обезболивающий) эффект, а также с большей долей вероятности прогнозировать эффективность нейростимуляции еще до имплантации всей системы.
Тестовый период в течение 7-10 дней проводится в амбулаторных условиях, приближенных к повседневным, для лучшей оценки больным динамики болевого синдрома и влияния его на повседневную активность. В тестовом периоде проводится подбор оптимальных параметров электростимуляции.
Если по результатам ТН удалось достичь 50% - го снижения боли по Визуально-аналоговой шкале (шкала оценки интенсивности боли), то пациенту может быть имплантирована система нейростимуляции полностью. В случае же неудачи, встанет вопрос о переходе на следующую ступень.
Отдельно следует отметить, что при некоторых болевых синдромах, например при травматическом отрыве корешков нервного сплетения пациентам производятся хирургические вмешательства, например DREZ-операция. При грыже межпозвоночного диска - соответствующее иссечение грыжи. А при онкологических болях - хордотомия.
Обязательное условие: Перед установкой нейростимулирующей системы проводится тестовая стимуляция (см. выше), при которая позволяет врачу убедиться в эффективности методики.
КОМПОНЕНТЫ SCS-СИСТЕМЫ КОМПАНИИ MEDTRONIC
Система для неиростимуляции состоит из трех базовых имплантируемых компонентов, которые могут использоваться унилатерально или билатерально:
- Нейростимулятор
- Удлиннитель
- Чрезкожный цилиндрический или хирургический электрод
Нейростимулятор, или имплантируемый генератор импульсов.
Нейростимулятор представляет собой изолированное устройство, похожее на кардиостимулятор, состоящее из батареи и электроники. Он имплантируется подкожно, и вырабатывает электрические импульсы, необходимые для унилатеральной или билатеральной стимуляции. Эти импульсы проводятся по удлиннителям и электродам в спинной мозг.
Удлиннитель
Удлиннитель - это тонкий изолированный провод. Удлиннители имплантируют подкожно, соединяя электрод с нейростимулятором.
Электрод представляет собой тонкий изолированный четырехжильный провод с четырьмя, восемью или 16-ю контактами на кончике. Электрод имплантируется в эпидуральное пространство, чтобы проводить туда электрический ток, осущевляющий нейростимуляцию. Оптимальное положение электрода всегда находится в корреляции с зоной боли пациента. Для стимуляции спинного мозга электроды имплантируются в эпидуральное пространство (между позвонком с твердой мозговой оболочкой), при этом контакты электродов находятся достаточно близко к заднему рогу спинного мозга, чтобы осуществлять стимуляцию толстых миелиновых нервных волокон.
Неимплантируемые компоненты системы
К неимплантируемым компонентам системы относятся пульт пациента и программатор врача, которые используются для управления нейростимулятором.
Программатор врача N'Vision. Используется для программирования нейростимуляторов. Параметры импульсов, вырабатываемых нейростимулятором, могут быть неинвазивно изменены при помощи программатора врача. Программатор передает настройки нейростимулятору дистанционно при помощи радиочастотной связи.
Пульт пациента. Пульт пациента-это портативное устройство, которое позволяет пациенту самостоятельно включать и выключать нейростимулятор,когда это необходимо, а также проверять уровень заряда батареи нейростимулятора.
Методика неинвазивной чрескожной электрической стимуляции спинного мозга
Позвоночно-спинномозговая травма и её последствия являются важной проблемой современной медицины. Одним из новых и перспективных методов реабилитации двигательных функций у таких больных является электрическая стимуляция спинного мозга. В ФГБУ «НМИЦ детской травматологии и ортопедии им. Г. И. Турнера» Минздрава России успешно применяется метод чрескожной электрической стимуляции спинного мозга (ЧЭССМ) у данной категории пациентов для воздействия на нейронные сети различных отделов спинного мозга с целью активации афферентных и эфферентных рефлекторных связей при полном или частичном нарушении супраспинальных влияний различного генеза. Эффективность применения этой методики у пациентов детского возраста со спинальной травмой шейного, грудного и поясничного отделов позвоночника клинически доказана.

С. В. Виссарионов, директор ФГБУ «НМИЦ детской травматологии и ортопедии им. Г. И. Турнера» Минздрава России, руководитель клиники патологии позвоночника и нейрохирургии, член-корреспондент РАН, профессор, д.м.н.«В лечении детей с переломами позвоночника мы применяем разработанные в Центре имени Г. И. Турнера минимально инвазивные хирургические методики и современные технологии реабилитации. Одна из наиболее эффективных методик восстановительного лечения — это неинвазивная чрескожная стимуляция спинного мозга. На протяжении нескольких лет её использования она показала свою эффективность на десятках сложных пациентов со спинальными травмами, у которых восстанавливалась способность к ходьбе и передвижению».
Особенности методики неинвазивной чрескожной электрической стимуляции спинного мозга
Особенность методики заключается в использовании электрических импульсов сложной формы, в отличие от стандартных прямоугольных. Особая форма стимулирующих импульсов делает токи большой интенсивности, необходимые для эффективного воздействия на спинной мозг, безболезненными для человека с нормальной чувствительностью. Благодаря этому воздействию на спинной мозг и его элементы происходит воздействие токами большой амплитуды, которые эффективно проникают с поверхности кожи в структуры спинного мозга и инициируют непроизвольные шагательные движения, что приводит к увеличению мышечной силы, улучшению тактильной и болевой чувствительности, к возникновению произвольных движений и восстановлению баланса тела.
В зависимости от возраста пациента и уровня расположения стимулирующих электродов подбираются оптимальные параметры силы тока. Каждый из каналов стимулятора выдаёт импульсы тока в диапазоне от 0 до 300 мА с шагом 1 мА. Электроды (катод) фиксируются между остистыми отростками позвонков в зависимости от уровня повреждения спинного мозга, индифферентный электрод (анод) располагается над гребнями подвздошных костей. Средний ток, выдаваемый стимулятором по каждому каналу (постоянная составляющая тока) равен нулю. Это обеспечивает нулевой потенциал на коже в месте приложения электродов, что предотвращает возможный ожог кожи в случае большой амплитуды импульсов. В результате проведённого анализа были определены предельно допустимые величины силы, рекомендуемые для проведения ЧЭССМ в различных возрастных группах. Предельно допустимая сила тока для проведения ЧЭССМ у детей с позвоночно-спинномозговой травмой в возрасте до 7 лет составляет 40мА, от 7 до 12 лет - 80мА, старше 12 лет - 150мА.
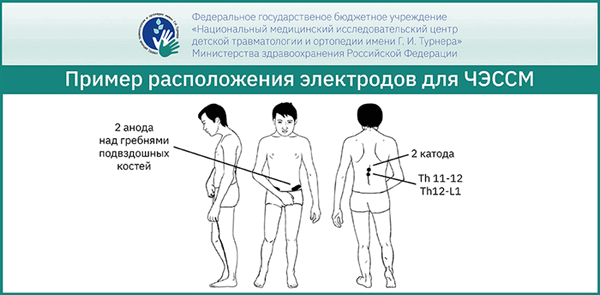
Преимущества метода ЧЭССМ:
- Неинвазивность: метод является менее болезненным и травматичным, что особенно важно в детской практике.
- Доступность.
- Возможность стимуляции на разных уровнях спинного мозга одновременно: на 5 сегментов спинного мозга, или на 3 сегмента спинного мозга и на 2 корешка, или на 1 сегмент спинного мозга и 4 корешка спинного мозга.
Метод ЧЭССМ у пациентов при повреждении и аномалии развития спинного мозга и позвоночного канала способствует восстановлению чувствительности, двигательной активности и нормализации функции тазовых органов. Выполнение ЧЭССМ в комплексной терапии с роботированной механотерапией позволяет усилить терапевтический эффект воздействия. Восстановление функций даже одного сегмента спинного мозга значительно улучшает социальную адаптацию и качество жизни таких пациентов. Однако восстановление функций спинного мозга напрямую зависят от ранних сроков хирургического вмешательства. Отсутствие ликвидации сдавления спинного мозга в первые часы от момента травмы вызывает в нём изменения, которые на 80 % необратимы.
Кому показана неинвазивная чрескожная электрическая стимуляция спинного мозга?
Чрескожная электрическая стимуляция спинного мозга показана пациентам старше 4 лет с травмой спинного мозга или её последствиями (глубокие парезы, плегия; шкала ASIA - тип А, В), врождёнными пороками развития позвоночного канала и спинного мозга, детским церебральным параличом.
Сроки проведения стимуляции - после заживления послеоперационной раны (у пациентов, перенёсших хирургическое вмешательство) или через 2 недели от момента травмы (у пациентов с повреждениями типа SCIWORA).
Противопоказания для использования метода ЧЭССМ:
- Общее тяжёлое соматическое состояние пациента, обусловленное травмирующим агентом (кома, повреждение внутренних органов, и т. д.).
- Задержка психического развития.
- Нарушение целостности кожных покровов в зоне наложения электродов.
- Индивидуальная непереносимость процедуры ребёнком (эмоциональная лабильность, сниженный болевой порог).
- Эпилепсия с некупированными приступами.
- Выраженная гиперемия кожных покровов, аллергическая реакция в зоне наложения электродов.
Материально-техническое обеспечение метода ЧЭССМ
В ФГБУ «НМИЦ детской травматологии и ортопедии им. Г. И. Турнера» Минздрава России для проведения процедуры ЧЭССМ используются следующие аппараты и расходные материалы:
- Аппаратно-программный комплекс для чрескожной стимуляции спинного мозга Биостим-5.
- Накожные электроды для ЧССМ.
- Роботизированный локомоторный тренажёр «Локомат».
- Велотренажер «Тера».
- Имитатор подошвенной опорной нагрузки «Корвит».
- Пассивная подвесная система «Экзарта».

Тренажеры «Тера» и «Локомат» обеспечивают механостимуляцию нижних конечностей в режиме поочередного сгибания-разгибания в тазобедренных, коленных и голеностопных суставах. Пациентов инструктируют стараться прикладывать усилия в том же направлении, в каком тренажёр двигает конечностями. Кинезиотерапевтическая пассивная подвесная система «Экзарта» позволяет синхронно со стимуляцией выполнять упражнения в подвешенном состоянии, позиционировать тело и преодолевать влияние гравитации.
Алгоритм проведения ЧЭССМ у детей с позвоночно-спинномозговой травмой
На первом этапе проводят оценку тяжести неврологического дефицита с определением типа по шкале ASIA.
Затем выполняют оценку уровня повреждения спинного мозга, что позволяет определить оптимальное количество и уровень расположения стимулирующих электродов.
При повреждении спинного мозга на уровне шейного утолщения и грудных сегментов показано проведение ЧЭССМ на двух уровнях - в зоне повреждения и на уровне поясничного утолщения; при повреждении спинного мозга на уровне поясничного утолщения показано проведение ЧЭССМ на одном уровне (поясничное утолщение).
Необходимо отметить, что пациентам с изолированным повреждением только элементов конского хвоста проведение ЧЭССМ не показано.
Далее проводят дозированный подбор оптимальных параметров силы тока с учётом переносимости процедуры пациентом и его возрастных особенностей.
Стимуляция спинного мозга и периферических нервов ( SCS, PNS )
CТИМУЛЯЦИЯ СПИННОГО МОЗГА - (SPINAL CORD STIMULATION - SCS)
Электроды соединяются с нейростимулятором, который имплантируется подкожно.
ТЕСТОВАЯ НЕЙРОСТИМУЛЯЦИЯ (ТН)
КОМПОНЕНТЫ SCS-СИСТЕМЫ КОМПАНИИ MEDTRONIC
- Нейростимулятор;
- Удлиннитель;
- Чрезкожный цилиндрический или хирургический электрод.
Нейростимулятор, или имплантируемый генератор импульсов.
Удлиннитель
Электроды
Неимплантируемые компоненты системы
Программатор врача N’Vision. Используется для программирования нейростимуляторов. Параметры импульсов, вырабатываемых нейростимулятором, могут быть неинвазивно изменены при помощи программатора врача. Программатор передает настройки нейростимулятору дистанционно при помощи радиочастотной связи.
ПРЕИМУЩЕСТВА СИСТЕМЫ
К преимуществам стимуляции спинного мозга SCS относятся:
- обратимость;
- возможность коррекции лечебного эффекта в зависимости от самочувствия пациента;
- отсутствие серьезных побочных эффектов и их преходящий характер.
ПОКАЗАНИЯ ДЛЯ SCS
- Невропатическая боль:
- Синдром «оперированного позвоночника» или постламинэктомический синдром;
- Комплексный регионарный болевой синдром (КРБС) I и II типов;
- Болезненные радикулопатии (с болями или без болей в пояснице);
- Диабетическая невропатия;
- Постгерпетическая невралгия;
- Рефрактерную стенокардию;
- Заболевания сосудов/критическую ишемию нижних конечностей, сопровождающиеся сильной болью (болезнь Рейно, облитерирующий эндартериит);
- Боль в культе;
- Боли вследствие травмы позвоночника;
- Стенозы позвоночного канала;
ПРОТИВОПОКАЗАНИЯ
- Тяжелая сопутствующая соматическая патология;
- Инкурабельная лекарственная зависимость;
- Неблагоприятные результаты психологического обследования;
- Наличие в прошлом суицидальных попыток, сопровождающих тяжелую психическую патологию;
- Психические нарушения с явными признаками соматизации;
- Недостаточность интеллектуального развития пациента, препятствующая использованию системы для ЭС;
- Активная инфекция в зоне планируемой операции.
ОСЛОЖНЕНИЯ
- Риск инфекции;
- Отсутствие стимуляции или прерывистая стимуляция;
- Изменение локализации ощущений при нейростимуляци;
- Снижение противоболевого эффекта нейростимуляци, что может привести к возобновлению болей.
Нейрохирургическое отделение (8 отделение) -
2-й корпус, 2-й этаж8 —HF10 и 8 —-залповая стимуляция
8 пациентов — с HF10, 8 пациентов — с залполвой стимуляцией
Снижение интенсивности боли в группе залповой стимуляции на 87,5%, в группе HF10 — на 54,9%
M. Russo и соавт. [43] опубликовали результаты ретроспективного анализа, в который вошли 256 пациентов с рефрактерным болевым синдромом. Среднее значение снижения болевого синдрома через 6 мес наблюдений составило 50%, при этом максимальный эффект (снижение боли на 81% и более) был характерен для боли с одновременной локализацией в спине и ноге.
Самое значительное исследование, посвященное сравнению эффективности тонической SCS и HF10, — SENZA [37]. В исследование включен 101 пациент с HF10 и 97 пациентов с классической SCS. Интересно, что более чем у 80% пациентов в обеих группах в анамнезе были неудачные спинальные вмешательства и почти 90% пациентов принимали опиоидные анальгетики.
Через 12 мес лечения 11 пациентов с традиционной SCS стали отмечать плохую переносимость парестезий. Регресс болевого синдрома был выше в группе высокочастотной стимуляции (уменьшение интенсивности болевого синдрома на 65% при HF10 против уменьшения боли на 45% при тонической SCS). Через 24 мес наблюдения средняя величина аналгезии составила 50%, при этом медиана обезболивания у пациентов с болью в спине и использованием SCS HF10 составила 66,9±31,8%, с тонической стимуляцией — 41,1±36,8%. Интенсивность боли в ноге снизиась на 65,1±36,0% при HF10 и 46,0± 40,4% при тонической SCS. Следует отметить, что в обеих группах уменьшилось число больных, принимающих опиоды, повысилось качество жизни пациентов.
Предположительным механизмом действия залповой стимуляции является одновременная активация передней части поясной извилины и правой дорсолатеральной префронтальной коры [44]. В работе N. Kriek и соавт. [45] показано, что при залповой стимуляции происходит уменьшение гиперсенситизации нейронов заднего рога с одновременной активацией ГАМК В-рецепторов, что увеличивает тормозные эффекты залповой SCS. Интересные данные по эффективности залповой стимуляции представлены в работе D. De Ridder и соавт. [46]. Согласно результатам залповая нейростимуляция может быть эффективна и у пациентов с КРБС (уменьшение интенсивности боли на 55% против уменьшения боли на 31% при тонической SCS). S. Schu и соавт. [47] опубликовали результаты двойного слепого рандомизированного плацебо-контролируемого исследования сравнения эффективности залповой стимуляции и 500Hz у пациентов с FBSS. В исследование вошли 20 больных (13 женщин и 7 мужчин), разделенных на три группы: плацебо (ложная стимуляция, 500Hz, burst. Медиана показателей интенсивности болевого синдрома по цифровой рейтинговой шкале составила 5,6±1,7, после стимуляции: в группе 500 Hz — 7,1±1,9; залповая стимуляция — 4,7±2,5; в группе плацебо — 8,3±1,1. Медиана показателей по Oswestry Disability Index до проведения стимуляции составила 22,3±8,0; после стимуляции в группе залповой стимуляции — 9,2±8,0; 500 Hz — 24,6±7,3; плацебо — 29,5±10,3.
Нельзя не упомянуть еще один новый метод — стимуляцию спинальных ганглиев (англ. dorsal root ganglion stimulation — DRGS). Предполагается, что DRGS влияет на нейрональную активность за счет сложного каскада иммунных реакций, опосредованных воздействием на глиальные клетки и клетки иммунной системы [48—50]. R. Weiner и соавт. [50] опубликовали результаты пилотного исследования, посвященного эффективности DRG-SCS у пациентов с синдромом оперированного позвоночника. Медиана снижения интенсивности болевого синдрома составила 59,9%. По данным S. Eldabe и соавт. [51], метод DRG-SCS имеет перспективы и для лечения фантомной боли. В небольшой серии, состоящей из 8 пациентов, было показано существенное уменьшение интенсивности болевого синдрома (первоначальная медиана по ВАШ — 83,5 мм; средняя величина катамнеза — 14,4 мес; медиана ВАШ после стимуляции — 43,5 мм), снижение потребности в приеме лекарственных препаратов. Тем не менее необходимо отметить, что у 3 пациентов в катамнезе наблюдали ухудшение результатов при хорошем изначальном эффекте.
Одной из самых последних разработок в области усовершенствования систем для хронической нейростимуляции является появление SCS-систем с закрытым контуром. Благодаря постоянному измерению потенциалов действия в режиме онлайн система подает на стимулируемую область спинного мозга ток, равномерно распределяющийся по волокнам вне зависимости от положения больного в пространстве и любых его изменений, даже связанных с дыханием. В 2017 г. компанией Avalon были опубликованы результаты пилотного исследования системы контроля закрытого контура SCS [52]. Тестовые электроды были имплантированы 51 пациенту, окончательную имплантацию провели в 36 случаях. Через 3 мес стимуляции снижения интенсивности болевого синдрома на 50% и более удалось добиться у 92,6% пациентов с болью в спине и у 91,3% с болью в ноге; через 6 мес стимуляции — у 85,7% пациентов с болью в спине и у 82,6% с болью в ноге. При этом снижения интенсивности боли минимум на 80% удалось добиться у 64,3% пациентов с болью в спине и у 60,4% с болью в ноге.
Новые подходы к снижению частоты осложнений
Несмотря на невысокую частоту осложнений (в среднем до 5% согласно результатам различных исследований), проблема осложнений SCS, прежде всего миграции электрода, остается актуальной. В настоящее время предлагаются новые механизмы фиксации, обеспечивающие контроль положения электрода, применяется нейромониторинг. С целью снижения частоты инфекционных осложнений предложены новые схемы антибиотикотерапии, позволившие снизить их распространенность до 1%. Совершенствование хирургической техники и использование новых методов контроля делают метод спинальной стимуляции безопасным, его использование стало возможным у различных групп пациентов [53].
На основании нескольких последних исследований можно создать алгоритм по выбору оптимального подхода к каждой клинической ситуации, принимая во внимание успех:
а) обычной стимуляции;
б) высокочастотной стимуляции;
в) залповой стимуляции;
г) стимуляции дорзальных ганглиев;
д) околоспинальной стимуляции.
Кроме того, появление микростимуляторов, основанных на принципе нанотехнологии, может значительно уменьшить инвазивность всего направления спинальной стимуляции.
Судя по всему, через 50 лет после создания SCS вышла из периода относительной стагнации и быстро набирает скорость в сторону диверсификации и убедительной доказательной базы, необходимой для принятия научно обоснованных решений при выборе оптимального подхода в индивидуальных случаях.
При этом важную роль играет и готовность врачей применять методы функциональной нейрохирургии в рутинной практике. Во всем мире наблюдается стигматизация этих методов и нацеленность на более широкое применение консервативной терапии. С другой стороны, безусловно, методы хронической электростимуляции не являются панацеей и показаны лишь пациентам, соответствующим критериям отбора, с диагностированной фармакорезистентностью. В последнее время созрела необходимость создания более четких критериев фармакорезистентности у пациентов с хронической болью для определения показаний к проведению инвазивных вмешательств, так как своевременное подключение этих методов может способствовать уменьшению центральной сенситизации и достижению более стабильного анальгетического эффекта.
Читайте также:
- Синдром Вискотта-Олдрича (Wiskott-Aldrich)
- Симптомы и клиника поражения головного мозга
- Борьба с травматизмом в механических цехах. Профилактика травм при шлифовке
- Тиреоидит Хашимото. Влияние гипертиреоза на головной мозг
- Диагностика и лечение американского трипаносомоза. Профилактика американского трипаносомоза
