Фетальная хирургия. Примеры операций у плода
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Фетальная хирургия — сравнительно новое направление, которое позволяет врачам внутриутробно оперировать пороки развития, переливать кровь и предотвращать фето-фетальный трансфузионный синдром.
В 1963 году была проведена первая операция на плоде, а в медицинском мировом сообществе фетальная хирургия получила широкую огласку только в 1981 году: благодаря внутриутробному вмешательству восстановили проходимость мочеиспускательного канала у плода на 36 неделе. Ребенок родился без почечной недостаточности, которая была бы уже неоперабельной в постнатальном периоде жизни.
Фето-фетальный трансфузионный синдром (twin-to-twin transfusion syndrome) — осложнение многоплодной монохориальной беременности, при котором смертность достигает 80-100 %.
Этот синдром, по данным Fetal care center of Tampa Bay, возникает в 5,5-17,5 % при монохориальной беременности. Данные не могут быть до конца корректными, поскольку самопроизвольное прерывание беременности может произойти до подтверждения диагноза.
Этиологией этого заболевания принято считать анастомозы, которые образуются в плаценте, поэтому кровь между плодами начинает диспропорционально распределяться, разделяя их на донора и реципиента. Количество крови у донора уменьшается, что приводит к гипоксии, задержке внутриутробного развития и инвалидности в дальнейшем. В то же время у реципиента объем циркулирующей крови увеличивается, в результате повышается нагрузка на сердце и почки, что приводит к сердечной недостаточности.
Выделяют пять стадий фето-фетального трансфузионного синдрома:
1. УЗИ регистрирует разницу объемов околоплодных вод между донором и реципиентом;
2. Отсутствие наполнения мочевого пузыря у плода-донора и торможение развития;
3. Возникновение патологических изменений сердечно-сосудистой системы, проявление на допплерографии артерий пуповины и венозного протока;
4. Развитие признаков водянки у плода-реципиента;
5. Смерть одного или двух плодов.
Терапевтические методы лечения не являются эффективными, необходимо оперативное вмешательство. Отсутствия лечения приводит к стопроцентной гибели обоих плодов. Внутриутробная хирургия позволяет акушерам-гинекологам спасти в 76 % случаях одного ребенка и в 96 % обоих. Процент выживаемости зависит от вида хирургического вмешательства.
Амниоредукция — это процедура многократного удаления околоплодных вод из пузыря плода-реципиента. Процедура имеет ряд рисков, например, на раннем сроке может спровоцировать прерывание беременности. При этом методе врачам приходится действовать вслепую, поскольку отсутствуют общепринятые стандарты, предписывающие объемы, которые необходимо забирать при амниодренаже.
Септостомия — оперативное вмешательство, при котором повреждают амниотическую перегородку, что приводит к выравниванию давления и объема околоплодных вод. При этом возрастает риск повреждения пуповины, что ведет к смерти плода.
Фетоскопическая окклюзия пуповины — процедура прекращает кровоток в одной из пуповин, что приводит к изменению давления и снижению трансфузии. Как правило, проводится на ранних сроках, при этом обеспечивается выживаемость только одного плода, также повышаются риски возникновения ДЦП.
Фетоскопическая коагуляция анастомозов плаценты — самый современный метод фетальной хирургии. В полость матки через переднюю брюшную стенку вводится фетоскоп под контролем УЗИ. К нему прикрепляется специальный лазер, который коагулирует анастомозы в плаценте.
Хирургия плода
Научно-практический подход «плод как пациент» имеет бесспорный приоритет в мировой и отечественной медицине. Развитие ультразвуковой и инвазивной пренатальной диагностики, а также эндоскопической техники обеспечило возможности для развития нового направления в перинатологии — фетальной хирургии, или хирургии плода.
Существует большая группа аномалий развития плода, плаценты и пуповины, вызывающих значительные или необратимые нарушения, которые затрудняют хирургическую коррекцию после рождения ребенка. В таких случаях оптимальным становится внутриутробное вмешательство.
Трепетные истории
Родоначальником современной фетальной хирургии принято считать американца Альберта Лилея. Именно он в 1963 году впервые, под контролем рентгеновского исследования, успешно осуществил внутриутробное переливание донорской крови плоду, страдающему анемией. Но как отдельное направление медицины хирургия плода была признана мировым научным сообществом лишь после сенсационной операции, проведенной профессором Калифорнийского университета в Сан-Франциско Майклом Харрисоном. 26 апреля 1981 года возглавляемая им бригада хирургов, урологов и гинекологов внутриутробно открытым доступом восстановила проходимость мочеиспускательного канала плоду на 36 неделе беременности. Плод выжил, ребенок родился без почечной недостаточности неоперабельной в постнатальном периоде.
Но, пожалуй, самая резонансная в мировых СМИ фетальная операция на открытой матке случилась в 1999 году. У еще нерожденного 21‑недельного Самуэля, как потом назвали ныне здорового 15‑летнего подростка, была диагностирована spina bifida — редкий дефект позвоночных дужек, приводящий к развитию спинномозговых грыж. Без устранения дефекта плод был обречен на паралич нижних конечностей. Американский хирург Джозеф Брюнер успешно провел внутриутробную операцию по выделению корешков спинного мозга из грыжевого мешка, погружению их в спинномозговой канал и вентрикуло-перитонеальному шунтированию. 2 декабря 1999 года Самуэль родился доношенным и здоровым, а сделанный в операционной снимок, на котором палец хирурга хватают высунувшиеся из раны крохотные пальчики плода, разошелся по всему миру.На данный момент в мире проведено более пяти тысяч подобных операций.
Критерии и показания
Международный союз фетальной медицины и хирургии, к которому в 1993 году присоединилась Российская Федерация, разработал критерии для внутриутробных операций:
- подтвержденный диагноз и однозначно негативный прогноз для плода;
- отсутствие эффективных методов лечения данного заболевания после рождения;
- наличие экспериментальных данных об эффективности и безопасности планируемого фетального оперативного вмешательства как для матери, так и для ребенка, как во время внутриутробного периода, так и после родоразрешения.
Оптимальный срок для проведения фетальных операций — 18-30 недель гестации.
В фетальной хирургии используются три основные технологии: кордоцентез, фетоскопия и операции на открытой матке.Кордоцентез — методика, ранее использовавшаяся лишь для исследования пуповинной крови, сейчас применяется и для введения с помощью сверхтонкой иглы лекарственных и гормональных веществ непосредственно в пуповину плода.
Фетоскопия
При фетоскопии через 1,5-2‑сантиметровые разрезы в брюшную полость и матку беременной женщины вводят эндоскоп и с его помощью осуществляют манипуляции: гемотрансфузию, введение баллонов, расширяющих артериальный или пищеводный просвет у плода, хирургическое обеспечение бронхолегочной проходимости у плода, коагуляцию сосудов и т. д. Диаметр фетоскопа составляет 1,2-2 мм. Место введения троакаров определяют под контролем эхографии. Каждый инструмент имеет размер 3-5 мм. Число вводимых троакаров может достигать 5-6 штук. Для фетоскопических лазерных процедур используют фетоскоп с лазерным проводником. Манипуляции проводят под местной или местно-регионарной анестезией. Процедуру завершают амниодренированием до достижения нормального количества околоплодных вод.
Обычно пациентки выписываются из стационара в течение 1-2 дней после операции, но продолжают находиться под наблюдением с целью своевременного выявления осложнений. Наиболее частое осложнение (6-9 %) в течение месяца после вмешательства — это разрыв плодных оболочек.
Эндоскопическое антенатальное вмешательство менее инвазивное, чем открытое, что позволяет уменьшить частоту преждевременных родов, предотвратить охлаждение и дегидратацию плода. Кроме общехирургических осложнений, таких как интраоперационное инфицирование, возрастание угрозы выкидыша — при фетоскопических операциях возможны и специфические осложнения. Описаны случаи фетоскопического рассечения амниотических перетяжек, которые могут приводить к прогрессирующей ампутации частей конечностей плода. Но данные случаи единичны и зависят от исправностиаппаратуры и профессионализма хирурга.
Открытый доступ
Операции на открытой матке — по сути, аналогичны кесареву сечению, но кожный и маточный разрезы имеют, как правило, в два раза меньшие размеры. Так, разрез на матке составляет обычно 5-7 см, а разрез передней брюшной стенки — 10-12 см. Через разрез, не пересекая пуповины, извлекают в рану плод, придерживаясь правила «как можно больше внутри матки, как можно меньше снаружи», и проводят необходимое вмешательство. Операция осуществляется под общим обезболиванием или под эпидуральной анестезией. Плоду дополнительно могут вводить микродозы анальгетиков и анестетиков. На края раны на матке накладывают клеммы для предупреждения кровотечения. Во время операции проводится всесторонний мониторинг состояния не только матери, но и плода. После вмешательства осуществляется массивный токолиз — торможение сократительной активности матки с помощью введения токолитиков. При отсутствии осложнений пациентки выписываются из стационара через 5-7 суток. Вследствие возрастающей вероятности маточных разрывов, перенесшим подобную операцию женщинам родоразрешение рекомендовано проводить путем кесарева сечения. Нередко открытый доступ позволяет осуществить ряд манипуляций, невозможных при эндоскопическом доступе: удалить разросшуюся опухоль у плода, ушить объемное грыжевое выпячивание, прооперировать угрожающий жизни ребенка порок сердца.
На потоке
Наиболее частое показание к открытым хирургическим вмешательствам — это миеломенингоцеле — спинномозговая грыжа, содержащая в грыжевом мешке, наряду с цереброспинальной жидкостью, участок спинного мозга вместе с нервными корешками.За прошедшие два десятилетия риски гибели плода при фетальных хирургических вмешательствах значительно снизились. Так, если еще в середине 90‑х годов до 50 % новорожденных не выживало, то сейчас частота гибели плода не превышает 25 %.Столь высокий процент смертности объясняется частично тем, что в ряде случаев, при операциях по поводу фето-фетального трансфузионного синдрома, врачам приходится, по согласованию с матерью, принимать решение о «редукции» — умерщвлении нежизнеспособного плода, для того чтобы сохранить жизнь перспективному близнецу. На данный шаг приходится идти, когда изоляция сросшихся плацентами плодов методом лазерной коагуляции и формирование у них автономных кровеносных систем, с целью предоставления им возможности самостоятельного развития в утробе матери — технически неосуществимы.
Одной из самых разработанных и успешных в фетальной хирургии является методика коррекции spina bifida (рис. 2). Наилучшие результаты достигаются при операции на сроках 17-27 недель беременности. Полностью выздоравливают 36 % подвергшихся хирургическому вмешательству пациентов. Еще 42 % детей могут самостоятельно передвигаться без помощи костылей. Для сравнения: доля способных к самостоятельному передвижению детей, у которых коррекция осуществлялась после рождения, — составляет лишь 21 %.
Широко используется фетальная хирургия при диафрагмальных грыжах плода. Весь цикл оперативного лечения включает три этапа: на сроке от 17 до 30 недель отверстие в диафрагме плода закрывают специальным баллоном, который удаляется в первые дни после рождения ребенка, а в возрасте от 1 до 3 месяцев диафрагмальный дефект младенцу ушивают открытым
доступом. Именно первый — фетальный — операционный этап позволил повысить эффективность лечения до 85 %.
Точки роста
В последние годы значительных успехов достигла фетальная онкологическая хирургия. Риск развития злокачественного новообразования у плода в утробе матери составляет 1:10 000, но данные случаи практически всегда имеют для ребенка летальный прогноз. Ряд опухолей, например пояснично-крестцовые тератомы, сегодня успешно удаляются в утробе матери. Стал широко известен случай успешного удаления онкохирургами клиники Джексона во Флориде оральной тератомы у четырехмесячного плода. А специалисты больницы Королевского Колледжа в Лондоне полностью удалили опухоль легкого у плода на сроке 20 недель.
Одной из проблемных патологий остается гидроцефалия плода. Послеоперационная смертность здесь составляет 18 %. Остаточные нарушения психофизического развития отмечаются у 66 % фетально прооперированных детей. Но учитывая, что без операции летальность при данной патологии составляет 100 % — прогресс очевиден.
Сегодня открытая фетальная хирургия относительно редко применяется в Европе, за исключением операций на плаценте. Крупнейшие европейские центры расположены в Каталонии, Лондоне, Париже. И наоборот, американские центры относительно редко применяют фетоскопию, отдавая предпочтение минимальным по объему лапаротомиям.
Одной из главных проблем при проведении эндоскопических операций является плохая видимость вследствие недостаточной прозрачности околоплодных вод. В начале 2000‑х годов немецкие врачи из Медицинского университета Бонна нашли частичное решение данной проблемы: они закачивают в околоплодную жидкость углекислый газ, безвредный для плода. Таким образом, отпадает необходимость в сложной процедуре замены околоплодных вод. На сегодняшний день ряд клиник по всему миру используют данную методику.
Фетальная хирургия в России
В СССР первую внутриутробную операцию провели в 1989 году в НИИ акушерства и гинекологии им. Д. О. Отта Санкт-Петербурга. Это была коррекция обструктивной уропатии наложением пиелоамнионального шунта. И по сей день в данном медучреждении подобные фетоскопические операции проводятся для лечения обструкции нижних отделов мочевыводящих путей. Также при кистозных поражениях легких плода, гидротораксе применяют внутриматочную эвакуацию жидкости и методику плевроамнионального шунтирования.
Сегодня фетоскопические операции проводятся в ряде клиник Российской Федерации.К сожалению, несмотря на прогресс последних лет, российские успехи в фетальной хирургии на фоне развитых европейских стран и США пока выглядят скромно. Давно назрела необходимость в координации действий всех подразделений здравоохранения, которые занимаются исследованиями плода.
Из-за отсутствия единых методических подходов к диагностике врожденных и наследственных заболеваний во многих регионах страны регистрация пороков развития ведется неадекватно, что в свою очередь приводит к путанице в показателях. Поэтому для развития фетальной хирургии в РФ ряд организационных проблем должен быть решен на самом высоком уровне системы государственного здравоохранения.
Фетальная хирургия врожденных пороков сердца
Завершить цикл статей о фетальной хирургии хочется одними из самых распространенных пороков детского возраста — пороками сердца. Летальность среди детей, рожденных с пороками сердца чрезвычайно высока. К концу первой недели погибают около 29 % новорожденных, к первому месяцу — 42 %, к первому году — 87 %. Раннее хирургическое вмешательство позволяет увеличить выживаемость среди детей, уменьшить количество осложнений. На данный момент фетальная хирургия предлагает нам несколько вариантов вмешательств, и сегодня мы рассмотрим метод чрескожного пункционного введения баллона для патологий, связанных с атрезией или обструкцией физиологических коммуникаций сердца.
Основная цель вмешательства при врожденных пороках сердца — предотвращение развития тяжелой сердечной недостаточности и обеспечение физиологического кровообращения в постнатальном периоде. Для чрескожных внутриутробных операций, о которых будет идти речь в данном материале, подходят формы пороков, имеющие в своем составе сужение клапанных отверстий и фетальных коммуникаций. К данным дефектам относятся: критический стеноз или атрезия аортального клапана, критический стеноз или атрезия легочной артерии без дефекта межжелудочковой перегородки и дефекты с уменьшением или отсутствием овального окна — фетальной коммуникации между предсердиями.
Атрезия легочной артерии без дефекта межжелудочковой перегородки может привести к недоразвитию трикуспидального клапана и правого желудочка и, иногда, к нарушению коронарного кровообращения. Клапанный стеноз аорты приводит к гипоплазии левых отделов сердца. Уменьшенное или отсутствующее овальное окно влияет на развитие левых отделов сердца, так как отсутствует физиологический сброс крови из правого предсердия в левое и, как следствие, левые отделы значительно отстают в развитии. После рождения и запуска легочного кровотока, затрудняется эффективный отток из левого предсердия, давление в аорте не нарастает, в то время как в системе легочных вен значительно увеличивается, повышается нагрузка на правые отделы сердца и продолжается сброс крови из легочного ствола в аорту через артериальный проток, что приводит к гипоксемии.
Идеальный гестационный возраст для лечения составляет от 18 до 30 недель при аортальном стенозе, 22-30 недель для вмешательств на легочном клапане и до 34 недели для вмешательств на межпредсердной перегородке. Необходимо провести тщательное ультразвуковое исследование плода для исключения сопутствующей патологии, определить положение плода и плаценты, а также провести кариотипирование для исключения хромосомной патологии. Особое внимание стоит уделить гемодинамике порока.
Вмешательство проводится под анестезией матери и плода, производится непрерывный ультразвуковой контроль состояния плода и положения катетера. Выбор места пункции зависит от положения плода и типа порока. Для пороков аортального и легочного клапана ход иглы должен совпадать с длинной осью желудочков, для пластики межпредсердной перегородки игла должна проходить через два предсердия. Точность в выборе места пункции очень важна, так как после введения иглы в сердце плода возможны лишь незначительные изменения траектории введения катетера.
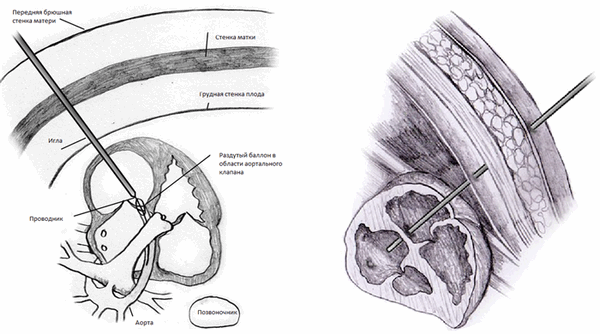
Рисунок 1 | Положение иглы для проведения процедуры
После прокалывания сердца плода через иглу и перфорированный клапан или перегородку пропускают проводник, вдоль которого можно провести маленький катетер с баллоном . Затем иглу извлекают и баллон приводят в правильное положение. Путем многократного надувания баллона, отверстие в клапане или перегородке может быть расширено настолько, насколько это необходимо для обеспечения беспрепятственного кровотока. После этого проводник и катетер медленно и осторожно извлекаются.
Потенциальные осложнения:
- преждевременные роды,
- кровотечение из среднего слоя стенки матки или плаценты,
- травмы сердца плода, включая травмы клапанов и электропроводящей системы, а также близлежащих органов (легкие, печень),
- перикардиальный выпот,
- аритмия и брадикардия плода,
- гибель плода в результате кровоизлияния в мозг, тампонады или водянки.
Подводя итог, можно сказать, что фетальная хирургия, безусловно, перспективный метод лечения врожденной патологии, снижающий перинатальную смертность и количество осложнений, а также улучшающий качество жизни, но необходимо объективная оценка соотношения пользы и риска для плода и матери, четкое соответствие критериям выбора пациентов для вмешательства и тщательный контроль состояния ребенка до и после рождения. Пройдет немало времени до того, как внутриутробные вмешательства станут достаточно безопасными и доступными повсеместно, однако уже сейчас внутриутробные операции могут спасать и улучшать жизнь сотням новорожденных.
Введение

Зарождение жизни — это всегда очень захватывающий процесс. Недаром все мировые религии и более-менее серьезные философские учения сравнивали человека с микрокосмом по аналогии с макрокосмом — вселенной. Однако даже если во вселенной есть воля случая, то тем более от нее не застрахован человек, обреченный в поте лица добывать хлеб и в мучении рождать детей. И если одни случайности полезны — например, мутагенез в Т-клеточном рецепторе или в антителах, а другие — являются данностью и не сильно мешают нам жить, как цвет глаз или предрасположенность к облысению, то третьи случайности приносят нам неудобства и опасности.
Беременность двойней — это случайность. Не в наш век продвинутых технологий, повышающих шанс на двойню, правда, но все же. Однако не всегда эта случайность может быть хорошей. По славной традиции, заложенной Каином и Авелем, Иаковом и Исавом, один близнец пытается убить другого, даже не выйдя из утробы матери. Такое явление ученые назвали ишиопаг, или близнец-паразит. Близнец-паразит не способен жить самостоятельно, поэтому, как правило, рождается уже мертвым, но до родов он получает питание за счет здорового близнеца, попутно доставляя ему неприятности, вплоть до риска мертворождения.
Наиболее редкая форма ишиопага — это акардия, когда здоровый близнец то ли был вынужден поставлять кислород и питательные вещества менее способному сородичу, то ли, наоборот, победил его и «накормил до смерти». Но обо всем по порядку.
Историческая справка
«Четвертого декабря 1551 года, в пятницу… родились трое детей… Один из них был маленьким мальчиком, который умер вскоре после крещения… Изображенный здесь третий имел удивительно редкую и устрашающую форму. Ибо у него не было ни головы, ни рук, можно было различить только туловище и ступни. Это был мертворожденный ребенок. Поскольку такие устрашающие чудовища без сомнения указывают на гнев Бога, весь христианский люд должен каяться и молиться… чтобы предотвратить наказание».
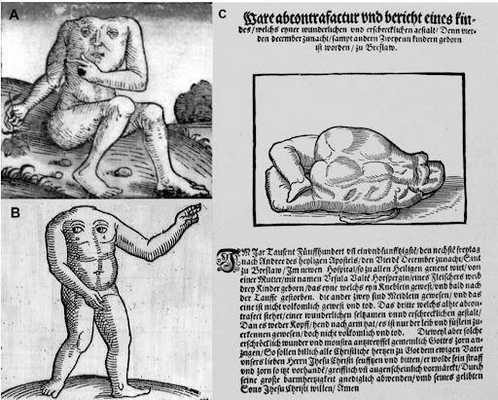
A — «Безголовый блеммии» из Нюрнбергской хроники Хартмана Шеделя, 1493. B — Рисунок из «Хроники чудесных и знаменательных событий» Конрада Ликосфена, 1557. C — Иллюстрация «Пугающее чудовище» в брошюре из польского города Вроцлав, 1551.
Неонатальные патологии, в частности акардические новорожденные, известны с древности. Так, свидетельства об этом встречаются и в Талмуде (III-V век), и у Геродота (V век), и в других средневековых европейских источниках. В одних источниках отмечалось, что это мертворожденные дети, в других же, как у Геродота, подчеркивалась жизнеспособность подобных объектов [3].
Почти каждый деформированный выкидыш тогда называли moon-calf, подразумевая негативное влияние Луны на беременность. Наиболее известный пример moon-calf — персонаж Калибан, уродливый слуга герцога Просперо из пьесы Шекспира «Буря». Однако безголовый плод был из ряда вон выходящим событием.
Несмотря на то, что акардия — довольно редкая патология, народная молва и мистический ужас перед безголовыми младенцами сильно раздули проблему, поэтому священник и врач Франческо Кангиамило постановил в 1745 году, что подобных новорожденных, не имеющих головы, не нужно крестить, так как у них нет души, которая, «как всем известно, в мозгу». Кангиамило не был первым, потому как еще Аристотель связывал человеческую душу с когнитивными процессами. Таким образом, можно сделать вывод, что с акардией человечество было знакомо давно.
Но несмотря на такое давнее знакомство, только в 1812 году врач Иоганн Фридрих Меккель-младший пришел к выводу, что акардия каким-то образом связана с близнецами, но как именно, он так и не понял. Лишь его племянник, Генрих, 38 лет спустя смог объяснить патогенез акардии, тогда как народ и некоторые ученые связывали рождение безголового плода с тем, что беременная женщина наблюдала, как приговоренному отрубали голову.
Патогенез и классификация
Со времен Меккеля нам известно, что акардия — это патология, встречающаяся у моноплацентарных близнецов. Другое название — TRAP, twin reversed arterial perfusion, или синдром близнецовой ретроградной артериальной перфузии. Здоровый близнец «накачивает» своего менее удачливого брата дезоксигенированной кровью, от чего тот и становится акардическим. Но каков патогенез этого явления? Почему вдруг здоровый эмбрион перекачивает кровь не обратно в плаценту, а в другого близнеца?
На данный момент известны две гипотезы, и обе связаны с артерио-артериальными анастомозами [2, 6].
Первая гипотеза связывает явление с артерио-артериальным анастомозом между близнецами. Напомним кровоснабжение нормального плода, чтобы понять патогенез акардии в данном случае.
Начинается плацентарное кровообращение с входящей в состав пупочного канатика пупочной вены, которая впадает в печень. Из органа кровь поступает в венозный проток, сообщающийся с нижней полой веной. По нижней полой вене богатая кислородом кровь попадает в правое предсердие, откуда через овальное окно попадает последовательно в правое предсердие и правый желудочек, откуда уже через аорту доставляется во все органы. Отток дезоксигенированной крови происходит через пупочные артерии, тоже входящие в состав пупочного канатика.
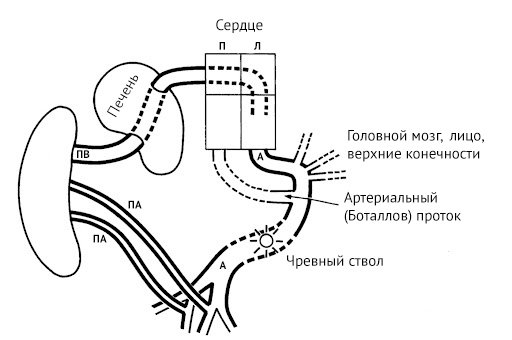
Первая гипотеза объясняет, почему нижние конечности у акардического близнеца развиты лучше, чем верхние: частично оксигенированная кровь идет по подвздошным артериям по обратному пути [7]. И напротив, низкое давление в ретроградно кровоснабжаемой верхней части тела и низкое насыщение кислородом ухудшают развитие этой области.
В пользу этой гипотезы говорят данные о том, что при уменьшении площади плаценты или снижении кровенаполнения ее сосудов кардиомиоциты развиваются намного медленнее, чем в норме [1].
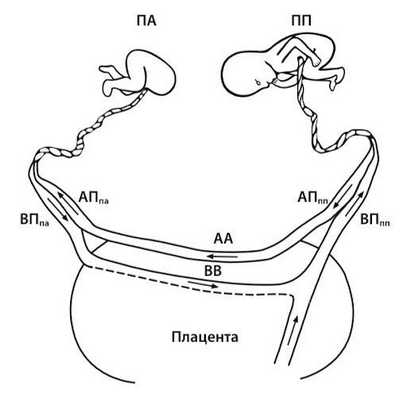
ПА — плод-акардиус, ПП — плод-помпа, АППА — артерия пуповины плода-акардиуса, АППП — артерия пуповины плода помпы, ВППА — вена пуповины плода-акардиуса, ВППП — вена пуповины плода-помпы.
Источник: Михайлов А.В с соавт. Синдром обратной артериальной перфузии: патофизиологические аспекты и принципы диагностики. Таврический медико-биологический вестник, 2018.
Другая гипотеза связывает акардию с врожденными патологиями сердца. В отличие от первой гипотезы, где сердце атрофируется в результате ретроградного тока, эта гипотеза утверждает, что именно пороки сердца в эмбриогенезе дают возможность обратной перфузии, а не наоборот, хотя дальнейшее описание патогенеза мало чем отличается. Из-за пороков сердца давление в пупочной артерии акардического близнеца ниже, чем у здорового (называемого насосным), что и приводит к обратной перфузии. Если кровяное давление здорового близнеца превышает систолическое желудочковое давление близнеца с пороком сердца, сердце второго не может перекачивать кровь в достаточном объеме и атрофируется [7]. Во второй гипотезе акардический близнец не жертва со стороны своего собрата по утробе, а скорее паразит, использующий анастомозы для частичного выживания.
Несмотря на то, что исследователи находят у акардических близнецов кариотипы, отличные от здоровых близнецов, этиология таких отличий в геноме остается не до конца ясной, чтобы делать какие-то выводы касательно верности одной из двух вышеуказанных гипотез.
Таким образом, для формирования синдрома обратной артериальной перфузии необходимо выполнение следующих условий:
- наличие сосудистого артерио-артериального анастомоза между артериями пуповины двух плодов;
- относительный градиент давления крови в артериальных системах гемоциркуляции на ранних этапах эмбрионального развития монохориальной многоплодной беременности.
Помимо наличия двух гипотез, которые основаны на сходном наборе данных и приводят к диаметрально противоположным выводам о причинах развития такой патологии, акардия поражает нас еще и большим выбором вариантов, словно мы оказались в патологическом гастрономе [2].
Так, среди акардических близнецов есть ацефалы, не имеющие головы, но у них могут быть сформированы конечности. Органы грудной клетки у таких близнецов обычно отсутствуют, и их место занимают аморфные ткани. Это, пожалуй, самый распространенный тип акардических близнецов.
Если этого недостаточно, то природа может предоставить анцепсов, имеющих большинство частей тела, пусть и плохо сформированных, или акормусов, представляющих одну голову с пуповиной. Если и этого покажется мало, то есть и аморфусы, крайне редкая форма акардического близнеца. Как следует из названия, такой близнец напоминает скорее аморфный кусок тканей с кровеносными сосудами, а не что-то человеческое.
Синдром фето-фетальной трансфузии
Говоря о патогенезе, стоит ответить на вопрос: какую роль играет плацента в развитии сердца плода? Плацента, как всем известно, очень важный орган в эмбриогенезе. Именно плацента является поставщиком кислорода и питательных веществ для эмбриона и барьером для ксенобиотиков. А поскольку экспрессия генов в эмбриогенезе — очень чувствительный и тонкий процесс, именно плацента может влиять на дифференцировку кардиомиоцитов и морфогенез сердца [8].
В течение первых недель беременности спиральные артерии матери, которые в конечном итоге будут кровоснабжать плаценту, претерпевают сильные изменения, которые включает потерю эластина и утрату активности (или полную атрофию) гладких миоцитов из их стенок и расширение конечных сегментов, которые открываются в межворсинчатое пространство. С нарушением перестройки сосудов связывают такие патологии, как преэклампсия, преждевременные роды или выкидыши.
Когда речь заходит о близнецах, все немного иначе. Так как акардия в основном встречается у монозиготных близнецов, то в этиологии пороков сердца также есть две гипотезы [5]. Одна из гипотез утверждает о взаимосвязи между процессом разделения близнецов в эмбриогенезе и восприимчивостью к другим повреждающим факторам, так что нарушается развитие сердца по крайней мере у одного близнеца. Другая гипотеза настаивает на том, что существует неравное деление массы эмбриональных клеток, что создает заведомо неравный потенциал для развития.
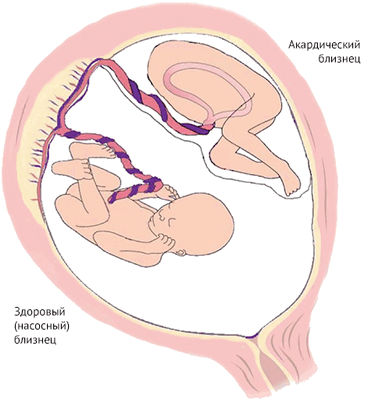
Этиология врожденных пороков сердца у близнецов изучена недостаточно. Можно только сказать, что такие поражения сердца являются следствием гемодинамических аномалий, которые могут возникнуть в результате синдрома фето-фетальной трансфузии (СФФТ), когда из-за общей плаценты монозиготные плоды могут иметь общее кровоснабжение [4]. Несмотря на тот факт, что каждый имеет свое место в плаценте, в ней могут образовываться анастомозирующие сосуды, кровь по которым способна перетекать от одного плода к другому, вызывая диспропорцию в ее объемах. В зависимости от направления тока крови, один из плодов становится «донором», второй — «реципиентом».
Ничего не напоминает? Да, TRAP — это один из вариантов СФФТ, наиболее серьезный. И соответственно работает по тому же принципу, когда один из близнецов — донор, а другой — реципиент. Отличаться будет только жизнеспособность обоих плодов.
Да, именно обоих. Акардический близнец шансов выжить не имеет, независимо ни от чего. Как только близнецы появляются на свет и пуповины перерезают, он жить более не способен. Однако СФФТ и акардия в том числе не просто так находятся в списке ишиопагов. Так как всю работу по перекачке крови за двоих делает лишь один близнец, то это грозит ему сердечной недостаточностью и многоводием [9]. Поэтому для здорового близнеца вероятность умереть составляет около 55 %, что, конечно, добавляет азарта ситуации, но угрожает здоровью матери. Причем риск развития сердечной недостаточности для насосного близнеца растет вместе с акардическим близнецом, который, как правило, превышает размеры своего здорового родственника [10]. Более того, помимо развития сердечной недостаточности у насосного плода может развиться и гипоксия тканей: так как ток крови в акардическим плоде обратный, то дезоксигенированная кровь отводится им через пупочную вену в плаценту, откуда может поступать в кровоток насосного [9]. Поэтому принято проводить хирургическое вмешательство: рассечение анастомозов в первые 16 недель, когда риски для насосного близнеца не так высоки.
Что еще более интересно и заслуживает отдельного внимания, так это морфология акардического близнеца, которая способна повлиять на внутриутробную смерть насосного: так, среди наиболее опасных критериев является формирование у акардиуса почек [11, 12]. И стоит объяснить, почему это так.
Так как циркуляция амниотической жидкости сопряжена с мочевыделением и обратным заглатыванием жидкости (трансмембранный путь реабсорбции в работе van Gemert считается незначительной), почки играют решающую роль в этом процессе наряду с глотательным рефлексом. А так как при акардии не развивается головной мозг, то глотательные движения невозможны, что снижает реабсорбцию амниотической жидкости при сохранившемся выделении и приводит к многоводию. И напротив, если почки у акардического плода не развиты, то это может привести к его отеку и увеличению массы, что тоже угрожает здоровому плоду и матери. Согласно данным работам, более дифференцированный вид акардиака несет больше вреда для насосного близнеца.
Заключение
Таким образом, акардиальный плод, словно камикадзе, вредит здоровому близнецу всеми доступными — и довольно ограниченными — способами. И хотя данная патология довольно редка, в наш век развития вспомогательных репродуктивных методик, которые повышают возможность монозиготной многоплодной беременности, не стоит недооценивать риски.
Сегодня акардический плод более не внушает мистический ужас и не связывается больше ни с фазами Луны, ни с гневом бога, ни с тем, что мать ребенка видела казнь. Однако несмотря на развитие науки и наше сегодняшнее понимание патогенеза, все равно остается много белых пятен и спорных вопросов, которые еще не решены.
Так, нет окончательного ответа касательно гипотезы возникновения ретроградной перфузии. И хотя большинство ученых склоняется к версии, что сердце развивается нормально и лишь потом атрофируется из-за ретроградного тока, у второй гипотезы тоже есть большое число сторонников. Генетические факторы до конца не ясны. К тому же нет четкого мнения об этиологии сердечной недостаточности у монозиготных близнецов, что делает сложным окончательное решение данных дилемм.
Фетальная хирургия
Задать вопрос онлайн
Заказать обратный звонок
Сегодня мы поговорим о том, как развивается в нашей стране такая область медицины, как фетальная хирургия. Наш собеседник - кандидат медицинских наук, врач акушер-гинеколог Научного центра акушерства гинекологии и перинатологии им. В.И. Кулакова, Кристина Гладкова .

- Кристина Александровна, расскажите подробнее о фетальной хирургии.
Фетальная хирургия - это хирургия пода, когда мы можем корригировать какие-либо патологические состояния внутриутробно, то есть во время беременности: проводить операции на плоде или на плаценте во время беременности.
- В фетальной хирургии используются разные технологии?
Да, конечно. Существуют несколько методик.
Одна из них - это пункционная методика , когда хирург тонкой иглой попадает в сосуды пуповины плода и, например, берет кровь на определенные исследования, делает переливание крови плоду или вводит определенные лекарства. То есть лечит непосредственно самого ребенка внутриутробно.
Есть скопические методики (фетоскопии) , когда с помощью определенной аппаратуры (фетоскопа) - мы можем входить в полость к плоду; с помощью лазера коагулировать патологические сосуды на плаценте; либо вводим баллон в трахею плода при определенных пороках, например, диафрагмальных грыжах.
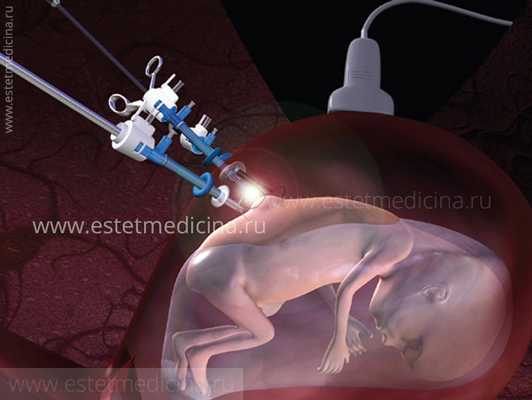
И также существует открытая хирургия , когда делается разрез на матке, немного извлекается плод (при этом пуповина не пересекается), и проводится операция. Хирургические вмешательства выполняются совместно с нейрохирургами, детскими хирургами: удаляют опухолевидные образования, корригируют патологические состояния (одно из них - Спина бифида), затем матка ушивается и беременность пролонгируется.
- Внутри матери плод находится в мешке, в котором находятся еще и околоплодные жидкости, правильно? А как этот мешок не разрывается при таких вмешательствах и эта жидкость не вытекает?
Он рассекается и жидкость вытекает. Жидкость собирают и восстанавливают обратно, либо замещают определенными растворами, которые сходны по биохимическому составу с околоплодными водами.
- Звучит фантастически. Как вообще врачи пришли к этому?
Есть определенные патологические состояния, которые врачи могут корригировать внутриутробно, и мы понимаем, что если не сделаем сейчас эту операцию, то уже после рождения, мы плоду помочь не сможем.
- То есть скорее всего, ребенок погибнет сразу после родов?
Малыш может погибнуть сразу после родов, либо может потребоваться серьезная операция. Приведу пример, после родов может потребоваться пересадка почек при таком состоянии, как обструкция нижних отделов мочеполовой системы, когда внутриутробно настолько страдают почки, что если не помочь во время беременности, то ребенок рождается с тяжелой почечной недостаточностью. Либо, при монохориальной двойне с фето-фетальным синдромом, если хирурги не проведут лечение внутриутробно, вероятность гибели малышей - 90%.
- Расскажите подробнее о монохориальной двойне с фето-фетальным синдромом . . .
Монохориальная двойня - это беременность близнецами с одной плацентой, то есть близнецы располагаются в разных мешках, но плацента одна на двоих. Это детки всегда однополые, всегда похожи друг на друга после рождения. Это прекрасно, но, к сожалению, при таком варианте плацентации возможны специфические осложнения, например, фето-фетальный транфузионный синдром. При этом синдроме кровоток между близнецами объединяется, и существуют патологические сосуды, которые объединяют близнецов, и оба плода страдают.
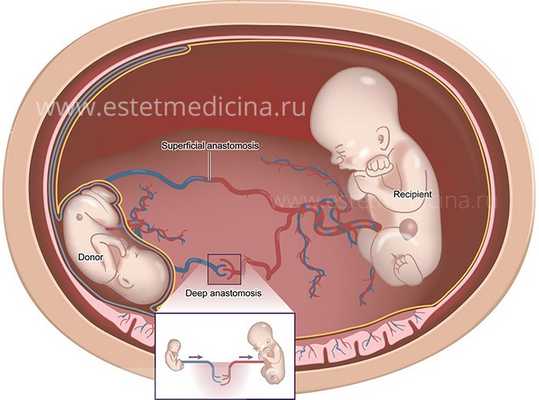
Кровь перераспределяется между близнецами таким образом, что у одного - нарастает выраженное многоводие (страдает сердце из-за выраженной гиперфункции), а у другого - совсем нет околоплодных вод (у него страдают почки, выражена анемия).
В такой ситуации, хирурги могут помочь внутриутробно (прервать патологический кровоток во время беременности), а после рождения - нет. Проводится такая операция при помощи фетоскопии, когда с помощью лазера коагулируются патологические анастомозы (переплетения сосудов) и, тем самым, купируется патологический кровоток.
- Как проходит такая операция?
Такая операция проходит под контролем ультразвука с обезболиванием. Проводится пункция передней брюшной стенки, вводится фетоскоп близнецу с многоводием, лазер коагулирует патологические анастомозы. Коагуляция сосудов проводится бесконтактно для близнецов. В завершении хирург осматривает всю плаценту, для того, чтобы удостовериться, что все патологические сосуды скоагулированы. Это новая высокотехнологичная техника, которая относительно недавно начала применяться в России и имеет хорошие результаты.
- Есть ли какие-то риски для матери при подобных операциях?
При фетоскопических операциях риски небольшие. Конечно, это вмешательство, которое проводятся под анестезией, это инвазивная методика, но для матери риски небольшие. Есть риски для беременности, среди них - потеря беременности.
- А еще какие осложнения возможны?
Отслойка плаценты, преждевременные роды, излитие вод.
- Сейчас вы рассказали об операциях на плаценте, но вы еще упомянули операции непосредственно на теле малыша, который находятся в утробе матери. Ребенок во время операции чувствует боль?
Нет, мы его обезболиваем. То есть, когда мы проводим операции на плаценте, мы не обезболиваем плод. В случае, проведения операции на плоде - обязательно вводятся анестетики. Ребенок чувствует боль, поэтому его также обезболивают.
- А это внутриутробное обезболивание как-то сказывается на неврологическом статусе малыша?
Речь о микродозах анестетиков, поэтому они вряд ли сказываются на плоде. Международных данных об этом нет. И потом, если мы говорим про открытую хирургию, то бригада анестезиологов-реаниматологов постоянно проводит мониторинг не только состояния матери, но и состояния ребенка. То есть пока хирурги оперируют, ребенок, как и взрослый пациент, помимо того, что обезболен, ему проводится мониторинг всех функций жизнедеятельности.
- Кристина Александровна, кроме Центра им. В.И. Кулакова в России во многих учреждениях проводятся такие операции?
Нет, не во многих. Все описанные состояния плода - это редкие патологии, и хирурги должны делать много операций, чтобы приобрести опыт. Внутриутробные операции проводятся в Санкт-Петербурге, Екатеринбурге, Томске, в Москве у нас (НЦАГП им. В.И. Кулакова), а также в Центре планирования семьи и репродукции (ЦПСиР). Такие операции не проводятся в больницах, они проводятся только в федеральных центрах.
Самое страшное для родителей - это когда дети болеют. Как хорошо, что появляются методики, способные вылечить наших детей еще до появления на свет. Спасибо вам за интервью!
Читайте также:
- Влияние раздражающих токсинов на обоняние. Клеточная реакция дыхательных путей на раздражающие токсины
- Реактивное увеличение лимфатических узлов шеи
- Причины синдрома реактивной болезни дыхательных путей (СРБДП) и ее критерии
- Зимний уход за волосами. Как сохранить пряди здоровыми?
- КТ при атрезии овального окна
