Фиброматоз десмоидного типа - лучевая диагностика
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Десмоидные фибромы (синоним - агрессивный фиброматоз) представляют собой мезенхимальные опухоли мягких тканей. Исторически сложилось разделение десмоидных фибром (ДФ) на истинные (растущие в пределах прямой мышцы живота) и экстраабдоминальные, хотя по гистологическому строению эти опухоли абсолютно идентичны. Долгое время среди патоморфологов существовало предположение, что ДФ - это результат реактивного процесса в тканях, однако генетические исследования позволили подтвердить истинный опухолевый характер патологии. ДФ, как и другие новообразования, являются моноклональными, то есть происходят из одной клетки. Макроскопически ДФ представляют собой один или несколько плотных узлов либо инфильтратов без четких границ, а под микроскопом не видно типичной для опухолей клеточности - это поля волокнистой соединительной ткани с вкраплениями единичных фиброцитов и фибробластов. При такой, казалось бы, безобидной микроскопической сущности клинически ДФ проявляют выраженную агрессивность в виде быстрого роста, темп которого превышает таковой у некоторых сарком мягких тканей, вовлечения соседних анатомических структур, а иногда и узурации подлежащей кости. В случае выжидательной тактики или неадекватного лечения ДФ могут достигать огромных объемов и веса в 20-30 кг. При такой местно-деструирующей активности ДФ не дают ни регионарных, ни отдаленных метастазов. У пациентов даже с огромными десмоидами не наблюдается раковой кахексии, характерной для злокачественных опухолей. Непосредственной причиной смерти при ДФ может быть сдавление опухолью жизненно важных органов или сосудов, кровотечение вследствие изъязвления больших узлов.
ДФ являются достаточно редкой патологией - 2-4 случая на 1 миллион человек в год и всего 0.03-0.1% среди опухолей мягких тканей человека. Низкая частота значительно затрудняет изучение этой патологии и систематизацию накопленного опыта, поскольку каждая отдельно взятая клиника располагает лишь небольшим числом наблюдений. Так, среди публикаций за 2000-2004 годы более трети статей представляют собой описание лишь одного клинического случая, а в наиболее значимых работах приводятся данные о 18, 72, 83 пациентах за 25-27 лет наблюдения. В МНИОИ им. П.А. Герцена проблемой ДФ занимаются более 50 лет, и на сегодняшний день институт располагает уникальным опытом лечения 376 пациентов, страдающих агрессивным фиброматозом. Поскольку многие пациенты помимо первичного лечения неоднократно получали различные виды терапии по поводу рецидивов, мы смогли проанализировать эффективность этих воздействий в 781 случае. За столь длительный период взгляды на этиологию, патогенез и методы лечения ДФ претерпели значительную эволюцию.
Этиология ДФ на сегодняшний день неясна. В качестве причин их развития обсуждают генетические нарушения, эндокринные факторы, а также, возможно, предшествующую травму. У 15% больных удалось выявить соматические мутации гена APC (гена аденоматозного полипоза толстой кишки), одна из функций которого заключается в регуляции клеточного содержания белка β-катенина. Повышение содержания этого белка приводит к усилению пролиферативной активности фибробластов. Мутации гена АРС могут быть причиной формирования синдрома Гарднера - семейного аденоматозного полипоза толстой кишки, который является облигатным предраком. При этом синдроме ДФ возникают в 1000 раз чаще, чем в популяции, причем в 80% случаев провоцирующим фактором оказывается оперативное вмешательство - гемиколонэктомия. Существует мнение, что десмоидные фибромы следует рассматривать как внекишечные проявления синдрома Гарднера. Получены данные и о других генетических дефектах при ДФ, а именно, повышении экспрессии антиапоптотических белков Bcl-2, Bcl-XL, surviving, NF-kB, снижении экспрессии проапоптотического белка Bax. Однако эти исследования отличаются крайне небольшим числом наблюдений, и их результаты нуждаются в уточнении, развитии, анализе и систематизации. В пользу генетических нарушений в этиологии ДФ свидетельствует и тот факт, что ДФ достаточно часто сочетаются с другой патологией соединительной ткани (нейрофиброматоз, аномалии развития костей).
Постулат об этиологической роли гормональных нарушений в развитии десмоидных фибром выдвинули Geschickter и Lewis (1935), которые обнаружили, что десмоиды активно накапливают гормоны передней доли гипофиза. В 1944 году Lipsсhutz и Girsmali в экспериментах на животных путем введения в грудную стенку эстрогенов в 100% случаев получили опухоли, близкие по строению к десмоидам, которые резорбировались после прекращения этих инъекций. В дальнейших исследованиях Lipsсhutz с соавт. (1956) отметили угнетение роста индуцированных опухолей путем введения тестостерона, прогестерона, дезоксикортикостерона. В 1980 году Loch и Baer также получили десмоидные опухоли в эксперименте при введении животным больших доз эстрогенов. Экспериментальные данные об участии эстрогенов в патогенезе десмоидных фибром были подтверждены и клиническими наблюдениями. Havry (1982) установил, что скорость роста десмоидов у мужчин в любом возрасте примерно одинакова и невысока. У женщин в течение жизни темп роста опухоли меняется существенно - у девочек он низкий, в репродуктивном возрасте он возрастает вдвое и, утраиваясь, достигает максимума в пременопаузе. После наступления менопаузы темп роста десмоидов снижается практически до исходного, приближаясь к таковому у мужчин. Многими исследователями констатировано ускорение темпа роста опухолей у женщин во время беременности. Описан случай развития огромного десмоида мягких тканей бедра у мужчины на фоне длительного лечения эстрогенами по поводу диссеминированного рака предстательной железы. После отмены гормонов опухоль медленно резорбировалась.
В пользу травмы в этиологии ДФ свидетельствует тот факт, что большинство пациентов при тщательном расспросе вспоминают, что возникновению образования предшествовал ушиб мягких тканей, либо перелом конечности. Некоторые из пациентов профессионально занимались спортом. В ряде случаев ДФ возникали на месте внутримышечных, после укуса осы. Противники этой теории выдвигают аргумент, что высокая частота травм мягких тканей не соответствует крайне низкой частоте возникновения ДФ.
Как правило, в стационарах общей хирургии или онкологии в виду незнания этой патологии, ДФ удаляют, после чего уже в ближайшем послеоперационном периоде наблюдают продолженный рост опухоли. Начинается тягостное путешествие пациента от хирурга к хирургу, увеличивают объем хирургического пособия, но неизбежный результат - тяжелая инвалидизация вследствие калечащих операций и прогрессирующего роста десмоидов. Частота рецидивов после оперативного лечения составляет по нашим данным 94%, по данным зарубежных авторов - 24-87%. Изучая много лет эти своеобразные новообразования, мы полагаем, что причиной неудач хирургического лечения, особенно при экстраабдоминальной локализации, служат морфологические особенности ДФ: аппозиционный характер роста, отсутствие капсулы и наличие выростов - спикул, которые в виде тонких нитей могут распространяться на многие сантиметры от основного массива опухоли.
Неудовлетворительные результаты хирургического лечения послужили предпосылкой для попытки дополнительного противоопухолевого лечения: лучевой терапии и химиотерапии.
В 40-х годах в МНИОИ им. П.А. Герцена впервые начали применять лучевую терапию как самостоятельный метод лечения у пациентов, не подлежавших хирургическому вмешательству или отказавшихся от ампутации или экзартикуляции. Несмотря на то, что при этом речь шла об очень больших по объему поражениях, результаты превзошли все ожидания: при наблюдении в течение 15-20 лет частота рецидивов не превышал 15%, да и то это были краевые рецидивы либо рост по продолжению, что расценено как результат неадекватности объема облучения. Радиобиологического объяснения высокой эффективности лучевой терапии этих опухолей, состоящих в основном из волокнистой соединительной ткани с вкраплениями единичных фиброцитов и фибробластов, не существует. Однако науке известны и другие примеры, когда факты опережают их интерпретацию. На основании этого опыта мы предложили использовать лучевую терапию как компонент комбинированного лечения при резектабельных десмоидах. Предоперационное и послеоперационное облучение экстраабдоминальных ДФ позволило снизить частоту рецидивов с 94% до 27.5% и 53.6% соответственно. Эти показатели побудили нас отказаться от хирургического лечения даже резектабельных опухолей и отдать предпочтение самостоятельной лучевой терапии. Тем не менее, несмотря на сравнительно высокую эффективность лучевой терапии, нередко ее применение невозможно из-за необходимости подведения радикальной дозы к слишком большим объемам ткани, при грубых трофических изменениях покровных тканей в результате многократных операций и ранее проведенного облучения. Поэтому мы продолжили поиск других вариантов лечения десмоидных фибром.
В стенах МНИОИ им. П.А. Герцена впервые в нашей стране при лечении десмоидных фибром стали апробировать химиотерапию. Подводя итоги этого опыта сегодня, мы можем сказать, что при ДФ противоопухолевое воздействие оказывают 2 препарата: винбластин и метотрексат, что обосновывает их включение в комплексное лечение.
Химиолучевое лечение позволяет добиться излечения большого числа больных. Вместе с тем, нельзя не учитывать негативных сторон влияния этих воздействий на организм-опухоленоситель, особенно в детском и детородном возрасте. Анализ собственного многолетнего опыта ведения пациентов с ДФ позволил выявить убедительные признаки гормонозависимости данных новообразований. Так, среди взрослых пациентов превалируют молодые женщины (80%). Часто появление опухоли или развитие рецидива связано с беременностью (у 24.3% больных). Известны случаи самопроизвольной регрессии десмоидных фибром у женщин с наступлением менопаузы. Пациентки, как правило, имеют сопутствующую гинекологическую патологию - эндометриоз, миомы матки, различные нарушения менструального цикла. У мужчин наблюдается отложение жировой клетчатки по женскому типу (76%), гинекомастия (75%), никогда не встречаются истинные десмоиды. Распределение больных по возрасту возникновения ДФ также указывает на участие половых гормонов в патогенезе этого заболевания. Убедительные данные в пользу гормонозависимости ДФ явились основой для включения в комплексное лечение ДФ гормонотерапии.
Исследование начато в 70-х годах 20 века. Поскольку ведущую роль в патогенезе ДФ согласно клиническим наблюдениям играли именно эстрогены, мы стали использовать антиэстроген тамоксифен и получили хороший эффект - при сочетании гормонотерапии с химиотерапией или лучевой терапией темпы резорбции опухолей значительно ускорялись, что в ряде случаев позволило сократить длительность лечения. Результаты гормонального обследования пациентов в динамике позволили установить, что повышение уровня эстрадиола является неблагоприятным прогностическим фактором в отношении возникновения рецидива или увеличения темпов роста опухоли.
Несмотря на очевидную клиническую эффективность тамоксифена, механизм его действия при ДФ и причины отсутствия эффекта у ряда больных пока не ясны. Считается, что основной механизм действия тамоксифена - это конкурентное связывание с эстрогеновыми рецепторами (ЭР), не позволяющее эстрогенам присоединиться к этим рецепторам и запустить синтез белка. Этот механизм объясняет высокую эффективность тамоксифена в лечении ЭР-положительного рака молочной железы, однако многолетние исследования показали, что определенный процент пациенток с ЭР-отрицательным раком молочной железы также оказывается чувствительным к тамоксифену. Этот феномен объясняют ЭР-независимыми механизмами антипролиферативного действия тамоксифена: ингибированием активности протеинкиназы С, связыванием с кальмодулином и ингибированием цАМФ фосфодиэстеразы, влиянием на факторы роста (TGF-β, IGF-I, IGF-II). Работы по определению ЭР в ткани десмоидных фибром отличаются крайне небольшим числом обследованных пациентов. Согласно их результатам в подавляющем большинстве случаев десмоиды являются ЭР-отрицательными опухолями. В связи с этим механизмы действия тамоксифена на десмоидные фибромы нуждаются в уточнении.
Таким образом, согласно современным знаниям, ДФ представляются тяжелой патологией соединительной ткани, отличающейся высокой склонностью к прогрессированию и рецидивированию при использовании традиционных методов лечения. Успешные попытки гормонотерапии, полностью соответствующие концепции о ДФ как системном гормонозависимом заболевании, а также низкая частота побочных эффектов в сравнении с химиотерапией и облучением позволяют считать развитие этого направления перспективным в лечении больных с агрессивным фиброматозом. В МНИОИ им. П.А. Герцена продолжаются исследования, связанные с применением различных вариантов гормонотерапии, однако уже накопленный на сегодняшний день положительный опыт позволяет рекомендовать самостоятельную антиэстрогенную терапию в качестве первичного лечения у пациентов, обратившихся как по поводу впервые диагностированной ДФ, так и по поводу рецидивов после оперативного, лучевого или лекарственного лечения.
Десмоидные фибромы
Десмоидные фибромы - это опухоли мезинхимальной природы, которые относятся к классу пограничных опухолей, так как не метастазируют, однако склонны к агрессивному местному росту и частому рецидивированию. Десмоидные фибромы (ДФ) могут развиваться из мышечно-апоневротических структур практически любой анатомической области тела, включая брюшную стенку, грудную стенку, конечности, шею, в ряде случаев наблюдается мультифокальный рост опухолей.
В зависимости от локализации выделяют:
- абдоминальные десмоидные фибромы (опухоли передней брюшной стенки)
- интраабдоминальные (опухоли забрюшинного пространства)
- экстраабдоминальные (опухоли туловища, конечностей)
- мультифокальные (множественные опухоли различных локализаций)
Причины возникновения десмоидных фибром
Как правило, пациенты обращаются к врачу по поводу безболезненного опухолевого образования, болевые ощущения и другие симптомы обычно связаны с вовлечением в опухолевый процесс близлежащих структур. Большинство пациентов с десмоидными фибромами экстраабдоминальной локализации связывают появление опухоли с предшествующей травмой. Десмоидные фибромы абдоминальной локализации зачастую развиваются у женщин после беременности или кесарева сечения. Интраабдоминальные десмоидные фибромы чаще всего сочетаются с полипозом толстой кишки (синдрома Гарднера).
Десмоидные фибромы-диагностика
- Морфологическая верификация опухоли при помощи выполнения трепан-биопсии или открытой биопсии.
- Магнитно-резонансная томография или компьютерная томография опухоли. Эти исследования позволяют адекватно оценить распространенность опухолевого процесса, прилежание опухоли к магистральным сосудисто-нервным структурам, степень вовлечения прилежащих анатомических структур и как следствие сделать вывод о возможности проведения хирургического лечения.
- Также всем пациентам с диагнозом десмоидная фиброма рекомендовано проведение колоноскопии для исключения полипоза толстой кишки.
Десмоидная фиброма-лечение
Группа специалистов (хирурги, радиологи, онкологи, морфологи) задействованы в лечении опухоли. После постановки диагноза десмоидная фиброма вариант лечения подбирается индивидуально для каждого пациента. К числу доступных вариантов лечения пациентов относятся динамическое наблюдение, хирургическое лечение, лучевая терапия и системная терапия (гормональные препараты, химиотерапия).
В зависимости от локализации опухоли возможны различные варианты хирургического лечения. Для достижения лучших онкологических и косметических результатов применяются различные виды пластики послеоперационного дефекта после удаления опухли.
При абдоминальных десмоидных фибромах пластика производится композитной сеткой. При экстраабдоминальной локализации опухоли в качестве пластического компонента могут быть использованы местные ткани, перемещенные или пересажанные лоскуты, а также различные виды модульных эндопротезов в случае вовлечения кости в опухолевый процесс. Помимо хирургического лечения в нашем Институте изучены и внедрены в практику эффективные схемы системного лекарственного лечения, а также лучевая терапия. Все описанные выше методы лечения могут применятся как отдельно, так и в комбинации для достижения наилучшего результата.
Десмоидная фиброма-прогноз заболевания
Так как десмоидные фибромы не относятся к злокачественным опухолям, прогноз заболевания благоприятный. Проведение радикальной операции позволяет снизить риск рецидива.
Филиалы и отделения, где лечат десмоидные фибромы
МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отделение хирургического лечения центральной нервной и костно-мышечной систем
Врач-онколог ЯДРИНА Анна Викторовна
Десмоидная опухоль
Десмоидная опухоль - опухоль, развивающаяся из мышечно-апоневротических структур и занимающая промежуточное положение между доброкачественными и злокачественными новообразованиями. Склонна к прорастанию окружающих тканей, но не дает отдаленных метастазов. Может возникать на любом участке тела, чаще локализуется в области передней брюшной стенки, спины и плечевого пояса. Представляет собой плотное опухолевидное образование, расположенное в толще мышц или связанное с мышцами. При прогрессировании может прорастать сосуды, кости, суставы и внутренние органы. Диагноз выставляется на основании осмотра и данных дополнительных исследований. Лечение - оперативные вмешательства, лучевая терапия, химиотерапия.
Общие сведения
Десмоидная опухоль (десмоид, десмоидная фиброма, мышечно-апоневротический фиброматоз) - редкая соединительнотканная опухоль, развивающаяся из фасций, мышц, сухожилий и апоневрозов. Микроскопически лишена признаков злокачественности и никогда не дает отдаленных метастазов, при этом склонна к местному агрессивному росту и частому рецидивированию (нередко многократному), поэтому онкологи рассматривают десмоид как условно-доброкачественное новообразование. Составляет 0,03-0,16% от общего количества новообразований. В 64-84% случаев страдают женщины.
У представительниц слабого пола десмоидная опухоль обычно возникает на втором или третьем десятилетии жизни, в 94% случаев выявляется у рожавших пациенток, в 6% случаев - у нерожавших. У больных мужского пола десмоид чаще диагностируется в детском или подростковом возрасте. В постпубертатном периоде количество случаев заболевания у мужчин резко уменьшается. Обычно наблюдается медленное прогрессирование. Диагностику и лечение десмоидных опухолей осуществляют специалисты в области онкологии, дерматологии, хирургии, травматологии и ортопедии.
Причины и патанатомия десмоидной опухоли
Причины развития десмоидной опухоли пока остаются невыясненными. В качестве одного из самых вероятных факторов специалисты рассматривают травматические повреждения мышц, связок и апоневрозов (в том числе - в процессе родов у женщин). Кроме того, исследователи указывают на возможную связь десмоидной опухоли с уровнем половых гормонов и некоторыми генетическими нарушениями. По статистике, десмоид диагностируется у 20% пациентов, страдающих семейным аденоматозом - наследственным заболеванием, обусловленным генетической мутацией.
Десмоидная опухоль представляет собой плотный, как правило, одиночный узел, имеющий волокнистое строение. Цвет новообразования на разрезе серовато-желтый. При микроскопическом исследовании десмоидной опухоли видны пучки коллагеновых волокон, расположенные в разных направлениях и переплетающиеся между собой. Выявляются зрелые фиброциты и фибробласты. Митозы возникают очень редко. При исследовании визуально неизмененных окружающих тканей, иссеченных вместе с новообразованием, могут обнаруживаться микроскопические элементы опухоли.
Симптомы десмоидной опухоли
Десмоидная опухоль может развиваться в любой части тела, однако чаще всего располагается на передней поверхности брюшной стенки. К числу достаточно распространенных локализаций также относятся спина и область плечевого пояса. На грудной клетке, верхних и нижних конечностях десмоидные опухоли появляются редко, однако, такие новообразования имеют особое значение, поскольку часто располагаются близко к костям и суставам, интимно спаиваются с близлежащими образованиями или прорастают их, нарушая подвижность суставов, прочность и опорность костей.
Десмоидные опухоли на руках и ногах всегда локализуются на сгибательной поверхности конечности. В зависимости от особенностей поражения тканей различают четыре клинических типа экстраабдоминальных десмоидных опухолей: одиночный узел с поражением окружающей фасции, одиночный узел с поражением фасциальных влагалищ на протяжении, множественные узлы на различных участках тела и злокачественное перерождение десмоида - превращение новообразования в десмоид-саркому.
Наряду с экстраабдоминальными выделяют интраабдоминальные и экстрабрюшные десмоидные опухоли, которые могут располагаться в брыжейке тонкой кишки, в забрюшинном пространстве, области мошонки и мочевого пузыря. Подобные новообразования выявляются реже периферических десмоидов и десмоидов передней брюшной стенки. Десмоидные опухоли в области брыжейки нередко сочетаются с семейным аденоматозом. Симптомы заболевания зависят от локализации и размера новообразования, наличия или отсутствия прорастания близлежащих органов и тканей.
Для десмоидной опухоли характерен медленный рост и малосимптомное течение. При десмоидных опухолях большого размера может наблюдаться болезненность. При прорастании суставов возможны контрактуры, при прорастании костей - патологические переломы, при прорастании внутренних органов - нарушения функции этих органов. В ходе внешнего осмотра обнаруживается плотное малоподвижное новообразование округлой или овальной формы с гладкой поверхностью, располагающееся в толще мышц либо связанное с мышцами и связками.
Диагностика и лечение десмоидной опухоли
Диагноз выставляют на основании осмотра, данных инструментальных исследований и результатов биопсии. Пациентов с десмоидной опухолью направляют на УЗИ, КТ и МРТ. Наиболее информативным методом исследования, позволяющим установить границы опухоли и степень ее инвазии в окружающие ткани, является магнитно-резонансная томография. При необходимости назначают ангиографию сосудов и другие исследования. При прорастании сосудов, нервов, внутренних органов и костных структур может потребоваться консультация сосудистого хирурга, невролога, абдоминального хирурга, торакального хирурга, травматолога, ортопеда и других специалистов.
Из-за высокой вероятности рецидивирования десмоидных опухолей предпочтительным является комбинированное лечение, включающее в себя хирургические операции и лучевую терапию. В ряде случаев применяют химиотерапию и гормональную терапию. По различным данным, десмоидные опухоли рецидивируют в 70-90% случаев после оперативного лечения, использованного в качестве монометодики. Проведение комбинированной терапии позволяет существенно уменьшить частоту рецидивов.
Операция по возможности должна быть радикальной. При наличии одиночного узла его удаляют вместе с пораженной фасцией и окружающими мышцами. При распространении десмоидной опухоли по фасциальному влагалищу иссекают фасцию на протяжении. При прорастании костных структур осуществляют удаление кортикальной пластинки или резецируют костную ткань. При поражении внутренних органов, близком расположении сосудов и нервов тактику операции определяют индивидуально.
Иссечение большого массива тканей при крупных десмоидных опухолях ведет к образованию дефектов. При возможности такие дефекты устраняют сразу после удаления опухоли, осуществляя местную пластику, используя костные ауто- и гомотрансплантаты и т. д. В ряде случаев в отдаленном периоде проводят пластические операции. При поражении близлежащего сустава конечности может потребоваться эндопротезирование. При множественных десмоидных опухолях показано поэтапное хирургическое лечение с особо радикальным удалением окружающих тканей, поскольку такие новообразования проявляют повышенную склонность к рецидивированию.
Взрослым пациентам с десмоидной опухолью назначают предоперационную и послеоперационную лучевую терапию. Недостатком метода являются выраженные постлучевые изменения тканей. Трофические нарушения и крупные рубцы, возникающие после проведения лучевой терапии, могут усложнять повторное хирургическое лечение в случае рецидивирования. В процессе лечения больных детского возраста лучевую терапию не применяют из-за возможного преждевременного закрытия ростковых зон кости в области облучения. При десмоидных опухолях у детей осуществляют оперативные вмешательства на фоне предоперационной и послеоперационной медикаментозной терапии. Пациентам назначают низкие дозы цитостатиков и антиэстрогеновые препараты. Продолжительность медикаментозного лечения десмоидной опухоли может составлять до 2 и более лет.
Прогноз при комбинированном лечении, включающем в себя хирургическое вмешательство и лучевую терапию или хирургическое вмешательство и химио-гормональную терапию, относительно благоприятный. Рецидивы выявляются у 10-15% больных, обычно - в течение 3 лет после удаления десмоидной опухоли. Чаще всего рецидивируют десмоиды, расположенные в области стопы и голени. Отдаленные метастазы не образуются. Летальный исход возможен при прорастании жизненно важных органов, обычно - при расположении десмоидной опухоли в области головы, шеи, живота и грудной клетки.
Современное лечение десмоидной фибромы
Если фиброматоз десмоидного типа мягких тканей требует хирургического лечения, рекомендуется обращаться в клиники, специализирующиеся по лечению сарком. Оба заболевания требуют высокого уровня подготовки со стороны хирурга для избежания риска рецидива.
Из этой статьи вы узнаете подробнее о симптомах и диагностике десмоидного фиброматоза, вариантах лечения за рубежом и ТОП клиниках, куда мы рекомендуем обратиться нашим пациентам.
Слушать статью:
Что такое десмоидная фиброма?
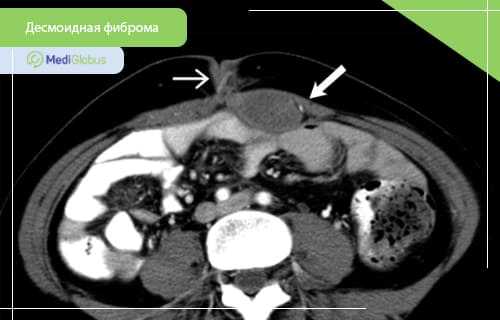
Десмоидная фиброма, также известная как десмоидный фиброматоз или фиброматоз десмоидного типа - это доброкачественная опухоль, образующаяся из фибробластов соединительной ткани. Это заболевание не является раком, так как оно не образовывает метастазы. Однако, крупные быстрорастущие фибромы могут нести опасность здоровью и жизни пациента. Десмоидная фиброма остается серьезным заболеванием, требующим лечения в специализированных медучреждениях.
Чаще всего заболевание обнаруживают у людей в возрасте от 15 до 60 лет. У женщин такие опухоли встречаются чаще, чем у мужчин.
До 10% случаев десмоидной фибросаркомы связаны с генетической предрасположенностью. В группу риска входят люди с синдромом Гарднера и семейным аденоматозным полипозом. У 89% пациентов обнаруживают мутации генов CTNNB1 и APC. Пациентов с десмоидной фибромой обычно отправляют на генетическую диагностику с целью поиска предшествующих заболеваний. К факторам риска также относятся травмы, беременность и прием оральных контрацептивов.
Оптимальный план лечения десмоидных фибром обычно требует участия мультидисциплинарных команд, в которые входят хирурги-саркоматологи, хирурги ЖКТ, онкологи и лучевые терапевты. Такие специалисты работают в иностранных онкоцентрах. Они имеют достаточный опыт хирургического лечения проблемно расположенных опухолей и знакомы с передовыми протоколами лечения фиброматоза десмоидного типа. Если вы ищете такие медцентры, обратитесь к специалистам MediGlobus, нажав на кнопку в верхней части сайта. Мы бесплатно проконсультируем вас относительно лечения за рубежом и поможем подобрать клинику, а также организовать поездку.
Симптомы десмоидной фибромы
Десмоидные опухоли могут возникнуть в любом участке тела. Обычно они образовываются внутри живота, на плечах, руках и бедрах. Распространенные места для опухолей - шрамы от кесаревого сечения или операций.
У ⅔ пациентов опухоли не вызывают боли. Такие образования менее опасные, и если они не продолжают расти, обычно не требуют хирургического вмешательства. Их могут обнаружить во время чек-апа или диагностики других заболеваний.
К симптомам, с которыми пациенты обращаются к врачам, относятся:
Боль;
Опухлость в области новообразования;
Бессонница;
Трудности при передвижении;
Кишечная непроходимость;
Гидронефроз;
Редко - перфорация кишечника.

Как диагностируют фиброматоз десмоидного типа
Ультразвуковое исследование используется для определения размера и расположения десмоидных фибром, в особенности - локализованных в передней брюшной стенке, руках и ногах.
КТ часто используется во время диагностики десмоидных фибром. Метод особенно полезен при внутрибрюшных поражениях. Опухоли, возникающие в брюшной полости, чаще всего вовлекают брыжейку, хотя могут поражаться и другие участки. КТ может предоставить важную информацию, необходимую для планирования операции, такую как расположение соседствующих сосудов и органов. Такие осложнения, как кишечная непроходимость, ишемия кишечника и гидронефроз, также легко выявляются на КТ.
Благодаря высокому качеству снимков мягких тканей МРТ отлично подходит для диагностики десмоидных фибром. Исследование часто назначают для диагностики опухолей, расположенных в области рук, ног, головы, шеи, брюшной полости и грудной стенки. МРТ также могут назначить вместо КТ пациентам с аллергией на йодированные контрастные вещества, а также детям, которым желательно снизить количество облучения.
Чтобы проверить, является ли новообразование десмоидной опухолью, врач проведет биопсию, взяв иглой небольшое количество ткани. Патологоанатом изучит клетки под микроскопом, чтобы определить, что это за опухоль. При некоторых трудно расположенных образованиях провести это исследование может быть проблематично.
Диагностика опухолей за рубежом
У 10%-62% пациентов, которые обращаются в иностранные клиники, обнаруживают неверно поставленный первичный диагноз. В случае редких заболеваний, таких как десмоидная фиброма, риск врачебной ошибки выше. Вы можете обратиться за квалифицированной консультацией иностранного онколога через международную медицинскую платформу MediGlobus. Оставьте заявку на сайте, и мы перезвоним вам в ближайшее время.
Лечение десмоидного фиброматоза
В прошлом основным методом лечения десмоидных фибром была хирургия. Современные протоколы лечения заболевания изменили подход, и сейчас практикуется более консервативный подход к терапии.
При бессимптомной десмоидной фиброме, врачи часто рекомендуют держать опухоль под активным наблюдением. В 50% случаев заболевание не прогрессирует, и пациенты могут избежать операции.
При возможности, хирург попытается удалить десмоидную фиброму во время операции. В случае, если ее удастся полностью вырезать, у болезни есть позитивный прогноз. Однако, новообразования часто формируются рядом с важными органами, сосудами или нервами. Хирургическое вмешательство в этой области может быть проблемным и опасным. Часто вместо этого врачи предлагают другие методы лечения. Однако, в каждом случае решение о необходимости проведения операции проводится индивидуально.
Резекция десмоидной фибромы обычно обширная. Хирургическое лечение внутрибрюшной десмоидной фибромы может потребовать обширной операции. Это включает в себя удаление участков кишечника, сосудистых структур и прилегающих органов брюшной полости.
Лучевая терапия
Лучевая терапия - это метод лечения опухолей с помощью контролированного радиационного облучения. Современная аппаратура, которая используется в иностранных клиниках, позволяет точно доставлять лучи к опухоли, не задевая здоровые ткани. Это позволяет снизить вред от терапии и уменьшить количество побочных эффектов.
Радиотерапия используется для лечения неоперабельных десмоидных фибром, а также опухолей в стадии рецидива. Лечение назначается после операции в случаях, если новообразование не удалось полностью вырезать. Это позволяет снизить риск рецидива.
Медикаментозная терапия
Для лечения десмоидного фиброматоза применяются различные группы препаратов:
антиэстрогенные препараты;
нестероидные противовоспалительные препараты;
цитотоксическую химиотерапию;
ингибиторы тирозинкиназы (таргетная терапия).
Некоторые из этих препаратов могут вызывать серьезные побочные эффекты, поэтому их прием проводится строго под контролем лечащего врача.
Радиочастотная абляция
Некоторые медицинские центры применяют радиочастотную абляцию для лечения десмоидных фибром. Это - минимально инвазивная процедура, которая уменьшает опухоли, используя высокие температуры.
Прогноз при десмоидной фиброме
Прогноз лечения пациентов в иностранных клиниках оптимистичный. В зависимости от размера и расположения опухоли, от 76% до 99% пациентов проживает более 5 лет.
В 20-30% случаев десмоидная фиброма рецидивирует. Среди факторов риска повторного возникновения заболевания:
большой размер опухоли;
молодой возраст пациента;
расположение опухолей в конечностях;
расположение опухолей в брыжейке - органе ЖКТ;
наличие генетической мутации CTNNB1 S45F;
Десмоидные опухоли обычно рецидивируют через 4-5 лет после операции. Они могут быть опасными и тяжелее поддаются лечению. 10-летняя выживаемость пациентов с рецидивом заболевания составляет 63%.
История пациента с десмоидной опухолью
У жителя Нью-Йорка Керта Робинсона обнаружили десмоидную фиброму на 43 году жизни. Она представляла собой болезненное образование в области шеи. Боль была такой сильной, что мужчина не мог повернуть голову или самостоятельно надеть футболку. Спустя несколько месяцев он обратился к врачам, которые провели биопсию и диагностировали десмоидный фиброматоз.
Сразу после подтверждения диагноза Керта направили к хирургу. К сожалению, опухоль выявилась неоперабельной. Из-за близкого расположения сосудов и нервов операция была бы слишком опасной. Однако, доктор рекомендовал Керту принять участь в исследовании препарата, который на тот момент еще не входил в протокол лечения десмоидной фибромы. Сейчас таргетная терапия доступна в профильных медцентрах для терапии этого заболевания. Препарат был разработан для помощи пациентам с раком почек, но его начали применять при десмоиде, когда оказалось, что эффект от лечения в 7 раз сильнее чем при стандартной терапии. В случае Керта, рост опухоли удалось полностью остановить на два года.

Мужчине удалось избежать опасного хирургического лечения и вернуться к нормальной жизни. После курса физиотерапии для восстановления полной подвижности руки и кисти, он больше не испытывает боли и снова может спокойно спать.
Результаты лечения больных c экстраабдоминальной десмоидной фибромой
Резюме. Проанализированы результаты лечения больных с экстраабдоминальными десмоидными фибромами. В результате хирургического лечения рецидивы заболевания развились у 61,5% пациентов в среднем через 23,9 мес. Рецидивы после хирургического лечения и лучевой терапии появились у 30,8% пациентов в среднем через 16,5 мес. Сделан вывод о преимуществе комбинированного лечения у больных с экстраабдоминальной десмоидной фибромой.

Введение
Необычную опухоль мягких тканей, которую онкологи сейчас называют десмоидом, впервые описал Макфарлейн (J. Macfarlane) в 1832 году. Своим названием «десмоид», происходящим от греческого слова «desmos» — связка, опухоль обязана своему внешнему виду — волокнистому строению, напоминающему сухожилия, белесоватой окраске. Это новообразование представляет собой мезенхимальную опухоль мягких тканей, состоящую из дифференцированных фибробластов и избыточного количества коллагеновых волокон. Согласно классификации опухолей мягких тканей и костей (ВОЗ, 2002) десмоидная фиброма отнесена к фибробластическим/миофибробластическим опухолям и занимает промежуточное положение между доброкачественными и злокачественными новообразованиями, является локально агрессивной [1]. Десмоидная фиброма/агрессивный фиброматоз характеризуются местным агрессивным течением, но не метастазируют. В зависимости от локализации десмоиды подразделяются на абдоминальные (располагающиеся в брюшной стенке или брюшной полости) и экстраабдоминальные (находящиеся в области туловища и конечностей). Агрессивное клиническое течение свойственно в большей степени экстраабдоминальным десмоидным фибромам (ЭДФ). Хирургические вмешательства играют большую роль в лечении ЭДФ, но в то же время сопровождаются значительным количеством рецидивов — их частота колеблется от 40 до 90% 3. Малоутешительные исходы хирургического лечения стимулировали поиски других подходов к лечению больных с данной патологией. Использование лучевой терапии в дополнении к хирургическому лечению и самостоятельно показало обнадеживающие результаты. Комбинированное лечение позволило снизить частоту рецидивов на 20% [5]. Об улучшении исходов комбинированного лечения путем применения терморадиотерапии сообщают С.И. Ткачев, М.Д. Алиев, В.В. Глебовская и др. [6]. Предложенная ими методика на 45,8% увеличила 10-летнее безрецидивное течение заболевания. Широкое распространение получило применение пролонгированной химиотерапии низкими дозами винбластина и метотрексата [7]. Заметное место в лечении десмоидных фибром заняла гормонотерапия (тамоксифен, гозерелин), с помощью которой удалось добиться полной и частичной регрессии опухоли у 46,7% пациентов [8]. Характерной особенностью ответа опухоли на терапию является то, что регрессия новообразования развивается в течение нескольких месяцев, а порой и лет. В то же время наличествующая информация об особенностях клинического течения десмоидных фибром побуждает уточнять роль и место каждого вида терапии. Так, большой клинический опыт, накопленный в ФГУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена», позволил говорить о возрастающей роли хирургического метода в лечении больных с десмоидной фибромой [9]. Подчеркивается, что широкое иссечение опухоли в пределах здоровых тканей часто требует резекции прилежащей кости и реконструктивных операций на мягких тканях. Для лечения больных с данной патологией используются нестероидные противовоспалительные препараты, сообщается об отдельных случаях успешного применения иматиниба при местно-распространенных формах заболевания [10, 11].
Но до настоящего времени консенсус в отношении лечения десмоидных фибром не достигнут.
Объект и методы исследования
Цель исследования: провести анализ результатов лечения больных с ЭДФ. Проведено ретроспективное исследование больных, которые находились на лечении в отделении онкоортопедии, опухолей кожи и мягких тканей Национального института рака МЗО Украины с 2000 по 2010 гг. В указанные сроки на лечении находились 68 пациентов в возрасте от 18 до 79 лет. У всех больных диагноз был подтвержден гистологическим исследованием. Сведения о распределении пациентов по полу и возрасту представлены в табл. 1. На верхних конечностях опухоль располагалась у 9 больных (13,2%), на туловище — у 29 (42,6%), на нижних конечностях — у 30 (44,2%). Обращают на себя внимание различия в локализации опухоли у пациентов мужского и женского пола. Так, у 60,5% больных женского пола новообразования располагались на нижних конечностях, у мужчин — у 20%. У мужчин в 56% случаев опухоль локализовалась на туловище, а у женщин — в 32,6%. Верхняя конечность поражалась заболеванием у мужчин в 24% случаев, а у женщин — только в 7% случаев. Подробная информация приведена в табл. 2. В 40 случаях пациенты поступали в клинику с впервые выявленной опухолью, 28 — с рецидивом заболевания. Двойная локализация опухоли отмечена у 3 (4,4%) пациентов (2 женщины, 1 мужчина), такой феномен наблюдался только на нижних конечностях и в таких сочетаниях: бедро и голень, стопа и голень, стопа и бедро.
Таблица 1 Распределение больных с экстраабдоминальной десмоидной фибромой по полу и возрасту
| Пол | Возраст | Всего | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 18-29 | 30-39 | 40-49 | 50-59 | Больше 60 | ||||||||
| n | % | n | % | n | % | n | % | n | % | n | % | |
| Женский | 17 | 25,0 | 8 | 11,8 | 10 | 14,7 | 5 | 7,4 | 3 | 4,4 | 43 | 63,2 |
| Мужской | 12 | 17,6 | 3 | 4,4 | 4 | 5,9 | 5 | 7,4 | 1 | 1,4 | 25 | 26,8 |
| Всего | 29 | 42,6 | 11 | 16,2 | 14 | 20,6 | 10 | 14,8 | 4 | 5,8 | 68 | 100,0 |
Таблица 2 Распределение больных с экстраабдоминальной десмоидной фибромой по полу и локализации
| Пол | Локализация | Всего | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Верхняя конечность | Туловище | Нижняя конечность | ||||||||
| Плечо | Предплечье | Кисть | Грудная стенка | Поясница | Ягодица | Бедро | Голень | Стопа | ||
| Мужчины | 5 | 0 | 1 | 12 | 2 | 0 | 2 | 0 | 3 | 25 |
| Женщины | 0 | 3 | 0 | 11 | 3 | 9 | 7 | 3 | 7 | 43 |
| Всего | 5 | 3 | 1 | 23 | 5 | 9 | 9 | 3 | 10 | 68 |
Хирургическое лечение в объеме широкого иссечения было проведено 39 пациентам. Оперативное вмешательство предусматривало удаление опухоли в футляре из здоровых тканей 2 см. У 3 больных иссечение опухоли сопровождалось резекцией прилежащей к опухоли кости: в 2 случаях — лопатки, в 1 — выполнена краевая резекция бедренной кости.
У 7 пациентов перед оперативным вмешательством проводилась лучевая терапия на аппарате «Рокус» ежедневно средними фракциями 2-2,2 Гр до суммарной очаговой дозы 35-40 Гр. После стихания ранних лучевых реакций мягких тканей через 3-4 нед выполнялся хирургический этап лечения в объеме широкого иссечения опухоли.
6 пациентов получали лучевую терапию в адъювантном режиме средними фракциями по 2-2,5 Гр на ложе удаленной опухоли до суммарной очаговой дозы в 40-45 Гр после заживления операционной раны.
Группе из 6 пациентов проведена химиогормонотерапия в адъювантном режиме. Использовали следующую схему химиотерапии: винбластин — 5 мг/м 2 1 раз в 7 дней + метотрексат 25 мг/ м 2 1 раз в 7 дней. Химиотерапия сопровождалась гормонотерапией — ежедневным приемом тамоксифена в суточной дозе 20 мг. Длительность лечения составила от 4 до 10 мес, в среднем — 7,2 мес.
Еще одну группу составили 8 человек, получавших консервативное лечение — химиогормонотерапию и лучевую терапию. Методика химиогормонотерапии приведена выше. Лучевая терапия проводилась ежедневно средними фракциями по 2-2,2 Гр до суммарной очаговой дозы в 40-45 Гр. Длительность лечения составила от 7 до 11 мес, в среднем — 8,3 мес.
Результаты и их обсуждение
Приступая к анализу полученных результатов, целесообразно прежде всего оценить характеристики всей группы больных с ЭДФ, вошедших в исследование. Обращает на себя внимание преобладающее количество женщин в данной когорте (соотношение мужчин и женщин было 1:2,4). Наши данные согласуются с данными других авторов, подчеркивающих преимущественное поражение женщин данной опухолью [12]. В 81,4% случаев женщины с данной патологией находились в репродуктивном возрасте (18-49 лет). Средний возраст женщин равнялся 36,7±2,2 года. В возрасте до 30 лет находились 48% пациентов мужчин, а их средний возраст составил 34,3±3,2 года. Наблюдается уменьшение количества пациентов обоего пола в возрасте после 50 лет.
Рецидивы опухоли после хирургического лечения возникли более чем у половины больных — у 24 пациентов из 39 (61,5±7,8%) в сроки от 4 до 96 мес. Появление рецидива отмечалось в среднем через 23,9 мес (медиана — 21 мес).
Рецидивы после проведения предоперационного облучения и операции развились у 3 больных из 7, что составило 42,6%. Возврат заболевания регистрировался в сроки от 6 до 24 мес, в среднем — через 14 мес (медиана — 12 мес).
Рецидив заболевания после адъювантной лучевой терапии возник через 24 мес после лечения у 1 больного из 6, что составило 16,7%.
Если объединить группы с неоадъювантной и адъювантной лучевой терапией в одну, то получим следующее. В группе из 13 пациентов рецидивы заболевания возникли у 4 пациентов — 30,8±5,7%. Среднее время развития рецидива составило 16,5 мес (медиана — 18 мес).
Группа больных, получивших консервативное лечение (химиогормонотерапию и лучевую терапию), наблюдается от 36 до 96 мес (медиана наблюдения — 48 мес). У 1 больной отмечена полная регрессия новообразования, частичная регрессия — также у 1 (сроки наблюдения 64 и 31 мес соответственно), у остальных — стабилизация размеров опухоли.
Сравнивая полученные нами результаты, считаем необходимым остановиться на следующем. Самая высокая частота рецидивов наблюдалась в группе больных, которые получали только хирургическое лечение — 61,5±7,8%. При комбинированном лечении с лучевой терапией — в пред- или послеоперационный период — частота рецидивирования значительно снизилась — до 30,8±5,7%. Улучшение полученных результатов на 30,7% было статистически значимым (р<0,05). Наши данные вполне созвучны данным доступной нам литературы, где также подчеркиваются преимущества комбинированного лечения десмоидных фибром [5, 6].
Обнадеживающие результаты получены при сочетании хирургического лечения с последующей длительной химиогормонотерапией. Отсутствие рецидивов в этой группе в период продолжительностью более 36 мес позволяет надеяться на хорошие исходы терапии, но недостаточное количество наблюдений не дает возможности сформулировать окончательные выводы. По нашему мнению, этот вопрос нуждается в дальнейшем изучении и оценке. Интерес к адъювантному лечению обусловлен еще и тем обстоятельством, что у 31% пациентов операция носит нерадикальный характер, так как в краях резекции при микроскопическом исследовании выявляются опухолевые клетки [9].
В связи с малым количеством наблюдений мы также не можем сформулировать окончательное мнение о консервативном лечении — пролонгированной химиогормонотерапии и лучевой терапии — и считаем целесообразным и перспективным продолжить исследования в данном направлении.
Выводы
1. В результате проведения только хирургического лечения рецидивы ЭДФ развились у 61,5% больных.
2. Комбинированное лечение имеет преимущество перед хирургическим лечением. Использование в неоадъювантном и адъювантном режимах лучевой терапии у больных с ЭДФ позволило снизить частоту рецидивов до 30,8% (р<0,05).
3. Применение химиогормонотерапии, возможно, в комбинации с хирургическим и лучевым лечением, является перспективным направлением в терапии больных ЭДФ.
ЛИТЕРАТУРА
1. Fletcher Ch.D.M., Unni K.K, Mertens F. (2002) World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of Soft Tissue and Bone. Lyon. IARC press., 427 p.
2. Higaki S., Tateishi A., Ohno T. et al. (1995) Surgical treatment of extra-abdominal desmoid tumors (aggressive fibromatosis). Int. Orthop., 19(6): 383-389.
3. Middleton S.B., Philips R.K. (2000) Surgery for large intra-abdominal desmoid tumors. Dis. Colon. Rectum., 43: 1759-1762.
4. Nuyttens J.J., Rust P.F., Thomas C.R. Jr., Turrisi A.T. (2000) Surgery versus radiotherapy for patient with aggressive fibromatosis. Cancer., 88: 1517-1523.
5. Bondiau P.Y., Peyrade F., Marcy P.Y. et al. (2002) Recurrent desmoid tumors on a gortex patch. Radiother. and Oncol., 63(3): 355-356.
6. Ткачев С.И., Алиев М.Д., Глебовская В.В. и др. (2009) Применение терморадиотерапии у больных первичными и рецидивными зкстраабдоминальными десмоидными опухолями. Cаркомы костей, мягких тканей и опухоли кожи, 1: 34-37.
7. Чиссов В.И., Дарьялова С.Л., Бойко А.В. и др. (1997) Лечение десмоидных фибром в Московском научно-исследовательском онкологическом институте им. П.А. Герцена. Российский онкологический журнал, 3: 13-17.
8. Чиссов В.И., Дарьялова С.Л., Бойко А.В. и др. (2006) Гормонотерапия в лечении десмоидных фибром. Российский онкологический журнал, 1: 4-10.
9. Дарьялова С.Л., Франк Т.А., Карпенко В.Ю. и др. (2010) Хирургический метод как этап комбинированного лечения десмоидных фибром. Cаркомы костей, мягких тканей и опухоли кожи, 4: 42-48.
10. Heinrich M.C., McArthur G.A., Demetri G.D. et al. (2006) Clinical and molecular studies of the effect of imatinib on advanced aggressive fibromatosis (desmoid tumor). J. Clin. Oncol., 24(7): 1195.
11. Chugh R., Maki R.G., Thomas D.G. et al. (2006) A SARC phase II multicenter trial of imatinib mesylate in patients with aggressive fibromatosis. J. Clin. Oncol., 24(18S): 9515.
12. Дарьялова С.Л., Чиссов В.И. (1993) Диагностика и лечение злокачественных опухолей, Медицина, М.: 255 с.
Результати лікування хворих з екстраабдомінальною десмоїдною фібромою
А.Ю. Палівець, С.І. Коровін, М.М. Кукушкіна
Національний інститут раку, Київ
Резюме. Проаналізовано результати лікування хворих на екстраабдомінальну десмоїдну фіброму. У результаті хірургічного лікування рецидиви захворювання виникли у 61,5% пацієнтів у середньому через 23,9 міс. Рецидиви після хірургічного лікування та променевої терапії виникли у 30,8% пацієнтів у середньому через 16,5 міс. Зроблено висновок про перевагу комбінованого лікування у хворих на екстраабдомінальну десмоїдну фіброму.
Ключові слова: екстраабдомінальна десмоїдна фіброма, хірургічне лікування, променева терапія, хіміогормонотерапія.
Results of treatment of patients with extra-abdominal desmoid fibromas
A.Y. Palivets, S.I. Korovin, M.N. Kukushkina
National Cancer Institute, Kyiv
Summary. Results of treatment of patients with extra-abdominal desmoids are presented. After surgical treatment disease recurrent occurred in 61.5% of patients at a mean of 23.9 months. Recurrences after surgery and radiation therapy appeared in 30.8% of patients after an average of 16.5 months. It is concluded that the advantages of combination therapy in patients with the extra-abdominal desmoids.
Key words: еxtra-abdominal desmoid fibroma, surgical treatment, radiation therapy, chemo-hormonal therapy.
Читайте также:
- Этапы и техника ампутации пальца кисти, стопы
- Статьи по отравлению гормонами (гормональными препаратами)
- Искусственная ( ключевая ) систематика микроорганизмов. Определитель бактерий Берджи.
- Защитный декомпрессионный механизм плода. Коллагенопатии и воротниковое пространство плода
- Синдром Риетти-Греппи-Микели (Rietti-Greppi-Micheli)
