Генетическая гетерогенность как причина глазных болезней
Добавил пользователь Владимир З. Обновлено: 01.02.2026
Наследственные болезни органа зрения - обширная группа генетически гетерогенных заболеваний с тяжелым течением, приводящая к ранней инвалидизации 2.
Генетика (от греч. «генезис» - рождение, происхождение), выдвинутая в разряд точных наук, показывает, что наследственность обусловлена передачей потомкам повторяющей информации о всех свойствах данного организма. Одним из важных свойств наследственности является консервативность, т.е сохранение наследственных особенностей на протяжении многих поколений [4, 5]. Молекулярная биология показывает широкие перспективы переделки наследственной природы организма, благодаря чему возможны введение или удаление тех или иных генов. Это направление генетики получило название «генетической инженерии» [6].
В настоящее время исследование новых подходов, основанных на сочетанном изучении клинических признаков заболевания и их корреляции с результатами генетического анализа, является основой для разработки перспективных методов профилактики и лечения целого ряда врожденных и генетически детерминированных заболеваний органа зрения 7. Установлены внутрисемейный и выраженный межпопуляционный клинический полиморфизм заболеваний зрительно-нервного аппарата, который свидетельствует о разной генетической их природе [10].
В монографии Хлебниковой О.В. и Дадали Е.Л. «Наследственная патология органа зрения», изданной под редакцией Е.К. Гинтера, опубликованы современные представления об этиологии, клинике, диагностике и новых возможностях профилактики наследственных заболеваний глаз. Основываясь на собственных данных клинико-генетических корреляций, авторы разработали алгоритмы ДНК-диагностики наиболее тяжелых форм наследственных заболеваний глаз, представили атлас клинических форм последних и их указатель по признакам, позволяющим практикующим офтальмологам предположить или установить клинико-генетическую форму заболевания. В результате проведенных популяционно-эпидемиологических исследований авторами установлено, что в разных регионах Российской Федерации наследственная этиология выявляется в 30% пациентов с заболеваниями глаз, а в структуре слепоты и слабовидения составляет в различных популяциях от 42 до 84%. По данным А.М. Шамшиновой (2001), в 42,3 % случаев глазные заболевания обусловлены наследственными факторами. В последние годы четко прослеживается тенденция к увеличению доли наследственных заболеваний в структуре офтальмопатологии.
Для практических врачей-офтальмологов идентификация генетического варианта необходима не только для определения особенностей клинических проявлений и течения заболевания глаз, а, прежде всего, для установления типа наследования, расчета риска рождения больного ребенка в отягощенной семье и планирования профилактических мер, направленных на предотвращение его рождения. Методы ДНК-диагностики более точные, чем традиционные, так как позволяют оценить генетический риск развития заболевания глаз в семье. На сегодня недостаточно проводится работа по идентификации отдельных генетических вариантов с использованием молекулярно-генетических методов. К сожалению, таких центров исследования в стране недостаточно. А существующие лаборатория ДНК-диагностики и лаборатория генетической эпидемиологии в ФГБУ МГНЦ РАМН не могут охватить большой контингент нуждающихся в этих обследованиях.
Важно вспомнить терминологию, относящуюся к наследственной патологии [11]. Ген - основная единица наследственности, воплощен в веществе наследственности - дезоксирибонуклеиновой кислоте (ДНК) и представляет собой участок ее молекулы, который передается от родителей к их потомкам. Размеры генов неодинаковы и зависят от размера белка, который кодирует данный ген. Существует более 20 тыс. генов.
Эпигенетика - наука об активности гена и его изменении, изучает все, связанное с ДНК и влияющее на ее структуру и функции [12]. Общеизвестно, что наследственная природа организма определяется набором генов (геномом), заключенным в ДНК каждой клетки. ДНК содержит более 3 млрд. нуклеотидных оснований четырех основных типов: аденин, цитозин, гуанин и тимин. Большое количество ДНК хранится в относительно небольшом объеме ядра клетки. В каждой хромосоме содержится одна цепь ДНК. Последовательность оснований в ДНК определяет жизнедеятельность человека.
Причиной наследственных заболеваний является повреждение генов, которые находятся в составе клетки - уникальной биологической структурной единицы организма. Ядро каждой клетки содержит хромосомы - материальные носители наследственных свойств человека, содержащие одну гигантскую молекулу ДНК и сотни тысяч генов, контролирующих важные звенья обмена на всех этапах развития человеческого организма. Поэтому наиболее прямой подход к диагностике наследственных заболеваний состоит в исследовании ДНК соответствующих генов. Современные методы молекулярной генетики позволяют прицельно изучать практически любой фрагмент ДНК клетки человека. Необходимым условием проведения ДНК-диагностики является наличие информации о расположении гена на определенной хромосоме. Локус - отдельный участок хромосомы, ответственный за реализацию определенного наследственного признака.
Геном - совокупность хромосом, содержащих единицы наследственности. Поэтому наследственная природа организма определяется геномом, заключенным в ДНК каждой клетки. Посредством картирования возможно выявление положения каждого гена на какой-либо хромосоме относительно других генов.
Ген создает ферменты, регулирующие биохимические процессы, и обеспечивает жизнедеятельность клетки. ДНК-метилирование - важный биохимический путь, нарушение которого ведет к развитию глазных болезней. В результате сложнейших биохимических изменений в организме под влиянием многих причин (заболеваний, интоксикации, влияния окружающей среды, низких и высоких температур, ионизирующего излучения и др.) может возникнуть изменение структуры хромосом и генов - мутации [13]. Мутация в соматической или половой клетке человека может привести к развитию наследственного заболевания: дистрофии роговицы, наследственной катаракте, врожденной глаукоме, абиотрофии сетчатки и многих других [14].
Наиболее важной проблемой в практике консультирования является определение типа наследования болезни. Доказано три основных типа наследования [15]: 1) аутосомно-рецессивный тип - оба родителя являются носителем дефектного гена, имеет место передача патологического гена из поколения в поколение, одинакова частота развития заболевания у мужчин и женщин (пример: муковисцидоз); 2) аутосомно-доминантный тип - носителем гена может быть только один из родителей (пример: туберкулезный склерит); 3) X-сцепленное наследование характеризуется следующими генеалогическими данными: больной отец может передать патологический ген дочерям, которые фенотипически будут здоровы, но являются носителями дефектной хромосомы. Женщина-носитель может получить патологический ген как от матери, так и отца и передает его сыновьям (пример: врожденный дефицит цветового зрения) [6].
В Уфимском НИИ глазных болезней совместно с Институтом биохимии и генетики Уфимского научного центра РАН в течение многих лет проводятся молекулярно-генетические исследования отдельных наследственных заболеваний органа зрения.
Впервые в Республике Башкортостан изучалась эффективность прогнозирования врожденной наследственной катаракты с учетом генетических факторов и ее хирургического лечения [16, 17]. Проанализированы сцепление гена аутосомно-доминантной врожденной катаракты с высокополиморфными микросателлитными маркерами, расположенными в пределах кластера генов β-кристаллинов. Проведено генотипирование индивидов изучаемых родословных по маркерным локусам и изучена генетическая гетерогенность аутосомно-доминантной врожденной катаракты. Доказана возможность проведения пренатальной диагностики врожденной наследственной катаракты на основе установленного сцепления гена АДВК с микросателлитными маркерами D22S264, TOP1P2, CRYBB2 в области кластера генов β-кристаллинов. Отсутствие сцепления аутосомно-доминантной врожденной катаракты с вышеперечисленными маркерами в ряде других семей с данной патологией свидетельствует о ее генетической гетерогенности.
В детском отделении института генетические исследования проводились по проблеме пигментной абиотрофии (греч. bios - жизнь, trophe - питание) сетчатки у взрослых и детей [18, 19]. Тапето-ретинальные абиотрофии у детей относятся к числу малоизученных тяжелых наследственных прогрессирующих заболеваний, которые приводят к слепоте в работоспособном возрасте. Заболевание наследуется по аутосомно-рецессивному типу. По типу наследования выделяют моногенную (вызванную дефектами в одном гене) и дигенную (вызванную дефектами в двух генах) пигментную абиотрофию сетчатки 21.
Выявлена повторяемость этой патологии в семьях в 3-4 поколении, чаще проявляясь у детей при близком родстве их родителей. Установлено несколько клинических форм пигментного ретинита. Cтепень развития пигментации сетчатки зависит от генетического типа пигментного ретинита и возраста пациента. Отмечены различные сроки проявления новых признаков заболевания - от 8-10 лет до 40-55 лет. При заболевании отмечают нарушение темновой адаптации, концентрическое сужение полей зрения, ночная слепота. Разные формы наследственной дегенерации сетчатки обусловлены проявлением мутации гена родопсина. Перинатальной диагностике помогает молекулярное биологическое генотипирование, которое позволяет идентифицировать большое количество генов, вызывающих это заболевание. Однако в настоящее время далеко не всегда осуществляется взаимодействие практикующих врачей-офтальмологов и специалистов в области молекулярной генетики.
В институте проводились исследования по наследственной открытоугольной глаукоме. На основании клинико-генеалогического и молекулярно-генетического исследования членов 138 семей установлено, что у пациентов с отягощенной наследственностью преобладающей клинической формой первичной открытоугольной глаукомы является псевдоэксфолиативная глаукома (56,8%), а в группе без отягощенной наследственности - пигментная глаукома (45,5%). Клинико-генеалогическое исследование семей, в которых первичная открытоугольная глаукома подтверждена в нескольких поколениях, выявило сходство клинических проявлений заболевания, прослеживался феномен антиципации [23]. В результате молекулярно-генетического анализа установлено, что частота мутации Q368X гена миоцилина в группе с отягощенной наследственностью составляет 1,35%, что указывает на целесообразность ее тестирования у лиц с семейным анамнезом заболевания [24]. Поэтому при наличии семейного анамнеза заболевания первичной открытоугольной глаукомой необходима преморбидная ее диагностика у кровных родственников.
Проводилось сопоставление однозначных показателей между мужем и женой, родителями и детьми. Более высокий коэффициент корреляции между родителями и потомками по сравнению с таковыми между супругами свидетельствовали о большом значении генотипических факторов в определении признаков. Суммирование наследственных признаков и микропризнаков, выявление закономерности их воздействия на развитие глаукомы у представителей конкретной родословной позволило своевременно диагностировать заболевание или предрасположенность к нему. Тесты на предрасположенность к глаукоме, как отмечено Р.П. Шикуновой [25], помогают предугадать болезнь задолго до ее клинических проявлений и содействовать правильному прогнозированию патологии в будущих поколениях.
К настоящему времени хорошо изучены клинико-генетические характеристики 20 нозологических форм наследственных дистрофий роговицы, представленных 35 генетических вариантов. Описаны аутосомно-доминантный, аутосомно-рецессивный и Х-сцепленный рецессивный типы наследования НЗР. Наследственные заболевания роговицы представлены дистрофиями различных слоев роговицы и эктазиями. В последние годы участились случаи кератоконуса, большинство которых являются спорадическими. Лишь в 6-8% случаев установлена моногенная природа заболевания [8, 14]. Описаны 5 генетических вариантов кератоконуса, клинически не отличимых, проведено картирование гена кератоконуса на хромосоме. Исследования в институте по проблеме наследования кератоконуса продолжаются.
Таким образом, идентификация патологического гена и его мутаций составляет основу понимания патогенеза заболевания, прогнозирования течения процесса и поиска путей эффективной терапии. Учитывая существование обширного нозологического спектра и выраженной генетической гетерогенности наследственных заболеваний органа зрения, необходима систематическая работа по определению алгоритма клинико-генетического исследования в отягощенных семьях.
Генетическая гетерогенность как причина глазных болезней
Для цитирования: Современная молекулярная генетика и наследственные дистрофии сетчатки. Клиническая офтальмология. 2001;2(4):142.
Modern molecular genetics and hereditary retinal distrophy
Modern molecular genetics and hereditary retinal distrophy
Shamshinova A.M., Zueva M.V., Zaletaev D.V., Tsipenco I.V., Zolnikova I.V., Yakovlev A.A.
There is an analysis of genetic studies, devoted to determination of specific chromosomal areas of various macular and peripheral retinal dystrophies, represented in the article. Results of genetic analysis showed that, in spite of differences in clinical picture of some retinal dystrophies, they may be connected with the expression of the same genes.
Литература
Adato A., Weston M.D., Berry A. et al. Three novel mutations and twelve polymorphisms identified in the USH2A gene in Israeli USH2 families // Hum. Mutat- 2000.- V.15, N4.- P. 388.
Aguilar-Bryan L., Ntehols C.G., Wechster S.W. et al. Cloning of the beta cell high-affinity suffon-ylurea receptor: a regulator of insulin secretion // Science.-1995.- V. 268.- P. 423-426.
Allikmets R., Singh N., Shroyer N.F. et al. A photoreceptor cell-specific ATP-binding transporter gene (ABCR) is mutated in recessive Stargardt macular dystrophy // Nat. Genet.-1997.- V. 15.- P. 236-246.
Allikmets R., Shroyer N.F., Singh N. et al. Mutation of the Stargardt disease gene (ABCR) in age-related macular degeneration // Science.-1997.- V.277.- P.1805-1807.
AI-Maghtheh M., Ingleheam C.F., Keen T.J..et al. Identification of a sixth locus for autosomal dominant retinitis pigmentosa on chromosome 19 // Hum. Mol. Genet.-1994.- V. 3.- P. 351-354.
Azarian S.M.. Travis G.H. The photoreceptor rim protein is an ABC transporter encoded by the gene for recessive Stargardts-disease (ABCR) // FEBS Lett.-1997.- V. 409.- P. 247-252.
Azarian S.M., Papennaster D.S., Travis G.H. Molecular characterization of the rim protein in bovine photoreceptors // Invest. Ophthalmol. Vis. Sci.-1996.- V. 37.- P. 5805.
Azarian S.M., Megarity Ch.F., Weng J. et al. The human photoreceptor rim protein gene (ABCR):
genomic structure and primer set information for mutation analysis // Hum. Genet.- 1998.- V. 102.- P. 699-705.
Baneriee P., Klein P. W., Knowles J.A.et al. TULP1 mutation in two extended Dominican kindreds with autosomal recessive retinitis pigmentosa // Nat. Genet.-1998.- V. 18.- P. 177-179.
Bard/en S., Ebenezer N., Greenberg J.,et al. An eighth locus for autosomal dominant retinitis pigmentosa is linked to chromosome 17q // Hum. Mol. Genet.-1995.- V. 4.- P. 1459-1462.
Bech-Hansen N. Т.; Nayfor M. J.; Maybaum T. A. et a/. Loss-of-function mutations in a calcium-channel alpha-1-subunit gene in Xp11.23 cause incomplete X-linked congenital stationary night blindness // Nature Genet.-1998.- V. 19.- P. 264-267.
Вегдеп, А. А. В., ten Brink J. В., Riemslag F. et al. Localization of a novel X-linked congenital stationary night blindness locus: dose linkage to the RP3 type retinitis pigmentosa gene region // Hum. Molec. Genet,- 1995.- V. 4.- P. 931-935.
Bird AC. Clinical investigations of retinitis pigmentosa // Brit. J. Ophthatmol.-1988.- V. 59.- P. 177-199.
Bhattacharya S.S., Wnght A.F., Clayton J.F.,et al. Close genetic linkage between X-linked retinitis pigmentosa and a restriction fragment lenght polymorphism identified by recombinant DNA probe LI.28 // Nature.- 1984.- V. 309.- P. 253-255.
Blanton S.H., Heckenlively J.R.. Cottingham A.W., etal. Linkage mapping of autosomal dominant retinitis pigmentosa (RP1) tothe pericentric region of human chromosome 8 // Genomics.-1991.- V. 11.-P. 857-869.
Sough/nan J.A., Confally P.M. and Nance W.E. Population genetic studies of retinitis pigmentosa // Amer. J. Hum. Genet.-1980.- V. 32.- P. 223-235.
Boycott К. M., Реагсе W. G., Musarella M. A. et al. Evidence for genetic heterogeneity in X-linked congenital stationary night blindness // Amer. J. Hum. Genet.-1998.- V. 62.- P. 865-875.
Bunker C.H., Berson E.L, Bromley W.C.,et al. Prevalence of retinitis pigmentosa in Maine // Amer. J. Ophthalmol.-1984.- V. 97.- P. 357-365.
Connell G.J., Molday R.S. Molecular cloning, primary structure, and orientation of the vertebrate photoreceptor cell protein peripherin in the rod outer segment disc membrance // Biochemistry.-1990.-V. 29.- P. 4691-4698.
Cremers F.P.M., Pol D.J.R. van de, Hollander A.I. den et al. Autosomal recessive retinitis pigmentosa and cone-rod dystrophy caused by splice site mutation in the Stargardfs disease gene ABCR // Hum. Mol. Genet- 1998.-V. 7- P. 355-362.
Crouch R.K.. Goletz P., Yu S. et al. A possible role for RPE65 in retinoid processing // Invest. Ophthalmol. Vis. Sci.-1997.-V. 38.- P. 1422.
Dean M.. Allikmets R. Evolution of ATP-binding cassette transporter genes // Curr. Opin. Genet. Dev.-1995.- V. 5.- P. 779-785.
Devree J.M.L, Jacquemin E; Sturm E. et al. Mutations in the Mdr3 gene cause progressive familial intrahepatic cholestasis // Proc. Natl. Acad. Sd. USA.-1998.- V. 95.- P. 282-287.
Dryja T.P., Finn J.T., Peng Y-W., et a/.Mutations in the gene encoding the a subunit of the rod cGMP-gated channel in autosomal recessive retinitis pigmentosa // Proc. Natt. Acad. Sd. USA.-1995.-V.92.-P. 10177-101181.
Dryja T.P., McGee T.L, Reichel E., et al. A point mutation of rhodopsin gene in one form of retinitis pigmentosa // Nature.-1990.- V. 343.- P. 364-366.
Fagerheim T, Raeymaekers P, Merren J, et al. Homozygosity mapping to the USH2A locus in two isolated populations // J. Med. Genet.-1999.- V. 36, N2.- P.44-47.
Farrar G.J., Kenna P., Jordan S.AД et al. A three base-pair deletion in the peripherin-RDS gene in one form of retinitis pigmentosa // Nature.- 1991.- V. 354.- P. 478-480.
Finckh U., Xu S., Kumaramanickavel G., Schumann M., et a/. Homozygosity mapping of autosomal recessive retinitis pigmentosa locus (RP22) on chromosome 16p12.1-p12.3 // Genomics.-1998.-V.48.-P. 341-345.
Fisher S. E., Ciccodicola A., Tanaka K. et al. Sequence-based exon prediction around the synaptophysin locus reveals a gene-rich area containing novel genes in human proximal Xp // Genom-ics.- 1997.- V. 45.- P. 340-347.
Franke R.R., Sakmar T.P., Graham P.M. et a/.Structure and function in rhodopsin: Studies of the interaction between the rhodopsin in cytoplasmic domain and transdudn // J. Biol. Chem.- 1992.- V. 267.-P. 14767-14774.
Gat A., Apfelstedt-Sytta E., Janecke A.R. et al. Rhodopsin mutation in inherited retinal dystrophies and dysfunctions // Prog. Ret. Eye Res.- 1997.- V. 16.- P. 51-79.
Gal A.. Orth U.. Baehr W., et al. Heterozygous missense mutation in the rod cGMP phosphodiesterase b subunit gene in autosomal dominant stationary night blindness // Nat.Genet-1994.- V. 7.- Р. 64-68.
Greenberg J., Goliath R., Beighton P. et at. A new locus for autosomal dominant retinitis pigmentosa on the short arm of chromosome 17 // Hum. Mol. Genet.-1994.- V. 3.- P. 915-918.
Gu S., Thompson D.A., Srikuman S.,et al. Mutations in RPE65 cause autosomal recessive childhood onset severe retinal dystrophy // Nat. Genet-1997.- V. 17.- P. 194-197.
Hamel C.P., Tsilou E., Pfeffer B.A., et al. Molecular cloning and expression of RPE65, a novel retinal pigment epithelium-specific microsomal protein that is post-transcriptionally regulated in vitro // J. Biol. Chem.- 1993.-V. 268.- P. 15751-15757.
Hardcastle A. J., David-Gray Z. К., Jay, M. et al. Localization of CSNBX (CSNB4) between the retinitis pigmentosa loci RP2 and RP3 on proximal Xp // Invest. Ophthal. Vis. Sci.- 1997.- V. 38.- P. 2750-2755.
Heckenlively J.R. and Foxmann S.G. Congenital and early-onset forms of retinitis pigmentosa // Retinitis Pigmentosa / Heckenlively J.R. ed. Lippincott: Philadelphia PA.-1988.- P. 107-149
Hmani M., Ghorbel A.. Boulila-Elgaied A. et al. A novel locus for Usher syndrome type II, USH2B, maps to chromosome 3 at p23-24.2 // Eur. J. Hum. Genet.-1999.- V. 7, N 3.- Р. 363-367/
Ноупд С.В., Poppelaars F., Pol T.J. van de et al. Genetic fine mapping of the gene for recessive Stargardt disease // Hum. Genet.-1996.- V. 98.- P. 500-504.
Huang S.H., Huang X., Pittter S.JДet al. A mutation in the gene encoding the a-subunit of rod cGMP phosphodiesterase (PDEA) in retinitis pigmentosa // Invest. Ophthalmol. Vis. Sci.- 1995.- 36 (suppi).- 8825 (abstract no.3815).
Illing M., Molday LL, Molday R.S. The 220-kDa rim protein of retinal rod outer segments is a member of the ABC transporter superfamily // J. Biol. Chem.-1997.- V. 272,- P. 10303-10310.
Ingleheam C.F., Carter S.A., Keen T.J., et al. A new locus for autosomal dominant retinitis pigmentosa on chromosome 7p // Nat. Genet.-1993.- V. 4.- P. 51-53.
Janecke A.R., Meins M., Sadeghi M.. et al. Twelve novel myosin VIIA mutations in 34 patients with Usher syndrome type I: confirmation of genetic heterogeneity // Hum. Mutat.-1999.- V. 13, N 2.- Р. 133-140.
Jay M. Figure and fantasies: the frequencies of the different genetic forms of retinitis pigmentosa // Birth Defects.-1982.-V. 18.- P. 167-173.
Joensuu Т., Hamalainen P., Lehesioki A.E. et al. A sequence-ready map of the Usher syndrome type III critical region on chromosome 3q.6 // Infect. Immun.- 2000.- V. 68, N 4.- Р. 2009-2015.
Jordan S.A.. Farrar G.J., Kenna P.et al. Localisation of an autosomal dominant retinitis pigmentosa gene to 7q // Nat. Genet.-1993.- V. 4.- P. 54-58.
Jordan S.A., Farrar G.J., Kumar-Singhe R-.et al. Autosomal dominant retinitis pigmentosa (adRP; RP6): Cosegration of RP6 and the peropherin-RDS locus in a late-onset family of Irish origin // Amer. J. Hum. Genet-1992.-V. 50.- P. 634-639.
Kajhwara К., Berson E.L, Dryja T.P. Digenic retinitis pigmentosa due to mutations at the unlinked peripherin/RDS and ROM1 loci // Science.-1994.- V. 264.- P. 1604-1608.
Kajiwara К., Hahn L.B., Mukai S. et al. Mutations in the human retinal degeneration slow gene in autosomal dominant retinitis pigmentosa // Nature.-1991.- V. 354.- P. 480-482.
Knowtes J.A., Shugarts Y.Y., Baneijee P.et al. Identification of a locus, distinct from RDS-peripherin, for autosomal recessive retinitis pigmentosa on chromosome 6p // Hum. Mol. Genet.-1994.-V.3.-P. 1401-1403.
Kumaramanickavel G., Maw M., Denton M.J. et al. Missense rhodopsin mutation in a family with recessive RP // Nat. Genet.-1994.- V. 8.- P. 10-11.
Liu X.Z., Hope С., Liang С. Y. et at. A mutation (2314delG) in the Usher syndrome type IIA gene:
high prevalence and phenotypic variation // Amer. J. Hum. Genet.-1999.- V. 64, N 4.- Р. 1221-1225.
Mansergh F.C., Millington-Ward S., Kennan A. et al. Retinitis pigmentosa and progressive sensorineural hearing loss caused by a C12258A mutation in the mitochondrial MTTS2 gene // Amer. J. Hum. Genet,- 1999.- V. 64, N 4.- Р. 971-985.
Marlhens F., Bareil C., Griffon C. et al. Mutations in RPE65 cause Leber’s congenital amaurosis // Nat. Genet.-1997.-V. 17.- P. 139-140.
Martinezmir A., Bayes M., Vilageliu L., et at. A new locus for autosomal recessive retinitis pigmentosa (RP19) maps to 1p13-1p21 // Genomics.- 1997.- V. 40.- P. 142-146.
Martinezmir A., Bayes MД Vilageliu L. et al. A new locus for autosomal recessive retinitis pigmentosa (RP19) maps to 1p13-1p21 // Genomics.- 1997.- V. 40.- P.142-146.
Martinezmir A., Paloma E., Allikmets R. et al. Retinitis pigmentosa caused by a homozygous mutation in the Stargardt-disease gene // Nat. Genet.-1998.- V. 18.- P. 11-12.
Maw M.A., Kennedy В., Knight A. et al. Mutation of the gene encoding cellular retinaldehyde-binding protein in autosomal recessive retinitis pigmentosa // Nat. Genet.-1997.- V. 17.- P. 198-200.
McLaughlin M.E., Sandberg M.A., Berson E.Let at. Recessive mutations in the gene encoding the b-subunit of rod phosphodiesterase in patients with retinitis pigmentosa // Nat. Genet- 1993.- V. 4.-P. 130-134.
McWilliam P., Farrar G.J., Kenna P. et al. Autosomal dominant retinitis pigmentosa (ADRP):
Localisation of an adRP gene to the long arm of chromosome 3 // Genomics.-1989.- V. 5.- Р. 619-622.
Meindl A., Dry К., Herrmann К. et at. A gene (RPGR) with homology to the RCC1 guanine nucleotide exchange factor is mutated in X-linked retinitis pigmentosa (RP3) // Nature Genet.- 1996.- V. 13.-P. 35-42.
Mosser J.. Douar AM, Sarde C.O. et al. Putative X-linked adrenoleukodystrophy gene shares unexpected homology with ABC transporters // Nature.-1993.- V. 361.- Р. 726-730.
Pieke-Dahl S., Moller C.G., Kelley P.M. et al. Genetic heterogeneity of Usher syndrome type II:
localisation to chromosome 5q // Med. Genet.- 2000.- V. 37, N 4.-P. 256-262.
Rosenfield P.J., Cowley G.S., McGee T.Let al. A null mutation in the rhodopsin mutation in the rhodopsin gene causes rod photoreceptor dysfunction and autosomal recessive retinitis pigmentosa // Nat. Genet.- 1992.- V. 1.- P. 209-213.
Rozzo C., Fossaretio М., Galleri G. et al. Complete congenital stationary night blindness maps on Xp11.4 in a Sardinian family // Europ. J. Hum. Genet.-1999.- V. 7.- P. 574-578.
Shugarts Y. Y., Banerjee P., Knowles J.A. et al. Fine genetic mapping of a gene for autosomal recessive retinitis pigmentosa on chromosomal 6p21 //Amer. J. Hum. Genet.-1995.- V. 57.- P. 499-502.
Strom Т. М., Nyakatura G., Apfelstedt-Sylta E. et al. An L-type calcium-channel gene mutated in incomplete X-linked congenital stationary night blindness // Nature Genet-1998.- V. 19.- P. 260-263.
Thomas P.M., Cote G.J., Wohllk N. et al. Mutations in the sulfonylurea receptor gene in familial persistent hyperinsulinemic hypoglicemia of infancy // Science.-1995.- V. 268.- P. 426-429.
Thomson J.L, Brzeski H., Dunbar B. et al. Photoreceptor rim protein: partial sequences of cDNA show a high degree of similarity to ABC transporters // Curr. Eye Res.-1997.- V. 16.- P. 741-745.
Travis G.H., Вгеппап М.В., Danielson P.E. et al. Identification of a photoreceptor-specific mRNA encoded by the gene responsible for retinal degeneration slow (rds) // Nature.- 1989.- V. 338.- P. 70-73.
Travis G.H., Sutcliiffe J.G., Bok D. The retinal degeneration slow (rds) gene product is a photoreceptor disc membrane associated glycoprotein // Neuron.-1991.- V. 6.- P. 61-70.
Van Soest S. et al Assignment of a gene for autosomal recessive retinitis pigmentosa (RP12) to chromosome 1q31-q32.1 in an inbred and genetically heterogeneous disease population // Genomics.» 1994.-V.22.-P. 499-504.
Weston M.D., Eudy J.D., Fujita S. et al. Genomic structure and identification of novel mutations in usherin, the gene responsible for Usher syndrome type fia A // Amer. J. Hum. Genet.- 2000.- V. 66, N 4.-P. 1199-1210.
Whght A.F., Bhattacharya S.S., Clayton J.F. et al. Linkage relationships between X-linked retinitis pigmentosa and nine short arm markers; exclusion of the disease locus from Xp21 and localisation to between DXS7 and DXS14 // Amer. J. Hum. Genet.-1987.- V. 41.- P. 635-644.
Xu S.Y., Schwartz M., Rosenburg T. et al. A ninth locus (RP18) for autosomal dominant retinitis pigmentosa maps in the pericentromeric region of chromosome 1 // Hum. Mol. Genet.-1996.- V. 5.- P. 1193-1997.
Наследственные заболевания в структуре офтальмопатологии составляют не менее 30%. Одной из наиболее распространенных нозологических форм является наследственная катаракта. При диагностике врачом-офтальмологом учитываются результаты комплексного клинико-лабораторного и параклинического узкоспециализированного обследования, однако при выставлении диагноза редко учитывается этиологический фактор болезни. Молекулярно-генетические исследования позволяют установить истинную причину и патогенез патологического процесса наследственного заболевания. Изолированные наследственные катаракты - это группа заболеваний, обусловленных выраженным клиническим полиморфизмом и генетической гетерогенностью. Эти особенности являются основными причинами затруднения диагностики клинико-генетической формы болезни. Согласно литературным данным, выделяют более 50 генетических форм изолированных наследственных катаракт. Клинико-диагностический алгоритм у пациентов с данной патологией является полноценным только в случае наличия медико-генетического консультирования семей врачами-генетиками с учетом данных офтальмологического обследования и молекулярно-генетического исследования. С учетом верификации этиологической компоненты патологического процесса появляется возможность корректно планировать профилактические и лечебные мероприятия. В настоящее время основным методом лечения катаракты является хирургическое лечение. Функциональное состояние органа зрения, стадия патологического процесса и соматическое состояние пациента, прогноз лечения диктуют корректировку лечебных мероприятий с отменой в некоторых случаях хирургического вмешательства при катаракте и с проведением консервативной терапии. В настоящее время терапия помутнения хрусталика проводится путем применения препаратов метаболического воздействия в виде глазных капель. Пиреноксин 75 мг в виде глазных капель (Каталин) - один из известных препаратов данной группы, он используется в практической офтальмологии 12 стран мира. Каталин показан при возрастной катаракте со слабой или средней степенью интенсивности помутнения хрусталиковых масс.
Ключевые слова: катаракта, наследственные болезни, медицинская генетика, клинический полиморфизм, гетерогенность, профилактика, лечение, пиреноксин.
Clinical and genetic aspects of isolated hereditary cataracts
Kadyshev V.V. 1, Zinchenko R.A. 1,2, Kutsev S.I. 1,2
1 Research Centre for Medical Genetics, Moscow
2 Russian National Research Medical University named after N.I. Pirogov, Moscow
Hereditary diseases in ophthalmology account for at least 30% of cases among the whole structure of ophthalmopathology. One of the most common nosological units is hereditary cataract. Using the diagnostic algorithm the ophthalmologist takes into account the results of a complex clinico-laboratory and highly specialized paraclinical examination, however, when the diagnosis is made, the etiological factor of the disease is rarely taken into account. Molecular genetic studies make it possible to establish true cause and pathogenesis of the pathological process of hereditary diseases. Isolated congenital cataract is a group of diseases caused by the severe clinical polymorphism and genetic heterogeneity. These signs are the main reasons for the difficulties of diagnosing clinical-genetic form of the disease. According to literary data there are more than 50 genetic forms isolated hereditary cataracts. Clinical-diagnostic algorithm in patients with this pathology is complete only if there is medical genetic counseling of families by geneticists taking into account the received ophthalmological examinations and molecular genetic studies. Taking into account the verification of the etiological component of the pathological process, it becomes possible to plan correctly the preventive and curative measures. Currently, the main treatment for cataracts, is surgical. The functional state of the organ of vision, the prognosis of treatment, the stage of the pathological process and the somatic state of the patient determine the correction of therapeutic measures and in some cases contributes to the cancellation of surgical measures in cataracts. In such cases, the patient needs a conservative therapy. Currently, opacities of the lens are subjected to conservative curative schemes with the administration of drugs with metabolic effects in the form of eye drops.The pharmaceutical market is represented by a relatively small range of drugs of this group. Pirenoxine 75 mg in the form of eye drops (Catalin) is one of the known drugs used in ophthalmology practice in more than 12 countries. Catalin is applicable in the age-dependent cataract of mild or moderate degree of turbidity of the lens masses.
Keywords: cataract, hereditary diseases, medical genetics, clinical polymorphism, heterogeneity, prevention, treatment, pirenoxin.
For citation: Kadyshev V.V., Zinchenko R.A., Kutsev S.I. Clinical and genetic aspects of isolated hereditary cataracts // RMJ. Clinical ophthalmology. 2017. № 2. P. 114-118.
Освещены клинико-генетические аспекты наследственных изолированных катаракт
Введение
Одним из наиболее распространенных заболеваний органа зрения является катаракта, при диагностике которой необходимо учитывать этиологический фактор. В данной статье обсуждается наследственная катаракта, не являющаяся симптомом наследственного синдрома. Врожденная, ювенильная катаракта и катаракта зрелого возраста являются видами наследственных катаракт. Превалирующий объем инвалидности у детей с офтальмологическими заболеваниями приходится на врожденную катаракту, которая в структуре слепоты и слабовидения составляет 37% [8, 7]. Установлено, что 30-40% случаев заболевания обусловлены генетическими причинами [9].
Распространенность наследственных катаракт в различных популяциях РФ составляет в среднем 1,2:10 тыс. населения [5, 7]. Известно более 300 клинико-генетических вариантов данной нозологической формы [10]. Необходимо отметить, что структура клинико-генетических форм катаракты весьма разнообразна: наследственные изолированные катаракты (16-17%), катаракта вследствие наследственных нарушений обмена веществ и синдромальной моногенной патологии (74-75%), помутнения хрусталика, являющиеся симптомом хромосомной патологии (7-8%).
В практической деятельности врача-офтальмолога наследственные изолированные катаракты представлены 32 клиническими формами, каждая из которых характеризуется широким клиническим полиморфизмом. Врачами-генетиками с учетом этиологического компонента диагностировано более 50 генетических вариантов с изменениями в заинтересованных генах или локусах [3, 10].
По литературным данным, для наследственных катаракт описаны аутосомно-доминантный, аутосомно-рецессивный, Х-сцепленный рецессивный и митохондриальный типы наследования. Основная доля заболеваний (68%) ассоциирована с аутосомно-доминантным типом наследования [4].
Верификация формы патологии хрусталика значительно затруднена из-за выраженного клинического полиморфизма и генетической гетерогенности. Медико-генетическое консультирование, сбор подробного анамнеза, дополнительное обследование родственников (с целью выявления субклинического течения заболевания и уточнения типа наследования) необходимы для разработки профилактических мероприятий и применения новых методов терапии.
Виды наследственных изолированных катаракт
Все наследственные катаракты условно подразделяются по локализации патологического процесса и характеру помутнений хрусталиковых масс.
Полярная катаракта характеризуется помутнением округлой формы, локализованным на переднем и/или заднем полюсах капсулы хрусталика. Тип наследования - аутосомно-доминантный. Идентифицированы 4 гена: CRYAB, EPHA, CHMP4B, PITX3.
При ядерной катаракте патологический процесс локализован в ядре хрусталика. По форме помутнений выделяют пылевидную, зонулярную, полную катаракту. Данная подгруппа заболеваний является одной из самых генетически гетерогенных - диагностировано 12 генетических вариантов. Идентифицированы 6 заинтересованных генов: BFSP2, GJA8, CRYGD, CRYBB1, CRYBA1, CRYAA. По типу наследования выделяют аутосомно-доминантный и аутосомно-рецессивный варианты.
Зонулярная наследственная катаракта дебютирует в течение 1-го года жизни. При биомикроскопии (фокальном осмотре) помутнение имеет вид колец. При наведении световой щели сбоку катаракта имеет вид мутных слоев, расположенных в различных отделах хрусталика. Основной тип наследования - аутосомно-доминантный. Идентифицированы изменения в 5 генах: CRYBA4, CRYGC, MIP, HSF4, MAF.
Особенностью пленчатой катаракты является самопроизвольная резорбция хрусталиковых масс. В основном наследуется по аутосомно-доминантному типу.
Полная (тотальная) катаракта - помутнение всех слоев хрусталика. Однако биомикроскопически отмечается разная степень интенсивности патологического процесса. Тотальная катаракта в основном является двусторонней. Известны 2 типа наследования данных форм изменения хрусталиковых масс: аутосомно-доминантный и Х-сцепленный рецессивный.
Наиболее сложная в диагностическом плане форма наследственной катаракты - частичная атипичная, что связано с выраженным клиническим полиморфизмом. Помутнения могут быть различной формы, интенсивности, содержать кальцификаты. Наследуется по аутосомно-доминантному и аутосомно-рецессивному типу. В настоящее время выявлены изменения в генах GJA3, MIP, CRYGD.
При пылевидной наследственной катаракте помутнения представляют собой взвеси и локализуются в области ядра и кортикальном слое хрусталика. Данный вид катаракт характеризуется клиническим полиморфизмом (LIM2, CRYBB1, CRYGC).
В случае биомикроскопических находок изменений хрусталика в виде голубых точечных помутнений офтальмолог диагностирует лазурную катаракту. Тип наследования - аутосомно-доминантный (MAF, CRYBB2).
Особенности диагностики изолированных наследственных катаракт
![Таблица 1. Гены, идентифицированные при наследственных изолированных катарактах [10]](/pimg3/geneticheskaya-geterogennost-kak-8C257.png)
Для диагностирования клинико-генетической формы патологии хрусталика необходимо коллегиальное взаимодействие врача-офтальмолога и врача-генетика. В результате офтальмологического обследования подробно анализируются характер и локализация патологического процесса. Врач-генетик проводит клинико-генетическое сопоставление полученных офтальмологических данных с литературными данными и каталогом OMIM [10]. При этом обязательно учитываются возраст манифестации заболевания, генеалогический анамнез, при семейном случае уточняется тип наследования.
Таким образом, после совместного клинического обследования пациента решается вопрос о молекулярно-генетическом исследовании образцов его биоматериала с целью выявления генных изменений. В настоящее время одним из ведущих учреждений, активно проводящих ДНК-диагностику наследственной офтальмологической патологии, является ФГБНУ «Медико-генетический научный центр».
Однако, несмотря на относительно несложный диагностический алгоритм, у врачей возникают затруднения в окончательном определении клинико-генетической формы наследственной изолированной катаракты, что связано, в частности, с выраженным клиническим полиморфизмом, вариабельной экспрессивностью признаков у членов одной семьи, вовлечением в патологический процесс хрусталика с одной стороны, прогрессирующим и непрогрессирующим течением болезни, а также в случае проведенного оперативного лечения, когда установить форму помутнения хрусталиковых масс не представляется возможным. Кроме того, верификация клинико-генетической формы катаракты затруднена ввиду большого количества мутаций de novo.
По литературным данным, идентифицированы мутации в 19 генах, ассоциированные с наследственными изолированными катарактами 12 (табл. 1).
Профилактика и лечение
Результаты комплексного обследования пациента позволяют сформировать план профилактических и лечебных мероприятий.
Различают первичную, вторичную и третичную профилактику наследственной патологии. Целью первичной профилактики является предупреждение рождения больного ребенка. Вторичная профилактика проводится на пренатальном уровне. При третичной профилактике наследственной патологии проводят коррекцию лечения с учетом клинической картины заболевания (на постнатальном уровне).
Особое внимание уделяется разработке новейших методов терапии катаракты и совершенствованию реабилитации пациентов [1, 2].
В настоящее время основным методом лечения катаракты является хирургический. При этом необходимо учитывать возраст манифестации заболевания, функциональное состояние сетчатки, интенсивность помутнения и возможность прогрессирования патологического процесса. В связи с этим оперативное лечение может быть отложено, и в таком случае необходимо проведение поддерживающей консервативной терапии. В настоящее время применяют препараты, действующие на метаболические процессы в хрусталике. В практической деятельности врача-офтальмолога используются препараты, содержащие пиреноксин, цитохром-С, аденозин, никотинамид, таурин. Пиреноксин 0,75 мг (Каталин) конкурентно ингибирует действие хиноновых веществ, продуцируемых в результате аномального метаболизма ароматических аминокислот, предотвращая развитие катаракты и ее прогрессирование. Каталин широко используется в 12 странах мира. В Российской Федерации глазная форма пиреноксина 0,75 мг успешно вернулась в арсенал врача в 2008 г. По данным отдаленного катамнеза, не менее чем у 47% пациентов отмечается положительная динамика заболевания. Препарат Каталин может быть рекомендован для консервативной поддерживающей терапии в случае помутнений хрусталика низкой или средней интенсивности в парацентральной области, когда хирургическое лечение отложено или не показано.
Исследование выполнено при частичной финансовой поддержке РНФ 17-15-01051
Основные наследственные заболевания глаз

Генетические заболевания - патологии, возникающие в результате изменений в генетическом коде. В офтальмологии есть ряд заболеваний, риск которых повышается при влиянии наследственного фактора.
В основе патологической наследственности - мутации генов у одного или обоих родителей. Мутации обычно происходят под влиянием неблагоприятных агентов:
- лекарства;
- наркотики;
- канцерогены;
- экологические катастрофы и др.
Ученые выделяют физические (радиация, излучения), химические (нитраты, алкоголь) и биологические провокаторы развития генных мутаций. Среди внешних факторов можно выделить:
- родственные браки;
- возраст родителей (младше 16 и старше 40 лет);
- тяжелые роды.
При этом важно учитывать, что для проявления и развития многих наследственных заболеваний могут требоваться также внешние факторы: образ жизни, экология.
Виды генетических заболеваний глаз
В офтальмологии наследственные заболевания глаз делят на три категории.
1. К первой категории относят особенности, которые заметны внешне, но не требуют лечения.
Например: гетерохромия (разный цвет радужных оболочек глаз), дальтонизм (цветовая слепота, при которой больной не может различать один или несколько цветов), близорукость.

2. Ко второй категории относят заболевания, связанные с другими патологиями.
Эта категория включает:
- альбинизм - сниженная выработка пигмента радужной оболочки;
- синдром Франческетти - отсутствие мейбомиевых желез, сужение глазной щели, выворот нижних век;
- синдром Дауна - сниженное зрение, характерный разрез век, пятна Брушфильда;
- синдром Марфана - выраженная миопия, уплощение роговицы, деструкция стекловидного тела и др.
Патологии из этой группы протекают с множественными изменениями в организме, связанными не только с органами зрения.

3. Врожденные патологии, требующие хирургического лечения.
Самыми распространенными заболеваниями из этой группы являются врожденная глаукома и катаракта. В первом случае речь идет об увеличение внутриглазного давления, которая приводит к быстрому поражению зрительного нерва, во втором - о помутнении хрусталика глаза.
Некоторые заболевания проявляются сразу после рождения:
- альбинизм;
- анофтальм;
- дальтонизм;
- микрофтальм;
- ретролентальная фиброплазия;
- врожденные глаукома и катаракта.
Другие (ретинобластома, близорукость) проявляются в первые годы жизни, а третьи нередко возникают лишь после 20 лет (заболевания сетчатки глаза, глаукома).

Диагностика и лечение генетических заболеваний глаз
В медицине описано более 500 генов, мутация которых способна вызывать патологии органов зрения. Правильно поставленный диагноз поможет определить верную тактику лечения и значительно изменить прогноз.
Любые заболевания органов зрения, в том числе, связанные с наследственным фактором, требуют обращения к врачу для подтверждения диагноза, наблюдения, оперативного вмешательства. Важно, что при многих патологиях зрение можно восстановить или улучшить консервативными методами. Например, миопию у ребенка можно устранить с помощью индивидуально подобранных капель и гимнастики.
1. Эндотелиальная дистрофия роговицы Фукса — К1, К2, К3.
2. Задняя полиморфная дистрофия роговицы — К1 или К2.
3. Врожденная эндотелиальная дистрофия — К1.
4. X-связанная эндотелиальная дистрофия роговицы — К2.
Далее приводятся данные о наиболее распространенных в офтальмологической практике и клинически значимых дистрофиях роговицы.
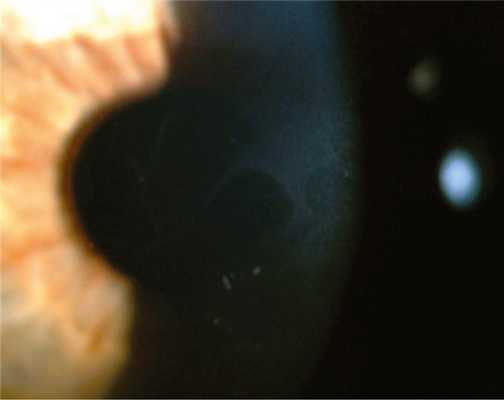
Дистрофия эпителиальной базальной мембраны (ДЭБМ) — одна из часто встречающихся дистрофий. Хотя она включена в представленную классификацию и поражает один слой роговицы, что типично для дистрофических поражений, только небольшое число случаев имеет доказанное наследование — ген TGFBI (transforming growth factor beta-induced), локус 5q31 [7, 11]. В большинстве наблюдений состояние считают специфической реакцией роговицы на внешние воздействия, т. е. дегенерацией, которая обусловлена аномальным восстановлением, созреванием и формированием базальной мембраны, приводящим к образованию патологических комплексов адгезии и ослабленному прикреплению эпителия к строме [7, 12]. Дистрофия встречается у 2% в популяции, чаще у женщин. При биомикроскопии в эпителиальном слое роговицы выявляются сероватые включения, тонкие линии, микрокисты. Эти образования формируют различные типы рисунка в субэпителиальном слое — точечные и микрокистные изменения, географический рисунок, рисунок «отпечатка пальца», «булыжной мостовой» (рис. 1). Рис. 1. Дистрофия эпителиальной базальной мембраны. Со временем они могут менять свою локализацию и тип рисунка [13, 14]. Так как эти интраэпителиальные поражения полупрозрачны и могут быть очень маленькими по размеру, биомикроскопия должна проводиться с особой тщательностью с использованием различной техники освещения. При гистологическом исследовании выявляются интраэпителиальные разрастания или многослойные образования базальной мембраны эпителия, которые формируют географический рисунок или рисунок «отпечатка пальца». Точечные изменения представляют собой псевдокисты, содержащие твердые частицы в цитоплазме и скопление клеточного детрита между патологическими разрастаниями мембраны либо в слоях эпителия [5—8]. Симптоматика дистрофии тесно связана с синдромом рецидивирующей эрозии роговицы и временным незначительным снижением остроты зрения, что чаще имеет место у пациентов старше 30 лет. Считается, что от 10 до 30% пациентов с ДЭБМ подвержены рецидивам эрозии роговицы и у 50% больных с рецидивирующей эрозией роговицы выявляются признаки ДЭБМ. При изменениях базальной мембраны в оптическом центре возможен неправильный астигматизм. В большинстве случаев дистрофия протекает бессимптомно [6].
Дистрофия Рейс—Буклера — аутосомно-доминантная (ген TGFBI, локус 5q31), билатеральная, центральная дистрофия роговицы с первичным поражением боуменового слоя, начальные признаки которой появляются в первые годы жизни в виде поверхностных линейных и кольцевидных сероватых помутнений, сопровождающихся рецидивирующими эрозиями с выраженным болевым компонентом. К 20—30 годам помутнения прогрессируют, сливаются между собой, сохраняя характерный географический рисунок, распространяясь на среднюю периферию и глубже в строму, развивается диффузное стромальное неинтенсивное помутнение (хейз) [15, 16]. Частота эрозий с возрастом заметно уменьшается, ухудшается острота зрения из-за прогрессирования помутнений и неправильного астигматизма. Снижение остроты зрения при этой дистрофии более выражено, чем при сходной дистрофии Тиля—Бенке, из-за большего нарушения регулярности передней поверхности роговой оболочки глаза [7, 17]. При гистологическом исследовании видно, что эпителиальный слой теряет регулярную архитектонику, местами утолщен, повторяет измененный рельеф подлежащей соединительной ткани. Местами отсутствует базальная мембрана эпителия. Боуменов слой замещается листовидной фиброцеллюлярной соединительной тканью с зернистыми отложениями, которая в развитой стадии заболевания распространяется в передние слои стромы [7, 17, 18].
Для стромальных и ряда эпителиально-стромальных дистрофий характерным является отложение патологических веществ между коллагеновыми фибриллами или в кератоцитах. Это могут быть как нормальные метаболиты, представленные в избыточном количестве, как гликозамингликаны при макулярной дистрофии, так и вещества, не встречающиеся в роговой оболочке в норме (амилоид, холестерол, гиалин) [8, 17].
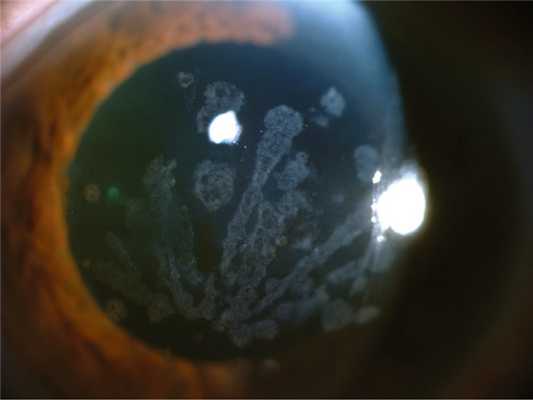
Зернистая дистрофия роговицы, тип 1 (классическая) имеет аутосомно-доминантный тип наследования (ген TGFBI, локус 5q31), билатеральная, симметричная. Заболевание проявляется в первую декаду жизни. Осмотр за щелевой лампой выявляет хорошо видимые гранулы, которые кажутся белыми при прямом освещении. При ретроиллюминации эти гранулы состоят из чрезвычайно мелких, полупрозрачных точек, выглядят как вакуоли, стеклянные осколки или измельченные крошки. Помутнения не захватывают лимбальную зону (рис. 2). Рис. 2. Зернистая дистрофия роговицы, тип 1. У детей коричневые гранулы, образующие вихревидный рисунок, расположены относительно поверхностно и распространяются к слою Боумена. В дальнейшем гранулы простираются в глубокие слои стромы вплоть до десцеметовой мембраны [6, 17]. Блики и светобоязнь являются относительно ранними симптомами. Так как на начальных этапах регулярность передней поверхности не нарушена, острота зрения остается высокой. С возрастом помутнения прогрессируют, сливаются между собой, острота зрения постепенно снижается. Иногда имеют место рецидивирующие эрозии. В развитых стадиях острота зрения редко снижается — менее 0,1. Как правило, к 50—60 годам необходима кератопластика, после которой вероятны рецидивы в течение нескольких лет (от 1 года до 20 лет) [7, 8, 18].
Зернистая дистрофия роговицы, тип 2, считается комбинированной — зернисто-решетчатой. Также часто именуется дистрофией роговицы Авеллино по местности, где проживала семья, страдавшая таким заболеванием. Имеет аутосомно-доминантный тип наследования (ген TGFBI, локус 5q31). По данным световой микроскопии помутнения роговицы простираются от базального эпителия до глубокой стромы. Помимо типичных для зернистой дистрофии 1-го типа гиалиновых отложений, в строме присутствует амилоид [5]. Заболевание начинается в первой декаде жизни, но выявляется чаще в подростковом возрасте или в ранней зрелости. Начальными признаками дистрофии, которые выявляются под щелевой лампой, считаются поверхностные стромальные крошечные белесые точки. На следующем этапе между поверхностной и средней стромой появляются кольцевидные или в форме снежинки помутнения. У некоторых пациентов в более глубоких слоях также имеют место решетчатые линии. Как правило, эти линии расположены глубже, чем стромальные помутнения в виде снежинок. На заключительном этапе полупрозрачные плоские крошковидные помутнения, расположенные поверхностно, могут сливаться между собой. У некоторых пациентов проявления дистрофии ограничиваются только множеством белых точек. Пациенты с зернистой дистрофией 2-го типа имеют меньше помутнений, чем лица с зернистой дистрофией 1-го типа. Острота зрения уменьшается с возрастом, так как постепенно вовлекается центральная зона. При эрозиях, которые, как правило, не имеют тяжелого течения, возникают болевые ощущения [6, 17, 19]. Заболевание прогрессирует медленно, несколько быстрее при гомозиготной форме.
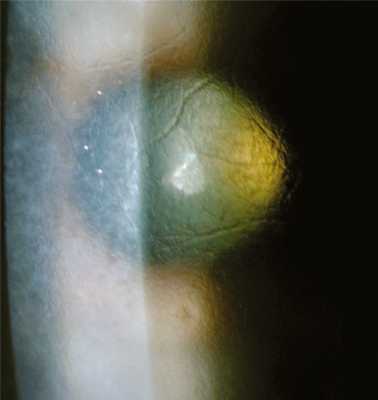
Решетчатая дистрофия роговицы, тип 1, считается классической решетчатой дистрофией роговицы, имеет аутосомно-доминантный тип наследования (ген TGFBI, локус 5q31). При гистологическом исследовании выявляются отложения амилоидного вещества в строме, которые нарушают ламеллярную архитектонику роговицы. Также могут отмечаться эпителиальная атрофия и дегенеративные нарушения базальных эпителиальных клеток, очаговое истончение или отсутствие слоя Боумена [5]. При биомикроскопии уже к концу первого десятилетия жизни видны тонкие ветвящиеся, отражающие свет линии и/или субэпителиальные беловатые овальные точки. Линии появляются в центре достаточно поверхностно, распространяясь на периферию и в глубь роговой оболочки глаза, но оставляя периферию, десцеметову мембрану и эндотелий интактными (рис. 3). Рис. 3. Решетчатая дистрофия роговицы, тип 1. Диффузное стромальное помутнение матового цвета, как правило, развивается позже, сопровождается рецидивирующими эрозиями [7]. Дискомфорт, боль и зрительные нарушения иногда начинаются уже в первое десятилетие жизни. Зрительные нарушения становятся значительными к четвертому десятилетию, что часто является показанием к кератопластике в этом возрасте [6, 8, 20].
Решетчатая дистрофия роговицы, тип 2, была внесена в первую редакцию современной классификации лишь условно, исключена из второй, не считается дистрофией роговицы как таковой, а является глазным проявлением семейного амилоидоза. Сопровождается краниальной нейропатией, проявляющейся как лицевой парез, бульбарный паралич, периферической полинейропатией. При биомикроскопии изменения сходны с таковыми при типе 1. Чувствительность роговицы снижена или отсутствует. Острота зрения сохраняется достаточно высокой длительное время, так как дистрофия прогрессирует от периферии к центру роговицы. Развивается симптоматика синдрома сухого глаза. В пожилом возрасте могут возникать рецидивирующие эрозии роговицы. Течение заболевания медленно прогрессирующее. У большинства может не быть серьезных нарушений до седьмого десятилетия. Существует повышенный риск открытоугольной глаукомы [6, 7].
Макулярная (пятнистая) дистрофия роговицы. Имеет аутосомно-рецессивный тип наследования, ген CHST6 (сarbohydrate sulfotransferase 6 gene), локус 16q22.
При задней полиморфной дистрофии (ЗПД) тип наследования аутосомно-доминантный, выявлены различные локусы: для ЗПД1 — 20p11.2-q11.2; ЗПД2 — 1p34.3-p32.3; ЗПД3 — 10p11.22. Ген для ЗПД1 не выделен, для ЗПД2 — COL8A2, ЗПД3 — ZEB1. Морфологически на задней поверхности десцеметовой мембраны выявляются патологические слои коллагена с локальными веретенообразными или узелковыми разрастаниями. Среди эндотелия определяются участки многослойных эпителиоподобных клеток с микроворсинками и десмосомами [8, 24]. Заболевание проявляется часто асимметричными поражениями различной формы в глубоких слоях роговицы, включая узелковые, везикулезные (изолированные, в группах или сливные) и блистероподобные. Помутнения могут иметь вид «железнодорожных путей» и очаговых серых участков на уровне десцеметовой мембраны. Стромальный и эпителиальный отек из-за эндотелиальной декомпенсации развивается редко. Изменения в эндотелии часто не прогрессируют годами. Возможны медленное прогрессирование полиморфных везикул и утолщение десцеметовой мембраны на протяжении многих лет. Периферические иридокорнеальные сращения встречаются в 25% случаев. Примерно в 15% наблюдений уровень внутриглазного давления повышен [26]. Эндотелиальные изменения часто протекают бессимптомно. Редко имеется значительное прогрессирующие снижение остроты зрения в результате стромальных помутнений [6, 24, 27].
Лечение. Эффективной патогенетической терапии на современном этапе развития медицины не существует. Симптоматическое местное лечение направлено на купирование нарушений передней поверхности роговицы и уменьшение ее отека при тех дистрофиях, где он имеет место. Для этого применяются любриканты, препараты, способствующие регенерации, мягкие контактные линзы, гипертонические растворы [12]. Перспективным представляется использование современных инновационных слезозаменителей, одним из представителей которых является катионорм (Santen), созданный по технологии Novasorb на основе катионной эмульсии. Препарат эффективно восстанавливает слезную пленку, во многом воспроизводит физиологию естественной слезы, не содержит консервантов, что позволяет применять его длительное время без побочных эффектов.
Хирургическое лечение может включать абразивные вмешательства на передней поверхности роговицы для улучшения адгезии эпителиального слоя к глубжележащим слоям и отчасти для уменьшения ее иррегулярности. ФТК является эффективным методом при удалении помутнений передних слоев роговой оболочки на фоне поверхностных и некоторых видов стромальных дистрофий. Кроме того, при выполнении ФТК удается устранить иррегулярный астигматизм и улучшить адгезию эпителия. При рецидивах заболевания процедуру можно повторять несколько раз. При глубоких помутнениях, существенно снижающих остроту зрения, методом выбора является кератопластика. При относительно изолированном поражении слоев роговицы предпочтительными являются модификации послойной кератопластики (передняя послойная, глубокая послойная, эндотелиальная кератопластика). При одновременном вовлечении стромального и эндотелиального слоев целесообразно проводить сквозную кератопластику или ее модификации со сложным профилем операционного разреза. Как и после ФТК, после кератопластики вероятны рецидивы в сроки от 1 года до 20 лет, частота которых и степень снижения зрения зависят от вида дистрофии и могут варьировать индивидуально [8, 28, 29].
Заключение
Дистрофии роговицы — группа медленно прогрессирующих невоспалительных поражений роговицы, большинство из которых отличаются вариабельностью фенотипических проявлений. Описанная в статье новая классификация сочетает в себе аспекты традиционного определения дистрофий роговицы с новыми генетическими, морфологическими и клиническими данными. Важно помнить о существовании подобной патологии и своевременно дифференцировать с острыми воспалительными процессами различной этиологии, которые требуют ургентной терапии. При дистрофиях целесообразное консервативное лечение, связанное, как правило, с нарушениями передней поверхности роговицы, является симптоматическим (любриканты, препараты, способствующие эпителизации, мягкие контактные линзы). Эффективной терапии этиопатогенетической направленности не существует. При значительном снижении остроты зрения возможно выполнение ФТК и различных модификаций кератопластики в зависимости от глубины поражения.
Читайте также:
- Влияние сердечно-сосудистых лекарств на плод и беременность
- Желтуха у ребенка при муковисцидозе
- Сбор гинекологического анамнеза у женщин
- Посттрансплантационное лимфопролиферативное расстройство конъюнктивы: признаки, гистология, лечение, прогноз
- Железистые эпителии. Физиологическая регенерация эпителиев. Ткани внутренней среды.
