География микробной колонизации полости рта. Микробы слизистой рта.
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
2. Байрамов Г.Р. Исследование пародонтопатогенной микрофлоры и ее этиологическая значимость в формировании разных клинических форм воспалительных заболеваний пародонта // Клиническая стоматология. - 2010. - № 2 (54). - С. 84-86.
3. Баяхметова А.А., Смагулова Е.Н., Мангытаева Б.Б., Баскакова И.В. Характеристика микрофлоры корневых каналов при хроническом периодонтите // НАУКА И МИР. - 2015. - Т. 9. - №4 (20). - С. 81-84.
4. Брофман И.Д., Созаева А.Ю., Жанимова Л.Р., Карданова К.Х., Алиев А.У. Изменение микрофлоры полости рта при пародонтите различной степени тяжести // Успехи современной науки. - 2016. - Т. 10. - № 11. - С. 39-42 .
7. Зорина О.А, Аймадинова Н.К., Борискина О.А., Басова А.А., Ребриков Д.В. Основные изменения нормальной микрофлоры пародонта при хроническом генерализованном пародонтите, выявленные с помощью метагеномного секвенирования// Российская стоматология. - 2017. - Т 10, № 2. - С. 41-48.
8. Когина Э.Н., Герасимова Л.П., Кабирова М.Ф., Усманова И.Н. Микробиологическое исследование содержимого корневых каналов при хроническом апикальном периодонтите // Современные проблемы науки и образования. - 2015. - № 5. - С. 328.
9. Колчанова Н.Э. Роль микрофлоры и ее способность формировать биопленку в патогенезе хронического периодонтита // Вестник витебского государственного медицинского унверситета. - 2017. - Т 16, № 5. - С. 127-135.
10. Крамарь В.О., Усатова Г.Н., Крамарь О.Г., Климова Т.Н. Пространственная структура и экологическая значимость микрофлоры полости рта и особенности ее изменений при кариесе // Фундаментальные исследования. - 2014. - № 2. - С. 85 - 89.
11. Кукушкин В.Л., Дутова А.А., Кукушкина Е.А., Смирницкая М.В. Микрофлора биопленки эндодонта при хроническом апикальном периодонтите // Актуальные проблемы и перспективы развития стоматологии в условиях Севера. - 2017. - С. 57-59.
12. Мозговая Л. А., Задорина И. И., Быкова Л. П. Микрофлора корневых каналов зубов в динамике лечения хронических форм апикального периодонтита // Саратовский научно-медицинский журнал. - 2013. - Т. 9, № 3. - С. 447-449.
13. Николаева Е. Н., Царев В. Н., ИпполитовЕ.В. Пародонтопатогенные бактерии — индикаторы риска возникновения и развития пародонтита// Стоматология для всех. - 2011. - №1. - С. 4-7.
15. Пашкова Г.С., Галиева Д.Т., Исаджанян К.Е., Никитин В.В., Попова В.М., Жиленков Е.Л. Особенности микрофлоры полости рта у пациентов с воспалительными заболеваниями пародонта // Лечение и профилактика. - 2013. - № 4 (8). - С. 74-80 .
16. Тамарова Э. Р., Баймиев А. Х., Швец К. Ю., Мавзютов А. Р. Молекулярно-генетическая характеристика видового состава микробиоты слюны и десневых карманов при пародонтите // Клиническая лабораторная диагностика. - 2015. - № 60(12). - С. 56-59.
17. Хашумов А. А. Микрофлора полости рта у больных кариесом // Молодой ученый. — 2018. — №32. — С. 26-28.
18. Царев В.Н., Ипполитов Е.В., Шулаков В.В., Никитин И.В. Первый опыт детекции молекулярных маркеров пародонтопатогенных видов 1 - го и 2 - го порядка при одонтогенных гнойно-воспалительных процессах челюстно-лицевой области с применением разных диагностических систем // Российская стоматология. - 2014. - № 7 (2) - С. 43-46.
В составе микрофлоры полости рта принято различать облигатные (резидентные) виды микроорганизмов, постоянно обитающие в полости рта и факультативные (непостоянные), которые обнаруживаются редко. Длительному пребыванию непостоянной микрофлоры препятствуют неспецифические факторы защиты ротовой полости и антагонизм с другими видами бактерий.
Также микрофлора полости рта делится на нормальную (не вызывает заболевания), условно-патогенную (способна вызывать заболевание при определенных условиях) и патогенную (всегда ведет к развитию заболевания).
Нормальная облигатная микрофлора полости рта включает аэробов, факультативных анаэробов и анаэробов. Аэробы и факультативные анаэробы представлены различными видами Streptococcus (100%) и Staphylococcus (80%), Neisseria (100%), Lactobacillus (90%), Diphtheroids (80%), Hemophilus (60%) и др. Среди анаэробов присутствуют Veillonella (100%), Peptostreptococcus (100%), Bacteroides (100%), Fusobacterium (75%), Actinomycetes и Diphtheroids (100%) и другие.
Факультативная нормофлора полости рта представлена такими аэробами и факультативными анаэробами как Klebsiella (15%), Escherichia (2%) и другими. Среди анаэробов не очень часто определяются Clostridium. Грибы рода Candida в норме отсутствуют или встречаются в небольших количествах [6].
Важно отметить, что среди нормофлоры присутствуют бактерии, снижение содержания которых тесно связано с развитием заболевания. К таким бактериям относятся Lactobacillus, Bifidobacterium и некоторые виды Streptococcus (Str. salivarius, Str. sanguis, Str. mitis) [10].
При заболеваниях состав микрофлоры патологического очага меняется как качественно, так и количественно, анализ этих данных может иметь большое значение при диагностике и лечении соответствующих заболеваний.
Различия в частоте выявления патогенов можно объяснить особенностями формирования групп, возможной (иногда запланированной) штаммоспецифичностью, а также разной чувствительностью используемых тест-систем [7].
При кариесе доминирующими остаются Streptococcus, однако их количество снижается (78%) и происходит изменение видового состава - снижается численность Str. Salivarius (45,4%), Str. Sanguis (38,2%), при этом доминирующими становятся Str. Mutans (18,2%), Str. Mitis (76,4%). Снижается содержание Lactobacillus sp. (63,6%) и Bifidumbacteriumsp. (67,3%), примечательно, что их количество уменьшается по мере прогрессирования кариозного процесса. Также из резидентной флоры отмечается увеличение колонизации Neisseria (16,4 %) и грибов рода Candida (21,8%). В полости рта у больных кариесом появляется транзиторная флора - Enterobacteriaceae (E. Coli (7,3%), Klebsiella (3,6%), Enterobacter (5,4%), Citrobacter (1,8%), Peptostreptococcus (21,8%). Таким образом, при кариесе регистрируется изменение в качественном и количественном составе микрофлоры полости рта [10, 17].
Согласно научным исследованиям, при хронических формах периодонтита в корневых каналах зубов спектр микробного пейзажа представлен достаточно широко. При этом доминируют патогенные стрептококки Str. tigurinus (91,7%), Str.vestibularis (45,8%), Str. bovis (37,5%), Str. milleri (33,3%) и Str. intermedius (16,7%), Str. mutans (9,7%), присутствуют и Str. sanguis (29%), Str. mitis (3,2%) [8].
Необходимо отметить, что известна взаимосвязь Str. tigurinus с инфекционными эндокардитами и менингитами, Str.milleri и Str.intermedius с абсцессами головного мозга и легких, Str. vestibularis и Str. bovis с бактериемией и абсцессами. Описан клинический случай спондилодисцита и инфекционного эндокардита, причинным микробным фактором которых являлся Str.vestibularis [3].
По данным других исследований в микробном пейзаже доминируют Streptococcus (50%), а также представители рода Staphylococcus (62,5%), анаэробные бактерии (58,3%), бактерии рода Lactobacillus (41,7%), Neisseria (16,7%), Enterococcus и Enterobacteriumпоровну (8,3%), грибы рода Candida (4,2% - 24,5%). Среди Staphylococcus в наибольшем количестве обнаружен S. epidermidis. Анаэробные бактерии в большинстве случаев представлены кокками рода Peptococcus (42,8%), Peptostreptococcus (21,4%), семейством Bacteroides (21,4%), бактериями рода Fusobacterium и Prevotella поровну (7,1%) [11, 12].
Кроме того, при хроническом периодонтите были выделены пародонтопатогены 1 порядка -Aggregatibacteractinomycetemcomitans (52,4%), Porphyromonasgingivalis (23,8%), Tannerellaforsythia (4,8%); 2 порядка -Fusobacteriumnucleatum (15,5%), Prevotellaintermedia (13,1%), Porphyromonasendodontalis (10,7%), Treponemadenticola (4,8%). Из ассоциаций чаще обнаруживаются комбинации анаэробов (70,5%), реже анаэробов со Streptococcus, Enterococcus, Staphylococcus (12,8%) [1].
В случае обострения хронического периодонтита пейзаж микрофлоры КК зубов претерпевает изменения. Лидирующее положение продолжают занимать Staphylococcus (55,5%). Значительно увеличивается роль Streptococcus (44,4%). Определяется увеличение количества Enterobacterium и Neisseria в равном количестве по 33,3%. Число анаэробных бактерий и представителей рода Lactobacillus снижается (22,2%). Грибы рода Candida чаще не обнаруживаются или составляют до 14,8% [11,12].
К пародонтопатогенам на сегодняшний день относят около 20 видов бактерий, относящихся по степени вирулентности к двум подгруппам. На Всемирном рабочем совещании клинических пародонтологов в 1996 г. в качестве специфических патогенных бактерий, обусловливающих заболевания пародонта, были названы три вида: A. actinomycetemcomitans, T. forsythus и Prevotella. Gingivalis. Это пародонтопатогены 1-го порядка, для которых выявлены строгие ассоциации с прогрессированием заболевания. Все эти бактерии являются грамотрицательными анаэробами, облигатными или факультативными. Все имеют выраженную тенденцию к внутриклеточному паразитированию в десневом эпителии и тканях пародонта. Наиболее агрессивным пародонтопатогеном является Porphyromonas gingivalis. К пародонтопатогенам 2-го порядка относятся бактерии, играющие второстепенную роль в развитии заболевания пародонта: Treponemadenticola, Prevotellaintermedia и другие. [13, 14].
Среди патогенной и условно-патогенной микрофлоры отмечается значительное увеличение распространенности Str. mutans (79,1%), Str. oralis (62,7%), Str. sobrinus (23% - 52,7%) [4, 16]. Candida albicans при разных степенях тяжести заболеваний пародонта - от 70,3 до 98,4% [2].
Достаточно высокая распространенность пародонтопатогенов 1-го порядка варьирует в пределах: P. gingivalis (35%,-50,5%), T. forsythensis (48,5%), A. actinomycetemcomitans (20,6%), 2-го порядка - F. nucleatum (40%), P. intermedia (32,9%), T. denticola (16% - 65,9%) [4, 9, 15, 18].
Выявлено, что с развитием заболевания наблюдается тенденция к увеличению распространенности пародонтопатогенов, однако многие исследователи отмечают данное увеличение не для всех видов [7, 9].
По данным ряда авторов, при пародонтите среди микрофлоры, связанной со здоровым пародонтом, уменьшается количество Veillonella в 4-5 раз. Обнаружено, что Treponema, Synergistaceae и Filifactor сильнее всего ассоциируются с пародонтитом, в то время как известные пародонтопатогены, такие как Porphyromonas и Tannerella, связаны с ним частично. Более того, колонизация пародонта родами P. intermedia и A. Actinomycetemcomitans оказалась никак не связана с воспалительными заболеваниями пародонта, хотя они часто считаются самыми опасными инфекционными возбудителями, напрямую ответственными за разрушение тканей пародонта. Возможно, объясняется это тем, что только определенные серотипы A. аctinomycetecomitans имеют пародонтопатогенность, в то время как другие серотипы этих видов, и особенно других видов рода Aggregatibacter, не связаны с хроническим пародонтитом [7].
Из недавно обнаруженных кандидатов в пародонтопатогены можно назвать представителей родов Campylobacter, Abiotrophia, Gemella, Capnocytophaga и Neisseria. Однако пока не ясно, насколько существенна их роль в развитии пародонтита [5].
Выводы: в нашей статье был проанализирован качественный и количественный состав микрофлоры при пародонтите, кариесе и периодонтите, были выявлены преобладающие виды патогенных микроорганизмов. В настоящее время в научных исследованиях большое внимание уделяется описанию микробиоценозов ротовой полости в норме и при патологии, имеющие большое значение при диагностике и лечении данных заболеваний. Необходимо подчеркнуть, что в существующей научной литературе либо описывается качественный состав сообществ, либо оценивается количество избранных патогенов по отношению друг к другу и к общей бактериальной массе, что ведет к накоплению информации лишь о наиболее значимой патогенной микрофлоре. В дальнейшем можно ожидать расширения списка патогенов благодаря совершенствованию методов диагностики. При количественных исследованиях микробиоценоза в рамках научного исследования необходимо учитывать большее разнообразие вероятных патогенов, чтобы выявить причинную микрофлору.
Биопленки ротовой полости

Бытует мнение, что ротовая полость (РП) - это самое грязное место во всём организме человека. С этим утверждением можно поспорить, но, по подсчётам учёных, в слюне и ротовой жидкости в среднем содержится 10^9 микроорганизмов в 1 миллилитре, а в зубном налёте - 10^11 в 1 грамме. Согласно последним данным, во рту у человека, не страдающего патологиями органов РП, неодномоментно обитают примерно 700 видов различных бактерий.
Несмотря на такое разнообразие микрофлоры, при хорошей гигиене и отсутствии соматических и психических отклонений (таких, как сахарный диабет, СПИД, постоянный стресс и многих других) мы живём в мире и согласии с колонизаторами слизистых оболочек (СО) нашей ротовой полости. Проявление наличия тех или иных бактерий в РП может служить диагностическим признаком (например, грибковые заболевания СО могут быть признаком нарушений Т-клеточного звена иммунитета).
Но помимо слизистых оболочек, микроорганизмы колонизируют и поверхность твёрдых тканей зуба. Как всем известно, это приводит к кариесу, а при откладывании визита к стоматологу и пускании процесса на самотёк - к таким осложнениям, как пульпиты, периодонтиты, а в дальнейшем - образование гранулём и кист. Чтобы разобраться, кто виноват и что делать, необходимо ближе рассмотреть то, с чего начинается любой кариес.
Ключевым механизмом возникновения кариеса является образование зубной бляшки. По своей сути, бляшка - это скопление большого количества разнообразных бактерий, которые потребляют и продуцируют органические вещества, а помимо этого представляют из себя многослойный конгломерат, каждый слой в котором выполняет свою собственную функцию. Получается небольшой “город” или “страна”, где есть “рабочие”, продуцирующие кислоты и витамины (стрептококки, коринобактерии и др.) , есть транспортные пути, по которым доставляются питательные вещества для разных слоёв микросообщества, есть “пограничники”, которые находятся на периферии и защищают наш город-страну от развала под действием внешних факторов (актиномицеты).
Процесс образования бляшки начинается сразу после того, как вы почистили зубы. На поверхности эмали образуется плёнка - пелликула, которая состоит из компонентов слюны и десневой жидкости (альбуминов, иммуноглобулинов, амилазы и липидов). В течении 2-4 часов бактерии колонизируют пелликулу, но они слабо связаны с плёнкой и легко удаляются. Если за это время никто им не помешал, они начинают активно расти и размножаться, образовывать микроколонии.
Стрептококки (S. mutans и S. sanguis) первыми приходят колонизировать эмаль. Они синтезируют из сахарозы молочную кислоту, которая способствует созданию кислой среды и деминерализации эмали. Бактерии закрепляются в углублениях зуба (именно поэтому самый распространённый вид кариеса - кариес жевательных поверхностей моляров и премоляров из-за наличия на них выраженных фиссур) и протягивают руку помощи тем, кто сам не способен закрепиться на эмали. Это явление получило название коагрегации. Самым распространенным примером является S. mutans, у которого есть специальные рецепторы к адгезии на эмали и который синтезирует из сахарозы внеклеточные полисахариды, что способствует связыванию стрептококков между собой и прикреплению к эмали других бактерий.
В первые 4 часа к стрептококкам присоединяются вейлонеллы, коринебактерии, актиномицеты. Вейлонеллы хорошо ферментируют уксусную, пировиноградную и молочную кислоты, тем самым нейтрализуя кариесогенное действие других бактерий. Коринебактерии синтезируют витамин К, который стимулирует рост анаэробных бактерий. Актиномицеты образуют переплетающиеся нити и способствуют прикреплению к эмали других бактерий, образуют каркас зубной бляшки, а также продуцируют кислоты, способствуя деминерализации эмали. Перечисленные бактерии составляют “раннюю” бляшку.
“Динамичная” бляшка, которая формируется в течение 4-5 дней, преимущественно состоит из фузобактерий, вейлонелл и лактобактерий. Фузобактерии продуцируют мощные ферменты и совместно с трепонемами играют роль в развитии стоматитов. Лактобактерии обильно синтезируют молочную и другие кислоты, а также витамины В и К.
На 6 день формируется зрелая зубная бляшка, которая в основном состоит из анаэробных палочек и актиномицет.
Находясь в биоплёнке, бактерии начинают работать сообща. Колонии в микробиоценозе окружены защитным матриксом, который пронизан каналами и по своей сути является теми самыми транспортными путями, про которые говорилось выше. По этим путям циркулируют не только питательные вещества, но и продукты жизнедеятельности, ферменты, метаболиты и кислород.
Микроорганизмы в биоплёнке связаны между собой не только благодаря каркасу - актиномицетам, но и посредством межклеточных взаимодействий. Благодаря своей общности, бактерии становятся более устойчивыми к антибиотикам и защитным системам организма, начинают синтезировать несвойственные им вещества и приобретать новые формы для поддержания устойчивости биоплёнки.
В многоклеточном организме слаженность поведения клеток обеспечивается специальными системами управления (например, нервной системой). В группе отдельных самостоятельных организмов таких централизованных систем управления нет, поэтому согласованность действий обеспечивается иными способами, в том числе при помощи чувства кворума (ЧК) - способности бактерий в биоплёнках координировать своё поведение за счет секреции молекулярных сигналов.
Впервые ЧК было описано у морской бактерии Photobacterium fisheri. ЧК основано на сигнальном механизме, который осуществляется с помощью выделения бактериями при высокой плотности популяции специфических химических веществ, взаимодействующих с рецепторными регуляторными белками. Системы ЧК оценивают не только плотность популяции, но и другие параметры внешней среды посредством соответствующих генных регуляторов. ЧК играет ключевую роль в регуляции многих метаболических процессов у микроорганизмов (биолюминисценции у морских бактерий, стимуляции роста стрептококков, синтеза антибиотиков и др).
Некоторые недавние исследования показали, что в дополнение к традиционным системам коммуникации клетка-к-клетке, таким как чувство кворума, бактерия может использовать для коммуникации поток электронов. Внутри сообществ бактериальных биоплёнок ионные каналы проводят электрические сигналы большой дальности благодаря пространственно распределяющимся волнам калия, который деполяризует соседние клетки. Распространяясь через биопленку, эта волна деполяризации координирует метаболические состояния среди клеток внутри и на периферии биоплёнки.
Эта форма электрической коммуникации таким образом может усиливать метаболическую созависимость широкого радиуса в биоплёнках. Интересно, что из-за быстрой диффузии ионов калия в водной среде возможно, что даже физически разъединённые биоплёнки могут быть способны синхронизировать их метаболические колебания путем сходного обмена ионами калия.
Подробнее об этом механизме и о чувстве кворума можно прочитать по ссылкам в источниках.
20.19. Микрофлора полости рта и ее роль в патологии человека
Микрофлора полости рта. Полость рта является благоприятной средой обитания для многих видов микроорганизмов. В ней имеется достаточное количество питательных веществ, стабильная оптимальная температура, слабощелочная реакция, постоянная влажность, что создает условия для адгезии, колонизации и размножения микроорганизмов. Микрофлора полости рта — это сложный динамичный биоценоз постоянных и изменяющихся популяций, который сложился эво-люционно в результате взаимодействия множества эндогенных и экзогенных факторов,
обусловленных влиянием внешней среды и состоянием макроорганизма.
У новорожденного в полости рта встречаются микроорганизмы, которые попали туда из родовых путей матери. В первые недели жизни полость рта у детей заселяют разные микробы, поступающие из окружающей среды и пищевых продуктов; среди них преобладают лактобактерии, грибы рода Candida, нейссерии, стрептококки. Появление зубов, создавая условия для размножения анаэробов в промежутках между зубами и у шейки зубов, приводит к смене качественного и количественного состава микрофлоры полости рта. Далее этот состав меняется по мере развития организма, изменений в эндокринной, иммунной системах, ввиду особенностей питания. В полости рта взрослого человека обнаруживают примерно 160 видов микроорганизмов. В основном они находятся на зубах, слизистой оболочке, в межзубных промежутках, в слюне, кариозных полостях, у шейки зубов, на спинке языка и в других участках полости рта, малодоступных обмыванию слюной (в слюне — до 10 9 микроорганизмов в 1 мл, в десневых карманах — в 100 раз больше). Среди них различают аутохтонные (индиген-ные), специфичные для полости рта постоянные виды, и аллохтонные, которые попадают из других частей организма и окружающей среды вместе с пищей, водой и воздухом.
Существенное влияние на состав микрофлоры полости рта оказывают: состояние защитных сил организма, взаимодействия внутри микробиоценозов, действие ряда факторов внешней и внутренней среды (антибиотиков, гормонов, токсических веществ и пр.). Многие микроорганизмы погибают под действием неспецифических и специфических факторов антиинфекционной защиты — лизоцима, секреторных иммуноглобулинов А, содержащихся в слюне и мокроте, фагоцитоза и др. Нередко сочетание неблагоприятных факторов приводит к развитию дис-бактериоза (дисмикробиоза) — изменению относительно стабильного количественного и качественного состава микробиоценоза этого биотопа организма. При ослаблении защитных сил организма представители нормальной микрофлоры (особенно факультативной)
способны вызывать эндогенную инфекцию, которая в случае глубокого иммунодефицита может иметь летальный исход. Многие представители аутохтонной микрофлоры полости рта имеют морфологическое сходство с возбудителями сифилиса, дифтерии, менинго-кокковой инфекции, пневмоний и др., что затрудняет микробиологическую диагностику соответствующих заболеваний.
Видовой состав микрофлоры полости рта представлен аэробными и анаэробными микроорганизмами.
Основную массу микроорганизмов ротовой полости составляют грамположительные и грамотрицательные бактерии, аэробные и анаэробные, кокки и аспорогенные палочки, актиномицеты, спирохеты, микоплазмы. Большую часть грамположительных кокков составляют стрептококки, грамположительных палочек — лактобактерии, грамот-рицательных палочек — строгие анаэробы (бактероиды, превотеллы, порфиромонады), нитевидные лептотрихии и веретенообразные фузобактерии (из факультативных анаэробов — гемофилы). Отмечается наличие ак-тиномицетов, спирохет (непатогенные тре-понемы, лептоспиры и боррелии), а также простейших. Многие из них обладают патогенным потенциалом и могут принимать участие в развитии заболеваний полости рта.
Кокки в ротовой полости, в основном, представлены зеленящими стрептококками (Streptococcus salivarius, S. sanguis, S. mutans, S. milleri, S. mitis). Это группа условно-патогенных и непатогенных кокков, которые расщепляют разные углеводы с образованием молочной и других органических кислот. Стрептококки вида S. salivarius, которые постоянно присутствуют в полости рта, вырабатывают из глюкозы нерастворимый в воде биополимер (декстрин), который способствует прикреплению бактерий к поверхности зуба и образованию зубных бляшек. S. mitis преимущественно накапливается в щелях между деснами и поверхностью зуба, a E.faecalis — в десневых бороздках.
В полости рта находятся также пептостреп-тококки (Peptostreptococcus asaccharolyticus и др.), которые обнаруживаются преимущественно при разных местных патологических процессах, в ассоциациях с фузобактериями
и спирохетами; особенно много их в десневых бороздках. Эти бактерии активно разлагают пептоны и аминокислоты и слабо действуют на углеводы.
Грамотрицательные анаэробные кокки из рода Veillonella постоянно обитают в полости рта. Они принимают участие в образовании зубного налета, но могут оказывать и противо-кариозное действие. Это обусловлено способностью вейлонелл расщеплять лактат, пируват ацетат и другие продукты обмена углеводов до углекислого газа и воды, что уменьшает закисленность среды и, следовательно, препятствует деминерализации тканей зуба.
Палочковидные грамположительные и грамотрицательные бактерии, в основном, представлены родами Lactobacillus, Bacteroides, Prevotella, Porphyromonas, Fusobacterium.
Лактобактерии (L. acidophilus, L. brevis, L.fermentum) участвуют в обеспечении колонизационной резистентности, оказывают антагонистическое действие на различные патогенные микроорганизмы, блокируя рецепторы эпителиоцитов. Однако при расщеплении углеводов лактобактерии образуют большое количество молочной кислоты, которая способствует развитию кариеса зубов.
Бактероиды (В. fragilis), превотеллы (P. melaninogenica), порфиромонады (P. gingivalis) — строгие анаэробы, они расщепляют глюкозу с образованием смеси кислот, продуцируют коллагеназу, фибролизин, гиалуронидазу и другие протеолитические ферменты. P. melaninogenica постоянно присутствует в десневых карманах у взрослых, вызывает заболевания пародонта.
Фузобактерии (F. periodonticum, F. nucleatum) являются представителями аутохтонной (постоянной) микрофлоры полости рта. Они могут образовывать из пептона и глюкозы молочную кислоту. Часто обнаруживаются вместе со спирохетами.
Из спирохет в полости рта больше всего трепонем (Т. denticola, T. vincentii и др.), они обнаруживаются в десневых карманах. В ассоциации с фузобактериями и некоторыми бактероидами они могут вызывать язвенно-некротический гингивостоматит Венсана.
Актиномицеты (Actinomyces viscosus, Actinomyces israelii) и актинобациллы
(Actinobacillus spp.) постоянно присутствуют на слизистой оболочке полости рта, принимают участие в образовании зубного налета и зубного камня. Вместе с другими микроорганизмами могут обуславливать развитие кариеса зубов и заболевания пародонта.
В составе микрофлоры полости рта также присутствуют лептотрихии, пропионибакте-рии, коринебактерии, микоплазмы, простейшие и другие микроорганизмы, количество которых увеличивается при различных заболеваниях зубов и пародонта.
Зубной налет. В биохимических процессах, которые происходят в эмали, особенно важное значение имеет структура мягкого зубного налета — пелликулы. В норме зубной налет имеет около 80% воды, связанной с белком, 20% гликопротеидов, 1—2% декстрина, кальций, фосфор, калий, натрий, фтор, фосфата-зы, протеазы, коллагеназы, гиалуронидазу и другие ферменты, в основном бактериального происхождения. Колонии разных видов микроорганизмов, которые составляют основную массу пелликулы заключены в органический матрикс, состоящий из гликопротеидов слюны, белков и из внеклеточных микробных полисахаридов. Самое большое число микробных видов регистрируется спустя сутки после образования налета. В первые часы образования налета в нем обнаруживаются преимущественно аэробные виды микроорганизмов, затем — аэробные и анаэробные виды: различные виды стрептококков, лакто-бактерии, стафилококки, грибы, дифтероиды, пептострептококки. вейлонеллы, нейссерии.
Зубные бляшки — это органический матрикс, состоящий из скопления бактерий, полисахаридов и белков, который прочно прикреплен к поверхности зуба. Первой стадией образования зубной бляшки считают формирование пелликулы. Процесс адгезии разных микроорганизмов (кокки, палочковидные, спирохеты) происходит в течение нескольких часов, количество бактериальных клеток быстро увеличивается, они образуют скопления — «кукурузные початки». В первой стадии образования зубной бляшки превалируют аэробные микроорганизмы (стрептококки, коринебактерии, актиномицеты), которые создают условия для развития строгих анаэробов.
При минерализации зубной бляшки образуется зубной камень. При этом уменьшается число аэробных представителей, исчезают лактобактерии.
Таким образом, образование зубного налета и зубных бляшек — сложный динамичный процесс, в котором микроорганизмы играют ведущую роль.
Микробная флора полости рта и её роль в развитии патологических процессов.
Микрофлора полости рта.Полость рта является благоприятной средой обитания для многих видов микроорганизмов. В ней имеется достаточное количество питательных веществ, стабильная оптимальная температура, слабощелочная реакция, постоянная влажность, что создает условия для адгезии, колонизации и размножения микроорганизмов. Микрофлора полости рта — это сложный динамичный биоценоз постоянных и изменяющихся популяций, который сложился эво-люционно в результате взаимодействия множества эндогенных и экзогенных факторов,обусловленных влиянием внешней среды и состоянием макроорганизма.
У новорожденного в полости рта встречаются микроорганизмы, которые попали туда из родовых путей матери. В первые недели жизни полость рта у детей заселяют разные микробы, поступающие из окружающей среды и пищевых продуктов; среди них преобладают лактобактерии, грибы рода Candida, нейссерии, стрептококки. Появление зубов, создавая условия для размножения анаэробов в промежутках между зубами и у шейки зубов, приводит к смене качественного и количественного состава микрофлоры полости рта. Существенное влияние на состав микрофлоры полости рта оказывают: состояние защитных сил организма, взаимодействия внутри микробиоценозов, действие ряда факторов внешней и внутренней среды (антибиотиков, гормонов, токсических веществ и пр.). Многие микроорганизмы погибают под действием неспецифических и специфических факторов антиинфекционной защиты — лизоцима, секреторных иммуноглобулинов А, содержащихся в слюне и мокроте, фагоцитоза и др.
Видовой состав микрофлоры полости рта представлен аэробными и анаэробными микроорганизмами.
Основную массу микроорганизмов ротовой полостисоставляют грамположительные и грамотрицательные бактерии, аэробные и анаэробные, кокки и аспорогенные палочки, актиномицеты, спирохеты, микоплазмы. Большую часть грамположительных кокков составляют стрептококки, грамположительных палочек —лактобактерии, грамот-рицательных палочек — строгие анаэробы(бактероиды, превотеллы, порфиромонады), нитевидныелептотрихии и веретенообразныефузобактерии (из факультативных анаэробов —гемофилы). Отмечается наличие актиномицетов, спирохет (непатогенные тре-понемы, лептоспиры и боррелии), а также простейших. Многие из них обладают патогенным потенциалом и могут принимать участие в развитии заболеваний полости рта.
Кокки в ротовой полости, в основном, представлены зеленящими стрептококками (Streptococcus salivarius, S. sanguis, S. mutans, S. milleri, S. mitis). Это группа условно-патогенных и непатогенных кокков, которые расщепляют разные углеводы с образованием молочной и других органических кислот. Стрептококки видаS. salivarius, которые постоянно присутствуют в полости рта, вырабатывают из глюкозы нерастворимый в воде биополимер (декстрин), который способствует прикреплению бактерий к поверхности зуба и образованию зубных бляшек.S. mitis преимущественно накапливается в щелях между деснами и поверхностью зуба,aE.faecalis — в десневых бороздках.
В полости рта находятся также пептостреп-тококки (Peptostreptococcus asaccharolyticus и др.), которые обнаруживаются преимущественно при разных местных патологических процессах, в ассоциациях с фузобактериями
Грамотрицательные анаэробные кокки из рода Veillonella постоянно обитают в полости рта. Они принимают участие в образовании зубного налета, но могут оказывать и противо-кариозное действие.
Лактобактерии (L. acidophilus, L. brevis, L.fermentum) участвуют в обеспечении колонизационной резистентности, оказывают антагонистическое действие на различные патогенные микроорганизмы, блокируя рецепторы эпителиоцитов. Однако при расщеплении углеводов лактобактерии образуют большое количество молочной кислоты, которая способствует развитию кариеса зубов.
Бактероиды (В. fragilis), превотеллы(P. melaninogenica), порфиромонады(P. gingivalis) — строгие анаэробы, они расщепляют глюкозу с образованием смеси кислот, продуцируют коллагеназу, фибролизин, гиалуронидазу и другие протеолитические ферменты.P. melaninogenica постоянно присутствует в десневых карманах у взрослых, вызывает заболевания пародонта.
Фузобактерии (F. periodonticum, F. nucleatum) являются представителями аутохтонной (постоянной) микрофлоры полости рта. Они могут образовывать из пептона и глюкозы молочную кислоту. Часто обнаруживаются вместе со спирохетами.
Из спирохет в полости рта больше всего трепонем (Т. denticola, T. vincentii и др.), они обнаруживаются в десневых карманах. В ассоциации с фузобактериями и некоторыми бактероидами они могут вызывать язвенно-некротический гингивостоматит Венсана.
Актиномицеты (Actinomyces viscosus, Actinomyces israelii) и актинобациллы
(Actinobacillus spp.) постоянно присутствуют на слизистой оболочке полости рта, принимают участие в образовании зубного налета и зубного камня. Вместе с другими микроорганизмами могут обуславливать развитие кариеса зубов и заболевания пародонта.
В составе микрофлоры полости рта также присутствуют лептотрихии, пропионибакте-рии, коринебактерии, микоплазмы, простейшие и другие микроорганизмы, количество которых увеличивается при различных заболеваниях зубов и Доящий из скопления бактерий, полисахаридов и белков, который прочно прикреплен к поверхности зуба. Первой стадией образования зубной бляшки считают формирование пелликулы. Процесс адгезии разных микроорганизмов (кокки, палочковидные, спирохеты) происходит в течение нескольких часов, количество бактериальных клеток быстро увеличивается, они образуют скопления — «кукурузные початки». В первой стадии образования зубной бляшки превалируют аэробные микроорганизмы (стрептококки, коринебактерии, актиномицеты), которые создают условия для развития строгих анаэробов.
Обзор остеопороза, пародонтита и дисбактериоза полости рта: новая роль микробиоты полости рта
Роль микробиоты полости рта в двунаправленной взаимосвязи между остеопорозом и пародонтитом
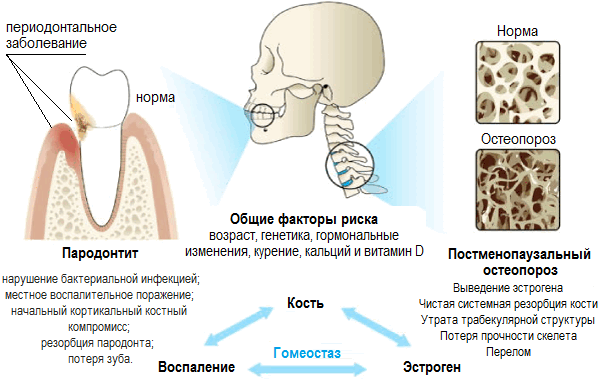
Схематическая иллюстрация связи между пародонтитом и остеопорозом. На диаграмме показана костная мишень для заболеваний пародонта (альвеолярная кортикальная кость) и остеопороза (трабекулярная кость). Также перечислены общие факторы риска и потенциальные механизмы, лежащие в основе обоих заболеваний.
Аннотация
1. Вступление
Многочисленные системные состояния и заболевания могут быть связаны со здоровьем полости рта или влиять на него. От синдромных расстройств с оральными проявлениями [1,2,3,4] до системных заболеваний с вовлечением полости рта [5,6,7] или заболеваний полости рта с внеротовыми эффектами и корреляциями [8,9,10,11,12], здоровье полости рта - это состояние, часто связанное с общим самочувствием.
Настоящая работа направлена на обзор двунаправленных взаимосвязей между остеопорозом и здоровьем полости рта, с акцентом на новые результаты исследования микробиома полости рта и на возникающее участие дисбиоза полости рта в возникновении этого системного заболевания костей.
2. Остеопороз.
Остеопороз ( ОП ) - распространенное системное заболевание костей, при котором генерализованная и прогрессирующая потеря минеральной плотности костной ткани (МПК или англ. BMD ) увеличивает хрупкость костей и склонность к переломам, что может произойти во время повседневной деятельности или при незначительной травме [13,14].
ОП более распространен среди пожилых женщин (ОП в постменопаузе), у которых пониженный уровень эстрогена [15,16], связанный с окислительным стрессом [16,17], ответственен за потерю BMD [18]; тем не менее, он также встречается у мужчин [19] старше 65 лет в связи с использованием пероральных глюкокортикоидов, андрогенной депривационной терапии при раке простаты и различных системных заболеваниях (хронические заболевания печени, инсульт в анамнезе, курение и употребление алкоголя, гиперпаратиреоз и / или гипертиреоз) [20].
ОП может предшествовать остеопения, которая является менее тяжелым состоянием потери BMD, чем ОП, и связана с более низким риском переломов костей, чем у пациентов с ОП [21].
Согласно Sozen et al. [22], во всем мире каждая третья женщина и каждый пятый мужчина в возрасте старше 50 лет страдают остеопоротическим переломом в течение своей жизни [23], и самые последние отчеты Национального фонда остеопороза США [24] подтвердили распространенность 10,2 миллиона американцев старше 50 лет с остеопорозом и 43,4 миллиона пожилых людей с низкой минеральной плотностью костной ткани (BMD); в Европе Международный фонд остеопороза [25] оценил 22 миллиона женщин и 5,5 миллиона мужчин с остеопорозом и 3,5 миллиона человек с новыми хрупкими переломами, в то время как распространенность ОП в азиатских странах колеблется от 35,2% до 25,1% среди пожилых женщин и считается выше, чем у женщин европеоидной расы (10,8%) [26].
3. Пародонтит.
ОП может повлиять на любую кость в теле и, следовательно, на челюсти, что приводит к истончению кортикального слоя, увеличивающемуся с возрастом [27].
Истончение костей и снижение BMD челюстей - не единственные ассоциации между ОП и здоровьем полости рта, но сообщалось о нескольких взаимосвязях между ОП и заболеваниями полости рта, в основном в отношении ОП и заболеваний пародонта, а также ОП и дисбактериоза полости рта.
Среди заболеваний пародонта пародонтит ( ПД ) представляет собой хроническое воспалительное заболевание, вызванное бактериями, ответственное за прогрессирующее и необратимое разрушение и потерю соединительных тканей пародонта и резорбцию альвеолярной кости, что приводит к потере зубов у взрослых старше 50 лет [28,29].
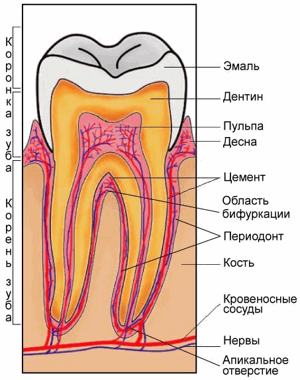
Примечание редактора: Пародонт - комплекс тканей, окружающих зуб и удерживающих его в альвеоле , имеющих общее происхождение и функции. Его составляющими являются дёсны, периодонт , цемент зуба, надкостницу и альвеолярные отростки . Ткани пародонта снабжает артериальной кровью челюстная артерия, ветвь наружной сонной артерии. Пародонт иннервируют средняя и нижняя ветви тройничного нерва, в связи с большим количеством рецепторов он является обширной рефлексогенной зоной. Пародонт составляет так называемый опорно-удерживающий аппарат зубов.
Этиология пародонтита подтверждается генетическими факторами и факторами окружающей среды [30,31], и бактерии, ответственные за запуск чрезмерной воспалительной реакции хозяина, исторически были идентифицированы как грамотрицательные / факультативные анаэробные бактерии (в основном Treponema denticola и Porphyromonas gingivalis), которые колонизируют десневой карман предрасположенных субъектов [32]. В этом месте высвобождение ряда провоспалительных цитокинов усиливает локальное воспаление, которое сохраняется и приводит к прогрессирующему разрушению структур периодонта, таких как пародонтальные соединительные связки и альвеолярные кости [15,33].
4. Остеопороз и пародонтит
ПД разделяет многие факторы риска с ОП, такие как возраст, курение и/или потребление алкоголя, индекс массы тела (ИМТ) и менопауза [34,35]. Остеопоротические женщины, по сути, демонстрируют большую тяжесть ПД, чем женщины без ОП, и эти две патологии вместе значительно влияют на качество жизни испытуемых [36].
Недавно Сюй и др. [37] проанализировали ассоциации между ОП и риском развития ПД с помощью метаанализа, чтобы установить, является ли ОП локальным показателем потери костной массы или зависит от причин ПД или связан с ними: было обнаружено, что ОП тесно связан с повышенным риском развития ПД. Кроме того, женщины с ОП представляют более высокий риск развития ПД, чем мужчины, и, независимо от пола, пациенты с ОП имеют в два раза более высокий риск развития ПД [38]. Однако основополагающие механизмы все еще остаются неопределенными [37].
Возникло множество гипотез, объясняющих, как ОП может ускорить резорбцию альвеолярной кости при ПД: (1) потеря минеральной плотности костной ткани на уровне альвеолярных костей может способствовать более глубокому проникновению бактерий в увеличенное пародонтальное пространство и, в замкнутом круге, локальное воспаление, может усиливать и ускорять резорбцию альвеол [27,39]; (2) сверхэкспрессия провоспалительных цитокинов с остеокластической активностью характерна как для ОП, так и для ПД [40,41,42]; (3) некоторые факторы риска, такие как курение, диабет и уровни гормонов, ответственны как за ОП, так и за ПД [39] (рис. 1).
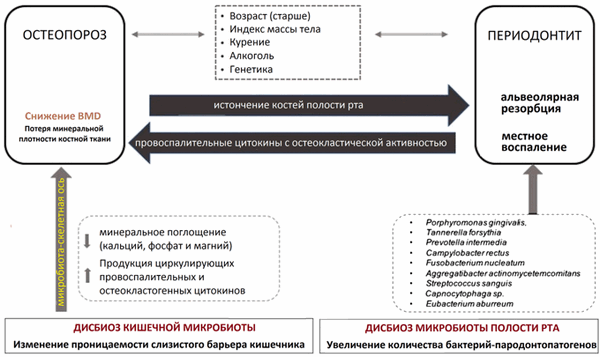
Рисунок 1. Двунаправленная взаимосвязь между остеопорозом (ОП) и пародонтитом (ПД). У них есть ряд общих факторов риска. Потеря минеральной плотности кости (BMD), связанная с ОП, может быть ответственной за увеличение резорбции альвеолярной кости при ПД, и, наоборот, местное воспаление, характерное для ПД, может активировать системные остеокластические цитокины, ответственные за дальнейшее снижение BMD. В этом сценарии роль дисбактериоза кишечника и полости рта может усилить и / или вызвать эти события, что приведет к ухудшению как патологий, так и здорового состояния пострадавших субъектов. BMD , минеральная плотность костной ткани.
5. Пародонтит и остеопороз.
Напротив, в других исследованиях считалось, что ПД и его пародонтопатогенные бактерии могут прямо или косвенно способствовать возникновению ОП, которое является хроническим воспалительным состоянием, ответственным за активацию остеокластов не только на уровне участков полости рта [39], но и в других местах, так как продемонстрированы при различных системных заболеваниях и состояниях, вызванных и / или усугубляемых наличием ПД, таких как ревматоидный артрит [43], сердечно-сосудистые заболевания [11,44,45] и нейродегенеративные заболевания, такие как болезнь Паркинсона [46] и болезнь Альцгеймера [47, 48].
6. Микробиом, дисбактериоз и остеопороз.

В последние годы было добавлено еще несколько частей к загадке связи между ОП и здоровьем полости рта из исследований микробиома и его связи с метаболизмом костей: после завершения картирования генома человека для определения последовательности и идентификации всех человеческих генов [49], исследования начали сосредотачиваться на картировании микробиома человека и связанной с ним микробиоты [50]. По определению, микробиота человека - это совокупность всех микроорганизмов, включая эукариот, архей, бактерий и вирусов, живущих вместе с человеческим телом в определенных экологических нишах, тогда как термин «микробиом» относится ко всему их генетическому материалу [51,52,53].
Самая богатая и наиболее изученная ниша человека - это кишечная среда, на которую приходится 95% всех микроорганизмов, присутствующих на теле человека и в нем, но также были идентифицированы и другие среды, такие как нос, глаза, желудок, гениталии, кожа и рот [54].
Обнаружение различий в бактериальном составе полости рта при нездоровом состоянии, также известном как дисбактериоз полости рта, все чаще открывает новые сценарии в изучении механизмов, лежащих в основе ОП.
Первое исследование микробиома ротовой полости человека было опубликовано в 2010 году [55], и из более чем 600 видов, идентифицированных с помощью культурных и некультуральных методов, 169, по-видимому, являются местными для ротовой полости (так называемый «основной микробиом полости рта»), расположенные в физиологических условиях, по количеству и качеству в трех различных экологических нишах / внутриротовых средах обитания, классифицируемых как: группа 1, слизистая оболочка щек, ороговевшая десна и твердое небо; группа 2: слюна, язык, миндалины и горло (задняя стенка ротоглотки); и группа 3, суб- и наддесневой налет [56,57].
6.1. Кишечный Микробиом / Микробиота и Остеопороз
Недавно Xu et al. [13] выявили и охарактеризовали специфическое изменение кишечной микробиоты больных ОП, заключающееся в увеличении общего количества кишечных бактерий, с преобладанием Bacteroidetes над Firmicutes в группе ОП, сообщив таким образом характерный отпечаток состава кишечных бактерий, ассоциированных с ОП (тип Bacteroidetes, семейство Prevotellaceae, семейство Ruminococcaceae, род Faecalibacterium и род Dialister). Кроме того, Das et al. обнаружили большее обилие Actinomyces, Eggerthella и Clostridium кластера XlVa у испытуемых ОП по сравнению с контрольной группой [23].
Данные о том, что пути, проходящие через кишечную микробиоту, могут влиять на метаболизм костной ткани и ее гомеостаз, приводят к гипотезе о существовании «микробиота-скелетной» оси [58,59] (Рис.1). Согласно ряду исследований, кишечная микробиота способна:
- Влиять на усвоение минеральных веществ (кальция, фосфата и магния) [60];
- Вмешиваться в иммунную систему (через выработку провоспалительных и остеокластогенных циркулирующих цитокинов, которые могут направлять резорбцию кости при воспалительных состояниях [23,60];
- Регулировать синтез серотонина и других нейромедиаторов, участвующих в метаболизме костной ткани [58,59].
Кроме того, в состоянии дисбактериоза слизистый барьер кишечника более проницаем, и обилие бактериального эндотоксина липополисахарида (ЛПС) также легко увеличивается в сыворотке крови, способствуя эндотоксемии и остеокластической активности, что негативно влияет на минеральную плотность костной ткани ( BMD ) [58,59].
6.2. Микробиом полости рта / микробиота и остеопороз
Одно из первых исследований о корреляции между бактериями полости рта и ОП было проведено Liang et al., которые в 2013 году сообщили о статистически значимом снижении бактериальной слизистой оболочки полости рта у женщин с ОП по сравнению с женщинами без ОП [61].
Пять лет спустя, в 2018 году, Banack et al. [62] опубликовали результаты 15-летнего проспективного когортного исследования под названием «OsteoPerio Study», чтобы изучить факторы риска развития и прогрессирования ОП и ПД у женщин в постменопаузе и подчеркнуть взаимосвязь между микробиотой полости рта и здоровьем полости рта и системного здоровья у женщин в постменопаузе. Результаты исследования подтвердили, что: (1) у женщин с ОП почти в два раза выше риск оральной потери BMDпо сравнению с женщинами без ОП; (2) системная и оральная потеря BMD была выше у пожилых женщин; (3) тяжесть ПД была обратно связана с BMD. Кроме того, те же авторы обнаружили у пациентов с ПД сильную положительную связь между конкретными оральными пародонтопатогенными бактериями (Porphyromonas gingivalis, Tannerella forsythia, Prevotella intermedia и Campylobacter rectus) и серьезной потерей костной массы полости рта. Аналогичным образом Brennan et al. [63] проверили связь между наличием бактериальной инфекции полости рта и потерей костной массы полости рта у 1256 женщин в постменопаузе, сообщив, что восемь видов поддесневых бактерий в основном связаны с тяжелой потерей костной массы полости рта: Streptococcus sanguis, Prevotella intermedia, Tannerella forsythensis, Capnocytophaga sp., Eubacterium saburreum, Campylobacter rectus, Porphyromonas gingivalis и Fusobacterium nucleatum. Напротив, Эрнандес-Вигерас и др. [27], которые также провели наблюдательное перекрестное исследование для профилирования микробиоты полости рта женщин в постменопаузе с ОП и без ОП, обнаружили, что почти 79% женщин с ПД также страдали ОП, но не было обнаружено статистически значимых различий в количестве и качестве исследованных пародонтопатогенных бактерий (Fusobacterium nucleatum, Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Campylobacter rectus и Tannerella forsythia) (рис. 1).
В последние годы важность здоровья полости рта для общего благополучия все чаще подтверждается научными данными, выясняющими, как инфекции и дисбактериоз полости рта способствуют возникновению или ухудшению различных типов системных заболеваний.
В свете этих результатов было показано, что патогенные бактерии пародонта, а также дисбактериоз кишечника также участвуют в детерминизме потери BMD, активно способствуя возникновению и ухудшению ОП (рис. 1).
Эти данные вдохновили на исследования по модуляции микробиоты для восстановления здоровья с помощью пребиотиков и пробиотиков. В частности, было показано, что ряд неперевариваемых хозяином пищевых соединений (пребиотики, такие как галактоолигосахариды, инулин и резистентный крахмал) участвуют в пищеварительных процессах, обеспечивая питание здоровых кишечных бактерий и тем самым способствуя абсорбции минералов энтероцитами [59, 64]. Более того, среди живых микроорганизмов, которые положительно влияют на здоровье костей, действуя на пищеварительном уровне и известных как «пробиотики», Lactobacillus sp. (в основном L. reuteri, L. casei, L. rhamnosus и L. salivarius) и бифидобактерии, по-видимому, значительно снижают остеокластогенез и останавливают резорбцию костей [59,65].
В последнее время появились также многообещающие результаты по использованию пребиотиков и пробиотиков для восстановления дисбактериоза полости рта [66,67] и в качестве вспомогательных терапевтических средств к лечению пародонта [68]. Пребиотики способствуют питанию полезных бактерий, тем самым способствуя восстановлению сбалансированной и здоровой микробиоты полости рта [69,70].
Исходя из этого, мы можем посоветовать стоматологам не недооценивать проблему ОП, когда они сталкиваются с женщиной в постменопаузе с признаками и диагнозом ПД или без них, а поощрять более глубокое изучение дисбактериоза полости рта и восстановление его микробного равновесия за счет использования пищевых продуктов с соответствующими и полезными бактериями. Например, Rosier et al. [71] сообщили о влиянии нитрата в качестве пребиотика на изменение состава микробиома полости рта за счет значительного уменьшения количества пародонтопатогенных бактерий, таких как Porphyromonas, Fusobacterium, Leptotrichia и Prevotella. Другие исследования также сообщили о преимуществах использования пробиотиков: от использования Lactobacillus sp. в дополнение к нехирургической пародонтальной терапии [72], к ее принятию для улучшения состояния пародонта [73], она приводит к снижению потребности в антибиотиках [74] и к безопасной и эффективной поддержке традиционных механических методов лечения при лечении ПД, что положительно сказывается как на здоровье полости рта, так и на его системных последствиях [75,76]. Еще одним широко изученным пробиотическим комменсалом является Streptococcus sp. и механизмы, с помощью которых он способен смягчать пародонтопатогенную активность Porphyromonas gingivalis. Hanel et al. [77] исследовали конкурентную адгезию Streptococci sp. к эпителиальным клеткам полости рта как ответственным за снижение инвазивности Porphyromonas gingivalis, тогда как Ohshima et al. [78], определили способность Streptococcus gordonii смягчать и модулировать воспалительную передачу сигналов, запускаемую Porphyromonas gingivalis, в то время как Ho et al. [79] идентифицировали способность Streptococcus cristatus изменять экспрессию вирулентных генов Porphyromonas gingivalis.
Читайте также:
- Синдром тромботической тромбоцитопенической пурпуры (ТТП-синдром)
- Стремя. Сочленения между слуховыми косточками
- Механизмы формирования лекарственной устойчивости у бактерий. Ферментативная инактивация лекарственных средств ( лс ). Лактамазы. Ацетилтрансферазы, фосфорилазы, нуклеотидазы бактерий.
- Обсуждение применения трансплантатов при лечении вращательной манжеты плечевого сустава
- Инородное тело наружного слухового прохода и его лечение
