Глюкокортикоидчувствительный гиперальдостеронизм - причины, клиника, диагностика
Добавил пользователь Дмитрий К. Обновлено: 09.01.2026
Что такое гиперальдостеронизм? Причины возникновения, диагностику и методы лечения разберем в статье доктора Матвеева М. А., эндокринолога со стажем в 11 лет.
Над статьей доктора Матвеева М. А. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Гиперальдостеронизм — это синдром, при котором кора надпочечников вырабатывает повышенное количество гормона альдостерона. Он сопровождается развитием артериальной гипертензии и поражением сердечно-сосудистой системы [1] . Нередко артериальная гипертензия, развившаяся на фоне повышенного уровня альдостерона, носит злокачественный характер: крайне плохо поддаётся медикаментозной коррекции и приводит к ранним и серьёзным осложнениям, таким как ранний инсульт, инфаркт миокарда, фибрилляция предсердий, внезапная сердечная смерть и др.
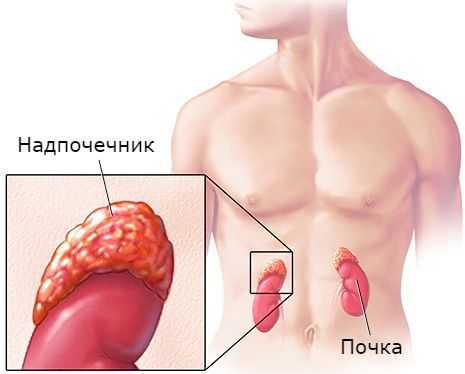
Гиперальдостеронизм является одной из самых частых причин артериальной гипертензии. По некоторым данным, он выявляется в 15-20 % всех случаев [5] .
В силу стёртой клинической картины данный синдром диагностируется редко. Однако его выявление имеет огромное значение как из-за своей распространённости, так и в связи с возможным своевременным лечением причины артериальной гипертензии и предотвращением тяжёлых сердечно-сосудистых осложнений, улучшая прогноз и качество жизни пациентов.
Кора надпочечников выделяет большое количество альдостерона либо автономно, либо в ответ на стимулы вне надпочечников.
Причинами автономной секреции альдостерона являются заболевания надпочечников:
- аденома (доброкачественная опухоль) надпочечника, продуцирующая альдостерон (синдром Крона);
- двусторонний идиопатический гиперальдостеронизм (точна причина неизвестна);
- односторонняя гиперплазия надпочечника (развивается в результате микро- или макронодулярного разрастания клубочковой зоны коры одного надпочечника);
- семейный гиперальдостеронизм (наследственное заболевание, встречается крайне редко);
- карцинома (злокачественная опухоль) надпочечника, вырабатывающая альдостерон.
Самой частой причиной гиперальдостеронизма является аденома (обычно односторонняя), состоящая из клеток клубочковой зоны. У детей аденомы встречаются редко. Как правило, это состояние у них вызвано раком или гиперплазией (разрастанием) одного надпочечника. У пожилых пациентов аденома встречается реже. Она связана с двусторонней гиперплазией надпочечников [4] [10] .
Вненадпочечниковыми причинами синдрома являются:
- стеноз (сужение) почечной артерии, приводящий к снижению почечного кровотока и, как следствие, гиперсекреции альдостерона;
- почечная вазоконстрикция (сужение любых сосудов почки), в том числе из-за опухолевого процесса;
- застойная сердечная недостаточность, цирроз печени с асцитом (скоплением жидкости в брюшной полости) и др., т. е. состояния, которые приводят к повышению альдостерона за счёт снижения печеночного кровотока и скорости метаболизма альдостерона [10] .
Крайне редко возможно развитие псевдогиперальдостеронизма — артериальной гипертензии и низкого уровня калия в крови, имитирующих симптомы гиперальдостеронизма. Причиной тому является существенная передозировка солодки или жевательного табака, которые влияют на метаболизм гормонов в надпочечниках.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гиперальдостеронизма
Клинические проявления гиперальдостеронизма чаще встречаются в возрасте 30-50 лет, однако описаны случаи выявления синдрома и в детском возрасте [1] .
Основным и постоянным симптомом гиперальдостеронизма является артериальная гипертензия. В 10-15 % она носит злокачественный характер [3] . Клинически гипертония проявляется головокружением, головными болями, мельканием "мушек" перед глазами, перебоями в работе сердца, в особо тяжёлых случаях — даже временной потерей зрения. Систолическое артериальное давление достигает 200-240 мм рт. ст.
Обычно гипертония при данном синдроме устойчива к препаратам, нормализующим давление. Однако этот признак гиперальдостеронизма далеко не всегда становится определяющим, поэтому его отсутствие не исключает диагноз и может привести к диагностической ошибке. Течение артериальной гипертензии при наличии синдрома может быть умеренным и даже мягким, поддающимся коррекции небольшими дозами препаратов. В редких случаях артериальная гипертензия носит кризовый характер, что требует дифференциальной диагностики и тщательного клинического разбора.
Второй признак гиперальдостеронизма — нейромышечный синдром. Он встречается довольно часто. Его основные проявления включают мышечную слабость, судороги, ползанье "мурашек" по ногам, особенно в ночные часы. В тяжёлых случаях могут быть временные параличи, которые внезапно начинаются и исчезают. Они могут длиться от нескольких минут до суток [3] [4] .
Третий признак гиперальдостеронизма, встречающийся не менее чем в 50-70 % случаев, — почечный синдром. Он представлен, как правило, невыраженной жаждой и учащённым мочеиспусканием (часто в ночное время).
Выраженность всех вышеперечисленных проявлений напрямую связана с концентрацией альдостерона: чем выше уровень этого гормона, тем выраженнее и тяжелее проявления гиперальдостеронизма.
Патогенез гиперальдостеронизма
Надпочечники — это парные эндокринные железы, расположенные над верхними полюсами почек. Они являются жизненно необходимой структурой. Так, удаление надпочечников у экспериментальных животных приводило к смерти через несколько суток [2] .
Надпочечники состоят из коркового и мозгового вещества. В корковом веществе, которое составляет до 90 % всей ткани надпочечника, выделяют три зоны:
- клубочковая;
- пучковая;
- сетчатая.
В клубочковой зоне синтезируются минералокортикоиды — подкласс кортикостероидных гормонов коры надпочечников, к коим относится альдостерон. К ней прилежит пучковая зона, вырабатывающая глюкокортикоиды (кортизол). Самая внутренняя зона — сетчатая — секретирует половые гормоны (андрогены) [2] .
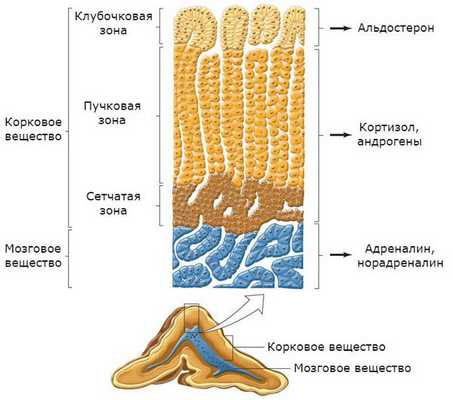
Главным органом-мишенью для альдостерона являются почки. Именно там данный гормон усиливает всасывание натрия, стимулируя выделение фермента Na + /K + АТФазы, таким образом повышая его уровень в плазме крови. Второй эффект воздействия альдостерона — выделение почками калия, снижая его концентрацию в плазме крови.
При гиперальдостеронизме, т.е. при повышенной альдостерона, натрия в плазме крови становится чрезмерно много. Это приводит к повышению осмотического давления плазмы, задержке жидкости, гиперволемию (увеличение объёма жидкости или крови в сосудистом русле), в связи с чем развивается артериальная гипертензия.
Дополнительно высокий уровень натрия повышает чувствительность стенок сосудов к их утолщению, воздействию веществ, повышающих артериальное давление (адреналин, серотонин, кальций и др.) и развитию фиброза (разрастанию и рубцеванию) вокруг сосудов. Низкий уровень калия в крови в свою очередь вызывает поражение почечных канальцев, что приводит к снижению концентрационной функции почек. В результате этого довольно быстро развивается полиурия (увеличение объёма выделяемой мочи), жажда и никтурия (ночное мочеиспускание). Также при низком уровне калия нарушается нейромышечная проводимость и pH крови [1] [3] . Сходным образом альдостерон влияет на потовые, слюнные и кишечные железы [2] .
Из всего выше сказанного можно сделать вывод о том, что основная жизненно важная функция альдостерона — это поддержание физиологической осмолярности внутренней среды, т. е. баланса суммарной концентрации растворённых частиц (натрия, калия, глюкозы, мочевины, белка).
Классификация и стадии развития гиперальдостеронизма
В зависимости от причин гиперсекреции альдостерона выделяют первичный и вторичный гиперальдостеронизм. Подавляющее большинство случаев данного синдрома являются именно первичными.
Первичный гиперальдостеронизм — это повышенная секреция альдостерона, независящая от гормональной системы, которая контролирует объём крови и кровяное давление. Он возникает из-за заболеваний надпочечников.
Вторичный гиперальдостеронизм — это повышенная секреция альдостерона, вызванная вненадпочечниковыми стимулами (заболеваниями почек, застойной сердечной недостаточностью).
Отличительные клинические признаки этих двух типов гиперальдостеронизма указаны в таблице ниже [10] .
Осложнения гиперальдостеронизма
У пациентов с гиперальдостеронизмом крайне часто наступают сердечно-сосудистые поражения и смерть в сравнении с людьми с аналогичной степенью артериальной гипертензии, но вызванной другими причинами [11] [12] . Такие пациенты имеют очень высокий риск развития инфаркта и нарушение ритма сердца, в частности фибрилляции предсердий, что потенциально является фатальным состоянием. Риск внезапной сердечной смерти у пациентов с гиперальдостеронизмом увеличивается в 10-12 раз [13] .
Нередко у пациентов выявляются вызванные гиперальдостеронизмом кардиосклероз, гипертрофия левого желудочка и дисфункция эндотелия (внутреннего слоя сосудов) [3] . Это объясняется прямым повреждающим влиянием альдостерона на миокард и сосудистую стенку. Доказано, что увеличение массы миокарда при гиперальдостеронизме развивается раньше и достигает больших размеров [1] .
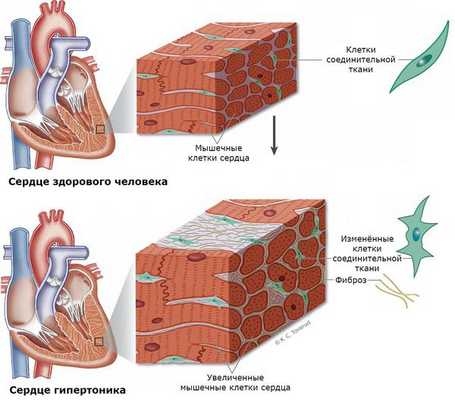
При развитии почечного синдрома (из-за интенсивного выведения почками калия) нарушается выведение ионов водорода. Это приводит к защелачиванию мочи и предрасполагает к развитию пиелита и пиелонефрита (воспаления почек), микроальбуминурии и протеинурии (выделения повышенного уровня альбумина и белка с мочой). У 15-20 % больных развивается почечная недостаточность с необратимыми изменениями работы почек. В 60 % случаев выявляется поликистоз почек [12] [13] .
Неотложным состоянием, связанным с гиперальдостеронизмом, является гипертонический криз. Его клинические проявления могут ничем не отличаться от обычных гипертонических кризов, проявляющихся головными болями, тошнотой, болями в области сердца, одышкой и т. д. Заподозрить нетипичный гипертонический криз в такой ситуации поможет наличие брадикардии (редкого пульса) и отсутствие периферических отёков. Эти данные в корне изменят тактику лечения и направят диагностический поиск в правильном направлении.
Диагностика гиперальдостеронизма
Для того чтобы не пропустить гиперальдостеронизм, вначале крайне важно выделить основные факторы риска, которые помогут заподозрить это заболевание. К ним относятся:
- артериальная гипертония II степени, т. е. стабильное повышение систолического (верхнего) артериального давления более 160/179 мм рт. ст., диастолического (нижнего) — более 100/109 мм рт. ст.;
- артериальная гипертония, устойчивая и/или плохо контролируемая препаратами (хотя этот признак далеко не всегда указывает на патологию);
- сочетание артериальной гипертонии с низким уровнем калия в крови (независимо от приёма мочегонных средств);
- артериальная гипертония и случайно выявленное (при УЗИ и/или КТ) образование надпочечника;
- отягощённый семейный анамнез: развитие артериальной гипертонии и/или острых сердечно-сосудистых катастроф до 40 лет, а также родственники, у которых уже был диагностирован гиперальдостеронизм [1][5] .
Следующий этап диагностики — лабораторное подтверждение. Для этого исследуется альдостерон-рениновое соотношение (АРС). Данное исследование является наиболее надёжным, информативным и доступным. Оно должно проводиться в ранние утренние часы: в идеале не позднее чем через два часа после пробуждения. Перед забором крови необходимо спокойно посидеть 5-10 минут.
ВАЖНО: некоторые препараты могут повлиять на концентрацию альдостерона и активность ренина плазмы, что, в свою очередь, изменит АРС. Поэтому за две недели до сдачи данного анализа важно отменить такие препараты, как спиронолактон, эплеренон, триамтерен, тиазидные диуретики, препараты из группы ингибиторов АПФ, БРА (блокаторов рецепторов ангиотензина) и другие. Врач должен проинформировать об этом пациента и временно назначить другую схему лечения гипертонии.
При положительном АРС необходимо провести подтверждающий тест с физиологическим раствором. Он проводится в условиях стационара, т. к. имеет ряд ограничений и требует исследование уровня альдостерона, калия и кортизола исходно и после 4-часового вливания двух литров физиологического раствора. В норме в ответ на большое количество вводимой жидкости выработка альдостерона подавляется, однако при гиперальдостеронизме подавить гормон таким способом не удаётся.
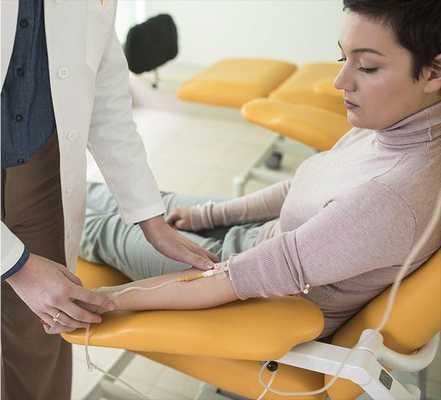
Низкий уровень калия в крови отмечается лишь в 40 % случаев синдрома, поэтому он не может быть надёжным критерием диагностики. А вот щелочная реакция мочи (вследствие повышенного выведения калия почками) является довольно характерным признаком патологии.
При подозрении на семейные формы гиперальдостеронизма проводится генетическое типирование (исследование на предрасположенность) с консультацией генетика [3] [6] .
Третий этап диагностики — топическая диагностика. Она направлена на поиски очага заболевания. Для этого используются различные способы визуализации внутренних органов.
УЗИ надпочечников — низкочувствительный метод диагностики. Предпочтительнее проводить КТ: она помогает выявить как макро- и микроаденомы надпочечников, так и утолщения ножек надпочечников, гиперплазии и другие изменения [14] .
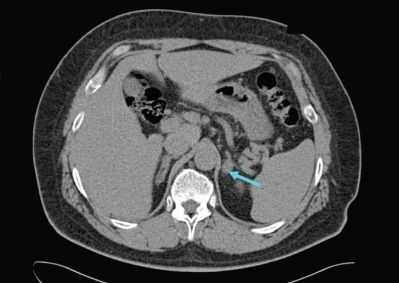
Для уточнения формы гиперальдостеронизма (одностороннего и двустороннего поражения) проводится селективный забор крови из вен надпочечников в специализированных центрах [9] . Это исследование эффективно снижает риск необоснованного удаления надпочечника только по данным КТ [4] .
Лечение гиперальдостеронизма
Оперативное лечение
Методом выбора при аденоме надпочечника, синтезирующей альдостерон, и односторонней гиперплазии надпочечника является эндоскопическая адреналэктомия — удаление одного или двух надпочечников через небольшие разрезы.
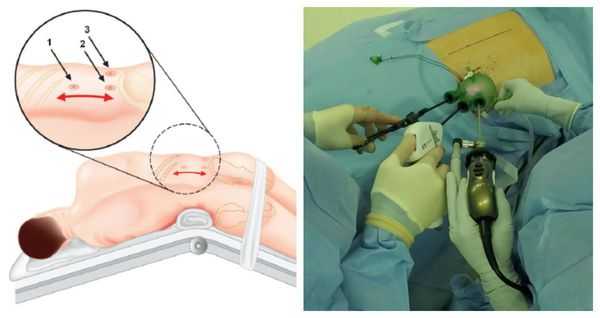
Данная операция выравнивает концентрацию калия в крови и улучшает течение артериальной гипертонии почти у 100 % больных. Полное излечение без использования антигипертензивной терапии достигается примерно у 50 %, шанс контроля артериального давления на фоне адекватной терапии увеличивается до 77 % [1] . В ряде исследований продемонстрировано уменьшение массы миокарда левого желудочка и устранение альбуминурии, что значительно повышает качество жизни таких пациентов.
Однако если гиперальдостеронизм не был диагностирован долгое время, то и после операции артериальная гипертония может сохраняться, а развившиеся сосудистые осложнения могут стать необратимыми, как и поражение почек. Поэтому крайне важно выявлять и лечить гиперальдостеронизм как можно раньше [7] .
Противопоказания к удалению надпочечника:
- возраст пациента;
- небольшая ожидаемая продолжительность жизни;
- тяжёлая сопутствующая патология;
- двусторонняя гиперплазия надпочечников (когда нет возможности провести селективный забор крови из вен надпочечников);
- гормонально-неактивная опухоль надпочечника, ошибочно принятая за источник выработки альдостерона.
Консервативное лечение
При наличии этих противопоказаний, высоком риске операции или отказе от хирургического вмешательства показано консервативное лечение специальными препаратами — антагонистами минералокортикоидных рецепторов (АМКР). Они эффективно снижают артериальное давление и защищают органы от избытка минералокортикоидов [7] [12] .
К этой группе препаратов относится калийсберегающий диуретик спиронолактон, который блокирует минералокортикоидные рецепторы и препятствует развитию фиброза миокарда, связанного с альдостероном. Однако он обладает рядом побочных эффектов, воздействуя ещё и на рецепторы андрогенов и прогестерона: может привести к гинекомастии у мужчин, снижению либидо, вагинальным кровотечениям у женщин. Все эти эффекты зависят от дозы препарата: чем больше доза препарата и длительность его применения, тем побочные эффекты более выражены.
Также существует относительно новый селективный препарат из группы АМКР — эплеренон. Он не воздействует на стероидные рецепторы в отличие от его предшественника, поэтому число неблагоприятных побочных эффектов будет меньше [9] .
При двусторонней гиперпродукции альдостерона показано длительное консервативное лечение. При вторичном гиперальдостеронизме следует лечить основное заболевание и корректировать артериальную гипертонию также с помощью препаратов группы АМКР [12] .
Прогноз. Профилактика
Выявление и адекватное лечение гиперальдостеронизма в большинстве случаев позволяет устранить артериальную гипертонию и связанные с ней осложнения или значительно смягчить её течение. Причём чем раньше синдром будет диагностирован и пролечен, тем благоприятнее прогноз: улучшается качество жизни, снижается вероятность инвалидизации и фатальных исходов [4] . Рецидивы после своевременной односторонней адреналэктомии, выполненной по показаниям, не возникают.
При запоздалой диагностике гипертония и осложнения могут сохраняться даже после терапии.
Гиперальдостеронизм может довольно долго протекать только с симптомами гипертонии.
Постоянно высокие цифры артериального давления (более 200/120 мм рт. ст.), нечувствительность к антигипертензивным препаратам, низкий уровень калия в крови — далеко не обязательные признаки синдрома. А ведь именно на это, зачастую, ориентируются врачи, чтобы заподозрить заболевание, "пропуская" гиперальдостеронизм с относительно "мягким" течением на ранних этапах.
Чтобы решить эту проблему, врачам, которые работают с пациентами с артериальной гипертензией, необходимо выявлять группы высокого риска и прицельно обследовать их на предмет наличия гиперальдостеронизма.
Синдром Конна (первичный гиперальдостеронизм) - симптомы и лечение
Что такое синдром Конна (первичный гиперальдостеронизм)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Лукьянова Сергея Анатольевича, хирурга-эндокринолога со стажем в 18 лет.
Над статьей доктора Лукьянова Сергея Анатольевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Синдром Конна (первичный гиперальдостеронизм) — это гормональное расстройство, при котором надпочечники в избыточном количестве вырабатывают гормон альдостерон. Проявляется повышением артериального давления.
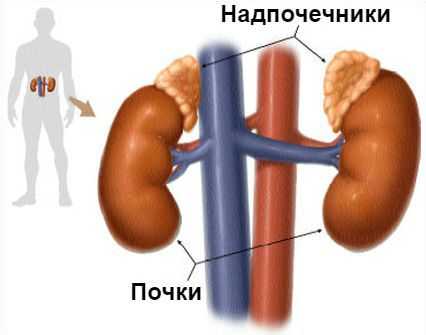
Основная задача альдостерона состоит в регулировании уровня натрия и калия в крови. Если этого гормона становится слишком много, организм начинает терять калий и удерживать слишком много воды, из-за чего объём крови и артериальное давление увеличиваются.
Первичный гиперальдостеронизм может быть вызван гиперактивностью либо одного, либо обоих надпочечников, т. е. быть односторонним или двусторонним. Одностороннее заболевание обычно вызывается альдостерон-продуцирующей аденомой (доброкачественной опухолью ), гиперплазией (усиленным ростом клеток) или, реже, раком одного надпочечника. На развитие этих причин влияют генетические факторы. Двустороннее заболевание обычно вызывает двусторонняя гиперплазия, т. е. усиленный рост клеток обеих желёз . Причиной такой гиперактивности надпочечников могут быть редкие генетические синдромы: семейный гиперальдостеронизм 1-го и 2-го типа.
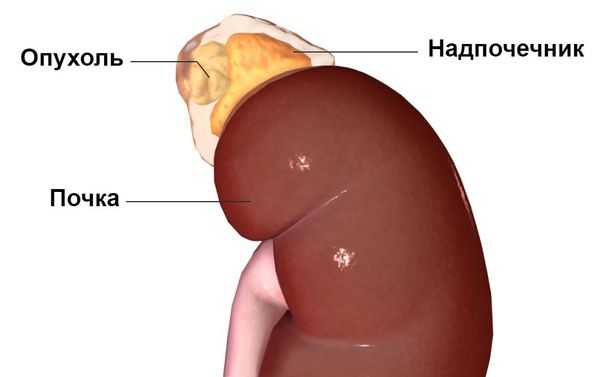
Наиболее часто синдром Конна встречается у людей 30-50 лет, преимущественно среди женщин — в 60-70 % случаев. Изначально он считался крайне редким заболеванием. В настоящее время установлено, что это одна из наиболее распространённых причин симптоматической артериальной гипертензии. Последние исследования показывают, что данное заболевание встречается у 5-15 % пациентов с гипертонией. Но так как пациентов, устойчивых к лечению артериальной гипертензии, редко направляют для обследования к эндокринологу, синдром Конна, по-видимому, часто остаётся недиагностированным [1] .
Хотя первичный гиперальдостеронизм всё ещё является значительной диагностической проблемой, его распознавание имеет решающее значение, поскольку артериальную гипертонию при этом заболевании можно полностью вылечить с помощью хирургического вмешательства (в отличие от гипертонической болезни, когда пациенты вынуждены пожизненно принимать гипотензивные препараты).
Симптомы синдрома Конна
Высокое давление является постоянным и зачастую единственным симптомом первичного гиперальдостеронизма. Оно наблюдается в 75-98 % случаев, вызывает головные боли, помутнение зрения и головокружение [2] [4] .
Повышение артериального давления может быть как незначительным, так и очень высоким. Причём высокие цифры при синдроме Конна обычно трудно контролировать, поэтому пациенты вынуждены принимать по четыре препарата для снижения давления или даже больше.
Часто у больных могут наблюдаться гипертонические кризы, при которых верхнее (систолическое) давление поднимается выше 250 мм рт. ст [3] . Клиническая картина таких кризов при синдроме Конна не отличается от обычного гипертонического криза: пациентов беспокоит головная боль, тошнота, рвота, головокружение, мелькание мушек перед глазами, избыточная потливость, боли в области сердца, учащённый пульс, чувство страха, звон в ушах и др.

Гипокалиемия (низкий уровень калия в крови) — второй по частоте симптом первичного гиперальдостеронизма. Его выявляют у 9-37 % больных [5] . Гипокалиемия может вызвать такие симптомы, как усталость, онемение, учащённое мочеиспускание, жажда, судороги и мышечная слабость. Увеличение объёма мочи (полиурия) и ночные пробуждения из-за позыва к мочеиспусканию (ноктурия) являются результатом нарушения работы почек. Иногда гипокалиемия может быть вызвана приёмом диуретиков. Уровень натрия в этом случае может быть нормальным или умеренно повышенным. Отёчный синдром, в отличие от других заболеваний почек, при этом встречается редко.
Все перечисленные жалобы часто встречаются и при других заболеваниях. Заподозрить именно синдром Конна можно, если у пациента:
- очень высокое артериальное давление, плохо поддающееся лекарственной терапии;
- семейный анамнез первичного альдостеронизма;
- высокое артериальное давление в возрасте до 40 лет;
- высокое артериальное давление и опухоль в одном из надпочечников;
- высокое артериальное давление и низкий уровень калия;
- высокое артериальное давление и апноэ во время сна.
Патогенез синдрома Конна
В связи с высоким уровнем альдостерона почки начинают сильнее всасывать натрий, задерживать воду и выводить калий из организма. Повышенное всасывание натрия почками, в свою очередь, увеличивает объём плазмы, что является первичным инициирующим механизмом гипертонии. Все эти изменения могут вызвать воспаление и отёк тканей с последующим развитием фиброза в жизненно важных органах, таких как сердце, почки и сосудистая сеть. В результате этого в дальнейшем развивается хроническая почечная недостаточность, мерцательная аритмия, инсульт, ишемическая болезнь сердца и застойная сердечная недостаточность.
Первичный гиперальдостеронизм может быть семейным (наследственным) и спорадическим (ненаследственным). Семейный вариант заболевания вызывает один из 4-х генетических вариантов гиперальдостеронизма, которые передаются по наследству. Также он может возникать спорадически, т. е. от случая к случаю. Генетические формы болезни связаны с мутацией генов, спорадические — с развитием альдостерон-продуцирующей аденомы или двусторонней гиперплазии надпочечников. До 2011 года причина возникновения этих аденом была не известна. Позже врачи установили, что в возникновении этих заболеваний особую роль также играют различные мутации [14] .
Не менее 6 % всех случаев первичного гиперальдостеронизма передаётся по наследству. Первый тип вызывается химерным геном, который содержит определённую последовательность структурных элементов ДНК гена 11β-гидроксилазы (CYP11B1). Этот ген регулируется АКТГ — адренокортикотропным гормоном, поэтому при первом типе заболевания также нарушается синтез глюкокортикоидов — других гормонов надпочечников. Тяжесть гиперальдостернизма может быть различной, отмечается раннее начало заболевания и высокая частота инсульта.
Клиническое течение второго типа неотличимо от спорадической формы болезни. Он диагностируется тогда, когда по крайней мере у двух членов семьи установлен этот диагноз. Генетическая основа данного типа остаётся неизвестной.
Третий тип ассоциируется с мутациями в гене KCNJ. Данные мутации приводят к нарушению транспорта калия и увеличению проводимости для натрия. В результате этого клеточная мембрана деполяризуется и вызывает открытие зависимых от каналов ионов кальция, который затем активирует выработку альдостерона. Для этого типа характерен дебют заболевания в раннем возрасте.
Недавно был описан новый, четвёртый тип семейного гиперальдостеронизма. Его вызывает мутация в гене CACNA1H, который кодирует работу кальциевых каналов. Этот тип также часто развивается ещё в детском возрасте и протекает с высоким артериальным давлением.
Спорадические формы гиперальдостеронизма (ненаследственные), тоже обусловлены различными мутациями, но уже соматическими (возникающими в течение жизни). Это в основном мутации усиления функции в генах, кодирующих ионные каналы или транспортёры (KCNJ5, CACNA1D, ATP1A1 и ATP2B3), которые приводят к избыточной продукции альдостерона [6] .
Достижения в области секвенирования генома человека (направленного на определение последовательности структурных элементов в молекуле ДНК) значительно продвинули наше понимание патогенеза первичного гиперальдостеронизма и показали, что чрезмерная выработка альдостерона при этой наиболее распространённой форме эндокринной гипертензии не так проста, как считалось ещё каких-то 10 лет назад.
Классификация и стадии развития синдрома Конна
Первичный гиперальдостеронизм классифицируется на основании анатомических характеристик и физиологических реакций.
Анатомически синдром Конна можно разделить на неопластический (аденомы, карциномы и эктопический гиперальдостеронизм) и неопухолевый (односторонняя или двусторонняя гиперплазия надпочечников).
Физиологически выделяют две формы заболевания:
- Ангиотензин чувствительная форма. К ней относится двусторонняя гиперплазия надпочечников и редкие формы односторонней аденомы. Они частично зависят от гормональной системы человека, которая регулирует артериальное давление.
- Ангиотензин нечувствительная форма. К ней относятся большинство альдостерон-продуцирующих аденом, рак или гиперплазия одного надпочечника. Они полностью не зависят от гормональной системы, регулирующей артериальное давление.
Частота встречаемости различных типов заболевания:
- Альдостерон-продуцирующие аденомы — 60 %.
- Первичная двухсторонняя гиперплазия надпочечников — 40 %.
- Односторонняя гиперплазия надпочечников — менее 1 %:
- альдостерон-продуцирующие ненадпочечниковые опухоли;
- альдостерон-продуцирующий рак коры надпочечника;
- глюкокортикоид-зависимый гиперальдостеронизм [7] .
Осложнения синдрома Конна
Повышенное артериальное давления и низкий уровень калия при синдроме Конна становятся причинами развития других проблем [8] . Так, гипокалиемия может привести к слабости, нарушению сердечного ритма, мышечным судорогам, чрезмерной жажде или мочеиспусканию, а постоянно высокое давление — к проблемам с сердцем и почками, в том числе инфаркту, инсульту и почечной недостаточности.
Риск возникновения сердечно-сосудистых проблем у пациентов с первичным гиперальдостеронизмом гораздо выше, чем у людей, которые имеют только высокое артериальное давление. Чтобы избежать возможных последствий синдрома Конна, больным с гипертонией, не поддающейся лечению, следует обратиться к эндокринологу для проведения обследования.
Диагностика синдрома Конна
Первичный гиперальдостеронизм диагностируется путём измерения в крови уровня альдостерона и ренина (гормона, вырабатываемого почками). Для более точной диагностики анализы необходимо сдавать утром. При синдроме Конна уровень альдостерона будет высоким, а уровень ренина — низким. При этом уровень калия может быть низким или нормальным.
Если результаты этих анализов будут положительными, то пациенту могут назначить дополнительные тесты для подтверждения диагноза. Они направлены на снижение количества альдостерона. Это можно сделать несколькими способами: ввести определённое лекарство, выполнить внутривенное вливание солевых растворов или ввести дополнительную соль с помощью диеты. Если после этих тестов уровень альдостерона останется высоким, а уровень ренина снизится, то диагноз подтверждается.
Альдостерон-рениновое соотношение (АРС). Этот анализ крови является скрининговым тестом, то есть он проводится при подозрении на гиперальдостеронизм. В настоящее время АРС является самым надёжным тестом по выявлению синдрома Конна. Однако различные методики определения этого соотношения часто приводят к ложноположительным или ложноотрицательным результатам. Об этом обязательно нужно помнить. Поэтому даже при высоком АРС, которое указывает на первичный гиперальдостеронизм, для подтверждения диагноза может потребоваться дополнительное тестирование.
Существует ряд правил по выполнению этого анализа:
- кровь необходимо брать в утренние часы (с 8:00 до 10:00);
- перед забором крови пациенту необходимо спокойно посидеть 5-10 минут;
- если у пациента есть гипокалиемия, то перед проведением анализа уровень калия необходимо нормализовать. Для этого в течение трёх дней перед забором крови рекомендуют соблюдать диету без ограничения соли, при которой пациенту нужно употреблять минимум 5-6 г поваренной соли в день;
- приём препаратов, которые могут повлиять на уровень альдостерона, необходимо отменить (например диуретики, противовоспалительные средства и др.) [9] .
Тест на подавление каптоприлом. Этот анализ крови измеряет реакцию альдостерона на каптоприл — лекарство, используемое для лечения высокого артериального давления. При отсутствии первичного гиперальдостеронизма уровень альдостерона в крови снизится более чем на 30 % от исходного.
24-часовая экскреция альдостерона с мочой. Для проведения этого теста пациент в течение пяти дней придерживается диеты с высоким содержанием соли, а затем сдаёт анализ мочи, собранной за сутки. Если уровень альдостерона в моче будет высоким, то наличие первичного гиперальдостеронизма будет подтверждено.
Тест на подавление физиологическим раствором. В этом тесте пациент получает солевой раствор через капельницу, затем ему измеряют уровень альдостерона и ренина. Первичный гиперальдостеронизм может быть подтверждён, если уровень альдостерона в крови после такой солевой нагрузки останется высоким, а уровень ренина понизится.
Для пациентов с доказанным первичным гиперальдостеронизмом следующим шагом является выяснение, каким заболеванием он вызван, — односторонним или двусторонним. Это очень важно, так как лечение каждого из них отличается. Компьютерная или магнитно-резонансная томография позволяют увидеть, есть ли опухоль в надпочечнике. Если пациент младше 40 лет и у него есть опухоль только в одном надпочечнике, то в этом случае можно приступать к лечению. Если пациент старше 40 лет и/или у него либо нет опухоли, либо есть опухоль, но в обоих надпочечниках, то возникает необходимость в проведении специального теста — селективного забора венозной крови из центральной вены надпочечников. В ходе этого теста хирург или рентгенолог берёт кровь непосредственно из вен обоих надпочечников, чтобы определить, какой именно орган вырабатывает патологическое количество гормона.
Лечение синдрома Конна
Лечение синдрома Конна зависит от его основной причины.
У пациентов с односторонней аденомой надпочечника единственным способом лечения является адреналэктомия — удаление опухоли вместе с надпочечником. Эта операция обычно выполняется ретроперитонеоскопически, т. е. через несколько очень маленьких разрезов со стороны спины. После односторонней адреналэктомии почти у 100 % пациентов снижается артериальное давление и нормализуется уровень калия в крови. При этом более чем у 50 % пациентов артериальная гипертензия полностью излечивается (без приёма лекарственных препаратов). Причинами стойкого повышения артериального давления после адреналэктомии может быть сопутствующая гипертоническая болезнь неизвестной причины и пожилой возраст пациентов.
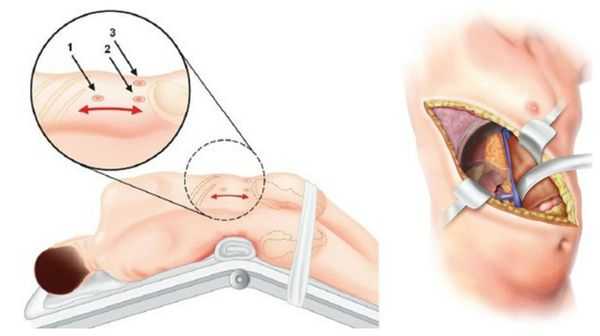
В крайних случаях проводится открытая адреналэктомия. Во время такой операции выполняется широкий разрез через грудную, брюшною полость и диафрагму. По сравнению с таким вмешательством, эндоскопическая адреналэктомия снижает сроки пребывания в стационаре и сочетается с меньшим количеством осложнений. Уже через неделю при эндоскопической операции пациент может вернуться к работе и обычным физическим нагрузкам.
Медикаментозное лечение рекомендуется пациентам с крайне высоким уровнем риска оперативного лечения (например при тяжёлой сердечной недостаточности). Поскольку односторонняя эндоскопическая адреналэктомия может полностью избавить пациента от медикаментозного лечения, её необходимо выполнять во всех остальных случаях. При этом важно, чтобы такое лечение выполнял хирург-эндокринолог, имеющий большой опыт проведения эндоскопических адреналэктомий.
Перед операцией артериальное давление и уровень калия в крови необходимо привести в норму. Если достичь этого в короткие сроки не удаётся, то операцию следует отложить.
После операции следует измерять уровень активности альдостерона и ренина в плазме крови, чтобы сделать предварительные выводы об эффективности оперативного лечения. Также в послеоперационном периоде нужно отменить приём добавок калия, прекратить приём спиронолактона и, при необходимости, уменьшить антигипертензивную терапию. Обычно артериальное давление улучшается или нормализуется через 1-6 месяцев после односторонней адреналэктомии, но у некоторых пациентов оно может оставаться повышенным до 1 года.
Для пациента с двусторонней гиперплазией лучшим способом лечением является консервативное — приём препарата под названием спиронолактон, который блокирует действие альдостерона. Кроме того, пациент должен придерживаться диеты с низким содержанием соли [10] .
Заболеваемость и смертность при синдроме Конна в первую очередь связаны с гипокалиемией и артериальной гипертензией. В случае своевременной диагностики болезнь излечивается полностью.
Причиной смерти могут стать сердечно-сосудистые осложнения. Установлено, что факторами риска развития этих осложнений при первичном гиперальдостеронизме являются гипокалиемия, односторонний первичный гиперальдостеронизм и высокий уровень альдостерона в плазме (не менее 125 пг/мл) [13] . Так, гипокалиемия, особенно тяжёлая, вызывает нарушения сердечного ритма, которые могут привести к летальному исходу.
Другими осложнениями гиперальдостеронизма являются инфаркт миокарда, цереброваскулярные болезни и сердечная недостаточность. Также у пациентов с синдромом Конна с большей вероятностью, чем у пациентов с гипертонией, развиваются острые коронарные синдромы, гипертрофия левого желудочка и инсульт [12] .
Существуют доказательства того, что хронический гиперальдостеронизм при отсутствии повышенного кровяного давления (как это происходит при вторичном гиперальдостеронизме) также связан с повышенным риском сердечных осложнений, включая ишемические, гипертрофические и фиброзные повреждения [11] .
Профилактика синдрома Конна предполагает своевременное лечение болезней, которые могут его вызвать. Пациентам с длительно существующей или трудно контролируемой артериальной гипертензией рекомендуется проходить скрининг на гиперальдостеронизм. В зоне риска находятся молодые люди до 40 лет и те, чьи родители страдают гипертонией.
Болезнь Иценко — Кушинга - симптомы и лечение
Что такое болезнь Иценко — Кушинга? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ворожцова Е. И., эндокринолога со стажем в 12 лет.
Над статьей доктора Ворожцова Е. И. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
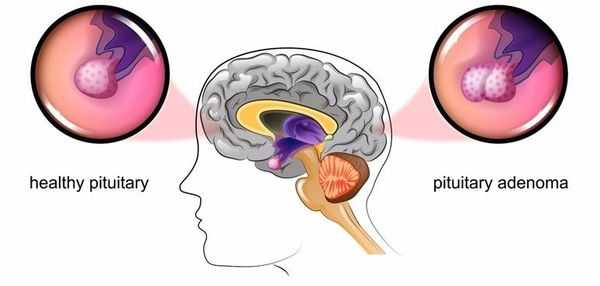
Болезнь Иценко — Кушинга (БИК) — тяжёлое многосистемное заболевание гипоталомо-гипофизарного происхождения, клинические проявления которого обусловлены гиперсекрецией гормонов коры надпочечников. [1] Является АКТГ-зависимой формой гиперкортицизма (заболевания, связанного с избыточным выделением гормонов корой надпочечников).
Основная причина заболевания — кортикотрофная микроаденома (доброкачественная опухоль) гипофиза. Возникновение последней может быть связано со множеством факторов. Часто заболевание развивается после травмы головного мозга, беременности, родов, нейроинфекции.
Болезнь Иценко — Кушинга является редким заболеванием, частота встречаемости которого составляет 2-3 новых случая в год на один миллион населения. [2]
Симптомы болезни Иценко — Кушинга
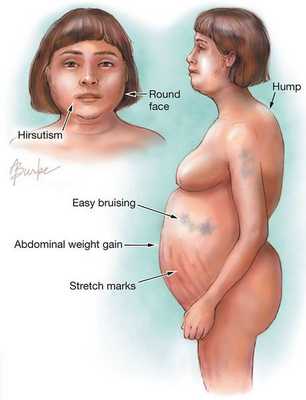
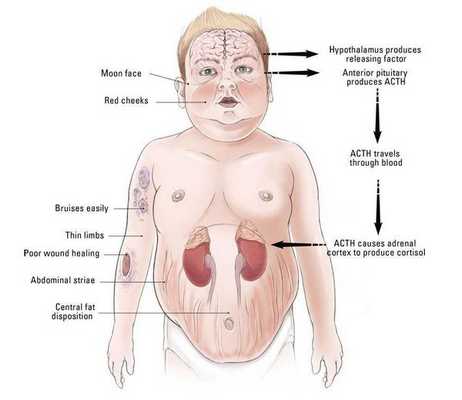
Клинические признаки данной болезни обусловлены гиперсекрецией кортикостероидов. В большинстве случаев первым клиническим признаком является ожирение, которое развивается на лице, шее, туловище и животе, при этом конечности становятся тонкими. Позднее проявляются кожные изменения — истончение кожи, трудно заживающие раны, яркие стрии (растяжки), гиперпигментация кожи, гирсутизм (избыточное появление волос на лице и теле).
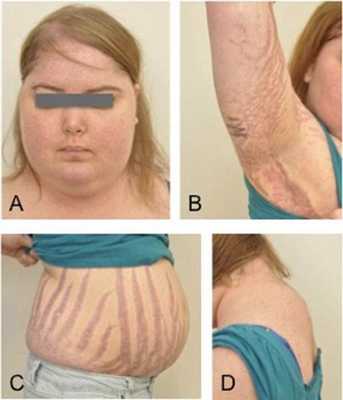
Также важным и частым симптомом является мышечная слабость, развитие остеопороза.
Артериальная гипертензия при БИК носит постоянный и умеренный характер, в редких случаях артериальное давление остаётся в норме. Это связано с тем, что глюкокортикоиды (гормоны, вырабатываемые корой надпочечников) повышают сосудистый тонус и чувствительность адренорецепторов к катехоламинам (природным веществам, контролирующим межклеточное взаимодействие в организме).
Более чем у половины больных возникают нарушения психики. Наиболее частые из них: эмоциональная неустойчивость, депрессия, раздражительность, панические атаки, расстройство сна.
Нарушения менструального цикла (редкие, скудные менструации или их отсутствие) встречается у 70-80% пациенток, также довольно часто встречается бесплодие. У мужчин при БИК снижается половое влечение и возникает эректильная дисфункция.
Болезнь Иценко — Кушинга сопровождается иммунодефицитом, который проявляется в виде рецидивирующей инфекции (чаще всего возникает хронический пиелонефрит).
Частота клинических проявлений БИК: [3]
- лунообразное лицо — 90%;
- нарушенная толерантность к глюкозе — 85%;
- абдоминальный тип ожирения и гипертензия — 80%;
- гипогонадизм (недостаток тестостерона) — 75%;
- гирсутизм — 70%;
- остеопороз и мышечная слабость — 65%;
- стрии — 60%;
- отёк суставов, акне и отложение жира в области VII шейного позвонка — 55%;
- боли в спине — 50%;
- нарушения психики — 45%;
- ухудшение заживления ран — 35%;
- полиурия (избыточное мочеобразование), полидипсия (чрезмерная жажда) — 30%;
- кифоз (искривление позвоночника) — 25%; и полицитемия (увеличение концентрации эритроцитов в крови) — 20%.
Патогенез болезни Иценко — Кушинга
Патогенез данного заболевания носит многоступенчатый характер.
В кортикотрофах гипофиза возникают характерные рецепторно-пострецепторные дефекты, в дальнейшем приводящие к трансформации нормальных кортикотрофов в опухолевые с гиперпродукцией адрено-кортикотропного гормона и последующим развитием гиперкортицизма. [4]
На трансформацию нормальных кортикотрофов в опухолевые влияют гормоны гипоталамуса и местные ростовые факторы:
- эпидермальный фактор роста (стимулирует рост клеток эпителия);
- цитокины (отвечают за межклеточное взаимодействие);
- грелин (нарушает углеводный обмен); [14]
- сосудистый эндотелиальный фактор роста (способствует росту клеток эндотелия).
Хронически повышенная концентрация АКТГ приводит к повышенной секреции кортизола, который и обуславливает характерную клиническую картину БИК.
Классификация и стадии развития болезни Иценко — Кушинга
Классификация БИК по степени тяжести: [5]
- лёгкая форма — симптомы выражены в умеренной степени;
- средняя форма — симптомы явно выражены, осложнения отсутствуют;
- тяжёлая форма — при наличии всех симптомов БИК возникают различные осложнения.
Классификация БИК по течению:
- торпидное (патологические изменения формируются постепенно, на протяжении 3-10 лет);
- прогрессирующее (нарастание симптомов и осложнений заболевания происходит в течение 6-12 месяцев от начала заболевания);
- циклическое (клинические проявления возникают периодически, непостоянно).
Осложнения болезни Иценко — Кушинга
- Сосудистая исердечная недостаточность. Данное осложнение развивается у половины пациентов после 40 лет. Данная патология может привести к смерти. В большинстве случаев это происходит по причине тромбоэмболии лёгочной артерии, острой сердечной недостаточности и отёка легких.
- Патологические остеопоретические переломы. Наиболее часто встречаются переломы позвоночника, рёбер, трубчатых костей.
- Хроническая почечная недостаточность. У 25-30% больных снижается клубочковая фильтрация и канальцевая реабсорбция (обратное поглощение жидкости).
- Стероидный сахарный диабет. Данное осложнение наблюдается у 10-15% пациентов с данным заболеванием.
- Атрофия мыщц, в результате которой появляется выраженная слабость. У больных возникают трудности не только при передвижении, но и в момент вставания.
- Нарушения зрения (катаракта, экзофтальм, нарушение полей зрения).
- Психические расстройства. Наиболее часто встречается бессонница, депрессия, панические атаки, параноидальные состояния, истерия.
Диагностика болезни Иценко — Кушинга
Диагноз «Болезнь Иценко — Кушинга» можно установить на основании характерных жалоб, клинических проявлений, гормонально-биохимических изменений и данных инструментальных исследований.
Исключительно важными гормональными показателями для данной патологии будут АКТГ и кортизол. Уровень АКТГ повышается и колеблется в пределах от 80 до 150 пг/мл. [7] Повышение уровня кортизола в крови не всегда является информативным, так как увеличение данного показателя может быть обусловлено рядом других причин (стрессы, алкоголизм, беременность, эндогенная депрессия, семейная резистентность (споротивляемость) к глюкокортикоидам и т. д.). В связи с этим разработаны методы исследования уровня свободного кортизола в суточной моче или слюне. Наиболее информативным является исследование свободного кортизола в слюне в 23:00. [6]
Для доказательства гиперкортицизма используется малый дексаметазоновый тест. При БИК данная проба будет отрицательной, так как подавление кортизола при приёме 1 мг дексаметазона не происходит. [7]
Биохимический анализ крови способен выявить многочиселнные измения:
- повышение в сыворотке крови уровня холестерина, хлора, натрия и глобулинов;
- снижение в крови концентрации калия, фосфатов и альбуминов;
- снижение активности щелочной фосфатазы.
После подтверждённого гиперкортицизма необходимо проведение инструментальных методов исследования (МРТ гипофиза, КТ надпочечников).
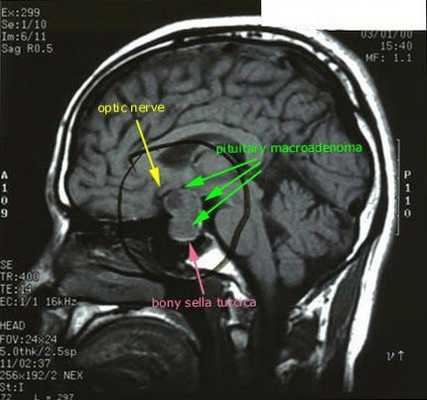
При БИК в 80-85% случаев выявляют микроаденому гипофиза (опухоль до 10 мм), у остальных 15-20% — макроаденому (доброкачественное новообразование от 10 мм). [7]
Лечение болезни Иценко — Кушинга
Медикаментозная терапия
В настоящее время эффективных лекарственных препаратов для лечения данной патологии не существует. В связи этим они используются либо при наличии противопоказаний для оперативного лечения, либо как вспомогательная терапия. Применяются следующие медикаменты:
- нейромодуляторы — блокируют образование АКТГ аденомой гипофиза (каберголин, бромкриптин, соматостатин); [8]
- препараты, блокирующие синтез стероидов в надпочечниках (кетоконазол, аминоглютетимид, митотан, метирапон);
- антагонисты глюкокортикоидов (мифепристон). [9]
Кроме препаратов данных групп пациентам назначается симптоматическая терапия для снижения симптомов гиперкортицизма и улучшения качества жизни пациента:
- гипотензивная терапия (ингибиторы АПФ, антагонисты кальция, диуретики, бета-адреноблокаторы);
- антирезорбтивная терапия при развитии стероидного остеопороза;
- препараты, корректирующие нарушения углеводного обмена (метформин, препараты сульфанилмочевины, инсулин);
- терапия, направленная на коррекцию дислипидемии;
- антиангинальная терапия.
Оперативная терапия
- Транссфеноидальная аденомэктомия в настоящее время считается наиболее эффективным и безопасным способом лечения БИК. [7] Противопоказаниями для данного вида лечения служат супраселлярный рост аденомы с прорастанием в боковые желудочки, тяжёлые сопутствующие заболевания, определяющие общий плохой послеоперационный прогноз. К осложнениям транссфеноидальной аденомэктомии относятся: ликворея (потеря спиномозговой жидкости), пансинусит (воспаление всех пазух носовой полости), несахарный диабет, приходящий гипокортицизм.
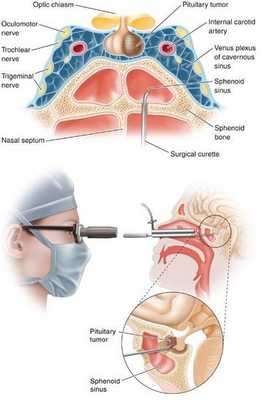
- Двусторонняя адреналэктомия используется при неэффективности аденомэктомии и радиохирургии. [10]
Радиохирургия
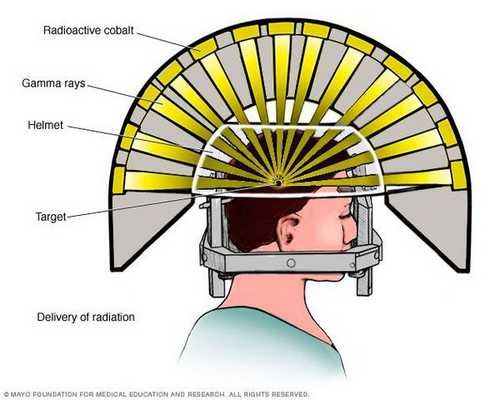
- Операция с помощью гамма-ножа. Во время проведения хирургического вмешательства луч радиации, направленный непосредственно в аденому гипофиза, разрушает её клетки. Данный метод лечения предотвращает рост опухоли при помощи однократной дозы радиации. Процедура длится около двух-трёх часов. Она не затрагивает окружающие структуры мозга, производится с точностью до 0,5 мм. Осложнения данной терапии — гиперемия (увеличение притока крови) в зоне облучения, алопеция (выпадение волос).
- Протонотерапия. [11] Данный вид лечения использует протонную энергию, которая генерируется в ядерных ускорителях. Протоны повреждают ДНК клеток, вследствие чего они погибают. Протоновый пучок фокусируют непосредственно на аденому, не повреждая окружающие ткани. Голова пациента фиксируется в специальной маске, которая изготавливается для каждого индивидуально. Во время процедуры облучения врач контролирует состояние больного, а операторы дистанционно наблюдают за пучком. Данный вид лечения обычно хорошо переносится пациентами. Улучшение самочувствия наблюдается уже через 1-1,5 месяца.
- Мегавольтное тормозное излучение медицинских ускорителей позволяет проникать электронам на большие расстояния. Данный вид терапии часто даёт хорошие результаты, но, одновременно с этим, усложняет дозиметрию (расчёты ионизирующих излучений), что может привести к опасным радиационным авариям.
Прогноз БИК зависит от нескольких показателей: формы и длительности заболевания, наличия осложнений, состояния иммунитета и других факторов.
Полное выздоровление и восстановление трудоспособности возможно при лёгкой форме болезни и небольшом стаже заболевания.
При средней и тяжёлой формах БИК трудоспособность крайне снижена или отсутствует. После проведённой двусторонней адреналэктомии развивается хроническая надпочечниковая недостаточность, которая диктует пожизненный приём глюко- и минералкортикоидов.
В целом любое лечение, как правило, приводит к улучшению качества жизни больного, однако она остаётся ниже, чем у лиц без данной патологии.
Болезнь Иценко — Кушинга — тяжёлое хроническое заболевание, которое при отсутствии своевременного лечения может стать причиной летального исхода. Смертность при данной патологии составляет 0,7%.
Пятилетняя выживаемость при БИК без проведения лечения составляет 50%, но заметно улучшается даже если проводить только паллиативное лечение (при двухсторонней адреналэктомии выживаемость увеличивается до 86%). [13]
Первичной профилактики БИК не существует. Вторичная профилактика заболевания направлена на предотвращение рецидива болезни.
Первичный гиперальдостеронизм: симптомы, диагностика, лечение синдрома Конна

Врач гинеколог-эндокринолог. Стаж 23+ лет. Принимает в Университетской клинике в Санкт-Петербурге. Стоимость приема 2000 руб.
- Запись опубликована: 19.09.2022
- Reading time: 6 минут чтения
Гиперальдостеронизм — одна из наиболее распространенных причин вторичной гипертензии. Это патологическое состояние вызвано чрезмерной выработкой гормона альдостерона надпочечниками. При первичном гиперальдостеронизме увеличение секреции альдостерона связано с аномалиями, расположенными внутри самих надпочечников. При вторичном гиперальдостеронизме аномалии, вызывающие повышение концентрации альдостерона, возникают вне надпочечников.
Альдостерон влияет на поддержание натриевого и калиевого баланса. Избыток альдостерона вызывает задержку натрия и воды в организме, что приводит к повышению артериального давления. Повышенное кровяное давление вызывает повышенный риск инсульта, инфаркта, сердечной и почечной недостаточности.
Что такое гиперальдостеронизм
Первичный гиперальдостеронизм - это ренин-независимый синдром перепроизводства альдостерона, характеризующийся повышенной концентрацией альдостерона, снижением активности ренина плазмы, повышением артериального артериального давления, гипокалиемией и метаболическим алкалозом. Проблема связана с органической патологией надпочечников, например, аденомой или гиперплазией.
Классические симптомы первичного гиперальдостеронизма - гипертония и гипокалиемия, но уровень калия также может находиться в пределах нормы.
Патология была впервые описана в 1954 г. доктором Конном, который диагностировал у пациента резистентную гипертензию, гипокалиемию и альдостерон-продуцирующий аденому надпочечников. Поэтому гиперальдостеронизм, развившийся из-за аденомы, продуцирующей альдостерон, называется синдром Конна.
Статистика распространенности заболевания
Точная распространенность первичного гиперальдостеронизма неизвестна, но последние исследования показывают, что проблема затрагивает 10-13% случаев артериальной гипертензии. Наиболее частая причина - реципрокная гиперплазия надпочечников. Такая патология чаще диагностируется у мужчин после 50 лет. У женщин обычно выявляется альдостерома. Классический возраст больных - 30-30 лет.
Таблица 1. Наиболее распространенные причины и классификация первичного гиперальдостеронизма
| Причина ПГ | Случаи, % |
| Односторонняя или двусторонняя альдостерон-продуцирующая аденома надпочечников | до 40 |
| Идиопатический гиперальдостеронизм и гиперплазия обоих надпочечников | 25-60 |
| Первичная гиперплазия одного надпочечника | 2 |
| Альдостерон-продуцирующая карцинома | 1 |
| Семейный гиперальдостеронизм:Тип I - глюкокортикоид-зависимый гиперальдостеронизм, Тип II - односторонняя или двусторонняя альдостерон-продуцирующая аденома или идиопатический гиперальдостеронизм и гиперплазия обоих надпочечников | |
| Эктопическая альдостерон-продуцирующая аденома или карцинома (может присутствовать при наличии опухолей яичников и почек) |
Патофизиология ПГ
При первичном гиперальдостеронизме надпочечники автономно выделяют альдостерон, что приводит к ингибированию (подавлению) эндогенной системы ренина и ангиотензина. Альдостерон вызывает задержку соли в почках и потерю калия, результатом чего становится повышение содержания натрия в организме, что приводит к угнетению синтеза ренина в почках.
Прямое влияние альдостерона на дистальный нефрон приводит к задержке натрия и потере ионов водорода и калия, что приводит к развитию гипокалимического алкалоза, хотя концентрации калия в плазме могут сохраняться и существенно не снижаться или соответствовать норме у каждого второго больного.
Кроме того, альдостерон оказывает патофизиологическое действие на многие другие ткани, например, может привести к фиброзу сердца, дисфункции эндотелия сосудов и нефросклерозу.
Клинические признаки первичного гиперальдостеронизма
Наиболее важный первичный клинический признак ПГ - гипертония, обычно умеренная или высокая (>180/110 мм рт.ст.), устойчивая к обычному лечению, требующая применения 3-х и более препаратов, снижающих артериальное давление. Гипертония, вызванная альдостерон-продуцирующей аденомой надпочечников, характеризуется более тяжелой гипертензией и более частым выявлением гипокалиемии, а при идиопатической гиперплазии надпочечников клинические признаки могут быть менее выраженными. К сожалению, эти клинические признаки не считаются надежными в плане дифференциации альдостерон-продуцирующей аденомы от идиопатической гиперплазии надпочечников.
Повышенное артериальное давление может проявляться головными болями, нарушениями зрения, болями в груди. Плохо контролируемая гипертония может привести к опасным для жизни осложнениям, поэтому важно определить причину повышенного артериального давления и быстро начать лечение.
Второй признак первичного гиперальдостеронизма - гипокалиемия, обычно бессимптомная. Гипокалиемия может привести к аритмии, мышечной слабости, болезненным мышечным спазмам, повышенной жажде и усилению мочеиспускания. Ранее гипокалиемия считалась одним из наиболее важных клинических признаков ПГ, но затем исследования показали, что этот симптом есть менее, чем у 40% больных.
Иногда из-за выраженной гипокалиемии у пациентов могут наблюдаться:
- тетания - болезненные и непроизвольные сокращения мышц;
- миопатия - хронические нервные заболевания с первичным поражением мышц;
- полиурия - чрезмерная выработка мочи; - активный ночной диурез (гипокалиемический нефрогенный несахарный диабет).
Также возможна ассоциация с остеопорозом. Снижение концентрации калия в плазме крови сопровождается метаболическим алкалозом.
Пациенты с первичным гиперальдостеронизмом имеют более высокую частоту и смертность от сердечно-сосудистых заболеваний по сравнению с больными с первичной артериальной гипертензией с таким же увеличением артериального давления. Влияние гиперальдостеронизма на сердечно-сосудистую систему не зависит от концентрации калия в плазме. Пациенты с диагнозом гиперальдостеронизм имеют большие размеры левого желудочка. Из-за повышенного риска сердечно-сосудистых патологий повышается риск развития инсульта, инфаркта миокарда и фибрилляции предсердий.
Возможны и другие клинические признаки, такие как гипернатриемия (концентрация натрия в плазме крови у пациентов с ЛГ составляет 143-147 ммоль/л), гипомагниемия.
Что делать при появлении симптомов гиперальдостеронизма?
При появлении симптомов следует обратиться к эндокринологу, который после сбора анамнеза, осмотра и измерения артериального давления назначит анализы на концентрации электролитов в сыворотке крови. В случае выявления отклонений и подозрения на первичный гиперальдостеронизм он направит пациента на дальнейшую диагностику.
Диагностика первичного гиперальдостеронизма
В 2016 г. Европейское Общество эндокринологов обновило клинические рекомендации по диагностике и лечению первичного гиперальдостеронизма. Ранее рекомендовалось обследование на гиперальдостеронизм всем пациентам с умеренной и тяжелой гипертензией (>160/100 мм рт.ст.), независимо от уровня калия в крови.
Новые руководящие принципы расширили этот список. В него включили больных с постоянно повышенным артериальным давлением (>150 мм рт.ст. (систолическое) и >100 мм рт.ст. (диастолическое)) и пациентов с гипертонией и апноэ сна.
Рекомендуемый в Европе алгоритм диагностики первичного гиперальдостеронизма включает 4 этапа.
Таблица 2. Этапы диагностики ЛГ первичного гиперальдостеронизма
| Этап | Диагностика |
| 1 | Выявление симптомов, дающих основание подозревать гиперальдостеронизм. Пациента нужно обследовать, если у него есть хотя бы 1 из 5 состояний (см. таблицу 3) |
| 2 | Первичный скрининговый тест - изучаются концентрация альдостерона в плазме и прямая концентрация ренина, затем рассчитывается отношение альдостерона к ренину |
| 3 | Анализы для подтверждения диагноза |
| 4 | Определение подтипа патологии |
Таблица 3. Признаки, требующие диагностики первичного гиперальдостеронизма
| Состояние | |
| 1 | Лечение устойчивой артериальной гипертензии (АКС >140/90 мм рт.ст. при лечении 3 группами антигипертензивных препаратов) |
| 2 | Артериальная гипертензия и спонтанная или мочегонная гипокалиемия |
| 3 | Артериальная гипертензия и эпизодиома |
| 4 | Раннее начало артериальной гипертензии и/или инсульта ( |
| 5 | Все пациенты с артериальной гипертензией с родственниками первой линии с диагнозом гиперальдостеронизм |
Результаты исследования могут быть искажены многими факторами и лекарствами, поэтому анализы проводятся в стандартизированных условиях. Перед проведением лабораторных исследований необходимо скорректировать уровень калия и натрия, прекратить прием препаратов (временная отмена некоторых препаратов, обычно за 4-6 недель до теста), способных повлиять на результаты исследования. В их числе:
- спиронолактон;
- ингибиторы ангиотензинпревращающего фермента;
- блокаторы рецепторов ангиотензина II;
- ингибиторы ренина, бета-адреноблокаторы; ;
- дигидропиридины;
- агонисты центрального действия α-2 (клонидин, α-метилдопа); .
Для коррекции артериальной гипертензии препаратами с минимальным воздействием на соотношение ПАК/ТРК рекомендуемый препарат первого выбора - не дигидропиридиновый блокатор кальциевых каналов, например, верапамил. При персистенции неконтролируемой гипертензии могут добавляться альфа-адреноблокаторы, например, доксазозин.
У пациентов с первичным альдостеронизмом обычно наблюдается снижение концентрации калия в крови, повышение концентрации альдостерона, снижение активности ренина плазмы и повышение альдостерон-ренинового индекса, обусловленное коэффициентом двух предыдущих значений. Первичный гиперальдостеронизм подозревается, если концентрация альдостерона в плазме (ng/dl)/прямая концентрация ренина (ng/l) составляет >5,7. Пределы соотношения могут варьироваться в зависимости от системы единиц измерения, используемой в лабораториях.
Обнаружив вышеперечисленные отклонения, врач примет решение о необходимости проведения дальнейших тестов, оценивающих гормональную функцию надпочечников, так называемых функциональных проб.
Третий этап представляет собой тест на подтверждение диагноза, направленный на подтверждение автономной выработки альдостерона. Рекомендуется проводить 1 из 4 проб: с пероральным прием соли, с 0,9% раствором NaCl, супрессионный тест на флудрокортизон, провокацию каптоприлом. Наиболее часто используемый тест с NaCl. Концентрация альдостерона после введения NaCl не снижается ниже 10 нг/дл, а у здоровых людей составляет менее 5 нг/дл.
Пациентам с неконтролируемой гипертензией, сердечной недостаточностью, почечной недостаточностью, аритмией, гипокалиемией рекомендуется пройти тест с провокацией каптоприлом, измеряющим изменение уровней ренина в плазме в ответ на препарат каптоприл.
После подтверждения диагноза проводится компьютерная томография (КТ) органов брюшной полости для определения подтипа патологии. КТ проводится для определения причины гиперальдостеронизма - аденомы надпочечников, гиперплазии или карциномы (подозревается при обнаружении односторонней опухоли >4 см). Магнитно-резонансная томография (МРТ) не имеет преимуществ перед КТ, поэтому не рекомендуется в качестве стандартного метода обследования. Чувствительность КТ - 78%, специфичность - 75%.
Данные КТ надпочечников определяют дальнейшую тактику обследования и лечения. Например, если при КТ обнаружен односторонний гиподенсный узел (участок, отличающийся по плотности или цвету и четкими границами на изображении) и пациенту более 35 лет, следующий диагностический этап - исследование венозной крови надпочечников. Для уточнения того, где происходит перепроизводство альдостерона, проводят катетеризацию надпочечниковых вен и тест на венозную кровь надпочечников. Это золотой стандарт оценки латерализации первичного гиперальдостеронизма, с чувствительностью - 95% и специфичностью - 100%.
Если патология выявлена у больного в возрасте до 20 лет с положительным семейным анамнезом или инсультом до 40 лет, необходима консультация генетика.
Лечение первичного гиперальдостеронизма
Цель лечения гиперальдостеронизма - нормализация артериального давления и концентрации калия в крови.
Тактика лечения зависит от причины патологии. При одностороннем гиперальдостеронизме, когда причина первичного альдостеронизма - опухоль надпочечников, секретирующая альдостерон, лечение выбора заключается в хирургическом удалении надпочечников вместе с опухолью лапароскопическим методом - лапароскопическая адреналэктомия. Важная предоперационная подготовка - коррекция гипокалиемии и гипертонической болезни. Лекарства первого выбора - антагонисты минералкортикоидных рецепторов. Рекомендуемая продолжительность лечения - до 5 недель.
После операции необходимо наблюдать за уровнем калия, так как из-за временного гипоальдостеронизма, вызванного контраллатеральной супрессией надпочечников, может возникнуть гиперкалиемия. По возможности следует уменьшить дозы антигипертензивных препаратов.
На следующий день после операции следует проверить активность альдостерона и ренина в плазме крови - это ранний биохимический показатель операционного успеха.
Первые несколько недель после операции не следует уменьшать количество поваренной соли в еде.
Важно понимать, что операция помогает снять давление не всем больным. После хирургического лечения артериальная гипертензия сохраняется примерно в половине случаев.
Пациентам после односторонней адреналэктомии требуется длительное наблюдение. Каждые 6-12 месяцев придется сдавать анализы на альдостерон, ренин, электролиты, и ежедневно измерять давление. Через год после операции нужно сделать КТ органов брюшной полости с последующим повторением КТ каждые 1-3 года.
При диагностике двусторонней гиперплазии надпочечников терапия включает фармакологическое лечение и модификацию образа жизни (рекомендуется поддерживать нормальную массу тела, умеренные физические нагрузки и диету с ограничением потребления соли
Для медикаментозного лечения используются диуретики, которые снижают действие альдостерона и повышают концентрацию калия в крови (спиронолактон и эплеренон). Эти препараты также применяются у пациентов с аденомой надпочечников, секретирующих альдостерон перед операцией или в случае противопоказаний к процедуре.
В случае семейного гиперальдостеронизма также назначается медикаментозное лечение.
- Антагонисты минералокортикоидных рецепторов. Это препараты первого выбора. Первым назначается спиронолактон. Начальная доза 12,5-25 мг 1 к./сут, постепенно дозу увеличивают до 100 мг. При персистенции неконтролируемого артериального давления, гипокалиемии доза может быть увеличена до 400 мг. Основные нежелательные эффекты после приема этого препарата: у мужчин - гинекомастия, у женщин - нарушения менструального цикла, болезненность груди. При плохой переносимости спиронолактона назначают эплеренон, не обладающий антиандрогенным действием прогестерона. Начальная доза - 25 мг 2 к./сут, стандартная доза - 50-200 мг/сут.
- Калийсберегающие диуретики. Например, триамтерен или амилорид. Препараты второй линии назначаются, когда не переносятся антагонисты минералокортикоидных рецепторов. В большинстве случаев требуется повышенная доза амилорида (до 40 мг/сут). При его приеме необходимо контролировать уровень калия в крови.
- Блокаторы кальциевых каналов. Например, нифедипин. Могут быть полезны, потому что, блокируя диффузию кальция в адренокортикальную клетку, они уменьшают выработку альдостерона. При наследственном гиперальдостеронизме требуется длительное наблюдение за больными - каждые 3-6 месяцев нужно проводить анализы на концентрацию калия, креатинина в крови, ежедневно измерять давление, при наличии опухолей и др. изменений повторять КТ надпочечников каждые 3-4 года.
- Глюкокортикоиды. Могут назначаться небольшие дозы для лечения глюкокортикоид-зависимого гиперальдостеронизма. Например, может быть выписан дексаметазон 0,25-0,5 мг перед сном.
При лечении глюкокортикоидами необходимо каждые 2-3 года проходить обследование на минеральную плотность костей на предмет возможного остеопороза.
Можно ли полностью вылечить гиперальдостеронизм?
Хирургическое лечение альдостеронсекрецирующей аденомы приводит к полному разрешению симптомов гиперальдостеронизма у 35-70% больных. Пациентам с двусторонней гиперплазией надпочечников рекомендуется постоянно соблюдать ограниченную солью диету и поддерживать пожизненное фармакологическое лечение, направленное на нормализацию концентрации калия в крови и контроль артериального давления. Только хорошо контролируемое артериальное давление позволит избежать органных осложнений (инсульт, инфаркт).
Что нужно сделать после окончания лечения гиперальдостеронизма?
После хирургического лечения альдостерон-секретирующей аденомы надпочечников некоторым пациентам требуется продолжение лечения гипертонической болезни. После хирургического лечения требуется оценка концентрации кортизола в крови, что обусловлено возможным риском развития надпочечниковой недостаточности. Рекомендуется регулярный контроль артериального давления.
Также нужно вести здоровый образ жизни, положительно влияющий на контроль артериального давления, в том числе: снижение соли в рационе, поддержание здоровой массы тела, регулярные физические упражнения, ограничение количества потребляемого алкоголя и отказ от курения.
Что делать, чтобы не заболеть гиперальдостеронизмом?
Способов предотвратить возникновение первичного гиперальдостеронизма пока не разработано. Однако ранняя диагностика и применение соответствующего лечения, направленного на надлежащий контроль артериального давления, позволяет уменьшить сердечно-сосудистые осложнения и, таким образом, снизить смертность.
Выводы
Первичный гиперальдостеронизм приводит более чем к каждому десятому случаю гипертонии - это одна из самых распространенных причин вторичной гипертонии. У пациентов с гиперальдостеронизмом заболеваемость и смертность от сердечно-сосудистых заболеваний выше по сравнению с пациентами с первичной артериальной гипертензией, которые имеют такой же порог артериального давления.
Поэтому первичный гиперальдостеронизм следует подозревать, если больной соответствует хотя бы 1 из 5 критериев. Перед проведением скринингового теста необходимо скорректировать уровень калия и натрия в крови, прекратить прием лекарств, способных повлиять на результаты исследования. После подтверждения диагноза проводится КТ органов брюшной полости, данные которой определяют дальнейшую тактику обследования и лечения.
Читайте также:
- Аллергические реакции, вызванные физическими упражнениями
- Эндометриоз
- Диагностика экзостозной хондродисплазии. Гемимелическая форма эпифизарной дисплазии
- Физиологический антагонизм лекарств. Оценка ответа на лекарство
- Укладка при рентгенограмме органов грудной клетки (ОГК) лежа на спине (передне-задней проекции)
