IgA-нефропатия у детей - эпидемиология, патогенез
Добавил пользователь Валентин П. Обновлено: 02.02.2026
Иммуноглобулин А (IgA) нефропатия впервые была описана в 1968 г Berger и Hinglais (1), и была определена как гломерулонефрит с преобладанием IgA среди иммуноглобулиновых депозитов в клубочках. Первоначально предполагалось, что IgA нефропатия является доброкачественным состоянием, в настоящее время известно, что в большинстве случаев заболевание прогрессирует до почечной недостаточности (2-4). Первичная IgA нефропатия может встречаться в любом возрасте, однако чаще всего заболевание возникает во второй-третьей декаде жизни (2,3,5). Практически все исследования демонстрируют, что заболевание чаще поражает лиц мужского пола, в соотношении 2:1 (6-9).
Клиника IgA нефропатии может варьировать от бессимптомного течения до агрессивного. У 30-40% пациентов наблюдается асимптомная микрогематурия с протеинурией либо без нее, и у ¼ этих пациентов периодически могут возникать эпизоды макрогематурии. Эти симптомы могут усиливаться при интеркуррентных инфекциях, особенно при инфекциях верхних дыхательных путей (10).
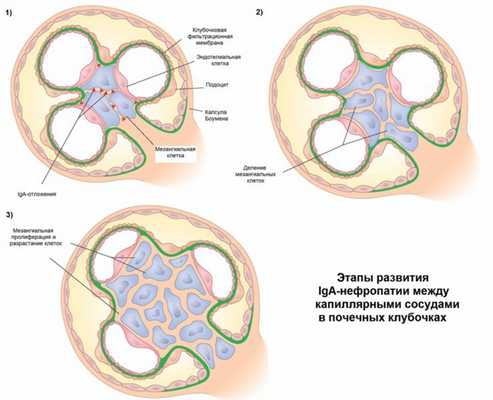
Гистологическая характеристика IgA нефропатии при световой микроскопии - расширение мезангиального матрикса и клеточная пролиферация (рис1). При иммунофлюоресцентной микроскопии наблюдаются депозиты IgA-иммунных комплексов (рис2). Также присутствуют отложения IgM, IgG1, IgG2, C3. При электронной микроскопии видны депозиты в мезангиальной зоне, которые могут распространяться в субэндотелиальные и субэпителиальные пространства капилляров (рис3) (11-13).
Основная функция системы IgA - предотвращать проникновение во внутреннюю среду организма различных микробных, пищевых и других антигенов окружающей среды (14). Известны 2 изотипных класса человеческого IgA: IgA1 и IgA2. Плазматические клетки пищеварительного и респираторного тракта продуцируют оба класса IgA. Плазматические клетки костного мозга, лимфатических узлов и селезенки продуцируют преимущественно IgA1 (15). Эти 2 субкласса IgA отличаются по устойчивости к расщеплению протеазами микроорганизмов, живущих в желудочно-кишечном и респираторном трактах (16). Также существует 2 аллотипа подкласса IgA - A2m(1) и A2m(2).
Большинство молекул IgA в сыворотке образуют типичные 4-х членные цепи с 2 тяжелыми и 2 легкими звеньями. Секреты организма содержат ди- и тетрамерные тяжелые цепи, связанные дисульфидными мостиками, формирующие многомерные структуры при присоединении гликопротеинов, образуемых в эпителиальных клетках. Таким образом, комплексная молекула IgA в секретах организма является продуктом 2 типов клеток - плазматических и эпителиальных (17).
Нарушение регуляции IgA.
Для возникновения IgA нефропатии недостаточно просто избыточного синтеза IgA. К примеру, у пациентов с IgA-секретирующей миеломой или с ВИЧ часто значительно повышен уровень IgA в сыворотке, однако IgA нефропатии у них развиваются редко (18,19).
Определенные наблюдения подтверждают, что IgA нефропатия ассоциирована с нарушением регуляции обмена IgA. Молекулы IgA, полученные из мезангиальных отложений, гомогенны по своему заряду, что может быть причиной их повышенного сродства к мезангию (20,21).
Было показано, что при IgA нефропатии происходит отложение как IgA1, так и IgA2 (21). Более недавние исследования демонстрируют, что IgA1 субкласс избирательно откладывается в мезангии (22-25), что может быть связано со структурными аномалиями молекулы иммуноглобулина. IgA1 - один из 2 подклассов иммуноглобулинов (другой - IgD), который подвергается О-гликозилированию с участием аспарагина, серина и треонина в специальной пролин-обогащенной шарнирной (hinge) области. Дефицицит этих веществ, возможно, приводит к полимеризации молекул IgA в тканях, особенно в мезангии клубочков.
Шарнирная (hinge) область человеческого IgA1 на тяжелой цепи - характерная особенность этой молекулы, она состоит из 18 аминокислот, расположенных между СН1 и СН2 доменами тяжелой цепи. Эти аминокислоты отсутствуют на IgA2. В недавних исследованиях были выявлены структурные и функциональные различия О-гликанов шарнирной области молекул IgA1, что может иметь роль в патогенезе IgA нефропатии(26-29). О-гликаны имеют анионный заряд, и они образуют массивные структуры на белковой части молекулы IgA1(30-31).
Ключевую роль в катаболизме IgA1 играет печеночный асиалогликопротеиновый рецептор, имеющий высокую степень сродства к О-гликану. Повреждение этого процесса может приводить к нарушению высвобождения IgА1 либо IgA-содержащих иммунных комплексов из кровотока, и, как следствие, отложение их в мезангии (32-33).
Более того, участок шарнира (hinge) О-гликозилирования находится под контролем лейкоцитарного фермента В1-3 галактозитранферазы. Недавние исследования показывают, что активность того фермента у пациентов с IgA нефропатией снижена (34-37).
Тромбоцитарный фактор роста вовлечен в пролиферацию мезангиальных клеток у пациентов с IgA нефропатией и другими клубочковыми заболеваниями (41). Трансформирующий фактор роста В (transforming growth factor B, TGF-B1) выступает как основной стимулятор роста соединительной ткани, присутствие которого приводит к гломерулосклерозу, интерстициальному фиброзу и атрофии канальцев (42,43), и почечная m-локализация TGF-B1 кореллирует с выраженностью тубулоинтерстициального повреждения у пациентов с IgA нефропатией (44).
IgA нефропатия у представителей негроидной расы.
Несмотря на высокую распространенность гломерулярных заболеваний у чернокожих, IgA нефропатия для них нехарактерна (45-46). Это может быть связано со структурными особенностями IgA2 у негроидов, а именно тем, что аллотип A2m(1) у европеоидов встречается чаще, чем у негроидов (47). Аллотип A2m(2) более устойчив к расщеплению, чем A2m(1), и, таким образом, негроиды, гомозиготные по A2m(2), возможно защищены от развития IgA нефропатии (48). Предполагается, что чернокожие пациенты с IgA нефропатией могут быть гомозиготны по A2m(1) аллели, преобладающей у белых (49). Однако, есть работы, свидетельствующие о том, что наличие аллели A2m(2) не предохраняет чернокожих от развития IgA нефропатии (49).
Заключение:
Во всем мире наиболее частой формой первичной гломерулярной патологии является иммунокомплексный гломерулонефрит, который может развиваться в любом возрасте, и чаще у лиц мужского пола. Пусковым моментом патогенеза заболевания являются вовлечение различных антигенов, нарушение иммунного ответа, как системного, так и со слизистых оболочек, возможно, модулированное множественными генетическими влияниями, формирование иммунных комплексов. Появляется все больше данных о том, что ведущую роль в патогенезе IgA нефропатии могут играть структурные аномалии молекулы IgA.
Рис1. Световая микроскопия клубочка демонстрирует пролиферацию мезангиальных клеток и расширение мезангиального матрикса.
Рис2. При иммунофлюоресцентной микроскопии обнаруживаются характерные отложения иммунных комплексов.
Рис 3. При электронной микроскопии выявляются массивные темные мезангиальные отложения.
Dialysis & Transplantation, том 35, №10,
октябрь 2006
Болезнь Берже ( IgA-нефропатия , Идиопатическая возвратная гематурия , Очаговый пролиферативный гломерулонефрит , Синфарингитная гематурия )
Болезнь Берже - это форма гломерулонефрита инфекционно-аутоиммунного характера, характеризующаяся мезангиопролиферативным воспалением с отложением иммунных комплексов. Клиническое течение сопровождается периодической макрогематурией вскоре после инфекционных заболеваний дыхательных путей, органов ЖКТ, изредка возможна постоянная микрогематурия, протеинурия, нефротический синдром с перемежающейся ОПН. Диагностика основывается на результатах лабораторных исследований мочи, иммунограммы крови, гистологического изучения биоптата почки. В лечении патологии используют симптоматическую терапию, иммуносупрессивные средства, антигипертензивные препараты.
Общие сведения
Болезнь Берже (IgA-нефропатия) также известна под названиями очаговый пролиферативный гломерулонефрит, синфарингитная гематурия или идиопатическая возвратная макрогематурия. Синонимические названия отражают разные черты патологии - пролиферативный характер воспаления почек, рецидивирующее развитие гематурии и ее связь с заболеваниями верхних дыхательных путей (фарингитом). Считается самым распространенным вариантом гломерулонефрита в мире - средняя частота встречаемости составляет 5 случаев на 100 тысяч населения, в азиатских странах регистрируется в 5-6 раз чаще, колеблется от 5 до 30% всех случаев воспаления почек. Мужчины страдают от синдрома Берже в несколько раз чаще женщин, среди заболевших преобладают лица в возрасте от 15 до 30 лет. Наблюдается некоторая сезонность обострений (увеличение в осенне-зимний период), что связано с большей частотой простудных заболеваний в холодное время года.
Причины
Болезнь Берже является патологией со сложной и многофакторной этиологией, включающей в себя ряд инфекционных, иммунологических и генетических особенностей организма. Достоверно доказана взаимосвязь заболевания с рядом бактериальных и вирусных инфекций, некоторыми аутоиммунными патологическими состояниями и определенными генетическими мутациями. Роль генетики в патогенезе состояния косвенно доказывают также особенности этнического и расового распространения болезни. Таким образом, выделяют следующие группы этиологических факторов:
- Инфекционные факторы. К ним относят разнообразные бактериальные и вирусные инфекции дыхательных путей, ЖКТ, кожи. У многих больных в анамнезе часто обнаруживаются ангины, гастрит, вирусный гепатит, герпесвирусная инфекция. Считается, что поражение почечной ткани при этих инфекциях обусловлено нетипичной иммунологической реакцией на антигены возбудителя.
- Иммунологические факторы. Патогенетическим субстратом состояния считается появление иммунных комплексов, которые не могут элиминироваться печенью и почками. Причиной их образования являются нарушения синтеза разных форм иммуноглобулина А, нетипичная реакция иммунитета на экзогенные (инфекционные, реже аллергенные) и эндогенные (опухолевые, клеточные) антигены.
- Генетические факторы. Этнические особенности распределения синдрома Берже обусловлены генетическими факторами. В частности, у больных обнаружены нетипичные мутации на 6-й хромосоме, изменения в генах, контролирующих синтез цепей главного комплекса гистосовместимости и рецепторов гепатоцитов. Выявлена повышенная частота развития патологии у лиц, имеющих некоторые наследственные заболевания - целиакию, галактоземию и ряд других.
Роль влияния внешних факторов является предметом обсуждения - возможно, они выступают причиной полиморфной клинической картины состояния. Употребление некоторых продуктов питания, характерных для азиатского региона (неочищенный рис, морепродукты), может усугублять течение нефропатии, что наряду с генетическими особенностями становится причиной более частой регистрации заболевания на этой территории. Роль сопутствующих патологий (артериальной гипертензии, воспалений мочевыводящих путей) в развитии болезни на сегодняшний момент не установлена.
Патогенез
В настоящее время известно несколько основных патогенетических сценариев развития IgA-нефропатии. При заболевании в крови возникают иммунные комплексы, содержащие полимерные формы иммуноглобулина А, которые обычно выделяются на слизистых оболочках и в ничтожном количестве встречаются в кровотоке. Выделение повышенных количеств полимерных разновидностей IgA обусловлено аномалиями их синтеза в костном мозге и нарушениями элиминации через печень по причине дефектов в рецепторах гепатоцитов. В конечном итоге единственным путем выведения иммуноглобулинов и связанных с ними антигенов становятся почки, но размер молекул слишком велик, поэтому они могут откладываться в клубочках нефронов.
Отложения иммунных комплексов в тканях почек активируют лейкоцитарную реакцию и систему комплемента, из-за чего возникает вялое диффузное воспаление с попаданием в мочу эритроцитов и незначительных количеств белка. Влияние факторов, активирующих синтез иммуноглобулинов (воспалительные реакции, инфекционные заболевания), приводит к попаданию больших количеств IgA в выделительную систему и усиливает иммунные реакции. Именно с этим связаны обострения IgA-нефропатии вскоре после перенесенных ангин, ларингитов, заболеваний ЖКТ, вирусных инфекций. Выраженность воспалительных проявлений в период обострения может быть высокой, способна приводить к преходящей острой острой почечной недостаточности. Скрытее и вялотекущие формы могут протекать бессимптомно длительное время, развитие ХПН в большинстве случаев занимает десятки лет.
Классификация
Болезнь Берже подразделяют на несколько клинических форм, которые характеризуются разной тяжестью проявлений, прогностическими данными и подходами к лечению. Разделение является условным - разновидности состояния могут перетекать одно в другое. Это дает повод некоторым исследователям рассматривать их как стадии развития единого патологического процесса, прогрессирующего под действием внешних и внутренних факторов. Значительные различия в скорости прогрессирования приводят к видимости существования различных форм нефропатии. В урологии и нефрологии выделяют три основные формы заболевания:
- Синфарингитная форма. Считается самой распространенной, проявляется периодическими обострениями, которые связаны с воспалительными заболеваниями дыхательных путей или желудочно-кишечного тракта (кишечная инфекция). Пик проявлений возникает через 1-2 дня после инфекционной патологии, их выраженность колеблется от макрогематурии и болей в пояснице до преходящей ОПН. В период между обострениями никаких клинических или лабораторных симптомов нефропатии не определяется.
- Латентная форма. Регистрируется примерно у трети больных, характеризуется менее выраженными симптомами, но считается более серьезной в прогностическом отношении. Обычно никаких субъективных проявлений не обнаруживается, признаки синдрома Берже выявляются при лабораторном исследовании мочи в виде слабой протеинурии и микрогематурии. Количество выделяемого с мочой белка постепенно увеличивается, фильтрующая способность почек уменьшается, что создает условия для развития ХПН.
- Нефротическая форма. Диагностируется у небольшого процента больных с IgA-нефропатией, сопровождается выраженной протеинурией, макрогематурией, онкотическими отеками, гиповолемией и гиперлипидемией. Крайне редко возникает первично, обычно становится осложнением синфарингитных и латентных форм заболевания.
Симптомы болезни Берже
Клинические проявления зависят от формы данного состояния. Самая распространенная синфарингитная гематурия характеризуется резким началом на 2-3 сутки после инфекционного заболевания - фарингита, ларингита, кишечной инфекции. Иногда пусковым фактором болезни Берже могут выступать вакцинации, тяжелые физические нагрузки, длительные инсоляции (солнечный загар, посещение солярия). Пациенты жалуются на боль и дискомфортные ощущения в области поясницы, моча становится красноватого оттенка (макрогематурия), ее количество уменьшается. В редких случаях регистрируются признаки ОПН - задержка мочи с последующей полиурией, нарушения водно-солевого обмена. У некоторых пациентов приступ сопровождается повышением уровня артериального давления. Чаще всего при синфарингитной форме IgA-нефропатии почечная функция полностью восстанавливается через несколько дней или недель.
Латентная разновидность болезни характеризуется скрытым течением с практически полным отсутствием симптомов поражения почек. В анализе мочи определяются патологические изменения - выделение белка и небольших количеств крови. У ряда больных имеются жалобы на боли в мышцах, суставах, периодические отеки. Со временем при отсутствии лечения такая форма заболевания ведет к развитию хронической почечной недостаточности. Нефротическая форма, напротив, характеризуется выраженной клинической картиной - нефротическим синдромом с резкими отеками тела, развитием асцита, признаками обезвоживания по причине потери жидкости с мочой.
Осложнения
Основным и самым распространенным осложнением IgA-нефропатии является почечная недостаточность. Острые формы (ОПН) могут возникать при приступе синфарингитных разновидностей и иногда при нефротическом типе заболевания. Хроническая почечная недостаточность развивается медленно, регистрируется в течение 15 лет примерно у половины больных. Среди прочих осложнений нефропатии выделяют риски развития гиповолемического шока, нефротического криза, тромбозов на высоте приступа болезни. Отсутствие комплексного лечения во много раз повышает риск возникновения почечной недостаточности и других осложнений нефропатии.
Диагностика
В нефрологии определение патологии Берже производится на основании результатов общего осмотра пациента, сбора анамнеза, лабораторных данных (общих, биохимических и иммунологических показателей крови и мочи). Кроме того, в спорных случаях может быть назначено гистологическое исследование почек, цистоскопия, рентгенографические методы диагностики - в основном, для исключения других заболеваний. Осложняют диагностику патологии такие обстоятельства, как рецидивирующее течение синфарингитных форм (в период ремиссии проявления нефропатии практически не обнаруживаются) и отсутствие явной симптоматики при наличии латентных разновидностей. Все диагностические мероприятия при нефропатии разделяют на группы:
- Физикальный осмотр и сбор анамнеза. При расспросе пациента обращают внимание на частоту аллергических и инфекционных состояний в прошлом, пытаются найти их взаимосвязь с почечными проявлениями (гематурией, болью в пояснице). Нефротические типы нефропатии характеризуются наличием отеков, увеличением живота из-за асцита, симптомами почечной недостаточности.
- Лабораторные исследования крови. Изменения в общем анализе крови незначительные - при остром приступе возможно увеличение СОЭ, нерезко выраженный лейкоцитоз, повышение гематокрита. Биохимические показатели изменяются сильнее - увеличивается уровень глобулинов крови, креатинина (из-за нарушенной фильтрации в почках), при развитии нефротического синдрома возникает гипоальбуминемия и гиперлипидемия. Иммунологическое исследование крови указывает на рост уровня IgA и небольшое снижение фракций комплемента.
- Лабораторные исследования мочи. При синфарингитном типе патологии в моче отмечается макрогематурия, протеинурия до уровня 1-2 г/л, иммунологическое исследование обнаруживает наличие комплексов на основе IgA и незначительное количество компонентов комплемента (С3). Латентный вариант болезни Берже проявляется слабо выраженной протеинурией (до 0,3 г/л), наличием выщелоченных эритроцитов в моче.
- Инструментальная диагностика. УЗИ почек часто не выявляет специфических изменений на начальных этапах заболевания, лишь при длительном течении можно обнаружить незначительное уменьшение размеров органа. В основном УЗИ и УЗДГ почек применяются для дифференциальной диагностики. Экскреторная урография указывает на задержку контраста по причине пониженной фильтрационной способности.
- Гистологическое изучение.Биопсия почек с гистологическим исследованием материала является наиболее точным методом диагностики IgA-нефропатии. Обнаруживаются признаки воспаления в мезангиальном пространстве, гистохимическими методами в нем выявляются отложения иммунных комплексов.
Дифференциальную диагностику IgA-нефропатии проводят с другими формами нефропатии, мочекаменной болезнью, онкологическими поражениями органов мочевыделительной системы. Для этого больным назначают цистоскопию, рентгенологические и ультразвуковые исследования, определяют уровень уратов в биохимическом анализе крови. Вспомогательную роль в диагностике нефропатии играет выявление заболеваний, способных спровоцировать поражение почек - воспаления миндалин, гепатитов, кишечных инфекций.
Лечение болезни Берже
Этиотропное специфическое лечение не разработано, врачами-нефрологами используется симптоматическая, нефропротективная и поддерживающая терапия. При развитии почечной недостаточности показано назначение гемодиализа по показаниям. Трансплантация почек, применяющаяся в исключительных случаях, не является эффективным методом лечения - примерно у каждого второго больного в пересаженном органе развиваются аналогичные изменения. Это говорит о преимущественно экстраренальных причинах патологии. Наиболее часто при лечении заболевания используют следующие методы:
- Нефропротективная терапия. Применяют препараты, снижающие артериальное давление (ингибиторы АПФ, блокаторы ангиотензиновых рецепторов) и антиагреганты (дипиридамол). Помимо лекарственных средств для снижения нагрузки на выделительную систему рекомендуют поддержание оптимального водного режима, ограничение потребления поваренной соли.
- Антибактериальная терапия. Назначается в тех случаях, когда точно доказана взаимосвязь между нефропатией и наличием очага бактериальной инфекции (при синфарингитных формах). Выбор антибиотика и схема его приема зависят от характера возбудителя, что определяется при дополнительной диагностике. Иногда применяют метод удаления инфекционного очага (тонзиллэктомию).
- Противовоспалительная терапия. С этой целью назначают глюкокортикостероидные средства (преднизолон и его аналоги). Их используют при всех формах данной нефропатии, дозировка зависит от выраженности протеинурии, которая отражает степень повреждения почек.
- Иммуносупрессивная терапия. Применение цитостатиков и других иммуносупрессоров показано при тяжелых случаях и выраженном иммунологическом повреждении органов выделительной системы. Их включают в комплексную терапию нефротических форм болезни Берже.
В зависимости от наличия других симптомов повреждения почек и экстраренальных проявлений больным также показана инфузионная терапия, статины (для уменьшения уровня липидов крови), гипотензивные средства. Важен отказ от вредных привычек - курения, употребления алкоголя. Во избежание провоцирования приступа гематурии следует избегать физических нагрузок, длительного нахождения под солнцем.
Прогноз и профилактика
Прогноз болезни Берже неопределенный, зависит от показателей конкретного больного. По статистике, в течение 16-20 лет приблизительно у 30-50% пациентов развивается ХПН, но ее прогрессирование крайне медленное и доброкачественное. При правильном соблюдении предписаний врача и поддерживающей терапии качество жизни больных сохраняется на высоком уровне. Методы профилактики патологии не разработаны, некоторые специалисты рекомендуют своевременное полноценное лечение хронических инфекций (воспаления миндалин и других), но достоверных данных, что эти меры позволяют избежать синфарингитной нефропатии, нет. Профилактические мероприятия (водный режим, ограничение соли, исключение вредных привычек) дают возможность существенно замедлить прогрессирование повреждения почек.
Клинические рекомендации Нефротический синдром у детей
В данных клинических рекомендациях новые и узконаправленные термины не используются.
1. Краткая информация
1.1. Определение
- клинико-лабораторный симптомокомплекс, характеризующийся протеинурией (>50 мг/кг/сут или > 40 мг/м 2 /час, т.е. 2,5 г/сут и более), гипоальбуминемией (
1.2. Этиология и патогенез
Нефротический синдром может быть первичным (при изолированном поражении почек) и вторичным (в составе системных заболеваний, на фоне инфекций). Выделяют также нефротический синдром, связанный с генетической патологией. Основной механизм возникновения - увеличение проницаемости клубочкового фильтра для белка вследствие функционального или структурного повреждения. В результате потери белка с мочой развивается гипопротеинемия и гипоальбуминемия, ведущие к падению онкотического давления плазмы с развитием отеков. Нефротический синдром у большинства детей является идиопатическим.
Патогенез протеинурии при идиопатическом нефротическом синдроме с минимальными изменениями, наиболее часто встречающимся у детей, до конца не изучен. Наиболее признана гипотеза о повышении гломерулярной проницаемости для белков плазмы в результате воздействия циркулирующих факторов на капилляры гломерул и повреждение «щелевых» диафрагм между отростками подоцитов. Предполагается, что активированные Т-лимфоциты продуцируют лимфокины, которые влияют на проницаемость гломерул для белков плазмы и вызывают протеинурию. [1],[2],[3],[4]
1.3. Эпидемиология
Ежегодная частота возникновения нефротического синдрома составляет 2-7 первичных случаев на 100 000 детского населения, распространённость у детей - 12-16 случаев на 100 000 детской популяции [2].
1.4. Кодирование по МКБ-10
Нефротический синдром (N04):
- Нефротический синдром с незначительными гломерулярными нарушениями
- Нефротический синдром при очаговых и сегментарных гломерулярных повреждениях
- Нефротический синдром при диффузном мембранозном гломерулонефрите
- Нефротический синдром при диффузном мезангиальном пролиферативном гломерулонефрите
- Нефротический синдром при диффузном эндокапиллярном пролиферативном гломерулонефрите
- Нефротический синдром при диффузном мезангиокапиллярном гломерулонефрите
- Нефротический синдром при болезни плотного осадка
- Нефротический синдром при диффузном серповидном гломерулонефрите
- Нефротический синдром с другими изменениями
- Нефротический синдром с неуточненным изменением
1.5. Примеры диагнозов
Идиопатический нефротический синдром, стероидрезистентный вариант, активная стадия. Хроническая болезнь почек 1 стадия. Морфологический диагноз: фокально-сегментарный гломерулосклероз.
Идиопатический нефротический синдром, стероидзависимый вариант, стадия клинико-лабораторной ремиссии. Хроническая болезнь почек 1 стадия. Морфологический диагноз: болезнь минимальных изменений.
Идиопатический нефротический синдром, стероидчувствительный вариант, часто рецидивирующее течение, стадия клинико-лабораторной ремиссии. Хроническая болезнь почек 1 стадия.
1.6. Классификация
НС подразделяют на идиопатический (первичный) и вторичный.
Идиопатический НС развивается при заболеваниях собственно клубочков почек.
Вторичный НС вызывается многочисленной группой различных заболеваний, которые обуславливают формирование специфической нефропатии (Наследственные заболевания (поликистоз почек, синдром Альпорта, спондилоэпифизарная дисплазия, болезнь Фабри, синдром Марфана и пр.); ревматические болезни (системная красная волчанка, системная склеродермия, дерматомиозит, ревматоидный артрит, ревматизм); системные васкулиты (геморрагический васкулит, узелковый полиартериит, гранулематоз Вегенера); гемолитико-уремический синдром; рефлюкс-нефропатия; амилоидоз почек; сахарный диабет; болезни крови (лимфогранулематоз, смешанная криоглобулинемия, миеломная болезнь, серповидно-клеточная анемия, талассемия); тромбозы вен и артерий почек, аорты или нижней полой вены; опухоли различной локализации; лекарственное поражение почек (препараты висмута, золота, противоэпилептические препараты и др.); болезни вирусной этиологии (гепатит B и C, цитомегаловирусная инфекция, ВИЧ-инфекция); болезни бактериальной этиологии (септический эндокардит; пневмония, абсцессы, бронхоэктазы, остеомиелит; туберкулёз, сифилис).
В зависимости от ответа на стандартный курс терапии преднизолоном нефротический синдром принято делить на стероидчувствительный и стероидрезистентный.
Стероидчувствительный НС - как правило, это дети с болезнью минимальных изменений (БМИ); ремиссия достигается в течение 2-4 недель, еще у части пациентов - к 6-8 неделе и только у 4% - через 12 недель от начала лечения:
— стероидчувствительный, нерецидивирующий после однократного курса стероидной терапии с достижением полной длительной ремиссии;
— стероидчувствительный, нечасто рецидивирующий - после достижения ремиссии по окончанию первого курса стероидной терапии рецидивы отмечаются реже, чем 2 раза в 6 месяцев;
— стероидчувствительный, часто рецидивирующий - после достижения ремиссии рецидивы - не реже 2 раз в 6 месяцев;
— стероидчувствительный стероидзависимый - рецидив развивается при снижении дозы преднизолона или не позднее, чем через 2 недели после отмены препарата;
2. Диагностика
2.1. Жалобы и анамнез
Жалобы на появление отеков и уменьшение количества мочи. Первым клиническим симптомом, заметным для больного и окружающих, являются отеки. Они могут развиться постепенно или же стремительно, достигнув степени анасарки. [1],[2],[3],[4].
2.2. Физикальное обследование
Периферические отеки выявляются в области век, лица, поясничной области и половых органов, могут распространяться на всю подкожную клетчатку, растягивая кожу до образования striae distensae. В это время у больных могут образовываться транссудаты в серозные полости: одно- или двусторонний гидроторакс, асцит, гидроперикард; возможно развитие отека легких.
При обследовании пациента обязательно рекомендуется измерение артериального давления, которое может быть повышено у детей с активной стадией нефротического синдрома. [1],[2],[3],[4]
(Сила рекомендации 1; уровень доказательств B)
2.3. Лабораторная диагностика
Рекомендуется определение белка в общем анализе мочи [1],[2].
(Сила рекомендации 1;уровень доказательств B)
Рекомендуется определение суточной экскреции белка с мочой [1],[2].
(Сила рекомендации 2; уровень доказательств A)
Комментарий: диагностически значимой для нефротического синдрома является протеинурия >50 мг/кг/сут или >40 мг/м 2 /сут, т.е. 2,5 г/сут и более. При невозможности определения суточной экскреции белка для уточнения степени протеинурии может быть использовано определение отношения уровня экскретируемого белка к креатинину в разовой порции мочи. Этот коэффициент достоверно коррелирует с уровнем суточной протеинурии/1,73м 2 .
Рекомендуется определение эритроцитов и лейкоцитов в анализе мочи [1],[2].
(Сила рекомендации 1; уровень доказательств D)
Комментарий: Гематурия не характерна для нефротического синдрома, но может сопровождать его, являясь признаком пролиферативных вариантов гломерулонефрита, наследственного нефрита и т.д., может быть разной степени выраженности - от умеренной до макрогематурии, лейкоцитурия также могут присутствовать у детей с нефротическим синдромом (см. раздел дифференциальный диагноз).
Рекомендовано проведение биохимического анализа крови (общий белок, альбумин, холестерин, креатинин, натрий, калий, кальций) [1],[2]:
Комментарии: Для нефротического синдрома характерны:
— гипопротеинемия: общий белок крови снижается до 40-30 г/л.
— гиперлипидемия: наиболее характерно повышение содержания в сыворотке крови холестерина, триглицеридов, а также дислипопротеинемия.
При исследовании биохимического анализа крови следует обращать внимание на уровень креатинина (может быть повышен), что является следствием гиповолемии при нефротическом синдроме, снижение уровня электролитов (гипонатриемия, гипокальциемия).
Рекомендовано исследование коагулограммы (фибриноген, уровень антитромбина III в сыворотке крови).
Комментарий: при нефротическом синдроме может повышаться уровень фибриногена, снижаться уровень антитромбина III.
Рекомендовано исследование общего анализа крови [1],[2].
Комментарий: высокая СОЭ является признаком активности нефротического синдрома и гипопротеинемии. Лейкоцитоз может быть следствием как приема кортикостероидных препаратов, так и проявлением бактериальной инфекции, которая часто осложняет течение нефротического синдрома. При почечной недостаточности может развиваться анемия.
2.4. Инструментальная диагностика
Рекомендовано измерение АД, в том числе суточное мониторирование АД, при наличии показаний [1,2].
(Сила рекомендаций 1; уровень доказательств С)
Рекомендовано проведение Эхо-КГ для оценки морфометрических параметров сердца и крупных сосудов при отеках, артериальной гипертензии, для выявления гидроперикарда [1],[2].
Рекомендовано проведение ЭКГ для выявления признаков возможных электролитных нарушений [1],[2].
Рекомендовано проведение ультразвукового исследования (УЗИ) почек (с допплерографией внутрипочечных сосудов) [1],[2].
Рекомендовано проведение денситометрии поясничного отдела позвоночника или рентгенографии трубчатых костей при длительной терапии глюкокортикостероидами для оценки степени деминерализации костной ткани [1],[2].
Рекомендовано проведение пункционной биопсии почки по показаниям с последующей световой, и, при необходимости, иммунофлюоресцентной и электронной микроскопией почечной ткани для уточнения морфологии ее повреждения [1],[2].
Комментарий: Показания к биопсии почки при нефротическом синдроме:
— стероидрезистентность нефротического синдрома (первичная и вторичная);
— НС у детей младше 1 года и старше 12 лет;
— через 2,5-3 года после начала лечения ингибиторами кальциневрина или при снижении функции почек на фоне этой терапии.
2.5. Иная диагностика
Для уточнения генеза нефротического синдрома рекомендовано назначение дополнительных лабораторных исследований [1],[2]:
вирусологические исследования: маркеры вирусов гепатита В, С (при подозрении на вторичный гломерулонефрит, связанный с хроническими гепатитами);
иммунологическое исследование крови при подозрении на системные заболевания: анти-ДНК, антинуклеарный фактор (АНФ), С3-фракция комплемента, криоглобулины;
исследование уровня Антистрептолизина-О (АСЛ-О) в крови при подозрении на острый постинфекционный гломерулонефрит,
молекулярно-генетическое исследование при стероидрезистентном нефротическом синдроме для определения мутации генов нефрина (NPHS1) и подоцина (NPHS2).
(Сила рекомендации 2; уровень доказательности B)
2.6. Дифференциальный диагноз
Проводится между гломерулопатиями, которые могут быть причиной нефротического синдрома.
Болезнь минимальных изменений (БМИ) - наиболее частая причина идиопатического нефротического синдрома у детей.
Фокально-сегментарный гломерулосклероз (ФСГС) - одна из основных форм стероидрезистентного идиопатического нефротического синдрома, составляет 10-18% случаев среди всех детей с идиопатическим нефротическим синдромом и 45% в целом в структуре стероидрезистентного нефротического синдрома. Диагноз ФСГС устанавливается по результатам биопсии почки.
Быстро-прогрессирующий гломерулонефрит морфологически характеризуется формированием полулуний более чем в 50 % клубочков. Клинически заболевание проявляется прогрессированием до конечной стадии хронической почечной недостаточности в течение от нескольких недель до нескольких месяцев.
Мембранопролиферативный (мезангиокапиллярный) гломерулонефрит (МПГН) нечастое заболевание у детей, более характерно для подросткового возраста. Нефротический синдром носит стероидрезистентный характер, в большинстве случаев сочетается с гематурий и гипокомплементемией. Выделяют 2 типа МПГН, различающиеся электронно-микроскопически и механизмом активации комплемента.
IgA-нефропатия - мезангиопролиферативный гломерулонефрит с преимущественным отложением IgA, выявляемым при иммунофлюоресцентной микроскопии. Проявляется, в основном, микрогематурией с протеинурией разной степени выраженности. Характерны эпизоды макрогематурии на фоне острых респираторных инфекций.
Мембранозная нефропатия - частая причина идиопатического нефротического синдрома у взрослых (до 50% случаев). У детей наиболее часто встречается вторичная мембранозная нефропатия при системной красной волчанке (СКВ), вирусном гепатите В, сифилисе, малярии.[1],[2],[3],[4]
Хронический нефритический синдром у детей
Хронический нефритический синдром характеризуется микро/макрогематурией, умеренной протеинурией (до 1 г/сутки), плотными отеками, гипертензией [1]. Это большая группа первичных и вторичных гломерулонефритов.
Название протокола: Хронический нефритический синдром у детей
Код протокола:
Коды по МКБ-10:
N03 Хронический нефритический синдром
N03.0 Незначительные гломерулярные нарушения
N03.1 Очаговые и сегментарные гломерулярные повреждения
N03.2 Диффузный мембранозный гломерулонефрит
N03.3 Диффузный мезангиальный пролиферативный гломерулонефрит
N03.4 Диффузный эндокапиллярный пролиферативный гломерулонефрит
N03.5 Диффузный мезангиокапиллярный гломерулонефрит
N03.6 Болезнь плотного осадка
N03.7 Диффузный серповидный гломерулонефрит
N03.8 Другие изменения
N03.9 Неуточненное изменение
Сокращения, используемые в протоколе:
АД - артериальное давление
АНА - антинуклеарные антитела
АНЦА - антинейтрофильные цитоплазматические антитела
АЛТ - аланинаминотрансфераза
Анти-ГБМ - антитела к гломерулярной базальной мембране
АСТ - аспаратаминотрансфераза
АЧТВ - активированное частичное тромбопластиновое время
БРА - блокатор рецепторов ангиотензина
ВИЧ - вирус иммунодефицита человека
ВН - волчаночный нефрит г - грамм
ГН - гломерулонефрит
ДНК - дезоксирибонуклеиновая кислота
иАПФ - ингибитор ангиотензинпревращающего фермента
ИФА - иммуноферментный анализ
ЛПВП - липопротеины высокой плотности
ЛПНП - липопротеины низкой плотности
мг - миллиграмм
МЕ - международные единицы
МКБ - Международная классификация болезней
мл - миллилитр
ММФ - мофетила микофенолат
МНО - международное нормализованное отношение
МПГН - мембранопролиферативный гломерулонефрит
ПВ - протромбиновое время
ПТИ - протромбиновый индекс
ПЦР - полимеразно-цепная реакция
С3ГН - С3-комплемент-связанный гломерулонефрит
СКФ - скорость клубочковой фильтрации
СОЭ - скорость оседания эритроцитов
СРБ - С-реактивный белок
УЗДГ - ультразвуковая допплерография
УЗИ - ультразвуковое исследование
ХБП - хроническая болезнь почек
ЭКГ - электрокардиограмма
ЭНА - антитела к экстрагируемому нуклеарному антигену
эхоКГ - эхокардиограмма
ANA - (anti-nuclear antibody) антинуклеарные антитела (АНА)
ANCA - (anti-neutrophilic cytoplasmic antibody) антинейтрофильные цитоплазматические антитела (АНЦА)
сANCA/PR3 - цитоплазматические АНЦА/антитела к протеиназе 3
С3ГН - С3-комплемент-связанный гломерулонефрит
ENA - (extractable nuclear antigen antibodies) антитела к экстрагируемому нуклеарному антигену (ЭНА)
Нв - гемоглобин
IgA - иммуноглобулин А
IgМ - иммуноглобулин М
IgG - иммуноглобулин G
K/DOQI - (Kidney Disease Outcomes Quality Initiative) инициатива качества лечения заболевания почек
рANCA/MPO - перинуклеарные АНЦА/антитела к миелопероксидазе
Дата разработки протокола: 2014 год.
Категория пациентов: дети с хроническим нефритическим синдромом.
Пользователи протокола: врачи общей практики, педиатры, нефрологи.
Болезнь Берже — IgA нефропатия
Член EAU (Европейская Ассоциация Урологов). Стаж работы +17 лет. Принимает в Университетской клинике. Цена приема — 2000 руб.
- Запись опубликована: 02.12.2019
- Reading time: 3 минут чтения
IgA нефропатия, также известная как болезнь Берже, — наиболее распространенная форма гломерулонефрита. Встречается у пациентов всех возрастов, но чаще поражает мужчин в возрасте от 15 до 30 лет.
Клиническая картина состоит в основном из гематурии или рецидивирующей гематурии. Течение заболевания зависит от индивидуальных особенностей пациента. У 20% пациентов развивается терминальная стадия почечной недостаточности, связанная с необходимостью диализа.
Результаты исследований, проведенных Американским обществом нефрологов, показали, что IgA-нефропатия (Болезнь Берже), поражающая почки, уменьшает продолжительность жизни в среднем на 6 лет и увеличивает смертность.
Почему возникает болезнь Берже и чем она опасна
Болезнь Берже или IgA-нефропатия — поражение почек, вызванное отложением иммуноглобулинов, нарушающих почечную функцию. Эти вещества, выделяемые иммунной системой для защиты организма, в данном случае, вредят.
Чаще всего болезнь возникает после инфекций. В этом случае значительно увеличивается количество иммуноглобулинов, предназначенных для борьбы с возбудителями. Поэтому заболевание зачастую развивается после ангин, простуд, ларингитов, инфекций желудочно-кишечного тракта.
В пищеварительной системе доминирующим причинным фактором является популярная кишечная палочка. В дыхательной системе — главным образом — стрептококки и вирусы гриппа.
IgA нефропатия может также появляться в ходе аутоиммунных заболеваний, чаще всего болезнь Берже провоцируют:
- гепатит В;
- глютеновая болезнь;
- саркоидоз;
- псориаз;
- анкилозирующий спондилит;
- ревматоидный артрит;
- реактивный артрит;
- воспаления кишечника;
- СПИД.
При болезни Берже костный мозг начинает вырабатывать слишком крупные полимерные молекулы иммуноглобулина А. Из-за своего размера такие соединения не могут пройти через печень, чтобы выделиться из организма. Печеночные клетки - гепатоциты не в состоянии распознать и переработать «неправильные» иммуноглобулины, чтобы удалить их.
Поэтому единственным путем выведения иммуноглобулинов А становятся почки. Однако из-за большого размера IgA ” застревают” в нефронах - почечных структурах, которые фильтруют мочу.
Поскольку глобулины относятся к биологически активным веществам, попав в почечную ткань, они вызывают ее воспаление, приводя к кровотечениям. У больного возникает гломерулонефрит - инфекционно аллергическое поражение почек, нарушающее их функцию.
Болезнь Берже постепенно прогрессирует, приводя к почечной недостаточности. Больных приходится переводить на гемодиализ - «искусственную почку».
Формы и симптомы болезни Берже
По происхождению выделяют две формы болезни Берже:
- Идиопатическая IgA-нефропатия обусловлена нарушениями в выработке иммуноглобина А на слизистых оболочках пищеварительной и дыхательной систем.
- Вторичная нефропатия сопровождает другие заболевания, такие как целиакия, ревматоидный артрит, саркоидоз, СПИД, гепатит В, воспалительные заболевания кишечника.
По симптомам и тяжести протекания IgA нефропатия делится на следующие формы:
- Синфарингитная - форма, обостряющаяся на фоне простуд, ларингитов, фарингитов. У больного появляется гематурия - кровь в моче. Иногда выделение крови бывает обильным. Гематурия сопровождается болью в пояснице, повышением температуры, отеками. В период между простудами симптомов не возникает.
- Латентная (скрытая) - опасная форма болезни, при которой примеси крови в моче незаметны. Проявляется небольшими болями в мышцах, пояснице, суставах, слабо выраженными отеками. Несмотря на скудость проявлений, она также приводит к почечной недостаточности.
- Нефротическая - тяжёлая форма, сопровождающаяся выделением с мочой крови, белка, обширными отёками, потерей жидкости. Часто является осложнением других форм заболевания.
Диагностика заболевания
Для выявления IgA-нефропатии урологи рекомендуют все всем переболевшим ларингитом, ангиной, простудными заболеваниями обязательно сдать анализы мочи. При болях в пояснице, отёчности и слабости, возникших на фоне простуд, нужно записаться на консультацию к урологу, исследовать кровь на биохимические показатели и пройти УЗИ почек.
Первый признак заболевания — наличие крови в моче, обнаруженной во время общих анализов мочи. Но чтобы поставить окончательный диагноз необходима более широкая диагностика. На данный момент единственный верный способ диагностики этого типа гломерулонефрита — иммунофлюоресцентный анализ IgA, обнаруживаемых в почечных клубочках.
Чтобы определить причину проблем, назначается биопсия почки — взятие образца тканей почки для гистопатологического исследования.
Болезнь Берже повышает риск летального исхода от различных причин
Исследователи из Университетской клиники Эребру в Швеции сравнили 3622 пациента с этим заболеванием с 18 041 здоровыми людьми, подобранными по возрасту и полу. У всех больных IgA-нефропатией риск смертности был повышен на 53%, а продолжительность жизни была меньше на 6 лет.
Самая высокая смертность наблюдалась в первый год после постановки диагноза. Среди причин лидировали сердечно-сосудистые осложнения. Больные умирали от них на 59% чаще по сравнению с пациентами, не имеющими такой патологии.
Однако исследование выявило одну достаточно интересную особенность - большинство пациентов погибали только после начавшейся некорректируемой почечной недостаточности. Поэтому главным было правильное лечение, позволяющее как можно дольше сохранить функцию почек.
Во время исследования обнаружилось, что кровные родственники таких пациентов в 3 раза чаще болеют тяжёлыми заболеваниями почек. Поэтому при наличии родственника больного IgA нефропатией, нужно контролировать показатели анализов мочи, сдавать кровь на биохимию и периодически проходить УЗИ почек. Это позволит выявить почечные патологии на раннем этапе, чтобы вовремя начать их лечение.
Специфического лечения не разработано. Больным назначают препараты, снимающие симптомы воспаления, выводящие лишнюю жидкость, устраняющие отеки. Показаны гормоны, противовоспалительные средства. Для борьбы с сопутствующими инфекциями применяются антибиотики.
Показана диета с исключением соли, копчёных, пряных, острых блюд. Запрещаются курение и алкоголь., Больным нельзя долго время находиться на солнце, чтобы не провоцировать новое появление крови в моче. Следует максимально избегать переохлаждений и простуд.
Продолжительность жизни при IgA нефропатии зависит от полноты и своевременности проведенного лечения, а также от соблюдения больным рекомендаций по образу жизни и диете. Факторы ухудшающие прогноз: гипертония, протеинурия, повышенный уровень креатинина в сыворотке.
Читайте также:
- Подогрев воздуха в общей приточной вентиляции. Рециркуляция
- Показания для реконструкции локтевой коллатеральной связки с использованием модифицированной техники Jobe
- Потребности человека в пирамиде Маслоу
- Причины, частота, диагностика и лечение кровотечения из носа. Сосудистое сплетение Киссельбаха
- Рентгенограмма, КТ, МРТ артропатии дугоотростчатых суставов шейного отдела позвоночника
