История химиотерапии онкологических заболеваний (рака)
Добавил пользователь Валентин П. Обновлено: 22.01.2026
Одна из основных статей расходов нашего фонда — покупка лекарств противоопухолевой терапии. Так, за 2017 год расходы на их покупку для клиник составили более 313 миллионов рублей — и это не считая адресной помощи.
Дело в том, что противоопухолевая терапия — очень динамично развивающаяся отрасль. Ежегодно в арсенале онкологов и онкогематологов возникают новые лекарства. Какие-то из них позволяют излечивать тех больных, которым раньше ничто не помогало. Какие-то не излечивают полностью, но существенно продлевают жизнь и улучшают ее качество. И почти все новые лекарства, увы, очень дороги. Потом они становятся более доступными, но на рынок выходят новые препараты, которые могут спасти новых пациентов. И вновь это очень дорогостоящие лекарства. Но их цена — это цена многих жизней.
При этом интересно, что химиотерапия — сравнительно молодая область. До начала XX века основным и фактически единственным инструментом онколога был скальпель хирурга. Чуть больше ста лет назад появился еще один метод — лучевая терапия. Но лишь с появлением химиотерапии многие онкологические заболевания из смертельных стали излечимыми или хорошо контролируемыми.
Может быть, пора оглянуться назад и посмотреть, какой огромный путь прошла лекарственная терапия онкологических заболеваний за последние 70 с лишним лет. И как врачи-исследователи, переходя от надежды к отчаянию и снова к надежде, одерживали победы над опухолями с 40-х годов XX века и до наших дней.
1. Рождение химиотерапии
Есть красивая легенда о том, как возникла идея химиотерапии. Эта легенда связана с известным событием Второй мировой войны: в 1943 году немецкая авиация разбомбила военные суда союзников в гавани итальянского города Бари. Бомбардировке подвергся и транспорт с грузом иприта — известного боевого отравляющего вещества. Из-за утечки иприта пострадали или погибли тысячи людей. Медики, обследуя пострадавших, заметили, что у них резко снижено число лейкоцитов, особенно лимфоцитов. И якобы именно это наблюдение подвигло ученых на то, чтобы изучать применение аналогов иприта для лечения таких опухолей, как лимфомы.
В действительно все было не так. Исследования противоопухолевой активности производных иприта уже велись ко времени бомбардировки Бари. Но это были секретные разработки, и первые результаты были опубликованы только в 1946 году. Американские химики Альфред Гилман и Луи Гудмен синтезировали препарат «Эмбихин», успешно испытали его на мышах, а затем и на человеке с лимфомой, добившись несомненного (но, увы, недолгого) улучшения. Сейчас этот высокотоксичный препарат практически не применяется, но свою роль он сыграл: впервые было показано, что химическое вещество может тормозить развитие опухоли, и это вызвало огромный интерес медиков и химиков.
2. Сидни Фарбер и его роль
Несмотря на открытие Гилмана и Гудмена, основоположником современной химиотерапии считают другого человека — американского педиатра Сидни Фарбера. Он основал Фонд исследований рака у детей и вел систематические исследования эффективности различных препаратов. Вероятно, самым известным достижением Фарбера явился препарат «Метотрексат», синтезированный по его просьбе гениальным химиком Суббарао: это лекарство, которое до сих пор является одним из ключевых химиопрепаратов, впервые позволило добиться ремиссии (исчезновения признаков болезни) при самом распространенном онкозаболевании у детей — остром лимфобластном лейкозе. Более того, разработка «Метотрексата» была основана на очень важной концепции, которая впоследствии позволила изобрести еще несколько противоопухолевых лекарств: его действие основано на том, что он очень похож на вещество, необходимое для деления клеток при этом варианте лейкоза, и позволяет «обмануть» делящиеся клетки, что приводит к их гибели.
3. Новые препараты. Оптимизм и пессимизм
В 50-е и начале 60-х годов XX века велся широкий поиск, и именно тогда появились многие противоопухолевые лекарства, которые хорошо нам знакомы и по сей день. Так, исследование противоопухолевого действия антибиотиков привело к открытию «Космегена», изучение растительных препаратов — к открытию «Винкристина». Были синтезированы и испытаны «Меркаптопурин», «Тиогуанин», «Фторурацил», «Цитозар» и другие лекарства. Бурный интерес к новой области привел и к росту финансирования: противораковой терапией заинтересовались и государства, и филантропы.
Однако, несмотря на многочисленные достижения, врачи в то время все более скептически смотрели на перспективы химиотерапии. Ни одно из лекарств не могло дать полного излечения: практически у всех пациентов болезнь через некоторое время «приспосабливалась» к препарату, возвращалась и оказывалась фатальной. И многие специалисты считали, что новые лекарства лишь продлевают мучения больных… Тем более что эти лекарства очень тяжело переносились: ведь побочные эффекты химиотерапии всем известны.
4. Полихимиотерапия. Первые выжившие
Прорыв произошел в 1965 году. Он был связан с именами трех врачей и исследователей — Эмиля Фрая, Эмиля Фрайрайха и Джеймса Холланда. Именно они впервые предположили, что для повышения эффективности лечения можно и нужно использовать сразу несколько лекарств с разными механизмами действия — тогда опухоли труднее будет к ним приспособиться.
Эта идея шла вразрез со всеми тогдашними представлениями: если пациент тяжело переносит один токсичный препарат, как можно давать ему сразу три или четыре? Но терять было нечего: лейкозы и лимфомы в те времена были абсолютно смертельными заболеваниями. И первые пациенты получили терапию сразу несколькими лекарствами — то, что сейчас называется полихимиотерапией. Еще одна идея состояла в том, что терапия должна длиться достаточно долго, даже когда признаки болезни вроде бы уже исчезли — чтобы уничтожить остатки опухолевых клеток и не дать им возможности вновь размножиться.
Эффект был потрясающим. Впервые появились не просто больные, у которых наступало кратковременное облегчение симптомов, а случаи длительных ремиссий, фактически равносильных выздоровлению. Шанс на долгую полноценную жизнь получили сразу десятки процентов детей с острым лимфобластным лейкозом и взрослых с лимфомой Ходжкина. Это и сейчас одни из самых излечимых онкологических заболеваний.
5. Адъювантная и неоадъювантная химиотерапия, сопроводительная терапия
И с этого момента представление о лечении химиотерапией стало приближаться к нашему современному пониманию. Не только разрабатывались новые препараты, но и изменялась концепция их использования. Возникло понятие протокола, который описывает, когда, в каких сочетаниях и в каких дозах должны вводиться химиопрепараты. Врачи также задумались над тем, как снизить опасность от токсического воздействия препаратов на больных, и стала развиваться сопроводительная терапия, без которой сейчас невозможно представить себе противораковое лечение: антибиотики и противогрибковые препараты для борьбы с инфекционными осложнениями, переливания компонентов крови, антидоты для некоторых конкретных лекарств…
Инфузоматы - автоматизированные приспособления для химиотерапии
Далее, врачи поняли, как сочетать химиотерапию и хирургическое лечение при солидных опухолях — то есть не лейкозах или лимфомах, а заболеваниях, где есть локальная масса опухолевых клеток. Использование пред- и послеоперационной (говоря по-научному, неоадъювантной и адъювантной) химиотерапии позволило добиться победы во многих случаях рака груди или кишечника у взрослых, нефробластомы и сарком у детей, при целом ряде других опухолей.
«Традиционная» химиотерапия за десятки лет достигла существенных успехов. Но в целом, хотя по сей день появляются новые лекарства и новые протоколы, есть ощущение, что во многом она уже достигла своего потолка. И современные магистральные пути развития уже основаны не просто на препаратах, которые блокируют деление любых быстро делящихся клеток, а на лекарствах, действие которых учитывает особенности каждой конкретной опухоли.
6. Таргетная терапия
Хронический миелоидный лейкоз еще сравнительно недавно считался болезнью, которая очень плохо поддается терапии: шанс больным давала только трансплантация донорского костного мозга. Но именно с этой болезнью был связан первый и самый значимый успех нового подхода: в конце 90-х годов XX века для борьбы с ней был разработан иматиниб («Гливек»). Это лекарство учитывает конкретные молекулярные механизмы, которые управляют делением опухолевых клеток именно при хроническом миелоидном лейкозе, и целенаправленно блокирует их. Новый подход получил название таргетной терапии, от английского target — мишень, цель.
С появлением «Гливека» практически фатальная болезнь превратилась в хорошо контролируемую: человек может полноценно жить многие годы, просто принимая таблетки (которые к тому же менее токсичны, чем традиционная химиотерапия). Другие лекарства учитывают молекулярные механизмы развития других опухолей и используются, например, при некоторых саркомах и лимфомах, раке почки, легких, других органов.
Особая разновидность таргетной терапии, также возникшая около 20 лет назад, — использование иммунопрепаратов на основе моноклональных антител. Речь идет об особых белках, которые связываются с клетками конкретной опухоли и тем самым способствуют их уничтожению. Например, ритуксимаб («Мабтера», «Ацеллбия») успешно используется при ряде лимфом, а трастузумаб («Герцептин») очень эффективен при определенных типах рака молочной железы.
Эти успехи вдохновили исследователей на новые разработки. Сейчас уже известны десятки таргетных препаратов, которые заметно улучшили результаты лечения при целом ряде опухолей. Разработка новых лекарств активно ведется и сейчас.
7. Современная противоопухолевая иммунотерапия
В последние несколько лет внимание онкологов всего мира приковано к новому направлению в лекарственной терапии злокачественных опухолей. Речь идет о том, чтобы *стимулировать иммунную систему самого организма на борьбу с раком*. Для этого, как выяснилось, необходимо блокировать те молекулярные механизмы, которые опухоль использует, чтобы защититься от атаки иммунных клеток. Углубленное понимание этих сложнейших механизмов (которые сейчас интенсивно изучаются) уже привело к разработке таких лекарств, как «Ервой», «Опдиво», «Китруда», «Тецентрик» и другие. Благодаря им уже сейчас удалось спасти целый ряд пациентов с меланомой, лимфомами и некоторыми другими онкозаболеваниями, но, по общему мнению, потенциал этих новейших лекарств пока еще раскрыт далеко не полностью и в самом скором времени нас ждут новые достижения.
В 2018 году за разработку этого класса лекарств ученым Джеймсу Эллисону и Тасуко Хондзе была присуждена Нобелевская премия по физиологии и медицине.
Перемены на Западном фронте: история химиотерапии

12 июля 1917 года около бельгийского городка Ипр немецкая армия впервые пустила в ход отравляющее вещество, названное по месту сражения ипритом. Оказалось, новое оружие можно обратить против опухолей.
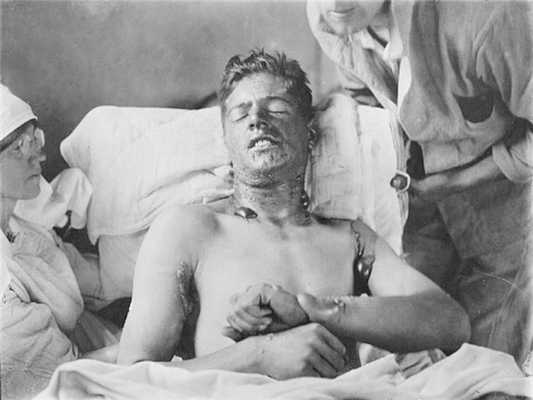
Волдыри и нарывы от иприта возникают прежде всего там, где кожа нежнее — на шее, под мышками, на запястьях.
Страшный яд оказывал действие, которого не ожидали даже сами немцы. Изучая последствия применения иприта, врачи придумали важнейший метод лечения рака — химиотерапию.
Как водится, новое оружие применили, не зная толком, с чем имеют дело. Весной 17-го года немецкое командование осознало, что силы на исходе. В дело шли все ресурсы без разбора, лишь бы удержать вражеское наступление. Химики предложили маслянистую жидкость, пары которой оказывали удушающее действие и раздражали глаза, судя по опытам на обезьянах. Отравляющее вещество с запахом горчицы, прозванное «горчичный газ», плохо разлагалось и заражало местность надолго. Для отличия начинённые им снаряды помечали жёлтым крестом.
Когда химический завод в Адлергофе выдал первую партию таких снарядов, в цеху произошёл взрыв. При тушении пожара и расчистке завалов никто не погиб. Военные решили, что новая отрава не так уж сильна, и не хотели принимать её на вооружение. Но деваться было некуда: англичане собрали под Ипром ударную группировку, которую надо было хоть чем-нибудь остановить. Для пробы артиллеристы обстреляли загон с кошками. Все кошки погибли, значит, «жёлтый крест» в качестве яда вполне пригоден. Отчего умерли животные, никто особо не разбирался. В 22 часа 12 июля немцы начали артобстрел и за ночь обрушили на противника 50 тысяч снарядов со 125 тоннами «горчичного газа».
Англичане ощутили сильный запах. Он чувствовался всего несколько минут. На самом деле это грозный симптом — если человек «принюхался» и более не слышит запаха, значит, началось отравление. Тогда этого ещё не знали. От нового газа немного першило в горле, но не сильней, чем от порохового дыма. Маслянистые лужи под ногами выглядели вполне безобидно. Проведя на всякий случай полчаса в газовых масках, британцы сочли, что ничего страшного нет, поснимали противогазы и легли спать. Сон их был крепок и спокоен. Но к утру они совершенно ослепли. Кожа по всему телу чесалась, в паху и под мышками ощущалась жуткая боль. Кричать и даже говорить сил не было: лёгкие заполнила пена, и каждый вдох давался так тяжело, что казался последним.
Задыхающиеся люди с повязками на глазах — они были не в силах выносить солнечный свет — держась друг за друга, брели в тыл, ведомые медсёстрами. Из 6000 готовых наступать бойцов пострадало 2143, умерло 95. К большинству остальных вернулось зрение, но ожоги и нарывы по всему телу не заживали месяца три. Эти-то не поддающиеся лечению нарывы и были сюрпризом для всех.

«Отравленные газом», картина американского живописца Джона Сингера Сарджента (1856-1925). Изображает британских и американских солдат, пострадавших на германском фронте от иприта. Эскизы выполнены в июле 1918 года с натуры, картина закончена в марте 1919-го.
Немцы при опытах на шимпанзе и кошках не удосужились посмотреть, что творится у них под шерстью. До 12 июля 1917 года лишь один человек испытал на себе все прелести иприта. Это был не кто иной, как Николай Зелинский, в будущем великий химик и создатель противогаза. 30 лет назад, в 1886 году, молодой Зелинский был на практике в Гёттингенском университете. Научный руководитель Виктор Мейер поручил ему синтезировать вещество, которое как раз и оказалось ипритом. Зелинский случайно облился своим продуктом и еле выжил. Он едва дышал, надолго ослеп и три месяца со страшными язвами пролежал в местной клинической больнице. Мейер послал остатки иприта в больницу на исследование. Лабораторные кролики демонстрировали те же симптомы, что и пострадавший. Когда же раздражение появилось на коже лаборанта, эксперименты сразу прекратили. Потом о них вообще забыли, и потеряли журнал.
В 1917 году немцам уже некого было спросить: Зелинский на стороне противника, а Мейер двадцать лет назад впал в депрессию и принял цианистый калий. Только после боевого применения все бросились изучать иприт. Британские врачи установили, что у отравленных падает уровень лейкоцитов в крови. Вскоре на фронт прибыл американский хирург Эдвард Крамбхаар, в будущем знаменитый кардиолог и историк медицины. С ним была его супруга Хелен, женщина-врач, верный помощник и ассистент. Постоянно оперируя, они урывали время ото сна, чтобы внимательно изучить тела отравленных.
Рассматривая под микроскопом их костный мозг, Крамбхаар заметил, что деления клеток совершенно не видно. Между тем в костном мозге этот процесс должен происходить активно — там из бластов вырабатываются новые клетки крови. Вот почему так трудно лечить причинённые «горчичным газом» язвы: иприт останавливает митоз, а значит, и любую регенерацию.
Этот вывод сразу же применили на практике. Немцы часто использовали смеси газов. Если анализ показывает снижение числа лейкоцитов и активности митоза, значит, пациент пострадал от иприта. Всего по обе стороны фронта таких отравленных насчитывалось около миллиона двухсот тысяч человек, из них до конца войны скончалась 91 тысяча. Остальные в массе своей не дожили до старости, умирая от инфекций дыхательных путей.
После войны на смену «горчичному газу» пришли в пять раз более ядовитые азотистые иприты. Перспектива их применения казалась сомнительной: теперь газ стоял на вооружении всех армий, и никто мечтать не мог о монополии на иприт, которая была у немцев целый год с лета 1917-го.
Но после Перл-Харбора стало ясно, что от японцев можно ждать всего. С декабря 1941 года в Йельском университете фармакологи Луис Гудман и Алфред Гилман стали по заказу военных искать антидот к азотистому иприту. А как проверить, действует ли антидот? Вспомнили работу Крамбхаара — если митоз идёт, значит, иприт нейтрализован. Активнее всего делятся раковые клетки, вот на них и можно проверять. Тут Гудмана осенило: да ведь инъекция иприта должна останавливать рост опухоли!
Если на опыты в интересах вооружённых сил изводили стаи кроликов, то для проверки этой гипотезы у Гилмана была всего одна мышь. У неё вызвали лимфому, затем ввели ей иприт — опухоль исчезла. Через две недели случился рецидив, после новых инъекций опухоль опять уменьшилась, однако теперь её клетки стали резистентными к яду, и мышь всё-таки умерла от рака. Но она прожила целых 84 дня, то есть на порядок больше, чем без лечения. Этот результат сообщили хирургу-онкологу Густаву Линдскогу. Он решился предложить такую химиотерапию кому-нибудь из безнадёжных пациентов больницы Нью-Хейвен. По счастливой случайности, первым согласился пациент с формой лейкоза, чувствительной к иприту. Будь у него другая патология, химиотерапия возникла бы на много лет позже.
История болезни была засекречена, потому что дело касалось применения боевого отравляющего вещества. В медицинской карточке вместо словосочетания «азотистый иприт» значится «субстанция X». Врачебная тайна до сих пор запрещает публиковать имя, фамилию и биографию больного.
Мы мало знаем об этом замечательном человеке, который вошёл в историю медицины под инициалами «J.D». Родился он в 1894 году в Российской империи, на территории современной Польши. В 1912 году эмигрировал в США. Семьи у него не было, он в одиночку снимал четырёхкомнатный дом в Меридене, штат Коннектикут, где работал на шарикоподшипниковом заводе. Вот, собственно, и всё.
К врачам он обратился в феврале 41-го, по поводу увеличения лимфоузлов и болезненных ощущений. Диагностировали лимфосаркому, облучали с некоторым результатом. После рецидива оперировали, затем опять облучали. Летом 42-го рост опухоли возобновился. Она мешала открывать рот и как следует дышать. Шея настолько распухла, что не давала повернуть голову, а спать «J.D.» мог только в кресле.
На предложение попробовать инъекции иприта больной согласился, понимая, что терять уже нечего. В 10 утра 27 августа 1942 года ему ввели внутривенно первую дозу яда. На четвёртый день химиотерапии опухоль спала, «J.D.» стал способен есть ложкой и спать в постели. За неделю внешние симптомы исчезли полностью, а через месяц наступила ремиссия — анализ крови показал отсутствие раковых клеток.
Конечно же, наблюдалась и характерная для отравленных ипритом лейкопения, то есть падение числа лейкоцитов в крови. Начались кровоизлияния и замещение костного мозга жировой тканью. Через некоторое время вернулась опухоль, и новые инъекции не свели её на нет. Спустя 96 дней после начала химиотерапии «J.D.» умер от побочных эффектов лечения. Но его фотографии, приложенные к этой публикации, произвели глубокое впечатление на врачей.
К 1946 году, когда работу рассекретили, азотистый иприт получили уже 67 онкобольных в разных городах Америки. Появилась статистика, которая с тех пор неуклонно улучшается. Лейкоз перестал быть смертным приговором: современная химиотерапия позволяет добиться стойкой ремиссии у 75% больных. «Горчичный газ», с которого всё началось, для медицины уже в далёком прошлом. Теперь остаётся исключить его использование по прямому назначению.
Лучевая терапия
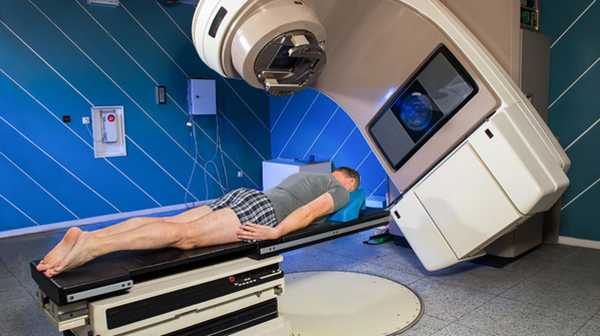
Показания к применению радиотерапии расширяются, в том числе и за счет увеличения количества выявленных онкологических заболеваний. Лучевая терапия исторически второй после операции эффективный метод лечения рака. Настоящим прорывом стала комбинация двух методов и возникновение радиохирургии.
Успехи лучевой терапии
Современные установки и методики радиотерапии позволили существенно повысить эффективность и безопасность лечения, а также расширить показания к его проведению, в том числе и за счет увеличения количества онкологических заболеваний.
Настоящим же успехом последних лет стала стереотаксическая радиохирургия. Она решила проблему повреждения клеток тканей и органов, через которые луч проникал к опухоли. Стереотаксическая радиохирургия - это принципиально новый метод лечения. В отличии от традиционной лучевой терапии вся доза излучения приходится непосредственно на опухолевые клетки, не затрагивая при этом через здоровые. Гамма-нож - один из самых известных в нашей стране вариантов такого радиационного лечения.
Доза облучения
Грамотный расчет дозы очень важен. Он позволяет добиться максимального эффекта при минимальном вреде для здоровых клеток организма. При этом учитывают вид опухоли, ее размер, состояние здоровья пациента. В качестве единиц измерения применяют Грей (Гр) или ее производную центигрей (1 цГр=100 Гр). При использовании лучевой терапии как вспомогательной при раке молочной железы, опухолях головы и тела доза составляет 45-60 Гр. Ее называют общей и делят на несколько процедур, которые образуют курс лечения. В среднем у пациента бывает около 5 сеансов в неделю, которые несколько раз повторяют в течении 5-8 недель. Иногда эти маленькие дозы еще дополнительно делят на две процедуры, которые проводят в один день.
Подготовка к лучевой терапии
Любому лечению предшествует беседа с врачом и дополнительные обследования. Лучевая терапия в этом случае не исключение. Лечащий врач расскажет о предстоящей процедуре, возможных результатах, рисках и побочных эффектах.
Радиотерапия может быть губительной для плода. Поэтому беременность в этот период нежелательна. Но если женщина уже ожидает ребенка, врач вместе с пациенткой подберет наиболее оптимальный вариант лечения.
Обязательно нужно сообщить доктору о наличии кохлеарных имплантов, электрокардиостимуляторов.
Во время проведения курса радиотерапии пациент может с трудом справляться с работой и даже с обычными домашними проблемами, поэтому вопрос с помощником по дому и с объемом профессиональных нагрузок лучше решить заранее.
При планировании курса терапии врач определяет оптимальный тип излучения, дозу, направление луча. При этом получают изображения проблемной области и проводят симуляцию лечения, во время которой необходимо найти максимально удобное положение тела на время облучения, чтобы у больного не было потребности двигаться во время процедуры. Для того этого пациента просят лечь на стол и выбрать самую комфортную из нескольких предложенных поз. Ограничители и подушки помогают сохранять неподвижность на протяжении всего сеанса облучения. После того, как удобная позиция найдена, врач отмечает на теле пациента место проникновения луча, используя маркер или нанося крохотную татуировку. Далее переходят ко второй части планирования - получения изображения опухоли, для чего обычно используют метод компьютерной томографию.
Как проводят лучевое лечение?
Лучевая терапия - это широкий арсенал методов, которые можно разделить на две большие группы: внешнюю и внутреннюю (брахиотерапию). В первом случае излучение генерируют специальным аппаратом, который двигается возле проблемной зоны и под разными углами посылает лучи в опухоль. Пациент при этом лежит неподвижно на столе в той позе, которую выбрали на этапе планирования. Время воздействия может быть разным. В среднем один сеанс занимает 10-30 минут. В большинстве случаев пациенту назначают несколько таких процедур. Через некоторое время курс повторяют. Если целью радиотерапии является обезболивание, то ее могут провести однократно.
Сама процедура абсолютно безболезненная, но вызывает у некоторых людей беспокойство. Комнаты для проведения облучения оборудованы аудиоаппаратурой. С ее помощью пациент может сообщить врачам о любой проблеме или просто поговорить, чтобы расслабиться. Сами доктора в это время находятся в соседней комнате.
Брахиотерапия предполагает облучение опухоли радиоактивными веществами, которые вводят непосредственно в новообразование или соседние ткани. Она имеет две разновидности: временная и постоянная. При временном варианте радиоактивные препараты находятся внутри специального катетера, который на некоторое время вводят в опухоль, а затем удаляют. Для постоянной брахиотерапии используют крохотный имплантат, который помещают непосредственно в опухоль, где из него постепенно высвобождаются радиоактивные вещества. Со временем они заканчиваются, а зерно имплантата остается в организме на всю жизнь, не причиняя никаких неудобств.
Возможные риски лучевой терапии
К сожалению, излучение оказывает негативное влияние не только на опухолевые, но и на здоровые клетки. Поэтому у большинства пациентов после лечения возможно развитие побочных эффектов. Проявления и степень тяжести зависят от дозы радиации и области тела, а также от способности здоровых клеток к восстановлению. Организм каждого человека реагирует на лечение очень по-разному. Поэтому точно спрогнозировать побочные эффекты крайне сложно. Некоторые проявляются сразу во время лечения, другие - дают о себе знать недели и месяцы спустя. К счастью, наиболее распространенные побочные эффекты достаточно мягкие, контролируемые и со временем проходят.
Отдаленные побочные эффекты редки, но они могут быть тяжелыми и необратимыми. По этой причине врач обязательно должен их проговорить.
Побочные эффекты
В зависимости от времени появления все побочные эффекты делятся на две группы: те, что проявляются во время или сразу после лечения и отдаленные. К первым относят поражение кожи, усталость, тошнота, понос (диарея), потеря аппетита, выпадение волос, затрудненное глотание (при облучении грудной клетки), эректильная дисфункция у мужчин (при облучении таза), проблемы с суставами и мышцами.
Серьезные отдаленные побочные эффекты отмечают редко, но надо понимать, что возможность их развития существует. Например, у женщин облучение тазовой области может привести к ранней меноупазе и невозможности зачать ребенка. В таких случаях у женщины есть возможность перед лечением заморозить несколько своих яйцеклеток. Мужчина может так поступить с образцами спермы. К другим отсроченным эффектам относится недержание кала, лимфатический отек, утолщение отдельных участков кожи и вторичный рак.
Способы облегчения своей жизни во время лучевой терапии
Лечение онкологических заболеваний - это серьезная нагрузка на организм, которая влияет на общее самочувствие и настроение. Этот сложный период пройдет проще, если к нему готовиться и проговорить с врачом все аспекты лечения. Желательно, чтобы родственники и близкие люди также были готовы прийти на помощь.
Нормально, что заболевший чувствует себя истощённым, уставшим, испуганным, одиноким и брошенным. Огромную помощь больным могут оказать родные люди. Высказанные эмоции облегчают жизнь человека, и пациент может выплеснуть все свои чувства. А близким хорошо бы не забывать сказать больному, что его любят и будут заботиться независимо от того, в каком он настроении.
Пациент при необходимости может обратиться к психологу, который подберет способ борьбы с переживаниями. Это может быть медитация, массаж или даже просто поход на концерт. Некоторым больным помогает общение с людьми, имеющих похожие проблемы, на специально организованных собраниях.
Многие пациентов страдают от проблем с кожей. Их можно облегчить, следуя простым советам:
- на время отказаться от бритья или использовать электробритву вместо обычной;
- остановить свой выбор на мыле без отдушек. Это касается также дезодорантов, кремов и прочих косметических средств, контактирующих с кожей;
- беречь кожу от холодного ветра и использовать солнцезащитный крем с уровнем SPF 15 и выше в солнечные дни;
- выбирать свободную одежду из натуральных материалов, которая не имеет выступающих швов, узлов и других элементов, способных натирать кожу.
Диета
Очень важно во время курса лучевой терапии правильно и регулярно питаться, потребляя достаточное количество калорий и белков и не допуская потери веса. Ведь план лечения и расчет дозы делают исходя из массы тела и объемов человека. При изменении этих параметров необходимо пересматривать весь курс лечения. В рационе человека обязательно должны присутствовать мясо, рыба, яйца, цельное молоко, сыр, бобовые.
Лечащий врач обязательно должен знать о проблемах с аппетитом. Тошнота, апатия, расстройства желудка не делают еду желанной. Но эти неприятные симптомы можно контролировать частым дробным питанием или с помощью препаратов. Если аппетита нет совсем, можно попробовать заменить твердую пищу калорийными напитками: молочными коктейлями, супами-пюре с добавлением протеиновых порошков. Алкогольные напитки разрешается употреблять не во всех случаях. Поэтому по этому вопросу лучше проконсультироваться с врачом.
Нельзя забывать и о воде, рекомендуемый суточный объем составляет 3 л.
Восстановление после курсов лучевой терапии
Усталость после лучевой терапии - это абсолютно закономерное состояние. Врачи считают, что она - результат работы организма над восстановлением. Стремление немного вздремнуть на протяжении всего дня вполне естественно, и такой отдых очень полезен. Причиной усталости в некоторых случаях может быть анемия (недостаточное количество эритроцитов в крови). В зависимости от тяжести состояния таким пациентам может быть назначено переливание крови.
При облучении области таза или живота пациенты еще некоторое время после лечения испытывают тошноту и страдают расстройством желудка. К счастью, сейчас врачи располагают большим количеством средств, которые помогают контролировать эти неприятные симптомы.
Облегчить проблемы с суставами и мышцами помогают регулярные упражнения. Есть также специальная программа для профилактики лимфатического отека.
Химиотерапия

Химиопрепараты разделяются на алкилирующие цитостатики, антиметаболиты, антибиотики и другие. Торможение роста опухоли гормонами, антигормонами или регуляторами их выработки также относят к химиотерапии.
Что такое химиотерапия?
Химиотерапия злокачественных опухолей - это один из методов нехирургического лечения онкологических заболеваний. Суть его заключается в применении препаратов, оказывающих токсическое действие на быстро делящиеся раковые клетки. Негативное влияние на здоровые клетки организма должно отсутствовать или быть минимальным. Существует важное отличие химиотерапевтических препаратов от других противоопухолевых медикаментов (таргетная терапия, иммунотерапия, гормональная терапия): они «убивают» раковые клетки, нарушая их деление.
В каких случаях назначают химиотерапию?
В зависимости от цели различают следующие виды химиотерапии:
- лечебная - для уничтожения новообразования.
- индукционная - перед операцией или радиотерапией, увеличивающая эффективность последующих процедур. Зачем назначают химиотерапию вместе с операцией? Лечение противоопухолевыми препаратами делает новообразование компактнее. Уменьшение опухоли дает возможность сократить объем хирургического вмешательства или сделать неоперабельную опухоль операбельной.
- адъювантная (химиотерапия после операции) - снижает риск рецидива.
- паллиативная - помогает контролировать симптомы у больных, которым невозможно провести радикальную операцию.
Химиотерапия у детей
Лечение онкологических заболеваний у детей часто включает химиотерапию. За некоторыми исключениями, эффективность для маленьких пациентов гораздо выше, чем для взрослых. Ребенок обычно также легче переносит препараты. Однако сочетание с радиотерапией нередко сопровождается отдаленными побочными эффектами. В этом случае рекомендуется мониторинг состояния здоровья на протяжении всей жизни.
Премедикация перед химиотерапией
Премедикацией называют введение лекарственных средств, которые помогают организму лучше переносить саму химиотерапию. Выбор медикаментов зависит от прогнозируемых побочных действий. Премедикация может включать дексаметазон, димедрол, ранитидин, тавегил и другие препараты.
Как проходит курс химиотерапии?
Прием химиотерапевтических препаратов происходит несколькими курсами. Перерывы между ними дают возможность здоровым тканям восстановиться и свести к минимуму количество и тяжесть побочных эффектов. Курс лечения можно проходить дома, амбулаторно или в процессе госпитализации. Здесь все зависит от способа введения препаратов, необходимости дополнительных процедур и общего состояния пациента. Схемы химиотерапии составляется индивидуально и могут включать один или несколько препаратов. Главная задача врача при подборе лекарств - обеспечить разумный баланс между эффективностью препаратов и минимально возможным вредом для здоровья. Как долго необходимо проводить лечение, будет зависеть от индивидуальных особенностей пациента.
Способ введения препаратов может быть различным:
- внутривенным (с постоянным катетером и без);
- пероральным (таблетки, капсулы);
- в виде подкожных или внутримышечных инъекций (редко, поскольку возможен некроз тканей в месте инъекции).
В особую категорию стоит выделить способ лечения, получивший название гипертермическая интраперитонеальная химиотерапия (ГИПХ, HIPEC). Она применяется для терапии некоторых новообразований органов брюшной полости; состоит из нескольких этапов. Первый - хирургическое удаление опухоли. Затем при помощи специального прибора в брюшную полость вводят подогретый до 42-43 градусов раствор химиопрепарата. Через некоторое время его откачивают и рану зашивают.
Расчет дозы при химиотерапии
Дозу химиопрепаратов обычно рассчитывают не на массу тела, а на его поверхность. Имеют значение возраст, тип заболевания, необходимость комбинирования с другими методами лечения и/или лекарствами.
При последовательной высокодозной химиотерапии (секвенс) больному назначают 2-4 препарата в максимальной дозировке. Каждый из них пропивается отдельным курсом. Высокодозную химиотерапию применяют при онкологических заболеваниях крови, в случае рецидива или отсутствия положительной реакции на ранее применяемые химиотерапевтические препараты.
Побочные действия после химиотерапии
Почему химиотерапия так плохо переносится? Раковая клетка обладает способностью к быстрому делению. Это одно из свойств, которое отличает ее от нормальных и делают особо уязвимой для химиопрепаратов. Лекарства не различают здоровые и мутировавшие клетки. Из-за этого помимо раковых страдают и нормальные ткани, в особенности те, клетки которых в норме быстро делятся (пищеварительный тракт, кровь, волосяные фолликулы, кожа). Поэтому основные побочные эффекты связаны с этими системами:
- усталость;
- тошнота, потеря аппетита;
- выпадение волос;
- анемия;
- подверженность инфекционным заболеваниям;
- повышенная кровоточивость;
- проблемы с памятью и концентрацией;
- понос или запор;
- стоматит;
- потеря сексуального влечения;
- бесплодие.
Щадящая химиотерапия оказывает минимальное влияние на здоровые клетки, но все же большинство пациентов испытывают те или иные из них. Основываясь на свойствах химиопрепаратов врач способен предположить наиболее вероятные побочные эффекты. Основываясь на этой информации он назначает поддерживающие лечение и дополнительные, которые существенно улучшают качество жизни.
Восстановление после химиотерапии
Реабилитация после химиотерапии может занять некоторое время. Ее продолжительность будет зависеть от типа препаратов, их дозы, общего состояния здоровья и индивидуальной переносимости лечения. Она может включать:
- диету;
- физические упражнения;
- психологическую поддержку;
- занятия, помогающие снизить стресс (медитация, дыхательная гимнастика).
Некоторые люди чувствуют себя истощенными. Если они работают, то им рекомендуется перейти на частичную занятость или взять больничный. Дополнительно необходимо периодически сдавать анализы, помогающие оценить своё общее состояние.
Сколько живут после химиотерапии?
Химиотерапия при онкологии может помочь победить рак или значительно улучшить качество и продолжительность жизни. Результат лечения будет зависеть прежде всего от вида опухоли, стадии рака, общего состояния здоровья человека и его возраста. Поэтому прогноз необходимо обсуждать со своим лечащим врачом.
Химиотерапия - метод лекарственного лечения рака с помощью клеточных ядов (цитостатических препаратов). То, что клеточные яды могут замедлять развитие опухолей, стало известно в середине прошлого века.

В 1919 году ученые обнаружили, что отравляющее вещество иприт угнетает созревание кровяных клеток. В 1942 году на основе иприта синтезировали эмбихин, который в 1946 году впервые применили в лечении рака. Уже в 1947 году его стали применять в НИИ онкологии (ныне НМИЦ онкологии им Н.Н.Петрова). Препарат вводился пациентам с лимфомой Ходжкина и позволял добиться выраженного улучшения. В то же время он и отравлял здоровые клетки.
В 1940- х годах был синтезирован метотрексат. Ученые исследовали его влияние при остром лимфобластном лейкозе у детей. И именно эти исследования стали первым шагом в химиотерапии опухолевых заболеваний. Метотрексат и по сей день используется при ряде опухолевых заболеваний, в основном - заболеваний крови.
Химиотерапия принципиально отличается от хирургического лечения и лучевой терапии. Она позволяет воздействовать одновременно на все опухолевые клетки в организме. Поэтому химиотерапию (и другие варианты лекарственной противоопухолевой терапии) называют системной терапией.
Как работает химиотерапия
Химиотерапевтические препараты (цитостатики) - это клеточный яд. Этот яд прерывает рост и деление опухолевых клеток. Конечно, н нормальные клетки подвергаются воздействию яда, но не так сильно. Именно клетки опухоли - из-за высокой скорости их деления - наиболее уязвимы для химиотерапии.
Чем химиотерапия отличается от других видов лечения
В лечении рака применяются различные варианты лечения. В чем особенности химиотерапии?
а) Механизм воздействия в сравнении с другими методами:
- химиотерапия действует неизбирательно. Она нарушаетобщие механизмы функционирования и в нормальных, и в опухолевых клетках. Но на злокачественные клетки она влияет сильнее из-за высокой скорости их роста.
- таргетная терапия “выключает” отдельный молекулярный процесс в опухоли, который и заставляетконкретную опухоль расти и давать метастазы. Таргетная терапия в меньшей степени затрагивает процессы функционирования в нормальных клетках
- иммунотерапия заставляетиммунную систему бить по опухоли. Химиотерапия напрямую уничтожаетопухолевые клетки, не привлекая для этого иммунную систему.
б) Побочные эффекты. Из-за разных механизмов действия побочные эффекты химиотерапии, таргетной и иммунотерапии тоже различаются. Подробнее об этом читайте в статьях:
Какие разновидности химиотерапии бывают
а) По целям химиотерапии ее разделяют на:
- предоперационную (неоадъювантную);
- послеоперационную (адъювантную);
- поддерживающую (паллиативную), в том числе, симптоматическую.
б) По группам химиотерапевтических препаратов выделяют:
- алкилирующие агенты (доксорубицин, темозоломид, циклофосфамид, ифосфамид) и препараты платины (цисплатин, карбоплатин, оксалиплатин). Они грубо повреждают генетический аппарат (ДНК) опухолевых клеток, что приводит к их гибели.
- “блокаторы” микротрубочек (паклитаксел, доцетаксел, эрибулин, винорельбин). Они “ломают” веревки, которые разделяют опухолевую клетку на две при ее попытке поделиться и удвоиться.
- антиметаболиты (метотрексат, фторурацил, гемцитабин). Эти вещества“обманывают” опухолевую клетку, выдавая себя за полезные для нее вещества. На самом деле нарушают ключевые процессы обмена веществ в опухоли.
- “выключатели” топоизомеразы (топотекан, иринотекан, этопозид). Превращают ДНК опухолевых клеток в клубок грязи, неспособный к нормальному функционированию.
Что такое схемы химиотерапии
Схема химиотерапии - комбинация химиотерапевтических препаратов, которая применяется при конкретном опухолевом заболевании (с учетом стадии, гистологической формы, молекулярно-генетических особенностей).
В схемы обычно входят препараты с разным механизмом противоопухолевого эффекта. Так достигается воздействие на большее количество клеток конкретной опухоли. Для лечения применяются только те схемы препаратов, которые показали свою эффективность при конкретном варианте заболевания в исследованиях.
- доксорубицин + циклофосфамид (“красная химия”) - предоперационная химиотерапия при раке молочной железы;
- карбоплатин + этопозид при лечении метастатического мелкоклеточного рака легкого.
Химиотерапия может сочетаться с другими видами лекарственного противоопухолевого лечения:
- с иммунотерапией (пембролизумаб + паклитаксел/карбоплатин приплоскоклеточном раке легкого; карбоплатин/этопозид + атезолизумаб примелкоклеточном раке легкого)
- с таргетной терапией (трастузумаб + пертузумаб + доцетаксел приHER2-положительном раке молочной железы.
Как долго проводится химиотерапия
В зависимости от вида опухолевого заболевания и целей лекарственного лечения химиотерапия может проводиться в течение нескольких месяцев (предоперационная, послеоперационная химиотерапия) или на постоянной основе (поддерживающая химиотерапия при метастатическом раке).
При метастатическом раке химиотерапия обычно проводится до того момента, пока она не перестанет “работать” (т.е. заболевание прогрессирует, опухоль продолжает распространяться). Также терапия прерывается, когда становится непереносимой для пациента из-за своей токсичности. В этих случаях схема лекарственного лечения меняется лечащим врачом.
Кому и когда показана химиотерапия
Химиотерапия может быть показана практически всем пациентам со злокачественными новообразованиями в том или ином виде. В зависимости от типа опухоли и ее стадии может быть назначена как предоперационная/послеоперационная химиотерапия, так и поддерживающая химиотерапия.
- в качестве предоперационной терапии: доксорубицин + циклофосфамид; трастузумаб + пертузумаб + доцетаксел + карбоплатин при раке молочной железы.
- в качестве послеоперационной терапии (примеры - схема FOLFOX (оксалиплатин + фторурацил + лейковорин) при третьей стадии рака толстой кишки.
- в качестве поддерживающей (паллиативной) химиотерапии (примеры - доцетаксел при метастатическом раке предстательной железы).
Где проводится химиотерапия и какие врачи ее проводят

Назначением и проведением химиотерапии занимаются врачи-онкологи, специализирующиеся на ее проведении: медицинские онкологи или “химиотерапевты”.
Химиотерапия может проводиться как в амбулаторных, так и в стационарных условиях. То, в каких условиях проводится химиотерапия, определяется конкретной схемой и характером ожидаемых побочных явлений.
В амбулаторных условиях химиотерапия проводится:
- в центрах амбулаторной онкологической помощи (ЦАОП). ЦАОП может быть организованна базе поликлиники, центральной районной больницы, многофункционального медицинского центра, онкодиспансера;
- в отделениях дневного стационара многопрофильного медицинского центра, онкологической больницы или онкодиспансера.
В стационарных условиях химиотерапия проводится в соответствующих отделениях в онкологических стационарах.
Условия проведения химиотерапии определяются врачом, исходя из:
- выбранной схемы химиотерапии;
- длительности ее введения;
- характера опухолевого заболевания;
- состояния пациента;
- организационных возможностей учреждения.
Как проводится химиотерапия
Различные схемы химиотерапии имеют свои особенности. Само проведение химиотерапии чаще всего можно поделить на два условных этапа:
а) Сопроводительная терапия (подготовительная терапия, премедикация) - введение препаратов, направленных на профилактику возникновения нежелательных явлений при химиотерапии и после нее.
В рамках сопроводительной терапии могут применяться препараты, профилактирующие тошноту (ондансетрон, фосапрепитант/апрепитант, дексаметазон), нежелательные реакции при введении препаратов (атропин перед иринотеканом для профилактики холинергического криза, дексаметазон перед паклитакселом/доцетакселом для профилактики инфузионных реакций), а также инфузионная терапия в виде большого количества жидкости - с целью профилактики повреждения почек (цисплатин).
Ряд схем, применяющихся в рамках лечения онкогематологических заболеваний, требует профилактического применения противомикробных препаратов - из-за наиболее высокого риска возникновения инфекционных осложнений.
б) Непосредственное введение противоопухолевых препаратов в рамках конкретной схемы химиотерапии. У каждой схемы существуют свои особенности введения. Они могут различаться:
- по времени, необходимому на безопасное введение препаратов;
- по характеру возможных нежелательных реакций, которые могут возникать при непосредственном введении препаратов или в последующие часы.
Существуют схемы, которые проводятся в течении двух и более дней.
- FOLFOX при раке толстой кишки и желудка;
- VAC/IE при саркоме Юинга;
- AI при саркомах мягких тканей;
- карбоплатин - этопозид при мелкоклеточном раке легкого;
- CHOP при лимфомах.
Из-за возможных нежелательных явлений они подразумевают проведение большого объема сопроводительной терапии и необходимости круглосуточного стационарного наблюдения в период введения препаратов.
В то же время существует ряд схем, токсичность которых может хорошо контролироваться в амбулаторных условиях. При этих схемах введение препаратов занимает всего несколько часов (доксорубицин + циклофосфамид; паклитаксел) или в их состав входят препараты в таблетках (капецитабин). Такие виды химиотерапии могут проводиться как в амбулаторных условиях (дневной стационар), так и условиях круглосуточного стационара.
Читайте также:
- Лучевые признаки диффузной идиопатической гиперплазии нейроэндокринных клеток легких (ДИГНКЛ)
- Показания, этапы, техника гемиколэктомии слева
- Передняя поверхность сердца. Венечная борозда сердца. Передняя межжелудочковая борозда сердца.
- Заболевания передней брюшной стенки. Воспалительные болезни передней брюшной стенки
- Причины сахарного диабета и механизмы его развития
