Изменение жизненного цикла развития Caulobacter crescentus
Добавил пользователь Alex Обновлено: 28.01.2026
Ученые из университета Индианы вместе с коллегами из других американских университетов обнаружили, что одноклеточная бактерия Caulobacter crescentus, живущая в водоемах, использует, пожалуй, самый прочный клей на Земле.
Выяснилось: для того, чтобы оторвать микроманипулятором единственную бактерию от стеклянной пипетки, требуется применить силу в 1 микроньютон, что, из-за крохотных размеров организма, «производит» огромную нагрузку - 70 ньютонов на квадратный миллиметр. Этот предел прочности данного соединения эквивалентен 5 тоннам на квадратный дюйм или 3-4 автомобилям, «наваленным сверху».
Caulobacter crescentus прикрепляет себя к речным камням и внутренностям водопроводных труб с помощью длинного стройного «стебля», на конце которого имеются полисахариды, цепочки сахарных молекул. Благодаря ним, вероятно, и происходит прилипание. Впрочем, это еще не доказано.
Очевидно, что создание аналогичного по свойствам «природного» клея принесет человечеству пользу. Например, речь может идти о разлагаемом микроорганизмами хирургическом пластыре, ведь, вдобавок ко всему, бактерия обитает в воде «из-под крана» и не представляет никакой угрозы здоровью людей.
Бактериологам уже удалось «при помощи специальных мутантов» изолировать клей на стеклянных поверхностях, но вот отделить клейкое вещество от них пока не получается.
Caulobacter Crescentus — бактерии с невероятными способности приклеиваться к поверхностям
Если занятная ящерица из семейства цепколапых — геккон, прикреплится к какой-либо поверхности своими лапками, это, желающему оторвать её понадобится сотни килограммов силы. Казалось бы, что нет на свете существа, кто может сильнее «приклеиваться» к поверхностям. Ан нет: никто не может даже близко сравниться со способностями приклеиваться с невероятной силой с одной удивительной бактерией — Caulobacter crescentus (Суперадгезивные бактерии).
Если вообразить данное органическое живое образование в роли Человека-паука, то сила сцепления окажется у C.Crescentus в семь раз большей, чем у гекконов и в три-четыре раза более клейкой, чем самый сильный коммерческий суперклей.
Бактерия Crescentus живет в любой влажной среде и в любой воде, будь то пресная, соленая или даже водопроводная. Микроб движется с помощью придатка, называемого жгутиком, до тех пор, пока не найдет подходящее место для жизни. Затем бактерия прикрепляется к выбранной поверхности через тонкие структуры, называемые пили. Расположившись в нужном месте, микроб выделяет сладкое адгезивное вещество, с помощью которого мгновенно прилипает к поверхности какого-нибудь существа.

Результаты научных испытаний показали, что «суперклей» C. crescentus обладает силой сцепления около пяти тонн на квадратный дюйм. Другими словами, небольшого пятна этого вещества было бы достаточно, чтобы поднять слона или несколько автомобилей с земли.
Поскольку C. crescentus перемещаются в местах, где мало еды, считается, что эти бактерии также используют свой суперклей для сбора питательных веществ.
Разумеется, ученые видят практический потенциал такого липкого вещества, применение которого может варьироваться от хирургических клеев до прочных строительных материалов.
Первый бактериальный геном, спроектированный при помощи компьютера

Все известные геномы организмов хранятся в базе данных, принадлежащей Национальному Центру Биотехнологической Информации в США. Сейчас в базе данных есть запись: Caulobacter ethensis-2.0. Это первый в мире полностью компьютерный геном живого организма, разработанный учёными из ETH Zurich. Нужно подчеркнуть, что, хотя геном Caulobacter ethensis-2.0 был физически получен в форме очень большой молекулы ДНК, соответствующий организм ещё не существует.
Caulobacter ethensis-2.0 основан на геноме хорошо изученной и безопасной пресноводной бактерии Caulobacter crescentus, которая встречается в природе в родниковой воде, реках и озёрах по всему земному шару. Не вызывает никаких заболеваний. Caulobacter crescentus также является модельным организмом, обычно используемым в исследовательских лабораториях в целях изучения жизни бактерий. Геном этой бактерии содержит 4000 генов. Учёные ранее показали, что лишь примерно 680 из этих генов имеют решающее значение в выживании бактерии в лаборатории.
Бит Кристен, профессор экспериментальной системной биологии в ETH Zurich, и его брат Маттиас Кристен, химик в ETH Zurich, взяли минимальный геном Caulobacter crescentus в качестве базы. Они намеревались химически синтезировать этот геном с нуля как непрерывную кольцевую хромосому. Эта задача считается реально сложной: химически синтезированный бактериальный геном, представленный 11 лет назад американским пионером генетики Крейгом Вентером, стал результатом 10 лет работы 20 учёных. Говорят, что стоимость проекта составила 40 миллионов долларов.
Рационализация сборочного процесса
В то время как группа Вентера сделала точную копию естественного генома, учёные из ETH Zurich радикально изменили геном, используя компьютерный алгоритм. Их мотивация была двоякой: одна - чтобы было намного проще синтезировать геномы, и вторая - решение фундаментальных проблем биологии.
Чтобы создать молекулу ДНК размером с бактериальный геном, учёные должны действовать шаг за шагом. В случае генома Caulobacter учёные из ETH Zurich синтезировали 236 фрагментов генома, которые они впоследствии сшили. «Синтез этих фрагментов не всегда прост», - объясняет Матиас Кристен. «Молекулы ДНК не только обладают способностью прилипать к иным молекулам ДНК, но в зависимости от последовательности они также могут скручиваться в петли и узлы, что может усложнить процесс синтеза или сделать его невозможным», - объясняет Матиас Кристен.
Упрощённые геномы
Чтобы синтезировать фрагменты генома самым простым способом, а затем собрать воедино все фрагменты наиболее правильным образом, учёные радикально упростили последовательность генома, не изменяя фактическую генетическую информацию (на уровне белка). Существует много возможностей для упрощения геномов, потому что биология имеет встроенные резервы хранения генетической информации. Например, у многих аминокислот есть две, четыре или больше возможностей записать свою информацию в ДНК.
Алгоритм, разработанный учёными из ETH Zurich, оптимально использует эту избыточность генетического кода. Используя этот алгоритм, они вычислили наиболее экономичную последовательность ДНК в целях синтеза и конструирования генома, которую они и использовали в своей работе.

Геном Caulobacter ethensis-2.0 в пробирке
В результате учёные внесли много небольших изменений в минимальный геном, что, впрочем, впечатляет: более шестой части из 800 000 букв ДНК в искусственном геноме были заменены по сравнению с «естественным» минимальным геномом. «Благодаря нашему алгоритму мы полностью переписали наш геном в новую последовательность букв ДНК, которая больше не похожа на исходную последовательность. Однако биологическая функция на уровне белка сохранилась», - говорит Бит Кристен.
Лакмусовая бумажка в генетике
Переписанный геном также интересен с биологической точки зрения. «Наш метод является лакмусовой бумажкой, чтобы увидеть, правильно ли мы, биологи, понимаем генетику, и он позволяет нам высветить возможные пробелы в наших знаниях», - объясняет Бит Кристен. Естественно, переписанный геном может содержать лишь информацию, которую исследователи реально поняли. Возможная «скрытая» лишняя информация, которая находится в последовательности ДНК и ещё не понята учёными, была бы потеряна в процессе синтеза нового кода.
Учёные вырастили штаммы бактерий, которые содержали как природный геном Caulobacter, так и фрагменты нового искусственного генома. Отключив некоторые естественные гены в этих бактериях, учёные смогли проверить функции искусственных генов. Они проверили каждый из искусственных генов в многоступенчатом процессе.
В этих экспериментах учёные обнаружили, что лишь около 580 из 680 искусственных генов были функциональными. «Получив знания, мы сможем улучшить наш алгоритм и разработать полнофункциональную версию генома 3.0», - говорит Бит Кристен.
Гигантский потенциал в биотехнологии
«Несмотря на то, что текущая версия генома ещё не идеальна, наша работа тем не менее показывает, что биологические системы построены таким простым способом, что в будущем мы сможем разработать спецификации проекта на компьютере в соответствии с нашими целями, а затем построить их», - говорит Матиас Кристен. И это может быть получено сравнительно простым способом, как подчёркивает Бит Кристен: «На что ушло десять лет у Крейга Вентера, наша небольшая группа выполнила при помощи нашей новой технологии в течение года с затратами лишь 120 000 швейцарских франков».
«Мы полагаем, что вскоре также будет возможно производить функциональные бактериальные клетки с таким геномом», - говорит Бит Кристен. Такое развитие будет иметь большой потенциал. Среди возможных будущих применений - синтетические микроорганизмы, которые могут быть использованы в биотехнологии, например, в синтезе сложных фармацевтически активных молекул или витаминов. Технология может применяться универсально у всех микроорганизмов, а не только у Caulobacter. Иной возможностью было бы производство ДНК-вакцин.
«Какими бы многообещающими ни были результаты исследований и их возможные применения, они требуют глубокого понимания целей, для которых эта технология может быть использована, и в то же время, как можно предотвратить злоупотребления», - говорит Бит Кристен. Ещё не ясно, когда будет получена первая бактерия с искусственным геномом, но теперь ясно, что она может быть получена и будет развиваться. «Нам нужно использовать время, которое у нас есть, в целях интенсивных дискуссий между учёными, а также в обществе в целом. Мы готовы внести свой вклад в эту дискуссию со всеми имеющимися у нас ноу-хау».
Как живет бактерия, видимая невооруженным глазом
Новость
Гигантская бактерия Thiomargarita magnifica по размеру не только обходит все известные прокариотические клетки, но и даже некоторые многоклеточные эукариотические организмы, например, нематоду Caenorhabditis elegans и плодовую мушку Drosophila melanogaster.
Автор
Редакторы
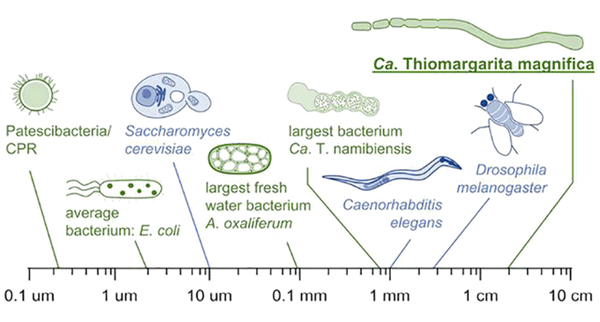
Бактериальные клетки, как правило, значительно меньше эукариотических и достигают в среднем 2 мкм в диаметре. Конечно, из этого правила есть любопытные исключения — некоторые бактерии имеют размер порядка 750 мкм (например, серная бактерия Thiomargarita namibiensis). Но недавно была открыта бактерия, которая по размеру превосходит не только всех ранее известных прокариот, но и большинство эукариотических клеток. Американские ученые обнаружили в мангровых зарослях Гваделупы нитевидную бактерию длиной 9 мм, причем отдельные ее клетки достигают ни много ни мало 2 см в длину. Новая бактерия получила предварительное название Thiomargarita magnifica. Как живет эта удивительная бактерия? Давайте разбираться.
Термином «микроорганизм» обычно называют одноклеточные существа, которые различимы в световой микроскоп, но не видны невооруженным глазом. К микроорганизмам относятся почти все прокариоты, а также ряд эукариот, например, дрожжи. Большинство вирусов можно рассмотреть только в электронный микроскоп, и чаще всего вирусы в понятие «микроорганизмы» не включаются. Впрочем, в последние годы и без того размытые границы микромира стали еще более условными. Открытие гигантских вирусов, поражающих амеб (в частности, мимивирусов), показало, что к микроорганизмам вполне можно отнести и некоторые вирусы (подробнее о гигантских вирусах можно прочитать в нашей статье [2]). Еще один мощный удар по концепции микроорганизмов нанесли гигантские бактерии, некоторых из которых можно рассмотреть и без всякого микроскопа.
Одним из самых ярких представителей гигантских бактерий является род Thiomargarita. Большинство его представителей населяют моря и океаны, занимаются окислением сульфида S 2- , причем размер их примерно в 50 раз превышает типичные параметры бактериальных клеток. До недавнего времени самой крупной бактерией считалась Thiomargarita namibiensis, которую нашли в донных отложениях континентального шельфа Намибии. Наиболее крупные клетки этого вида достигают 750 мкм в длину (клетки такого размера можно рассмотреть даже невооруженным глазом), а большинство имеет диаметр порядка 100-300 мкм (такие клетки можно разглядеть уже с помощью бинокуляра) [3]. Однако недавно была описана новая представительница рода Thiomargarita, отдельные клетки которой достигают целых 2 см в длину! Новую бактерию, найденную в мангровых зарослях на территории Гваделупы, назвали Thiomargarita magnifica (точнее, Candidatus Thiomargarita magnifica) [1].
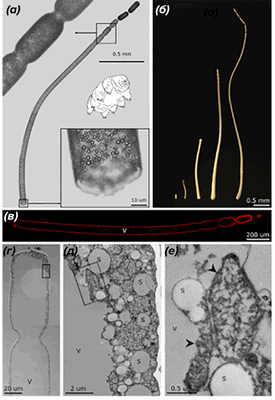
Рисунок 1. Морфология и ультраструктура клеток Thiomargarita magnifica.
(а) — внешнее строение клетки T. magnifica, визуализированной с помощью светового микроскопа. Перетяжки в верхней части клеток отделяют апикальные почки. Видно, что цитоплазма клетки заполнена множеством мембранных пузырьков.
(б) — внешний вид клеток T. magnifica на разных стадиях развития.
(в) — мембрана клетки T. magnifica окрашена красителем FM 1-43x. Видно, что септ внутри клетки нет, а апикальные почки отделены неполными перегородками.
(г), (д), (е) — ультраструктура клетки T. magnifica, визуализированной с помощью электронного микроскопа, где (г) — апикальный конец клетки вблизи апикальных почек. Видно, что почти все пространство внутри клетки занимает гигантская вакуоль (v), а цитоплазма оттеснена к периферии.
(д) — более крупное увеличение участка, обведенного прямоугольником на рисунке (г). Видны серные гранулы (s), вакуоль (v) и многочисленные пепины (так ученые, описавшие T. magnifica, предложили называть мембранные пузырьки, содержащие генетический материал, см. далее в тексте).
(е) — более крупное увеличение участка, обведенного прямоугольником на рисунке (д). Стрелки указывают на пепины.
Внешний вид этой бактерии довольно своеобразен. «Букеты» из филаментов, состоящих из сантиметровых нитчатых клеток T. magnifica, прикрепляются к листьям мангрового кустарника Rhizophora mangle. Сами филаменты могут достигать в длину несколько сантиметров. Впрочем, глубоководные представители рода Thiomargarita имеют похожую морфологию. На протяжении большей части своей длины клетки T. magnifica сохраняют нитевидную форму, однако у одного из концов часто находятся 1-4 маленькие почки — дочерние клетки, образующиеся в результате неравного деления (рис. 1). Филаменты T. magnifica окружены слизистым матриксом, однако, в отличие от других гигантских бактерий, на их поверхности отсутствуют эпибиотические бактерии — бактерии, которые живут во внешнем слизистом чехле более крупных бактерий (почему, мы расскажем позднее) [1].
Ученые, обнаружившие эту бактерию, поначалу были уверены, что столь крупные нитевидные клетки на самом деле являются цепочкой из нескольких клеток, разделенных септами. Каково же было их удивление, когда на электронных микрофотографиях клетки T. magnifica никаких септ обнаружено не было! Даже в области концевых почек сплошных септ нет, есть только неполные перегородки. Электронная микроскопия выявила еще одну, не менее удивительную особенность клеток T. magnifica (кажется, слово «удивительный» в отношении этой бактерии можно применять бесконечно). Выяснилось, что большая часть клетки занята гигантской вакуолью, на долю которой приходится 70-80% объема клетки! Цитоплазма при этом оттеснена на периферию и образует тоненький слой около 4 мкм толщиной. В цитоплазме были выявлены многочисленные везикулы диаметром около 2 мкм, которые, как оказалось, выполняют роль серных гранул: метаболизм T. magnifica построен на окислении сульфида до элементарной серы, которая откладывается в составе упомянутых гранул. Кроме того, в цитоплазме присутствуют и более мелкие везикулы диаметром порядка 1 мкм. Авторы, описавшие бактерию, предположили, что в этих маленьких пузырьках может находиться часть генетического материала гигантской бактерии в силу ее высокополиплоидности (об организации генетического материала T. magnifica мы подробно поговорим чуть позже) [1].
Считается, что окруженные мембраной органеллы — удел эукариотических клеток. В частности, клеточное ядро представляет собой полость, окруженную двумя мембранами и содержащую внутри геномную ДНК. Впрочем, помещение генетического материала в «мешок», образованный липидным бислоем, описано и у некоторых бактерий, таких как планктомицеты. У одного представителя группы Atribacteria была даже описана гигантская вакуоль, занимающая большую часть объема клетки и содержащая генетический материал бактерии. Но все же у подавляющего большинства бактерий геномная ДНК находится в особой зоне цитоплазмы, известной как нуклеоид, и никакими мембранами не окружена. Окрашивание клеток T. magnifica DAPI (это вещество специфически метит только ДНК) показало, что ДНК у этой бактерии находится внутри окруженных мембраной структур. В этих же компартментах концентрируются рибосомы. Пузырьки, содержащие геномную ДНК, разбросаны по всей цитоплазме клетки, включая апикальные почки. Подобные мембранные компартменты, содержащие и геномную ДНК, и рибосомы, ранее не были описаны ни у одной бактерии! Ученые предложили называть эти органеллы пепинами (pepins, от английского слова pips, которым называют мелкие косточки фруктов, например, киви или арбуза) [1].
Стоит уделить внимание и тому, как организована ДНК внутри этих бактерий. В наиболее типичном случае бактериальная клетка содержит единственную копию генома, представленную кольцевой молекулой ДНК. Однако увеличение размеров клетки неизбежно приведет к тому, что молекулы РНК, считанные с одной-единственной копии генома, а также синтезированные на их матрице белки просто физически не смогут достичь удаленных концов клетки. Именно по этой причине все гигантские бактерии полиплоидны и содержат от нескольких десятков до нескольких тысяч (!) копий генома. T. magnifica в этом отношении не стала уникальной, хотя степень ее полиплоидии поражает воображение: на 1 миллиметр нитевидной клетки приходится около 37 тысяч копий генома! Внутри двухсантиметровой клетки находится около 740 тысяч копий генома. Стоит ли говорить, что это абсолютный рекорд по количеству копий генома на клетку среди бактерий. Колоссальная полиплоидия открывает беспрецедентные возможности для геномных перестроек в пределах одной клетки, а именно, всевозможных дупликаций и подобных изменений [1].
Секвенирование генома T. magnifica и сравнение полногеномных последовательностей отдельных клеток показал, что популяции T. magnifica гомогенны на геномном уровне, как обычно и бывает в случае полиплоидных бактерий. Для секвенирования были использованы пять клеток, прикрепленных к одному и тому же листу мангрового кустарника и, следовательно, представляющих одну популяцию. Вывод о гомогенности популяций бактерии был сделан на основании сравнения геномов секвенированных клеток: оказалось, что доля идентичных нуклеотидов в одинаковых позициях составляет целых 99,5%! Сам геном T. magnifica состоит из примерно 12 миллионов пар оснований, что вдвое превышает длину генома второго представителя рода Thiomargarita с секвенированным геномом, Candidatus T. nelsonii. При среднем размере бактериальных геномов в 4,2 миллиона пар оснований геном T. magnifica является одним из крупнейших секвенированных геномов бактерий. В его состав входит 11,788 генов, при том что средний геном бактерии включает около 4 тысяч генов. По размеру генома T. magnifica сопоставима с пекарскими дрожжами Saccharomyces cerevisiae, чей геном включает 12,1 млн пар оснований, а по числу генов эта бактерия обходит даже гриб Aspergillus nidulans, в геноме которого насчитывается порядка 9,5 тысяч генов [1].
Судя по функциональной аннотации генов, T. magnifica является хемоавтотрофным организмом, способным к фиксации углерода и окислению соединений серы, что подтверждается наличием в ее цитоплазме гранул элементарной серы. Примечательно, что, несмотря на внушительный арсенал метаболических путей, T. magnifica практически полностью лишена генов, ответственных за восстановление нитрата и денитрификацию. Таким образом, T. magnifica может использовать нитрат как акцептор электронов в дыхательной цепи. Отсутствие эпибиотических бактерий на поверхности клеток T. magnifica можно объяснить продукцией большого количества вторичных метаболитов, которые, возможно, обладают активностью антибиотиков. В геноме T. magnifica закодированы десятки нерибосомных пептидсинтаз и поликетидсинтаз, которые и отвечают за синтез веществ такого рода [1].
Необычная морфология T. magnifica отразилась и на репертуаре генов, продукты которых участвуют в делении клеток. Оказалось, что T. magnifica утратила львиную долю генов, необходимых для деления бактериальных клеток, однако имеет полный набор генов, связанных с удлинением клеток. Возможно, именно сокращение количества генов, отвечающих за деление, вкупе с активным удлинением клеток лежит в основе формирования невероятно длинных клеток [1].
Ранее мы отмечали, что на концах нитей T. magnifica находится от одной до четырех апикальных почек. Наблюдения за клетками T. magnifica в лаборатории показали, что эти почки время от времени отваливаются и дают начало новым нитевидным клеткам. Таким образом, компактные апикальные почки можно рассматривать как стадию жизненного цикла, на которой возможно распространение T. magnifica в пространстве: зрелые клетки, длинные и тонкие, слишком хрупки, чтобы служить надежной формой распространения. К слову, жизненный цикл с неравным делением и формированием почек встречается и у других бактерий, например, Caulobacter crescentus. Поскольку деление у T. magnifica неравное, апикальные почки получают лишь малую толику копий генома бактерии, которые располагаются внутри пепинов в апикальных почках. Если рассматривать апикальные почки как дочерние клетки, то жизненный цикл T. magnifica напоминает таковой у миксобактерий, формирующих плодовые тела, стрептомицет и даже инфузории Zoothamnium niveum. Авторы работы отмечают, что в этом случае имеет место конвергентная эволюция жизненных циклов у представителей разных доменов [1].
В заключение хотелось бы немного порассуждать о том, почему такие огромные бактерии, как T. magnifica, действительно ломают наши стереотипы о привычных размерах организмов из разных групп. Не секрет, что размер организма ограничивается множеством факторов окружающей среды. Например, почему сейчас не бывает двухметровых стрекоз, которые населяли Землю в каменноугольном периоде? За доставку кислорода к тканям у насекомых отвечает система тонких трубочек — трахей, которые буквально пронизывают тело животного. В карбоне уровень кислорода был выше, чем сейчас, поэтому эффективная доставка кислорода посредством трахей была доступна даже для очень больших насекомых. С современным уровнем кислорода гигантские насекомые бы не выжили: трахеи не смогли бы доставить необходимое количество кислорода ко всем тканям и органам [4]. В случае с прокариотическими организмами ограничения, накладываемые на размер, еще более строгие. У прокариот нет систем активного внутриклеточного транспорта, и молекулы движутся в цитоплазме, полагаясь на пассивную диффузию, которая хорошо подходит для переноса молекул в пределах нескольких микрометров. Очевидно, что в больших клетках диффузия не сможет обеспечивать эффективный транспорт разнообразных молекул во все уголки клетки. Большая клетка требует огромного количества белковых молекул, и, чтобы обеспечить его синтез, необходимо такое количество рибосом, что клетка будет буквально забита ими. Наконец, изменение соотношения площади поверхности клетки к ее объему приводит к тому, что, даже если заполнить всю мембрану молекулами АТФ-синтазы (напомним, АТФ-синтаза — это фермент, который всегда заякорен в мембране), энергии для такой огромной клетки все равно будет не хватать. При этом T. magnifica в три раза превышает максимальный теоретический размер прокариотической клетки, рассчитанный с учетом перечисленных ограничений. Как же ей это удается? Вполне возможно, что усложнение внутриклеточной организации, а именно, наличие многочисленных мембранных органелл, помогает бактерии «обмануть» законы природы. Как знать, может, в скором времени мы узнаем о еще более крупных и странных бактериях и археях, которые полностью сломают наши представления об устройстве прокариотической клетки.
Изменение жизненного цикла развития Caulobacter crescentus
Сегодня мы поговорим о Caulobacter crescentus
Caulobacter crescentus - это одноклеточная небольшая бактерия, которая делится асимметрично ,продуцируя клетки, различающиеся по структуре и функции - это идеальная модель для изучения механизмов асимметричного деления клеток.

Физиология и биохимические особенности
Это грамотрицательные палочковидные клетки, которые могут иметь жгутик или стебель. У Caulobacter отсутствуют внутриклеточные органеллы. Они являются гетеротрофными аэробами и могут быть найдены в водных средах, прикрепленных к стеблям твердых частиц, растительных материалов или других микроорганизмов. Caulobacter делится асимметрично, образуя дочерние клетки двух типов, которые функционально и структурно различны. Цилиндрическое тело клетки стебля имеет диаметр приблизительно 0,7 мкм и длину 2-3 мкм. Клетка с жгутиком изначально меньше клетки с стеблем.

Caulobacter обычно живут в водной среде, где наиболее распространенным питательным веществом является фосфор, необходимый элемент для здорового роста клетки. Недостаток этого питательного вещества заставляет Caulobacter значительно удлинять свой стебель до 30 раз дольше, сравняя с размером стебля в богатой фосфором среде.
Caulobacter делится асимметрично, образуя подвижную клетку с жгутиком и клетку стебля. Клетка с жгутиком плавает в течение 30-45 минут, прежде чем потерять жгутик и дифференцироваться в клетку стебля. Жгутик выбрасывается из клетки путем разрушения структур у основания жгутика. Внутри жгутиковой клетки хромосомы не реплицируются; тем не менее, репликация хромосомы начинается сразу в дочерней клетке со стеблем и когда жгутиковая клетка теряет свой жгутик, стебельная прилипает к поверхности через адгезивную органеллу.
Несколько двухкомпонентных белков сигнальной трансдукции участвуют в процессе клеточного цикла, накапливаясь на одном или обоих полюсах. В дополнение к этому, метилирование ДНК является основным компонентом дифференцировки передачи сигналов. На протяжении клеточного цикла хромосома постепенно превращается из полностью метилированной в гемиметилированную, во время репликации ДНК - это приводит к дифференциальному связыванию регуляторных белков для активации или репрессии транскрипции.
Про культивирование ничего не могу сказать точно, ибо хоть бактерия и хорошо изучена и описана, но информации о культивации я не нашёл и не знаю. По моей логике, этой бактерии хватит и простого мясо-пептонного агара с добавлением фосфатов, культивация должна проходить в температурном районе около 34-36 градусов за Цельсием.
Эта бактерия обладает силой сцепления, которая в 7 раз выше, чем та, которую вырабатывают лапки геккона, а еще она «сильнее» коммерческого суперклея в 3-4 раза. Caulobacter crescentus встречается практически повсюду - в любой среде, в любых водоемах и в любой воде (соленой, пресной, водопроводной). Этот микроб передвигается с помощью придатка под названием жгутик, пока не найдет для себя комфортного местечка, где и остается жить. Когда идеальный дом найден, бактерия просто прилипает к его поверхности тоненькими отростками под названием пили или фимбрии. Когда удобное положение наконец-то занято, бактерия выделяет сахаристую адгезионную субстанцию, которая немедленно и намертво приклеивает микроорганизм к избранному объекту. Ученые провели ряд экспериментов, и выяснили, что «суперклей», производимый этой уникальной бактерией, обладает силой сцепления в 703 килограмма на квадратный сантиметр. Другими словами, небольшой лоскуток из этого вещества смог бы выдержать целого слона или несколько машин, если бы можно было подвесить их над землей. Поскольку бактерия Caulobacter crescentus обитает в очень скудной на питательные вещества среде, ученые считают, что ее суперклей также помогает ей и в добыче пропитания. Исследователи убеждены, что у настолько клейкой субстанции есть невероятный практический потенциал, который люди в будущем смогли бы использовать для создания прочнейших строительных материалов или в медицинских целях, например, во время операций.
Читайте также:
- Почечная колика: случай успешного лечения болезни с нетипичным симптомом
- Техника, этапы операции чрескожной реконструкции латеральных связок голеностопного сустава
- Исследование сосудов головного мозга
- Прекращение сердечной деятельности. Асистолия. Причины ( этиология ) асистолии.
- Синдром чемодана без ручки. Как разорвать отношения, которые себя изжили?
