Концепция вестибулярного тонуса. Значение вестибулярного тонуса в развитии головокружения
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
1. Поликлиника восстановительного лечения №7;
2. Кафедра неврологии и нейрохирургии Российского национального исследовательского медицинского университета им. Н.И. Пирогова;
3. Окружные неврологические отделения Москвы
Опыт лечения вестибулярного головокружения и синдрома Меньера в амбулаторных условиях
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2012;112(12): 36‑40
Костенко1 Е.В., Петрова1 Л.В., Торгованова14 Е.А., Ганжула3 П.А., Лисенкер3 Л.Н., Отческая3 О.В., Хозова3 А.А., Лебедева2 А.В., Бойко2 А.Н. Опыт лечения вестибулярного головокружения и синдрома Меньера в амбулаторных условиях. Журнал неврологии и психиатрии им. С.С. Корсакова. 2012;112(12):36‑40.
Kostenko1 EV, Petrova1 LV, Torgovanova14 EA, Ganzhula3 PA, Lisenker3 LN, Otcheskaia3 OV, Khozova3 AA, Lebedeva2 AV, Boĭko2 AN. Treatment of vestibular vertigo and Ménière syndrome in outpatient clinics. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2012;112(12):36‑40. (In Russ.).
Цель исследования - оценка клинической эффективности и переносимости препарата тагиста при симптоматическом лечении вестибулярного головокружения (вертиго) и синдрома Меньера. Наблюдали 32 больных, 16 женщин и 16 мужчин, в возрасте от 25 до 67 лет. В 17 случаях головокружение было обусловлено хронической ишемией головного мозга, в 14 оно было связано с дисциркуляцией в вертебрально-базилярной системе на фоне остеохондроза шейного отдела позвлночника, и в 1 случае был диагнотирован синдром Меньера. Препарат тагиста назначался в течение 4 нед в дозе 48 мг в сутки (по 24 мг 2 раза) в комбинации с ранее назначенной базисной медикаментозной терапией, лечебной физкультурой и стабилотренингом. Получены статистически достоверные показатели, свидетельствующие о положительном влиянии изучавшегося препарата на основные проявления заболевания (частоту, продолжительность, интенсивность приступов головокружения и др.) и его хорошей перносимости, что послужило основанием для его рекомендации к применению в неврологической практике.
Головокружение — одна из самых распространенных жалоб больных, встречающихся во врачебной практике.
У амбулаторных больных, обращающихся к врачам всех специальностей, головокружение является основной жалобой в 2—5% случаев. В последние годы отмечается значительный рост частоты (до 5—10%) этого симптома во всех развитых странах [8, 9]. Головокружение может быть как физиологической реакцией, так и проявлением патологии. Оно возникает при разных заболеваниях среднего и внутреннего уха (воспалительного и невоспалительного характера), патологии центральной нервной системы, органов шеи, в том числе при дегенеративно-дистрофических изменениях шейного отдела позвоночника, метаболических и гематологических отклонениях, приеме ряда лекарственных веществ, инфекционных поражениях, кардиогенных расстройствах и т.д. Нередко встречается сочетание нескольких причин [4, 6, 14]. Во всех случаях головокружение приводит к ухудшению качества жизни пациента, вплоть до стойкой утраты трудоспособности и инвалидности [8, 14].
Причины головокружения не всегда понятны и легко устранимы. Поэтому основное значение в терапии больных с головокружением приобретает патогенетическое и симптоматическое лечение. Накопленный клинический опыт показывает, что предлагаемые на сегодняшний день лекарственные средства для лечения больных с головокружением относятся к разным фармакологическим группам и имеют различную эффективность и переносимость. Наибольшей эффективностью при лечении головокружения обладают средства, действующие на уровне вестибулярных рецепторов или центральных вестибулярных структур [4, 16, 17].
На сегодняшний день установлено, что передача импульсации от вестибулярных рецепторов и вестибулярных ядер обеспечивается преимущественно гистаминергическими нейронами. Основным источником гистаминергической иннервации является задний гипоталамус, главным образом туберомамиллярное ядро, нейроны которого связаны практически со всеми структурами диэнцефальной области и конечного мозга, включая базальные ганглии и кору, а также со стволом и, в частности, с комплексом вестибулярных ядер. При периферических вестибулярных расстройствах наблюдается усиление спонтанной импульсации нейронов ипсилатеральных вестибулярных ядер, главным образом медиального. Одновременно отмечается снижение экспрессии рецепторов ГАМК, что ведет к преобладанию возбуждающих гистаминергических влияний. Гистаминергическая система также обеспечивает передачу возбуждения между вестибулярными ядрами и рвотным центром [15].
Поскольку важную роль в функционировании вестибулярных структур играет гистаминергическая система, в качестве базового средства лечения синдрома головокружения используется гидрохлорид бетагистина, имеющий структурное сходство с гистамином. Бетагистин реализует свое действие через центральные и периферические гистаминовые рецепторы. Центральная активность бетагистина в отношении вестибулярного аппарата способствует развитию компенсации, периферическая активность увеличивает кохлеарный кровоток [17].
Одним из препаратов бетагистина является тагиста. Это средство имеет структурное сходство с гистамином. Вследствие блокады Н3-рецепторов и стимуляции H1-рецепторов тагиста увеличивает высвобождение нейромедиаторов из нервных окончаний пресинаптической мембраны, оказывает ингибирующий эффект в отношении вестибулярных ядер ствола мозга и улучшает кровоснабжение внутреннего уха.
Цель данного исследования — оценка клинической эффективности и переносимости препарата тагиста при симптоматическом лечении вестибулярного головокружения (вертиго) и синдрома Меньера.
Материал и методы
В исследование были включены 32 пациента, 16 женщин и 16 мужчин, в возрасте от 25 до 67 лет (средний — 53,4±10,7 года) с вестибулярным головокружением и синдромом Меньера, наблюдавшихся в 5 окружных неврологических отделениях Москвы.
В исследование включались пациенты с системным постоянным или приступообразным головокружением установленной этиологии; с частыми (не реже 3 раз в неделю) приступами любой степени выраженности и общей продолжительностью более 1 мес.
Критериями исключения больных из исследования служили: наличие головокружения неустановленной этиологии; декомпенсация соматических заболеваний; язвенная болезнь желудка и двенадцатиперстной кишки, эрозивный гастрит в стадии обострения; феохромоцитома; бронхиальная астма в стадии обострения; установленные заболевания внутреннего и среднего уха воспалительного характера, в том числе после оперативного вмешательства; повышенная чувствительность к бетагистину или вспомогательным компонентам исследуемых препаратов; беременность и лактация; злоупотребление алкоголем; эндогенные психические расстройства.
Во время исследования запрещался прием других ноотропных и метаболически активных препаратов, а также средств, влияющих на головокружение: антигистаминных, антидепрессантов, транквилизаторов, нейролептиков. В случае, если пациент принимал препараты вышеперечисленных групп, производилась их отмена не менее чем за 4 нед до включения в исследование.
Основными причинами головокружения являлись хроническая ишемия головного мозга — у 17 (53,1%) человек; дисциркуляция в вертебрально-базилярной системе на фоне остеохондроза шейного отдела позвоночника — у 14 (43,75%); у 1 (3,15%) больного диагностирована болезнь Меньера.
Головокружение отразилось на работоспособности у 22 (68,7%) пациентов; 8 (25%) человек сменили работу, в 4 (12,5%) случаях головокружение стало причиной стойкой инвалидизации. За последние 3 мес в связи с острым головокружением 8 (25%) человек неоднократно вызывали бригаду скорой медицинской помощи (в среднем 3,75 раза в месяц). По поводу головокружения 16 (50%) пациентов обращались к терапевту в среднем 2,7 раза в месяц; к неврологу — 31 (96,9%) пациент в среднем 3,7 раза в месяц. Двое (6,25%) больных были выписаны из неврологического стационара, где проводилась коррекция вестибулярных нарушений. На амбулаторном лечении с оформлением документа о нетрудоспособности в связи с головокружением находились 4 человека (средняя длительность нетрудоспособности 7,3±4,8 дня).
Для оценки эффективности терапии исследовалась динамика неврологических симптомов, а также использовался ряд дополнительных методик [5]: вестибулярные тесты: нистагм — спонтанный, оптокинетический, позиционный; вестибулоспинальные пробы: проба Ромберга, шаговая проба Унтерберга, указательная проба Барани; шкала головокружения; методика оперативной оценки самочувствия, активности и настроения (САН) в модифицированном варианте В.А. Доскина; шкала общего клинического впечатления (CGI), которая используется для дополнительной количественной оценки возможного ухудшения или улучшения психического состояния пациента в процессе терапии. Оценки по этой шкале варьируют от 1 до 7 баллов: 1 — «очень значительное улучшение», 2 — «существенное улучшение», 3 — «минимальное улучшение»; 4 — «нет изменений», 5 — «минимальное ухудшение», 6 — «умеренное ухудшение», 7 — «значительное ухудшение». Кроме того, использовали балльную оценку переносимости и эффективности препарата (0—4 балла).
При неврологическом осмотре у большинства больных выявлялись координаторные (50%) и чувствительные (28,12%) расстройства, нарушения мышечного тонуса — у 8 (25%) человек. Изменения слуха наблюдались у 23 (71,9%) пациентов в виде субъективного шума, треска в ухе, снижения слуха.
Наиболее часто пациентов беспокоили головокружения в виде вращения, уплывания, проваливания, качания, кроме того, их беспокоили проявления в виде шаткости при ходьбе, укачивания в транспорте, шума или звона в ушах, понижения слуха, головной боли, слабости, усталости, ухудшения памяти.
При проведении вестибулоспинальных проб неустойчивость в позе Ромберга выявлена в 22 (68,75%) случаях. Отклонения в пробе Унтерберга — у 18 (56,25%) человек, указательной пробе Барани — у 14 (43,75%) больных. Спонтанный и оптокинетический нистагм зафиксирован у 13 (40,6%) пациентов.
Артериальная гипертония была у 12 (37,5%) больных, ишемическая болезнь сердца — у 6 (18,75%). У 8 (25%) имелись соматические заболевания: мочекаменная болезнь, хронический холецистит, хронический гастрит, хронический пиелонефрит, катаракта. Один пациент наблюдался отоларингологом в связи с хроническим отитом. Сопутствующую терапию, не противоречащую критериям включения в исследование, получали 17 человек.
Всем больным препарат тагиста назначался в дозе 48 мг в сутки (2 таблетки по 24 мг 2 раза в день). Он входил в состав комплексной терапии: пациенты продолжали принимать базовую гипотензивную терапию, дезагреганты, назначались также лечебная гимнастика и стабилотренинг с биологически-обратной связью на стабилоплатформе — 10 процедур по стандартной методике. Длительность лечения составляла 4 нед. Состояние пациентов изучали до и после курса лечения.
Результаты исследований заносились в индивидуальную регистрационную карту пациента и подвергались статистической обработке на персональном компьютере с использованием стандартизованных функций программ Excel, Epi и Statistica 6.0. Достоверность различий средних величин определяли с помощью параметрического метода (t-тест Стьюдента) и непараметрической статистики (критерий &khgr; 2 ). Различия считались статистически достоверными при р
Кохлеовестибулярные нарушения: подходы к диагностике и лечению
Проведена оценка эффективности включения Мильгаммы и Мильгаммы композитум в схему лечения пациентов с кохлеовестибулярными нарушениями. В результате проведенного лечения у пациентов, получавших Мильгамму и Мильгамму композитум, вестибулярная компенсация (в том числе по данным постурографических показателей) достигалась в более короткие сроки — через 3—4 нед от начала лечения, тогда как у пациентов, не получавших эти препараты, — через 5 нед. Таким образом, можно рекомендовать применение Мильгаммы и Мильгаммы композитум в качестве нейротропных средств, дополняющих базовую терапию у пациентов с кохлеовестибулярными нарушениями для сокращения сроков достижения вестибулярной компенсации.
Ключевые слова: кохлеовестибулярные нарушения, головокружение, нарушения равновесия, сенсоневральная тугоухость, Мильгамма, Мильгамма композитум.
The aim of this work was to evaluate the efficacy of introduction of milgamma and milgamma compositum in the treatment of 52 patients with cochleovestibular disorders of different etiology. Thirteen patients enrolled in the study received standard therapy and 39 others were given its combination with milgamma preparations. Combined therapy with milgamma and milgamma compositum ensured faster vestibular compensation including posturographic characteristics than the standard treatment (within 3—4 weeks compared with 5 weeks in controls). The results of the study give reason to recommend milgamma and milgamma compositum as neurotropic medicines in addition to standard therapy for the management of the patients presenting with cochleovestibular disorders for the acceleration of the vestibular compensation.
Key words: cochleovestibular disorders, dizziness, balance disorder, sensorineural loss of hearing, milgamma, milgamma compositum.
Актуальность проблемы кохлеовестибулярных нарушений определяется в первую очередь высоким уровнем заболеваемости с преобладанием лиц наиболее активного и трудоспособного возраста [1—4]. Так, при опросе более 20 тыс. человек в возрасте от 18 до 64 лет выяснилось, что за последний месяц более 20% испытали головокружение, из них свыше 30% страдают головокружением на протяжении более 5 лет [5]. Около трети пациентов, обращающихся к оториноларингологам, высказывают жалобы на различные типы головокружения. В Российской Федерации число больных с кохлеовестибулярными нарушениями составляет 13—14 человек на 10 тыс. населения [6]. Следует отметить, что детальное вестибулометрическое исследование больных острой сенсоневральной тугоухостью в ряде случаев позволяет выявить нарушения функции лабиринта [2]. Установленная по результатам калорической и вращательной проб экспериментальная вестибулярная гипо- или гиперрефлексия, а также выявленная в ходе стабилометрического исследования статическая атаксия даже при отсутствии спонтанной вестибулярной симптоматики дает основания расценивать такое состояние больного, как кохлеовестибулярное нарушение [7]. Считается, что при сенсоневральной тугоухости наиболее часто регистрируется симптоматика, характерная для периферического вестибулярного синдрома угнетения [2].
Периферические вестибулярные расстройства возникают при поражении сенсорных элементов ампулярного аппарата и преддверия, вестибулярного ганглия и нервных проводников ствола мозга [8].
Периферическое вестибулярное головокружение — это чаще головокружение приступообразного характера различной интенсивности (от слабых до бурных атак), сопровождающееся спонтанным нистагмом — клоническим горизонтальным или горизонтально-ротаторным, разной интенсивности, степени, ассоциированным с гармоничным отклонением туловища и рук в сторону медленного компонента. Отмечается положительное влияние поворота головы (в сторону медленного компонента нистагма). Как правило, периферическое вестибулярное головокружение бывает односторонним и нередко сопровождается нарушением слуховой функции на пораженной стороне. Экспериментальные пробы выявляют угнетение функции вестибулярных рецепторов (кроме начального периода заболевания) [9].
Установление причины кохлеовестибулярного расстройства весьма важно, поскольку это обеспечивает возможность проведения патогенетически обоснованного лечения и выбора адекватной профилактической тактики.
Обследование пациентов с кохлеовестибулярными нарушениями должно быть детальным и всесторонним и обязательно включать обследование у отоневролога, позволяющее оценить функциональное состояние вестибулярного анализатора и уровень его поражения.
Расстройство функции равновесия (атаксия), являясь неотъемлемой частью кохлеовестибулярных нарушений, существенно ухудшает качество жизни: пациенты нередко оказываются неспособными без посторонней помощи передвигаться даже в пределах собственного жилища. Поэтому при оценке состояния вестибулярной функции большое внимание уделяется исследованию способности человека поддерживать вертикальное положение тела — функции равновесия, осуществляющейся посредством установочных рефлексов, которые удерживают центр массы тела в пределах проекции площади его опоры.
Одним из способов выявления атаксии является цифровая постурография. Применявшиеся ранее методики проведения стабилографического исследования предполагали проведение проб, часто мучительных для пациента: обследование на аппарате, конструкция которого предусматривала качательные движения в горизонтальной и сагиттальной плоскостях, которые регистрировались на ЭВМ, контроль спонтанных и поствращательных отклонений при помощи «пишущего стержня» и шкалы, прикрепленных к креслу Барани [10]. Позднее для выявления нарушений статокинетической устойчивости были предложены пробы, не сопровождающиеся вегетосенсорными проявлениями: медленные наклоны головы в сагиттальной и фронтальной плоскости, повороты головы вправо и влево с последующей ходьбой по прямой линии, а также алгоритм «пятка—носок», шагательная проба [11].
Использование современной аппаратуры значительно расширило диагностические возможности проведения статокинетических исследований, позволило проводить информативную качественную и количественную оценку функции равновесия. Современным вариантом позы Ромберга является проведение исследования на стабилометрической платформе, являющейся центром прибора, оценивающего функцию равновесия в количественном отношении [12]. Для дифференциальной диагностики различных нарушений функции равновесия используются нагрузочные функциональные пробы с одновременной постурографией: пробы с оптокинетической стимуляцией, с максимальным поворотом головы вправо и влево, с дозированной пороговой вращательной стимуляцией, с фиксацией взора [13].
Лечение пациентов с кохлеовестибулярными нарушениями должно быть незамедлительным и этиотропным и включать наряду с вестибулярной реабилитацией использование вазоактивных, антихолинергических, нейротропных препаратов (высокие дозы витаминов группы В) [6, 14]. Витамины группы B, прежде всего В1, В6 и В12, многие годы применяются в комплексном лечении заболеваний периферической нервной системы с целью улучшения обменных и усиления регенеративных процессов в нейроэпителии и замедления развития нейропатии [15].
Витамин В1 (тиамин) участвует в энергетических процессах в нервных клетках, в частности в цикле Кребса [16], и регенерации поврежденных нервных волокон [6, 17—19].
Витамин В6 (пиридоксин) является кофактором более чем для 100 ферментов, а благодаря способности регулировать метаболизм аминокислот нормализует белковый обмен [20, 21]. Кроме того, в последние годы доказано, что витамин В6 имеет антиоксидантное действие [22], участвует в синтезе катехоламинов, гистамина и гаммааминомасляной кислоты, увеличивает внутриклеточные запасы магния, также играющего важную роль в обменных процессах нервной системы.
Витамин В12 (цианокобаламин) играет важную роль в делении клеток, кроветворении, регуляции обмена липидов и аминокислот. Он участвует в важнейших биохимических процессах миелинизации нервных волокон [23].
В период с января 2008 г. по май 2011 г. проведено консервативное лечение 52 пациентов в возрасте от 18 до 43 лет (23 женщины и 29 мужчин) с кохлеовестибулярными нарушениями. Причиной кохлеовестибулярных нарушений у 21 пациента явилась перенесенная острая респираторная вирусная инфекция, у 19 — стрессовый фактор, у 12 — подъем артериального давления. Всем пациентам проводилось комплексное аудиологическое и вестибулологическое исследование, включавшее исследование спонтанной отоневрологической симптоматики, оптокинетического нистагма (скорость движения стимула 15°/с, 30°/с и 45°/с), тесты плавного зрительного слежения, зрительных саккад, позиционный тест Дикса—Холлпайка, битермальный бинауральный калорический тест, вращательный тест с записью движения глаз на видеоокулографическом комплексе VNG Stad Alone Unit VO 25 («Heinemann Medizintechnik GmbH», Германия), исследование статики, координации на постурографическом комплексе Smart EquiTest Balans Master («NeuroCom», США), электрокохлеография на установке Viking Ques («Nicolet», США) и/или дегидратационный тест с ксилитом.
Повторная аудиометрия и вестибулометрия проводились сразу по окончании лечения и спустя 2 мес, цифровая постурография выполнялась еженедельно на протяжении курса лечения и также спустя 2 мес. Выраженность головокружения оценивали по критериям выраженности функциональных нарушений Международной классификации функций ВОЗ: 0 — нет (никаких, ничтожные), 1 — легкие (незначительные, слабые), 2 — умеренные (средние, значимые), 3 — тяжелые (высокие, интенсивные), 4 — абсолютные (полные) [29].
Дополнительные исследования включали: рентгенографию височных костей по Стенверсу, при необходимости магнитно-резонансную томографию головного мозга/внутренних слуховых проходов и мостомозжечковых углов; рентгенографию шейного отдела позвоночника, экстра- и транскраниальную допплерографию. Всем больным выполняли общеклинические анализы крови и мочи, биохимический анализ крови, коагулограмму.
39 человек (19 женщин и 20 мужчин в возрасте от 18 до 43 лет) получали помимо базовой терапии препараты Мильгамма и Мильгамма композитум по схеме: Мильгамма внутримышечно №10, затем по 1 драже Мильгаммы композитум 3 раза в день в течение 6 нед.
13 пациентам (6 женщинам и 7 мужчинам в возрасте от 20 до 43 лет) Мильгамма и Мильгамма композитум не назначались в связи с индивидуальной непереносимостью витаминов В-группы; они получали только препараты базовой терапии.
Данные отоневрологического и аудиологического исследований у пациентов, получавших и не получавших препараты Мильгамма и Мильгамма композитум, были сравнимы.
Данные компьютерной постурографии с автоматическим расчетом показателей, в частности индекса вестибулярной устойчивости, измеряемого в процентах, — отношение суммарной амплитуды смещения центра тяжести к абсолютному центру платформы — у пациентов обеих групп, получавших препараты Мильгамма и Мильгамма композитум, были также сравнимы и достоверно (р
В результате проведенного лечения у всех пациентов при проведении контрольной постурографии на момент окончания курса зафиксировано уменьшение статической атаксии, что выразилось в достоверном (рОднако у пациентов, принимавших Мильгамму и Мильгамму композитум, нормализация постурографических показателей наступала в среднем на 2 нед раньше и индекс вестибулярной устойчивости по окончании лечения был достоверно (р
| Сроки обследования в процессе лечения | Базовое лечение (n=13) | Базовое лечение+Мильгамма и Мильгамма композитум (n=39) |
| До начала лечения | 49±7 | 47±10 |
| От начала лечения | ||
| через 1 нед | 53±8 | 60±7 |
| через 2 нед | 59±4 | 67±6 |
| через 3 нед | 64±5 | 72±6 |
| через 4 нед | 70±6 | 79±4 |
| через 5 нед | 72±3 | 83±6 |
| через 6 нед | 78±6 | 85±7 |
| Спустя 2 мес после лечения | 81±5 | 86±6 |
Как видно из таблицы, у пациентов, получавших Мильгамму и Мильгамму композитум, стойкая нормализация основного постурографического показателя — индекса вестибулярной устойчивости (норма ≥70), достигалась в более короткие сроки — через 3—4 нед от начала лечения, тогда как у пациентов, получавших только базовую терапию, — через 5 нед.
Выраженность головокружения на момент окончания лечения пациенты в среднем оценивали на 0,3±0,2 балла по критериям выраженности функциональных нарушений Международной классификации функций ВОЗ (достоверной разницы в оценке выраженности головокружения среди пациентов обеих групп не было). У всех пациентов к окончанию курса лечения зафиксирована компенсация вестибулярной функции в покое, сочетавшаяся с положительной динамикой показателей повторной вестибулометрии. Повторное аудиологическое исследование показало, что у получавших Мильгамму и Мильгамму композитум пациентов слух улучшился в среднем на 24±0,8 дБ, что достоверно (р
Нежелательных явлений (т.е. любых неблагоприятных медицинских явлений, наблюдаемых у использующего медицинский продукт пациента, которое может и не иметь причинно-следственной связи с данным видом лечения) ни у кого из пациентов, в том числе получавших сопутствующую терапию, зафиксировано не было, лечение все переносили хорошо. Со слов пациентов, ни у одного из них за весь период наблюдений эпизодов вращательного головокружения не возникало. Таким образом, можно рекомендовать применение Мильгаммы и Мильгаммы композитум в качестве нейротропных средств, дополняющих базовую терапию у пациентов с кохлеовестибулярными нарушениями для сокращения сроков достижения вестибулярной компенсации и улучшения слуховой функции.
Физиологические основы поддержания равновесия
Причиной головокружения в большинстве случаев служит нарушение согласованной деятельности различных сенсорных систем - вестибулярной, зрительной, проприоцептивной (информация о положении тела в пространстве, получаемая от рецепторов, расположенных главным образом в мышцах и сухожилиях). Кроме того, важной, а иногда и доминирующей причиной возникновения головокружения является дисфункция центральных структур, участвующих в поддержании равновесия тела, главным образом, ядер мозжечка.
Вестибулярная система
Вестибулярная система состоит из:
- лабиринта,
- вестибулярной части преддверно-улиткового нерва,
- вестибулярных ядер в стволе головного мозга, а также их связей с другими отделами ЦНС (центральной нервной системы).
Правильная работа вестибулярной системы позволяет человеку четко ориентироваться в трехмерном пространстве, а именно:
- воспринимать положение тела относительно вектора силы тяжести (статический компонент);
- ощущать направление и скорость движения тела при его угловых и линейных перемещениях (динамический компонент).
Лабиринт располагается в каменистой части височной кости и включает:
- отолитовый аппарат, который представлен двумя сообщающимися камерами (саккулус и утрикулус);
- системой трех полукружных каналов, располагающихся во взаимоперпендикулярных плоскостях.
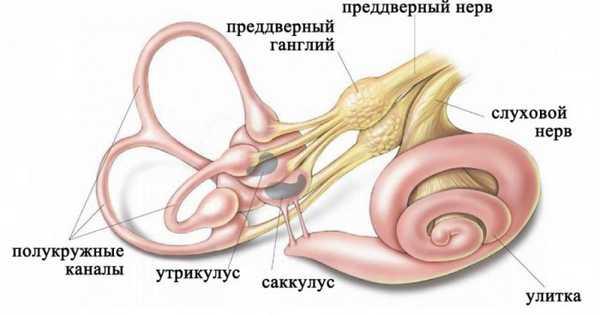
Строение лабиринта
В каждой камере отолитового аппарата и в каждом полукружном канале имеется скопление рецепторных клеток - макула, которая покрыта желатинообразной массой - купулой. В отолитовом аппарате купула покрывает волосковые клетки наподобие подушки и содержит отложения кристаллов кальцита (отолиты), которые придают купуле дополнительный вес.
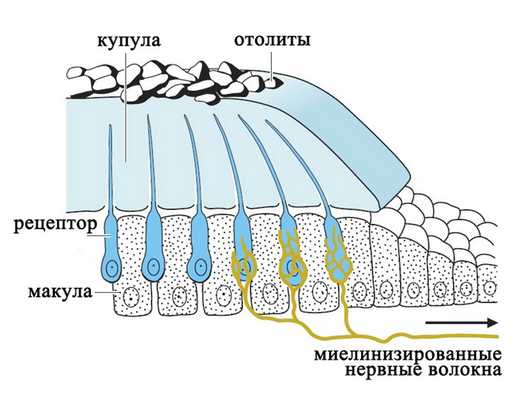
Отолитовый аппарат
В полукружных каналах желатинообразная масса не содержит отолитов и полностью перекрывает просвет канала.
Рецепторы вестибулярной системы представлены волосковыми клетками, которые несут на апикальной поверхности от 60 до 80 тонких выростов цитоплазмы (стереоцилий) и одну ресничку (киноцилию).
Восприятие положения тела относительно силы гравитации
При вертикальном положении головы макула утрикулуса располагается горизонтально. Когда голова наклоняется в сторону, утяжеленная отолитами желатинообразная мембрана под действием силы тяжести соскальзывает в сторону наклона. Это скольжение приводит к изгибанию стереоцилей волосковых клеток. Наклон стереоцилей сопровождается (в зависимости от направления) повышением или снижением частоты нервных импульсов в чувствительных нейронах вестибулярного ганглия. Макула саккулуса располагается вертикально и действует таким же образом.
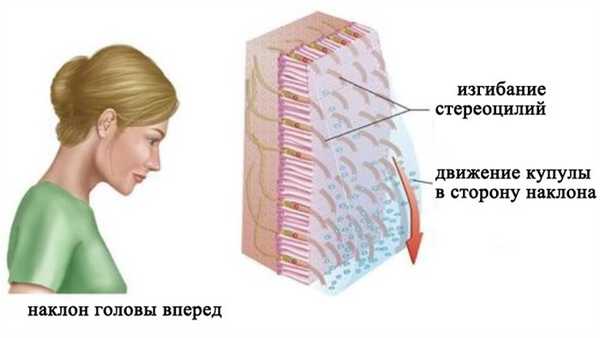
Восприятие положения тела относительно силы гравитации
Восприятие линейных ускорений
При резком линейном ускорении тела купула саккулуса или утрикулуса за счет сил инерции смещается в направлении, противоположном направлению движения, что также приводит к изменению электрической активности рецепторов.
Восприятие углового ускорения
Три полукружных канала расположены в трех разных плоскостях. Каждый из трех каналов действует как замкнутая трубка, заполненная лимфой. В расширенной части канала его внутренняя стенка выстлана волосковыми клетками, а расположенная над ними купула полностью перекрывает просвет канала. При повороте головы полукружные каналы поворачиваются вместе с ней, а эндолимфа в силу своей инерции в первый момент остается на месте. В результате этого возникает разность давлений по обе сторону купулы, и она прогибается в направлении, противоположном движению. Это вызывает деформацию стереоцилий и последующее изменение активности нейронов.
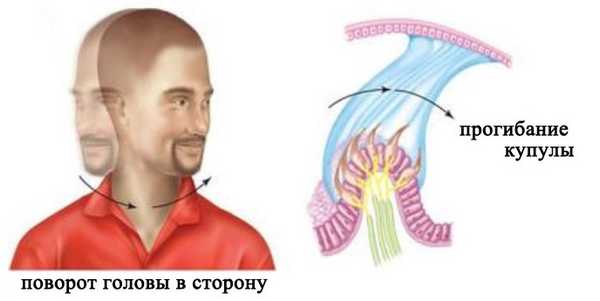
Восприятие углового ускорения
При вращении головы только в горизонтальной, сагитальной или фронтальной плоскости активируются рецепторы одного из соответствующих каналов. При сложном вращении головы активируются рецепторы всех трех каналов. Информация от них поступает в головной мозг и на основе ее конвергенции и анализа модулируется истинная картина перемещения головы.
Центральный отдел вестибулярной системы
Аксоны чувствительных нейронов, тела которых располагаются в вестибулярном ганглии, следуют в продолговатый мозг и оканчиваются в четырех парных вестибулярных ядрах. Приходящие в эти ядра импульсы от рецепторов дают точную информацию о положении в пространстве исключительно головы (но не всего тела!), поскольку она может быть наклонена или повернута относительно туловища. Для восприятия положения тела в пространстве необходим также учет угла наклона и поворота головы относительно туловища, поэтому вестибулярные ядра получают дополнительные стимулы от проприорецепторов мышц шеи.
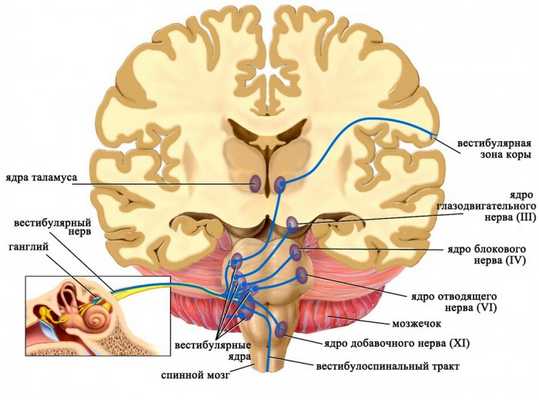
Ядра вестибулярного нерва и их связи
Далее от вестибулярных ядер афферентная импульсация направляется к нейронам специфических ядер таламуса, а отростки последних достигают постцентральной извилины коры больших полушарий головного мозга
Проприоцептивная система
Благодаря проприоцепции, мы ощущаем положение конечностей, движение и степень мышечного напряжения в них. Это дает человеку чувство “опоры”, т.е. осознание, что стопы опираются на какую-либо поверхность, удерживая вес тела. Рецепторный аппарат проприоцептивной чувствительности, расположен в мышцах, сухожилиях, фасциях, капсулах суставов, а также в коже.
Необходимо отметить, что важную роль в поддержании равновесия тела играют рецепторы глубокой чувствительности, расположенные не только в конечностях, но и в структурах шеи, главным образом, в глубоких мышцах. Информация, получаемая головным мозгом от этих рецепторов, необходима для пространственной ориентации человека, поддержании его позы, а также координинации движения головы и туловища.
Зрительная система
Эффективное поддержание равновесия требует четкого контроля со стороны зрительной системы (в соответствие с принципом обратной связи). При этом контроль над движениями мышц глазного яблока является чрезвычайно сложным процессом. Существует 3 основных системы контроля взора:
- Система саккадических движений глазных яблок;
- Система плавных (следящих) движений глазных яблок;
- Вестибуло-окулярная система.
В пределах головного мозга эти системы контролируются определенными анатомическими зонами, которые являются в значительной степени изолированными, и обеспечивают две главные функции:
- зафиксировать предмет рассматривания в периферии визуальной области, поворачивая к нему глаза;
- удержать изображение предмета рассматривания устойчивым на ямке сетчатки.
Система саккадических движений глазных яблок
Когда объект интереса появляется в периферии визуальной области, происходит быстрый поворот глазных яблок в его сторону, так, что изображение объекта проецируется на сетчатку в области желтого пятна. Тот же самый двигательный ответ глазных яблок может быть вызван внезапным звуком или болезненным стимулом. Такое быстрое движение глаз называется саккадическим, от французского слова, означающего резкое движение парусника при ветре или дергание головы лошади от потягивания узды. В целом, система саккадических движений глазных яблок обеспечивает обнаружение зрительной цели и выведение ее на наиболее чувствительную часть сетчатой оболочки. Саккады возникают, например, в процессе чтения, при этом глаза человека обычно совершают несколько саккадических движений на каждой строке. Кроме того, они появляются, когда человек рассматривает какой-либо объект (картину, скульптуру и пр.), но в этом случае саккады совершаются в разных направлениях (вверх, вниз, в стороны и под углом) последовательно от одной точки объекта к другой.
Классическое изображение, описывающее саккадические движение глазных яблок
при рассматривании объекта
Система плавных (следящих) движений глазных яблок
Когда объект рассматривания перемещается, саккадическая система может первоначально зафиксировать его, но скоро теряет, поскольку изображение ускользает из области желтого пятна (сетчатое скольжение). Плавные (следящие) движения глаз необходимы для длительной фиксации движущегося объекта и слежения за ним. После того как визуальная цель выбрана, система работает вне волевого контроля.
Схематическое изображение функционирования системы
плавных (следящих) движений глаз
Вестибуло-окулярная система
В то время как система следящих движений глазных яблок фиксирует изображение перемещающегося объекта рассматривания на желтом пятне, существует другая система, которая позволяет стабилизировать изображение неподвижного объекта рассматривания на сетчатке во время движения головы. Это основная функция вестибуло-окулярной системы. Благодаря ее наличию у человека во время движения на транспорте по неровной дороге или ходьбе не возникает проблем с четким рассматриванием отдаленного объекта. В том случае, когда по какой-либо причине вестибуло-окулярная система не работает возникает феномен, называющийся “осциллопсия” - “дергание” визуальной картинки при движении.
Мозжечок
Основная функция мозжечка заключается в получении информации о положении тела в пространстве от всех органов чувств и регуляции на ее основе мышечного тонуса и движений для поддержания равновесия и выполнения точных действий.
Для больных с повреждением мозжечка характерна астазия-абазия - нарушение способности к сохранению равновесия тела при стоянии и ходьбе. Больные ходят, широко расставив ноги - так называемая туловищная атаксия (“пьяная походка”).
Ходьба на пятках и носках невозможна. Атаксия в данном случае развивается вследствие неспособности головного мозга координировать деятельность мышц в процессе преодоления силы тяжести. Также выявляются глазодвигательные расстройства. Они проявляются нарушением фиксации взора на неподвижных или двигающихся объектах, в результате чего возникают рывковые движения глаз при слежении. Также характерен вертикальный нистагм, бьющий вверх или вниз.
Головокружение в неврологической практике
Головокружение — это симптом, который может сопровождать течение целого ряда заболеваний различных органов и систем организма. В неврологической практике головокружение является ведущей жалобой примерно у 12% больных.
Клинически значимым является разделение головокружения на вестибулярное и невестибулярное. Под вестибулярным головокружением понимают иллюзию движения самого человека или предметов окружающей среды. Вестибулярное (истинное или системное) головокружение свидетельствует о патологии вестибулярного анализатора, причем как его периферического, так и центрального отделов.
Все другие ощущения, которые отличаются от системного головокружения (расстройства равновесия — неустойчивость, пошатывание; чувство опьянения и дурноты; синкопальные и предобморочные состояния; «пелена» перед глазами, «пустота и легкость» в голове и прочие ощущения дискомфорта в голове) не связаны с патологией вестибулярного анализатора и носят название невестибулярного (несистемного) головокружения.
В зависимости от уровня поражения вестибулярного анализатора выделяют периферический (ПВС) и центральный (ЦВС) вестибулярные синдромы.
ПВС возникает при поражении рецепторных образований внутреннего уха, вестибулярного ганглия и корешка VIII пары черепных нервов. Наиболее часто встречающиеся нозологические формы, сопровождающиеся ПВС, — болезнь Меньера, доброкачественное пароксизмальное позиционное головокружение (ДППГ), острый и хронический лабиринтит, острое нарушение кровообращения во внутренней слуховой артерии.
Характерными особенностями головокружения при ПВС являются:
быстрое наступление компенсации за счет включения центральных компенсаторных механизмов — продолжительность остаточной вестибулярной дисфункции редко превышает месяц.
Головокружение при поражении периферического отдела вестибулярного анализатора обязательно сопровождается односторонним горизонтальным или горизонтально-ротаторным спонтанным нистагмом, направление которого определяется стадией раздражения или угнетения лабиринта. Как правило, в начале приступа пациенты ощущают движение предметов в сторону больного уха, в эту же сторону направлен и нистагм (стадия раздражения лабиринта). В последующем, по мере угнетения лабиринта, головокружение и нистагм могут поменять свое направление на противоположное (в сторону здорового уха).
Обязательным для периферического головокружения является наличие спонтанного отклонения рук и туловища в сторону, противоположную направлению спонтанного нистагма.
Для ПВС характерны слуховые расстройства (снижение слуха, ушной шум).
ЦВС развивается при поражении вестибулярных ядер и путей в задней черепной ямке, а также вестибулярных образований в корково-подкорковых отделах мозга. ЦВС, как правило, наблюдается при патологии центральной нервной системы различного генеза.
Для головокружения при ЦВС характерны:
длительное (месяцы, годы) присутствие остаточной вестибулярной дисфункции вследствие ограниченности компенсаторных возможностей при центральном поражении;
Спонтанный нистагм при ЦВС либо отсутствует, либо наблюдается в нескольких направлениях. Может присутствовать вертикальный, диагональный или конвергирующий спонтанный нистагм. Спонтанного отклонения рук и туловища не наблюдается, или его направление совпадает с направлением спонтанного нистагма.
В случае, если процесс в центральной нервной системе остро воздействует на вестибулярные образования, то головокружение по своему характеру и интенсивности во многом сходно с таковым, которое наблюдается при патологии периферического отдела вестибулярного анализатора.
В рамках данной статьи хотелось бы поподробней остановиться на вестибулярной патологии, которая вследствие скудной освещенности в отечественной литературе вызывает наибольшие диагностические и терапевтические трудности как в неврологической, так и ЛОР-практиках, а именно на ДППГ.
ДППГ — патология периферического отдела вестибулярного анализатора, возникающая вследствие перемещения фрагментов отолитовой мембраны утрикулюса в полукружные каналы внутреннего уха.
ДППГ как отдельная нозологическая форма было описана Dix и Hallpike в 1952 году, и по данным зарубежной литературы на нее приходится 8% всех вестибулярных расстройств, а в структуре поражения периферического отдела вестибулярного анализатора — 17-35% случаев [1]. Особенно высока встречаемость ДППГ среди пожилых пациентов — до 68%.
За период 2007-2008 гг. в ГУ НЦ неврологии РАМН находилось под наблюдением 148 больных с ДППГ (125 женщин и 23 мужчины, средний возраст 59 лет, разброс значений от 23 до 81 года). Средняя продолжительность заболевания составила 10 месяцев (разброс значений от 5 дней до 17 лет).
Диагноз ДППГ выставлялся на основании характерных жалоб пациентов и результатов диагностических тестов. Помимо отоневрологического осмотра все больные были осмотрены неврологом, многим проводились компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) головного мозга, ультразвуковая доплерография или дуплексное сканирование магистральных артерий головы.
В качестве лечебного мероприятия применялся реабилитационный вестибулярный маневр.
Этиология. В большинстве случаев однозначно установить причину заболевания не представляется возможным. В качестве наиболее часто встречающихся причин в литературе упоминаются травма головы, вирусная инфекция (вирус герпеса), сосудистые и дегенеративные изменения. Если установить причину расстройства не представляется возможным, то тогда говорят об идиопатическом ДППГ [2].
В нашем исследовании идиопатическое ДППГ встречалось у 51% пациентов. Посттравматическое ДППГ диагностировано у 6% больных. Следует отметить, что ни у кого не отмечалось черепно-мозговой травмы средней или тяжелой степени тяжести. В основном речь шла скорее о повышенной вибрации, легком сотрясении (падение с высоты собственного роста, резкое торможение транспорта, езда по неровной проселочной дороге). 39% больных составили лица с сосудистой патологией (артериальная гипертония, атеросклероз, вертебрально-базилярная недостаточность, дисциркуляторная энцефалопатия). Вирусная этиология отмечалась у 4% больных.
Эпидемиология. Среди наших больных женщины преобладали над мужчинами — 84,5% и 15,5% соответственно, что согласуется с данными литературы. Зависимость частоты встречаемости заболевания от половой принадлежности многие авторы связывают с гормональным фактором, который лежит в основе изменения водно-электролитного баланса, рН эндолимфы, нарушения метаболизма глюкозы и липидов, что приводит к дегенеративным изменениям отолитовой мембраны [2, 3].
Клиническая картина. Приступы системного головокружения с вегетативными проявлениями возникали у наших пациентов при строго определенных движениях головы или тела, как то — повороты в постели на бок, укладывание в постель на спину, переход из лежачего в сидячее положение, запрокидывание головы назад, наклон туловища вперед и вниз. Приступы могли возникать при всех провоцирующих движениях или только при некоторых, но при поворотах в постели присутствовали во всех без исключения случаях. У большинства пациентов (79%) головокружение возникало при повороте только на один бок. У 21% пациентов приступы головокружения развивались при поворотах как на один, так и на другой бок, но интенсивность головокружения была различной, при повороте на одну из сторон головокружение всегда было выражено интенсивнее.
Слуховые симптомы отсутствовали. Приступы ДППГ беспокоили больных с регулярной частотой — ежедневно, практически при каждом провоцирующем движении. Считается общепризнанным, что приступ ДППГ длится не более 60 секунд. У наших больных продолжительность приступа не выходила за эти рамки. Иногда больные не могли точно обозначить продолжительность головокружения, поскольку, не дожидаясь самопроизвольного окончания приступа, выходили из критического положения. Некоторые пациенты отмечали более продолжительное время приступа (3-5 минут), но при прицельном опросе устанавливалось, что за головокружение они принимали сопутствующие остаточные ощущения — тяжесть, дискомфорт в голове и пр.
По нашим наблюдениям выраженность головокружения зависела от продолжительности заболевания. В дебюте головокружение у более половины больных (56%) носило драматический характер — интенсивное вращение в горизонтальной или вертикальной плоскостях с выраженными вегетативными проявлениями. Со временем сила приступов, как правило, уменьшалась.
Интересным с нашей точки зрения является тот факт, что при сборе анамнеза выяснилось, что у 23% больных возникновению ДППГ предшествовала острая вестибулярная дисфункция сосудистого генеза, развившаяся на фоне гипертонического криза или дисциркуляции кровообращения в вертебрально-базилярной системе. У больных при этом наблюдалось системное головокружение в течение нескольких дней, легкая неврологическая симптоматика. Большинство больных было госпитализировано. В ближайший отсроченный период (в течение одного месяца), по мере стихания первичной острой вестибулярной дисфункции и атаксии, развивалось ДППГ. Скорее всего, по нашему мнению это можно объяснить дисциркуляцией кровообращения в вертебрально-базилярной системе, провоцирующей дегенеративные изменения отолитовой мембраны. Связь между ДППГ и состоянием кровообращения в вертебрально-базилярной системе отмечается в целом ряде работ [4]. Нельзя также исключить, что в данном случае речь идет о синдроме Lindsay-Hemenway, который из-за скудности литературных данных остается недооцененным. Pardal Refoyo J. L. [5] в своем исследовании наблюдал этот синдром у 16,3% больных с ДППГ. Синдром развивается при ишемии в бассейне передней вестибулярной артерии и характеризуется развитием ДППГ после первоначальной острой вестибулярной дисфункции.
Диагностика. Для диагностики ДППГ заднего полукружного канала проводили пробу Дикса-Холлпайка (рис. 1). Диагностика ДППГ горизонтального канала осуществлялась иначе: в положении больного лежа на спине поворачивают голову в плоскости канала — справа налево или наоборот.
Принято считать, что диагностические тесты считаются положительными, если возникают позиционное головокружение и нистагм. При поражении заднего полукружного канала наблюдается ротаторный нистагм, направленный в сторону нижележащего уха. При поражении горизонтального — горизонтальный нистагм также в сторону нижележащего уха.
Характерными особенностями головокружения и нистагма при ДППГ являются феномены истощения (уменьшение интенсивности при повторных триггерных движениях) и адаптации (самопроизвольное исчезновение через некоторое время — не более 60 секунд). У 36 пациентов (24%) нам не удалось наблюдать позиционного нистагма, а только позиционное головокружение. Тем не менее, нами был выставлен диагноз ДППГ, а последующее успешное лечение больного с помощью вестибулярного маневра подтвердило правильность нашей диагностики.
Таким образом, диагностические тесты можно считать положительными и в отсутствии позиционного нистагма, а только по наличию типичного позиционного головокружения, так называемого «субъективного» ДППГ [6]. Считается, что позиционный нистагм может не наблюдаться по следующим причинам: не визуализируется врачом; истощение во время повторных тестов; при легких формах ДППГ, характеризующихся недостаточной стимуляцией вестибулоглазодвигательных связей.
В подавляющем большинстве случаев при ДППГ нистагм геотропный, т. е. направлен в сторону нижележащего уха, «к земле». У двух больных мы наблюдали агеотропный нистагм — направленный в сторону вышележащего уха. По данным литературы агеотропный нистагм при ДППГ встречается крайне редко при некоторых формах горизонтального купулолитиаза.
Лечение. В качестве лечебных мероприятий проводились реабилитационные вестибулярные маневры. При ДППГ заднего полукружного канала — маневр Semont (рис. 2), а при поражении горизонтального канала — маневр Epley (рис. 3) [7, 8, 9].
Полное излечение после однократно проведенного маневра мы наблюдали у 83% больных. У 11% больных маневр проводился дважды, и у 4% пациентов пришлось повторять маневр до 3-4 раз. В 2% наблюдений вестибулярные маневры эффекта не имели. В этих случаях применялись упражнения по методике Brandt-Daroff в течение месяца, что в конце концов привело к полному выздоровлению.
Результаты лечения оценивались через день путем интервьюирования больного по телефону. Если пациент не предъявлял жалоб на головокружение, то маневр считался проведенным успешно. Примерно у трети из общего числа больных в течение 1-7 дней после проведения лечебной процедуры отмечались вестибулярные расстройства в виде нарушения равновесия, ощущения «укачивания», которые постепенно самостоятельно купировались. Скорее всего, подобные нарушения равновесия были следствием возврата фрагментов отолитовой мембраны в эллиптический мешочек.
Мы наблюдали рецидивирование заболевания у 4 больных. Рецидив наступал через 3-15 месяцев после проведения лечебных мероприятий. Лечение рецидивов такое же, как и первичного заболевания.
Несмотря на то, что основным лечебным мероприятием при ДППГ является реабилитационный вестибулярный маневр, мы рекомендовали всем больным дополнительно пройти курс сосудистой, метаболической и нейропротективной терапий (Кавинтон, Бетасерк, Пирацетам, Триметазид, Мексидол, Мильгамма). Целью данной терапии является улучшение процессов микроциркуляции и метаболизма в отолитовой мембране для предотвращения отрыва от нее отдельных фрагментов.
Таким образом, накопленный нами опыт свидетельствует, что ДППГ является достаточно распространенной патологией вестибулярного анализатора, для диагностики и лечения которой не требуется сложных и дорогостоящих методик, оборудования и лекарственных средств. Сосудистая патология головного мозга является одной из наиболее часто встречающихся причин развития ДППГ.
Литература
Breven M. et al. Epidemiology of benign paroxysmal positional vertigo: a population based study // J Neurol Neurosurg Psychiatry. 2007, Jul. Vol. 78, № 7, p. 710-715.
Baloh W. Robert, M. D. et al. Benign positional vertigo: сlinical and oculograpic features in 240 cases // Neurology. 1987. № 37, р. 371-378.
Giacomidi P. G. et al. Recurent paroxysmal positional vertigo related to oral contraceptive treatment // Gynecol Endocrinol. 2006, Jan. Vol. 22, № 1, р. 5-6.
Seo T. et al. Relationship between neurological asymptomatic vertigo and the vertebrobasilar system as revealed by magnetic resonance angiography // ORL J Otorhinolalaryngol Relat Spec. 2000, Mar-Apr. Vol. 62, № 2, р. 63-67.
Pardal Refoya J. L. et al. Ishemia of the anterior vestibular artery (Lindsay-Hemenway syndrome). Review and comments // Acta Otorrinolaringol Esp. 1998, Nov-Dec. Vol 49, № 8, р. 599-602.
Kentala E. et al. Vertigo in patients with benign paroxysmal positional vertigo // Acta Otolaryngol Suppl. 2000. № 543, р. 20-22.
Semont A. et al. Benign paroxysmal positional vertigo and provocative maneuvers // Ann Otolaryngol Chir Cervicofac. 1989. Vol. 106, № 7, р. 473-47
О. В. Веселаго, кандидат медицинских наук
ГУ НЦ неврологии РАМН, Москва
Читайте также:
