Координация сократительной деятельности. Медленные ритмические колебания. Продольный мышечный слой. Влияние катехоламинов на миоциты.
Добавил пользователь Morpheus Обновлено: 21.01.2026
Моторная деятельность тонкой кишки обеспечивает дальнейшую механическую обработку химуса, его измельчение, перемешивание со щелочными пищеварительными секретами, продвижение по ходу кишки в дис-тальном направлении, смену слоя химуса у слизистой оболочки, повышение внутрипо-лостного давления. Кроме того, строго координированная сократительная активность мышц тонкой кишки определяет продолжительность задержки содержимого в каждом ее отделе, оптимальную для переваривания пищевых субстратов с образованием необходимого количества питательных веществ и их транспортом в кровь и лимфу. Таким образом, моторная функция тонкой кишки повышает эффективность полостного и пристеночного пищеварения и способствует всасыванию питательных веществ.
Способность гладкомышечных клеток к автоматии лежит в основе всех видов сокращений тонкой кишки.
Основными видами моторики тонкой кишки являются следующие.
Ритмическая сегментация проявляется в виде одновременных сокращений циркулярных мышц в нескольких соседних участках кишки, разделяющих ее на сегменты, благодаря чему химус перемещается на небольшие расстояния в обе стороны от мест сужений просвета кишки. Следующим сокращением циркулярных мышц каждый сегмент разделяется на две части, а ранее сокращенные участки кишки расслабляются. Содержимое каждого нового сегмента кишки состоит из химуса двух половин бывших сегментов. За счет ритмической сегментации обеспечиваются перемешивание химуса и его небольшое смещение в дистальном направлении.
Маятникообразные сокращения возникают в результате ритмических сокращений главным образом продольного мышечного слоя при участии циркулярных мышц, приводящих к перемещению химуса вперед-назад. Они обеспечивают перемешивание кишечного содержимого и его слабое поступательное
продвижение в дистальном направлении. Частота маятникообразных сокращений и ритмической сегментации в одном и том же участке кишки одинакова. Чередование ритмической сегментации и маятникообразных сокращений способствует тщательному перемешиванию химуса.
Перистальтические сокращения представляют собой волнообразно распространяющиеся по кишке сокращения циркулярных мышц, которым предшествует волна расслабления. Они обеспечивают продвижение содержимого по кишке в проксимодистальном направлении. Перистальтическая волна возникает в результате сужения просвета кишки при сокращении циркулярных мышц выше комка химуса и расширения полости кишки при сокращении мышц продольного слоя ниже комка. Возникающий при этом прокси-модистальный градиент давления является непосредственной причиной продвижения химуса по кишечнику.
Перистальтические сокращения могут быть различными по силе и скорости распространения. Достаточно сильные перистальтические сокращения перемещают химус в дистальном направлении на большие расстояния. Такие перистальтические движения называются пропульсивными. Скорость распространения перистальтических волн по тонкой кишке у здорового человека обычно составляет 1—2 см/с. В проксимальных отделах тонкой кишки она выше, чем в средней ее части, а в терминальном участке подвздошной кишки при стремительной перистальтике достигает 7—21 см/с. Такой тип перистальтических сокращений наблюдается в конце пищеварительного периода.
Перистальтические волны могут возникать в любых отделах тонкой кишки. Чаще всего они начинаются в двенадцатиперстной кишке в момент эвакуации желудочного химуса. Одновременно по кишечнику проходит несколько таких волнообразных сокращений, которые придают движениям кишки сходство с движением червя. Отсюда произошло их название — червеобразные, или перистальтические, сокращения.
Тонические сокращения могут иметь локальный характер или перемещаться по кишке с малой скоростью. На тонические волны накладываются ритмические и перистальтические. Базальное давление в полости тонкой кишки определяется не только тонусом ее мышечной стенки, но и внутрибрюш-ным давлением и составляет у человека 8— 9 см вод.ст. Величина внутриполостного давления в кишке существенно возрастает при
появлении перистальтики. Тонические сокращения лежат в основе моторной деятельности гладкомышечных сфинктеров.
Микродвижения кишечных ворсинок способствуют перемешиванию химуса. Частота ритмических сокращений ворсинок уменьшается от проксимальных к дистальным отделам тонкого кишечника. Стимулирующее влияние на их двигательную активность оказывает интестинальный гормон валликинин, вырабатываемый в слизистой оболочке тонкой кишки.
14.7.5. РЕГУЛЯЦИЯ МОТОРНОЙ ДЕЯТЕЛЬНОСТИ ТОНКОЙ КИШКИ
Моторика тонкой кишки регулируется мио-генным, нервным и гуморальным механизмами.
А. Миогенный механизм регуляции. В основе моторной деятельности тонкой кишки лежат свойства гладкомышечных клеток спонтанно сокращаться и отвечать сокращением на растяжение.
Спонтанная активность гладких мышц, проявляющаяся в виде ритмической генерации медленных электрических волн, пачек потенциалов действия и фазных сокращений тонкой кишки в отсутствие внешних раздражений, обеспечивается миогенным механизмом. Частота генерации медленных электрических волн постоянна для каждого участка тонкой кишки и зависит от уровня обмена веществ. Локальное понижение температуры в области водителя ритма ведет к снижению частоты генерации медленных волн и ритмических сокращений гладких мышц тонкой кишки и скорости их распространения. Отделение водителя ритма от нижележащих сегментов кишки путем полной перерезки кишки или только продольного мышечного слоя при сохранении внешних нервов снижает частоту сокращений кишки дистальнее перерезки на 20—30 %.
К миогенным механизмам регуляции моторики тонкой кишки относится также сократительная реакция гладких мышц на растяжение. Сокращение мышц продольного мышечного слоя кишки обеспечивает растяжение циркулярных мышц, достаточное для того, чтобы вызвать их сокращение.
Б. Интрамуральные нервные механизмы регуляции. Двигательная деятельность тонкой кишки регулируется с помощью энтеральной нервной системы — комплекса микрогангли-онарных образований, включающих полный набор нейронов (сенсорных, эндогенных ос-
цилляторов, интернейронов, тонических и эфферентных нейронов), придающий ей черты истинной автономии (А.Д.Ноздрачев). Энтеральная нервная система оказывает нисходящие тормозные тонические влияния на миогенную ритмику гладкой мышцы кишки. Эндогенный осциллятор внутриганглионар-ного ансамбля является холинергическим, он вызывает возбуждение эфферентного пепти-дергического нейрона, в окончаниях которого выделяются тормозные медиаторы ВИП, АТФ, обусловливает гиперполяризацию мембраны гладкомышечной клетки, что приводит к уменьшению амплитуды медленных электрических волн, прекращению генерации пиковых потенциалов и угнетению двигательной активности кишки. Энтеральная система на основе поступающей сенсорной информации, получаемой от рецепторов, программирует и координирует двигательную активность тонкой кишки.
Раздражителем, запускающим и поддерживающим движения кишечника, служит растяжение его стенки. Локальное раздражение кишки после перерезки экстраорганных нервов вызывает миэнтеральный рефлекс, проявляющийся в сокращении мышц выше и их расслаблении ниже места раздражения. Рефлекторная дуга миэнтерального рефлекса замыкается в интрамуральных ганглиях. Еще более ярко выражен «слизистый» местный рефлекс, возникающий при действии механических и химических раздражителей на слизистую оболочку кишки, проявляющийся в сокращении циркулярных мышц прокси-мальнее химуса и их расслаблении дистальнее кишечного содержимого. Возбуждение рецепторов растяжения или хеморецепторов, расположенных в слизистой оболочке, передается по сенсорным нейронам подслизисто-го сплетения к интернейронам межмышечного сплетения, что приводит к возбуждению холинергического мотонейрона и сокращению циркулярных мышц проксимального участка кишки и активации пептидергичес-кого тормозного нейрона (медиаторы АТФ, ВИП), обусловливающего расслабление дис-тально расположенных циркулярных мышц.
В. Центральные влияния. В регуляции моторной деятельности кишечника важную роль играют кора большого мозга, структуры лимбической системы, гипоталамус.
Электростимуляция передней сигмовидной извилины коры стимулирует моторику тонкой кишки, а орбитальной извилины — напротив, тормозит. Раздражение передней части поясной извилины (лимбической области коры) и миндалевидного комплекса
вызывает как тормозные, так и стимулятор-ные эффекты в зависимости от исходного функционального состояния тонкой кишки. Раздражение ядер переднего и среднего отделов гипоталамуса преимущественно стимулирует, а заднего — тормозит моторику тонкой кишки. Однако в целом действие ЦНС на моторику тонкой кишки является преимущественно тормозным (Ю.М.Гальперин).
Влияния ЦНС на моторику тонкой кишки реализуются с помощью симпатических (ад-ренергических), парасимпатических (холи-нергических) и, по-видимому, серотонинер-гических нервных волокон. Возбуждение парасимпатических волокон блуждающих нервов оказывает преимущественно стимулирующее влияние на моторику тонкой кишки за счет выделяющегося в их окончаниях аце-тилхолина. Однако могут возникать и тормозные эффекты. Механизм тормозного влияния блуждающего нерва на моторику кишки изучен недостаточно. Полагают, что его реализация осуществляется с помощью активации М-холинорецепторов симпатических терминален и выброса ими катехоламинов. Тормозной эффект лучше выявляется на фоне сильных сокращений кишки. Возбуждение симпатических волокон чревных нервов оказывает угнетающее влияние на моторную деятельность тонкой кишки (рис. 14.14, А). Получены доказательства того, что в составе чревных нервов содержатся серотони-нергические волокна, возбуждение которых стимулирует моторику тонкой кишки (рис. 14.14, Б).
Рефлексогенные зоны и рефлексы. Основной закон рефлекторной регуляции моторной деятельности желудочно-кишечного тракта имеет универсальный характер. Его действие отчетливо проявляется на примере рефлекторной регуляции моторики тонких кишок в виде моторных и тормозных рефлексов кишечника.
К моторным рефлексам кишечника относят пищеводно-кишечный, желудочно-кишечный и кишечно-кишечный рефлексы.
Пищеводно-кишечный моторный рефлекс возникает при раздражении механорецепто-ров пищевода на фоне покоя или слабых сокращений тонкой кишки и проявляется в виде повышения ее тонуса и амплитуды перистальтических волн. Рефлекторная дуга этого рефлекса замыкается в продолговатом мозге, а эфферентные возбуждающие влияния на моторику тонкой кишки передаются по блуждающим нервам.
Желудочно-кишечные моторные рефлексы (гастродуоденальный, гастроеюнальный и га-
строилеальный) наблюдаются при раздражении механорецепторов желудка или наполнении его пищей, что приводит к появлению или усилению имеющихся сокращений тонкой кишки. Возбуждение к тонкому кишечнику при раздражении желудка передается двумя путями: по стенке пищеварительного тракта — с помощью местных рефлексов, замыкающихся в ганглиях энтеральной нервной системы; рефлекторно — посредством блуждающих нервов, с замыканием рефлекторной дуги в центральной нервной системе.
Кишечно-кишечный моторный рефлекс возникает при адекватном механическом и химическом раздражении тонкой кишки и проявляется усилением сокращений нижележащих отделов кишечника. Возбуждение с проксимальных на дистальные отделы кишечника передается с помощью местных рефлексов (рис. 14.15), замыкающихся в ин-трамуральных ганглиях, а также центральных рефлексов, реализующих свое стимулирующее влияние на моторику кишки через блуждающие нервы.
К тормозным рефлексам кишечника относят рефлекторное торможение (расслабление) верхних отделов тонкой кишки во время приема пищи; кишечно-кишечный тормозной рефлекс и ректоэнтеральный рефлекс.
Рефлекторное торможение моторики тонкой кишки в процессе акта еды проявляется понижением тонуса и амплитуды перистальтических сокращений проксимальных отделов кишечника, за которым следует усиление его моторной деятельности. Это явление получило название воспринимающего торможения (рецептивной релаксации) кишки. Аффе-
тонкой кишки химусом тормозит поступление в его полость следующих порций из проксимальных частей и усиливает моторно-эва-куаторную деятельность данного и нижерасположенных сегментов кишки. Когда в результате гидролиза, всасывания и продвижения химуса количество его в данном сегменте уменьшается, тормозное влияние на вышележащие участки кишки снижается. Вследствие этого моторика проксимальных участков кишки усиливается и химус продвигается вниз по кишечнику, поступая в освобождающийся от содержимого сегмент кишечника, где продолжаются процессы гидролитического расщепления пищевых веществ и всасывания продуктов их переваривания в кровь и лимфу.
Г. Гуморальная регуляция. Мотилин, га-стрин, ХЦК, гистамин, серотонин, вещество П, брадикинин, вазопрессин и окситоцин, действуя на миоциты и нейроны энтеральной нервной системы, усиливают, а секретин, ВИП, ГИП тормозят моторику тонкой кишки.
рентный путь рефлекторной дуги данного рефлекса начинается с рецепторов корня языка и глотки, а эфферентное звено представлено адренергическими волокнами чревного нерва.
Кишечно-кишечный тормозной рефлекс вызывается сильным раздражением механо-рецепторов любой части желудочно-кишечного тракта, что приводит к ослаблению моторной деятельности других частей, в том числе тонкой кишки, за исключением илео-цекального сфинктера. Замыкание рефлекса происходит в спинном мозге ниже ThV|. Важнейшая роль в осуществлении этого рефлекса принадлежит адренергическим волокнам чревного нерва.
Прямокишечно-кишечный рефлекс возникает в результате раздражения механорецеп-торов прямой кишки и сфинктеров ее ампулы. Он проявляется торможением моторики тонкой и толстой кишки. Замыкание данного рефлекса происходит в спинном мозге. Передача тормозных влияний с прямой кишки на моторную деятельность тонкой кишки осуществляется посредством адренергических волокон чревных нервов.
Возникающие в процессе пищеварения моторные и тормозные рефлексы кишечника обеспечивают оптимальный темп переваривания пищевых веществ и всасывания продуктов гидролиза в каждом участке тонкой кишки. Переполнение какого-либо отдела
Координация сократительной деятельности. Медленные ритмические колебания. Продольный мышечный слой. Влияние катехоламинов на миоциты.
ГБОУ ВПО "Московский государственный медико-стоматологический университет им. А.И. Евдокимова" Минздрава России
ФГБУ "Поликлиника №1" УДП РФ, Москва
Механизмы нарушения сократительной активности кишечника при запорах и пути их коррекции
Журнал: Доказательная гастроэнтерология. 2013;(3): 9‑16
Вьючнова Е.С., Дорофеева А.Н. Механизмы нарушения сократительной активности кишечника при запорах и пути их коррекции. Доказательная гастроэнтерология. 2013;(3):9‑16.
V'iuchnova ES, Dorofeeva AN. Mechanisms of disturbed intestinal contractile activity associated with constipation and methods for its correction. Russian Journal of Evidence-Based Gastroenterology. 2013;(3):9‑16. (In Russ.).
В статье освещены особенности регуляции моторики кишечника, классификация запоров по механизмам нарушения двигательной активности кишечника и место стимулирующих слабительных в их лечении, а также общепринятые стандарты лечения запоров, основанные на механизмах нарушения сократительной активности кишечника.
Выделяют две группы рефлексов - моторные и тормозные. Гастродуоденальный, гастроеюнальный и гастроилеоцекальный моторные рефлексы возникают в ответ на раздражение механорецепторов наполненного пищей желудка и имеют две компоненты: одна из них реализуется через энтеральную нервную систему, другая - через центр блуждающего нерва. Раздражение механо- и хеморецепторов слизистой оболочки тонкой кишки порцией химуса вызывает кишечно-кишечный моторный рефлекс, который выражается в усилении двигательной активности участков кишки, расположенных каудальнее места раздражения. Кишечно-кишечный моторный рефлекс тоже имеет две компоненты - местную и центральную, осуществляемую через ядро блуждающего нерва. Тормозные рефлексы выражаются в угнетении моторики тонкой кишки и других отделов желудочно-кишечного тракта (ЖКТ). При сильном раздражении механорецепторов кишечника возникает ослабление моторики ЖКТ за счет возбуждения спинальных центров чревного нерва (кишечно-кишечный тормозной рефлекс). В физиологических условиях он предотвращает поступление в нижележащие отделы кишечника недостаточно переработанных порций химуса. Аналогичный характер имеет прямокишечно-кишечный тормозной рефлекс, который реализуется через спинальный центр чревного нерва и обусловливает угнетение моторики тонкой и толстой кишки в ответ на раздражение механорецепторов прямой кишки при ее переполнении каловыми массами, что уменьшает поступление химуса в конечный отдел толстой кишки до ее освобождения от каловых масс [2].
Двигательная активность толстой кишки представлена сегментарными непропульсивными сокращениями: большими и малыми маятникообразными движениями, а также пропульсивными перистальтическими сокращениями. Начальным отделам толстой кишки свойственны очень медленные малые маятникообразные сокращения, которые способствуют перемешиванию химуса, что ускоряет всасывание воды. В поперечной ободочной и сигмовидной кишке наблюдаются большие маятникообразные сокращения, вызванные возбуждением большого количества продольных и циркулярных мышечных пучков, что способствует перемешиванию и продвижению химуса. Медленное перемещение содержимого толстой кишки в дистальном направлении осуществляется благодаря редким перистальтическим волнам. Задержке химуса в толстой кишке способствуют антиперистальтические сокращения, которые перемещают содержимое в ретроградном направлении и тем самым способствуют всасыванию воды. Обезвоженный химус накапливается в дистальном отделе толстой кишки. При заполнении поперечной ободочной кишки плотным содержимым усиливается раздражение механорецепторов слизистой оболочки кишки на значительной площади, что усиливает мощные рефлекторные пропульсивные сокращения, которые перемещают большой объем содержимого в сигмовидную и прямую кишку. Прием пищи ускоряет возникновение пропульсивных сокращений за счет осуществления желудочно-ободочного рефлекса. Перечисленные фазные сокращения толстой кишки осуществляются на фоне тонических сокращений, которые в норме продолжаются от 15 с до 5 мин. Желчные кислоты в регуляции моторики и секреции в толстой кишке имеют важное значение. Изменение поступления желчных кислот в толстую кишку при гепатобилиарной патологии или вследствие побочного действия лекарственных средств приводит к появлению диареи или запора. Эндокринные клетки и нейроны энтерального сплетения экспрессируют рецепторы TGR5 к желчным кислотам, при взаимодействии с которыми желчные кислоты стимулируют моторику кишки. По данным последних исследований, у людей с недостаточным содержанием этих рецепторов к желчным кислотам отмечается склонность к запору [3]. Нормальная перистальтика кишечника, продвигающая химус в дистальном направлении, оказывает большое влияние на уровень заселенности микробами каждого отдела кишечного тракта, препятствуя их распространению в проксимальном направлении. Нарушения двигательной активности кишечника способствуют возникновению дисбактериоза: изменению количественных соотношений и состава микрофлоры [2]. Молочнокислые бактерии оказывают стимулирующее влияние на моторику кишечника [3].
Важным принципом в выборе терапевтической тактики является дифференцированный подход с учетом формы и причин констипации (рис. 4 и 5). Рисунок 4. Классификация запоров по нарушению сократительной активности кишечника [9]. Рисунок 5. Нарушения моторики при функциональном запоре [21]. Запоры можно разделить на следующие типы: запор с нормальным транзитом, запор с медленным транзитом, запор с дисфункцией мышц тазового дна 4. Запор с нормальным транзитом - наиболее часто встречающийся подтип нарушения моторики, когда стул ежедневный, но остаются другие критерии, по которым у пациента диагностируется запор: пациенты жалуются на чувство неполного опорожнения, длительное натуживание, вздутие живота. Запоры с нормальным транзитом чаще связаны с психосоциальным стрессом. Существуют три объяснения этой взаимосвязи. Во-первых, психологические расстройства могут приводить к развитию медленного транзита, во-вторых, запоры способны приводить к психологическим расстройствам, а в-третьих, возможно независимое сосуществование запоров и психологических расстройств. В исследованиях с участием здоровых людей выявлено, что при волевой многократной задержке дефекации происходит замедление транзита в правых отделах толстой кишки и ректосигмоидном отделе. Таким образом, иногда хроническое растяжение фекальными массами прямой кишки при нарушениях эвакуации может привести к формированию привычки задерживать акт дефекации, что в дальнейшем приводит к развитию запора. Запоры с нормальным транзитом поддаются коррекции при добавлении пищевых волокон или их комбинации с осмотическими слабительными [4, 8]. Среди упорных хронических запоров преобладают запоры с медленным транзитом. Это запоры со сниженной пропульсивной активностью кишечника, которые чаще встречаются у молодых женщин, характеризуются снижением желудочно-ободочного рефлекса в ответ на прием пищи, что, возможно, может быть обусловлено повреждением нейронов миоэнтерального сплетения во время операций на органах малого таза или родов либо в результате уменьшения клеток Кахаля, выполняющих функции передачи сигнала для пропульсивных сокращений и мессенжера нейротрансмиттеров. Обнаружены две сети интерстициальных клеток Кахаля: в нервном межмышечном сплетении и подслизистом слое кишки [4, 6, 7, 9]. Запоры с дисфункцией мышц тазового дна обусловлены дискоординацией работы мышц тазового дна и анального сфинктера. Трудности при изгнании кала могут быть связаны со структурными аномалиями прямой кишки (ректоцеле, пролапс), снижением чувствительности прямой кишки к растяжению, парадоксального сокращения анального отверстия или его ненадлежащего расслабления, что, в свою очередь, может сочетаться с медленным транзитом или нормальным транзитом кишечного содержимого [4, 5]. К аноректальным нарушениям функционального характера относятся болезнь Гиршпрунга, нарушение расслабления внутреннего анального сфинктера, синдром спазма тазового дна, рефлекторный запор (при наличии болезненных процессов в аноректальной зоне - проктита, трещин, воспаления геморроидальных узлов, эрозивно-язвенного процесса).
4 нед, без признаков электролитных нарушений и привыкания [17]. Таблетки Дульколакс разрешены детям с 4 лет, а свечи - с 10 лет. Дульколакс принимают по 1-2 драже перед сном. Свечи имеют приоритет при проктогенном запоре. Гутталакс взрослым и детям старше 10 лет назначают по 10-20 капель (5-10 мг); детям 4-10 лет - по 5-10 капель (2,5-5,0 мг). Прием препаратов Дульколакс и Гутталакс во время беременности возможен только после консультации со специалистом (если потенциальная польза для матери превышает возможный риск для плода) по причине отсутствия клинических исследований с участием беременных. Противопоказаниями к назначению стимулирующих слабительных являются кишечная непроходимость, острые воспалительные заболевания органов брюшной полости, боли в животе неясного генеза, кровотечение из ЖКТ, маточные кровотечения, цистит, спастический запор, острый геморрой, острый проктит, новообразования кишечника, нарушения водно-электролитного баланса [18, 19]. Хорошим эффектом обладают схемы при сочетании слабительных с разными механизмами действия короткими курсами для повышения эффективности терапии у пациентов с упорными запорами, а также их чередование во избежание привыкания. При неэффективности комбинированной терапии проводят дальнейшие мероприятия по обследованию пациента, уточняют механизм развития запора [4, 5].
Говоря об использовании слабительных, следует подчеркнуть еще одну немаловажную деталь - очень важно выработать ритм дефекации - своеобразный условный рефлекс, от формирования которого зависит дальнейшая тяжесть течения запоров. Наилучшим временем для его формирования являются утренние часы, время после пробуждения от сна и завтрака, поскольку амплитуда пропульсивных движений кишечных (каловых) масс в данные часы является максимальной и такие данные регистрируются не только у здоровых людей, но и у пациентов с хроническими запорами [22]. Поэтому для формирования такого рода условного рефлекса у пациентов с хроническими запорами помимо завтрака необходим прием слабительных средств, чей эффект бы гарантировано развивался в утренние часы. Такими свойствами обладают ограниченное количество слабительных препаратов, а именно, применяя таблетки Дульколакс или капли Гутталакс накануне на ночь, слабительный эффект будет развиваться в утренние часы [18]. Поэтому для нормализации ритма дефекации рекомендуется использование стимулирующих слабительных препаратов, таких как Дульколакс и Гутталакс [23]. Препарат Дульколакс выпускается не только в виде таблеток, но и в виде ректальных свечей, в упаковке содержится 6 свечей, что является оптимальным количеством, позволяющим восстановить утраченный рефлекс утреннего опорожнения кишечника. Ко всем немедикаментозным терапевтическим мероприятиям человек, желающий наладить стул, после плотного завтрака добавляет ректальное введение Дульколакса. Дульколакс надежно обеспечивает опорожнение кишечника примерно через 30 мин, вызывая стул. Благодаря этому вырабатывается привычка к утренней дефекации. Большинству людей 6 дней бывает достаточно для закрепления рефлекса. Некоторым пациентам необходимо через неделю повторить курс. Редко, при резистентных формах запора, возникает нужда в более длительном курсе Дульколакса для закрепления утреннего рефлекса на дефекацию.
В этих случаях следует использовать Дульколакс в таблетках [24].
Таким образом, при неэффективности немедикаментозных мероприятий группа стимулирующих слабительных оказывает наиболее быстрое эффективное и безопасное действие в решении проблемы запоров, рекомендуется в качестве терапии первой линии у разных групп пациентов при всех формах констипации.
Введение в проблему регуляции мышечного тонуса. Спастичность.
Функция поддержания мышечного тонуса обеспечивается по принципу обратной связи на различных уровнях регуляции организма Периферическая регуляция осуществляется с участием гамма-петли, в состав которой входят супраспинальные моторные пути, вставочные нейроны, нисходящая ретикулярная система, альфа- и гамма-нейроны.
Существует два типа гамма-волокон в передних рогах спинного мозга. Гамма-1-волокна обеспечивают поддержание динамического мышечного тонуса, т.е. тонуса, необходимого для реализации процесса движения. Гамма-2-волокна регулируют статическую иннервацию мышц, т.е. осанку, позу человека. Центральная регуляция функций гамма-петли осуществляется ретикулярной формацией через ретикулоспинальные пути. Основная роль в поддержании и изменении мышечного тонуса отводится функциональному состоянию сегментарной дуги рефлекса растяжения (миотатического, или проприоцептивного рефлекса). Рассмотрим его подробнее.
Рецепторным элементом его является инкапсулированное мышечное веретено. Каждая мышца содержит большое количество этих рецепторов. Мышечное веретено состоит из интрафузальных мышечных волокон (тонких) и ядерной сумки, оплетенной спиралевидной сетью тонких нервных волокон, представляющих собой первичные чувствительные окончания (анулоспинальная нить). На некоторых интрафузальных волокнах имеются также и вторичные, гроздевидные чувствительные окончания. При растяжении интрафузальных мышечных волокон первичные чувствительные окончания усиливают исходящую из них импульсацию, которая через быстропроводящие гамма-1-волокна проводится к альфа-большим мотонейронам спинного мозга. Оттуда, через также быстропроводящие альфа-1-эфферентные волокна, импульс идет к экстрафузальным белым мышечным волокнам, которые обеспечивают быстрое (фазическое) сокращение мышцы. От вторичных чувствительных окончаний, реагирующих на тонус мышцы, афферентная импульсация проводится по тонким гамма-2-волокнам через систему вставочных нейронов к альфа-малым мотонейронам, которые иннервируют тонические экстрафузальные мышечные волокна (красные), обеспечивающие поддержание тонуса и позы.
Интрафузальные волокна иннервируются гамма-нейронами передних рогов спинного мозга. Возбуждение гамма-нейронов, передаваясь по гамма-волокнам к мышечному веретену, сопровождается сокращением полярных отделов интрафузальных волокон и растяжением их экваториальной части, при этом изменяется исходная чувствительность рецепторов к растяжению (происходит снижение порога возбудимости рецепторов растяжения, и усиливается тоническое напряжение мышцы).
Гамма-нейроны находятся под влиянием центральных (супрасегментарных) воздействий, передающихся по волокнам, которые идут от мотонейронов оральных отделов головного мозга в составе пирамидного, ретикулоспинального, вестибулоспинального трактов.
При этом если роль пирамидной системы заключается преимущественно в регуляции фазических (т.е. быстрых, целенаправленных) компонентов произвольных движений, то экстрапирамидная система обеспечивает их плавность, т.е. преимущественно регулирует тоническую иннервацию мышечного аппарата. Так, по мнению J. Noth (1991), спастичность развивается после супраспинального или спинального поражения нисходящих двигательных систем при обязательном вовлечении в процесс кортикоспинального тракта [2] .
В регуляции мышечного тонуса принимают участие и тормозные механизмы, без которых невозможно реципрокное взаимодействие мышц-антагонистов, а значит, невозможно и совершение целенаправленных движений. Они реализуются с помощью рецепторов Гольджи, расположенных в сухожилиях мышц, и вставочных клеток Реншоу, находящихся в передних рогах спинного мозга. Сухожильные рецепторы Гольджи при растяжении или значительном напряжении мышцы посылают афферентные импульсы по быстропроводящим волокнам 1б-типа в спинной мозг и оказывают тормозящее воздействие на мотонейроны передних рогов. Вставочные клетки Реншоу активизируются через коллатерали при возбуждении альфа-мотонейронов, и действуют по принципу отрицательной обратной связи, способствуя торможению их активности. Таким образом, нейрогенные механизмы регуляции мышечного тонуса многообразны и сложны.
При поражении пирамидного пути растормаживается гамма-петля, и любое раздражение путем растяжения мышцы приводит к постоянному патологическому повышению мышечного тонуса. При этом поражение центрального мотонейрона приводит к снижению тормозных влияний на мотонейроны в целом, что повышает их возбудимость, а так же на вставочные нейроны спинного мозга, что способствует увеличению числа импульсов, достигающих альфа-мотонейронов в ответ на растяжение мышцы [4].
В качестве других причин спастичности можно указать структурные изменения на уровне сегментарного аппарата спинного мозга, возникающие вследствие поражения центрального мотонейрона: укорочение дендритов альфа-мотонейронов и коллатеральный спрауттинг (разрастание) афферентных волокон, входящих в состав задних корешков.
Возникают так же и вторичные изменения в мышцах, сухожилиях и суставах. Поэтому страдают механико-эластические характеристики мышечной и соединительной ткани, которые определяют мышечный тонус, что еще больше усиливает двигательные расстройства.
В настоящее время повышение мышечного тонуса рассматривается как комбинированное поражение пирамидных и экстрапирамидных структур центральной нервной системы, в частности кортикоретикулярного и вестибулоспинального трактов. При этом среди волокон, контролирующих активность системы «гамма-нейрон - мышечное веретено», в большей степени обычно страдают ингибирующие волокна, тогда как активирующие сохраняют свое влияние на мышечные веретена.
Следствием этого является спастичность мышц, гиперрефлексия, появление патологических рефлексов, а также первоочередная утрата наиболее тонких произвольных движений [5].
Наиболее значимым компонентом мышечного спазма является боль. Болевая импульсация активирует альфа- и гамма-мотонейроны передних рогов, что усиливает спастическое сокращение мышцы, иннервируемой данным сегментом спинного мозга. В то же время, мышечный спазм, возникающий при сенсомоторном рефлексе, усиливает стимуляцию ноцицепторов мышцы. Так, по механизму отрицательной обратной связи формируется замкнутый порочный круг: спазм - боль - спазм - боль [3].
Помимо этого, в спазмированных мышцах развивается локальная ишемия, так как алгогенные химические вещества (брадикинин, простагландины, серотонин, лейкотриены и др.) оказывают выраженное действие на сосуды, вызывая вазогенный отек тканей. В этих условиях происходит высвобождение субстанции «Р» из терминалей чувствительных волокон типа «С», а также выделение вазоактивных аминов и усиление микроциркуляторных нарушений.
Интерес представляют также данные о центральных холинергических механизмах регуляции мышечного тонуса. Показано, что клетки Реншоу активируются ацетилхолином как через коллатерали мотонейрона, так и через ретикулоспинальную систему.
M.Schieppati и соавт., (1989) установили, что фармакологическая активация центральных холинергических систем значительно снижает возбудимость альфа-мотонейронов путем повышения активности клеток Реншоу.
В последние годы исследователи регуляции мышечного тонуса придают огромное значение роли нисходящих адренергических супраспинальных путей, начинающихся в области голубого пятна. Анатомически эти образования тесно связаны со спинальными структурами, особенно с передними рогами спинного мозга. Норадреналин, высвобождаемый с терминалей бульбоспинальных волокон, активизирует адренорецепторы, располагающиеся во вставочных нейронах, первичных афферентных терминалях и мотонейронах и воздействует одновременно на альфа- и бета-адренорецепторы в спинном мозге (D.Jones et al., 1982). К ядерным образованиям ретикулярной формации ствола подходят многочисленные аксоны болевой чувствительности. На основе информации, поступающей в ретикулярную формацию ствола головного мозга, выстраиваются соматические и висцеральные рефлексы. От ядерных образований ретикулярной формации формируются связи с таламусом, гипоталамусом, базальными ядрами и лимбической системой, которые обеспечивают реализацию нейроэндокринных и аффективных проявлений боли, что особенно важно при хронических болевых синдромах [2].
В итоге формирующийся порочный круг включает в себя мышечный спазм, боль, локальную ишемию, дегенеративные изменения, которые самоподдерживают друг друга, усиливая первопричину патологических изменений.
Следует учитывать, что чем больше компонентов этого порочного круга становятся мишенями при лечении, тем выше вероятность его успеха. Поэтому современными требованиями к миорелаксирующей терапии являются: мощность миорелаксирующего действия, его селективность, наличие противосудорожного и антиклонического эффектов, мощность анальгетического действия, а так же безопасность и наличие широкого терапевтического диапазона доз препарата.
Согласно современным представлениям, большинство миорелаксантов воздействуют на трансмиттеры или нейромодуляторы ЦНС. Воздействие может включать супрессию возбуждающих медиаторов (аспартат и глутамат) и/или усиление тормозных процессов (ГАМК, глицин). Далее
Интерстициальные клетки Кахаля
Интерстициальные клетки Кахаля имеют вытянутую веретеновидную форму. Длина клеток — от 40 до 100 мкм, толщина — 0,2-0,5 мкм. У клеток Кахаля имеется от 2-х до 5-и отростков длиной от нескольких десятков до сотни мкм, некоторые из отростков имеет вторичное и третичное ветвление, образуя трехмерную сеть. Отростки содержат в своем составе специфические тонкие фибриллоподобные сегменты и расширенные цистерноподобные участки.
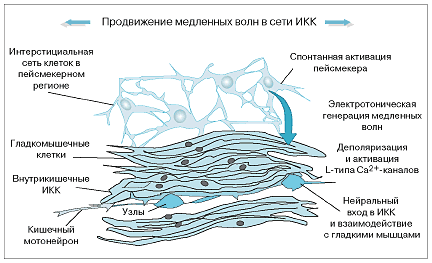
Являясь водителями ритма, они играют ключевую роль в активации и координации фазных и распространяющихся сокращений. Другой функцией этих клеток служит контроль за передачей возбуждающих и тормозных нервных импульсов гладкомышечным клеткам (Andrews Ch.N., Storr M.).
Интерстициальным клеткам Кахаля, расположенным между циркулярным и продольным мышечными слоями и составляющим синцитиум с гладкомышечными клетками (ГМК), принадлежит важнейшая роль в регуляции двигательной активности кишечника и чувствительности к механическим раздражителям. Сеть клеток Кахаля начинается с проксимальных отделов желудка и их скопление в теле желудка рассматривают как водитель ритма верхних отделов пищеварительной системы. Клетки Кахаля контактируют с варикозными терминалями аксонов нервных клеток и мембранами ГМК, модулируют передачу нервных импульсов к мышечным волокнам. В то же время они чувствительны к механическим стимулам. Растяжение стенок желудка при приеме пищи вызывает деполяризацию мембраны и появление медленноволновой активности привратника. По-видимому, это лежит в основе гастроколического рефлекса, который выражается в появлении позыва к дефекации через 20-30 минут после завтрака. Генераторная функция клеток Кахаля зависит от активности циклооксигеназы-2: при подавлении этого фермента они становятся нечувствительными к растяжению. По-видимому, в восприятии растяжения принимают участие эйкозаноиды - продукты циклооксигеназы-2 (Шульпекова Ю.О.).
Наличие ИКК не ограничивается желудочно-кишечным трактом. Они могут быть найдены в мочевом пузыре, мочеточнике, семявыносящих протоках, простате, половом члене, молочной железе, матке, поджелудочной железе, кровеносных сосудах (например, в воротной вене) и влагалище. Совсем недавно они были обнаружены в червеобразном отростке у детей. Некоторые из них, как полагают, имеют функцию водителя ритма (например, в воротной вене, в лимфатических сосудах или простате), но есть те (в артериях, в матке или мочевом пузыре), которые оказывают ингибирующее влияние
Интерстициальные пейсмейкерные клетки. Типы клеток Кахаля
Некоторые исследователи считают термин «интерстициальные пейсмейкерные клетки» (ИПК) более современным и более корректным, оставляя за термином «интерстициальные клетки Кахаля» или более узкое, или только историческое значение. В то же время, в современной гастроэнтерологии более распространён термин «интерстициальные клетки Кахаля».
Новая классификация (разделяемая не всеми) была предложена T. Komuro (Structure and organization of interstitial cells of Cajal in the gastrointestinal tract. J. Physiol. 2006; 576 (3)). В её основу легли ультрамикроскопические особенности строения этих клеток в сравнении с фибробластами и гладкомышечными клетками, на основании чего он подразделил их на 2 группы: интерстициальные клетки Кахаля и фибробластоподобные клетки. Фибробластоподобные клетки имеют ряд выраженных морфологических отличий: присутствие хорошо развитой гранулярной эндоплазматической сети, малое число митохондрий, отсутствие базальной мембраны и кавеол. В свою очередь клетки Кахаля подразделяют на 3 типа. К типу I относят клетки Кахаля с наименее выраженным сходством с ГМК; к типу III — клетки Кахаля с наиболее выраженным сходством с ГМК. Тип II — промежуточный, представлен клетками Кахаля, имеющими признаки клеток типа I и III. По иммуногистохимическим характеристикам клетки Кахаля позитивны для c-kit (CD117), в то время как фибробластоподобные клетки отличаются негативной реакцией. Считается, что интерстициальные пейсмейкерные клетки каждого органа имеют свои особенности (Ниязева Н.В. и др. Вестник РАМН/2014/№7-8).
- в субмукозном слое (они локализуются в основном в стенке поперечно-ободочной кишки и пилорического отдела желудка)
- в субсерозном слое
- внутри циркулярных и продольных мышечных слоев
- области регионального нервного межмышечного (Ауэрбахова) сплетения, находящегося между циркулярным и продольным мышечными слоями
- области глубокого внутримышечного нервного сплетения (характерного для стенки тонкой кишки).
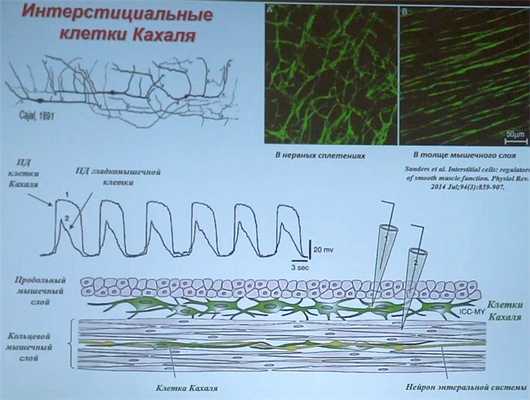
Кадр из видеолекции д.б.н. О.С. Тарасовой «Физиология пищеварения» для обучающихся на Факультете биоинженерии и биоинформатики МГУ им. М.В. Ломоносова.
Клетки Кахаля и электрогастроэнтерография
- в желудке — 2-4
- в двенадцатиперстной кишке — 10-12
- в тощей кишке — 9-12
- в подвздошной кишке — 6-8
- в толстой кишке — около 0,6, а также 3-4 и 6-12
- в прямой кишке — около 3
- в сфинктере Одди — 3-6
Снижение числа клеток в пищеварительном тракте Кахаля и заболевания ЖКТ
В качестве одной из из вероятных причин развития запоров, вызванных замедленным транзитом, рассматривается снижение числа клеток Кахаля в стенке толстой кишки на всём её протяжении (Пасечников В.Д., Andrews Ch.N., Storr M.).
 |
| Уменьшение объема и плотности интерстициальных клеток Кахаля (ИКК) - одна из вероятных причин развития запоров, вызванных замедленным кишечным транзитом (В.Д. Пасечников ) |
Уменьшение популяции интерстициальных клеток Кахаля является одним из факторов развития диабетического гастропареза (Шульпекова Ю.О.).
Клетки Кахаля погибают при хронической псевдообструкции, тяжелых нарастающих запорах, сахарном диабете, пилоростенозе, воспалительных заболеваниях кишечника (Пахомова И.Г.).
Снижение числа интерстициальных клеток Кахаля — процесс обратимый. Установлено, что частичная обструкция кишки приводит к снижению числа пейсмейкеров, определяющих частоты медленных волн электрического потенциала гладкой мышечной ткани, а также частоту перистальтики различных отделов ЖКТ и их контактов с интерстициальными клетками Кахаля. Эти изменения являются основой расстройств электрической и сократительной активности мышечных слоёв, а также гипертрофии миоцитов и нарушения соотношения миоцитов и стромальных элементов. Устранение обструкции приводило к восстановлению популяции клеток Кахаля (Вавринчук С.А., Косенко П.М.). При дуоденостенозе также наблюдается снижение клеток Кахаля (Оноприев В.В.).
Электрические процессы в гладкой мускулатуре
Мембранные потенциалы гладкомышечных клеток отличаются от мембранных потенциалов волокон скелетной мускулатуры и кардиомиоцитов ионной природой, амплитудой, формой и длительностью. Величина ПП миоцитов в норме колеблется от -50 до -60 мВ, что примерно на 30 мВ меньше ПП волокон скелетной мускулатуры. ПД миоцитов имеют две формы: спайковую и форму плато.
Спайковые ПД имеют амплитуду от 30 до 60 мВ в зависимости от исходного уровня ПП. Их продолжительность составляет от 10 до 50 мс. Снайко- вые ПД могут быть вызваны стимулами ВМС, действием гормонов, растяжением миоцита или быть результатом авгоматии самих гладкомышечных клеток (рис. 2.10, а, в).
Рис. 2.10. Потенциалы действия гладкомышечных клеток:
а — спайковый потенциал действия, вызванный внешним стимулом (стенка аорты); б — потенциал действия с плато (миометрий матки); в — спайковые потенциалы действия на фоне медленноволновых колебаний потенциала покоя (стенка кишечника)
Потенциалы действия, имеющие форму плато, по амплитуде близки к спайковым, но значительно продолжительнее: их длительность может достигать 1 с. Самые продолжительные ПД развиваются в миоцитах мочеточников, некоторых кровеносных сосудов и матки. Именно с этим связана способность гладкой мускулатуры этих органов к длительным тоническим сокращениям (рис. 2.10, б).
Возникновение, развитие и поддержание ПД в миоцитах обеспечиваются входом в клетку ионов кальция через потенциалзависимые «медленные» кальциевые каналы. Таких каналов в мембранах миоцитов значительно больше, чем «классических» натриевых потенциалзависимых каналов. Кальциевые каналы под влиянием изменений мембранного потенциала открываются заметно медленнее натриевых и остаются открытыми более длительное время. Именно с этими особенностями работы кальциевых каналов связано наличие длительных плато у ПД гладкомышечных клеток.
Автоматия гладких мышц и лежащие в ее основе медленноволновые потенциалы фиксируются только в мускулатуре моноунитарного типа. На мембранах таких миоцитов наблюдаются регулярные волнообразные колебания ПП. Эти колебания мембранного потенциала связывают с ритмическими колебаниями активности Ыа + /К + -АТФ-азы или с колебаниями мембранной проводимости для потенциал-образующих ионов. Когда вершина «медленной волны» достигает критического уровня деполяризации, который составляет около -35 мВ, происходят открытие кальциевых каналов и развитие одного или нескольких спайковых ПД. На пике следующей волны колебаний мембранного потенциала генерация спайковых потенциалов повторяется. Это позволяет говорить о существовании у таких миоцитов явления автоматии. Повторяющиеся с постоянной частотой вспышки спай- ковой электрической активности на мембранах гладкомышечных клеток приводят к регулярной сократительной активности этих клеток и всего гладкомышечного слоя. Ответы на серии спайков могут суммироваться. Суммарный ответ превышает по амплитуде ответы на одиночные спайки (рис. 2.11).
Читайте также:
