Лечение аритмий. Классификация антиаритмических средств, разработанная Воганом Уильямсом
Добавил пользователь Валентин П. Обновлено: 28.01.2026
АРИТМИЯ - это любые нарушения сердечного ритма характеризующиеся:
источника возбуждения сердца,
нарушением проведения импульсов.
Все нарушения ритма делятся на:
Нарушения функции автоматизма - синусовые тахикардия, брадикардия, аритмия и миграция источника ритма асистолия;
Нарушения функции возбудимости - экстрасистолия, пароксизмальная и непароксизмальная тахикардия, трепетание, мерцание предсердий и желудочков
Нарушения проводимости - блокады: с/а, а/в, внутрижелудочковые;
Комбинированные аритмии - ускользающие сокращения и ритмы, а/в диссоциация, парасистолия.
Органические причины аритмий:
Диагностические манипуляции и операции на сердце и коронарных сосудах
Функциональные причины аритмий
(следствие нарушений нейро-гуморальной регуляции сердечной деятельности)
* дисфункция вегетативной нервной системы
* гипо- и гипертермия
* чрезмерная физическая нагрузка
* интоксикация алкоголем, никотином, кофе,
* интоксикация лекарственными средствами (симпатомиметики, сердечные гликозиды, диуретики, психотропные, антиаритмики).
Методы исследования для верификации аритмии
Длительная регистрация ЭКГ в отведениях II, аVF
Удвоенный вольтаж ЭКГ
Суточный ЭКГ-мониторинг (по Холтеру)
Запись ЭКГ на скорости 100 мм/с;
Болюсные пробы с медикаментами
Пробы с физической нагрузкой
Электролиты (К+, Са2+,Mg2+),
Показатели функции щитовидной железы;
ПАТОГЕНЕЗ АРИТМИЙ
Активация эктопического очага возбуждения
Механизм повторного входа
Ощущение перебоев в сердце,
Гемодинамические расстройства: головокружения и обмороки (МАС).
КЛАССИФИКАЦИЯ АРИТМИЙ СЕРДЦА
I. Нарушения образования импульса
А. Нарушение автоматизма синусового узла (номотопные аритмии):
1) синусовая тахикардия;
2) синусовая брадикардия;
3) синусовая аритмия;
4) синдром слабости синусового узла;
5) остановка синусового узла.
Б. Эктопические (гетеротопные) ритмы, обусловленные преобладанием автоматизма эктопических центров
1) медленные (замещающие) выскальзывающие ритмы:
а) предсердные, из атриовентрикулярного соединения;
2) миграция источника водителя ритма;
3) ускоренные эктопические ритмы (пароксизмальные тахикардии).
В. Эктонические (гетеротопные) ритмы, преимущественно не связанные с нарушением автоматизма
б) из атриовентрикулярного соединения;
2) пароксизмальная тахикардия:
3) трепетание предсердий;
4) мерцание предсердий;
5) трепетание и мерцание желудочков.
II. Нарушение проводимости:
1. Синоатриальная блокада.
2. Внутрипредсердная блокада.
3. Атриовентрикулярная блокада.
4. Внутрижелудочковые блокады.
5. Асистолия желудочков.
6. Синдром преждевременного возбуждения желудочков:
а) синдром Вольфа-Паркинсона-Уайта (WPW);
б) синдром укорочения интервала PQ (CLC).
. При мерцании предсердий может быть электро-механическая диссоциация (дефицит пульса)
Синусовый арест - угнетение функции синусового узла, и, как следствие, отсутствие предсердной деполяризации с периодом асистолии желудочков.
Классификация желудочковых экстрасистол (по B.Lown, M.Wolf, M.Ryan):
0 - отсутствие экстрасистол за 24 ч. мониторирования.
1. - ≤ 30 экстрасистол за любой час мониторирования.
2. - > 30 экстрасистол за любой час мониторирования.
3. - полиморфные желудочковые экстрасистолы.
Классификация антиаритмических средств:
1 класс - средства, действующие на натриевые каналы
1А - удлиняют реполяризацию
1B - укорачивают реполяризацию
1C - практически не влияют на реполяризацию
2 класс - бета-адреноблокаторы
3 класс - средства, удлиняющие реполяризацию и действующие на калиевые каналы.
4 класс - кальциевые блокаторы.
Группа 1. Препараты, уменьшающие поступление ионов натрия в клетки сердечной мышцы (мембраностабилизаторы) блокируют натриевые каналы и препятствуют распространению патологических импульсов. Увеличение дозы препарата часто провоцирует аритмию, подавляя проведение импульса в нормальных тканях, особенно при тахикардии, гиперкалиемии и ацидозе.
Группа 1А с умеренным замедлением проведения.
«Терапия отчаяния», обладают проаритмогенным эффектом
Хинидина сульфат: ударная доза (УД) - 500-1000 мг в/в, поддерживающая доза (ПД) - внутрь 200 - 400 мг через 6 ч; ПЭ - артериальная гипотензия, шум в ушах, диарея, удлинение QT, анемия, тромбоцитопения.
Хинидина глюконат: УД - 500 - 1000 мг в/в, ПД - внутрь 324 - 628 мг через 8 ч.
Прокаинамид: 500 - 1000 мг в/в, в /в: 2 - 5 мг/мин внутрь 500 - 1000 мг через 4 ч; ПЭ - тошнота, волчаночноподобный синдром, агранулоцитоз, удлинение QT.
Прокаинамид длительного действия: ПД - внутрь 500 - 1250 мг через 6 ч, ПЭ - A/V-блокада, депрессия миокарда, удлинение QT.
Дизопирамид: ПД - внутрь 100 - 300 мг через 6 - 8 ч, ПЭ - антихолинергические эффекты.
Группа 1В с минимальным замедлением проведения.
«Быстрые антиаритмики», используются только при желудочковых нарушениях ритма, значительно укорачивают реполяризацию
Лидокаин: УД - 1 мг/кг болюс в/в, затем по 0,5 мг/кг болюс через 8 - 10 мин до общей дозы 3 мг/к; ПД - 1- 4 мг/мин; ПЭ - спутанность сознания, приступы, угнетение дыхания. Может спровоцировать асистолию
Токаинид: внутрь 400 - 600 мг через 8 ч; ПЭ - тошнота, тремор, волчаночно-подобная реакция, спутанность сознания.
Мексилетин: внутрь 100 - 300 мг через 6 - 8 ч; ПЭ - мышечный тремор, тошнота, нарушенная походка. Может разблокировать ножки пучка Гиса при инфаркте
Группа 1С с выраженным замедлением проведения.
Увеличивают период деполяризации и практически не влияют на реполяризацию. Увеличивают QRST, поэтому характерен аритмогенный эффект. Купируют бигемению, тригеминию, правильные нарушения ритма, нарушения ритма с «узким комплексом», нельзя при внутрижелудочковых блокадах
Флекаинид: внутрь 50-200 мг через 12ч; ПЭ - тошнота, усиление желудочковой аритмии, удлинение интервалов PR и QRS.
Пропафенон: внутрь 150-300 мг через 8 ч.
Группа II - -адреноблокаторы. В результате устранения избыточного влияния катехоламинов на сердце эти препараты понижают возбудимость, частоту сердечных сокращений, нормализуют ритм. К этому классу относятся метопролол, надолол, пиндолол, тразикор, корданум. Эффективны для купирующей и для поддерживающей терапии
1. -Адреноблокаторы без вазодилатирующих свойств: а) неселективные (пропранолол, надолол, окспренолол, соталол, тимолол и др.); б) 1-селективные (атенолол, бетаксолол, бисопролол, метопролол и др.). 2. -Адреноблокаторы с вазодилатирующими свойствами: а) неселективные (пиндолол, лабетолол и др.); б) 1-селективные (карведилол, целипролол и др.) .
Лечение нарушений ритма сердца
Почему терапия аритмий считается одним из самых сложных разделов кардиологии? Как классифицируются аритмии? Какие группы лекарственных препаратов используются при лечении аритмий? Нарушения ритма сердца (аритмии) представляют собой один из самы
Почему терапия аритмий считается одним из самых сложных разделов кардиологии?
Как классифицируются аритмии?
Какие группы лекарственных препаратов используются при лечении аритмий?
Нарушения ритма сердца (аритмии) представляют собой один из самых сложных разделов клинической кардиологии. Отчасти это объясняется тем, что для диагностики и лечения аритмий необходимо очень хорошее знание электрокардиографии, отчасти — огромным разнообразием аритмий и большим выбором способов лечения. Кроме того, при внезапных аритмиях нередко требуется проведение неотложных лечебных мероприятий.
Одним из основных факторов, повышающих риск возникновения аритмий, является возраст. Так, например, мерцательную аритмию выявляют у 0,4% людей, при этом большую часть пациентов составляют люди старше 60 лет [1, 2, 4]. Увеличение частоты развития нарушений ритма сердца с возрастом объясняется изменениями, возникающими в миокарде и проводящей системе сердца в процессе старения. Происходит замещение миоцитов фиброзной тканью, развиваются так называемые «склеродегенеративные» изменения. Кроме этого, с возрастом повышается частота сердечно-сосудистых и экстракардиальных заболеваний, что также увеличивает вероятность возникновения аритмий [17, 18].
Основные клинические формы нарушений ритма сердца
- Экстрасистолия.
- Тахиаритмии (тахикардии).
- Наджелудочковые.
- Желудочковые.
По характеру клинического течения нарушения ритма сердца могут быть острыми и хроническими, преходящими и постоянными. Для характеристики клинического течения тахиаритмий используют такие определения, как «пароксизмальные», «рецидивирующие», «непрерывно рецидивирующие» [2].
Лечение нарушений ритма сердца
Показаниями для лечения нарушений ритма являются выраженные нарушения гемодинамики или субъективная непереносимость аритмии. Безопасные, бессимптомные или малосимптомные легко переносящиеся аритмии не требуют назначения специального лечения. В этих случаях основным лечебным мероприятием является рациональная психотерапия. Во всех случаях прежде всего проводится лечение основного заболевания.
Антиаритмические препараты
Основным способом терапии аритмий является применение антиаритмических препаратов. Хотя антиаритмические препаты не могут «вылечить» от аритмии, они помогают уменьшить или подавить аритмическую активность и предотвратить рецидивирование аритмий.
Любое воздействие антиаритмическими препаратами может вызывать как антиаритмический, так и аритмогенный эффект (то есть, наоборот, способствовать возникновению или развитию аритмии). Вероятность проявления антиаритмического эффекта для большинства препаратов составляет в среднем 40-60% (и очень редко для некоторых препаратов при отдельных вариантах аритмии достигает 90%). Вероятность развития аритмогенного эффекта составляет в среднем примерно 10%, при этом могут возникать опасные для жизни аритмии. В ходе нескольких крупных клинических исследований было выявлено заметное повышение общей летальности и частоты случаев внезапной смерти (в 2 — 3 раза и более) среди больных с органическим поражением сердца (постинфарктный кардиосклероз, гипертрофия или дилатация сердца) на фоне приема антиаритмических препаратов класса I, несмотря на то что эти средства эффективно устраняли аритмии [7, 8, 9].
Согласно наиболее распространенной на сегодняшний день классификации антиаритмических препаратов Вогана Вильямса, все антиаритмические препараты подразделяются на 4 класса:
I класс — блокаторы натриевых каналов.
II класс — блокаторы бета-адренергических рецепторов.
III класс — препараты, увеличивающие продолжительность потенциала действия и рефрактерность миокарда.
IV класс — блокаторы кальциевых каналов.Применение комбинаций антиаритмических препаратов в ряде случаев позволяет достичь существенного повышения эффективности антиаритмической терапии. Одновременно отмечается уменьшение частоты и выраженности побочных явлений вследствие того, что препараты при комбинированной терапии назначают в меньших дозах [3, 17].
Следует отметить, что показаний для назначения так называемых метаболических препаратов пациентам с нарушениями ритма не существует. Эффективность курсового лечения такими препаратами, как кокарбоксилаза, АТФ, инозие-Ф, рибоксин, неотон и т. п., и плацебо одинаковы. Исключение составляет милдронат, препарат цитопротективного действия, имеются данные об антиаритмическом эффекте милдроната при желудочковой экстрасистолии [3].
Особенности лечения основных клинических форм нарушений ритма
Экстрасистолия
Клиническое значение экстрасистолии практически целиком определяется характером основного заболевания, степенью органического поражения сердца и функциональным состоянием миокарда. У лиц без признаков поражения миокарда с нормальной сократительной функцией левого желудочка (фракция выброса больше 50%) наличие экстрасистолии не влияет на прогноз и не представляет опасности для жизни. У больных с органическим поражением миокарда, например с постинфарктным кардиосклерозом, экстрасистолия может рассматриваться в качестве дополнительного прогностически неблагоприятного признака. Однако независимое прогностическое значение экстрасистолии не определено. Экстрасистолию (в том числе экстрасистолию «высоких градаций») даже называют «косметической» аритмией, подчеркивая таким образом ее безопасность.
Как было уже отмечено, лечение экстрасистолии с помощью антиаритмических препаратов класса I C значительно увеличивает риск смерти. Поэтому при наличии показаний лечение начинают с назначения β-блокаторов [8, 17, 18]. В дальнейшем оценивают эффективность терапии амиодароном и соталолом. Возможно также применение седативных препаратов. Антиаритмические препараты класса I C используют только при очень частой экстрасистолии, в случае отсутствия эффекта от терапии β-блокаторами, а также амидороном и соталолом (табл. 3)
Тахиаритмии
В зависимости от локализации источника аритмии различают наджелудочковые и желудочковые тахиаритмии. По характеру клинического течения выделяют 2 крайних варианта тахиаритмий (постоянные и пароксизмальные. Промежуточное положение занимают преходящие или рецидивирующие тахиаритмии. Чаще всего наблюдается мерцательная аритмия. Частота выявления мерцательной аритмии резко увеличивается с возрастом больных [1, 17, 18].
Мерцательная аритмия
Пароксизмальная мерцательная аритмия. В течение первых суток у 50% больных с пароксизмальной мерцательной аритмией отмечается спонтанное восстановление синусового ритма. Однако произойдет ли восстановление синусового ритма в первые часы, остается неизвестным. Поэтому при раннем обращении больного, как правило, предпринимаются попытки восстановления синусового ритма с помощью антиаритмических препаратов. В последние годы алгоритм лечения мерцательной аритмии несколько усложнился. Если от начала приступа прошло более 2 суток, восстановление нормального ритма может быть опасным — повышен риск тромбоэмболии (чаще всего в сосуды мозга с развитием инсульта). При неревматической мерцательной аритмии риск тромбоэмболий составляет от 1 до 5% (в среднем около 2%). Поэтому, если мерцательная аритмия продолжается более 2 суток, надо прекратить попытки восстановления ритма и назначить больному непрямые антикоагулянты (варфарин или фенилин) на 3 недели в дозах, поддерживающих показатель международного нормализованного отношения (МНО) в пределах от 2 до 3 (протромбиновый индекс около 60%). Через 3 недели можно предпринять попытку восстановления синусового ритма с помощью медикаментозной или электрической кардиоверсии. После кардиоверсии больной должен продолжить прием антикоагулянтов еще в течение месяца.
Таким образом, попытки восстановления синусового ритма предпринимают в течение первых 2 суток после развития мерцательной аритмии или через 3 недели после начала приема антикоагулянтов. При тахисистолической форме сначала следует уменьшить ЧСС (перевести в нормосистолическую форму) с помощью препаратов, блокирующих проведение в атриовентрикулярном узле: верапамила, β-блокаторов или дигоксина.
Для восстановления синусового ритма наиболее эффективны следующие препараты:
- амиодарон - 300-450 мг в/в или однократный прием внутрь в дозе 30 мг/кг;
- пропафенон - 70 мг в/в или 600 мг внутрь;
- новокаинамид - 1 г в/в или 2 г внутрь;
- хинидин - 0,4 г внутрь, далее по 0,2 г через 1 ч до купирования (макс. доза - 1,4 г).
Сегодня с целью восстановления синусового ритма при мерцательной аритмии все чаще назначают однократную дозу амиодарона или пропафенона перорально. Эти препараты отличаются высокой эффективностью, хорошей переносимостью и удобством приема. Среднее время восстановления синусового ритма после приема амиодарона (30 мг/кг) составляет 6 ч, после пропафенона (600 мг) — 2 ч [6, 8, 9].
При трепетании предсердий кроме медикаментозного лечения можно использовать чреспищеводную стимуляцию левого предсердия с частотой, превышающей частоту трепетания, — обычно около 350 импульсов в минуту, продолжительностью 15-30 с. Кроме того, при трепетании предсердий очень эффективным может быть проведение электрической кардиоверсии разрядом мощностью 25-75 Дж после в/в введения реланиума.
Постоянная форма мерцательной аритмии. Мерцание предсердий является наиболее часто встречающейся формой устойчивой аритмии. У 60% больных с постоянной формой мерцательной аритмии основным заболеванием являются артериальная гипертония или ИБС. В ходе специальных исследований было выявлено, что ИБС становится причиной развития мерцательной аритмии примерно у 5% больных. В России существует гипердиагностика ИБС у больных с мерцательной аритмией, особенно среди людей пожилого возраста. Для постановки диагноза ИБС всегда необходимо продемонстрировать наличие клинических проявлений ишемии миокарда: стенокардии, безболевой ишемии миокарда, постинфарктного кардиосклероза.
Мерцательная аритмия обычно сопровождается неприятными ощущениями в грудной клетке, могут отмечаться нарушения гемодинамики и, главное, повышается риск возникновения тромбоэмболий, прежде всего в сосуды мозга. Для снижения степени риска назначают антикоагулянты непрямого действия (варфарин, фенилин). Менее эффективно применение аспирина [1, 17, 18].
Основным показанием для восстановления синусового ритма при постоянной форме мерцательной аритмии является «желание больного и согласие врача».
Для восстановления синусового ритма используют антиаритмические препараты или электроимпульсную терапию.
Антикоагулянты назначают, если мерцательная аритмия наблюдается более 2 суток. Особенно высок риск развития тромбоэмболий при митральном пороке сердца, гипертрофической кардиомиопатии, недостаточности кровообращения и тромбоэмболиях в анамнезе. Антикоагулянты назначают в течение 3 недель до кардиоверсии и в течение 3 — 4 недель после восстановления синусового ритма. Без назначения антиаритмических препаратов после кардиоверсии синусовый ритм сохраняется в течение 1 года у 15 — 50% больных. Применение антиаритмических препаратов повышает вероятность сохранения синусового ритма. Наиболее эффективно назначение амиодарона (кордарона) — даже при рефрактерности к другим антиаритмическим препаратам синусовый ритм сохраняется у 30 — 85% больных [2, 12]. Кордарон нередко эффективен и при выраженном увеличении левого предсердия.
Кроме амиодарона для предупреждения повторного возникновения мерцательной аритмии с успехом используются соталол, пропафенон, этацизин и аллапинин, несколько менее эффективны хинидин и дизопирамид. При сохранении постоянной формы мерцательной аритмии больным с тахисистолией для снижения ЧСС назначают дигоксин, верапамил или β-блокаторы. При редко встречающемся брадисистолическом варианте мерцательной аритмии эффективным может быть назначение эуфиллина (теопек, теотард).
Проведенные исследования показали, что две основные стратегии ведения больных с мерцательной аритмией — попытки сохранения синусового ритма или нормализация ЧСС на фоне мерцательной аритмии в сочетании с приемом непрямых антикоагулянтов — обеспечивают примерно одинаковое качество и продолжительность жизни больных [17].
Пароксизмальные наджелудочковые тахикардии
Пароксизмальные наджелудочковые тахикардии, встречающиеся гораздо реже, чем мерцательная аритмия, не связаны с наличием органического поражения сердца. Частота их выявления с возрастом не увеличивается.
Купирование пароксизмальных наджелудочковых тахикардий начинают с применения вагусных приемов. Наиболее часто используют пробу Вальсальвы (натуживание на вдохе около 10 с) и массаж сонной артерии. Очень эффективным вагусным приемом является «рефлекс ныряния» (погружение лица в холодную воду) — восстановление синусового ритма отмечается у 90% больных. При отсутствии эффекта от вагусных воздействий назначают антиаритмические препараты. Наиболее эффективны в этом случае верапамил, АТФ или аденозин.
У больных с легко переносящимися и сравнительно редко возникающими приступами тахикардии практикуется самостоятельное пероральное купирование приступов. Если в/в введение верапамила оказывается эффективным, можно назначить его внутрь в дозе 160-240 мг однократно, в момент возникновения приступов. Если более эффективным признается в/в введение новокаинамида — показан прием 2 г новокаинамида. Можно иcпользовать 0,5 г хинидина, 600 мг пропафенона или 30 мг/кг амиодарона внутрь.
Желудочковые тахикардии
Желудочковые тахикардии в большинстве случаев возникают у больных с органическим поражением сердца, чаще всего при постинфарктном кардиосклерозе [13, 14].
Лечение желудочковой тахикардии. Для купирования желудочковой тахикардии можно использовать амиодарон, лидокаин, соталол или новокаинамид.
При тяжелых, рефрактерных к медикаментозной и электроимпульсной терапии, угрожающих жизни желудочковых тахиаритмиях применяют прием больших доз амиодарона: внутрь до 4 — 6 г в сутки перорально в течение 3 дней (то есть по 20 — 30 табл.), далее по 2,4 г в сутки в течение 2 дней (по 12 табл.) с последующим снижением дозы [6, 10, 15, 16].
Предупреждение рецидивирования тахиаритмий
При частых приступах тахиаритмий (например, 1 — 2 раза в неделю) последовательно назначают антиаритмические препараты и их комбинации до прекращения приступов. Наиболее эффективным является назначение амиодарона в качестве монотерапии или в комбинации с другими антиаритмическими препаратами, прежде всего с β-блокаторами.
При редко возникающих, но тяжелых приступах тахиаритмий подбор эффективной антиаритмической терапии удобно проводить с помощью чреспищеводной электростимуляции сердца — при наджелудочковых тахиаритмиях — и программированной эндокардиальной стимуляции желудочков (внутрисердечное электрофизиологическое исследование) — при желудочковых тахиаритмиях. С помощью электростимуляции в большинстве случаев удается индуцировать приступ тахикардии, идентичный тем, которые спонтанно возникают у данного больного. Невозможность индукции приступа при повторной электрокардиостимуляции на фоне приема препаратов обычно совпадает с их эффективностью при длительном приеме [17, 18]. Следует отметить, что некоторые проспективные исследования продемонстрировали преимущество «слепого» назначения амиодарона и соталола при желудочковых тахиаритмиях перед тестированием антиаритмических препаратов класса I с помощью программированной электростимуляции желудочков или мониторирования ЭКГ.
При тяжелом течении пароксизмальных тахиаритмий и рефрактерности к медикаментозной терапии применяют хирургические способы лечения аритмий, имплантацию кардиостимулятора и кардиовертера-дефибриллятора.
Подбор антиаритмической терапии у больных с рецидивирующимим аритмиями
С учетом безопасности антиаритмических препаратов оценку эффективности целесообразно начинать с β-блокаторов или амиодарона. При неэффективности монотерапии оценивают действенность назначения амиодарона в комбинации с β-блокаторами [17]. Если нет брадикардии или удлинения интервала РR, с амиодароном можно сочетать любой β-блокатор. У больных с брадикардией к амиодарону добавляют пиндолол (вискен). Показано, что совместный прием амиодарона и β-блокаторов способствует значительно большему снижению смертности пациентов с сердечно-сосудистыми заболеваниями, чем прием каждого из препаратов в отдельности. Некоторые специалисты даже рекомендуют имплантацию двухкамерного стимулятора (в режиме DDDR) для безопасной терапии амиодароном в сочетании с β-блокаторами. Антиаритмические препараты класса I применяют только при отсутствии эффекта от β-блокаторов и/или амиодарона. Препараты класса I C, как правило, назначают на фоне приема бета-блокатора или амиодарона. В настоящее время изучается эффективность и безопасность применения соталола (β-блокатора, обладающего свойствами препаратов класса III).
П. Х. Джанашия, доктор медицинских наук, профессор
Н. М. Шевченко, доктор медицинских наук, профессор
С. М. Сорокoлетов, доктор медицинских наук, профессор
РГМУ, Медицинский центр Банка России, МоскваОсобенности лечения нарушений ритма на догоспитальном этапе
Лечение нарушений ритма представляет собой один из самых сложных разделов кардиологии и напрямую зависит от наличия четкого представления о механизме их возникновения. Однако попытка создания универсальной классификации антиаритмических средств, которую
Лечение нарушений ритма представляет собой один из самых сложных разделов кардиологии и напрямую зависит от наличия четкого представления о механизме их возникновения. Однако попытка создания универсальной классификации антиаритмических средств, которую можно было бы использовать в качестве руководства к действию и которая позволяла бы подбирать оптимально обоснованное лечение, другими словами, попытка подобрать антиаритмик, подходящий к аритмии как «ключ к замку», потерпела неудачу.
Взаимодействие антиаритмиков представляет собой достаточно тонкую субстанцию, суть которой зачастую ускользает от понимания. Существуют взаимодействия, которые априорно опасны и нежелательны, но неблагоприятное воздействие далеко не всех комбинаций столь широко известно и очевидно, как, например, риск развития брадисистолии и гипотензии при совместном применении верапамила и β-адреноблокатора.
Суправентрикулярная тахикардия
Диагностировать суправентрикулярную тахиаритмию (СВТ) бывает несложно при наличии характерной электрокардиографической картины (отсутствие или атипичный зубец P и узкие комплексы QRS). Однако нарушения проведения импульса по ножкам пучка Гиса или же развитие реэнтрантной тахикардии с ретроградным проведением при наличии дополнительных проводящих путей приводят к появлению аберрантных (расширенных, имеющих измененную форму) желудочковых комплексов. Отсутствие предсердных зубцов заставляет сомневаться в характере нарушения ритма: является ли эта тахикардия суправентрикулярной или желудочковой. Принципиально важной в такой ситуации может оказаться фиксация сливных или захваченных комплексов, т. е. эпизодов прохождения импульса от синусового узла к желудочкам. Это является верным признаком желудочковой тахикардии.
Напротив, так называемые вагусные пробы вызывают снижение ритма при некоторых наджелудочковых тахикардиях и никак не влияют на желудочковую. Но при наличии в арсенале врача достаточного количества лекарственных средств увлечение вагусными пробами малообоснованно, так как может привести к неблагоприятным последствиям. Массаж каротидных синусов, например, связан с риском нарушения мозгового кровообращения и не рекомендуется у пожилых людей и у пациентов более молодого возраста, страдающих распространенным атеросклерозом. Проба Ашоффа (надавливание на глазные яблоки) сопряжена с риском повреждения сетчатки, а надавливание (или удар) в область солнечного сплетения чревато нанесением повреждений внутренним органам. Опасным может оказаться натуживание для больных с острым коронарным синдромом и пациентов с нарушенным мозговым кровотоком. Не рекомендуются вагусные пробы и при наличии синдрома Вольффа-Паркинсона-Уайта (WPW) — а ведь именно ретроградные тахикардии при этой болезни сопровождаются «аберрантными» QRS и вызывают серьезные диагностические затруднения.
Другим типичным подходом является диагностика ex juvantibus, т. е. на основании выбора эффективного лекарства. Риск «не угадать» нужное средство заставляет подыскивать для этой цели наиболее «безопасные» и некумулирующие препараты. Предпочтение отдается аденозину (АТФ), так как период его «полужизни» составляет менее полминуты, соответственно ни потенциальные побочные эффекты, ни потенциальные взаимодействия долго наблюдаться не могут. Справедливости ради стоит заметить, что выделяются как формы желудочковой тахикардии, чувствительные и к аденозину, и к верапамилу, так и формы СВТ, синусовый ритм при которых восстанавливается лидокаином. Следует лишь учитывать, что введение АТФ на фоне приема β-адреноблокаторов сопряжено с риском преходящего угнетения синусового узла и, соответственно, развития тяжелой брадикардии или даже асистолии после купирования эктопического ритма.
Распределение аденозиновых рецепторов в гладкой мускулатуре — характеристика достаточно индивидуальная. Поэтому относительно непредсказуемым можно считать эффект от воздействия АТФ на тонус сосудов. У пациентов с вазоспастической стенокардией введение этого препарата чревато развитием тяжелого ангинозного приступа. В случае затягивания последнего следует иметь в виду, что медикаментозным антагонистом АТФ является теофиллин.
Вводить АТФ следует быстро, толчком, предварительно не разводя (разведение может уменьшить концентрацию и «размыть» эффект).
Если введение АТФ может применяться при любых суправентрикулярных нарушениях ритма, то верапамил следует назначать только в случаях тахикардии с узкими комплексами QRS. Назначение этого лекарства при «аберрантных» тахикардиях в тех случаях, когда причина аберрации комплексов не установлена, может превратиться в фатальную ошибку в том случае, если врач имеет дело с антедромной тахикардией (тахикардией с обратным проведением) на фоне синдрома WPW. Кстати, пароксизмы ортодромной тахикардии при том же синдроме (а эта тахикардия, как правило, характеризуется «нормальными» QRS) противопоказанием к назначению верапамила не являются.
Известной аккуратности требует оценка потенциальных взаимодействий верапамила. В частности, совместное применение с дигоксином приводит к вытеснению последнего из связи с белками и риску развития дигиталисной интоксикации, а внутривенное применение на фоне приема β-блокаторов чревато развитием тяжелой брадикардии, блокад и артериальной гипотензии.
А вот опасность взаимодействия с β-адреноблокаторами другого антагониста кальция — дилтиазема — оказалась не так велика, в отличие от выраженности антиаритмического эффекта, что послужило причиной появления рекомендации по самостоятельному купированию пароксизмов суправентрикулярной тахикардии путем одновременного приема этих 2 препаратов в таблетированной форме.
И АТФ, и верапамил в случае отсутствия эффекта следует вводить повторно, увеличивая при этом вдвое начальную дозу (необходимо помнить, что начальной при введении верапамила является доза не более 5 мг).
Новокаинамид, являясь «универсальным» антиаритмическим средством, все-таки представляет собой препарат второго ряда. При пароксизмах СВТ переходить к нему следует только при отсутствии эффекта от повторных введений АТФ или верапамила. Основными недостатками новокаинамида являются риск развития гипотензии, появления внутрисердечной блокады и удлинения интервала Q-T. Поэтому внутривенное введение этого препарата следует осуществлять медленно, со скоростью 20-30 мг/мин (что гораздо медленнее привычного темпа, когда 10 мл 10% раствора вводятся за 5-10 мин), под контролем давления и ЭКГ.
В случае существенного расширения QRS введение лекарства останавливается. Максимальная разовая доза новокаинамида — 17 мг на килограмм массы тела, а это значит, что введение полной ампулы препарата (1000 мг) возможно только у лиц, весящих не меньше 59 кг — в иных случаях требуется уточнение.
Серьезное ухудшение состояния новокаинамид может вызвать и за счет присущего ему отрицательного инотропного действия, поэтому его применение в условиях развития острой сердечной недостаточности неоправданно.
Сердечные гликозиды являются значительно менее эффективным средством купирования СВТ. К тому же их антиаритмический эффект развивается гораздо позже (ко второму часу от момента введения). О них следует вспоминать, пожалуй, только в тех случаях, когда перечисленные выше препараты по тем или иным причинам противопоказаны, у пациента имеется выраженное угнетение насосной функции сердца, а проведение электроимпульсной терапии невозможно. Следует стараться избегать назначения дигоксина у пациентов с синдромом WPW, особенно при наличии в анамнезе эпизодов мерцательной аритмии (высокий риск фибрилляции желудочков).
Трепетание предсердий
Традиционно вопросы лечения трепетания предсердий (ТП) рассматриваются либо в разделе суправентрикулярных тахиаритмий, либо в разделе мерцательной аритмии (МА), что вряд ли обоснованно. Слишком велики особенности этой патологии. В отличие от других видов СВТ, аденозин при ТП абсолютно неэффективен — его введение лишь помогает проведению дифференциальной диагностики — на ЭКГ на считанные секунды появляется страшноватая с виду «пилообразная» кривая без желудочковых комплексов. Эффективность верапамила также невелика, а достижению эффективной дозы мешает порой артериальная гипотензия.
Более выраженным эффектом обладают антиаритмики класса IА — новокаинамид и хинидин. Однако ваголитический эффект этих препаратов (в особенности верапамила) создает риск ускорения проводимости по атривентрикулярному соединению. Это может стать причиной увеличения показателя кратности проведения — от 3:1 или 2:1 к 1:1, что приведет к развитию тахикардии с ЧСС 300-400 уд/мин, т. е. состоянию, гемодинамически мало чем превосходящему трепетание желудочков. Поэтому применение хинидиноподобных препаратов при ТП является мероприятием небезобидным. Средством профилактики этого побочного эффекта может быть предварительное назначение верапамила (как средства, наиболее быстро блокирующего проведение по АВ-соединению).
Поэтому средством выбора при пароксизмах ТП являются электроимпульсные методы лечения — дефибрилляция или учащающая чреспищеводная стимуляция (последняя методика позволяет если не восстановить ритм, то перевести его в мерцательную аритмию, ЧСС при которой гораздо легче контролируется).
Из медикаментозных средств для восстановления ритма при ТП в настоящее время рекомендуются пропафенон и амиодарон.
Желудочковая тахикардия
Традиционно первым средством выбора при лечении желудочковой тахикардии (ЖТ) является лидокаин. Хорошее знакомство с лекарством, частое назначение (особенно раньше, когда препарат применялся превентивно в период транспортировки больных инфарктом миокарда) создали иллюзию безопасности этого средства. Увы, это не совсем так. Применение лидокаина сопряжено с рядом опасностей, в первую очередь связанных с его передозировкой.
Начальная доза лидокаина должна составлять 1,5 мг на килограмм массы тела — меньшее количество может оказаться попросту неэффективным (в первую очередь это относится к пациентам с инфарктом миокарда; инфаркт сопровождается повышением сывороточной концентрации кислого α1-гликопротеина — белка, связывающего лидокаин). Снижать ее следует у лиц старше 75 лет, при патологии печени и при одновременном применении β-адреноблокаторов. Общая нагрузочная доза (в случае повторных введений) не должна превышать 3 мг на килограмм массы. В дальнейшем поддерживающая доза составляет 2-3 мг/мин (редко 1 или 4).
Не показано введение лидокаина с превентивными целями, так как было продемонстрировано, что это повышает летальность при инфаркте миокарда. (Правда, в ходе того же исследования было обнаружено, что профилактическое применение лидокаина все же уменьшает частоту развития нефатальной фибрилляции желудочков. Таким образом, вопрос о том, следует ли вводить лидокаин во время транспортировки пациента при отсутствии дефибриллятора остается открытым.)
В случае неэффективности лидокаина препаратом выбора при лечении ЖТ является новокаинамид. Его применение в известной степени ограничивает тот факт, что довольно часто ЖТ сопутствует артериальная гипотензия. Кроме того, применение новокаинамида может оказаться рискованным и даже фатальным при развитии ЖТ на фоне удлинения интервала Q-T. Новокаинамид потенцирует это явление, и его назначение способно вызвать развитие трепетания и фибрилляции желудочков.
Для синдрома удлинения интервала Q-T характерна аритмия «пируэт» (torsade de points). Препаратом первого ряда при ней является отнюдь не лидокаин, а сульфат магния (2-2,5 г внутривенно). Кроме того, эффективным может оказаться учащение сердечного ритма с помощью инфузии изопротеренола (от 2 до 20 мг/мин) или проведение учащающей электрокардиостимуляции.
Лечение желудочковой экстрасистолии должно сводиться либо к мерам, сходным с лечением ЖТ (при частой, политопной, групповой экстрасистолии или пробежках неустойчивой ЖТ), либо к поиску причин, спровоцировавших экстрасистолию, и принятию мер по их устранению.
Мерцательная аритмия
Распространенной ошибкой (особенно при оказании помощи на догоспитальном этапе) является восстановление синусового ритма любыми силами. Между тем последние данные (результаты исследований PIAF и AFFIRM) показали, что излишнее упорство в поддержании синусового ритма даже несколько ухудшает отдаленный прогноз в сравнении с теми пациентами, у которых контролируется не ритм, а частота сердечных сокращений. Однако грамотная схема лечения должна предусматривать разделение пациентов с постоянной формой мерцательной аритмии на 2 группы: больные с сохраненным сердечным выбросом и больные со снижением сердечного выброса и признаками застойной сердечной недостаточности. ЧСС в отсутствие застойных явлений следует контролировать β-адреноблокаторами или антагонистами кальция. Назначение в этой ситуации дигоксина в качестве препарата первого ряда необоснованно. Напротив, наличие сердечной недостаточности предусматривает назначение дигоксина в качестве препарата выбора либо комбинации дигоксина с небольшой дозой β-адреноблокатора.
Электроимпульсная терапия
Назначение препаратов калия в настоящее время не признается серьезным базовым антиаритмическим мероприятием, за исключением случаев гипокалиемии. Однако в качестве адъювантного средства применение ионных растворов допустимо. В особенности это касается подготовки пациентов к кардиоверсии, когда для обеспечения электрической стабильности миокарда следует добиваться достижения уровня калия не ниже 4,0 ммоль/л и магния не ниже 0,85 ммоль/л.
При проведении кардиоверсии следует учитывать предшествующую и сопутствующую терапию. Само по себе применение дигоксина не исключает последующего проведения ЭИТ, а вот насыщение дигоксином (завершенная дигитализация) делает проведение ЭИТ если не невозможным, то как минимум очень опасным в связи с риском развития фибрилляции желудочков. Применение лидокаина и амиодарона повышает антифибрилляторный порог, но может потребовать и более высокой энергии наносимого разряда. В целом, энергия разряда зависит от характера нарушения ритма: при трепетании предсердий и суправентрикулярной тахикардии требуется проведение ЭИТ с энергией разряда равной 50 Дж, при мономорфной желудочковой тахикардии — разрядом в 100 Дж, при полиморфной желудочковой тахикардии — 200 Дж, а при мерцательной аритмии используется разряд в 100-200 Дж.
А. Л. Верткин, доктор медицинских наук, профессор
О. Б. Талибов, кандидат медицинских наук, доцент
МГМСУ, ННПОСМП, МоскваКлассификация антиаритмических средств по электрофизиологическим параметрам (Williams e.M.)
Принципиальные механизмы действия антиаритмических средств
↓ Скорость МДД (удлиняют фазу 4)
↓ Скорость фазы 0
↓ Частоту импульсов при аритмиях предсердий и Re-entry.
Ограничивают частоту импульсов при тахиаритмии.
↓ Поступление Na + в клетки
Замедляют скорость деполяризации.
При аритмии ↑ этих функций может быть связано с ↑ СНС (экстракардиальный фактор) → Na + в клетки → ПД → ↑ скорость МДД (↑ автоматизм).
Необходимо ↓ симпатическую иннервацию к сердцу (β-блокаторы), но β-блокаторы ↓ и сократимость, т.к. ↓ вход Na + в клетки сократительного миокарда, а Na + необходим для обмена на Са ++ → Са ++ не поступает в клетку → СН, ↓ МОС, ↓ САД.
Точки приложения действия антиаритмических средств
СУ и предсердия
Механизмы действия антиаритмических лекарственных средств
↓ Быстрый вход ионов Na + в клетки в фазе 0 → замедление максималь-ной скорости деполяри-зации (по принципу действия местноанесте-зирующих средств).
А: ↑ ЭРП проводящих клеток после быстрой деполяризации (за счет
↑ продолжительности ПД - замедления репо-ляризации),
↓ Автоматизм (за счет удлинения диастоличес-кой деполяризации - фазы 4 и ↑ порога возбу-димости),
↓ Проводимость (за счет ↓ Скорости быстрой де-поляризации - фазы 0 и замедления процессов деполяризации-реполя-ризации в целом).
Лечение аритмий. Классификация антиаритмических средств, разработанная Воганом Уильямсом
Фармакология:
Классификация антиаритмических лекарств по Вону-Уильямсу
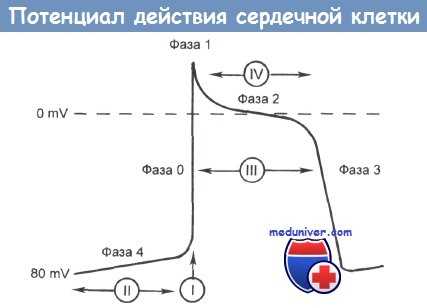
Эта классификация препаратов основана на фазах сердечного цикла, представленных на рисунке.
Фаза 0 — это быстрая деполяризация клеточной оболочки, обусловленная быстрым поступлением ионов натрия через каналы, избирательно пропускающие эти ионы.
Фаза 1 характеризуется коротким начальным периодом быстрой реполяризации, главным образом за счет выхода из клетки ионов калия.
Фаза 2 — это период замедленной реполяризации главным образом за счет медленного поступления ионов кальция из внеклеточного пространства в клетку через кальциевые каналы.
Фаза 3 — второй период быстрой реполяризации, в течение которой ионы калия выходят из клетки.
Фаза 4 — это состояние полной реполяризации, во время которой ионы калия вновь поступают в клетку, а ионы натрия и кальция выходят из нее. В течение этой фазы содержимое клетки, которая разряжается автоматически, постепенно становится менее отрицательным, до тех пор пока не будет достигнут потенциал (порог), что позволит пройти быстрой деполяризации (фаза 0), и весь цикл повторяется. Клетки, которые сами по себе не обладают автоматизмом, зависят от перехода потенциала действия от других клеток для того, чтобы началась деполяризация.В итоге в большинстве случаев аритмии сердца, возможно, обусловлены:
• изменением скорости спонтанных разрядов в проводящей ткани или
• нарушением проведения импульсов в части проводящих волокон с образованием очагов рециркуляции возбуждения.![Потенциал действия клетки сердца]()
Потенциал действия сердечной клетки, способной к спонтанной деполяризации (узел СП или АВ или пучок Гиса—Пуркинье), соответствует фазам 0—4; цифры показывают постепенное повышение трансмембранного потенциала (mV) в течение фазы 4; клетки, не способные к спонтанной деполяризации, не демонстрируют повышения вольтажа во время этой фазы (см. текст). Действие антиаритмических препаратов классов I, II, III и IV показано в связи с этими фазами.
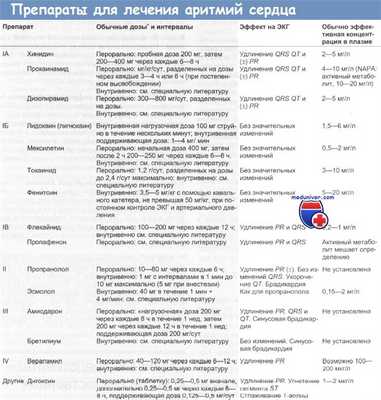
Классификация антиаритмических лекарственных средств
Класс I: блокаторы натриевых каналов. Препараты этой группы ограничивают быстрый входящий ток ионов натрия в клетки во время фазы 0 и, таким образом, замедляют максимальную скорость деполяризации. Это свойство препаратов получило название мембраностабилизирующей активности, в результате которой могут купироваться аритмии, снижая реакцию на возбуждение клеток сердца. Эти препараты можно разделить на следующие подклассы:
A. Удлиняющие длительность потенциала действия и рефрактерный период, например хинидин, дизопирамид, прокаинамид;
Б. Укорачивающие длительность потенциала действия и рефрактерный период, например лидокаин, мексилетин, токаинид, фенитоин;
B. Мало влияющие на длительность потенциала действия и рефрактерный период, например флекайнид, иропафенон.Препараты группы IБ неэффективны при суправентрикулярной аритмии, хотя все они обладают некоторым действием при аритмии желудочков сердца. Однако данная классификация не может объяснить, почему эти классы препаратов действуют на определенные анатомические структуры.
Класс II: блокаторы симпатической нервной системы. Пропранолол и другие b-адреноблокаторы снижают активность симпатической нервной системы в сердце, уменьшают автоматический разряд (фаза 4) и защищают от адренергически стимулированных эктопических водителей ритма.
Класс III: удлиняющие рефрактерный период без изменения скорости деполяризации (фаза 0). Удлинение периода рефрактерности клеток (фазы 1, 2, 3) выше критического уровня может прервать рециркуляцию импульса при аритмиях, связанных с повторным поступлением возбуждения, и таким образом ликвидировать тахикардию, обусловленную нарушениями в проводящей системе, например амиодарон, бретилиум, соталол.
Класс IV: блокаторы кальциевых каналов. Блокируя медленные кальциевые каналы (фаза 2), препараты этой группы замедляют скорость разрядов в СП-узле и удлиняют время проведения и рефрактерность в узле АВ. Это объясняет эффективность 6локаторов кальциевых каналов при пароксизмальной суправентрикулярной тахикардии. Этими свойствами обладает верапамил.
Хотя все противоаритмические препараты вошли в эту классификацию в соответствии с характеристикой их главного действия, большинство из них обладает и другими эффектами. Например, хинидин (класс I) обладает только эффектами препаратов класса III, пропранолол (класс II) — эффектами препаратов класса I, бретилиум (класс III) — эффектами класса II и сатолол (класс II) — эффектами класса III.
![Препараты для лечения аритмий сердца]()
Дозы основаны на рекомендациях Британского национального фармакологического справочника (British National Formulary). Для больных с пониженной функцией печени и почек дозы следует уменьшать.
Читайте также: