Лучевые признаки дисплазии трикуспидального клапана сердца плода
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
При возникновении жизнеугрожающих осложнений аномалии Эбштейна конусная реконструкция может быть выполнена в раннем возрасте, включая новорожденных детей, а также у людей старшего возраста с обязательным учетом сократительной функции правого и левого желу
Ebstein’s anomaly: etiology, pathogenesis and cone reconstruction of the tricuspid valve as a first experience in anatomic repair
In the event of life-threatening complications in Ebstein’s anomaly cone reconstruction can be done at early age, including newborns and in older people in consideration of the contractile function of the left and right ventricles.
Наиболее полное первое освещение особенностей аномалии Эбштейна в отечественной литературе дано Р. П. Зубаревым в книге «Аномалия Эбштейна» [1].
В настоящее время накоплен большой материал по эмбриогенезу данного врожденного порока сердца (ВПС). Механизмы, вызывающие нарушение сепарации створок, не установлены. Однако известны данные о частом возникновении данного порока при мутации гена NKX2.5, 10p13-p14, 1p34.3-p36.11 и у женщин, принимавших на ранних сроках беременности бензодиазепин или препараты, содержащие литий [2]. Известны семейные случаи возникновения данного порока [3]. У нас под наблюдением находятся два таких пациента. В одном случае это однояйцевая двойня, так как матери путем экстракорпорального оплодотворения имплантировали одну яйцеклетку, а в другом случае это была монохориальная двойня. У одного ребенка аномалия Эбштейна сочеталась с дефектом межжелудочковой и межпредсердной перегородки и атрезией легочной артерии, у другого с дефектом межпредсердной перегородки. Вторые дети не имеют врожденных пороков сердца. Генетический материал в данных случаях идентичный, как и характер воздействия факторов внешней среды.
Анатомические особенности при данной патологии подробно описаны Н. А. Белоконь и В. П. Подзолковым (1990) [4]. Следует отметить, что данный врожденный порок имеет выраженную индивидуальную вариабельность. Основная анатомическая особенность порока заключается в смещении трехстворчатого клапана в полость правого желудочка по направлению к верхушке сердца, обычно до места соединения приточной и трабекулярной его частей [5, 6]. Степень дисплазии, деформации створок, их структур варьирует в широких пределах:
- нарушается процесс деламинации (отсепаровывания) ткани створок трикуспидального клапана от эндокарда правого желудочка (рис. 2);
- задняя и септальные створки распластываются по эндокарду правого желудочка, и свободные части створок смещены апикально от клапанного кольца;
- хордальный аппарат задней и септальных створок укорачивается или отсутствует;
- происходит смещение в переднеапикальном направлении уровня кооптации створок трикуспидального клапана;
- передняя створка трикуспидального клапана компенсаторно увеличивается, утолщается, в ней часто появляются фенестрации;
- зона истинного трикуспидального кольца расширяется;
- происходит дилятация атриализированной части правого желудочка с истончением в ней миокарда и замещением последнего фиброзом;
- полость правого предсердия значительно увеличивается.
Естественное течение пациентов с аномалией Эбштейна неблагоприятно. По данным исследования A. Yetman и соавт. (1997), проанализировавших выживаемость 46 новорожденных пациентов с аномалией Эбштейна и цианозом, 70% больных умерли. По данным кардиохирургического отделения ДГБ № 1 г. Санкт-Петербурга у одной женщины была диагностирована замершая беременность плода, наблюдавшегося с диагнозом «аномалия Эбштейна», а двое детей с аномалией Эбштейна погибли на первом месяце жизни. В Самарском кардиодиспансере наблюдался ребенок с выраженной формой аномалии Эбштейна. Ребенок погиб внезапно на дому в возрасте 7 месяцев.
В связи с появлением возможности анатомической коррекции данного порока сердца собственными тканями в раннем возрасте, выполняя операцию конусной реконструкции, можно утверждать, что в решении данной проблемы появился коренной перелом. Важной проблемой остается возможность выделения пациентов, у которых риск внезапной смерти превышает риск выполнения оперативного лечения в раннем возрасте.
Материалы и методы исследования
Данное исследование проводилось на основании анализа клинического материала с 2014 г. по настоящее время. Учитывались результаты операции аномалии Эбштейна в трех кардиохирургических центрах. Клиническая характеристика пациентов приведена в табл.
Результаты
У пациентов, прооперированных в возрасте до 5 лет, с высокой частотой отмечались различные осложнения, в том числе: реципрокные предсердно-желудочковые (28,5%) и нереципрокные предсердные нарушения ритма (33,3%), наличие сопутствующих пороков сердца и декомпенсация гемодинамики.
Среди них был пациент 11 месяцев. Ребенок поступил в стационар по экстренным показаниям в связи с выраженной тромбоцитопенической пурпурой. Хроническая гипоксемия привела к декомпенсации ДВС-синдрома. Во время операции в полости правого желудочка у этого пациента был выявлен и удален плоский организовавшийся тромб.
Другой пациент был прооперирован по поводу аномалии Эбштейна на вторые сутки жизни. Масса тела ребенка составляла 2 кг 300 г. Он был вторым из двойни. Первый ребенок здоров. Операция потребовалась по экстренным показаниям в связи с наличием у ребенка атрезии легочной артерии и гемодинамикой, зависящей от функционирования артериального протока. Ребенку в условиях искусственного кровообращения была выполнена анатомическая коррекция аномалии Эбштейна, закрыт дефект межпредсердной перегородки, дефект межжелудочковой перегородки и легочная артерия реконструирована венозным клапансодержащим гомографтом. По данным литературы подобная успешная коррекция выполнена впервые в мире.
У третьего ребенка прогрессировала легочная гипертензия на фоне большого дефекта межжелудочковой перегородки.
Четвертый пациент был 5 лет. Ему операция выполнялась по срочным показаниям в связи с остро развившейся брадиаритмией (частота сердечных сокращений 36-48 ударов в минуту) через 2 месяца после повторной радиочастотной абляции. Радиочастотная абляция выполнялась по поводу дополнительных проводящих путей, приводящих к постоянно рецидивирующей атриовентрикулярной реципрокной гемодинамически значимой тахикардии. У него появилась полная атриовентрикулярная блокада. Во время операции ему был имплантирован постоянный двухкамерный кардиостимулятор, и через 2 месяца по данным холтеровского мониторирования у него 86% времени регистрировался правильный синусовый ритм. Результаты обобщены в рис. 1.
При анализе показания для выполнения оперативного лечения аномалии Эбштейна в раннем возрасте выделены следующие основные звенья нарушения гемодинамики, выявленные у всех оперированных пациентов:
- уменьшение полости правого желудочка за счет смещения уровня кооптации створок к верхушке сердца, приводящее к нарушению диастолической функции правого желудочка;
- регургитация на трикуспидальном клапане вызывала объемную перегрузку правых отделов сердца и приводила к прогрессирующей дилатации атриализированной части правого желудочка и правого предсердия при наблюдении в динамике;
- атриализированная часть правого желудочка выбрасывает кровь в ретроградном направлении, увеличивая объемную перегрузку правых отделов сердца;
- тахиаритмии нарушали механизмы компенсации, вызывая острую сердечно-сосудистую недостаточность.
Данные нарушения гемодинамики взаимосвязаны, прогрессируют со временем и при возникновении нарушений ритма носят жизнеугрожающий характер. В связи с этим риск откладывания оперативного лечения превышает риск выполнения операции у детей раннего возраста.
Существенную роль в патогенезе заболевания имеет прогрессирующее замещение мышечной ткани правого желудочка в атриализированной части фиброзом. По данным операционного материала получены морфологические препараты, представленные на рис. 2, 3 и 4.
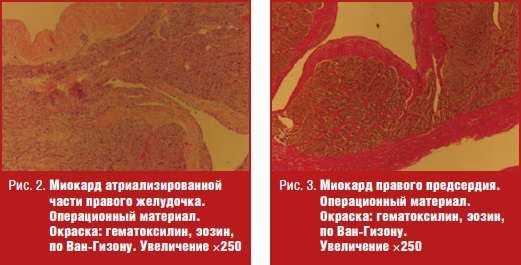

На этом препарате зафиксировано выраженное утолщение эндокарда. Выраженные признаки фиброза в эндомизии и склеротические изменения истонченного миокарда.
На всех препаратах выраженное замещение соединительнотканным матриксом миокарда.
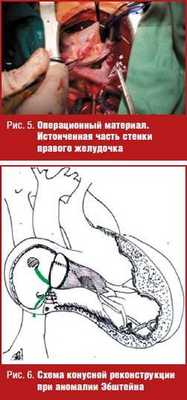
Убедительным примером морфологических изменений в атриализированной части правого желудочка может служить операционная фотография, характеризующая нативный вид атриализированной стенки правого желудочка после отсепаровывания задней створки трикуспидального клапана. Так выглядел миокард приточного отдела правого желудочка у всех пациентов (рис. 5).
Стенка атриализированной части правого желудочка после сепарации створок представляет собой слой эпикарда и миокарда толщиной 2-3 мм. Ее функциональные возможности сомнительны. Риск развития аневризмы и риск возникновения в ней круговых электрических токов достаточно велик.
Суммируя анатомические изменения, вызывающие нарушения гемодинамики и морфофункциональные изменения в полости правого желудочка, можно сделать вывод о том, что пациенты с выраженной формой аномалии Эбштейна должны быть прооперированы в раннем детстве, могут быть прооперированы в подростковом возрасте и не все взрослые пациенты с аномалией Эбштейна смогут перенести операцию по радикальной коррекции порока сердца.
У 19 пациентов с аномалией Эбштейна была проведена операция по конусной реконструкции.
У всех пациентов операция выполнялась на остановленном сердце. В среднем время пережатия аорты составило 127 ± 34 минуты. Кардиоплегия выполнялась раствором Кустодиол. Кардиоплегия повторялась через 90-110 минут. Гипотермия во время коррекции составляла 28-32 °С.
Схема операции представлена на рис. 6.
Цель данной операции — создание конуса из тканей трикуспидального клапана без подтягивания створок к фиброзному кольцу. Важно при этом, чтобы сохранялась подвижность и парусность створок, а папилярные мышцы хордального аппарата были максимально сближены между собой. У 7 пациентов отсутствовали краевые хорды задней и септальной створок, а у двух и передних створок трикуспидального клапана. Хорды были созданы, после отсепаровывания створок путем разрезов на 1/4 длины створок, от края их прикрепления к миокарду. Существенным моментом данной операции явилось перемещение задней створки на 180 градусов по часовой стрелке к септальной створке. Ее подвижность при этом обеспечивалась отсечением апикального края створки от миокарда и повторной фиксацией его к участкам септальной створки, смещенным к верхушке сердца или непосредственно к эндокарду правого желудочка. Дискутабельным вопросом остается необходимость иссечения атриализированной части правого желудочка или его пликация. В данном исследовании у 7 пациентов из 19, включая новорожденного ребенка, атриализированная часть миокарда в межсосудистой зоне иссекалась. Именно у этих пациентов удалось достичь наилучшего восстановления формы приточной части правого желудочка. Следует отметить, что у 8 пациентов это было сделать невозможно из-за рассыпного типа коронарных артерий. Пликация атриализированной части правого желудочка обеспечивалась П-образными швами с большими велюровыми прокладками для предупреждения прорезования швов. Этот риск обусловлен истончением и нарушением прочности миокарда в атриализированной части правого желудочка. У всех пациентов выполнялось сужение фиброзного кольца. У двух пациентов сужение фиброзного кольца выполнялось на уровне «3» и «10» часов. У всех пациентов потребовалось ушивание отверстий в створках клапанов для создания конуса. Большое значение имеет создание опоры для задней створки благодаря дополнительным фиксирующим швам между задней и септальной створками, обеспечивающим роль раскрытия «паруса».
У 16 пациентов трикуспидальный клапан был реимплантирован в фиброзное кольцо непрерывным обвивным швом. По данным приведенного материала, непрерывный шов в зоне атриовентрикулярного узла проводился с «выходом» на правое предсердие. У одного пациента в конце был сразу имплантирован двухкамерный электрокардиостимулятор с двумя эпикардиальными электродами, так как он оперировался по срочным показаниям в связи с развившейся полной атриовентрикулярной блокадой через два месяца после выполнения повторной радиочастотной абляции. У этого пациента в течение 4 лет постоянно рецидивировала атриовентрикулярная реципрокная тахикардия.
В раннем послеоперационном периоде 16 пациентов потребовали назначение допамина и 4 пациентов кратковременный курс в течение 1-5 дней назначения адреналина.
У одного пациента потребовалось выполнить на четвертые сутки операцию по созданию двунаправленного кавопульмонального анастомоза.
Время наблюдения пациентов после операции составило от 2 месяцев до 3,5 лет. В среднем 1,8 ± 0,74 года. Всем пациентам выполнялось ультразвуковое исследование каждые 3-6 месяцев. Важным прогностическим признаком является эффективная реконструкция приточного отдела правого желудочка: ушивание или резекция атриализированной части правого желудочка. Сближение папилярных мышц или участков прикрепления хорд между собой.
Через 3 месяца после выписки только 6 пациентов получали ингибиторы ангиотензинпревращающего фермента. У всех пациентов сохранялась высокая толерантность к физической нагрузке. По данным динамического наблюдения за электрокардиограммой в группе оперированных пациентов рецидивов пароксизмальных изменений выявлено не было.
Следует отметить, что анатомия аномалии Эбштейна всегда носит индивидуальный характер. В связи с эти решение о характере лечения принимается всегда индивидуально. Операция конусной реконструкции успешно корригирует анатомические нарушения и тоже всегда носит строго индивидуальный характер. По мере накопления опыта и клинического материала данная операция должна войти в основной арсенал отделений детской и взрослой кардиохирургии.
Выводы
- Конусная реконструкция — операция, позволяющая выполнить анатомическую коррекцию врожденного порока сердца — аномалии Эбштейна в любом возрасте.
- При возникновении жизнеугрожающих осложнений данная операция может быть выполнена в раннем возрасте, включая новорожденных детей.
- По полученным результатам данная операция может быть выполнена и у людей старшего возраста с обязательным учетом сократительной функции правого и левого желудочков.
Литература
- Зубарев Р. П. Аномалия Эбштейна. М.: Медицина, 1975. 112 с.
- Park J. M. Ebsten’s anomaly of the tricuspid valve associated with prenatal exsposure to lihium carbonate // Amer. J. Dis. Child. 1980. Vol. 134. № 7. P. 703-704.
- Attenhofer Jost C. H., Connolly H. M., Dearani J. A., Edwards W. D., Danielson G. K. Ebstein’s anomaly. Circulation. 2007. 115 (2): 277-285. doi:10.1161/ CIRCULATIONAHA.106.619338. PMID 17228014.
- Белоконь Н. А., Подзолков В. П. Врожденные пороки сердца. М.: Медицина, 1990. 352 с.
- Dearani J. A., Bacha E., da Silva J. P. Cone Reconstruction of the Tricuspid Valve for Ebstein’s Anomaly: Anatomic Repair.
- Reddin G., Poterucha J. T., Dearani J. A., Warnes C. A. et al. Cone Reconstruction of Atypical Ebstein Anomaly Assosiated with Right Ventricular Apical Hypoplasia // Tex Heart Inst J. 2016 Feb; 43 (1): 78-80. DOI: 10.14503/THIJ-15-5011.
В. А. Болсуновский* , 1 , кандидат медицинских наук
Г. Г. Хубулава**, доктор медицинских наук, профессор, академик РАН
Г. А. Новик*, доктор медицинских наук, профессор
М. В. Жданова*, кандидат медицинских наук
Р. Р. Мовсесян***, доктор медицинских наук, профессор, член-корреспондент РАН
С. Е. Шорохов****, доктор медицинских наук
М. С. Хохлунов****
А. В. Болсуновский*
* ФГБОУ ВО СПбГПМУ МЗ РФ, Санкт-Петербург
** ФГБВОУ ВО ВМА им. С. М. Кирова Минобороны РФ, Санкт-Петербург
*** СПб ГБУЗ ДГБ № 1, Санкт-Петербург
**** ГБУЗ СОККД, Самара
Клиническое значение малых аномалий развития сердца у детей
В последние годы большое внимание уделяется дисплазии соединительной ткани (ДСТ) у детей. Под ДСТ понимают врожденную аномалию соединительно-тканной структуры различных органов и систем, в основе которой лежит снижение содержания отдельных
В последние годы большое внимание уделяется дисплазии соединительной ткани (ДСТ) у детей. Под ДСТ понимают врожденную аномалию соединительно-тканной структуры различных органов и систем, в основе которой лежит снижение содержания отдельных видов коллагена и/или нарушение их соотношения, приводящее к снижению прочности соединительной ткани [12, 13, 24, 26].
В развитии ДСТ принимают участие эндогенные (хромосомные и генетические дефекты) и экзогенные (неблагоприятная экологическая обстановка, неадекватное питание, стрессы) факторы [12, 30, 43]. Особенность морфогенеза соединительной ткани заключается в том, что она участвует в формировании каркаса сердца практически на всех этапах онтогенеза, следовательно, влияние любого повреждающего фактора может привести к развитию ДСТ сердца [15].
В 1990 г. в классификации заболеваний сердечно-сосудистой системы Нью-Йоркской ассоциации кардиологов, а также в Омске, на симпозиуме, посвященном проблеме дисплазии соединительной ткани, был впервые выделен синдром ДСТ сердца, сопровождающий как дифференцированные, так и недифференцированные ДСТ. При синдроме ДСТ сердца в патологический процесс вовлекается его соединительно-тканный каркас — сердечные клапаны (атриовентрикулярные, полулунные, евстахиев клапан), подклапанный аппарат, перегородки сердца и магистральные сосуды.
В клинической практике, когда речь идет о морфологической основе изменений сердечно-сосудистой системы без гемодинамических нарушений, Ю. М. Белозеровым (1993) и С. Ф. Гнусаевым (1995) вместо термина «ДСТ сердца» был предложен другой — «малые аномалии развития сердца» (МАРС) [3, 8]. Согласно определению этих авторов, МАРС считаются анатомические изменения архитектоники сердца и магистральных сосудов, не приводящие к грубым нарушениям функций сердечно-сосудистой системы [9].
Классификация МАРС по С. Ф. Гнусаеву, 2001 (с изменениями)
предсердия и межпредсердная перегородка: пролабирующий клапан нижней полой вены, увеличенный евстахиев клапан более 1 см, открытое овальное окно, небольшая аневризма межпредсердной перегородки, пролабирующие гребенчатые мышцы в правом предсердии;
трикуспидальный клапан: смещение септальной створки в полость правого желудочка в пределах 10 мм, дилатация правого атриовентрикулярного отверстия, пролапс трикуспидального клапана;
легочная артерия: дилатация ствола легочной артерии, пролапс створок;
аорта: погранично узкий и широкий корень аорты, дилатация синуса Вальсальвы, двустворчатый клапан аорты, асимметрия и пролапс створок клапана аорты;
левый желудочек: трабекулы (поперечная, продольная, диагональная), небольшая аневризма межжелудочковой перегородки;
митральный клапан: пролапс митрального клапана, эктопическое крепление хорд, нарушенное распределение хорд передней и (или) задней створки, «порхающие» хорды, дополнительные и аномально расположенные папиллярные мышцы.
До сих пор нет единого мнения о клиническом значении МАРС, многие из которых имеют нестабильный характер, связанный с ростом ребенка. Так, возможно обратное развитие увеличенного евстахиева клапана, пролабирующих гребенчатых мышц в правом предсердии, пролапса митрального клапана (ПМК), закрытие открытого овального окна, нормализация длины хорд митрального клапана и диаметра магистральных сосудов. В ряде случаев МАРС изменяются не только в качественном, но и в количественном отношении [3]. Превышение установленного порогового уровня сердечной стигматизации у здоровых детей (более 3 МАРС), по мнению С. Ф. Гнусаева (1995), свидетельствует о возможном неблагополучии как в отношении факторов, влияющих на формирование здоровья, так и показателей, характеризующих его [8].
Учитывая, что МАРС являются вариантом висцеральных ДСТ, дети, как правило, имеют выраженный полиморфизм клинико-морфологических нарушений, зависящий от степени ДСТ и вовлечения в патологический процесс других органов и систем. Выявлена ассоциативная связь между числом внешних фенотипических маркеров ДСТ и МАРС [12, 16, 21, 22]. При этом имеют значение не только число внешних фенотипических маркеров, но и «диагностический вес» каждого из них. Отмечено, что дисплазии кожи и скелета наиболее часто сочетаются с МАРС [12].
Клиническая значимость патологии соединительной ткани у лиц с ДСТ подтверждается данными о высокой частоте нейровегетативных расстройств, изменений центральной нервной системы (энурез, дефекты речи, вегетососудистая дистония (ВСД)), нарушений психики [5, 12, 24]. Как правило, у таких пациентов всегда выявляется ВСД, что, вероятно, обусловлено наследуемыми (наследственными) особенностями структуры и функции лимбико-ретикулярного комплекса, определяющими аномальный характер нейровегетативных реакций [12]. Е. В. Буланкиной (2002) установлена отчетливая взаимосвязь между вегетативной дисфункцией и ДСТ [4]. При этом выраженность диспластических изменений сочеталась с тяжестью процессов дезадаптации регуляторных механизмов и снижением стрессовой устойчивости организма. Наиболее распространенными проявлениями вегетативной дисфункции являются цефалгии, вегетативные кризы, вегетовисцеральные пароксизмы, пре- и синкопальные состояния [12, 16]. Согласно данным С. Ф. Гнусаева (1995), у лиц с ПМК выявлена недостаточность сегментарных вегетативных структур [8]. Исследования Т. М. Домницкой (2000) позволили установить прямую зависимость между ПМК, аномально расположенными трабекулами (АРТ) и распространенностью невротических (невротические реакции, невроз навязчивых состояний, панические расстройства) и энцефалопатических (церебрастенический синдром, заикание, тики, нарушения сна, энурез, гипердинамический синдром, страхи) расстройств [10].
Нередко МАРС сопровождают такие патологические состояния, как нарушения сердечного ритма и проводимости, в том числе синдром ранней реполяризации, синдром слабости синусового узла, синдром Вольф-Паркинсон-Уайта, повышение электрической активности левого желудочка, блокада правой ножки пучка Гиса, экстрасистолия и пароксизмальная тахикардия [4, 6, 8, 34]. По данным Л. А. Балыковой и соавт. (2002), у 90% больных с нарушениями сердечного ритма с помощью эхографии были выявлены МАРС (преимущественно ПМК) [2]. Однако не все МАРС сопровождаются нарушениями сердечного ритма и (или) могут являться их причиной. К аритмогенным МАРС относятся фиброзно-мышечные аномально расположенные хорды (АРХ) и АРТ, ПМК и пролапс трикуспидального клапана (ПТК), аневризма межпредсердной перегородки, увеличенный и/или пролабирующий евстахиев клапан.
Наличие проводящих кардиомиоцитов в фиброзно-мышечных АРХ и АРТ формирует дополнительные проводящие пути, чем объясняется происхождение импульса, опережающего внутрижелудочковое проведение и вызывающего раннее возбуждение прилежащих к нему сегментов с последующей их более ранней реполяризацией [12, 15, 19, 20, 28]. Имеется гистологическое подтверждение наличия проводящих клеток в АРТ с диагонально-базальной, срединно-поперечной и продольной локализацией и в АРХ, соединяющих базальные септальные отделы и боковую стенку левого желудочка [3, 10, 33]. M. Suwa и соавт. (1986) отметили возрастание частоты желудочковых экстрасистол с увеличением толщины хорды. По мнению E. Chesler и соавт. (1983), появление желудочковых экстрасистол связано с миксоматозно измененными хордами, вызывающими механическое раздражение стенки левого желудочка [27]. Факт аритмогенности АРХ и АРТ также подтверждается исчезновением у пациентов экстрасистолии в случае их самостоятельного разрыва или оперативного рассечения либо при физической нагрузке, когда уменьшается степень их натяжения [8, 10, 12]. Довольно распространенным нарушением сердечного ритма при АРХ и АРТ является и синдром раннего возбуждения желудочков [6, 12].
Аритмии при ПМК и ПТК, по данным разных авторов, встречаются от 15 до 90% случаев [11]. Среди причин аритмий рассматриваются вегетативные дисфункции, механическая стимуляция эндокарда, дефицит внутритканевого магния, психологический стресс и миксоматозная дегенерация створок клапанов [3, 10-12, 18, 27, 29, 37, 39]. Установлена прямая корреляционная зависимость между частотой, а также степенью тяжести нарушений ритма и глубиной ПМК [1]. Ряд авторов полагают, что причиной развития аритмий при ПМК и ПТК может являться турбулентный поток, возникающий в результате регургитации через клапанное кольцо во время систолы желудочков, особенно при ПТК, когда происходит механическое раздражение зоны синусового узла [3, 8, 23]. Возможным механизмом развития желудочковых экстрасистол при ПМК большинство исследователей считают избыточное натяжение папиллярных мышц вследствие их аномальной тракции при пролабировании створок [12, 14, 25, 38].
Развитие аритмий может провоцировать пролабирующий евстахиев клапан и аневризма межпредсердной перегородки: условия для возникновения аритмий возникают в результате их холмистых движений и рефлекторного раздражения ими пейсмекерных образований в правом предсердии [42].
Согласно исследованиям О. А. Дианова (1999), нарушения сердечного ритма встречались у детей с погранично узкой аортой, у которых в 32,4% случаев регистрировалась суправентрикулярная и в 10,8% — желудочковая экстрасистолии, свидетельствующие о декомпенсации адаптации, особенно в условиях физической нагрузки [4].
По данным Ю. М. Белозерова, дети с МАРС отличаются сниженными возможностями кардиогемодинамики и демонстрируют плохую переносимость физических нагрузок [3]. По данным Н. А. Мазура, установлена связь между ПМК и синдромом внезапной смерти у взрослых. Накоплено достаточно сведений о том, что дети с МАРС относятся к группе риска по развитию инфекционного эндокардита.
Таким образом, существующие результаты исследований о том, что МАРС в ряде случаев являются основой кардиоваскулярной патологии у детей. В то же время неоправданным было бы преувеличение их роли в функциональных нарушениях сердечно-сосудистой системы. Очевидно, в каждом конкретном случае значимость структурных аномалий сердца должна рассматриваться индивидуально.
Принципы терапии детей с МАРС еще до конца не сформулированы. Однако на сегодняшний день можно предложить следующую тактику ведения детей с МАРС:
- Комплексная оценка состояния здоровья, включающая различные виды исследования детей.
- Выбор терапии в зависимости от клинико-электрофизиологических и эхокардиографических изменений.
- Применение препаратов, направленных на нормализацию метаболизма соединительной ткани.
- Определение адекватной физической активности в зависимости от функционального состояния миокарда.
Общепризнанным является применение немедикаментозных методов лечения, включающих:
Вопрос о допуске к занятиям спортом решается индивидуально. При наличии ПМК необходимо учитывать семейный анамнез (случаи внезапной смерти у родственников), наличие жалоб на сердцебиения, кардиалгии; синкопальные состояния; изменения на ЭКГ (нарушения сердечного ритма, синдром укороченного и удлиненного QT) являются основанием для принятия решения о противопоказании спортивных тренировок. Это касается и наличия АРХ, АРТ с синдромом раннего возбуждения желудочков, которые, являясь аритмогенными МАРС, могут спровоцировать нарушения сердечного ритма у спортсменов в условиях физического и психоэмоционального напряжения.
Медикаментозное лечение включает применение:
- препаратов магния;
- кардиотрофической терапии (при нарушении процессов реполяризации в миокарде);
- антибактериальной терапии при обострении очагов инфекции, оперативных вмешательствах (профилактика инфекционного эндокардита);
- антиаритмических препаратов (по показаниям, при чистой групповой экстрасистолии с нарушением процессов реполяризации).
В настоящее время терапия препаратами магния при МАРС приближается к патогенетической. Это обусловлено тем, что магний входит в состав основного вещества соединительной ткани и необходим для правильного формирования волокон коллагена. В условиях магниевой недостаточности нарушается способность фибробластов продуцировать коллаген [29, 31]. Кроме того, магний оказывает мембраностабилизирующее действие, удерживает калий внутри клетки, препятствует симпатикотоническим влияниям, что делает возможным его применение для лечения нарушений сердечного ритма [40, 41].
В работах О. Б. Степуры (1999), О. Д. Остроумовой и соавт. (2004) имеются сведения о достоверном уменьшении степени ПМК, симптомов ВСД, количества желудочковых экстрасистол на фоне терапии препаратами магния [17, 18].
Целесообразным может быть признано назначение следующих препаратов:
Магнерота, содержащего соль магния и оротовую кислоту. Последняя не только усиливает реабсорбцию Mg в кишечнике, но и обладает самостоятельным метаболическим действием. Детям назначают по 500 мг магнерота (32,8 мг магния 3 раза в день в течение 1 нед, затем 250 мг 3 раза в день в течение последующих 5 нед. Принимается препарат за 1 ч до еды).
Магне В6. Выпускается в таблетках (48 мг магния или в растворе для приема внутрь (100 мг магния). Детям с массой тела более 10 кг (старше 1 года) — 5-10 мг/кг/сутки в 2-3 приема. Детям старше 12 лет — 3-4 табл. в сут, в 2-3 приема. Продолжительность курса 6-8 нед.
Калия оротата. Детям препарат назначают из расчета 10-20 мг/кг/сут в 2-3 приема за 1 ч до еды или через 4 ч после еды. Продолжительность курса — 1 мес.
Следует проводить повторные курсы терапии этими препаратами (3-4 раза в год).
Для улучшения клеточной энергетикии миокарда применяют препараты, обладающие комплексным влиянием на метаболические процессы в организме, а также являющиеся активными антиоксидантами и мембраностабилизаторами:
- L-карнитин (элькар — 20% раствор карнитина гидрохлорида). Дозы: 1-6 лет по 0,1 г/сут (14 капель) 3 раза в день; 6-12 лет — 0,2-0,3 г/сут (1/4 ч. л.) 3 раза в день. Курс — 1-1,5 мес.
- Коэнзим Q10 (убихинон) назначается детям старше 12 лет по 1 капсуле (500 мг) 1-2 раза в сут. К препаратам, содержащим убихинон, относится кудесан: по 1 капле на год жизни (до 12 лет), далее по 12 капель 1 раз в день. Продолжительность курса должна составлять не менее 1 мес.
- Цитохром С (цито-мак). Выпускается в ампулах (по 4 мл = 15 мг). Назначают внутримышечно по 4 мл, № 10. Проводится 2-4 курса в год.
Кроме указанных препаратов для улучшения метаболических процессов в соединительной ткани, миокарде и в организме в целом показано применение:
- никотинамида (витамин PP) — 20 мг/сут 1,5-2 мес;
- рибофлавина (витамин В2) — 10- 15 мг/сут 1,5-2 мес;
- тиамина (витамин В1) — 10 мг/сут и липоевой кислотой 100-500 мг/сут 1,5 мес;
- лимонтара (комплекс лимонной и янтарной кислоты) 5 мг/кг/сут 3-4 дня еженедельно в течение 2 мес;
- биотина — 2-5 мг/сутки — 1,5-2 мес.
Показаны повторные курсы лечения (до 3 раз в год).
При наличии ВСД проводится комплексная длительная терапия по восстановлению баланса между симпатическим и парасимпатическим отделами вегетативной нервной системы (дифференцированная фитотерапия, вегетотропные препараты, ноотропы, вазоактивные препараты — кавинтон, вазобрал, инстенон, циннаризин и др.).
Таким образом, все вышесказанное позволяет сделать вывод, что МАРС, являясь висцеральным проявлением дисплазии соединительной ткани, составляют морфологическую основу функциональных изменений сердечной деятельности и нейровегетативных расстройств. Выбор индивидуальной программы курсового лечения способствует улучшению обменных процессов в соединительной ткани и профилактирует возможные осложнения ДСТ у детей и подростков.
По вопросам литературы обращайтесь в редакцию.
Н. А. Коровина, доктор медицинских наук, профессор
А. А. Тарасова, кандидат медицинских наук, доцент
Т. М. Творогова, кандидат медицинских наук, доцент
Л. П. Гаврюшова, кандидат медицинских наук, доцент
М. С. Дзис
РМАПО, Москва
Соединительнотканная дисплазия
Соединительнотканная дисплазия - группа полиморфных в клиническом отношении патологических состояний, обусловленных наследственными или врожденными дефектами синтеза коллагена и сопровождающихся нарушением функционирования внутренних органов и опорно-двигательного аппарата. Наиболее часто соединительнотканная дисплазия проявляется изменением пропорций тела, костными деформациями, гипермобильностью суставов, привычными вывихами, гиперэластичной кожей, клапанными пороками сердца, хрупкостью сосудов, мышечной слабостью. Диагностика основана на фенотипических признаках, биохимических показателях, данных биопсии. Лечение соединительнотканной дисплазии включает ЛФК, массаж, диету, медикаментозную терапию.
Общие сведения
Соединительнотканная дисплазия - понятие, объединяющее различные заболевания, обусловленные наследственной генерализованной коллагенопатией и проявляющиеся снижением прочности соединительной ткани всех систем организма. Популяционная частота соединительнотканной дисплазии составляет 7-8%, однако предполагается, что отдельные ее признаки и малые недифференцированные формы могут встречаться у 60-70% населения. Соединительнотканная дисплазия попадает в поле зрения клиницистов, работающих в разных медицинских областях - педиатрии, травматологии и ортопедии, ревматологии, кардиологии, офтальмологии, гастроэнтерологии, иммунологии, пульмонологии, урологии и др.
Причины
В основе развития соединительнотканной дисплазии лежит дефект синтеза или структуры коллагена, белково-углеводных комплексов, структурных белков, а также необходимых ферментов и кофакторов. Непосредственной причиной рассматриваемой патологии соединительной ткани выступают различного рода воздействия на плод, приводящие к генетически детерминированному изменению фибриллогенеза внеклеточного матрикса. К таким мутагенным факторам относятся:
- неблагоприятная экологическая обстановка,
- неполноценное питание и вредные привычки матери,
- стрессы,
- отягощенное течение беременности и пр.
Некоторые исследователи указывают на патогенетическую роль гипомагниемии в развитии соединительнотканной дисплазии, основываясь на выявлении дефицита магния при спектральном исследовании волос, крови, ротовой жидкости. Синтез коллагена в организме кодируется более 40 генами, в отношении которых описано свыше 1300 видов мутаций. Это обусловливает разнообразие клинических проявлений соединительнотканных дисплазий и усложняет их диагностику.
Классификация
Соединительнотканная дисплазия подразделяются на дифференцированные и недифференцированные. К числу дифференцированных дисплазий относятся заболевания с определенным, установленным типом наследования, четкой клинической картиной, известными генными дефектами и биохимическими нарушениями. Наиболее типичными представителями данной группы наследственных заболеваний соединительной ткани служат синдром Элерса-Данлоса, синдром Марфана, несовершенный остеогенез, мукополисахаридозы, системный эластоз, диспластический сколиоз, синдром Билса (врожденная контрактурная арахнодактилия) и др. Группу недифференцированных соединительнотканных дисплазий составляют различные патологии, чьи фенотипические признаки не соответствуют ни одному из дифференцированных заболеваний.
По степени выраженности выделяют следующие виды соединительнотканных дисплазий: малые (при наличии 3-х и более фенотипических признаков), изолированные (с локализацией в одном органе) и собственно наследственные заболевания соединительной ткани. В зависимости от преобладающих диспластических стигм различают 10 фенотипических вариантов соединительнотканной дисплазии:
- Марфаноподо6ная внешность (включает 4 и более фенотипических признака скелетной дисплазии).
- Марфаноподо6ный фенотип (неполный набор признаков синдрома Марфана).
- МАSS-фенотип (включает поражение аорты, митрального клапана, скелета и кожи).
- Первичный пролапс митрального клапана (характеризуется ЭхоКГ-признаками митрального пролапса, изменениями со стороны кожи, скелета, суставов).
- Классический элерсоподобный фенотип (неполный набор признаков синдрома Элерса-Данлоса).
- Гипермобильный элерсоподобный фенотип (характеризуется гипермобильностью суставов и сопутствующими осложнениями - подвывихами, вывихами, растяжениями, плоскостопием; артралгиями, вовлечением костей и скелета).
- Гипермобильность суставов доброкачественная (включает повышенный объем движений в суставах без заинтересованности костно-скелетной системы и артралгий).
- Недифференцированная соединительнотканная дисплазия (включает 6 и более диспластических стигм, которых, однако, недостаточно для диагностики дифференцированных синдромов).
- Повышенная диспластическая стигматизация с преимущественными костно-суставными и скелетными признаками.
- Повышенная диспластическая стигматизация с преимущественными висцеральными признаками (малыми аномалиями сердца или других внутренних органов).
Поскольку описание дифференцированных форм соединительнотканной дисплазии подробно дано в соответствующих самостоятельных обзорах, в дальнейшем речь пойдет о ее недифференцированных вариантах. В том случае, когда локализация соединительнотканной дисплазии ограничена одним органом или системой, она является изолированной. Если дисплазия соединительной ткани проявляется фенотипически и захватывает, как минимум, один из внутренних органов, данное состояние рассматривается как синдром соединительнотканной дисплазии.
Симптомы соединительнотканной дисплазии
Фенотипические признаки
Внешние признаки соединительнотканной дисплазии представлены конституциональными особенностями, аномалиями развития костей скелета, кожи и др. Пациенты с дисплазией соединительной ткани имеют астеническую конституцию: высокий рост, узкие плечи, дефицит массы тела. Нарушения развития осевого скелета могут быть представлены сколиозом, кифозом, воронкообразной или килевидной деформациями грудной клетки, ювенильным остеохондрозом.
Краниоцефальные стигмы соединительнотканной дисплазии нередко включают долихоцефалию, нарушения прикуса, аномалии зубов, готическое небо, несращение верхней губы и нёба. Патология костно-суставной системы характеризуется О-образной или Х-образной деформацией конечностей, синдактилией, арахнодактилией, гипермобильностью суставов, плоскостопием, склонностью к привычным вывихам и подвывихам, переломам костей.
Со стороны кожных покровов отмечается повышенная растяжимость (гиперэластичность) или, напротив, хрупкость и сухость кожи. Нередко на ней без видимых причин возникают стрии, пигментные пятна либо очаги депигментации, сосудистые дефекты (телеангиэктазии, гемангиомы). Слабость мышечной системы при соединительнотканной дисплазии обусловливает склонность к опущению и выпадению внутренних органов, грыжам, мышечной кривошее. Из других внешних признаков соединительнотканной дисплазии могут встречаться такие микроаномалии, как гипо- или гипертелоризм, лопоухость, асимметрия ушей, низкая линия роста волос на лбу и шее и др.
Изменения со стороны внутренних органов
Висцеральные поражения протекают с заинтересованностью ЦНС и вегетативной нервной системы, различных внутренних органов. Неврологические нарушения, сопутствующие соединительнотканной дисплазии, характеризуются вегето-сосудистой дистонией, астенией, энурезом, хронической мигренью, нарушением речи, высокой тревожностью и эмоциональной неустойчивостью. Синдром соединительнотканной дисплазии сердца может включать в себя пролапс митрального клапана, открытое овальное окно, гипоплазию аорты и легочного ствола, удлинение и избыточную подвижность хорд, аневризмы коронарных артерий или межпредсердной перегородки.
Следствием слабости стенок венозных сосудов служит развитие варикозного расширения вен нижних конечностей и малого таза, геморрой, варикоцеле. Пациенты с соединительнотканной дисплазией имеют склонность к возникновению артериальной гипотензии, аритмий, атриовентрикулярных и внутрижелудочковых блокад, кардиалгий, внезапной смерти.
Кардиальным проявлениям нередко сопутствует бронхолегочный синдром, характеризующийся наличием кистозной гипоплазии легких, бронхоэктазов, буллезной эмфиземы, повторных спонтанных пневмотораксов. Характерно поражение ЖКТ в виде опущения внутренних органов, дивертикулов пищевода, гастроэзофагеального рефлюкса, грыжи пищеводного отверстия диафрагмы. Типичными проявлениями патологии органа зрения при соединительнотканной дисплазии служат близорукость, астигматизм, дальнозоркость, нистагм, косоглазие, подвывих и вывих хрусталика.
Со стороны мочевыделительной системы может отмечаться нефроптоз, недержание мочи, почечные аномалии (гипоплазия, удвоение, подковообразная почка) и пр. Репродуктивные нарушения, ассоциированные с соединительнотканной дисплазией, у женщин могут быть представлены опущением матки и влагалища, метро- и меноррагией, самопроизвольными абортами, послеродовыми кровотечениями; у мужчин возможен крипторхизм. Лица, имеющие признаки соединительнотканной дисплазии, склонны к частым ОРВИ, аллергическим реакциям, геморрагическому синдрому.
Диагностика
Заболевания из группы соединительнотканных дисплазий не всегда диагностируются правильно и своевременно. Часто больные с теми или иными признаками дисплазии наблюдаются у врачей разных специальностей: травматологов, неврологов, кардиологов, пульмонологов, нефрологов, гастроэнтерологов, офтальмологов и др. Распознавание недифференцированных форм соединительнотканной дисплазии усложняется отсутствием единых алгоритмов диагностики.
Наибольшей диагностической значимостью обладает выявление совокупности фенотипических и висцеральных признаков. С целью обнаружения последних широко применяются ультразвуковые (ЭхоКГ, УЗИ почек, УЗИ органов брюшной полости), эндоскопические (ФГДС), электрофизиологические (ЭКГ, ЭЭГ), рентгенологические (рентгенография легких, суставов, позвоночника и др.) методы. Выявление характерных полиорганных нарушений, главным образом, со стороны опорно-двигательной, нервной и сердечно-сосудистой систем с высокой степенью вероятности свидетельствует о наличии соединительнотканной дисплазии.
Дополнительно исследуются биохимические показатели крови, система гемостаза, иммунный статус, проводится биопсия кожи. В качестве метода скрининг-диагностики соединительнотканной дисплазии предложено проводить исследование папиллярного рисунка кожи передней брюшной стенки: выявление неоформленного типа папиллярного рисунка служит маркером диспластических нарушений. Семьям, где имеются случаи соединительнотканной дисплазии, рекомендуется пройти медико-генетическое консультирование.
Лечение соединительнотканной дисплазии
Специфического лечения соединительнотканной дисплазии не существует. Пациентам рекомендуется придерживаться рационального режима дня и питания, оздоровительных физических нагрузок. С целью активизации компенсаторно-приспособительных возможностей назначаются курсы ЛФК, массажа, бальнеотерапии, физиотерапии, иглорефлексотерапии, остеопатии.
В комплексе лечебных мероприятий, наряду с синдромальной медикаментозной терапией, используются метаболические препараты (L-карнитин, коэнзим Q10), препараты кальция и магния, хондропротекторы, витаминно-минеральные комплексы, антиоксидантные и иммуномодулирующие средства, фитотерапия, психотерапия.
Прогноз
Прогноз соединительнотканной дисплазии во многом зависит от степени выраженности диспластических нарушений. У пациентов с изолированными формами качество жизни может не нарушаться. У больных с полисистемным поражением повышен риск ранней и тяжелой инвалидизации, преждевременной смерти, причинами которой могут выступать фибрилляция желудочков, ТЭЛА, разрыв аневризмы аорты, геморрагический инсульт, тяжелые внутренние кровотечения и др.
Трикуспидальная недостаточность
Трикуспидальная недостаточность - неплотное смыкание створок трехстворчатого клапана во время систолы, что приводит к обратному току крови из желудочка в предсердие. При трикуспидальной недостаточности ощущается слабость, умеренная одышка, сердцебиение, боли в области сердца; развивается цианоз и сердечная недостаточность. Трикуспидальная недостаточность диагностируется по данным ЭКГ, рентгенографии, ЭхоКГ, катетеризации сердца, яремной флебографии, вентрикулографии. Симптоматическое лечение трикуспидальной недостаточности направлено на уменьшение сердечной недостаточности, легочной гипертензии, профилактику бактериального эндокардита; радикальная хирургическая коррекция включает проведение пластики или протезирования трехстворчатого клапана.
МКБ-10
Трикуспидальная недостаточность - порок правых отделов сердца, характеризующийся неполным закрытием атриовентрикулярного отверстия трехстворчатым клапаном, что сопровождается патологической систолической регургитацией крови из правого желудочка в правое предсердие. Среди приобретенных пороков сердца ревматической этиологии трикуспидальная недостаточность встречается в 15-30% случаев. В кардиологии по данным ЭхоКГ трикуспидальная недостаточность I степени выявляется даже у практически здоровых людей.
Трикуспидальной недостаточности могут сопутствовать другие врожденные пороки сердца: дефект межпредсердной перегородки, открытое овальное окно, корригированная транспозиция магистральных сосудов. Трикуспидальный стеноз или недостаточность могут входить в структуру сочетанного митрально-аортально-трикуспидального порока.
Причины трикуспидальной недостаточности
Врожденная трикуспидальная недостаточность может быть обусловлена аномалией Эбштейна, недоразвитием или аномалией количества створок клапана, дисплазией соединительной ткани при синдромах Марфана и Элерса-Данлоса. Приобретенная первичная недостаточность трехстворчатого клапана встречается чаще и может вызываться различными причинами.
Самая распространенной причиной развития трикуспидальной недостаточности служит ревматизм. Рецидивирующий ревматический эндокардит приводит к утолщению и сморщиванию створок, укорочению и утолщению сухожильных нитей. Формирующаяся трикуспидальная недостаточность в большинстве случаев сочетается со стенозом правого предсердно-желудочкового отверстия (комбинированный трикуспидальный порок). Изолированная трикуспидальная недостаточность ревматической этиологии встречается крайне редко. Другими относительно нечастыми причинами развития трикуспидальной недостаточности могут выступать травматические разрывы папиллярных мышц, карциноидный синдром (при раке яичников, раке тонкой кишки, бронхогенном раке легких), инфекционный эндокардит наркоманов.
Случаи вторичной трикуспидальной недостаточности могут быть связаны с дилатацией фиброзного кольца при дилатационной кардиомиопатии, легочной гипертензией высокой степени; ослаблением миокарда правого желудочка при легочном сердце, хронической сердечной недостаточности, миокардитах, миокардиодистрофии. Трикуспидальной недостаточностью осложняется течение 90% митральных пороков (чаще митрального стеноза). Развитию вторичной трикуспидальной недостаточности может способствовать разрыв папиллярных мышц при инфаркте миокарда правого желудочка. Преходящая недостаточность трикуспидального клапана у новорожденных встречается при ишемической дисфункции правого желудочка, обусловленной гипоксией плода, ацидозом и гипогликемией. Недостаточность трехстворчатого клапана может развиваться или прогрессировать после выполнения митральной комиссуротомии.
Классификация трикуспидальной недостаточности
Таким образом, по этиологическому принципу различают врожденную и приобретенную, первичную (органическую) и вторичную (функциональную) трикуспидальную недостаточность. Органическая недостаточность может быть обусловлена деформацией, сморщиванием, обызвествлением створок; функциональная трикуспидальная недостаточность - дисфункцией клапанного аппарата (папиллярных мышц, сухожильных хорд, фиброзного кольца).
С учетом выраженности регургитации, определяемой при ЭхоКГ, принято различать 4 степени трикуспидальной недостаточности:
- I - минимальный обратный ток крови, не вызывающий нарушения гемодинамики;
- II - обратная струя крови на расстоянии 2 см от трехстворчатого клапана;
- III - поток регургитации на расстоянии более 2 см от трехстворчатого клапана;
- IV - выраженная регургитация на значительном протяжении полости правого предсердия.
Особенности гемодинамики при трикуспидальной недостаточности
Трикуспидальная недостаточность сопровождается возвращением части крови во время систолы правого желудочка в правое предсердие, в которое одновременно поступает кровь из полых вен. Незначительная трикуспидальная недостаточность компенсируется усиленной работой правых отделов сердца, приводя к их расширению и гипертрофии. Однако ввиду ограниченности компенсаторных возможностей правого предсердия, при трикуспидальной недостаточности рано развивается венозный застой в большом круге кровообращения.
В случае выраженной трикуспидальной недостаточности и большого объема регургитации происходит переполнение не только правого предсердия, но и системных вен, прежде всего - печеночных и яремных. Повышенное венозное давление обусловливает систолическую пульсацию крупных вен. Систолическое давление в правом предсердии значительно повышается и составляет 10—25 мм рт. ст. (при норме около 3 мм рт. ст.); диастолическое давление в правом желудочке также увеличено. Выраженная дилатация правого предсердия может сопровождаться его тромбозами, ТЭЛА и фибрилляцией предсердий, вызывая декомпенсацию кровообращения и смерть.
Симптомы трикуспидальной недостаточности
У грудных детей с врожденной трикуспидальной недостаточностью обнаруживается тяжелая сердечная недостаточность и цианоз. В 25% случаев начальным проявлением трикуспидальной недостаточности служит развитие наджелудочковой тахикардии (при сочетании аномалии Эбштейна с синдромом WPW) или фибрилляции предсердий.
В более старшем возрасте предъявляются жалобы на слабость, быструю утомляемость при минимальной нагрузке, одышку, сердцебиение, боли в области сердца, кровохарканье, тяжесть в правом подреберье, диспепсические нарушения (тошноту, рвоту, метеоризм). При застое в большом круге кровообращения присоединяются периферические отеки, гидроторакс, асцит, гепатомегалия.
Осмотр больного с трикуспидальной недостаточностью выявляет одутловатость лица, синюшно-желтушную окраску кожи лица и дистальных частей тела, пульсацию вен шеи, передней части грудной клетки и увеличенной печени. Вследствие портальной гипертензии могут возникать желудочно-кишечные кровотечения. У беременных с трикуспидальной недостаточностью беременность может осложниться гестозом, фетоплацентарной недостаточностью, преждевременными родами.
Диагностика трикуспидальной недостаточности
При аускультативном обследовании выявляется систолический шум в области мечевидного отростка и на уровне V-VII межреберий по левому краю грудины, усиливающийся при глубоком вдохе, а также другие акустические феномены, обусловленные сопутствующими пороками. При пролапсе трикуспидального клапана выслушиваются звуки «хлопающего паруса». Перкуторно определяется смещение границ относительной сердечной тупости вправо.
Инструментальная диагностика при трикуспидальной недостаточности включает полипозиционную рентгенографию грудной клетки, рентгенографию сердца с контрастированием пищевода, фонокардиографию, ЭКГ, ЭхоКГ с допплеровским исследованием, зондирование правых отделов сердца, вентрикулографию, яремную флебографию и др.
Электрокардиографические данные при трикуспидальной недостаточности свидетельствуют о гипертрофии и перегрузке правых отделов сердца, нарушениях ритма и проводимости (пароксизмальной тахикардии, мерцательной аритмии, АВ-блокаде). Фонокардиографическими признаками трикуспидальной недостаточности служат снижение амплитуды первого тона в области проекции клапана, лентовидный систолический шум. Рентгенологически определяется расширение теней правого предсердия и желудочка, полых вен при отсутствии признаков застоя в малом круге кровообращения.
При проведении УЗИ сердца обнаруживается гипертрофия стенок и дилатация полостей правых отделов сердца, деформация трехстворчатого клапана (при ревматизме), расширение фиброзного кольца (при вторичной трикуспидальной недостаточности), наличие вегетаций на створках (при бактериальном эндокардите), смещение створок клапана (при аномалии Эбштейна), сопутствующие ВПС и т. д. По отношению площади струи к правому предсердию определяется тяжесть регургитации.
Яремная флебограмма характеризуется выраженными V-волнами, высота которых зависит от степени трикуспидальной регургитации. Во время выполнения правой вентрикулографии осуществляется регистрация потока регургитации и исключение дополнительных аномалий. Зондирование правых отделов сердца позволяет определить давление в правом предсердии, желудочке, легочной артерии, оценить обратимость артериальной гипертензии и спланировать хирургическое лечение трикуспидальной недостаточности.
Лечение трикуспидальной недостаточности
Консервативная тактика при трикуспидальной недостаточности носит, главным образом, паллиативный характер и направлена на борьбу с сердечной недостаточностью и легочной гипертензией. Больным назначаются диуретики, венозные вазодилататоры, ингибиторы АПФ, b-адреноблокаторы, сердечные гликозиды, метаболические препараты, антикоагулянты. При наличии гидроторакса прибегают к проведению плевральных пункций или дренирования; в случае скопления выпота в брюшной полости - к лапароцентезу.
При трикуспидальной недостаточности I степени хирургическое лечение не показано. Основаниями для кардиохирургического вмешательства служат гемодинамически значимые нарушения при трикуспидальной недостаточности II-IV степень. Основными видами операций служат пластика трикуспидального клапана и протезирование трикуспидального клапана биологическим или искусственным протезом. Протезированию отдается предпочтение при инфекционном эндокардите, грубых структурных изменениях клапана, неэффективности аннулопластики.
Оперативное лечение трикуспидальной недостаточности сопряжено с риском развития протезного эндокардита, дегенерации биологического протеза, тромбоза или кальциноза искусственного протеза, АВ-блокады.
Прогноз и профилактика трикуспидальной недостаточности
Факторами, отягощающими естественное течение трикуспидальной недостаточности, служат органические изменения клапана, наличие других пороков сердца, тяжелая недостаточность кровообращения. Гибель больных обычно наступает от прогрессирующей сердечной недостаточности, пневмонии, легочной эмболии. Развитие вторичной трикуспидальной недостаточности также считается прогностически неблагоприятным.
5-летняя выживаемость после аннулопластики составляет 70%, после протезирования 62-66%. Больным, перенесшими замену трикуспидального клапана искусственным протезом, показан прием непрямых антикоагулянтов, профилактика инфекционного эндокардита.
Основу профилактики трикуспидальной недостаточности служит предупреждение рецидивов ревматизма, лечение основного заболевания для предупреждения развития относительной недостаточности клапана, систематическое наблюдение кардиолога и кардиохирурга.
Читайте также:
- Слабое место локтевого сустава. Связки локтевого сустава. Кровоснабжение и иннервация локтевого сустава.
- Дисметаболические полиневропатии. Боли при диабете. Лечение болей при диабете.
- Диагностика менингиомы мостомозжечкового угла и внутреннего слухового прохода по КТ, МРТ
- Оценка стабильности голеностопного сустава. Стопа
- КТ, МРТ при гиперэкстензионном повреждении грудного и поясничного отдела позвоночника
