Лучевые признаки трисомии 21 у плода
Добавил пользователь Евгений Кузнецов Обновлено: 21.01.2026
Московский областной НИИ акушерства и гинекологии
Медико-генетическое отделение Московского областного НИИ акушерства и гинекологии
- SPIN РИНЦ: 3366-5193
- Scopus AuthorID: 54886347400
- ORCID: 0000-0002-5649-0534
Курс пренатальной диагностики при кафедре медицинской генетики ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва, Россия
Пренатальные маркеры частых хромосомных синдромов. Оценка прогностической значимости
Журнал: Российский вестник акушера-гинеколога. 2016;16(6): 47‑53
Пренатальная диагностика патологических состояний является современным методом диспансеризации плода, позволяет определить медицинский и социальный прогноз для жизнеспособности и здоровья будущего ребенка. Поиск и практическое использование знаний о достоверных пренатальных признаках частых врожденных заболеваний определяют эффективность скрининговых программ. Основной целью настоящего исследования явилась оценка значимости известных и поиск новых ультразвуковых признаков, улучшающих диагностику частых хромосомных анеуплоидий для оптимизации скринингового обследования беременных в сроках беременности 11—14 нед. Материал и методы. Материалом для исследования послужили результаты ультразвукового обследования 266 779 беременных, жительниц Московской области, за период 2011—2015 гг., проведенного в рамках раннего пренатального скрининга в сроки беременности 11—14 нед (строго при показателе копчико-теменного размера плода от 45 до 84 мм). Одновременно проводились биохимический скрининг для выявления патологических пренатальных маркеров и расчет индивидуального риска выявления хромосомных анеуплоидий на основе единого программного обеспечения. Результаты. Были выявлены 433 плода с трисомией 21, 166 плодов с трисомией 18, 64 плода с трисомией 13. Впервые в российской популяции установлены медианы известных пренатальных ультразвуковых признаков трех частых хромосомных анеуплоидий (трисомии 21, 18 и 13): толщины воротникового пространства, частоты сердечных сокращений и состояния носовой кости. Изучена распространенность ряда врожденных пороков развития и особенностей фенотипа плода. Заключение. В перечень дополнительных пренатальных ультразвуковых маркеров могут входить следующие: патология лимфатической системы и дефекты межжелудочковой перегородки при трисомии 21; врожденный порок сердца, микрогнатия, расщелины лица, патологическое положение кистей плода при трисомии 18; пороки развития центральной нервной системы, врожденные пороки сердца, пороки развития и особенности строения лицевого черепа, полидактилия при трисомии 13. Авторы информируют об отсутствии конфликта интересов.
Спорадически возникающие врожденные дефекты развития у детей в настоящее время могут быть диагностированы при использовании доказательно эффективной системы ранней дородовой диагностики в рамках нового подхода при решении задач медицинского и социального прогноза в семье. Акушерская тактика при наблюдении за течением беременности должна определяться достоверным пренатальным диагнозом нарушений состояния плода, постановка которого реальна уже в сроки 11—14 нед беременности. При этом особое значение в системе пренатального скрининга имеют летальные и неизлечимые болезни, определяемые с помощью различных пренатальных методов. Поиск и изучение маркерных признаков патологических состояний плода и оценка их прогностической ценности составляют основу важнейшего направления медицины плода — пренатальной диагностики (ПД).
Цель исследования — оптимизация дородовой диагностики частых хромосомных синдромов как нового подхода к медико-социальному прогнозу исхода беременности посредством изучения прогностической значимости известных ультразвуковых маркеров и поиска новых достоверных ультразвуковых признаков хромосомных анеуплоидий (ХА) на основании их распространенности.
В задачи исследования входило изучение закономерностей изменения таких известных эхомаркеров ХА, как толщина воротникового пространства (ТВП), состояние носовой кости (НК), частота сердечных сокращений (ЧСС) при наиболее частых анеуплоидиях (трисомиях по 21, 18, 13-й хромосомам), а также поиск новых достоверно значимых ультразвуковых маркеров: врожденных пороков развития (ВПР) и особенностей фенотипа плода для диагностики наиболее частых генетических синдромов хромосомной этиологии.
Материал и методы
В рамках современного акушерского мониторинга в России проводится массовый ранний пренатальный скрининг (РПС) беременных на частые ХА, трисомии по хромосомам 21, 18, 13 и рано манифестирующие пороки развития у плода. Алгоритм РПС основан на международном стандарте, разработанном независимой врачебной организацией «Фонд медицины плода» и признанном в большинстве стран мира [1]. В сроки 11—14 нед беременности на экспертном уровне ПД одновременно проводятся ультразвуковое исследование (УЗИ) и биохимический скрининг (БХС) для выявления патологических пренатальных маркеров, а также расчет индивидуального риска выявления ХА на основе единого программного обеспечения, позволяющего вести базу данных и проводить внутренний индивидуальный аудит всех пренатальных измерений с оценкой качества РПС в регионе в целом.
Источником данных для проведения настоящего исследования явились сведения об обследованиях, проведенных в рамках РПС в Московской области за 5 лет, с 2011 по 2015 гг. Всего были обследованы 270 087 беременных, взято в анализ 266 779 случаев одноплодных беременностей в связи с имеющимся различием подходов к расчету рисков и к интерпретации результатов при многоплодных беременностях.
В программе РПС были созданы базы данных, куда вводились результаты УЗИ (в том числе наличие и описание маркеров ХА и ВПР), показатели биохимического исследования материнских сывороточных маркеров ХА (РАРР-А и свободная β-субъединица ХГч) [11], расчетные риски ХА с учетом порогового значения cut-off 1:100, результаты медико-генетического консультирования (МГК), инвазивной пренатальной диагностики (ИПД): виды манипуляций и лабораторные данные по анализу плодного материала, а также исходы беременности у женщин, прошедших РПС.
ИПД (аспирация ворсин хориона, амниоцентез) для постановки окончательного диагноза была проведена в 3053 случаях: в 61% наблюдений — аспирация ворсин хориона, в 39% — амниоцентез. По результатам лабораторного исследования плодного материала, выполненного посредством молекулярно-цитогенетических, цитогенетических исследований, было выявлено 916 различных хромосомных аномалий при общей эффективности пренатального кариотипирования 30%. Структура пренатально установленных за период исследования ХА представлена на рис. 1. Число включенных в исследование частых анеуплоидий (трисомий по хромосомам 21, 18 и 13) составило 663.
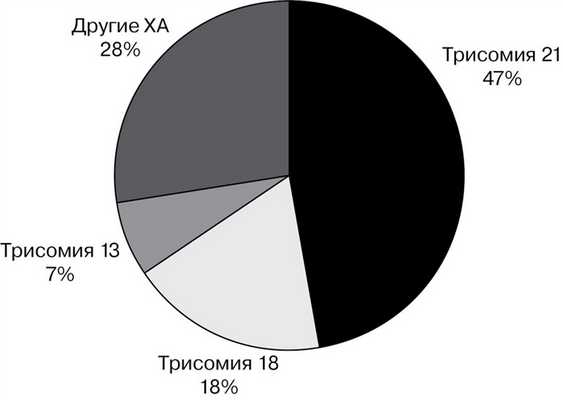
Рис. 1. Структура пренатально выявленных ХА в Московской области (2011—2015 гг.).
Результаты и обсуждение
Основным, самым важным и статистически значимым ультразвуковым маркером для пренатальной оценки индивидуального риска развития хромосомной патологии является ТВП. Распространенность хромосомных или других дефектов зависит от величины, а не от внешнего вида воротникового пространства [1—3]. Аномальное увеличение ТВП ассоциируется с трисомией 21 и другими частыми хромосомными аномалиями, более чем с 50 различными пороками развития плода и генетическими синдромами, а также с внутриутробной гибелью плода. Превалирование хромосомных дефектов увеличивается экспоненциально с увеличением ТВП с 0,2% для тех, у кого ТВП находится между 5-м и 95-м перцентилями, до 65% при ТВП 6,5 мм и более [4—6].
Расширение протокола осмотра с оценкой дополнительных ультразвуковых маркеров (оценка НК, кровотока в венозном протоке и на трикуспидальном клапане) улучшает чувствительность РПС за счет увеличения частоты обнаружения и уменьшения частоты ложно-положительных результатов. В работах многих авторов установлена взаимосвязь между патологией НК и наличием у плода ХА [1, 7—10].
Трисомия 21 (синдром Дауна)
Суммарно у 433 плодов с пренатально установленной трисомией по 21-й хромосоме медиана ТВП составила 3,5 мм. Более 95-го перцентиля ТВП встречалась у 351 плода, что составило 81% (рис. 2, а). По данным литературы [1, 5, 6], значение ТВП более 95-го перцентиля встречается у 71% плодов с трисомией 21.
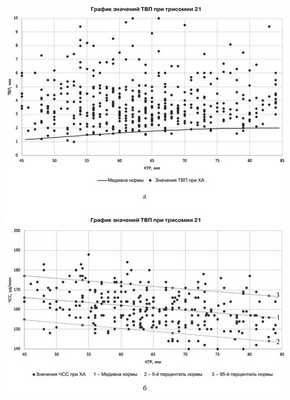
Рис. 2. График распределения ТВП (а) и ЧСС (б) при трисомии по 21-й хромосоме. Здесь и на рис. 3—4: указаны значения копчико-теменного размера (КТР) в пределах допустимого для проведения РПС в сроки беременности 11—14 нед.
Медиана ЧСС при трисомии по 21-й хромосоме составила 161 уд/мин (см. рис. 2, б), что соответствует общепопуляционному значению и не подтверждает опубликованные данные литературы, согласно которым ЧСС плода превышает 95-й перцентиль примерно в 15% случаев [1].
У 429 плодов с трисомией по 21-й хромосоме в качестве дополнительного маркера ХА оценивалась НК (99%). Патология Н.К. была отмечена в 342 (79,7%) случаях. По усредненным данным мультицентровых исследований Фонда медицины плода, в 11—14 нед беременности НК была изменена у 60% плодов с трисомией 21 [1, 7—10, 12—15].
Трисомия 18 (синдром Эдвардса)
Трисомия 13 (синдром Патау)
В 64 случаях трисомии по 13-й хромосоме медиана ТВП в среднем составила 3 мм (рис. 4, а), что ниже, чем при трисомии 21 (3,5 мм) и 18 (4 мм). Более 95-го перцентиля ТВП встречалась у 36 (56%) плодов. Полученный показатель ниже, чем по данным литературы (71%) [1, 5, 6].
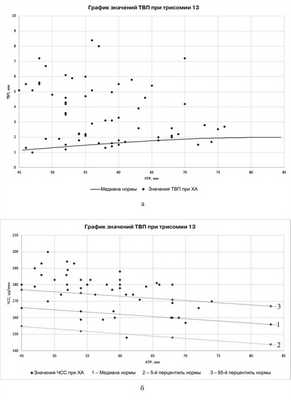
Рис. 4. График распределения ТВП (а) и ЧСС (б) при трисомии по 13-й хромосоме.
Медиана ЧСС составила 179 уд/мин (см. рис. 4, б), что выше общепопуляционного значения и подтверждает литературные данные: превышение 95-го перцентиля в 85% случаев [1].
Как дополнительный маркер НК оценивалась у 61 (95,3%) плода с трисомией 13. Патология Н.К. встречалась в 35 (57%) случаях. По опубликованным данным [1, 7—10, 12—15], НК отсутствует у 40% плодов с трисомией по 13-й хромосоме.
Всего при трисомии 13 было выявлено 156 наблюдений ВПР и особенностей фенотипа плода. Обращала внимание высокая частота обнаружения в данной выборке патологии центральной нервной системы (ЦНС) — 39%. ВПР и особенности строения лица встречались у 42% всех пренатально выявленных трисомий 13, из них одно- и двусторонние расщелины лица составили 20 случаев из 27. Различные ВПС были отмечены у 64% плодов. В 40% случаев была диагностирована полидактилия. Таким образом, учитывая распространенность трисомии 13, можно рекомендовать использовать все эти маркеры для диагностики трисомии 13.
Таким образом, по результатам исследования, проведенного на материале Московской области, в России впервые установлены популяционные частоты ранее известных пренатальных эхо-маркеров при частых ХА, трисомии по 21, 18, 13-й хромосомам. Произведена оценка распространенности дополнительных ультразвуковых признаков данной патологии: ВПР и особенностей фенотипа плода. Использование полученных в исследовании результатов врачами ультразвуковой диагностики экспертного уровня в процессе выполнения ими мероприятий массового ультразвукового обследования беременных в сроках 11—14 нед позволит повысить эффективность раннего пренатального скрининга на частые хромосомные анеуплоидии у плода.
Выводы
1. В российской популяции (на примере региона «Московская область») при пренатально выявленной трисомии по 21-й хромосоме (синдром Дауна) медиана ТВП составила 3,5 мм, медиана ЧСС — 161 уд/мин, а патология носовой кости — в 342 (79,7%) из 433 выявленных случаев.
3. В случаях трисомии по 13-й хромосоме (синдром Патау) медиана ТВП в среднем составила 3 мм, медиана ЧСС — 179 уд/мин, а патология носовой кости была выявлена в 35 (57%) случаях из 64.
Нужно ли делать аборт и когда, если у плода обнаружен синдрома Дауна?

Заболевание Синдром Дауна — это генетическая врожденная патология, считающаяся формой умственной отсталости. Дети с Синдромом Дауна медленно развиваются, обладают плохой памятью и визуально отличаются от сверстников. Некоторые пары решают родить такого малыша и с удовольствием его воспитывают. Других диагноз приводит в шоковое состояние и они принимают решение об аборте. Чтобы понять, как поступить, если УЗИ выявило у плода Синдром Дауна, давайте рассмотрим причины и последствия патологии.
Что такое Синдром Дауна
Патология подразумевает врожденную, генетически обусловленную, а значит неизлечимую, задержку физического и психического развития. У таких детей нарушается рост костей, что приводит к изменению строения тела.
У детишек с СД характерная внешность:
- маленькая округлая головка;
- раскосые, суженные, припухшие глаза, уши и нос меньше нормы, губы утолщены, язык удлиненный;
- рост низкий, укороченные пальцы;
- кожа отечная, волосы истончены;
- половые органы недоразвиты.
Умственное развитие человека с СД даже во взрослом возрасте сохраняется на уровне дошкольника — это главная причина, по которой многие семейные пары выбирают аборт.
При этом нужно отметить, что люди с этим диагнозом очень добрые, ласковые, любят животных и с усердием занимаются разными простыми делами. За открытость и беззлобие их называют «солнечными». Многие из пациентов могут себя обслуживать самостоятельно — одеваться, убирать за собой посуду. Некоторые считают и читают на уровне первоклашек. Но выжить без опекуна они не смогут.
Важные факты о синдроме Дауна
- Первым описал это заболевание английский врач Джон Даун, поэтому в названии патологии нет ничего оскорбительного — болезнь названа в честь великого ученого.
- Частота генетической аномалии не зависит от пола и выявляется с одинаковой частотой и у девочек, и у мальчиков.
- Большинство ученых считает, что СД — не наследственная патология, в одной семье могут быть и здоровые и больные дети. Но, врачи советуют с вниманием отнестись к случаям, если в роду уже рождались больные детки, и тщательнее обследоваться на ранних сроках беременности.
- Болезнь Дауна выявляется на сроках беременности до 12 недель на скрининговом УЗИ. Поэтому, проходя своевременно обследование на хорошем УЗ-аппарате, можно обнаружить патологию ещё в тот период, когда разрешен аборт.
- По статистике, значительными нарушениями мозговой деятельности, включая умственную отсталость, в разных формах страдает до 10% новорожденных малышей.
- Многие родители, родив «даунят», очень их любят и рады, что когда-то отказались сделать аборт. Некоторые семьи, напротив, устают от трудностей и распадаются. Мужчины уходят, устав от бесконечной опеки малыша, с которым приходится очень много и терпеливо заниматься.
Причины развития синдрома Дауна
Истинная причина развития синдрома Дауна определена совсем недавно — у больных людей выявляется не 46, а 47 хромосом. Лишняя хромосома в кариотипе — результат нарушений в момент созревания и деления половых клеток.
Половая клетка делится, наделяя каждую из новых клеток 23-мя хромосомами. Если в этот момент одна из хромосомных пар не смогла разделиться (явление трисомии), остается лишняя хромосома. Чаще всего такая проблема возникает в возрастных браках — у женщин старше 35 лет, риск рождения малыша с синдромом Дауна повышен.
Группы риска, требующие обязательного скрининга на Синдром Дауна:
- Наличие в семье ребенка с генетическими заболеваниями или пороками развития;
- Наличие у одного из супругов или у кого-либо из близких родственников наследственных генетических и хромосомных заболеваний;
- Возраст женщины более 35 лет и/или возраст мужчины более 40 лет;
- Неблагоприятные условия жизни или профессиональной деятельности;
- Наличие в анамнезе спонтанных (самопроизвольных) абортов (выкидышей, привычных выкидышей) или замерших беременностей;
- Близкородственный брак;
- Прием лекарств на ранних сроках беременности, в т.ч. средств для медикаментозного аборта, антибиотиков,
Как выявляется СД — эффективная диагностика при беременности
В настоящее время все беременные, вне зависимости от наличия у них наследственных заболеваний, должны проходить скрининг плода на УЗИ и биохимическую диагностику. Всемирная Организация Здравоохранения (ВОЗ) рекомендует пройти хотя бы одну процедуру скрининга во втором триместре беременности.
Болезнь Дауна во время беременности можно определить несколькими методами:
- Скрининговое УЗИ плода. Доктор измеряет размер воротниковой зоны плода, определяя наличие подкожной жидкости, рост плода и другие параметры, характерные для разных генно-хромосомных патологий.
- Неинвазивная антенатальная диагностика — анализ крови с использованием биохимических маркеров. Кровь берут из вены и воздействуют на нее специальными веществами.
- Амниоцентез — исследование околоплодных вод. Методика требует вмешательства в организм, поэтому относится к инвазивным процедурам. Жидкость берут тонкой иглой через микроскопический прокол в животе и направляют на исследование.
При подозрение на СД нужно пройти минимум два типа диагностики, чтобы удостовериться в наличии патологии на 100% и только после этого принимать решение об аборте.
Результаты УЗИ анализируются вкупе с данными биохимического скрининга, позволяя более точно оценить вероятность наличия генетических аномалий у плода. Если по данным биохимического и УЗИ скрининга риски наличия того или иного генетического нарушения оказываются достаточно велики, назначается инвазивная процедура генетического анализа, которая дает результат с точностью, близкой к 100%. По результатам инвазивного анализа принимается решение о прерывании беременности.
Определение маркеров в крови беременной женщины
Биохимический скрининг подразумевает анализ крови матери, в котором выявляют определенные вещества, которые появляются при наличия генетических отклонений у плода. Их доля постоянно меняется в зависимости от срока беременности.
Биохимический скрининг проводится в два этапа:
- В первом триместре беременности - на содержание свободной β-субъединицы хорионического гонадотропина человека (ХГЧ) и плазменного протеина А, связанного с беременностью (PPP-A);
- Во втором триместре - на содержание ХЧГ или свободной β-субъединицы ХГЧ, свободного эстриола, ингибина А и альфа-фетопротеина (АФП).
Для каждого из перечисленных выше веществ есть некоторые нормы содержания в крови в зависимости от срока беременности. Отклонения в количестве маркеров от определенных норм не подтверждает на 100% генно-хромосомной болезни, а лишь указывает на высокий риск генетических пороков и аномалий. Поэтому, исследование дополняется результатами УЗИ плода. А если остаются сомнения, потребуется дополнительное обследование инвазивными методами.
Кроме данных анализов крови, при биохимическом скрининге учитываются также ряд общих данных о беременной (особенно важную роль играет возраст) и показания УЗИ, сделанного на том же самом сроке. Так или иначе, в качестве результата выдается лишь вероятность существования генетического заболевания у будущего ребенка. Достоверные сведения можно получить лишь в результате инвазивных процедур, то есть амниоцентеза, кордоцентеза или биопсии ворсинок хориона.
Амниоцентез, кордоцентез и биопсия хориона — инвазивные методы генетического скрининга
Если СД не выявлен до 15 недель (женщина пропустила сроки УЗИ, пренебрегала анализами), но есть подозрения на наличие патологии, гинеколог направляет беременную на неприятные инвазивные процедуры.
- Амниоцентез - метод генетического скрининга плода, выполняемый, начиная с 15-й недели беременности. Доктор берет амниотическую жидкость из матки, контролируя процесс на УЗИ. В амниотической жидкости содержатся клетки плода, поэтому после амниоцентеза есть возможность изучить непосредственно хромосомный набор будущего ребенка. Процедура практически безболезненна, но ее использование несколько повышает риск преждевременных родов и развития внутриутробной инфекции. Кроме этого, сам процесс очень неприятен для женщины, также как и ожидание результатов анализа.
- Биопсия ворсинок хориона. Врачи получают клетки околоплодной оболочки плода (хориона), которые генетически идентичны клеткам эмбриона. Риски инфекции и преждевременных родов сохраняются.
- Кордоцентез. Врач берет пуповинную кровь, в которой также содержатся клетки плода.
Полученный клеточный материал культивируют в лаборатории в специальных условиях примерно в течение 2-х недель и затем подвергают полному генетическому анализу. Исследования могут различаться в зависимости от назначений врача-генетика.
Существует более срочная диагностика клеток плода — флуоресцентная гибридизация (FISH), результат такого анализа обычно бывает готов в течение 2-3 дней. Однако возможности метода ограничены, и количество определяемых таким методом отклонений отличается от полного списка наследственных заболеваний. Методом FISH обычно определяют нарушения в количестве хромосом из 13, 15, 17, 18, 21, 22 пар хромосом, а также среди половых хромосом X и Y.
Точность инвазивных методов генетического скрининга составляет 97-99%.
Обязательно ли прерывать беременность?
Начнем с того, что делать или не делать аборт при Синдроме Дауна, женщина решает самостоятельно. Т.е. прерывать беременность в связи с патологией плода ее никто не заставит. Но гинеколог и генетик обязательно предупредят о последствиях — болезнь неизлечима и будет прогрессировать.
Некоторые женщины не хотят делать аборт, планируя сдать больного ребенка в детский дом. Если раньше достаточно было подписать отказ на малыша, теперь закон обязывает платить бессовестных мамаш алименты. Поэтому, произведя на свет ребенка с СД и отказываясь от него, жить счастливо и беззаботно не получится.
В какие сроки делается аборт, если у плода обнаружен СД
Если женщина решает сделать аборт, то его назначают в срочном порядке, чтобы провести его в щадящем режиме. Чем больше срок — тем больше возможных негативных последствий для психики и здоровья можно ожидать.
Нормальные сроки для аборта:
- До 6 недель — медикаментозный аборт. Выполняется с помощью приема таблеток, вызывающих выкидыш;
- До 7 недель — вакуумный аборт. Делается с помощью специального оборудования, не затрагивающего стенки матки;
- До 12 недель — хирургический аборт. Плод удаляют с помощью хирургического инструмента. Стенки матки выскабливаются.
Если сроки упущены, делают поздний аборт — допустимый срок до 22 недель гестации.
В случае, когда женщина решила сохранить беременность, все последующие обследования проводятся по стандартному плану. Роды также ничем не отличаются от обычных.
Диагностика синдрома Дауна при беременности

Синдром Дауна — одна из генетических патологий. Второе название — трисомия 21 хромосомы. Это патология развития плода, которая регистрируется у каждого 800 новорожденного ребёнка. Болезнь проявляется комплексным нарушением когнитивного развития от слабого до умеренного уровня, а также значительно повышает риски сопутствующих болезней и патологий анатомического строения. С целью ранней диагностики трисомии 21 во время беременности проводят скрининг на синдром Дауна. Зачем это делают, какие методики применяются в различных случаях, рассказывает MedAboutMe.
Синдром Дауна у ребёнка: кто виноват в болезни?

Сам синдром как набор разнообразных симптомов был описан врачом Лэнгдоном Дауном, по чьему имени назвали болезнь, еще в ХIХ веке. Но хромосомное нарушение как причину развития заболевания обнаружили только через почти 100 лет после описания самого синдрома. В этиологии синдрома — умножение 21 хромосомы (трисомия): в норме их должно быть только две, при трисомии — три.
В каждой клетке нашего тела присутствуют 23 пары хромосом: половину ребёнок наследует от мамы, половину — от папы. Если же происходит искажение процесса копирования родительских хромосомных наборов, у эмбриона оказывается избыток или недостаток хромосом. И при синдроме Дауна такой профицит образуется в 21 хромосоме, в большинстве случаев при этом появляется дубликат материнского набора генов на данном участке.
Дубликат только 21 хромосомы — причина развития заболевания в 95%. У трех процентов больных детей он дополняется переносом генов из 21 хромосомы в 14, а еще примерно 2% детей с данным синдромом рождается с мозаичной формой, при которой дубликат 21 хромосомы присутствует только в некоторых клетках. При этой форме болезни симптомы могут быть настолько стертыми, что определяются только генетическим исследованием.
У 95 из 100 детей синдром Дауна возникает вследствие случайных сбоев репликации в период слияния яйцеклетки и сперматозоида. И только в 5% случаев отмечается наследственная причина трисомии.
Сегодня только один фактор подтвержден, как имеющий влияние на вероятность возникновения синдрома, — это возраст женщины на момент зачатия. Возрастная беременность повышает риск рождения ребёнка с трисомией, но совсем не гарантирует. Другие факторы влияния пока не выяснены.
Зачем проводят скрининг на трисомию 21 во время беременности?
Не секрет, что данный тип скрининга в значительном количестве стран проводится только по желанию родителей. В некоторых странах он обязателен для мам старше 35 лет, но в большинстве случаев это добровольное исследование (и платное). В России его проводят всем мамам бесплатно, хотя от проведения можно отказаться: немало родителей задумываются, а нужна ли вообще такая диагностика?
Действительно, в большинстве случаев ребёнок с трисомией 21 — такой же малыш, как и другие, он будет любимым и желанным вне зависимости от нарушений. И родители, придерживаясь подобной позиции, отказываются от проведения скрининг-теста, так как опасаются, что по результатам их могут склонять к прерыванию беременности. Однако это — довольно безответственная позиция.
Хотя ребёнок с синдромом Дауна на самом деле все тот же любимый ребёнок, да и в современном обществе отношение к «солнечным малышам» становится довольно позитивным, стоит помнить, что нарушениями когнитивного развития заболевание не ограничивается. Малыш с трисомией 21 может иметь врожденные или развивающиеся в течение периода раннего детства патологии, и о них необходимо знать заранее, чтобы внимательно следить за здоровьем крохи, вовремя корректировать и лечить.
Среди патологических предрасположенностей у детей с синдромом Дауна выделяют:
- нарушения строения органов сердечно-сосудистой системы, врожденные пороки сердца различного типа и тяжести. Встречаются ситуации, когда экстренная хирургическая операция необходима сразу же после появления ребёнка на свет, и к такому надо быть готовым;
- болезни и нарушения функционирования органов пищеварения: атрезия пищевода, кишечника, стенозы, свищевые отверстия, отсутствие перфорации (отверстия) в анусе, и эти состояния требуют срочной оперативной помощи;
- к не требующим хирургического вмешательства, но с высокой степенью вероятности возникающим при синдроме Дауна патологиям относят инфекции среднего уха из-за особенностей строения, что приводит к нарушению слуха, дисфункции щитовидки (гипотиреозы), нестабильность шейного отдела позвоночного столба, развитие близорукости, астигматизма, приступы ночного апноэ, избыточную массу тела, дисфункции ЖКТ и некоторые виды онкологических заболеваний.
Если говорить о психическом развитии и неврологических отклонениях, то примерно у 30% детей отмечается также дефицит внимания, расстройства аутичного спектра, гиперреактивность, стереотипии, обсессивно-компульсивные и депрессивные расстройства.
Стоит знать, что беременность в таком случае ничем не отличается от вынашивания здорового ребёнка, и без скрининга заподозрить или выявить трисомию 21 у плода невозможно. А различные нарушения, заболевания и патологии у новорожденного нередко требуют лечения как практически сразу после появления на свет, так и в течение раннего детства, и тратить время на постановку диагноза из-за отказа от проведения пренатального исследования не стоит. Понимание особенностей, вероятных рисков и признаков различных болезней, специфическом лечении и уходе за малышами с синдромом Дауна позволяет быстро и качественно оказывать помощь ребёнку и не тратить время на диагнозы, исследования и адаптацию взрослых к неожиданной патологии у новорожденного.
Пренатальный скрининг на синдром Дауна: различные методики

Скрининг-тесты на трисомию 21 проводятся неинвазивным и инвазивным методами. Неинвазивный скрининг — тот, что проводят всем будущим мамам: замер уровня альфа-фетопротеина в материнской крови и его корреляция с параметрами плода, определяемыми на УЗИ.
Стоит помнить, что по результатам нескольких ультразвуковых исследований и анализов крови, проводимых в беременность для выявления патологии, определенного диагноза у плода быть не может. Максимальная достоверность результатов для возрастных матерей — 80%. И если мама попадает в группу риска, ей по итогам обследований предлагается скрининг инвазивным методом: амниоцентеза, биопсии хориона плода, анализа крови из пуповины. Данные скрининг-тесты можно проводить в беременность на различных сроках, и они позволяют со стопроцентной точностью установить наличие или отсутствие трисомии, хотя спрогнозировать, насколько будет выражен синдром Дауна у ребёнка, невозможно.
Пренатальные скрининги — это не способ принудить родителей к прерыванию беременности. Заставить кого-либо сделать это невозможно. Такие тесты дают возможность заранее подготовиться к возможным аспектам ухода и лечения новорожденного, выбрать клиники, врачей и подготовить все, что нужно для наилучшего развития ребёнка.
Синдром лишней хромосомы: какие бывают трисомии?

Человеческий организм — не машина, и в нем случаются сбои на всех уровнях: от органного до молекулярного. Особенно опасны некоторые поломки в геноме. Природа обеспечила наш вид защитными механизмами: даже если зачатие плода с тяжелыми генетическими аномалиями произойдет, с высокой долей вероятности в I триместре организм избавится от него. Но существуют тяжелые геномные патологии, при которых дети рождаются живыми, и тогда только от врачей и окружающих людей зависит, как этот ребёнок проживет свою, иногда очень короткую, жизнь. В Международный день людей с синдромом Дауна MedAboutMe разбирается, какие виды трисомий, кроме синдрома Дауна, существуют и какие шансы у таких детей на выживание.
Трисомии — хромосомные болезни
Хромосомы у людей бывают двух типов: половые хромосомы, которые различаются у мужчин (XY) и женщин (XX), и аутосомы — парные хромосомы, имеющиеся у обоих полов. Для правильного развития человека, начиная с момента зачатия, важно все: и правильность строения хромосом, и их количество. Если нарушено строение, говорят о хромосомных мутациях, а если количество не соответствует норме — то о мутациях на уровне генома. Хотя отдельные хромосомные нарушения встречаются нечасто, а некоторые из них смело можно отнести к редким заболеваниям, все же в целом хромосомные аномалии фиксируются у 6-7 новорожденных из каждой тысячи.
Подавляющее большинство числовых нарушений хромосомного набора приводит к аномальному развитию плода, и организм избавляется от такого эмбриона на ранних сроках. Эксперты утверждают, что четверть спонтанных выкидышей в I триместре — это как раз результат трисомий. Но при некоторых видах анеуплоидии (утрата или, наоборот, появление дополнительной хромосомы) женщины донашивают ребёнка до рождения.
Нас интересуют трисомии аутосом — ситуации, когда имеется дополнительная хромосома. Чаще всего это происходит на стадии образования яйцеклеток и сперматозоидов из-за неполного расхождения хромосом, но бывают и другие механизмы развития данной патологии. Согласно последним данным, существует даже мутация, которая существенно повышает риск передачи аномального числа хромосом потомству. В итоге, когда после оплодотворения наборы хромосом отца и матери объединяются, получившаяся клетка будет иметь трисомию — одну хромосому, как и положено, от одного родителя, и две хромосомы под тем же номером — от другого.
Трисомии могут возникать по любой из 22 аутосом человека. Но только для семи из них возможно рождение живого младенца, это 21, 18, 13, 14, 8, 9 и 22 хромосомы. В остальных случаях плод не выживает — ученые обнаруживали такие нарушения только при самопроизвольных выкидышах.
Все случаи трисомий выявляются сразу после рождения малыша. Такие дети обладают характерными чертами внешности, обычно имеют многочисленные и выраженные пороки развития, как внешних, так и внутренних органов, у них отмечается значительная задержка психомоторного развития и существенные дефекты интеллекта. Дети с большинством трисомий живут очень недолго.
Синдром Эдвардса: 3 месяца жизни
Синдром Эдвардса — результат трисомии по 18 хромосоме. Это редкое заболевание, которое встречается с частотой 1:2500-6766 среди живорожденных детей. Девочки с синдромом Эдвардса рождаются в 3 раза чаще, чем мальчики. Также доказано, что с возрастом матери риск рождения ребёнка с этим заболеванием растет, впрочем, не так сильно, как в случае синдрома Дауна. Вероятность родить малыша с синдромом Эдвардса у женщин старше 45 лет составляет 0,7%.
В 70% случаев трисомии по 18 хромосоме происходит самопроизвольный выкидыш еще в I триместре беременности. Половина живорожденных детей погибает в течение первой недели жизни. Лишь 5% доживают до своего первого дня рождения. Но при этом у них обычно наличествуют множественные тяжелые пороки развития, включая скелетные и черепно-лицевые аномалии, разнообразные патологии сердца и магистральных сосудов, нарушения развития пищевода, мочевыводящей системы, желудочно-кишечного тракта. Живут такие дети в среднем не более 3 месяцев, некоторые доживают до года.
Синдром Патау: несчастливая хромосома
Синдром Патау развивается при трисомии по 13 хромосоме, которая встречается в 1 случае на 7-14 тысяч новорожденных младенцев. Мальчики и девочки с синдромом Патау рождаются с одинаковой частотой. Существует связь между риском зачатия малыша с трисомией по 13 хромосоме и возрастом матери.
Младенцы, которым удалось дожить до появления на свет, имеют многочисленные тяжелые пороки развития. Это патологии центральной нервной системы вкупе с микроцефалией, болезни глаз, деформация и недоразвитие лицевых отделов, в 80% случаев — тяжелые пороки развития сердца и сосудов, полидактилия, болезни поджелудочной железы и селезенки, почек и половых органов. У детей отмечается задержка умственного развития и глубокая идиотия. Раньше подавляющее большинство детей умирало еще до 1 года. Но сегодня, по мере развития медицины, продолжительность жизни малышей с синдромом Патау растет. В развитых странах в наше время до 5 лет доживает уже 15% детей, а до 10 лет — от 2 до 3%.
Синдром Дауна: солнечные дети

Синдром Дауна развивается при полной трисомии по 21 хромосоме. Мальчики и девочки с этой патологией рождаются с одинаковой частотой, а в среднем на свет появляется 1 ребёнок с синдромом Дауна на 700 живорожденных детей. Достоверно известно, что на вероятность зачатия ребёнка с такой трисомией значительное влияние оказывает возраст матери. Чем старше женщина, тем выше риски.
Как и всех обладателей трисомий, детей с синдромом Дауна отличают характерные внешние черты, по которым «солнечного» малыша можно узнать, вне зависимости от его национальности. Как и в случае других хромосомных болезней из этой группы, такие дети имеют множество патологий, нарушения умственного развития и определенных физиологических особенностей. Но, в отличие от других анеуплоидий, эта патология может развиваться без тяжелых пороков внутренних органов. И тогда такие дети имеют все шансы прожить достаточно долгую жизнь — до 60-65 лет, хоть и демонстрируя признаки раннего старения. Такой срок, сравнимый с продолжительностью жизни здорового человек — победа современной медицины, науки и, конечно, показатель развития общества, ведь еще 30-35 лет назад средняя продолжительность жизни человека с синдромом Дауна не превышала 25 лет.
Вырастая, люди с синдромом Дауна способны и сами заводить детей. Большинство мужчин бесплодны, но не все, а среди женщин могут иметь детей примерно половина. И каждый второй ребёнок, рожденный матерью с трисомией по 21-й хромосоме, будет здоровым.
Другие трисомии
Другие трисомии, при которых дети имеют шанс родиться живыми, не столь известны, как вышеперечисленные три синдрома:
- Трисомия по 8 хромосоме: встречается в 1 случае на 50 тысяч успешных родов. Среди проявлений патологии — макроцефалия, аномалии скелета, врожденные пороки развития мочевой системы, пороки сердца и сосудов, задержка речевого и психомоторного развития. Известны случаи, когда люди с такой патологией доживали до 17 лет.
- Трисомия по 9 хромосоме: микроцефалия, тяжелые нарушения опорно-двигательного аппарата, патологии сердца и сосудов, почек, желудочно-кишечного тракта. Большинство таких детей погибает в возрасте до 4 месяцев.
- Трисомия по 14 хромосоме: микроцефалия, пороки сердечно-сосудистой системы, тяжелые патологии почек, астма и заболевания кожи. Хотя обычно такие дети умирают достаточно рано, известны случаи, когда люди с трисомией по 14 хромосоме доживали до 13 лет.
- Трисомия по 22 хромосоме: рождение детей с такой патологией — большая редкость. По частоте выкидышей в I триместре эта анеуплоидия стоит на втором месте (после трисомии по 16 хромосоме). Смерть ребёнка наступает обычно после рождения или в течение ближайших недель.
Лечение трисомий

Пока генетические заболевания такого плана не лечатся. Однако ученые уже говорят о потенциальной возможности лечить трисомии путем генной инженерии. Например, можно было бы использовать аденовирус, как транспорт для доставки в конкретный участок лишней хромосомы гена, способного привести к ее утрате (и такой ген уже известен, по крайней мере, для 21 хромосомы). В другом варианте рассматривается возможность активизации точечных мутаций, включающих этот ген при его наличии.
По мнению экспертов, не так уж много времени осталось до момента, когда можно будет избавлять людей с такими синдромами хотя бы от тяжелых сопутствующих болезней. Например, людям с синдромом Дауна, страдающим о лейкемии, можно будет вводить «исправленные» стволовые клетки, которые способны к производству здоровых и не склонных к болезням клетки.
Неожиданный эффект дает лечение болезней сердца, которые очень часто развиваются у детей с трисомиями. У 40% детей с синдромом Дауна отмечаются врожденные пороки сердца. Когда-то это состояние было дополнительным фактором риска преждевременной смерти человека. Но в наше время такие дети получают операцию на сердце, а вместе с ней возможность жить и в значительном числе случаев быть полноценными членами общества.
В прошлом году американские ученые выступили с заявлением о необходимости проведения операций на сердце также детям с трисомиями по 13 и 18 хромосомам, то есть с синдромами Патау и Эдвардса. Из-за того, что продолжительность жизни таких малышей невелика, обычно они получают лишь симптоматическую поддерживающую терапию. Считается, что не имеет смысла делать серьезную операцию на сердце, если в течение нескольких месяцев ребёнок все равно умрет. Однако врачи собрали статистику по тем детям, которые все же такую операцию получили. Оказалось, что при этом срок их жизни увеличивается на 33-67% — дети стали доживать до 2-х лет и более. Особенно выраженным эффект оказался для синдрома Эдвардса. Исследователи заявили, что это повод пересмотреть принципы проведения операций на сердце детям с трисомиями — ведь для многих родителей это шанс провести со своим ребёнком не 2 недели, а 2 года.

Пройдите этот тест и узнайте, во сколько баллов - по десятибалльной шкале - можно оценить состояние вашего здоровья.
Лучевые признаки трисомии 21 у плода
ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России, Екатеринбург, Россия
НИИ охраны материнства и младенчества, Екатеринбург
Цитогенетические нарушения у эмбриона при неразвивающейся беременности
Журнал: Российский вестник акушера-гинеколога. 2013;13(4): 18‑21
Башмакова Н.В., Третьякова Т.Б., Демченко Н.С. Цитогенетические нарушения у эмбриона при неразвивающейся беременности. Российский вестник акушера-гинеколога. 2013;13(4):18‑21.
Bashmakova NV, Tret'iakova TB, Demchenko NS. Cytogenetic disorders in embryos during non-developing pregnancy. Russian Bulletin of Obstetrician-Gynecologist. 2013;13(4):18‑21. (In Russ.).
С целью изучения частоты и структуры хромосомной патологии был исследован 71 образец эмбриональных тканей у женщин с неразвивающейся беременностью I триместра. Ворсины хориона, полученные из абортного материала, были подвергнуты цитогенетическому анализу для определения кариотипа плода. В результате были обнаружены все типы хромосомных нарушений: трисомии, моносомии, триплоидия, мозаичные кариотипы. Наиболее распространенной аномалией кариотипа абортусов были трисомии - 71% случаев. Чаще всего встречались трисомии 21-й и 160-й хромосом. Интересной особенностью полученных результатов является высокая частота мозаичных форм хромосомных нарушений, которые составили 34% от числа аномальных кариотипов.
Проблема невынашивания беременности продолжает оставаться актуальной и социально значимой в практике акушера-гинеколога. Самопроизвольные аборты составляют 15-20% от всех желанных беременностей. Среди различных форм невынашивания беременности особое место занимает несостоявшийся аборт (неразвивающаяся беременность) - гибель эмбриона в раннем сроке беременности с длительной задержкой в полости матки. В структуре репродуктивных потерь число случаев неразвивающейся беременности составляет 10-20%. Причины неразвивающейся беременности многочисленны и нередко комплексны [3]. Особую роль в этиологии невынашивания беременности играет хромосомный дисбаланс. Так, в 6-7 нед беременности 60-75% абортусов имеют аномальный кариотип, в 12-17 нед - 15-20%, и в 17-28 нед - только 2-7% [14].
Таким образом, если около 50% эмбрионов I триместра беременности погибают вследствие естественного отбора зачатий с аномальным кариотипом, то причина гибели других эмбрионов имеет мультифакториальную природу, т.е. является результатом аддитивного действия многих факторов, связанных как с зародышем, так и с матерью, а также комплекса неблагоприятных условий внешней среды. Среди факторов внешней среды к причинам самопроизвольного аборта относится ряд социальных (курение, стрессы, вредные профессиональные факторы) и медицинских факторов (эндокринные, инфекционные, иммунные). Однако, по данным ряда авторов, в 20-40% случаев невынашивания беременности причина остается невыясненной. В настоящее время особое внимание уделяется изучению молекулярных вариантов ряда генов, модулирующих риск широко распространенных мультифакториальных заболеваний, к которым относится и синдром невынашивания беременности.
Описано около 7 различных групп генов, ассоциированных с риском невынашивания беременности. К ним относятся следующие генные сети: гены II фазы детоксикации (GSTM1, GSTT1, GSTP1); гены плазменного гемостаза (FGB, PTM, FVL, XII); гены иммунной системы (DQA1, DQB2, DQB1, HLA-G, ILIB); гены метаболизма гормонов (PGR, ER); гены факторов роста хориона и плаценты (VEGF, IGF1, TNFA, TGFB); гены метаболизма фолиевой кислоты и витамина В12 (MTHFR, MTRR, MTR) [1]. Влияние полиморфизма перечисленных генов на систему мать-плацента-плод осуществляется как со стороны матери, так и со стороны плода. Особая роль в этиологии ранней эмбриональной гибели отводится нарушениям самого эмбриона: эпигенетической регуляции, не выявленным, редким мозаичным вариантам хромосомных аномалий, однородительской дисомии, повышенной частоте мутаций повторяющихся последовательностей [4-7, 9, 12, 13].
Цель данного исследования - изучение частоты и структуры хромосомной патологии среди абортированных эмбрионов у женщин с неразвивающейся беременностью и анэмбрионией.
Материал и методы
Абортивный материал для исследования был получен в гинекологическом отделении ФГБУ НИИ «Охраны материнства и младенчества» в Екатеринбурге с 2010 по 2011 г. С помощью стандартного цитогенетического анализа исследован материал 71 абортуса при неразвивающейся беременности. Среди них 63 образца получены у женщин с клиническим диагнозом неразвивающейся беременности, поставленным в ходе динамического ультразвукового обследования, и характеризовались наличием в полости плодного мешка внутриутробно погибшего эмбриона. Остальные 8 образцов абортного материала представляли собой случаи анэмбрионии, характеризовавшейся отсутствием эмбриональных структур в полости плодного мешка. Эмбриональные ткани получали из полости матки методом вакуум-аспирации. Гестационный возраст эмбрионов составил 4-11,5 нед (7,5±1,8 нед).
В 56 случаях беременность наступила естественным образом, в 15 случаях - в результате применения вспомогательных репродуктивных технологий. Женщины получили полную информацию о цели проводимого исследования и подписали информационное согласие на его проведение.
Фрагменты плодного мешка тщательно отмывали от крови и децидуальной ткани в среде RPMI-1634 комнатной температуры. Отобранные отдельные ворсины хориона обрабатывали по стандартному протоколу ускоренного «прямого» метода приготовления препаратов хромосом из ворсин хориона. Приготовленные препараты окрашивали стандартным дифференциальным методом G-окраски с применением 0,25% раствора трипсина и раствора красителя Гимза [1]. Кариотипирование проводили на микроскопе Leica DM4000B c программным обеспечением LeicaCW 4000 Karyo.
Результаты и обсуждение
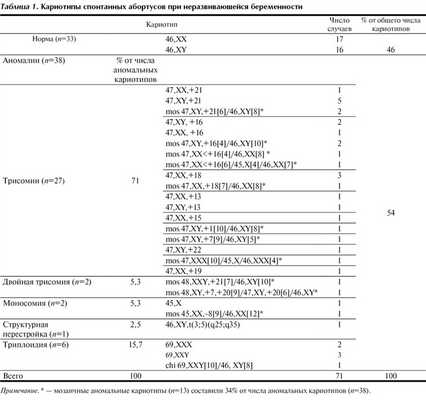
Стандартный цитогенетический анализ был успешно проведен в 71 случае спонтанных абортусов. В результате цитогенетического исследования в 33 (46%) случаях был выявлен нормальный кариотип и в 38 (54%) случаях - аномальный кариотип абортуса (табл. 1). Установленная доля аномальных кариотипов согласуется с проведенными ранее исследованиями других авторов. По обобщенным данным, число случаев хромосомных аномалий у абортусов при неразвивающейся беременности до 10 нед гестации составляет около 60% [1, 5, 11].
Среди выявленных 38 случаев аномального кариотипа у эмбрионов были обнаружены все типы хромосомных нарушений, описанных ранее другими авторами при ранней эмбриональной гибели, за исключением тетраплоидии и маркерных хромосом [1, 4].
В 2 случаях обнаружен сложный вариант двойной трисомии, с участием дополнительной половой хромосомы (Х) и 21-й в первом случае, 7-й и 20-й хромосом - в другом случае (см. табл. 1). Частота отдельных трисомий согласуется с наблюдениями других авторов [2].
Хромосомный дисбаланс половых хромосом был обнаружен в 3 случаях (см. табл. 1). В одном случае имела место дисомия Х хромосомы в мужском кариотипе (mos 48,ХХY,+21[7]/46,ХY[10]), в другом - трисомия Х в женском кариотипе (mos 47,ХХХ[10]/45,Х[4]/46,ХХ[4]). Оба варианта выявлены в мозаичной форме. Полная моносомия Х хромосомы выявлена также в 1 случае.
Как следует из табл. 1, полиплоидия в проведенном исследовании была представлена только триплоидией у 6 (15,8%) абортусов, распространенность которой согласуется с данными по другим популяциям [6, 11]. Триплоидия является либо результатом нарушения созревания половых клеток (отсутствие редукции диплоидного набора), либо оплодотворения одной яйцеклетки двумя сперматозоидами [1, 15]. Один случай представлял собой химерный вариант кариотипа (chi 69,XXY[10]/46,XY[8]).

Определенный интерес представляет изучение структуры хромосомных аномалий у абортусов с наиболее тяжелой морфологической формой нарушений эмбриогенеза - анэмбрионией. По результатам собственных исследований, среди 8 случаев анэмбрионии нами были выявлены 3 случая анеуплоидного кариотипа с трисомией по 15, 16 и 19-й хромосоме (табл. 3). В ряде исследований методом сравнительной геномной гибридизации (CGH) показано, что у абортусов с анэмбрионией имели место как моносомии (7, 15, 21 и 22-й хромосом), так и трисомии (1, 2, 15 и 19-й хромосом) [1, 8].
Интересной особенностью полученных результатов является высокая частота мозаичных форм хромосомных нарушений, которые составили 34% (13 случаев) от числа аномальных кариотипов (см. табл. 1). По данным исследований других популяций [6], проведенных с использованием стандартного цитогенетического анализа, число случаев мозаицизма по всем хромосомам колеблется от 0 до 14%. Следует учитывать, что стандартный цитогенетический анализ не позволяет отличить истинную трисомию и моносомию от потери хромосомы при приготовлении препаратов, особенно при мозаицизме низкого уровня. Кроме того, количество метафазных пластин часто ограничено, что не позволяет объективно судить о доле аномального клона клеток. Более достоверные результаты о наличии мозаичного варианта кариотипа можно получить методами молекулярной цитогенетики, например, методом FISH (fluorescence in situ hy bridization), который позволяет многократно увеличить количество анализируемых метафаз. Исследователи из Томска FISH-методом обнаружили высокую частоту мозаичных форм кариотипа спонтанных абортусов (37%) [10]. В работе С.Г. Ворсановой [2] с применением метода FISH обнаружен мозаицизм у 50,3% абортусов с аномальным кариотипом. Поэтому мы склонны считать выявленный мозаицизм в экстраэмбриональных тканях абортусов истинным, характерным для этиологии неразвивающейся беременности. Для исключения ложноположительного мозаицизма, обусловленного погрешностями техники приготовления цитогенетических препаратов, мы постоянно совершенствуем мастерство и контролируем качество обработки биологического материала.
Мозаичные нарушения кариотипа являются результатом соматического мутагенеза в тканях самого зародыша на постзиготических этапах развития. Другими словами, хромосомные аномалии у плода могут возникать не только на этапе гаметогенеза у родителей погибшего плода, но и в процессе имплантации, морфогенеза и развития эмбриона с исходно нормальным кариотипом. В настоящее время одной из причин хромосомного мозаицизма на ранних этапах онтогенеза человека рассматриваются нарушения эпигенетической регуляции экспрессии генов, выполняющих различные функции в ходе клеточного цикла. Исследования некоторых авторов указывают на взаимосвязь цитогенетических нарушений с аномалиями эпигенетического репрограммирования [10].
Следует отметить, что частота хромосомных аномалий среди абортусов при неразвивающейся беременности, по данным ряда авторов, выше, чем при самопроизвольных абортах [6, 10]. Следовательно, можно предположить, что гибель эмбриона при несостоявшемся аборте, вероятно, чаще вызвана генетическими факторами. Это ставит новые вопросы об этиологии и механизмах внутриутробной задержки погибшего эмбриона при несостоявшемся аборте и причинах гибели плода с нормальной хромосомной конституцией, о роли генетических и эпигенетических факторов в индивидуальном развитии человека.
Выводы
1. Наиболее распространенным нарушением кариотипа у абортусов при неразвивающейся беременности была трисомия (71%).
2. Значительная часть аномальных кариотипов абортусов была представлена мозаичными вариантами (34%).
3. В большинстве мозаичных кариотипов имеет место невысокая частота анеуплоидных клеток, что свидетельствует о митотических ошибках на постзиготическом этапе развития эмбриона.
Читайте также:
- Зоб и тимомы у детей. Тератодермоидные опухоли у ребенка
- Воздействие старения на нервную систему
- Религия и духовность у пожилых людей
- Раннее выявление рака поджелудочной железы. Скрининг населения на рак поджелудочной железы.
- Болезнь Кастлемана. Гиалиновый сосудистый, плазмоклеточные типы болезни Кастлемана.

