Микроокружение лимфоидных органов. Значение микроокружения для лимфоидных клеток
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Лимфатические узлы располагаются по ходу лимфатических сосудов, являются органами лимфоцитопоэза, иммунной защиты и депонирования протекающей лимфы. В лимфатических узлах происходят антигензависимая пролиферация (клонирование) и дифференцировка Т- и В-лимфоцитов в эффекторные клетки, образование клеток памяти. Это округлые или овальные весьма многочисленные образования размером около 0,5—1 см. Обычно лимфатические узлы с одной стороны имеют вдавление. В этом месте, называемом воротами, в узел входят артерии и нервы, а выходят вены и выносящие лимфатические сосуды. Сосуды, приносящие лимфу, входят с противоположной, выпуклой стороны узла. Благодаря такому расположению узла по ходу лимфатических сосудов он является не только кроветворным органом, но и своеобразным фильтром для оттекающей от тканей жидкости (лимфы) на пути в кровяное русло. Протекая через лимфатические узлы, лимфа очищается от инородных частиц и антигенов на 95—99 %, от избытка воды, белков, жиров, обогащается антителами и лимфоцитами. Строение. Снаружи узел покрыт соединительнотканной капсулой, несколько утолщенной в области ворот. В капсуле много коллагеновых и мало эластических волокон. Кроме соединительнотканных элементов, в ней главным образом в "области ворот располагаются отдельные пучки гладких мышечных клеток, особенно в узлах нижней половины туловища. Внутрь от капсулы через относительно правильные промежутки отходят тонкие соединительнотканные перегородки, или трабекулы, анастомозирующие между собой в глубоких частях узла. На срезах узла, проведенных через его ворота, можно различить периферическое, более плотное корковое вещество, состоящее из лимфатических узелков, паракортикалъную (диффузную) зону, а также центральное светлое мозговое вещество, образованное мозговыми тяжами и синусами. Большая часть кортикального слоя и мозговые тяжи составляют область заселения В-лимфоцитов (В-зона), а паракортикальная, тимусзависимая зона содержит преимущественно Т-лимфоцитьг (Т-зона).
Корковое вещество Характерным структурным компонентом коркового вещества являются лимфатические узелки. Они представляют собой округлые образования диаметром около 0,5—1 мм. В ретикулярном остове узелков проходят толстые, извилистые ретикулярные волокна, в основном циркулярно направленные. В петлях ретикулярной ткани залегают лимфоциты, лимфобласты, макрофаги и другие клетки. В периферической части узелков находятся малые лимфоциты в виде короны. Лимфатические узелки покрыты ретикулоэндотелиальными клетками, лежащими на ретикулярных волокнах. Среди ретикулоэндотелиальных клеток много фиксированных макрофагов («береговые макрофаги»). Центральная часть узелков обычно выглядит светлой вследствие того, что она состоит из более крупных клеток с большими светлыми ядрами: из лимфобластов, типичных макрофагов, «дендритных клеток», лимфоцитов. Лимфобласты обычно находятся в различных стадиях деления, вследствие чего эту часть узелка называют герминативным центром или центром размножения. При интоксикации организма, особенно микробного происхождения, в центральной части узелка могут появляться скопления фагоцитирующих клеток, что указывает на высокую реактивность описываемых структур. Поэтому данную часть узелка часто называют еще реактивным центром. Типичные свободные макрофаги преобразуют корпускулярный антиген в молекулярный и концентрируют его до количества, способного побудить к пролиферации и дифференцировке расположенные рядом В-лимфоциты при участии Т-хелперов. В результате этого образуются клетки памяти Т- и В-типа и плазмобласты. Активированные антигеном В-лимфоциты по мере размножения и созревания образуют В-зону, откуда мигрируют в мозговые тяжи, где превращаются в плазмоциты и продуцируют антитела. Клетки памяти с током лимфы или через посткапиллярные вены вступают в циркуляцию и будут созревать в эффекторные клетки после вторичной встречи с антигеном. Макрофаги светлых центров могут фагоцитировать также погибающие клетки, в результате чего в их цитоплазме обнаруживаются хро-мофильные остаточные тельца. Отростчатые («дендритные») клетки реактивных центров являются разновидностью макрофагов, способных с помощью рецепторов цитолеммы к фикyсации иммуноглобулинов, а через них и антигенов, вызвавших иммунный ответ организма. Накопленные на их поверхности антигены активируют и вовлекают в иммунную реакцию контактирующие с ними В-лимфоциты. Морфологически «дендритные» клетки характеризуются отростчатой формой, электронно-прозрачной цитоплазмой, бедной рибосомами, лизосомами и канальцами цитоплазматической сети. Полагают, что эти клетки характерны для В-зон лимфатических узелков. Длительная задержка антигенов на поверхности дендритных клеток и наличие клеток памяти обеспечивают более быстрый иммунный ответ при повторной встрече с тем же антигеном.
Строение лимфатических узелков может меняться в зависимости от физиологического состояния организма. Различают 4 стадии, отражающие происходящие в них процессы. В I стадии — формирование центра размножения — в лимфатическом узелке имеется небольшой центр, состоящий преимущественно из малодифференцированных клеток лимфо-цитопоэтического ряда. Некоторые из этих клеток могут быть в состоянии митотического деления. Во II стадии у лимфатических узелков центры крупнее и содержат большое количество митотически делящихся клеток лимфо-цитопоэтического ряда (от 10 и более на срезе). Центральная часть узелка выглядит светлой. В III стадии вокруг светлых центров появляется корона из малых лимфоцитов. Уменьшаются число митотически делящихся клеток и количество молодых клеток лимфоцитопоэтического ряда. В IV стадии в центре узелка фигуры митозов и макрофаги единичны. Вокруг узелка корона из малых лимфоцитов состоит преимущественно из клеток В-памяти. Это стадия относительного покоя. Возникновение и исчезновение центров происходит в течение 2—3 сут.
Лимфоидные узелки содержат преимущественно В-лимфоциты на разных стадиях антигензависимой дифференцировки. Антигены, попавшие в лимфатический узел с током лимфы, распространяются по синусам, достигают поверхностной зоны центров размножения, фагоцитируются макрофагами, частично переработанные фиксируются на их мембране и на мембране отростков дендритных клеток. В-лимфоциты также могут посредством своих рецепторов разносить антигенную информацию. Получив информацию об антигене, В-лимфоциты превращаются в иммунобласты, пролиферируют, часть клеток дифференцируется в плазматические клетки, другая становится клетками памяти. Паракортикальная зона. На границе между корковым и мозговым веществом располагается паракортикальная тимусзависимая зона. Она содержит главным образом Т-лимфоциты. Микроокружением для лимфоцитов паракортикальной зоны является разновидность макрофагов, потерявших способность к фагоцитозу, — «интердигитирующие клетки», которые обладают многочисленными пальцевидными отростками, вдавливающимися из одной клетки в другую. Ядра интердигитирующих клеток неправильной формы, светлые, с краевым расположением хроматина. В слабобазофильной цитоплазме обнаруживаются везикулы, аппарат Гольджи, гладкая эндоплазматическая сеть. Фагосомы встречаются редко. Эти клетки вырабатывают гликопротеиды, которые играют роль гуморальных факторов лимфоцитогенеза. Гликопротеиды примембранных слоев способны сорбировать и сохранять антиген на цитоплазматических мембранах и индуцировать пролиферацию Т-лимфоцитов.
Полагают, что интердигитирующие клетки приносятся лимфой в лимфатический узел из кожи и являются потомками внутриэпидермальных макрофагов. На своей мембране они могут нести антигены, полученные в коже. Из лимфоцитов здесь преобладают Т-лимфоциты-хелперы. В паракортикальной зоне происходят пролиферация Т-клеток и дифференцировка в эффекторные клетки (клетки-киллеры и др.). Посткапиллярные венулы паракортикальной зоны являются местом проникновения в лимфатический узел циркулирующих Т- и В-лимфоцитов. В некоторых случаях при разрастании паракортикальной зоны лимфатические узелки сливаются в плато. Мозговое вещество. От узелков и паракортикальной зоны внутрь узла, в его мозговое вещество, отходят мозговые тяжы, анастомозирующие между собой. В основе их лежит ретикулярная ткань, в петлях которой находятся В-лимфоциты, плазматические клетки и макрофаги. Здесь происходит созреваний плазматических клеток. Большая часть иммуноглобулинов, образуемых здесь плазматическими клетками, относится к классу иммуноглобулинов G. Внутри мозговых тяжей проходят кровеносные сосуды и капилляры, содержащие поры в эндотелии. Снаружи тяжи, так же как и лимфатические узелки, покрыты эндотелиоподобными ретикулярными клетками, лежащими на пучках ретикулярных фибрилл и образующих стенку синусов. Пространства, ограниченные капсулой и трабекулами с одной стороны и узелками и мозговыми тяжами — с другой, называются синусами, являющимися как бы продолжением приносящих лимфатических сосудов. Различают подкапсульный, или краевой, синус, располагающийся между капсулой и узелками, вокругузелковые синусы, проходящие между узелками и трабекулами, мозговые синусы, ограниченные трабекулами и мозговыми тяжами. Наружные клетки подкапсульного синуса, прилежащие к капсуле узла, расположены на базальной мембране. По строению и функции они близки к эндотелиальным клеткам, выстилающим приносящие лимфатические сосуды. Среди этих клеток встречаются фагоцитирующие — макрофаги. Внутренние эндотелиоподобные ретикулярные клетки, покрывающие лимфатические узелки коркового вещества, не имеют базальной мембраны, а лежат на пластинке ретикулярных фибрилл. Между клетками обнаруживаются щели, через которые в просвет синуса проникают лимфоциты. Клетки, выстилающие все остальные синусы, имеют аналогичное строение.
Мозговые тяжи вместе с окружающими их трабекулами и синусами образуют мозговое вещество. По синусам коркового и мозгового вещества протекает лимфа. При этом она обогащается лимфоцитами, которые поступают в нее в большем или меньшем количестве из узелков, паракортикальной зоны и мозговых тяжей. Среди свободных клеточных элементов в синусах при различных состояниях организма можно обнаружить лимфоциты, плазмоциты, свободные макрофаги; встречаются единичные зернистые лейкоциты и эритроциты. Синусы выполняют роль защитных фильтров, в которых благодаря наличию фагоцитирующих клеток задерживается большая часть попадающих в лимфатические узлы антигенов. Лимфатические узлы очень чувствительны к различным внешним и внутренним факторам. Например, под действием ионизирующей радиации быстро погибают лимфоциты в лимфатических узелках, в мозговых тяжах. При недостаточной функции гормонов коры надпочечников, наоборот, происходит разрастание лимфоидной ткани во всех органах. Регенерация. Регенерация лимфатических узлов (частичная или полная) возможна лишь при сохранении приносящих и выносящих лимфатических сосудов и прилежащей к узлу соединительной ткани. В случае частичной резекции лимфатического узла репаративная регенерация его происходит через 2—3 нед после повреждения. Восстановление начинается с пролиферации клеток ретикулярной ткани, затем появляются очаги лимфоидного кроветворения и образуются узелки. При полном удалении лимфатического узла, но при сохранении лимфатических сосудов регенерация этого органа начинается с появления большого количества очагов лимфоидного кроветворения, которые возникают из стволовых кроветворных клеток. При этом приносящие и выносящие лимфатические сосуды анастомозируют между собой в области лимфоидного очага. В результате дальнейших преобразований анастомозы сосудов оказываются погруженными внутрь лимфоидного очага и превращаются в синусы узла. Гемолимфатические узлы.
Кроме обычных лимфатических узлов, у жвачных и некоторых других млекопитающих встречаются гемолимфатические узлы, синусы которых содержат кровь. У человека такие узлы бывают редко. Обычно они располагаются в околопочечной клетчатке вдоль почечных артерий или по ходу брюшной аорты, реже — в заднем средостении. Развитие. Развитие гемолимфатических узлов весьма сходно с развитием обычных лимфатических узлов, но гемолимфатические узлы относительно долго сохраняют способность к миелопоэзу (до рождения, а иногда и в течение нескольких лет в постнатальном периоде). Строение. По величине гемолимфатические узлы, как правило, значительно меньше лимфатических. Снаружи они покрыты соединительнотканной капсулой, нередко содержащей пучки гладких мышечных клеток. Корковое вещество меньшего объема, лимфатических узелков немного; мозговые тяжи тоньше и малочисленнее. Синусы гемолимфатических узлов, особенно мозговые, бывают относительно широкими. Благодаря значительной примеси крови синусы не всегда легко отличаются от вен, проходящих в мозговых тяжах. Критерием служат ретикулярные клетки и ретикулярные волокна в просвете сосудов. Вопрос о наличии соустьев между лимфатическими сосудами и венами гемолимфатических узлов остается спорным.
Гемолимфатические узлы вырабатывают форменные элементы крови не только лимфоидного, но и миелоидного ряда.
Возрастные изменения.С возрастом гемолимфатические узлы подвергаются инволюции. Корковое и мозговое вещества замещаются жировой тканью или прорастают рыхлой волокнистой соединительной тканью
У эмбрионов и в раннем постнатальном периоде в гемолимфатических узлах, кроме клеток лимфоидного ряда, составляющих большинство клеточных элементов, обнаруживаются промиелоцшпы, миелоциты и метомиемциты, особенно эозинофильные, проэритробластыунормоциты и даже мегакариоциты. Кровь, находящаяся в синусах, частично вымывается лимфой частично подвергается разрушению: эритроциты и их фрагменты фагоцитируются макрофагами, в цитоплазме которых всегда обнаруживается железосодержащий фрагмент. Ложные могут образовываться в результате всасывания крови лимфатическими сосудами из различных очагов кровоизлияний, в связи с чем она обнаруживается в краевом синусе и приносящих лимфатических сосудах. Гемолимфатические узлы имеют приносящие лимфатические сосуды, а в просвете синусов встречаются ретикулярные клетки.
Стромальное микроокружение лимфатических узлов при ХЛЛ
Резюме
Оценка состояния стромального микроокружения лимфоидной ткани при злокачественной трансформации лимфоидных предшественников имеет принципиальное значение в раскрытии механизмов развития лимфопролиферативных заболеваний, так как на сегодняшний день твердо установлено, что стромальные клетки лимфоидных органов, в частности лимфатических узлов, играют важную роль в поддержании нормального лимфопоэза и иммуногенеза. Учитывая это обстоятельство, представляется актуальным анализ структурных особенностей непаренхиматозного компонента лимфатических узлов. Целью обзора являлся анализ литературных данных о состоянии стромы лимфатических узлов при одном из самых распространенных лимфопролиферативных заболеваний - ХЛЛ, с вовлечением в процесс лимфоидной ткани лимфоузлов.
Ключевые слова
хронический лимфолейкоз, строма лимфоузлов, микроокружение.
(статья в формате PDF. Для просмотра необходим Adobe Acrobat Reader)
открыть статью в новом окне
1. Zhang J., Li L. Stem Cell Niche: Microenvironment and Beyond // J Biol Chem. - 2008. - Vol. 283, № 15. - P. 9499 -9503.
2. Purton L.E., Scadden D.T. The hematopoietic stem cell niche // StemBook, ed. The Stem Cell Research Community. - 2008. - Vol. 15. - P. 1-14.
3. Yin T., Li L. The stem cell niches in bone // J Clin Invest. - 2006. - Vol. 116. - P. 1195-1201.
4. Scadden D.T. The stem cell niche in health and leukemic disease // Best Pract Res Clin Haematol. - 2007. - Vol. 20, № 1. - P. 19-27.
5. Ругаль В.И., Семенова Н.Ю., Бессмельцев С.С. Состояние интрамедулярной стромы больных неходжкинскими лимфомами с поражением костного мозга // Вестник гематологии. - 2011. - Т. VII, №2. - С. 36-37.
6. Semenova N., Bessmeltsev S., Rugal V. Stromal microenvironment lymph nodes in CLL // Haematologica.17 Congress EHA Amsterdam. Abstract Book. - 2012. - Vol. 97, № S1. - Р. 521.
7. Киселева М.В. Морфо-функциональное состояние стромы лимфатических узлов при некоторых лимфопролиферативных заболеваниях. Диссертация. Санкт-Петербург, 2001.
8. Tsuda H., Nishimura H., Sawada T., Takatsuki K. The roles of lymph node stromal cells in proliferation of lymphoid leukemia cells // Br.J.Cancer. - 1990. - Vol. 61. - Р. 362-364.
9. Bonato M., Pittaluga S., Tierens A. et al. Lymph node histology in typical and atypical chronic lymphocytic leukemia // Am J Surg Pathol. - 1998. - Vol. 22, № 1. - Р. 49-56.
10. Park C-S., Choi Y.S. How do follicular dendritic cells interact intimately with B cells in the germinal centre? // Immunology. - 2005. - Vol. 114. - Р. 2-10.
11. Herishanu Y., Perez-Galan P., Liu D. et al. The lymph node microenvironment promotes B-cell receptor signaling, NF-kappaB activation, and tumor proliferation in chronic lymphocytic leukemia // Blood. - 2011. - Vol. 117, № 2. - Р. 563-574.
12. Caligaris-Cappio F. Role of the microenvironment in chronic lymphocytic leukaemia // Br J Haematol. - 2003. - Vol. 123. - Р. 380-388.
13. Белянин В.Л., Цыплаков Д.Э. Диагностика реактивных гиперплазий лимфатических узлов. - СПб-Казань, 1999. - 328 с.
14. Д.Райт, Б.Эддис, Э.Леонг. Морфологическая диагностика патологии лимфатических узлов. - М.: Мед.лит., 2008. - С. 42-86.
15. Криволапов Ю.А., Леенман Е.Е. Морфологическая диагностика лимфом. - СПб.: Коста., 2006. - С. 45-48.
16. Rosati S., Kluin P.M. Chronic lymphocytic leukaemia: a review of the immunoarchitecture // Curr Top Microbiol Immunol. - 2005. - Vol. 294. - 91-107.
17. Hallek M., Cheson B.D., Cotovsky D. et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute Working Group 1996 guidelines // Blood. - 2008. - Vol. 111. - Р. 544-546.
18. Rawstron A.C., Bennett F.L., O`Connor S.J. et al. Monoclonal B-cell lymphocytosis and chronic lymphocytic leukemia // N Engl J Med. - 2008. - Vol. 359, № 6. - Р. 575-583.
19. Chiorazzi N., Rai K.R., Ferrarini M. Chronic lymphocytic leukemia // N Engl J Med. - 2005. - Vol. 352. - Р. 804-815.
20. Montillo M., Hamblin T., Hallek M. et al. Chronic lymphocytic leukemia: novel prognostic factors and their relevance for risk-adapted therapeutic strategies // Haematologica. - 2005. - Vol. 90, № 3. - Р. 391-399.
21. Cordone I., Matutes E., Catovsky D. Monoclonal antibody Ki-67 identifies B and T cells in cycle in chronic lymphocytic leukemia: correlation with disease activity // Leukemia. - 1992. - Vol. 6, № 9. - Р. 902-906.
22. Шерстнева Е.С., Исаева Н.В., Загоскина Т.П. и др. Клиническое значение внутриклеточного ИЛ-8 у больных В-клеточным хроническим лимфолейкозом // Вестник гематологии. - 2007. - Т 3, №2. - С. 49-50.
23. Леенман Е.Е., Мухина М.С. и др. Место дендритных клеток в микроокружении при лимфоме Ходжкина. - Санкт-Петербург, 2010.
24. Asplund S.L., McKenna R.W., Howard M., Croft S.H. Immunophenotype does not correlate with lymph node gistology in chronic lymphocytic leukemia/small lymphocytic lymphoma // Am J of Surg Pathol. - 2002. - Vol. 26. - Р. 624-629.
25. Bueso-Ramos C.E., Ferrajoli A., Medeiros L.J. et al. Aberrant morphology, proliferation, and apoptosis of B-cell chronic lymphocytic leukemia cells // Hematology. - 2004. - Vol. 9. - Р. 279-286.
26. Tangye S.G., Raison R.L. Human cytokines suppress apoptosis of leukaemic CD5+ B cells and preserve expression of bcl-2 // Immunol Cell Biol. - 1997. - Vol. 75. - Р. 127-135.
27. Jonathan W. Friedberg. CLL microenvironment: macro important // Blood. - 2011. - Vol. 117, № 2. - Р. 377-378.
28. Bäckman E., Bergh A-C., Lagerdahl I. et al. Thioredoxin, produced by stromal cells retrieved from the lymph node microenvironment, rescues chronic lymphocytic leukemia cells from apoptosis in vitro // Haematologica. - 2007. - Vol. 92, № 11. - Р. 1495-1504.
29. Gromer S., Urig S., Becker K. The thioredoxin system: from science to clinic // Med Res Rev. - 2004. - Vol. 24. - Р. 40-89.
30. Weistner A., Rosenwald A., Barry T.S. et al. ZAP-70 expression identifies a chronic lymphocytic leukemia subtype with unmutated immunoglobulin genes, inferior clinical outcome, and distinct gene expression profile // Blood. - 2003. - Vol. 101. - Р. 4944-4951.
31. Amin S., Parker A., Manu J. Zap 70 in chronic lymphocytic leukemia // Int J Biochem Cell Biol. - 2008. - Vol. 40, № 9. - P. 1654-1658.
32. Saitoh M., Nishitoh H., Fujii M. et al. Mammalian thioredoxin is a direct inhibitor of apoptosis signal-regulating kinase [ASK-1] // Embo J. - 1998. - Vol. 17. - Р. 2596-2606.
34. Ghia P., Circosta P., Scielzo C. et al. Differential effects on CLL cell survival exerted by different microenvironmental elements // Curr Top Microbiol Immunol. - 2005. - Vol. 294. - P. 135-145.
35. Семенова Н.Ю. Иммунная гистохимия при изучении ниши гемопоэтических стволовых клеток // Вестник гематологии. - 2011. - Т. VII, №1. - С.41.
36. Семенова Н.Ю., Ругаль В.И. Морфофункциональные особенности стромы лимфатических узлов при ХЛЛ // Вестник гематологии. - 2011. - Т. VII, №4. - С.45-46.
Микроокружение лимфоидных органов. Значение микроокружения для лимфоидных клеток
1 ГБОУ ВПО «Саратовский государственный медицинский университет им. В.И. Разумовского Минздрава России»
1. Алмазов В.А., Петрищев Н.И., Шляхто Е.В., Леонтьева И.В. Клиническая патофизиология. - М.: ВУНМЦ, 1999. - 464 с.
2. Белоцкий С.М., Авталион Р.Р. Воспаление. Мобилизация клеток и клинические эффекты. - М.: Изд-во БИНОМ, 2008. - 240 с.
5. Маянский А.Н. Лекции по иммунологии. - Изд-во Нижегородской медицинской академии.- Н. Новгород, 2003. - 200 с.
6. Нормальная физиология: учебник [Н.А. Агаджанян, Н.А. Барабаш, А.Ф. Белов и др.] / Под ред. проф. В.М. Смирнова. - 3-е изд. - М.: Издательский центр «Академия», 2010. - 480 с.
9. Типовые реакции иммунной системы на действие антигенов-аллергенов / Под общей ред. проф. Чесноковой Н.П. - Изд-во Саратов. мед. ун-та. Саратов, 2014. - 154 с.
10. Тотолян А.А. Клетки иммунной системы / А.А. Тотолян, И.С. Фрейдлин. - СПб.: Наука, 2000. - 231 с.
11. Фрейдлин И.С. Регуляторные Т-клетки: происхождение и функции / И.С. Фрейдлин / Медицинская иммунология. - 2005. - Т. 7, № 4. - С. 347-354.
12. Хаитов Р.М. Оценка иммунного статуса в норме и патологии / Р.М. Хаитов, Б.В. Пинегин // иммунология. - 2001. - № 4. - С. 4-6.
13. Ярилин А.А. Цитокины в тимусе. Биологическая активность и функции цитокинов в тимусе // Цитокины и воспаление. - 2003. - Т. 2, № 2. - С. 3-11.
14. Ярилин А.А., Донецкова А.Д. Регуляторные Foxp3+ - Т- клетки и их роль при аллергии // Росс. Аллергол. Журнал. - 2005. - № 2. - С. 22-26.
В-система лимфоцитов (лимфопоэз)
К центральным лимфоидным органам человека относят вилочковую железу (тимус), у птиц - «бурсу» (сумку Фабрициуса). У человека аналогом бурсы считают костный мозг, групповые лимфатические фолликулы кишечника (пейеровы бляшки).
В костном мозге поддерживается пул кроветворных стволовых клеток, являющихся источником образования всех клеток крови, в том числе и лимфоцитов.
Подавляющее большинство костномозговых лимфоцитов относится к бурсазависимым или В-лимфоцитам, обеспечивающим развитие иммунных или аллергических реакций гуморального типа.
В костном мозге под влиянием микроокружения стромальных костно-мозговых клеток осуществляется дифференцировка большей части В-лимфоцитов, относящихся к В2-субпопуляции клеток.
В1-субпопуляция лимфоцитов еще в эмбриональном периоде покидает костный мозг. Физиологическая регенерация В1-лимфоцитов в течение жизни человека поддерживается преимущественно в брюшной и плевральных полостях.
В1- и В2-субпопуляции лимфоцитов отличаются по своей функциональной значимости и экспонируемым на поверхности мембраны маркерам.
В процессе дифференцировки В2-лимфоцитов на их мембране экспонируются рецепторы иммуноглобулиновой природы, причем, незрелые В2-лимфоциты экспрессируют IgМ и небольшое количество молекул главного комплекса гистосовместимости класса II. По мере созревания В2-лимфоцитов на их поверхности экспрессируются молекулы иммуноглобулинов всех 5 классов. В то же время появляются рецепторы для различных компонентов комплемента и другие маркерные молекулы, в частности, СD19, СD21, СD23, СD35. Антигенчувствительными рецепторами В-лимфоцитов являются мембраносвязанный мономер IgМ, а возможно, и IgD.
Степень зрелости В-лимфоцитов определяется наличием на их мембране следующих рецепторов: антигенспецифических иммуноглобулиновой природы, к Fc-фрагменту Ig, к комплементу, к поликлональным В-активаторам, липополисахаридам и монопротеинам. В2-лимфоциты являются предшественниками клеток - плазмоцитов, обеспечивающих синтез иммуноглобулинов в ответ на антигенную стимуляцию. Необходимым условием их трансформации в клетки-продуценты антител является их взаимодействие с Т-лимфоцитами-хелперами.
В связи с этим очевидно, что В2-лимфоциты ответственны за развитие гуморального ответа на тимусзависимые антигены.
В настоящее время определена структура рецепторов В2 лимфоцитов, включающих помимо иммуноглобулина еще 4 полипептидные цепи, расположенные попарно с каждой стороны молекулы иммуноглобулина, обозначаемые как Ig-a и Ig-b. Назначение указанных пептидных компонентов заключается в проведении сигнала о связывании антигена иммуноглобулиновой частью рецептора в глубь клетки.
Как указывалось выше, дифференцировка и поддержание жизненного пула В1-лимфоцитов осуществляются за пределами костного мозга в основном в плевральной и брюшной полостях. В1-лимфоциты обеспечивают синтез антител только класса IgМ без взаимодействия с Т-хелперами. Особенностью иммуноглобулинов, продуцируемых В1-лимфоцитами, является их широкая перекрестная реактивность в ответ на воздействие бактериальных антигенов полисахаридной структуры.
Не доказана возможность реакции В1-лимфоцитов на антигены белковой природы. Характерно наличие на поверхности В1-лимфоцитов маркерной молекулы CD5, поэтому указанную субпопуляцию В-лимфоцитов нередко именуют CD5-лимфоциты.
В2-лимфоциты после созревания в костном мозге поступают в системный кровоток, а затем заселяют периферические лимфоидные органы (селезенку, лимфатические узлы, лимфоидную ткань кишечника, миндалин и других органов).
Как известно, в периферической крови в условиях нормы содержатся от 20 до 40 % лимфоцитов, причем, среди лимфоцитов периферической крови на долю В-лимфоцитов приходится лишь 20-30 %; 50-65 % составляют Т-лимфоциты и около 10 % лимфоцитов не имеют рецепторов, свойственных Т- и В-лимфоцитам; их называют «нуль-лимфоциты».
Незначительная часть лимфоцитов периферической крови имеет на своей поверхности маркеры Т- и В-лимфоцитов (D клетки).
В лимфатических узлах В-лимфоциты располагаются в тимуснезависимых зонах фолликулов, составляя лишь 35 % всех лимфоцитов. В-лимфоциты находятся в кортикальной зоне в покоящемся состоянии и образуют так называемые первичные фолликулы. На фоне антигенной стимуляции они формируют вторичные фолликулы.
Важным компонентом системы иммунопоэза является селезенка, в которой содержание В-лимфоцитов достигает 65 %, что обеспечивает быстрое накопление антителпродуцирующих плазматических клеток на фоне антигенной стимуляции.
При внутривенном введении антигена антитела образуются преимущественно в селезенке.
Лимфоидные образования червеобразного отростка, а также групповые лимфатические фолликулы - пейеровы бляшки - участвуют в синтезе антител класса IgA, тем самым обеспечивая иммунитет слизистых.
В миндалинах глоточного кольца имеются Т- и В-лимфоциты, обеспечивающие клеточный и гуморальный механизмы защиты, в частности, синтез антител класса IgA и IgG. В связи с этим тонзиллэктомия, проведенная в раннем возрасте, снижает противоинфекционную защиту глоточного кольца.
Т-система лимфоцитов
Тимус, как и костный мозг, является центральным, или первичным органом лимфоидной ткани. В составе тимуса имеются несколько долек, каждая из которых представлена эпителиальными клетками, дендритными клетками, макрофагами, лимфоцитами и другими клетками. Эпителиальные клетки тимуса синтезируют такие пептидные гормоны, как тимолин, тимозины, тимопоэтин. Крупные эпителиальные клетки коркового вещества выполняют роль «клеток-кормилиц» для лимфоцитов. Эпителиальные клетки коркового вещества имеют разветвленные отростки с большим количеством молекул главного комплекса гистосовместимости. В то же время на поверхности отростков эпителиальных клеток мозгового вещества тимуса представлены молекулы главного комплекса гистосовместимости классов II и I.
Продвигаясь из коркового вещества в мозговое, предшественники Т-лимфоцитов дифференцируются в Т-лимфоциты под влиянием тимических гормонов. В то же время секретируемые в кровь гормоны тимуса обеспечивают дозревание Т-лимфоцитов в периферических лимфатических органах - селезенке и лимфатических узлах.
Долгое время полагали, что дифференцировка всех Т-лимфоцитов происходит на территории тимуса. Однако в настоящее время обнаружены Т-лимфоциты с рецептором, большая часть которых дифференцируется экстратимически, преимущественно в стенке кишечника. В тимусе Т-лимфоциты составляют менее 0,5 % от общего числа тимоцитов.
Тимические Т-лимфоциты приобретают способность распознавать антигены в комплексе с собственными продуктами главного комплекса гистосовместимости.
Масса вилочковой железы достигает максимума к 10-12 годам, что соответствует периоду «иммунного созревания». Инволюция тимуса начинается обычно после 30 лет, но полной инволюции никогда не происходит. Касаясь особенностей дифференцировки Т-лимфоцитов в тимусе, следует отметить сохранение в клетках-предшественниках уникального репарирующего хромосомы фермента-теломеразы, что указывает на возможность многократной пролиферации Т-лимфоцита в течение жизни.
На мембране тимических Т-лимфоцитов экспрессируется специфический рецептор для распознавания антигена. В отличие от антигенраспознающего рецептора В-лимфоцитов иммуноглобулиновой природы специфический рецептор Т-лимфоцита является гетеродимером, состоящим из a- и b-цепей, обеспечивающих распознавание специфичности антигена, а также молекулы CD3. Последняя состоит из трех пептидных цепей и обеспечивает передачу сигнала о взаимодействии антигенраспознающих пептидных цепей a, b с антигеном в глубь клетки. Таким образом, полная структура рецептора Т-лимфоцитов представляется комплексом из пяти пептидов, включающих гетеродимер и молекулу CD3. Поверхностными антигенными маркерами Т-лимфоцитов являются CD3-рецепторы.
Помимо дифференцировки Т-лимфоцитов в тимусе осуществляются процессы элиминации и позитивной селекции указанных клеток. Элиминации подвергаются Т-лимфоциты, не связавшие или чрезвычайно сильно связавшие своим рецептором антигены системы МНС I и II класса, укомплектованные на клеточной мембране дендритных клеток тимуса. Такие тимоциты способны реагировать против собственных антигенов организма. Позитивная селекция проявляется в защите от апоптоза тех Т-лимфоцитов, которые связали своим антигенчувствительным рецептором антигены I и II класса МНС (HLA) со средней аффинностью.
Содержание Т-лимфоцитов в периферической крови достигает 50-65 % всех лимфоцитов крови, в грудном лимфатическом протоке - 85 % лимфоцитов.
Уровень Т-лимфоцитов в селезенке составляет 35 %, в лимфатических узлах - 65 %, где они занимают паракортикальные или тимус-зависимые зоны.
Главный комплекс гистосовместимости - группа генов, играющих важную роль не только в регуляции контроля иммунного ответа на аллотрансплантаты, но и в контроле клеточных взаимодействий.
Установлено, что система HLA (МНС) локализуется на коротком плече справа от центромеры VI аутосомной пары хромосом, включает примерно 105-106 генов. Продукты этих генов поставляются на мембраны клеток и являются антигенами гистосовместимости.
Гены, кодирующие антигены системы HLA, делят на IV класса.
Гены I класса - А, В, С, а кодируемые ими продукты - HLA-А, HLA-B, HLA-C. Гены II класса включают D-область, в которой, в свою очередь, выделяют 4 сублокуса: HLA-D, HLA-DR, HLA-DQ, HLA-DP. В состав III класса входят гены компонентов комплемента С2, С4а, С4в, пропердиновый фактор Вf. Антигены III класса присутствуют в сыворотке, на мембранах клеток их нет. К IV классу условно отнесены гены, связь которых с системой HLA требует дальнейших доказательств. Антигены HLA-системы I-II классов имеют гликопротеидную структуру. Антигены I класса присутствуют практически на всех ядросодержащих клетках организма, за исключением ранних эмбриональных и злокачественных клеток; в наибольшем количестве представлены на мембранах лимфоцитов, эпителиальных клетках, эндотелии, дендритных антигенпредставляющих клетках. Антигены А, В, С локусов системы HLA занимают примерно около 1 % клеточной поверхности.
Антигены II класса есть только на В-лимфоцитах, Т-лимфоцитах, макрофагах, дендритных антигенпредставляющих клетках.
Антигены I-II классов системы HLA выступают в качестве рецепторов для чужеродных антигенов. Антигенам I класса отводится главная роль во взаимодействии между клеткой-мишенью и Т-киллером в реакциях гиперчувствительности замедленного типа, в развитии инфекционного иммунитета. Между тем, Т-хелперы как предшественники, так и зрелые, распознают антигены II класса системы HLA в комплексе с негидролизованной частью антигена, в результате чего синтезируется интерлейкин-2. В свою очередь, интерлейкин-2 стимулирует созревание эффекторных клеток - Т-киллеров.
В связи с этим очевидна важная роль активности генов I и II классов в механизмах развития иммунных и аллергических реакций.
Следует отметить, что в системе HLA в структуре DR, т.е. генах II класса, предполагается наличие генов иммунного ответа (immune response).
HLA-DR-антигены экспонируются на В-лимфоцитах, макрофагах, эндотелии сосудов, сперматозоидах. На Т-клетках HLA-DR антигены в обычном состоянии не обнаруживаются, экспонируются лишь на фоне антигенной стимуляции.
Таким образом, HLA (МНС)- система представляет собой полиморфную систему генов и кодируемых ими продуктов- антигенов, экспонированных на мембранах различных клеток, участвующих в развитии иммунологических реакций.
Субпопуляционная характеристика T-лимфоцитов
Как указывалось выше, все Т-лимфоциты имеют на своей поверхности молекулу CD3, представленную 3 полипептидными цепями. Эти цепи армируют по бокам рецептор Т-лимфоцитов для антигена. У Т-лимфоцитов млекопитающих есть два молекулярных типа рецепторов для связывания антигена. Каждая из 4 пептидных цепей антигенсвязывающего рецептора Т-лимфоцитов кодируется отдельным геном. На каждом лимфоците есть только одна из двух пар полипептидных цепей.
В то же время, на мембранах Т- и В- лимфоцитов располагаются поверхностные антигенные маркеры, обозначаемые символом CD (Claster definion). В настоящее время идентифицировано всего свыше 130 маркерных молекул клеточных мембран лимфоцитов.
Субпопуляция CD4 Т-лимфоцитов
Характерная особенность субпопуляции CD4 Т-лимфоцита состоит в том, что антигенраспознающий рецептор представлен a- и b-полипептидными цепями. Последний способен распознавать только пептидные антигены в комплексе с молекулами МНС-II, экспрессируемыми на антигенпредставляющих дендритных клетках, В-лимфоцитах, макрофагах, эндотелии сосудов. Свободный антиген не распознается CD4-лимфоцитами.
Основными функциональными субпопуляциями CD4 лимфоцитов являются Т-хелперы (Th0, Th1, Th2, Th3) , выделена также минорная субпопуляция цитотоксических лимфоцитов с мембранным маркером CD4.
Разделение ТCD4-лимфоцитов на отдельные субпопуляции обусловлено их способностью к синтезу тех или иных лимфокинов с различной степенью интенсивности.
Ниже представлена функциональная характеристика отдельных субпопуляций CD4-лимфоцитов, используемая в нашей стране на протяжении ряда лет.
Th0 отличаются незначительной интенсивностью экспрессии генов, кодирующих цитокины всех других трех субпопуляций (Th1, Th2, Th3).
Th1 продуцируют лимфотоксин, интерлейкин-2, g-интерферон, туморнекротизирующий фактор (ФНО).
Th2 на фоне антигенной стимуляции продуцируют интерлейкин-4, интерлейкин-5, интерлейкин -9, интерлейкин-10, интерлейкин-13.
Th3 выделяют интерлейкин-4, интерлейкин-10, трансформирующий фактор роста В.
Однако, в последние годы в отечественной и зарубежной литературе предложено, наряду с представленными выше субпопуляциями Th1 и Th2, выделить субпопуляцию Th17, ответственную за развитие аутоиммунных воспалительных реакций за счет продукции провоспалительных и гемопоэтических цитокинов (TNFα, IL-6, IL-1β, IL-10, GCSF и др.
И, наконец, к числу Th относятся так называемые регуляторные Т-лимфоциты с маркерными молекулами CD4 + , CD25 + , Fox 3 , оказывающие иммуносупрессирующее действие за счет IL-10 , TGFB. Treg составляют около 10 % периферической крови, подавляют гиперактивность иммунной системы.
Следует отметить, что на поверхности всех лимфоцитов помимо антигенчувствительных рецепторов, CD-рецепторов различных категорий к малоизученным лигандам, имеются рецепторы к интерлейкинам, С3- и С4-компонентам комплемента, к Fc-фрагментам иммуноглобулинов и другим антигенам. Установлено, что продуцируемые Th цитокины обеспечивают межклеточное взаимодействие не только между отдельными субпопуляциями лимфоцитов, но и клетками мононуклеарной фагоцитирующей системы, костномозговыми клетками и другими клеточными элементами.
В настоящее время идентифицировано около 300 цитокинов, а история их изучения началась в 40-е годы 20 в. с описания биологических эффектов кахектина. Термин цитокины предложен N. Cohen в 1974 г.
Цитокины - белково-пептидные факторы с ММ от 5 до 50 кДа, участвующие в формировании и регуляции защитных реакций в ответ на действие экзогенных или эндогенных патогенов инфекционной или неинфекционной природы.
Цитокины включают следующие группы пептидов: интерлейкины, интерфероны, ростовые факторы, факторы некроза опухоли, колониестимулирующие факторы, хемокины.
К особенностям биологического действия действия цитокинов относят аутокринную стимуляцию, паракринную регуляцию межклеточного взаимодействия, а также системное действие. Цитокины обеспечивают одномоментное вовлечение иммунной, эндокринной и нервной систем в формирование реакций адаптации в ответ на действие стрессорного раздражителя.
Цитокины не являются антигенспецифическими факторами, но мониторинг показателей их содержания в крови позволяет сделать заключение об интенсивности антигенной стимуляции моноцитарно-макрофагальной и лимфоидной систем, степени активности патологических процессов или заболеваний.
На фоне антигенной стимуляции прежде всего возникает секреция цитокинов 1-го поколения с выраженной провоспалительной активностью (IL-1, IL-6, TNFα), которые индуцируют биосинтез центрального регуляторного цитокина IL-2, а затем противовоспалительных цитокинов IL-4, IL-10, TGFB и др.
Такое разделение цитокинов на про- и противоспалительные соединения далеко не всегда оправдано: так, IL-4 обеспечивает развитие IgЕ-зависимых атопических воспалительных реакций, а IL-10 подавляет продукцию ряда провоспалительных цитокинов, обеспечивающих формирование защитных реакций в зоне воспаления.
Достаточно четко определено участие Th в продукции цитокинов. Так Th1 продуцируют IFNγ, IL-2, TNFα, а Th2 - IL4, IL-5, Il-9,IL-10, IL-13.
Th17 - участники аутоиммунных реакций, синтезируют IL-17, а также GCSF, TNF, IL-6, IL-10, IL-12 и др.
Treg CD4 + , CD25 + являются источниками IL-10, TGFB, подавляющих суперэкспрессию ряда про- и противовоспалительных цитокинов.
Таким образом, в связи с гетерогенностью структуры лимфоидной ткани и многогранностью функций лимфоцитов становится очевидной значимость этих клеточных элементов в обеспечении не только специфических иммунологических механизмов защиты, развитии аллергических реакций гуморального и клеточного типов, но и в формировании синдрома системного воспалительного ответа за счет продукции цитокинов. Последние обладают способностью регулировать не только межклеточные взаимодействия в лимфоидной и моноцитарно-макрофагальной системах и, соответственно, интенсивность развития адаптивных реакций, но и дистантным действием на гипоталамо-гипофизарно-надпочечниковую систему, обеспечивая реализацию стресс-реакций, а также интенсивность продукции острофазных белков, изменение функциональной активности жизненно важных органов и систем.
ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Миграция лимфоцитов из первичных во вторичные лимфоидные ткани уже описана выше. Оказавшись во вторичных лимфоидных органах и образованиях, многие лимфоциты не остаются в них, а перемещаются из одного лимфоидного органа в другой по кровеносным и лимфатическим сосудам (рис. 3.25).
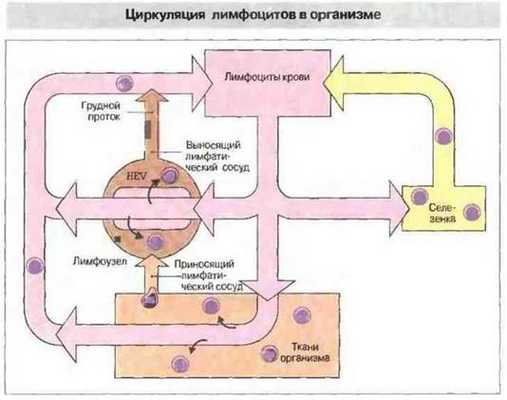
Рис. 3.25. Лимфоциты из кровотока проникают в лимфоузлы и в ЛТС через специализированный высокий эндотелий посткапиллярных венул (ВЭВ); затем они покидают лимфоидную ткань по выносящим лимфатическим сосудам и, пройдя сквозь другие лимфоузлы, возвращаются в кровоток по грудному протоку, впадающему у человека в левую подключичную вену. В селезенке лимфоциты входят в белую пульпу через краевые зоны; затем, попав в синусоиды красной пульпы, покидают орган через селезеночную вену.
Лимфоциты выходят из кровотока в лимфоидную ткань через стенки венул с высоким эндотелием. Некоторые лимфоциты переходят из кровотока в лимфоидную ткань через обычные посткапиллярные венулы, однако у большинства млекопитающих этот переход осуществляется преимущественно через специализированные участки венозного русла - венулы с высоким эндотелием, или высокоэндотелиальные венулы (ВЭВ) (рис. 3.26 и 3.27). В лимфоузлах эти сосуды находятся главным образом в паракортикальной области и иногда в корковой, но не в мозговой. Вместе с тем часть лимфоцитов, в первую очередь Т-клетки, поступают в регионарный лимфоузел из дренируемой им области но приносящим лимфатическим сосудам, а не по ВЭВ. Тем же путем в лимфоузлы поступает большинство антигенов. Венулы с высоким эндотелием обнаружены не только в лимфоузлах, но и в ЛТС, а также в тимусе.
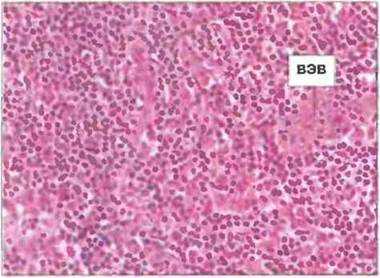
Рис. 3.26. Венула с высоким эндотелием (ВЭВ) в паракортикальной области лимфоузла. Лимфоциты выходят из кровотока через высокий эндотелий (ВЭВ) и проникают в лимфоузел. Окрашивание гематоксилином/эозином. х 200. (Фото любезно предоставлено д-ром A. Stevens и проф. J. Lowe.)
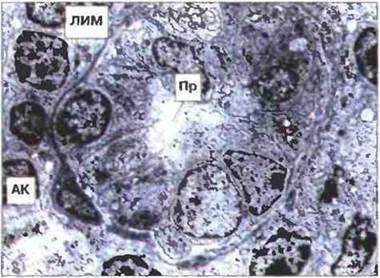
Рис. 3.27. Электронная микрофотография венулы с высоким эндотелием в паракортикальной области лимфоузла. Вблизи базальной мембраны виден лимфоцит (ЛИМ), покидающий просвет (Пр) венулы, которая снаружи частично охвачена адвентициальной клеткой (АК). х 1600.
Венулы с высоким эндотелием управляют циркуляцией лимфоцитов. Эти венулы выстланы кубическими эндотелиальными клетками, которые в отличие от покоящихся плоских клеток эндотелиальной выстилки обычных венул экспрессируют при активации разнообразные молекулы межклеточной адгезии. Один из механизмов активации клеток эндотелия опосредован локально синтезируемыми цитокинами, такими как ИФγ, ИЛ-1 и ФИО.
Эндотелий обычных венул может превращаться в кубический в участках хронического воспаления, например в коже или в синовиальных оболочках, где ВЭВ в норме отсутствуют. Появившиеся ВЭВ направляют в очаг воспаления специализированные субпопуляции Т-лимфоцитов. Активированные кубические эндотелиоциты экспрессируют ряд молекул межклеточной адгезии из суперсемейства иммуноглобулинов [1CAM-1 (CD54), 1САМ-2 (CD102) и VCAM-1 (CD106)] или из семейства селектинов, в том числе Е-селектин [ELAM-1 (CD62E)] и Р-селектин (CD62P). Р-селектин хранится втельцах Вейбеля-Палала эндотелиальных клеток кровеносных капилляров и при активации быстро доставляется на поверхность эндотелиоцита (см. гл. 5). Ведущая роль в прилипании лимфоцитов к эндотелию принадлежит CD44 — белку с мол. массой 90 кДа, который экспрессируют все лейкоциты. Предположительно, между лимфоцитами и эндотелием возникают специфические лиганд-рецепторные взаимодействия, в результате которых лимфоциты направляются в определенные ткани-мишени. Это происходит за счет экспрессии эндотелием специфичных для данного органа «адресатов», например MAdCAM-1 на эндотелиоцитах в кишечнике и VCAM-I на эндотелиальных клетках в других органах. Для избирательного органоспецифического распределения лимфоцитов важны также особые молекулы «хоминга» (от англ, homing — возврат). Например, решающее значение для возвращения лимфоцитов в лимфоидную ткань кишечника имеют их интегрины α4β7, которые связываются с алрессинами MAdCAM-1 на эндотелиальных клетках ВЭВ в пейеровых бляшках. У мышей, дефектных по гену β7, образование лимфоидной ткани кишечника существенно нарушено.
Благодаря рециркуляции любой антиген экспонируется множеству лимфоцитов. Из лимфоузлов лимфоциты возвращаются в кровоток по выносящим лимфатическим сосудам, через грудной проток и подключичную вену. Ежечасно в рециркуляцию вовлекается 1—2% лимфоцитов. В итоге этот процесс позволяет множеству антигенспецифичных лимфоцитов встретиться с соответствующими антигенами, проникшими в их микроокружение в периферических лимфоидных органах. Особая важность рециркуляции становится очевидной, если вспомнить, что лимфоидные клетки моноспецифичны, и лишь ограниченное число лимфоцитов способно распознавать каждый конкретный антиген.
В норме рециркуляция лимфоцитов через лимфоузлы происходит постоянно, но если в лимфоидную ткань ранее сенсибилизированного к тому или иному антигену животного повторно попадает данный антиген, рециркуляция прекращается приблизительно на 24 ч. Временная остановка рециркуляции обусловлена в этом случае избирательной задержкой антига (специфичных лимфоцитов в лимфоузлах, дренирующих место проникновения антигена. Например, образовавшиеся в результате контакта с антигеном лимфобласты уже не рециркулируют, оставаясь, по-видимому, в участке встречи с антигеном.
Лимфоидная ткань, ассоциированная со слизистыми оболочками, отличается как система от других лимфоидных органов в том числе и тем, что лимфоциты ЛТС возвращаются в процессе рециркуляции главным образом в эту ткань. Так, лимфоциты, стимулированные в пейеровых бляшках, проходят через регионарные лимфоузлы в кровоток, а затем возвращаются «домой», в собственную пластинку слизистой оболочки кишечника (рис. 3.28). Такая специфическая рециркуляция объясняется тем, что эти лимфоциты эспрессируют молекулы «возврата домой», которые связываются со специфическими молекулами адгезии - адресатами — на поверхности эндотелиоиитов. Адресаты экспрессирует только эндотелий венул лимфоидной ткани слизистых оболочек, но не ВЭВ обычных лимфоузлов (см. выше), что и обеспечивает избирательную рециркуляцию. По той же причине стимуляция антигеном в области слизистой оболочки (в том или ином участке организма) вызывает системное образование антител преимущественно в ЛТС.
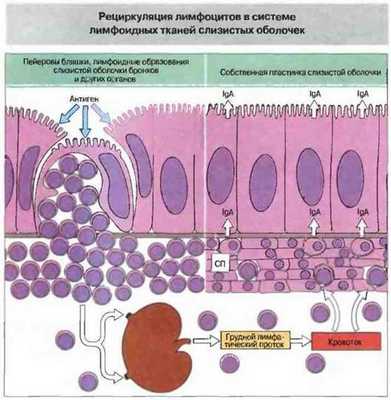
Рис. 3.28. Лимфоидные клетки, активированные антигеном в пейеровых бляшках (или в лимфоидных образованиях, ассоциированных с бронхами и другими слизистыми оболочками) через регионарные лимфоузлы и затем по грудному протоку мигрируют в кровяное русло, из которого вновь возвращаются в собственную пластинку (СП) эпителия кишечника и других слизистых оболочек, вблизи места антигенного примирования или на значительном удалении от него. Таким образом лимфоциты, стимулированные на слизистой оболочке в одной из частей тела, могут избирательно распределяться по системе ЛТС. Избирательность расселения достигается благодаря экспрессии особых молекул межклеточной адгезии на лимфоцитах и на клетках ВЭВ слизистых оболочек.
Вопросы для размышления
■ Почему млекопитающие нуждаются в столь высокоспециализированной лимфоидной системе, тогда как более примитивные животные способны выживать без нее?
■ Насколько важна рециркуляция лимфоцитов в системе лимфоидной ткани слизистых оболочек и какие молекулы обеспечивают ее избирательность?
■ В чем сходство и различия между лимфоидной тканью слизистых оболочек и остальными органами лимфоидной системы? Важна ли для выживания одна из этих частей лимфоидной системы более, чем другая?
■ Чем лимфоидная система отличается от любой другой системы организма, например от дыхательной или репродуктивной? (Возможно, для ответа вам понадобится освежить знания о различных системах организма по учебнику физиологии.)
■ Какие вспомогательные клетки присутствуют в лимфоидных тканях и в чем их функции? В чем состоят функции первичных и вторичных лимфоидных органов и образований?
Butcher Е.С., Picker L.J. 1996. Lymphocyte homing and homeostasis. Science 272: 6—66.
Hogg N.. Berlin C. 1995. Structure and function of adhesion receptors in leukocyte trafficking. Immunol. Today 16. 327-330.
Kuby J. 1997. Immunology. 3rd edn. Cells and Organs of the Immune System. New York: W.H. Freeman and Co. 47-83.
Playfair J.H.L. Immunology at a Glance. 6th edn.
Oxford: Blackwell Scientific Publications. 1996.
Roitt I.M. Essential Immunology. 9th edn. Oxford: Blackwell Scientific Publications, 1997.
1. Белянин В.Л., Цыплаков Д.Э. Диагностика реактивных гиперплазий лимфатических узлов. - СПб - Казань, 1999. - 328 с.
2. Райт Д., Эддис Б., Леонг Э. Морфологическая диагностика патологии лимфатических узлов. - М.: Мед. лит., 2008. - С. 42-86.
3. Криволапов Ю.А., Леенман Е.Е. Морфологическая диагностика лимфом. - СПб.: Коста., 2006. - С. 45-48.
4. Шерстнева Е.С., Исаева Н.В., Загоскина Т.П. и др. Клиническое значение внутриклеточного ИЛ-8 у больных В-клеточным хроническим лимфолейкозом // Вестник гематологии. - 2007. - Т. 3, № 2. - С. 49-50.
5. Леенман Е.Е., Мухина М.С. и др. Место дендритных клеток в микроокружении при лимфоме Ходжкина. - СПб, 2010.
6. Киселева М.В. Морфо-функциональное состояние стромы лимфатических узлов при некоторых лимфопролиферативных заболеваниях. Диссертация. Санкт-Петербург, 2001.
7. Semenova N., Bessmeltsev S., Rugal V. Stromal microenvironment lymph nodes in CLL // Haematologica.17 Congress EHA Amsterdam. Abstract Book. - 2012. - Vol. 97, № S1. - Р. 521.
8. Семенова Н.Ю., Ругаль В.И. Морфофункциональные особенности стромы лимфатических узлов при ХЛЛ // Вестник гематологии. - 2011. - Т. VII, № 4. - С.45-46.
9. Tsuda H., Nishimura H., Sawada T., Takatsuki K. The roles of lymph node stromal cells in proliferation of lymphoid leukemia cells // Br.J.Cancer. - 1990. - Vol. 61. - Р. 362-364.
11. Caligaris-Cappio F. Role of the microenvironment in chronic lymphocytic leukaemia // Br J Haematol. - 2003. - Vol. 123. - Р. 380-388.
В функциональном отношении клетки лимфоидной системы могут быть разделены на три типа: стволовые кроветворные клетки, клетки-предшественники первичных лимфоидных органов, клетки вторичных лимфоидных органов. По темпу клеточного обновления лимфоидная ткань занимает одно из первых мест в организме. Развитие лимфоидных клеток не прекращается всю жизнь - это необходимо для “подстройки” иммунитета к постоянно изменяющейся иммунологической ситуации.
Особенность всей лимфоидной системы состоит в том, что в течение всей жизни ее органы объединяют интенсивные клеточные миграции, в ходе которых осуществляется пролиферация и дифференцировка иммунокомпетентных клеток. Эти процессы происходят при условии упорядоченной миграции клеток-предшественников из одних органов кроветворной системы в другие, включая костный мозг, тимус и периферические лимфоидные органы. Стоит отметить, что дифференцировка общих предшественников в разных направлениях (например, в Т- и В-клетки) требует различных несовпадающих местных условий.
Основная функция лимфоузлов состоит в обеспечении взаимодействия антигена, который поступает туда по афферентным лимфатическим сосудам, с иммунокомпетентными клетками. В ходе иммунного ответа в структуре лимфоузла происходит ряд изменений, благодаря которым обеспечивается возможность для наибольшего количества лимфоцитов проконтактировать с антигеном и между собой. Структуры лимфатического узла создают условия для направленного, а не случайного взаимодействия разных субпопуляций лимфоцитов и для развития стимулированных антигеном клонов иммунокомпетентных клеток.
Группой экспертов ВОЗ (Котье и соавт., 1973) предложено выделять в лимфоузле следующие функциональные зоны и структуры:
1. Кортикальный слой с залегающими в нем фолликулами.
2. Паракортикальную зону.
3. Мозговое вещество с мозговыми тяжами.
Фолликулы и мозговые тяжи являются тимуснезависимыми областями (В-зона), паракортикальная зона - тимусзависимой областью (Т-зона). В-зависимые зоны - это зоны лимфоидных фолликулов лимфоузлов, селезенки, аппендикса, миндалин, лимфоидных агрегатов кишечника. Т-зависимые зоны - это паракортикальная зона лимфоузлов, периартериальные зоны селезенки, интерфолликулярные зоны в аппендиксе, миндалинах, пейеровых бляшках.
Структура и клеточный состав лимфоузлов человека исследовались многими авторами. Непаренхиматозный компонент лимфатических узлов представлен стромальными образованиями, выполняющими, в основном, опорную и трофическую функцию - фибробласты, фиброциты, миоциты, эндотелиоциты сосудов, нейральные элементамы. Также непаренхиматозные структуры лимфоидной ткани включают в себя группу ретикулярных клеток и экстрацеллюлярный матрикс, которые играют ключевую роль в формировании лимфоидного микроокружения, отвечающее за развитие лимфоидных клеток. Остальные элементы стромы играют вспомогательную роль.
Термин ретикулярные клетки носит собирательный характер и включает 4 основных морфофункциональных типа: гистиоцитарные, дендритные, интердигитирующие и фибробластические ретикулярные клетки. На светооптическом уровне с использованием рутинных окрасок дифференцировать указанные типы достаточно сложно. Определение принадлежности к определенному варианту требует гистохимических и иммуногистохимических методов анализа.
Гистиоцитарные ретикулярные клетки имеют вид фиксированных макрофагов, почти неотличимых от гистиоцитов и макрофагов костномозгового происхождения, особенно находящихся в лимфатических фолликулах.
Дендритные ретикулярные клетки преобладают в корковом веществе, главным образом в центрах первичных и вторичных лимфатических фолликулов, являясь антиген-представляющей субпопуляцией клеточных элементов лимфатического узла. Эти клетки способны длительное время удерживать антиген на своей поверхности, регулируя образование В-клеток памяти и предшественников антителоформирующих плазмоцитов. Кроме того, дендритные ретикулярные клетки образуют правильную сеть в первичных и вторичных лимфоидных фолликулах. Реализации этих функций способствуют длинные отростки цитоплазмы, которые соединены с такими же отростками соседних дендритных ретикулярных клеток. Они имеют характерные ядра: часто они двуядерные или многоядерные. Рутинными методами окраски дендритные отростки не идентифицируются, но часто они хорошо визуализируются на срезах, окрашенных на IgM, маркирующий иммунные комплексы на поверхности отростков. Их отростки также выявляются окрашиванием на CD21 и CD23. Дендритные клетки помимо длинных отростков, которыми они соединяются между собой, имеют отчетливо различимые замыкательные комплексы - десмосомы, отличающие эти клетки от интердигитирующих ретикулярных клеток.
Интердигитирующие ретикулярные клетки в наибольшем количестве присутствуют в паракортикальной зоне, определяя стимуляцию Т-клеточного ответа. Интердигитирующие ретикулярные клетки имеют бледно окрашивающиеся ядра овальной или удлиненной формы, иногда с инвагинациями довольно сложной конфигурации, и широкую цитоплазму. Эти клетки имеют большое сходство с клетками Лангерганса, но не содержат гранул Бирбека. При иммуноцитохимическом исследовании в них определяется белок S-100 и антиген HLA-DR. Интердигитирующие ретикулярные клетки, в отличие от дендритных, соединяются между собой и другими клеточными элементами при помощи пальцевидных отростков цитоплазмы, входящих между такими же структурами других клеток.
Фибробластические ретикулярные клетки характеризуются наличием в цитоплазме волокнистых структур, идущих на формирование ретикулиновых волокон.
Как и в костном мозге, система кровеносных сосудов является важным компонентом лимфатического узла, поскольку из крови в его ткань и обратно осуществляется интенсивная миграция лимфоцитов. Проникшие в узел через его ворота кровеносные сосуды ветвятся в мозговом и корковом слоях. В корковом слое располагаются мелкие венулы, в которые переходят капилляры. Эндотелий посткапиллярных венул построен из высоких клеток, в их цитоплазме часто обнаруживаются лимфоциты. В ходе миграции лимфоциты проходят как между эндотелиальными клетками, так и через их цитоплазму, затем через базальную мембрану и попадают в ткань глубокого кортекса. Эмиграция лимфоцитов из лимфоузлов осуществляется через эфферентные лимфатические сосуды, по которым лимфоциты возвращаются в кровоток. В этих взаимодействиях участвуют селектины, CD44 и интегрины, экспрессированные на лимфоцитах.
Имеется небольшое количество работ по морфологии некоторых клеточных элементов лимфоидного микроокружения при лимфопролиферативных заболеваниях. Так, при исследовании морфологических особенностей дендритных ретикулярных клеток при неходжкинских лимфомах отмечено изменение ультраструктуры ретикулярных клеток. При этом, происходило уменьшение количества лимфоцитов, контактирующих с дендритными ретикулярными клетками, увеличение межклеточных расстояний, перестройки плазматических мембран, изменения ультрацитохимических свойств клеток, в частности, снижение или полное отсутствие реакции на кислую фосфатазу. Отмечено уменьшение количества дендритных ретикулярных клеток в зависимости от гистологического варианта лимфом. Так, лимфомы фолликулярного типа сопровождаются увеличением количества ретикулярных клеток, в то время как при диффузных лимфомах отмечено уменьшение их числа и значительные деструктивные изменения. Данные о вовлечении в патологический процесс дендритных ретикулярных клеток при неходжкинских лимфомах были подтверждены при иммуногистохимических и экспериментальных исследованиях.
Известно, что строма реализует свое воздействие на гемопоэтические клетки, как путем непосредственных межклеточных контактов, так и опосредованно, с помощью гуморальных механизмов. При лимфоидных неоплазиях происходят значительные нарушения в системе межклеточных взаимодействий. Клетки микроокружения являются главным источником цитокинов - пептидов, обеспечивающих регуляцию пролиферации, дифференцировки и апоптоза гемопоэтических клеток. Отмечено, что роль цитокинов в патогенезе лимфопролиферативных заболеваний весьма значительна. К примеру, известно, что пролиферативная активность стромы лимфоузлов у больных неходжкинскими лимфомами не зависит от морфологического варианта заболевания, а связана с продукцией цитокинов, в частности ФНО-α стромальными элементами лимфатических узлов. У пациентов с хроничесским лимфолейкозом повышена секреция стромой лимфатических узлов ИЛ-6 и ИЛ-4 in vitro, что отражает участие данных веществ в патогенезе заболевания. Применение химиотерапии снижает продукцию ИЛ-4 in vivo, что может быть благоприятным фактором, учитывая особенность ИЛ-4 ингибировать апоптоз опухолевых клеток. Также были показаны различия в экспрессии внутриклеточного ИЛ-8 клетками опухолевого клона и нормальными В-лимфоцитами, что имеет клиническое значение.
Работы, посвященные изучению дендритных клеток (ДК) при некоторых формах опухолей, показали, что количество и иммунофенотип ДК, их распределение в опухолевой и непораженной ткани отражаются на прогнозе этих новообразований. ДК считаются наиболее важным фактором, определяющим состав лимфоидной популяции и влияющим на регулирование функциональной активности лимфоидных клеток. Они могут создавать не только противоопухолевые, но и проопухолевые стимулы.
Согласно данным Цыплакова Д.Э. и соавт. (1995), исследовавших влияние кровеносного микроциркуляторного русла на клеточный иммунный ответ в лимфатических узлах, регионарных к злокачественным опухолям, сосудистое русло лимфатических узлов играет двоякую роль. С одной стороны, на ранних этапах развития опухоли происходит активация Т-клеточных иммунных реакций с усилением рециркуляции лимфоцитов через посткапиллярные венулы и превращением их путем бласттрансформации в цитотоксические Т-киллеры, что, вероятно, сдерживает процесс метастазирования. С другой стороны, на более поздних стадиях опухолевого роста изменения сосудистой стенки и циркуляторные расстройства сопровождаются отложением внутри- и внесосудистого фибрина, затрудняя тем самым рециркуляцию лимфоцитов и, следовательно, приводят к уменьшению числа трансформированных Т-киллеров, способных уничтожать попадающие в лимфатический узел опухолевые клетки, что, по мнению авторов, предопределяет процесс метастазирования. При появлении в лимфатических узлах метастазов фибрин уже способствует их закреплению в лимфоидной ткани, а также изолирует от цитотоксического действия оставшихся в небольшом количестве Т-эффекторов.
На сегодняшний день накопилось достаточное количество данных, свидетельствующих о роли стромального микроокружения в становлении лимфопролиферативных заболеваний. При этом отсутствует целостное представление о структурных особенностях лимфоидной стромы при нарушениях пролиферации и дифференцировки В-лимфоцитов. Дальнейшее изучение лимфоидного микроокружения, его морфофункциональных особенностей, адгезивных взаимодействий с использованием современных методов структурного анализа может способствовать поискам новых методов лечения гемобластозов и лимфопролиферативных заболеваний.
Читайте также:
- Секреция кишечного пищеварительного сока. Состав кишечного пищеварительного сока
- КТ, МРТ при периневральной опухоли в жевательном пространстве
- Рекомендации по скринингу рака эндометрия (РЭ)
- Общие сведения о наследственных синдромах периодической лихорадки
- Возраст развития опухолей средостения. Частота злокачественных опухолей средостения
