Морфология, стадии и развитие асептического некроза полулунной кости - болезни Кинбека
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Болезнь Кинбека (Kienböck disease) — это проблема в запястье, связанная с нарушением кровоснабжения полулунной кости. Полулунная — это одна из тех восьми маленьких косточек, которые составляют запястье. В запястье выделяют два ряда: тот, что ближе к предплечью называют проксимальным, другой, который ближе к пальцам — дистальным. Полулунная кость находится в самом центре проксимального ряда, она неразрывно связана с ладьевидной костью, которая соединяет оба ряда запястья. Согласно биомеханическим исследованиям порядка 70% нагрузки на лучезапястный сустав ложатся именно на полулунную кость.
Чем вызвана болезнь Кинбека?
По всей видимости, нет одной точной причины для нарушения кровоснабжения, что приводит к некрозу полулунной кости. Болезнь Кинбека вызвана многими факторами. Эти факторы могут быть связаны с притоком крови (артериальные проблемы), с оттоком крови (венозные проблемы) или особенностями строения костей. Варианты строения костей, предрасполагающие к болезни Кинбека, — это относительное укорочение локтевой кости и особенности строения самой полулунной кости. Некоторые случаи могут быть ассоциированы с подагрой, серповидно-клеточной анемией или церебральным параличом.
Травма, единичная или регулярно повторяющаяся, также может вызвать некроз полулунной кости. В целом, все же, не существует достоверных данных о том, что болезнь Кинбека может считаться профессиональным заболеванием. Следует заметить, что нарушение кровоснабжения полулунной кости накладывает свои особенности на лечение травм запястья и безусловно влияет на прогноз.
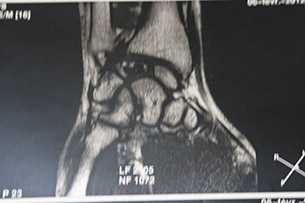
Некроз полулунной кости на МРТ
Как поставить диагноз?
Большинство пациентов жалуются на боль запястье, усиливающуюся при нагрузке. При осмотре определяется болезненность в проекции полулунной кости. Первые шаги для диагностики болезни Кинбека — это сбор анамнеза, осмотр и рентгенограммы. Иногда требуются дополнительные исследования, наиболее информативным из которых является магнитно-резонансная томография. Именно МРТ позволяет выявить нарушение кровоснабжения полулунной кости, когда еще нет изменений на рентгенограммах. Также могут применяться компьютерная томография или остеосцинтиграфия.
Что происходит с кистью при этой патологии?
Болезнь Кинбека может иметь различное и непредсказуемое течение. Иногда болезнь удается выявить на самой ранней стадии, когда есть только боль, отек и нормальные рентгенограммы. По мере прогрессирования болезни асептический некроз полулунной кости прогрессирует, рентгенологические и биомеханические изменения становятся более очевидными. В дальнейшем в появляются маленькие переломы, кость распадается на фрагменты и полностью разрушается. После разрушения полулунной кости меняется биомеханика движений, что вызывает чрезмерную нагрузку на суставы запястья и их повреждение. Однако стоит помнить, что далеко не все случаи болезни Кинбека неизменно прогрессируют от начальной стадии до завершающей с тяжелыми нарушениями в запястье.
Лечение болезни Кинбека
Если удается выявить болезнь на ранней стадии возможно выполнение относительно малотравматичной операции с хорошим прогнозом — это укорочение лучевой кости. Благодаря этой процедуре снимается чрезмерное давление с полулунной кости и есть большая вероятность восстановления ее кровоснабжения. При уже случившемся коллапсе (разрушении) полулунной кости ее можно заместить костным трансплантатом, искусственным имплантом или удалить. Кстати, несмотря на кажущуюся травматичность операции по удалению всего проксимального ряда запястья, она может давать неплохие функциональные результаты. На последней стадии заболевания при тотальном поражении запястья рассматриваются варианты эндопротезирования или артродеза кистевого сустава.
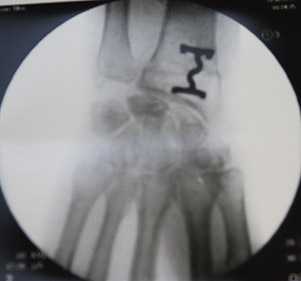
Снимок после укорочения лучевой кости
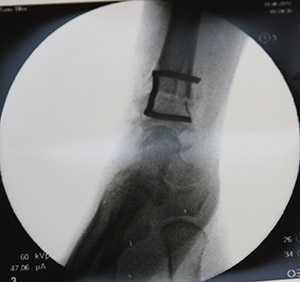
Элегантный способ фиксации остеотомии скобкой.
Консервативное лечение и физиотерапия не оказывают влияния на течение болезни, однако могут уменьшить боль и улучшить функцию кисти.
Изготовление индивидуального фиксатора позволяет снять нагрузку с поврежденного сустава и тем самым уменьшает боль, связанную с болезнью Кинбека.
Что следует ожидать человеку с диагнозом болезнь Кинбека?
Результаты лечения напрямую зависят от стадии заболевания и от скорости его прогрессирования. Оценить скорость развития болезни и эффективность лечения можно только по прошествии нескольких месяцев. В некоторых случаях различные способы лечения могут сочетаться, и не всегда одной операции достаточно.
Случай из практики
Пациентка 26 лет пришла на прием с болью в запястье. До нашей встречи жалобы были уже больше полугода. К моменту осмотра болезнь Кинбека была уже диагностирована, разрушение полулунной кости отчетливо видно на рентгене, стадия 3б.
Коллеги из крупной и уважаемой больницы успели рекомендовать девушке оперативное лечение в объеме тотального артродеза лучезапястного сустава. Конечно, эта операция дает прогнозируемый и уверенный результат: болей в лучезапястном суставе не будет. Но не будет и самого лучезапястного сустава, а значит и сгибания/разгибания в кисти.
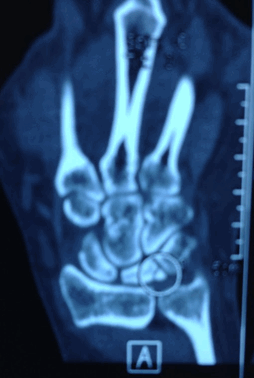
На компьютерной томографии были признаки фрагментации полулунной кости.
Мы подробно все обсудили и решили не делать тотальный артродез лучезапястного сустава, ведь потерять движения в крупном суставе в возрасте 26 лет — отнюдь не самая радужная перспектива.
При обнаружении некроза полулунной кости почти всегда я рекомендую начинать с остеотомии лучевой кости. Это относительно безопасная и весьма эффективная операция. Она заключается в пересечении лучевой кости (пилой или остеотомом) с последующей ее фиксацией. При этом сам кистевой сустав и кости запястья даже не затрагиваются. Плюсы в том, что мы, не вмешиваясь в поврежденный сустав, можем значительно улучшить его функцию.
Как же так? Не может быть! Дело в том, что мы действительно не знаем, почему остеотомия работает при болезни Кинбека.
Такой способ лечения болезни Кинбека был открыт случайно: пациент сломал лучевую кость, а после ее сращения сказал своему врачу, что у него прошли боли в кисти, которые он испытывал предыдущий год. Рентгеновский снимки подтвердили изменения в полулунной кости. С тех пор врачи специально делают такие “переломы” с лечебной целью. Есть две теории: биомеханическая — укорочение лучевой кости снимает давление с полулунной, вторая теория сосудистая, скорее магическая — декортикация соседней с поврежденной кости, снимает внутренний отек и тем самым улучшает кровоснабжение всего сегмента. Есть даже доктор из Аргентины, который просто делает отверстие в лучевой кости и докладывает об улучшении течения некроза полулунной кости.
Вот именно подобная мистика и отсутствие четкого простого объяснения механизма работы этой методики заставляет докторов сомневаться в эффективности остеотомии лучевой кости для лечения болезни Кинбека.
Посмотрим на это с другой стороны: что мы теряем в случае неудачи? В общем-то ничего, кроме времени. Сам кистевой сустав остается нетронутым и доступным для любых других вариантов оперативных пособий: кровоснабжаемых трансплантатов, артродезов, различных имплантов, удаления проксимального ряда.
Главное предостережение, которое я хочу дать докторам и пациентам, который столкнулись с болезнью Кинбека: опасайтесь так называемой операции Гранера — это заведомо порочная и неэффективная методика. Сама идея остеотомии и дистракции головчатой кости противоречит всем современным знаниям о биомеханике кистевого сустава. Да, опора головчатой кости на фасетку полулунной возможна, но для этого не надо тянуть ее вниз, для этого надо удалить соседние ладьевидную и трехгранную, как в тетрисе. Удаление проксимального ряда запястья — распространенная процедура, которая может использоваться в том числе и для лечения болезни Кинбека.
Вернемся к нашей героине, которая столкнулась с проблемой запястья накануне свадьбы. За месяц до намеченной даты была выполнена операция — остеотомия лучевой кости.
Болезнь Кинбека
Болезнь Кинбека (англ. kienbocks disease) относится к аваскулярному некрозу полулунной кости запястья, известному как лунатомаляция.
Клинически значимая анатомия
Проксимальный запястный ряд срединно-запястного сустава в значительной степени отвечает за движение запястья, в отличие от относительно фиксированного дистального запястного ряда. Полулунная кость является центральной костью в проксимальном ряду, и она сочленяется с ладьевидной, головчатой, трехгранной, а иногда и крючковидной костью. Более проксимально, полулунная кость является компонентом лучезапястного сустава, и она также сочленяется с локтевой костью через треугольный фиброхрящевой комплекс (ТФХК). Следует отметить, что почти 10 % аксиально-лучевой/локтевой/кистевой нагрузки передается через ТФХК и впоследствии на локтевую кость, а 35 % - через лучеполулунное сочленение [1].
Эпидемиология
Болезнь Кинбека является вторым по распространенности типом аваскулярного некроза костей запястья, которому предшествует только аваскулярный некроз ладьевидной кости [1].
Возрастное распределение больных болезнью Кинбека зависит от пола.
- Это состояние наиболее распространено в доминирующем запястье молодых взрослых мужчин, где оно, по-видимому, связано с повторяющейся нагрузкой на полулунную кость.
- У женщин болезнь Кинбека обычно возникает в среднем возрасте и поровну распределяется между доминирующим и недоминирующим запястьем [2].
Этиология
Существует значительная связь между отрицательным лучелоктевым индексом и болезнью Кинбека. Лучелоктевой индекс относится к непропорционально укороченной локтевой кости по сравнению с лучевой [1].
Изображение 2: Взаимосвязь между радиальной длиной и лучелоктевым индексом. Радиальная длина - это мера от дистального конца локтевой кости до лучевого шиловидного отростка. Когда лучелоктевой индекс нейтрален, радиальная длина должна составлять от 9 до 12 мм.
Причинно-следственную связь трудно доказать, однако эффективность декомпрессивных процедур, таких как укорочение лучевой кости или удлинение локтевой кости, в облегчении боли и предотвращении дальнейшего коллапса полулунной кости является благоприятной. В целом, отрицательный лучелоктевой индекс присутствует в качестве предрасполагающего фактора примерно в 75 % случаев болезни Кинбека [2].
Клиническая картина
Типичными симптомами болезни Кинбека являются связанные с активностью боли в запястье и слабость, часто сопровождающиеся припухлостью дорсально вокруг полулунной кости. Жалобы в большинстве случаев являются давними и постепенно увеличиваются. Боль может быть описана от легкой и случайной до сильной и изнуряющей. Диапазон движений сустава почти всегда уменьшается с потерей сгибания и разгибания. По сравнению с незатронутой стороной наблюдается потеря силы хвата [3]. Симптомы чаще всего проявляются в доминирующем запястье, и может присутствовать травма в анамнезе [4].
Изображение 3: Рентгеновский снимок правого запястья, показывающий болезнь Кинбека. Присутствует свернутая полулунная кость.
Длина двух костей предплечья, локтевой кости и лучевой кости, обычно не одинакова. Мы можем разделить длину между дистальными суставными поверхностями лучевой кости и локтевой кости, называемую лучелоктевым индексом. Он может быть отрицательным, положительным или нейтральным. Отрицательный лучелоктевой индекс указывает на то, что дистальная суставная поверхность локтевой кости расположена более проксимально, чем лучевой кости, положительный лучелоктевой индекс указывает на стадию, когда дистальная суставная поверхность локтевой кости расположена более дистально по сравнению с поверхностью лучевой кости, и, наконец, нейтральный лучелоктевой индекс означает, что локтевая и лучевая поверхности находятся на одном уровне [5].
Стадирование болезни Кинбека имеет важное значение для планирования лечения и подразделяется по морфологии.
- Стадия 1: Нормальная рентгенограмма, изменение интенсивности сигнала на МРТ.
- Стадия 2: склероз полулунной кости на рентгенографии с линиями переломов или без них. Форма полулунной кости нормальная.
- Стадия 3: Коллапс суставной поверхности полулунной кости. 3A: с сохраненным выравниванием запястья и высотой. 3B: с сгибанием ладьевидной кости и потерей высоты запястья. 3C: с сопутствующим корональным переломом
- Стадия 4: Стадия 3B + лучезапястный или срединно-запястный артроз [1].
Дифференциальный диагноз
Рентгенологическая визуализация, такая как МРТ и компьютерная томография, в случае болезни Кинбека, как правило, является единственным способом поставить правильный диагноз [6].
- Ушиб полулунной кости/Острый перелом: Этот тип поражения с трудом можно отличить от болезни Кинбека I стадии. Наличие в анамнезе острых эпизодов тяжелой травмы кисти, вероятно, является единственной характеристикой острого перелома лучевой кости, который можно отделить от перелома Кинбека [7].
- Лучезапястный синдром ущемления
- Ушиб кости: Может быть трудно отличить раннюю стадию болезни Кинбека на МРТ. История недавних травм и сопутствующих травм запястья/кисти в этом случае помогла бы в постановке диагноза
- Артрит: Изменения сигнала костного мозга при воспалительных или дегенеративных артритах могут имитировать изменения, наблюдаемые при болезни Кинбека. Отличительные особенности включают демографические данные, клиническую картину и отсутствие дефекта локтевой кости при артрите [1].
Диагностические процедуры
Болезнь Кинбека - это клинический и визуализирующий диагноз. Как рентгенография/компьютерная томография, так и магнитно-резонансная томография (МРТ) являются высокоспецифичными. Однако МРТ является наиболее чувствительной и выявляет рентгенологически скрытые случаи.
- Рентгенография
- Компьютерная томография
- МРТ: Объявлена лучшей методикой визуализации для Кинбека. Она чрезвычайно чувствительна и специфична для выявления остеонекроза [8]. МРТ наиболее важна на ранних стадиях заболевания (особенно на I стадии, когда простые рентгенограммы показывают норму) [7][9].
Обследование
Как правило, на тыльной стороне запястья видна некоторая припухлость, наряду с синовитом [14]. Пациент может испытывать определенную боль, расположенную в ямке распятия, которую можно увидеть между сухожилиями разгибателя пальцев и лучевого разгибателя пальцев [15]. Кроме того, жесткость и болезненность могут развиться над полулунной костью [14].
При физикальном осмотре диапазон движений довольно чувствителен, особенно при вытягивании запястья. Такие движения, как сгибание и разгибание, сокращаются, иногда в сочетании с постепенной потерей силы захвата [15][14]. Однако вращение предплечья все еще сохраняется.
Лечение
Целью лечения болезни Кинбека является облегчение боли, сохранение подвижности запястья и сохранение силы захвата. Лечение болезни Кинбека зависит от стадии заболевания и его причинных факторов.
- Стадия I всегда лечится шинированием или гипсовой иммобилизацией.
- Стадию II также можно лечить иммобилизацией, если некроз является неполным.
- Стадии II с полным некрозом, III и IV требуют операции "выравнивания суставов", возможно, в сочетании с сосудистой костной пластикой или переносом ветвей из соседних артерий.
- Более поздние стадии с коллапсом лучевой кости и вторичным дегенеративным артрозом запястья также могут потребовать проксимальной карпэктомии или межпальцевого артродеза.
Изображение 5: Карпэктомия левой руки после проксимального ряда
Лечение может улучшить симптомы и функциональные возможности, не влияя на результаты визуализации на поздних стадиях [1].
Физиотерапия
Физиотерапия не является распространенным методом лечения этого заболевания. Очевидно, что существует слишком мало исследований по физиотерапии этого состояния. Результаты исследований:
- Комбинированная трансфузия костного мозга (медицинская), низкоинтенсивное импульсное ультразвуковое исследование внешняя фиксация (хирургия). У большинства пациентов в этом исследовании боль в запястье улучшилась до безболезненного уровня, улучшилось сгибание запястья и увеличилась средняя сила захвата. Этот метод может быть использован в качестве менее инвазивной хирургической альтернативы при болезни Кинбека по сравнению с хирургическими процедурами [16].
- В исследовании сравнивались различные методы лечения после операции. Одна группа проходила лечение в соответствии с протоколом лечения, состоящим из кинезиотерапии, электротерапии, термотерапии, массажа, терапевтических мероприятий и домашнего руководства. Другая группа проходила лечение в неспециализированных отделениях кистевой терапии и получала только термотерапию и упражнения без прямого руководства терапевта. После терапии 90 % первой группы были удовлетворены результатами лечения, как и 66 % второй группы. Также группа 1 показала лучшие результаты по боли, мышечной силе, силе хвата, диапазону суставных движений предплечья для движений пронации и супинации, диапазону суставных движений запястья при отведении и приведении и выполнению мануальных функций [17].
- Исследование представляет собой тематическое исследование, в котором сообщается о 23-летнем профессиональном игроке в бадминтон, у которого были ограниченные и болезненные движения запястья, и впоследствии ему был поставлен диагноз болезни Кинбека. В этом исследовании пациент лечился хирургическим путем. В течение пяти недель после операции запястье постоянно шинировалось, использовались местные противовоспалительные средства и лед. В течение следующих восьми недель растяжка постепенно увеличивалась. Регулярный массаж мышц-разгибателей и сгибателей запястья также проводился для снижения тонуса, что может повлиять на функцию суставов. Через четыре месяца после операции запястье имело безболезненный диапазон разгибания 0-45° и диапазон сгибания 0-70°. Пациент начал свою обычную тренировочную программу с лентой на запястье для поддержки. Это тематическое исследование, поэтому результаты не могут быть экстраполированы на все группы пациентов [18].
Прогноз
Болезнь Кинбека неизменно прогрессирует, и разрушение суставов происходит в течение 3-5 лет после начала заболевания.
Прогноз зависит от:
- Функциональная стадия: Чем больше объем жизнеспособной кости, тем лучше прогноз [6].
- Отрицательнлучелоктевой индекс: Чем больше отрицательный лучелоктевой индекс, тем тяжелее заболевание и тем больше вероятность его прогрессирования.
- Возраст на момент постановки диагноза: Пациенты, которым поставлен диагноз в более старшем возрасте, с большей вероятностью имеют запущенную стадию заболевания и с большей вероятностью прогрессируют.
Важно отметить, что тяжесть симптомов не всегда коррелирует с морфологической стадией [1].
Болезнь Кинбека ( Асептический или аваскулярный некроз полулунной кости , Остеохондропатия полулунной кости )
Болезнь Кинбека - это неспецифический остеонекроз полулунной кости. Вначале протекает бессимптомно или сопровождается неинтенсивными болями при физических нагрузках. Затем на фоне разрушения кости образуется патологический перелом. Боли, ограничение движений нарастают, мышцы предплечья постепенно атрофируются. В исходе болезни формируется деформация полулунной кости различной степени выраженности. Диагноз выставляется на основании данных опроса, осмотра, рентгенографии, КТ, МРТ. Лечение оперативное - частичный артродез, реваскуляризация, костная пластика.
МКБ-10

Общие сведения
Болезнь Кинбека (остеохондропатия полулунной кости, асептический или аваскулярный некроз полулунной кости) - заболевание, сопровождающееся изолированным разрушением кости запястья, участвующей в образовании лучезапястного сустава. Встречается достаточно редко, обычно страдают люди 20-40 лет, занимающиеся ручным физическим трудом. Поражается преимущественно ведущая рука (у правшей - правая, у левшей - левая), в 10% случаев патология носит двухсторонний характер. Мужчины заболевают чаще женщин.

Причины
Этиология болезни Кинбека окончательно не установлена. Австрийский рентгенолог, имя которого с 1910 года носит это заболевание, считал дистрофические изменения полулунной кости отдаленным последствием травмы. Причиной заболевания также называли циркуляторные расстройства на фоне эмболии и повреждений сосудов. В настоящее время патологию рассматривают как полиэтиологическую, в качестве провоцирующих факторов указывают:
- повторяющиеся микротравмы при значительных нагрузках на кисть;
- компрессионные переломы полулунной кости;
- нераспознанные патологические переломы вследствие кистозных дефектов кости;
- врожденное укорочение локтевой кости (анатомический вариант нормы), из-за которого повышается нагрузка на полулунную кость.
Из-за прохождения типичных стадий аваскулярного некроза патологию относят к остеохондропатиям. Вместе с тем, специалисты подчеркивают, что болезнь Кинбека отличается от большинства остеохондропатий, поскольку развивается у взрослых людей, а не у детей или подростков, признаки восстановления кости после завершения процесса отсутствуют.
Патогенез
Дегенеративные изменения кости провоцируются ухудшением локального кровоснабжения вследствие перегрузки и травматических повреждений. Вокруг очага дегенерации образуется зона отека, что также негативно влияет на местное кровообращение. Процессы разрушения превалируют над процессами восстановления. Из-за поражения значительной части кости даже при небольших травматических воздействиях возникают патологические переломы.
На фоне импрессионных переломов продолжает снижаться прочность костной ткани. На суставной поверхности образуются участки некроза и фиброзного перерождения, деформации усугубляются. Кость фрагментируется. Суставные поверхности утрачивают конгруэнтность, прогрессируют артрозные изменения. Степень окончательной деформации варьируется от незначительной до грубой.
Классификация
В своем развитии болезнь Кинбека проходит пять стадий, типичных для асептического некроза кости у взрослых пациентов. Эти стадии до определенной степени условны, поскольку разрушение и дегенеративное перерождение кости являются непрерывным динамическим процессом, однако они помогают выбрать оптимальную тактику лечения и оценить прогноз заболевания. В основе классификации лежат рентгенологические изменения:
- 1 стадия - рентгенограммы без изменений.
- 2 стадия - формируются импрессионные переломы. Кость умеренно деформируется, появляются очаги затемнения с нарушением структурного рисунка.
- 3 стадия - вовлекается хрящ, субхондральная пластинка. Деформация прогрессирует, суставная щель расширяется.
- 4 стадия - полулунная кость разделяется на несколько вертикальных фрагментов.
- 5 стадия - на снимках выявляются признаки деформирующего артроза.
Симптомы болезни Кинбека
В отдельных случаях наблюдается бессимптомное течение, патология выявляется случайно. В типичном варианте начало может быть постепенным или внезапным. В первом случае дискомфорт и неинтенсивные боли без четкой локализации появляются еще до перелома полулунной кости. Болезненные ощущения провоцируются значительными физическими нагрузками, исчезают в покое. Во втором случае первый болевой приступ отмечается на фоне патологического перелома.
Боль достаточно острая, но не достигает такой степени, как при обычных переломах. Ограничение движений незначительное. Затем интенсивность и продолжительность болей постепенно нарастают. При пальпации зона наибольшей болезненности определяется по средней линии преимущественно на тыльной стороне запястья. Там же выявляется локальная отечность. Пациент щадит руку при бытовых и профессиональных нагрузках. Объем движений в суставе уменьшается. Прогрессируют атрофические изменения мышц предплечья. Возможно появление хруста при движениях.
Осложнения
Из-за нарастающих изменений формы и структуры полулунной кости ладьевидная кость уходит в положение стойкого подвывиха. Со временем у пациентов с болезнью Кинбека развивается деформирующий артроз лучезапястного сустава. У некоторых больных возникает синдром карпального канала. Из-за сопутствующего поражения сухожилий могут образовываться их патологические разрывы.
Диагностика
Диагноз устанавливается врачом-ортопедом или ревматологом на основании жалоб, данных объективного обследования и дополнительных исследований. Решающее значение при определении характера патологии играют визуализационные методики. Диагностическая программа включает:
- Физикальный осмотр. В первые 2-3 месяца (до появления изменений на рентгенограммах) диагностика может быть затруднительной, что обусловлено неспецифичностью и нечеткостью симптоматики. Указанием на болезнь Кинбека на этой стадии может стать локальная болезненность в проекции полулунной кости и усиление болевого синдрома при интенсивных движениях в лучезапястном суставе.
- Рентгенография лучезапястного сустава. Является основным методом исследования. Рентгенологическая картина соответствует стадии заболевания. Обнаруживаются изменения формы, структуры кости, импрессионные переломы, фрагментация или признаки артроза.
- КТ и МРТ лучезапястного сустава. Назначаются в сомнительных случаях на ранней стадии для выявления изменений, не отображающихся на обычных рентгенограммах.
Клиническую дифференцировку в травматологии осуществляют с глубокими гигромами лучезапястного сустава, стенозирующим лигаментитом, кистой полулунной кости, повреждением связок. С учетом особенностей рентгенологической картины болезнь Кинбека различают с опухолями, туберкулезным оститом, ревматоидным поражением костей запястья.
Лечение болезни Кинбека
Консервативная терапия
Консервативное лечение показано на начальной стадии болезни, до образования импрессионных переломов. Рекомендована иммобилизация с использованием ортеза, тутора, гипсовой или полимерной повязки сроком на 1 месяц с последующим проведением реабилитационных мероприятий, включающих ЛФК, массаж и физиотерапию.
В ряде случаев такой подход позволяет восстановить кровоснабжение полулунной кости за счет улучшения кровотока по старым сосудам или реваскуляризации. На поздних стадиях и при неблагоприятном течении болезни консервативная терапия неэффективна, она лишь временно уменьшает болевой синдром и несколько замедляет разрушение полулунной кости.
Хирургическое лечение
С учетом стадии и выраженности патологического процесса могут применяться следующие оперативные вмешательства:
- Реваскуляризация. Осуществляется путем перемещения небольшого васкуляризованного костного трансплантата. Рекомендована при отсутствии грубых нарушений формы полулунной кости, сохранении функциональности сустава.
- Костная пластика. Производится при обширном разрушении кости с использованием аутотрансплантата и костной крошки.
- Низведение фрагмента головчатой кости. Выполняется после удаления поврежденной полулунной кости, Г-образной остеотомии головчатой кости.
- Эндопротезирование. Иногда разрушенную полулунную кость замещают эндопротезом, однако такая операция возможна только при последующем отказе от тяжелого физического труда.
Кроме того, пациентам с болезнью Кинбека проводят частичные артродезы. Полный артродез лучезапястного сустава используется редко, показан только при тяжелом деформирующем артрозе. В послеоперационном периоде осуществляют иммобилизацию в течение 1,5-3 месяцев, проводят реабилитационные мероприятия.
Прогноз
Прогноз при болезни Кинбека сомнительный, точный исход предсказать сложно. Полное восстановление отмечается редко даже в случае раннего начала лечения. Наблюдается значительная вариативность течения болезни - у одних пациентов формируются тяжелые деформации, у других изменения на протяжении долгих лет остаются умеренными или незначительными. Оперативные вмешательства в большинстве случаев обеспечивают хороший или удовлетворительный отдаленный результат.
Профилактика
Из-за неясной этиологии однозначных профилактических рекомендаций не существует. С учетом взаимосвязи между травмами, хроническими перегрузками кисти и болезнью Кинбека пациентам советуют оптимизировать нагрузку на конечность, соблюдать необходимые меры предосторожности в быту и на производстве.
2. Метод хирургического лечения аваскулярного некроза полулунной кости/ Волотовский А.И., Беспальчук А.П. и др. - 2011.
Асептический некроз головки бедренной кости
Асептический некроз головки бедренной кости - это омертвление участков костного мозга головки бедра с развитием локального остеопороза и остеонекроза вследствие расстройств кровоснабжения. Проявляется нарастающими болями, ограничением движений, нарушением функции тазобедренного сустава. Может стать причиной инвалидизации больного. Диагностируется на основании жалоб, данных объективного осмотра, результатов рентгенографии, КТ, МРТ и сцинтиграфии. В процессе лечения применяется медикаментозная терапия, физиотерапия, ЛФК, ортопедические мероприятия, корригирующая остеотомия. При значительном разрушении головки осуществляется эндопротезирование.


Асептический некроз головки бедра (АНГБК) у взрослых пациентов впервые был описан как самостоятельное заболевание в конце 30-х годов прошлого века. Некоторые исследователи пытались объединить данную патологию с болезнью Пертеса у детей, но в последующем было установлено, что в детском возрасте некроз протекает гораздо более благоприятно. Заболевание чаще выявляется в возрасте 25-40 лет, в половине случаев имеет двухсторонний характер. У 15% пациентов обнаруживается аналогичное асептическое поражение других эпифизов длинных трубчатых костей (головки плеча, мыщелков бедра). Соотношение мужчин и женщин составляет примерно 8:1.

Асептический некроз головки бедра рассматривается как полиэтиологическое заболевание. Непосредственной причиной разрушения бедренной кости является локальная ишемия тканей в результате тромбоза на фоне нарушения кровообращения вследствие патологии сосудов или внешнего сдавления. Основными факторами, вызывающими формирование тромба, считаются:
- Интоксикации. По данным ученых, 65% от общего количества случаев АНГБК вызывается алкоголизмом и продолжительным приемом глюкокортикоидных и химиотерапевтических средств.
- Лучевые поражения:лучевая болезнь, лучевая терапия.
- Болезни системы кроветворения.
- Сосудистая патология: атеросклероз.
- Заболевания соединительной ткани.
- Внутренние болезни: панкреатит, почечная недостаточность, печеночная недостаточность, синдром Кушинга.
- Прочие причины: трансплантация органов, онкологические поражения, декомпрессионная болезнь, аллергические реакции.
Доля асептического некроза, возникшего по неустановленным причинам (идиопатического), колеблется от 15 до 20%.
Пусковым механизмом развития асептического некроза является значительное ухудшение или полное прекращение локального кровообращения, вызывающее гибель участка костномозговой ткани. Вокруг зоны некроза образуется отек. Начинается процесс восстановления, однако из-за продолжающихся нарушений кровотока, обусловленных парезом или спазмом мелких сосудов, местных застойных явлений и агрегации клеточных компонентов крови репарация оказывается неэффективной.
Область омертвления не уменьшается, а распространяется на соседние участки. Из-за отека, асептического воспаления, расширения сосудов и венозного стаза повышается внутрикостное давление, что еще больше усугубляет имеющиеся нарушения. В процесс вовлекаются субхондральные отделы головки, формируется зона остеопороза, а затем - остеонекроза.
Снижение механической прочности кости становится причиной импрессионных микропереломов, которые, в свою очередь, ведут к дальнейшему уменьшению прочности костной ткани. Из-за нарушения питания и отсутствия адекватной опоры на костные структуры гиалиновый хрящ при асептическом некрозе быстро разрушается и замещается фиброзной тканью.
Дальнейшее течение болезни в значительной степени определяется локализацией пораженного участка. При вовлечении верхненаружной зоны процесс обычно продолжает прогрессировать, завершается коллапсом головки и быстро развивающимся тяжелым коксартрозом. При некрозе медиальных участков с меньшей нагрузкой в некоторых случаях наблюдается спонтанное выздоровление.
Наиболее рациональной с практической точки зрения считается классификация некроза головки бедренной кости с учетом стадии развития патологии. Такой подход позволяет уточнить прогноз, выбрать оптимальную врачебную тактику, определить необходимость и вид хирургического вмешательства. При этом принимают во внимание, что асептическое омертвление кости является динамическим процессом без четко определяемого момента перехода одной стадии в другую.
Специалисты в области травматологии и ортопедии разработали несколько вариантов систематизации асептического некроза, включающих от 3 до 7 стадий. В России обычно используется классификация, предложенная С. А. Рейнбергом и основанная на особенностях рентгенологической картины:
- 1 стадия (дорентгеновская). Рентгенологические изменения отсутствуют. Может протекать бессимптомно или сопровождаться болями, атрофией мышц и ограничением движений. Результаты гистологического исследования свидетельствуют о наличии локальных некротических изменений в костном мозге и губчатом веществе.
- 2 стадия (импрессионных переломов). На рентгенограмме выявляется гомогенное затемнение, отсутствие структурного рисунка в зоне поражения, локальные уплотнения и снижение высоты головки, расширение суставной щели. Обнаруживается большое количество микропереломов.
- 3 стадия (секвестрации). Головка становится еще более плоской, теряет нормальные контуры, суставная щель продолжает расширяться. На снимках визуализируются отдельные фрагменты кости различного размера и формы, не имеющие нормальной структуры. Определяется утолщение и укорочение шейки бедра.
- 4 стадия (репарации). Фрагментированность костного вещества исчезает. Головка бедренной кости нормально контурируется, однако ее структура еще не восстановлена. В костном веществе иногда просматриваются кистовидные очаги просветления.
- 5 стадия (деформирующего артроза). Костная структура восстанавливается, сохраняется деформация головки, возникшая на 2 и 3 стадии. Головка плоская, расширенная, не совпадает по форме с суставной впадиной. На ее поверхности видны остеофиты, в кости выявляются кистозные полости, образовавшиеся на фоне дистрофических процессов.
Симптомы
Клиническая картина асептического некроза может формироваться постепенно или развиваться внезапно, для двухстороннего процесса характерно более быстрое прогрессирование симптоматики в сравнении с односторонним. Первым проявлением становятся боли в области паха, реже - бедренной кости или пояснично-крестцовой зоны, не сопровождающиеся отеком, локальной или общей гипертермией.
Сначала болевой синдром возникает периодически, затем становится постоянным, его выраженность все больше усиливается. На 3 стадии возможны ночные боли. Иногда интенсивность болевых ощущений настолько велика, что пациенты с асептическим некрозом на несколько дней полностью теряют способность к опоре и ходьбе. После кратковременного усиления симптоматика ослабевает, больные возвращаются к привычному режиму нагрузок.
Нарушения движений усугубляются в течение нескольких месяцев или лет. Вначале снижается объем ротации, ограничивается отведение. В последующем уменьшается амплитуда движений при сгибании и разгибании бедра. По мере развития болезни нарастают атрофические изменения в бедренных и ягодичных мышцах. При осмотре определяется уменьшение объема бедра, уплощение ягодицы. Общая продолжительность заболевания составляет 1,5-2 года.
Тяжесть остаточных явлений после завершения репарации может существенно варьироваться. В исходе возможна контрактура с вынужденным положением и укорочением конечности. При двухсторонних поражениях нередко выявляются тяжелые коксартрозы, сопровождающиеся значимым нарушением функции опоры и движений. Перечисленные нарушения становятся причиной инвалидизации больных, требуют проведения объемных хирургических вмешательств.
Диагностику асептического некроза костно-суставных структур осуществляют врачи-ортопеды. Раньше основным методом было рентгенологическое исследование, не позволяющее обнаруживать ранние патологические изменения. В настоящее время наряду с традиционной рентгенографией при постановке диагноза применяются современные методики, чувствительность которых на ранней стадии достигает 90-100%. План обследования включает следующие методы визуализации:
- Рентгенография тазобедренного сустава. Для повышения информативности используются специальные укладки по Лаунштейну. Вначале на снимках просматриваются участки со сниженной плотностью под субхондральной костью, придающие поверхностным частям головки вид «яичной скорлупы». Затем становится видна деформация головки и некротический очаг в виде плотной тени, окруженной более светлым ободком. В исходе визуализируются изменения, характерные для деформирующего артроза.
- КТ тазобедренного сустава. На начальной стадии при выполнении диагностической процедуры определяются нарушения структуры и плотности костного вещества. В последующем обнаруживается некротический дефект. Метод позволяет уточнить размеры и точное расположение очага деструкции кости, выявленного на рентгеновских снимках.
- Сцинтиграфия. При проведении статического исследования отмечается гиперфиксация радиофармпрепарата в очаге поражения. Интенсивность накопления зависит от активности процесса и степени нарушений кровоснабжения. Динамическая сцинтиграфия на начальных этапах свидетельствует об увеличении, на поздних - о снижении всех фаз кровотока.
Дифференциальная диагностика
Дифференциальную диагностику асептического поражения головки осуществляют с деформирующим артрозом тазобедренного сустава, остеохондрозом, туберкулезным кокситом, посттравматической остеодистрофией. Для исключения остеохондроза используют данные рентгенографии позвоночника. При подозрении на туберкулезный процесс выполняют туберкулиновые пробы, назначают рентгенографию ОГК.
Для различения асептического некроза, артроза и остеодистрофии иногда производят измерение внутрикостного давления: при коксартрозе оно снижено по сравнению с нормой, при остеодистрофии отмечается незначительное или умеренное, при некрозе - выраженное увеличение показателя.

КТ тазобедренных суставов. Множественные кистовидные участки остеонекроза в головке обеих бедренных костей и в подвздошной кости слева.
Лечение асептического некроза головки бедра
В зависимости от стадии процесса и выраженности патологических изменений лечение асептического некроза в зоне головки бедренной кости может быть консервативным или оперативным, производиться амбулаторно или в условиях ортопедического стационара. Этиотропное воздействие предусматривает исключение или уменьшение влияния факторов, спровоцировавших некротические изменения в головке бедра.
Ортопедический режим
Рекомендуется изменение нагрузки на тазобедренный сустав. Мнения относительно продолжительности применения дополнительных приспособлений среди специалистов разнятся. Одни ортопеды предлагают длительную разгрузку сустава сроком до полугода. Другие указывают на высокую вероятность последующей мышечной атрофии, ограничения движений и нарушения двигательного стереотипа.
При варианте лечения с ранней активизацией больным рекомендуют использовать костыли или трость на протяжении 3-4 недель, а потом воздерживаться от инерционных нагрузок (бега, прыжков) и соблюдать режим дозированной физической активности, включающий непродолжительную ходьбу, занятия на велотренажере, специальные комплексы ЛФК.
Консервативное лечение
Используется медикаментозная и немедикаментозная терапия. Лекарственные средства назначаются длительными курсами. План лечения асептического некротического поражения включает в себя:
- Нормализацию кровообращения. На ранних стадиях осуществляется патогенетическое лечение, предусматривающее назначение сосудистых средств сроком до 3 месяцев для устранения ишемии, восстановления реологических свойств крови, предотвращения образования микротромбов.
- Обезболивание. Для устранения болевого синдрома выполняют периартикулярные блокады, используют НПВС общего и местного действия.
- Восстановление костной ткани. Применяют препараты кальция в сочетании с медикаментами, содержащими этидроновую кислоту, в течение 8 месяцев.
Программу консервативной терапии дополняют короткими курсами хондропротекторов с интервалом 6-12 месяцев. На 3 и 4 стадии в сустав вводят стекловидное тело и кислород. Физиолечение включает лазеротерапию и КВЧ.
Может проводиться в ранние и отдаленные сроки. Целью ранних вмешательств является минимизация разрушения головки бедренной кости, предупреждение развития осложнений. В отдаленном периоде используют методики, направленные на коррекцию стойких нарушений.
- Вмешательства на головке бедра. Для предотвращения коллапса головки выполнят раннюю декомпрессию области поражения. Наиболее эффективной разновидностью декомпрессии считается туннелизация, предусматривающая удаление одного или двух участков цилиндрической формы диаметром до 10 мм с их замещением ауто- или аллотрансплантатом.
- Операции на нижележащих отделах. Еще одним способом уменьшить нагрузку на пораженную зону является корригирующая остеотомия в межвертельной зоне бедренной кости, которая также проводится в раннем периоде заболевания.
- Восстановление функции конечности. При коллапсе головки требуется эндопротезирование сустава. При наличии противопоказаний к установке эндопротеза показан артродез с фиксацией сустава в функционально выгодном положении.
Тактика послеоперационного ведения пациента определяется сроками проведения и видом вмешательства. После декомпрессии рекомендуются режим, определяемый стадией заболевания. После эндопротезирования применяется ранняя активизация, показана ходьба с костылями в течение 2 месяцев. После артродеза требуется иммобилизация на протяжении 3-4 месяцев.
Прогноз при некротическом поражении головки бедренной кости определяется объемом, локализацией и двухсторонним или односторонним характером поражения. Наиболее неблагоприятный исход наблюдается при двустороннем некрозе верхнелатеральных участков головки - после завершения процесса репарации нередко отмечается значительное нарушение движений в суставе, существенно страдает опорная функция, происходит инвалидизация.
При одностороннем асептическом некрозе внутренней зоны остаточные явления менее выражены, чаще сохраняется трудоспособность. После выполнения эндопротезирования объем движений и опорность конечности восстанавливаются. После проведения артродеза отмечается стойкая нетрудоспособность, движения в суставе отсутствуют.
К мерам первичной профилактики относят исключение или минимизацию воздействия провоцирующих факторов. Необходимо отказаться от употребления алкоголя, контролировать продолжительность приема глюкокортикоидов. Важно предотвращать травмы тазобедренного сустава, проводить своевременное лечение заболеваний, способствующих развитию некроза.
Профилактика негативных последствий патологии включает продуманный режим двигательной активности соответственно периоду болезни, своевременное проведение декомпрессии для предупреждения коллапса головки бедра. Для предупреждения развития инвалидизирующих осложнений пациентам следует соблюдать рекомендации врача относительно использования специальных средств, не перегружать больную конечность.
3. Асептический некроз головки бедренной кости: варианты консервативного лечения и результаты/ Шушарин А.Г., Половинка М.П., Прохоренко В.М.// Фундаментальные исследования - 2014 - №10
4. Асептический некроз головки бедренной кости (обзор литературы)/ Антонов А.В., Воловик В.Е.// Кафедра травматологии и ортопедии - 2017 - №3
Болезнь Келлера
Болезнь Келлера — это хроническое дистрофическое заболевание костей стопы, приводящее к их асептическому некрозу. Заболевание может протекать с поражением ладьевидной кости (болезнь Келлера I) или плюсневых костей (болезнь Келлера II). Болезнь Келера проявляется отечностью и болями в стопе в области пораженной кости, усилением болевого синдрома при ходьбе и его прогрессированием с течением времени, изменением походки и хромотой при одностороннем поражении. Характерным признаком является отсутствие воспалительных изменений пораженной области. Диагностика заболевания основывается на данных рентгенологического исследования. Лечение состоит в снятии нагрузки с пораженной стопы путем ее иммобилизации и последующей восстановительной терапии (лечебная гимнастика, физиотерапия, массаж).

Заболевание, описанное Келлером в 1908 году, получило название болезнь Келлера I. Оно представляет собой асептический некроз ладьевидной кости, а болезнь Келлера II — асептический некроз головок костей плюсны. Дегенеративно-дистрофические процессы в костной ткани, лежащие в основе данной патологии, послужили основанием для ее причисления к группе остеохондропатий, куда также входят болезнь Кальве, болезнь Тиманна и болезнь Шляттера. Страдают преимущественно пациенты детского и подросткового возраста.

Как и этиология других остеохондропатий, факторы, вызывающие болезнь Келлера, пока окончательно не изучены. Большинство исследователей склонны считать основной причиной некротических изменений костной ткани нарушение ее питания за счет расстройств местного кровоснабжения. Расстройства васкуляризации кости, в свою очередь, могут быть обусловлены следующими состояниями:
- врожденные особенности кровообращения пораженной области;
- наличие продольного или поперечного плоскостопия;
- ношение неудобной или слишком тесной обуви;
- повторные травмы: ушибы, подвывихи или вывихи стопы, переломы костей стопы и т. п.
Роль способствующих факторов в развитии болезни Келлера могут играть различные обменные нарушения и эндокринопатии (гипотиреоз, сахарный диабет, ожирение).
Из-за локальных нарушений кровоснабжения в губчатом веществе ладьевидной или плюсневой кости формируется участок некроза. Затем начинается процесс репарации, однако из-за сохраняющихся расстройств кровоснабжения, которые усугубляются местным отеком, спазмом или парезом мелких артерий, полноценного восстановления костной ткани не происходит. Зона некроза постепенно распространяется до кортикального слоя.
В результате снижения механической прочности кости образуются импрессионные (вдавленные) патологические переломы. В последующем участки некроза замещаются соединительной тканью. Начинаются интенсивные процессы репарации, которые через 1-3 года с момента начала заболевания завершаются восстановлением костной ткани. При этом кость в различной степени деформируется из-за предыдущих вдавленных переломов и дефрагментации.
В своем развитии заболевание проходит определенные фазы, установление которых необходимо для подбора оптимальной тактики лечения. В отечественной травматологии и ортопедии применяют следующий вариант стадирования патологии:
- 1 стадия (некроза) - асептическое разрушение кости, обусловленное сосудистыми нарушениями.
- 2 стадия (импрессионных переломов) - возникновение патологических переломов.
- 3 стадия (фрагментации) - кость разделяется на фрагменты.
- 4 стадия (репарации) - отмечается интенсивный рост соединительной ткани и ее постепенное замещение костной тканью, не имеющей нормальной структуры.
- 5 стадия (консолидации) - структура костной ткани восстанавливается с сохранением формы кости или развитием деформаций разной степени тяжести.
Симптомы болезни Келлера
Болезнь Келлера I
Чаще диагностируется у мальчиков 3-7 лет. Патология характеризуется появлением на тыльной стороне стопы ближе к ее внутреннему краю припухлости, обусловленной отечностью тканей этой области. Отсутствие покраснения кожи и местного повышения температуры в зоне отека свидетельствует в пользу невоспалительного характера происходящих изменений.
Отмечается болезненность пораженной зоны при прощупывании и при нагрузке на стопу, утомляемость ребенка при ходьбе. Чтобы избежать боли, дети ставят ногу с упором на наружный край стопы. Может наблюдаться хромота. Со временем боль усиливается и приобретает постоянный характер, не исчезая даже при полном покое. Болезнь Келлера I длится в среднем около года и может привести к стойкой деформации ладьевидной кости.
Болезнь Келлера II
Обычно выявляется у девочек 10-15 лет. Заболевание проявляется припухлостью и болезненностью в области пораженной плюсневой кости. Чаще всего встречается поражение II и III плюсневых костей. Возможен двусторонний характер патологических изменений. При этом симптомы воспаления не наблюдаются. Болезнь Келлера начинается с появления неинтенсивного болевого синдрома, поначалу проявляющегося лишь при нагрузке на передние отделы стопы.
Характерно усиление боли при прощупывании пораженной области и во время ходьбы, особенно по неровному грунту или в обуви со слишком тонкой и мягкой подошвой. Со временем пациенты начинают жаловаться на то, что боль в стопе становится постоянной, более интенсивной и сохраняется даже в покое. Отмечается укорочение пальца, который примыкает к головке подвергшейся некрозу плюсневой кости. Объем движений в суставе, сформированном пораженной плюсневой костью, ограничивается. Болезнь Келлера II протекает в среднем в течение 2-3 лет.
В число возможных осложнений болезни Келлера входят артрозы мелких суставов стопы. Возможно ограничение движений. У некоторых пациентов возникают боли, обусловленные деформацией свода стопы и патологическим перераспределением нагрузки. Типично усиление болевого синдрома после нагрузки (стояния, длительной ходьбы). Все перечисленное может накладывать определенные ограничения при выборе профессии, возможности заниматься различными видами спорта и пр.
Болезнь Келлера диагностируется клинически и рентгенологически. Детский ортопед выясняет жалобы и анамнез заболевания, проводит объективный осмотр. Основным методом исследования является рентгенография стопы:
- Болезнь КеллераI. На рентгенограммах вначале отмечается остеопороз ладьевидной кости, вызванный асептическим разрушением ее губчатого вещества. Затем выявляется уплотнение точек окостенения, сплющивание и уплотнение ладьевидной кости. Позже наблюдается дефрагментация ладьевидной кости, т. е. ее распад на отдельные костные фрагменты в результате прогрессирования некротического процесса.
- Болезнь КеллераII. На снимках выявляются патологические изменения в головке пораженной плюсневой кости. В зависимости от срока заболевания может обнаруживаться остеопороз, уплотнение и деформация головки плюсневой кости, ее патологический перелом и дефрагментация.
При первом типе болезни Келлера может потребоваться дифференцировка с индивидуальными особенностями окостенения ладьевидной кости (многоядерным, замедленным), туберкулезным поражением. Второй тип заболевания дифференцируют с маршевой стопой, остеофитами, костным туберкулезом, инфекционным артритом и последствиями переломов.

Лечение болезни Келлера
Лечение патологии длительное (до полного восстановления структуры кости), обычно проводится в амбулаторных условиях, включает в себя специальный охранительный режим, иммобилизацию, ЛФК и физиотерапию. Медикаментозное лечение назначается при наличии показаний. Хирургические вмешательства требуются редко.
На начальной стадии болезнь Келдера лечится путем разгрузки пораженной некрозом кости, что позволяет предотвратить прогрессирование некроза и остановить деформацию костных структур. Это достигается ограничением физической нагрузки и иммобилизацией стопы. В последующем нагрузку постепенно увеличивают. В периоде восстановления возрастает значимость немедикаментозных методов лечения. Программа терапии включает следующие мероприятия:
- Иммобилизация. При болезни Келлера I на стопу накладывается гипсовая повязка, моделирующая продольный свод стопы. Ее ношение рекомендовано в течение 4-8 недель. При болезни Келлера II иммобилизация достигается ношением гипсового сапожка в течение 1 месяца. В этот период пациент может передвигаться при помощи костылей.
- Ограничение нагрузки. После снятия гипса для уменьшения нагрузки на стопу во время ходьбы необходимо пользоваться специальными супинаторами. Рекомендуется избегать прыжков, длительной ходьбы и бега.
- Лекарственная терапия. Для купирования болевого синдрома применяются анальгетики. Для устранения отека могут назначаться противовоспалительные средства. Для нормализации метаболических процессов используются витаминные комплексы, медикаменты, содержащие кальций и фосфор.
- Физиотерапия. После периода иммобилизации проводят комплекс физиотерапевтических и гимнастических лечебных мероприятий, направленных на восстановление функции стопы. Лечение болезни Келлера осуществляется с применением массажа стопы, рефлексотерапии, магнитотерапии, грязелечения, ножных ванн и лечебной физкультуры.
Правильно проведенная терапия приводит к сокращению сроков протекания болезни Келлера, предупреждает необратимую деформацию кости и способствует полному восстановлению функции стопы.
Если, несмотря на проводимое консервативное лечение, развивается деформирующий остеоартроз пораженного сустава, то рассматривается вопрос об оперативном лечении. Методом выбора является артропластика суставов стопы, предусматривающая ремоделирование суставных поверхностей, иссечение участков фиброза.
КТ стопы. Болезнь Келера-2 (остеохондропатия головки 3-й плюсневой кости: снижение высоты головки вследствие остеонекроза, с наличием свободного костно-хрящевого фрагмента).
Прогноз и профилактика
Прогноз определяется временем начала лечебных мероприятий, соблюдением рекомендаций врача-ортопеда, наличием остаточных явлений. Предупредить болезнь Келлера у ребенка поможет правильный подбор обуви, которая должна соответствовать размеру ноги, быть удобной и не слишком жесткой. Следует избегать травм стопы, а при их получении незамедлительно обращаться к травматологу и следовать всем его рекомендациям. Поскольку болезнь Келлера связана с плоскостопием, то его своевременное лечение также имеет профилактическое значение.
Читайте также:
