Нейропатии при ВИЧ. Нейропатия при цитомегаловирусной системе. Плексит плечевого сплетения.
Добавил пользователь Skiper Обновлено: 01.02.2026
Плечевой плексит — поражение плечевого нервного сплетения, проявляющееся болевым синдромом в сочетании с двигательной, сенсорной и вегетативной дисфункцией верхней конечности и плечевого пояса. Клиническая картина варьирует в зависимости от уровня поражения сплетения и его генеза. Диагностика осуществляется неврологом совместно с другими специалистами, она может потребовать проведения электромио- или электронейрографии, УЗИ, рентгенографии, КТ или МРТ плечевого сустава и области сплетения, исследования биохимии крови, уровня С-реактивного белка и РФ. Вылечить плечевой плексит и полностью восстановить функцию сплетения возможно лишь в течение первого года, при условии устранения причины заболевания, проведения адекватной и комплексной терапии и реабилитации.

Общие сведения
Плечевое сплетение сформировано ветвями нижних шейных спинномозговых нервов С5-С8 и первого грудного корешка Th1. Нервы, исходящие из плечевого сплетения, иннервируют кожу и мышцы плечевого пояса и всей верхней конечности. Клиническая неврология различает тотальное поражение сплетения — паралич Керера, поражение только верхней его части (С5-С8) — проксимальный паралич Дюшена-Эрба и поражение только нижней части (С8-Th1) — дистальный паралич Дежерин-Клюмпке.
В зависимости от этиологии плечевой плексит классифицируется как посттравматический, инфекционный, токсический, компрессионно-ишемический, дисметаболический, аутоиммунный. Среди плекситов другой локализации (шейный плексит, пояснично-крестцовый плексит) плечевой плексит является наиболее часто встречающимся. Широкое распространение и полиэтиологичность заболевания обуславливает его актуальность как для неврологов, так и для специалистов в области травматологии- ортопедии, акушерства и гинекологии, ревматологии, токсикологии.

Причины возникновения
Среди факторов, обуславливающих плечевой плексит, наиболее распространены травмы. Повреждение сплетения возможно при переломе ключицы, вывихе плеча (в т. ч. привычном вывихе), растяжении связок или повреждении сухожилий плечевого сустава, ушибе плеча, резаных, колотых или огнестрельных ранениях области плечевого сплетения. Зачастую плечевой плексит возникает на фоне хронической микротравматизации сплетения, например, при работе с вибрирующим инструментом, использовании костылей. В акушерской практике общеизвестен акушерский паралич Дюшена-Эрба, являющийся следствием родовой травмы.
Второе место по распространенности занимает плечевой плексит компрессионно-ишемического генеза, возникающий при сдавлении волокон сплетения. Подобное может произойти при длительном нахождении руки в неудобном положении (во время крепкого сна, у постельных больных), при сдавлении сплетения аневризмой подключичной артерии, опухолью, посттравматической гематомой, увеличенными лимфатическими узлами, добавочным шейным ребром, при раке Панкоста.
Плечевой плексит инфекционной этиологии возможен на фоне туберкулеза, бруцеллеза, герпетической инфекции, цитомегалии, сифилиса, после перенесенного гриппа, ангины. Дисметаболический плечевой плексит может иметь место при сахарном диабете, диспротеинемии, подагре и т. п. обменных заболеваниях. Не исключено ятрогенное повреждение плечевого сплетения при различных оперативных вмешательствах в области его расположения.
Симптомы
Плечевой плексит манифестирует болевым синдромом — плексалгией, носящей стреляющий, ноющий, сверлящий, ломящий характер. Боль локализуется в области ключицы, плеча и распространяется на всю верхнюю конечность. Усиление болевых ощущений наблюдается в ночное время, провоцируется движениями в плечевом суставе и руке. Затем к плексалгии присоединяется и прогрессирует мышечная слабость в верхней конечности.
Для паралича Дюшена-Эрба типичны гипотония и снижение силы в мышцах проксимальных отделов руки, приводящие к затруднению движений в плечевом суставе, отведения и поднятия руки (особенно при необходимости удержания в ней груза), сгибания ее в локтевом суставе. Паралич Дежерин-Клюмпке, напротив, сопровождается слабостью мышц дистальных отделов верхней конечности, что клинически проявляется затруднением выполнения движений кистью или удержания в ней различных предметов. В результате пациент не может удерживать чашку, полноценно использовать столовые приборы, застегнуть пуговицы, открыть ключом дверь и т. п.
Двигательные расстройства сопровождаются снижением или выпадением локтевого и карпорадиального рефлексов. Сенсорные нарушения в виде гипестезии затрагивают латеральный край плеча и предплечья при проксимальном параличе, внутреннюю область плеча, предплечья и кисть — при дистальном параличе. При поражении симпатических волокон, входящих в нижнюю часть плечевого сплетения, одним из проявлений паралича Дежерин-Клюмпке может выступать симптом Горнера (птоз, расширение зрачка и энофтальм).
Кроме двигательных и сенсорных нарушений, плечевой плексит сопровождается трофическими расстройствами, развивающимися вследствие дисфункции периферических вегетативных волокон. Отмечается пастозность и мраморность верхней конечности, повышенная потливость или ангидроз, чрезмерная истонченность и сухость кожи, повышенная ломкость ногтей. Кожа пораженной конечности легко травмируется, раны длительно не заживают.
Зачастую наблюдается частичное поражение плечевого сплетения с возникновением либо проксимального паралича Дюшена-Эрба, либо дистального паралича Дежерин-Клюмпке. Более редко отмечается тотальный плечевой плексит, включающий в себя клинику обоих перечисленных параличей. В исключительных случаях плексит носит двусторонний характер, что более типично для поражений инфекционного, дисметаболического или токсического генеза.
Диагностика
Установить диагноз «плечевой плексит» невролог может по данным анамнеза, жалобам и результатам осмотра, подтвержденным электронейрографическим исследованием, а при его отсутствии — электромиографией. Важно отличать плексит от невралгии плечевого сплетения. Последняя, как правило, манифестирует после переохлаждения, проявляется плексалгией и парестезиями, не сопровождается двигательными нарушениями. Кроме того, плечевой плексит следует дифференцировать с полиневропатией, мононевропатиями нервов руки (невропатией серединного нерва, невропатией локтевого нерва и невропатией лучевого нерва), патологией плечевого сустава (артритом, бурситом, артрозом), плечелопаточным периартритом, радикулитом.
С целью дифференциальной диагностики и установления этиологии плексита при необходимости проводится консультация травматолога, ортопеда, ревматолога, онколога, инфекциониста; УЗИ плечевого сустава, рентгенография или КТ плечевого сустава, МРТ области плечевого сплетения, рентгенография легких, исследование уровня сахара крови, биохимический анализ крови, определение РФ и С-реактивного белка, пр. обследования.
Лечение
Дифференцированная терапия определяется генезом плексита. По показаниям проводится антибиотикотерапия, противовирусное лечение, иммобилизация травмированного плечевого сустава, удаление гематомы или опухоли, дезинтоксикация, коррекция нарушений обмена. В отдельных случаях (чаще при акушерском параличе) требуется совместное с нейрохирургом решение вопроса о целесообразности хирургического вмешательства — пластики нервных стволов сплетения.
Общим направлением в лечении выступает вазоактивная и метаболическая терапия, обеспечивающая улучшенное питание, а значит и скорейшее восстановление нервных волокон. Пациенты, имеющие плечевой плексит, получают пентоксифиллин, комплексные препараты витаминов группы В, никотиновую к-ту, АТФ. На улучшение трофики пораженного сплетения направлены и некоторые физиопроцедуры — электрофорез, грязелечение, тепловые процедуры, массаж.
Немаловажное значение отводится симптоматической терапии, включающей купирование плексалгии. Пациентам назначают НПВП (диклофенак, метамизол натрия и др.), лечебные блокады с новокаином, ультрафонофорез гидрокортизона, УВЧ, рефлексотерапию. Для поддержки мышц, улучшения кровообращения и профилактики контрактур суставов пораженной руки рекомендован специальный комплекс ЛФК и массаж верхней конечности. В восстановительном периоде проводятся повторные курсы нейрометаболической терапии и массажа, непрерывно осуществляется ЛФК с постепенным наращиванием нагрузки.
Прогноз и профилактика
Своевременное начало лечения, успешное устранение причинного триггера (гематомы, опухоли, травмы, инфекции и пр.), адекватная восстановительная терапия обычно способствуют полному восстановлению функции нервов пораженного сплетения. При запоздалом начале терапии и невозможности полностью устранить влияние причинного фактора плечевой плексит имеет не очень благоприятный в плане выздоровления прогноз. С течением времени в мышцах и тканях происходят необратимые изменения, вызванные их недостаточной иннервацией; формируются мышечные атрофии, контрактуры суставов. Поскольку наиболее часто поражается ведущая рука, пациент теряет не только свои профессиональные возможности, но и способности к самообслуживанию.
К мерам, позволяющим предотвратить плечевой плексит, относят профилактику травматизма, адекватный выбор способа родоразрешения и профессиональное ведение родов, соблюдение операционных техник, своевременное лечение травм, инфекционных и аутоиммунных заболеваний, коррекцию дисметаболических нарушений. Повысить устойчивость нервных тканей к различным неблагоприятным воздействиям помогает соблюдение нормального режима, оздоравливающие физические нагрузки, правильное питание.
Плекситы
Плекситы (плексопатии) — группа заболеваний, в основе которых лежит поражение нервного сплетения, образованного спинномозговыми нервами. Плексит проявляется плексалгией и выпадением функций входящих в пораженное сплетение нервных стволов (парезами, мышечной гипотонией и атрофией, отсутствием сухожильных рефлексов, трофическими и вегетативными расстройствами). Диагностировать плексит можно по типичной неврологической симптоматике с учетом данных анамнеза, результатов электромио- и электронейрографии, рентгенологических, томографических и ультразвуковых исследований, консультаций смежных специалистов. Тактика лечения определяется этиологией. В основном это консервативные способы, операция необходима при травматическом и компрессионном плексите.

После выхода из позвоночного столба спинномозговые нервы разделяются на задние и передние ветви. Последние группируются и переплетаются своими волокнами, образуя парные нервные сплетения. Шейное сплетение составлено передними ветвями корешков С1-С4 и располагается за грудино-ключично-сосцевидной мышцей. В межлестничном промежутке с переходом в подмышечную ямку находится плечевое сплетение, образованное ветвями С5-Th1.
Спинномозговые нервы грудного уровня, кроме Th1 не формируют сплетений. Следующее нервное сплетение располагается в глубине большой поясничной мышцы и носит название поясничное. Его составляют отдельные волокна передней ветви нерва Th12, передние ветви L1- L3 и частично нерва L4. Другая часть волокон передней ветви спинномозгового нерва L4 совместно с L5, S1-S4 формирует крестцовое сплетение, находящееся в полости малого таза. Копчиковое сплетение локализуется сбоку от крестца, позади него расположена крестцовая мышца. Сплетение образовано частью передних ветвей S5 и двумя копчиковыми нервами.

Причины возникновения плексита
Значительное место среди факторов, вызывающих плексит, принадлежит травме. Это может быть сильный удар в область сплетения (ушиб руки в районе плеча, ушиб поясничной или шейной области, травма позвоночника, падение на копчик); огнестрельное, резанное или колотое ранение; растяжение нервных стволов сплетения при резкой тракции за ногу или руку, при вывихе плеча или вывихе бедра, переломе костей таза. Посттравматический плексит встречается в практике акушеров-гинекологов и неонатологов, как следствие родовой травмы (например, родовой паралич Дюшена-Эрба). Ведущими патогенетическими механизмами при травме являются: повреждение ветвей нервного вплетения с частичным или полным разрывом их волокон, сдавление нервных стволов сплетения посттравматической гематомой или отеком. Наиболее часто встречается посттравматический плексит плечевого сплетения.
Среди других причин, обуславливающих плексит, находятся: расположенные в области сплетения опухоли или увеличенные в результате лимфаденита лимфоузлы, аномалии развития позвоночника, искривление позвоночника (сколиоз), переохлаждение, некоторые инфекции (опоясывающий герпес, сифилис, грипп, туберкулез, бруцеллез), аутоиммунные заболевания (синдром Гийена-Барре), обменные нарушения (подагра, сахарный диабет). В отдельных случаях этиофакторами крестцового и копчикового плекситов выступают воспалительные процессы (аднексит, сальпингит, цистит, простатит и пр.) и тромбофлебит вен малого таза. Обуславливать шейный плексит может аневризма подключичной артерии, добавочное шейное ребро.
Симптомы плексита
Как правило, плексит носит односторонний характер. В его течении выделяют несколько стадий. В невралгическую стадию ведущим симптомом выступает плексалгия — боль, возникающая в нервном сплетении и иррадиирующая на периферию по его нервным стволам. Плексалгия зачастую имеет спонтанный характер, усиливается при надавливании в области нервного сплетения, ночью и во время движений. Возможны легкие сенсорные нарушения.
Появление признаков выпадения функции нервов пораженного сплетения знаменует переход плексита в паралитическую стадию. Наблюдаются парезы или параличи, гипотония и гипотрофия мышц, иннервируемых указанными нервами; отмечается выпадение соответствующих сухожильных рефлексов. В зонах, за иннервацию которых отвечает пораженное сплетение, страдают все виды чувствительности и появляются трофические расстройства — вазомоторные реакции, пастозность, гипергидроз или ангидроз, побледнение кожи. Плексит может быть полным или частичным. В последнем случае симптомы паралитической стадии проявляются более узко — лишь в областях, иннервируемых пораженной частью сплетения.
В дальнейшем плексит переходит в восстановительную стадию, которая может длиться до года. Степень восстановления утраченных нервных функций варьирует. При неполном восстановлении плексит приводит к необратимым остаточным явлениям в виде стойких вялых парезов, мышечных атрофий, контрактур суставов.
Шейный плексит манифестирует диффузными болями по передне-латеральной поверхности шеи, иррадиирующими в ухо и затылок. При раздражении нервов шейного сплетения может развиться мышечно-дистонический синдром в виде спастической кривошеи. Возможно раздражение диафрагмального нерва, сопровождающееся икотой. В паралитической стадии шейный плексит проявляется парезом диафрагмы, атрофией задне-шейных и подзатылочных мышц.
Плечевой плексит может быть верхним, нижним и тотальным. Тотальный плечевой плексит характеризуется болями во всей верхней конечности, носящими отдельные признаки симпаталгии; вялым парезом руки; атрофиями мышц руки и плечевого пояса; выпадением сухожильных рефлексов и признаками вегетативно-трофической дисфункции в тканях верхней конечности. Из-за мышечных атрофий возможно возникновение привычного вывиха плеча. В стадии остаточных явлений возможна контрактура локтевого сустава.
Поясничный плексит сопровождается плексалгией с иррадиацией боли по передней поверхности бедра и в ягодицу. Нарушено приведение и сгибание бедра, разгибание в коленном суставе. По этой причине пациенту трудно ходить и стоять. Отсутствует коленный рефлекс и сенсорное восприятие ягодичной области бедра и медиальной поверхности голени. В мышцах ягодиц и передней стороны бедра отмечаются атрофические изменения. Может развиться контрактура коленного сустава.
Крестцовый плексит зачастую сочетается с поясничным. Для него типичны иррадиирующие по ноге боли в районе крестца, наличие триггерных точек по ходу ягодичного и седалищного нервных стволов, гипестезия и мышечная атрофия по задней поверхности бедра, стопы и голени. Плексит копчикового сплетения характеризуется отсутствием анального рефлекса, расстройством дефекации, мочеиспускания и половой функции.
Диагностика плексита
Установить предварительный диагноз «плексит» позволяют данные анамнеза и неврологического осмотра. Определение мышечных групп с пониженной мышечной силой, зон гипестезии, выпавших рефлексов дает основание для диагностики уровня поражения периферической нервной системы. Уточнить топику поражения неврологу помогают электронейрография и электромиография. В отдельных случаях могут потребоваться: консультация травматолога, ортопеда, уролога, гинеколога, онколога; рентгенография плечевого сустава, рентгенография позвоночника, рентгенография тазобедренного сустава, КТ сустава, КТ позвоночника; УЗИ органов малого таза.
Дифференцировать плексит необходимо от сирингомиелии, полиомиелита, радикулита, неврита, радикулопатии при заболеваниях позвоночника (остеохондрозе, грыже межпозвонкового диска, спондилоартрозе), полиневропатии, патологии суставов (артроз, артрит, повреждение связок и т. п.). В зависимости от локализации плексит дифференцируют от невропатии бедренного нерва, малоберцовой невропатии, невропатии седалищного нерва, локтевой и лучевой невропатии.
Лечение плексита
В случае посттравматического плексита специалисты в области травматологии и неврологии совместно курируют пациента. Необходимо создать покой пораженного участка. С этой целью возможна иммобилизация конечности повязкой или лонгетой. При инфекционном генезе плексита проводят соответствующую этиотропную терапию, применяют противовоспалительные фармпрепараты (кеторолак, диклофенак, ибупрофен). Если плексит имеет токсическую этиологию, то осуществляют дезинтоксикационные мероприятия.
Плексит любого генеза является показанием для назначения нейрометаболического лечения (витамины В6, В1, В12) и терапии, направленной на улучшение обменных процессов в мышечной ткани и нейро-мышечных синапсах (АТФ, галантамин, неостигмин). Болевой синдром купируется приемом обезболивающих средств и проведением лечебных блокад. Для улучшения кровообращения в тканях сплетения и пораженных мышцах в комплексном лечении рекомендуют использовать сосудистые препараты (пентоксифиллин, ксантинола никотинат, никотиновую кислоту).
Среди физиотерапевтических процедур в терапии плексита эффективны УВЧ, диадинамические токи, электрофорез на соответствующие спинномозговые сегменты, амплипульстерапия, фонофорез с гидрокортизоном на область сплетения, ионофорез с новокаином. После купирования острых симптомов, или примерно через 2-3 недели после травмы, в комплекс лечения включают ЛФК и массаж, направленные на укрепление мышц и профилактику развития контрактур. Иглорефлексотерапию применяют в начальном периоде плексита для снятия болевого синдрома, затем переходят к электроакупунктуре. В восстановительном периоде (не раньше, чем через 6 мес. после травмы) рекомендовано водолечение радоновыми и сероводородными ваннами, грязелечение, озокеритотерапия.
Хирургическое лечение требует посттравматический плексит, неподдающийся консервативной терапии, и плексит обусловленный сдавлением сплетения. В первом случае проводится пластика нервного ствола, во втором — удаление гематомы, опухоли и пр. сдавливающих факторов.
Прогноз и профилактика плексита
При отсутствии лечения плексит может иметь не очень благоприятный прогноз, поскольку выраженность остаточных явлений (парезов, контрактур) зачастую приводит к инвалидизации пациента. В остальных случаях прогноз зависит от этиологии плексита, возраста пациента, наличия фоновых заболеваний, своевременности начала лечения.
Предупредить травматический плексит помогают мероприятия, направленные на профилактику травматизма у взрослых, детей и особенно у спортсменов. Ведущую роль в профилактике плекситов у новорожденных играет правильное ведение беременности и адекватный выбор способа родоразрешения. Предупредить плексит инфекционной этиологии может своевременное лечение инфекций.
Невропатия (нейропатия) - симптомы и лечение
Что такое невропатия (нейропатия)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Алексеевича Григория Васильевича, невролога со стажем в 16 лет.
Над статьей доктора Алексеевича Григория Васильевича работали литературный редактор Вера Васина , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Невропатия, или нейропатия (Neuropathy) — повреждение одного или нескольких нервов периферической нервной системы. К ней относятся черепные и спинальные нервы, а также нервы и сплетения вегетативной нервной системы [2] [3] . Невропатия проявляется нарушением чувствительности, болью в поражённом участке, судорогами, мышечной слабостью и затруднением движений. Выделяют две основные группы невропатий:
- мононевропатия — повреждение отдельного нерва, например срединного.
- полинейропатия — множественные повреждения нервов при диабетической полинейропатии, диффузной нейропатии, полирадикулопатии, плексопатии.
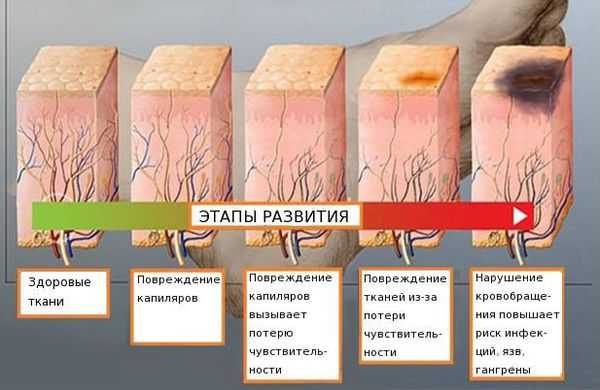
Распространённость нейропатии среди населения составляет 2-7 %. Риск развития заболевания увеличивается с возрастом: в 40 лет патология встречается в 15 % случаев [4] [5] [6] .
Повреждение периферических нервов может вызывать множество причин. Даже после комплексного обследования выявить их удаётся не всегда. К основным факторам, приводящим к заболеванию, относят:
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы невропатии
Несмотря на то, что нейропатию вызывают различные причины, основные симптомы заболевания схожи [9] [14] [15] [16] [17] :
- Двигательные нарушения, слабость мышц. Пациент с трудом выполняет действия, связанные с мелкой моторикой, например застёгивание пуговиц. Возникают проблемы с ходьбой — больной может упасть из-за слабости мышц стопы.
- Сенсорные нарушения — онемение, повышенная тактильная чувствительность, резкая стреляющая боль, подобная удару электрическим током.
- Снижение и выпадение сухожильных рефлексов. Появляются трудности при выполнении повседневных действий, таких как надевание одежды, перемещение предметов.
- Расстройства сердечно-сосудистой системы. Выражается в нестабильности артериального давления и его снижении при резком вставании, проявляется головокружением и потемнением в глазах .
- Расстройства желудочно-кишечного тракта — запоры и кишечная непроходимость, вызванные ухудшением тонуса мышц кишечника.
- Боли в кистях и стопах.
- Нарушение равновесия и координации движений.
- Повышенная потливость.
- Задержка мочеиспускания.
- Сексуальная дисфункция.
При нейропатии могут поражаться не только нервы конечностей, но и черепно-мозговые нервы:
- невропатия зрительного нерва (оптическая нейропатия) приводит к нечёткости, затуманенности зрения, нарушению цветового восприятия, слепоте;
- поражение глазодвигательного нерва проявляется опущением верхнего века и параличом глазных мышц;
- патология отводящего нерва вызывает сходящееся косоглазие, опущение верхнего века, двоение в глазах;
- лицевого нерва — паралич мимических мышц;
- преддверно-улиткового (слухового нерва) — потерю слуха;
- языкоглоточного нерва — нарушение подвижности языка;
- гортанного нерва — дыхательную недостаточность [15] .
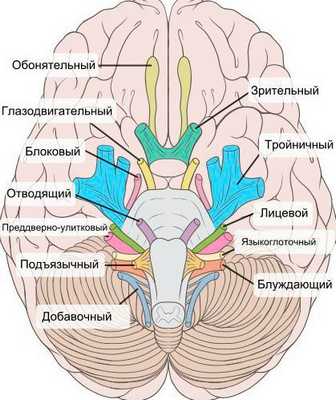
На начальных стадиях двигательные расстройства могут не проявляться. Но в дальнейшем нейропатия значительно ограничивает физическую активность пациента [5] [7] [16] [17] .
Для повреждения периферической нервной системы характерны основные синдромы:
- Поражение переднего корешка спинного мозга — приводит к ослаблению или параличу мышц. Возможны судороги и подёргивания.
- Поражение заднего корешка спинного мозга — проявляется повышенной тактильной чувствительностью, жжением, нарушением спинальных рефлексов, болью в области поражения.
- Поражение межпозвоночного узла — вызывает жжение, покалывание, снижение болевого порога, интенсивные жгучие боли, обострение герпесвирусной инфекции.
- Поражение спинального нерва — приводит к расстройствам чувствительности и двигательным нарушениям.
- Поражение сплетения периферических нервов — вызывает боль, но менее интенсивную, чем при повреждении корешков [16] .
Патогенез невропатии
К нейропатии могут приводить нарушения обмена веществ и иммунной системы, генетические факторы, инфекционное и токсическое воздействие [1] .
Развитие заболевания при обменных нарушениях, например при сахарном диабете, вызвано чрезмерным накоплением глюкозы в клетке. Гипергликемия приводит к отложению в нервных клетках продукта обмена — сорбитола. Избыток сорбитола нарушает функции клеток периферических нервов. При этом уменьшается выработка мио-инозитола — соединения, влияющего на передачу сигналов в мозге и защиту нервных клеток от повреждения. Всё это приводит к ухудшению регенеративных способностей нервной ткани и снижению её проводимости [9] .
В развитии нейропатии важная роль принадлежит митохондриям (органеллам, обеспечивающих клетку энергией) . Они повреждаются при гипергликемии и приёме противоопухолевых препаратов: паклитаксела, бортезомиба, оксалиплатина. Эти лекарства влияют и на другие внутриклеточные структуры (например микротрубочки, поддерживающие форму клетки ), негативно воздействуют на клеточные процессы и в результате активируют запрограммированную гибель нейронов [9] [15] [18] . Схожие нарушения возникают и у ВИЧ-инфицированных пациентов, принимающих антиретровирусные препараты [9] [15] .
Классификация и стадии развития невропатии
Попытки систематизировать различные виды нейропатии предпринимались многократно как отечественными, так и зарубежными авторами. Но ни одна из классификаций не удовлетворяет всем потребностям клиницистов. Это связано с тем, что к развитию заболевания приводит множество сложных и до конца не изученных факторов [16] .
По одной из классификаций, нейропатии разделяют на следующие группы: [19]
I. Мононевропатии (поражение одного нерва).
- Травматические мононевропатии — возникают при травмах, ранениях, электротравмах, химических повреждениях.
- Туннельные синдромы — это ущемление нерва при длительном сдавлении и травматизации в костно-мышечных каналах. К ним относятся: синдром карпального канала (сдавление нерва в области запястья), пронаторный синдром (поражение нерва в плече), синдром кубитального канала (в локте), синдром тарзального канала (сдавление большеберцового нерва), синдром ложа Гийона (сдавление глубокой ветви локтевого нерва) и др.
II. Множественные нейропатии (поражение нескольких отдельных нервов).
- Моторная мультифокальная нейропатия с блоками проведения — аутоиммунное заболевание, проявляющееся слабостью мышц стоп и кистей.
- Моторно-сенсорная невропатия с блоками проведения — вызывает поражение не только моторных, но и сенсорных волокон.
- Множественная невропатия при васкулитах.
III. Полиневропатии (множественные поражения нервной ткани).
1. Наследственные полиневропатии: Шарко — Мари — Тута, синдром Руси — Леви, Дежерина — Сотта и др.
2. Приобретённые полиневропатии.
2.1. Аутоиммунные полиневропатии — возникают при сбое в работе иммунной системы (синдром Гийена — Барре, синдром Миллера — Фишера, хроническая воспалительная демиелинизирующая полинейропатия, парапротеинемические полиневропатии, паранеопластические полинейропатии).
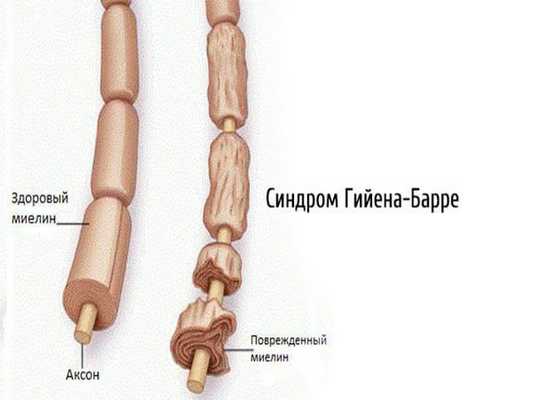
2.2. Метаболические полинейропатии — диабетическая, уремическая, печёночная, при системных заболеваниях. Наиболее часто встречается диабетическая нейропатия.
2.2 Вызванные дефицитом витаминов В1, В6, В12.
2.3 Токсические полинейропатии — вызванная алкоголем, лекарствами, отравлением тяжёлыми металлами. Препараты, способные приводить к нейропатии:
- — крайне нейротоксичное средство. Развитие острой нейропатии возникает в 90 % случаев, а хронической — в 50 %. Приём оксалиплатина приводит к жжению, покалыванию, онемению рук, ног и области вокруг рта.
- Таксен (Палитаксел,Доцетаксел) — вызывает нарушение чувствительности, слабость и боль в мышцах, возможны редкие вегетативные симптомы.
- Препараты на основе алкалоидов барвинка (Винбластин, Винорелбин, Виндезин, Винкристин) — нарушают функции мочевого пузыря и кишечника, влияют на чувствительность в руках и ногах, ухудшают мелкую моторику, приводят к мышечной слабости и резкому снижению артериального давления.
- Бортезомиб — нарушает чувствительность, приводит к боли и вегетативным симптомам.
- Иммуномодулирующие препараты (Талидомид) — провоцирует сенсорные нарушения, преимущественно в нижних конечностях, лёгкие двигательные, желудочно-кишечные и сердечно-сосудистые расстройства [15][16][18] .
2.4 Инфекционно-токсические — после гриппа, кори, дифтерии, мононуклеоза, поствакцинальные, при ВИЧ-инфекции, лепре.
IV. Поражения сплетений (шейного, верхнего плечевого, нижнего плечевого, пояснично-крестцового).
V. Вертеброгенные поражения нервных корешков (радикулиты).
Несмотря на многообразие причин, вызывающих полинейропатии, по участкам поражения их можно разделить на два вида:
- Аксональные — вовлечены нервы с наиболее длинными отростками (аксонами), к ним относится большинство токсических полинейропатий, аксональный тип наследственной моторно-сенсорной полинейропатии. Характеризуются мышечными атрофиями.
- Демиелинизирующие — вызваны разрушением миелиновой оболочки, окружающей отростки нервных клеток. Проявляются выпадением сухожильных рефлексов, развитием мышечной слабости без мышечных атрофий [19] .
Осложнения невропатии
Зачастую нейропатия уже является осложнением какого-либо заболевания, например сахарного диабета. У некоторых пациентов, страдающих диабетом, может развиваться диабетическая амиотрофия — асимметричное поражение проксимальных (близких к туловищу) отделов ног с развитием болей и слабости в мышцах [16] [17] [19] .
Если лечение не начато вовремя, нейропатия стремительно прогрессирует. В результате снижается тонус мускулатуры, наступает атрофия мышц и инвалидность. На фоне мышечной слабости случаются падения и травмы. Пациенты утрачивают способность ходить и обслуживать себя. Иногда последствиями полинейропатии становятся полный паралич конечностей или дыхательная недостаточность.
Диагностика невропатии
Неврологи используют различные шкалы для оценки тяжести нейропатии. Универсального опросника, соответствующего всем потребностям клиницистов, не существует. Это связано с различным прогнозом, проявлениями и причинами нейропатии [21] .
Во время обследования оценивают проводимость нерва, учитывая временную динамику [17] . Для диагностики применяют следующие методы:
- Электромиография (ЭМГ) — регистрация электрической активности в мышце при её сокращении. Позволяет определить характер двигательных расстройств, уточняет степень разрушения нерва и выявляет заболевание до появления симптомов. ЭМГ позволяет провести дифференциальную диагностику невропатии с миастенией, миотонией, миоплегией, полимиозитом [16][17] .
- Электронейромиография (ЭНМГ) — оценивает прохождение импульса по нервному волокну. ЭНМГ поможет не только выявить расположение поражённых участков, но и определить момент начала патологического процесса [17] .
- УЗИ — распространённый метод визуализации периферических нервов. Ультразвук поможет выявить нарушения, которые незаметны при электродиагностике. Оценивается изменение диаметра нерва, непрерывность и ухудшение звукопроводимости. УЗИ позволяет обнаружить опухоли периферических нервов, травматические невромы, разрывы, воспаление, демиелинизирующие процессы.
- МРТ — визуализирует нервы и структуру мягких тканей, выявляет злокачественные опухоли и предоставляет информацию о мышечной атрофии и поражении нервов. МРТ выявляет повреждение нерва в областях, которые трудно исследовать при помощи электродиагностики или ультразвука.
Согласно статистике, УЗИ выявляет мононевропатии или плечевые плексопатии чаще, чем МРТ [20] .
Лечение невропатии
Выбор методов лечения нейропатии зависит от вызвавших её причин:
- Метаболические нейропатии, в частности диабетическую нейропатию лечат препаратами альфа-липоевой кислоты. Перспективный препарат для терапии диабетических невропатий — канитин. Однако основное лечение при сахарном диабете заключается в контроле уровня глюкозы [6] .
- При комплексной терапии применяют препараты с витаминами. Высокие дозы принимают не более месяца.
- При возникновении болевого синдрома используют противосудорожные препараты, трициклические антидепрессанты. Их противоболевое действие связано с блокированием болевого импульса в головном мозге и устранением болевой «памяти». К физическим методам воздействия относят магнитотерапию, лазеротерапию, электрофорез с прозерином, элетростимуляцию ослабленных мышц, иглотерапию [17][16] .
- Для лечения хронической демиелинизирующей полирадикулониейропатии применяют иммуносупрессивные препараты. Иногда при терапии на первый план выходит уменьшение боли.
- При синдроме Гийена — Барре необходима госпитализация в многопрофильную больницу с отделением реанимации и интенсивной терапии, в тяжёлых случаях — вентиляция лёгких, мониторинг ЭКГ и артериального давления, введение гепарина для предупреждения тромбоза глубоких вен и лёгочной эмболии. При выраженных болях вводят опиоидные анальгетики, антиконвульсанты, проводят лечебную физкультуру, организуют рациональное (зондовое) питание. Патогенетическая терапия включает использование плазмафереза, введение иммуноглобулинов, кортикостероидную терапию. При синдроме Гийена — Барре иммунотерапия ускоряет выздоровление, но не влияет на окончательный прогноз [16][17] .
- Для достижения долгосрочной ремиссии при системном васкулите, не связанном с вирусами, применяют кортикостероиды и циклофосфамид. Продолжительность терапии кортикостероидами может быть более двух лет [1][17] .
- Лечение нейропатий, вызванных приёмом противоопухолевых препаратов, является сложной задачей. Общепризнанной профилактической или лечебной стратегии до сих пор не существует [15][18] .
Прогноз. Профилактика
Невропатия зачастую развивается достаточно медленно. Пациенты сообщают о неврологических проявлениях врачу спустя годы после её формирования. О симптомах симметричной полинейропатии лечащий врач узнаёт в среднем через 39 месяцев. В таком случае лечение может быть запоздалым, а повреждение нерва необратимым [5] .
При синдроме Гийена — Барре прогноз ухудшают пожилой возраст, быстрое развитие заболевания, потеря аксонов. Восстановление может занять несколько месяцев и быть неполным. Приблизительно у 15 % пациентов с синдромом Гийена — Барре сохраняются остаточные параличи [16] [17] .
Васкулитная нейропатия развивается с разной скоростью. Заболевание может протекать как в прогрессирующей хронической форме, так и в рецидивирующей с длительными периодами ремиссии.
Прогноз при сахарном диабете зависит от поддержания оптимального уровня сахара в крови. Приверженность лечению позволяют замедлить развитие нейропатии.
Прогноз после травмы периферической нервной системы плохой. При повреждении эндоневральной трубки (внешнего слоя соединительной ткани, окружающей периферические нервы) пациенты редко восстанавливаются полностью [17] .
После терапии противоопухолевыми средствами нейропатия может сохраняться несколько лет [18] . Обратимость патологии остаётся под вопросом, особенно при приёме противораковых препаратов на основе платины и таксанов. Для уменьшения тяжести симптомов онкологи могут снизить дозировку или прекратить применение нейротоксических противоопухолевых препаратов [15] [18] .
Не все нейропатии можно предотвратить. Однако часть нарушений возможно избежать или отсрочить их появление на несколько лет. Это в первую очередь относится к эндокринным нейропатиям, например диабетической, и нейропатии, вызванной дефицитом витаминов в организме.
Синдром Персонейджа-Тернера ( Идиопатический плечевой неврит , Невралгическая амиотрофия , Синдром лопаточного пояса )
Синдром Персонейджа-Тернера — это поражение нервных стволов и ветвей плечевого сплетения неясной этиологии, характеризующееся приступами невропатической боли, быстрым многоочаговым парезом и атрофией мышц верхних конечностей с длительным восстановительным периодом. Диагностика проводится с учетом данных неврологического статуса, лабораторных, электрофизиологических, рентгенологических, томографических исследований. Консервативное лечение осуществляется глюкокортикоидами, нестероидными противовоспалительными, внутривенными иммуноглобулинами. При неэффективности медикаментозной терапии возможно применение хирургических методов.
МКБ-10



Синдром Персонейджа-Тернера относится к группе невральных амиотрофий. Первое упоминание патологии датируется 1887 г.. Подробное описание сделано в 1948 г. англичанами Морисом Персонейджем и Джоном Тернером по результатам наблюдения 136 клинических случаев. Синонимичными названиями заболевания являются «идиопатический плечевой неврит», «невралгическая амиотрофия», «синдром лопаточного пояса». Уровень годовой заболеваемости составляет 1 случай на 1000 человек. Среди заболевших доминируют мужчины, по различным данным, они заболевают в 2-10 раз чаще женщин. Интерес к заболеванию увеличился в связи с появлением случаев, индуцированных коронавирусом и вакциной против COVID-19.

Причины
Этиологические факторы продолжают изучаться. Выявлены формы патологии, передающиеся по наследству, и спонтанно возникающие идиопатические варианты. Среди основных этиофакторов, способных привести к возникновению синдрома Персонейджа-Тернера, выделяют:
- Генетические нарушения. В пользу наследственной природы болезни свидетельствует семейный анамнез. У 50% пациентов выявлены точечные мутации гена SEPT9, расположенного на хромосоме 17q25.
- Иммунологические факторы. Более 50% заболевших имеют в анамнезе такое событие, активирующее иммунную систему, как инфекция, вакцинация, хирургическое вмешательство, беременность, стресс. Инфекционные причины включают оспу, коксаки-вирусы, цитомегаловирус, коронавирус, парвовирус, ВИЧ.
- Механические нагрузки. Спровоцировать развитие синдрома могут занятия спортом, связанная с тяжелой физической нагрузкой работа. В исследованиях около 10% больных сообщали о предшествующей интенсивной механической нагрузке на плечевой пояс и верхнюю конечность.
Патогенез
Наследственные генетические мутации обуславливают нарушения синтеза гуанозин 5-трифосфатсвязывающего белка, участвующего в формировании цитоскелета глиальных клеток, образующих миелиновую оболочку периферических нервных стволов. Патологическое строение последней делает нерв подверженным воспалительным изменениям под воздействием внешних триггеров, обуславливая рецидивирование клинической симптоматики.
Среди патогенетических теорий спонтанного возникновения амиотрофии Персонейджа-Тернера наиболее признана иммунологическая. Согласно данной теории, вариабельные иммунологические триггеры вызывают иммунную гиперактивацию, приводящую к воспалительным процессам. Имеются данные о повышении уровня антител к миелину периферических нервов.
Иммунологическая теория нашла подтверждение в ряде исследований, выявивших эпиневральные периваскулярные Т-клеточные инфильтраты в биоптатах пораженных нервов. CD8+ Т-лимфоциты, CD68+ макрофаги и CD20+ В-лимфоциты были также обнаружены в эндотелии сосудов, окружающих вовлеченные нервные стволы. При этом механические факторы имеют провоцирующее действие, запускают механизм иммунного воспаления.

Классификация
Согласно современным представлениям об этиологии и патогенезе синдрома Персонейджа-Тернера, различают 2 основных варианта болезни. Их клиническая картина мало отличается, понимание различий в механизме возникновения необходимо для успешного лечения и определения прогноза:
- Идиопатическая форма. Представляет большинство случаев невралгической амиотрофии. Отличается более доброкачественным течением, отсутствием рецидивов.
- Наследственная форма. Встречается примерно в 10 раз реже, чем идиопатическая. Наследуется аутосомно-доминантно. Характеризуется возникновением рецидивов острого или подострого воспаления.
Синдром Персонейджа-Тернера чаще затрагивает одну конечность, у 30-35% пациентов наблюдается двустороннее асимметричное поражение. В 96% случаев болезнь дебютирует острой болью в плечевом поясе, иррадиирующей в шею, плечо, переднюю поверхность грудной клетки, предплечье. Небольшая часть больных испытывает боль только в ограниченной области, например, в шее, лопатке или плече.
Примерно в 60% случаев приступы начинаются ночью. Пациенты просыпаются рано утром с сильной болью, которая затем достигает максимальной интенсивности в течение следующих нескольких часов. Боль обычно носит «колющий», «пульсирующий», «ноющий» характер, нарастает при движениях плечом, руками. Продолжительность приступа брахиалгии варьирует от нескольких часов до 2 месяцев, средняя длительность болевого синдрома составляет 4 недели.
Примерно у 5% пациентов боль проходит в течение 24 часов, у 10% пациентов боль сохраняется более 2 месяцев. Спустя несколько дней или недель после манифестации симптомов возникает мышечная слабость, прогрессирующая по мере стихания боли. Типично поражение бицепса и трицепса плеча, передней зубчатой, надостной, дельтовидной, подостной мышцы.
У большинства пациентов отмечаются сенсорные расстройства в виде гипестезии и/или парестезии латеральной поверхности плеча, зоны над дельтовидной мышцей. Однако на первое место в клинической симптоматике выходит слабость мышц, затрудняющая движения верхней конечностью. Поражение длинного грудного нерва с парезом передней зубчатой мышцы приводит к отстоянию нижнего угла лопатки от грудной клетки.
Осложнения
В целом, синдром Персонейджа-Тернера имеет доброкачественное течение. Однако выраженный парез с силой мышц менее 3 баллов приводит к ее неполному восстановлению поле стихания основных симптомов. Развитие мышечной атрофии сопровождается стойкой утратой нормальной двигательной функции. Другим осложнением болезни выступает рецидив воспалительного процесса с возобновлением болевого эпизода, что более характерно для наследственного варианта невралгической амиотрофии.
Диагноз синдрома Персонейджа-Тернера устанавливается на основании анамнеза и осмотра неврологом после исключения другой возможной патологии. В анамнезе внимание уделяют семейности случая, заболеваниям и механическим факторам, предшествующим возникновению симптомов. Общий осмотр определяет ограничение движений в одной или обеих руках, положение вынужденного приведения плеча и сгиба в локтевом суставе. В 20% случаев выявляется крыловидная лопатка. Для подтверждения диагноза проводят следующие обследования:
- Неврологический осмотр. Позволяет выявить и определить степень пареза мышц плечевого пояса и верхних конечностей. Нарушения поверхностной чувствительности диагностируются в области дельтовидной мышцы, наружной поверхности плеча. Глубокая чувствительность сохранена.
- Лабораторные исследования. Включают общий анализ крови, посев крови для исключения инфекционного процесса. Ревмопробы необходимы для дифдиагностики с заболеваниями соединительной ткани.
- Электромиография. Позволяет локализовать место поражения нервов, оценить степень поражения, динамику процесса, эффективность лечения. Выявляет снижение амплитуды М-ответа, фибрилляции в мышцах, которые иннервируются пораженными нервными волокнами.
- Электронейрография. Наблюдается снижение амплитуд прохождения потенциалов действия в стволах и ветвях пораженных двигательных нервов. Нарушения проводимости по сенсорным нервам наблюдаются в 30-45% случаев.
- Рентгенография. Выполняется при необходимости дифференцировать синдром от патологии позвоночника и плечевого сустава. При синдроме Персонейджа-Тернера диагностируются только возрастные изменения.
- Магнитно-резонансная томография. МРТ позвоночника проводится для исключения радикулопатии, вызванной грыжей межпозвоночного диска. На МРТ мягких тканей с усилением гадолинием визуализируются участки высокой интенсивности сигнала, соответствующие воспалению в нервных волокнах.
Дифференциальная диагностика
Болезнь Персонейджа-Тернера необходимо дифференцировать от заболеваний плечевого сустава, плексита, патологии шейного отдела позвоночника, имеющих сходную симптоматику. К основным заболеваниям, требующим исключения относятся:
- плечевой плексит;
- субакромиальный бурсит;
- шейная радикулопатия;
- компрессионная нейропатия;
- разрыв вращательной манжеты плеча.
Отличительной особенностью синдрома Персонейджа-Тернера является усиление пареза при снижении интенсивности брахиалгии, отсутствие рентгенологических и томографических изменений позвоночника и плечевого сустава.

Лечение синдрома Персонейджа-Тернера
Консервативная терапия
В остром периоде пациентам рекомендована иммобилизация для минимизации боли. С целью купирования воспалительных изменений и болевого синдрома проводится активная фармакотерапия. В последующем для восстановления мышечной силы необходимы реабилитационные мероприятия, включающие массаж, индивидуально подобранную лечебную гимнастику. В ходе терапии болезни Персонейджа-Тернера в практической неврологии применяют следующие лекарственные средства:
- Нестероидные противовоспалительные. Применяются в качестве поддерживающей терапии. Позволяют купировать воспалительный процесс, снизить интенсивность болевых ощущений. Существенно не влияют функциональные исходы заболевания.
- Кортикостероиды.Глюкокортикоидная пульс-терапия в течение 2 недель ускоряет облегчение боли, уменьшает время восстановления нерва, увеличивает шансы на выздоровление. Применение кортикостероидов не предупреждает возникновение мышечных атрофий.
- Иммуноглобулины. Назначаются внутривенно в комбинации с кортикостероидами. По данным клинических исследований, такая схема лечения позволяет сократить длительность острого периода, улучшить результаты лечения.
Хирургическое лечение
Поскольку у многих пациентов с синдромом Персонейджа-Тернера наблюдается спонтанное разрешение болезни, хирургические вмешательства показаны при отсутствии клинических признаков выздоровления в течение 3-х месяцев. Предварительно проводится магнитно-резонансная нейрография. При выявлении сужения нервного ствола рассматривают вопрос о целесообразности операции. К вариантам оперативного лечения относятся:
- Интрафасцикулярный невролиз. Показан при истончении нерва менее 75% по данным томографии. Операция направлена на иссечение патологически измененных тканей и создание оптимальных условий для регенерации нерва.
- Нейрорафия. Проводится при уменьшении диаметра нерва более 75%. Хирургическое вмешательство заключается в иссечении места сужения и сшивании концов, что может явиться стимулом для восстановления нерва.
Прогноз и профилактика
Исход синдрома Персонейджа-Тернера зависит от степени развития коллатеральной иннервации. В большинстве случаев происходит спонтанное выздоровление. Как правило, пациенты восстанавливаются до 80-90% своего предшествующего состояния за 2-3 года, однако более 70% больных имеют остаточную двигательную слабость.
Если амплитуда сложных двигательных потенциалов при электромиографии снижена более 70%, или имеется начальный парез ≤3 степени по шкале мышечной силы, коллатеральная реиннервация будет неполной, и прогноз восстановления двигательной функции будет неблагоприятным. Поскольку этиология заболевания Персонейджа-Тернера окончательно неясна, специфические профилактические мероприятия не разработаны.
1. Невралгическая амиотрофия плечевого пояса/ Хайбуллин Т. И., Гранатов Е. Б., Аверьянова Л. А., Бабичева Н. Н.// Практическая медицина. - 2013. - №1(66).
2. Острая идиопатическая невралгическая амиотрофия: синдром Персонейджа-Тернера/ Бушкова Ю.В., Стаховская Л.В., Ковражкина Е.А., Шурдумова М.Х.// Consilium Medicum. - 2018. - №20(2).
3. COVID-19 Vaccine-Induced Parsonage-Turner Syndrome: A Case Report and Literature Review/ Amjad M.A., Hamid Z., Patel Y., et al.// Cureus. - 2022. - 14(5).
4. Neuralgic amyotrophy: an underrecognized entity/ Kim T.U., Chang M.C.// The Journal of International Medical Research. - 2021. - 49(4).
Полинейропатия - симптомы и лечение
Что такое полинейропатия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Богдановой Евгении Павловны, нейрофизиолога со стажем в 10 лет.
Над статьей доктора Богдановой Евгении Павловны работали литературный редактор Вера Васина , научный редактор Наталья Пахтусова и шеф-редактор Маргарита Тихонова

Полинейропатия (Polyneuropathy) — это группа заболеваний периферической нервной системы, при которых повреждаются периферические нервные волокна, входящие в состав различных нервов. Полинейропатия может быть вызвана множеством причин, но проявляется общими симптомами: слабостью в руках и ногах, онемением, покалыванием и жжением в кистях и стопах.

Полиневропатия и полинейропатия — это разные варианты написания одного и того же термина.
Как часто встречается полинейропатия
Полинейропатией страдает около 2,4 % населения, заболевание чаще встречается среди пожилых людей [6] .
Причины полинейропатии
Выделяют первичные и вторичные полинейропатии. Первичные полинейропатии — это наследственные формы, которые могут сочетаться с поражением других органов и отделов нервной системы. К наследственным полинейропатиям относятся транстиретиновая семейная амилоидная полинейропатия, болезнь Фабри, порфирийная полинейропатия, болезнь Рефсума.
Вторичные полинейропатии встречаются гораздо чаще. В зависимости от причинного фактора их можно разделить на несколько видов:
- Инфекционные и инфекционно-аллергические (с известным и неизвестным возбудителем, аллергические). В эту группу входит синдром Гийена — Барре.
- Токсические: медикаментозные, при хронических бытовых и производственных интоксикациях (ртутью, свинцом, литием), при токсикоинфекциях (ботулизм, дифтерия, столбняк), алкогольные. Медикаментозные полинейропатии могут развиться при приёме Амиодарона, Колхицина, Хлоракина, Хлорамфеникола, Дапсона, Дисульфирама, Этамбутола, Этионамида, Глутетимида, статинов, Изониазида, Гидралазина, Фенитоина, Никотинамида, препаратов золота. Чаще всего полинейропатия развивается при длительном применении больших доз этих лекарств. Также к ней может привести приём нуклеозидов — препаратов для лечения ВИЧ-инфекции. Полинейропатия может возникать на фоне химиотерапии — примерно через месяц после начала применения Цисплатина, если доза превышает 400 мг/м 2 ; при терапии Винкристином и Винбластином — нередко в первые два месяца лечения, если суммарная доза препаратов превышает 30-50 мг [8] . В редких случаях полинейропатию вызывает Интерферон-альфа, используемый при гепатите С и опухолях.
- При воздействии физических факторов: холода, вибрации, радиации, хронических компрессиях (из-за утолщения оболочек вокруг нерва при системных болезнях соединительной ткани) и т. д.
- Сосудистые: при системных заболеваниях соединительной ткани, специфических и неспецифических васкулитах, атеросклерозе.
- Метаболические: при болезнях обмена веществ, дефиците витаминов (алиментарные), эндокринных заболеваниях (например, при сахарном диабете), болезнях печени и почек. Полинейропатия может быть первым проявлением сахарного диабета, чаще всего 2-го типа.
- Паранеопластические (при злокачественных новообразованиях).
Около 20-30 % аксональных полинейропатий, т. е. возникших из-за повреждения длинных отростков нервов, являются идиопатическими: их причину не удаётся выявить, несмотря на полную диагностику [7] . Иногда поиск причины полинейропатии может затянуться на месяцы. Это связано с многообразием провоцирующих факторов и трудностями при сборе анамнеза: пациенты не всегда честно рассказывают о вредных привычках и часто не знают, чем болели родственники.
Симптомы полинейропатии
Клиническая картина полинейропатий типична и проявляется следующими симптомами:
- Двигательные нарушения. При заболевании развиваются периферические парезы — снижается мышечная сила и тонус, атрофируются мышцы, угнетаются или исчезают рефлексы. Постепенно слабеют и уменьшаются в размерах мышцы рук и ног, чаще в стопах, голенях и кистях. Пациенты быстро устают при ходьбе, подъёме по лестнице и занятиях спортом, не могут встать на носки и пятки, взять и удержать тяжёлые предметы, чувствуют неловкость в руках, отмечают шаткость при ходьбе.
- Чувствительные нарушения. Страдают глубокие (суставно-мышечное чувство, вибрационная чувствительность) и поверхностные виды чувствительности (чаще — болевая чувствительность). Чувствительные нарушения проявляются следующими симптомами:
- Снижается или исчезает чувствительность к боли и температуре, преимущественно в стопах, голенях и кистях. Немеют руки и ноги, пациенты не различают горячую и холодную воду, могут поранить ногу, наступить на что-то острое и не заметить этого, так как не чувствуют боли.
- Нейропатическая боль — пациенты описывают болевые ощущения по-разному: колющие, кинжальные, жгучие, ноющие, как от удара электрическим током. Боль может сочетаться с нарушением болевой и температурной чувствительности, аллодинией (боль возникает из-за прикосновения к коже) и гипералгезией (слабый раздражитель вызывает сильную боль). Нейропатическая боль часто начинается со стоп, но пациент, как правило, не может указать точно, где болит, и лишь примерно показывает область боли. Боль может быть постоянной или периодической, возникать самопроизвольно или в ответ на прикосновение.
- Из-за нарушения глубоких видов чувствительности развивается сенситивная атаксия: пациент неустойчив, вынужден при ходьбе всегда смотреть под ноги, так как не чувствует поверхность под ногами. К глубоким видам чувствительности относится ощущение вибрации и суставно-мышечное чувство — понимание положения своего тела в пространстве. При ходьбе по твёрдой поверхности у больного возникает ощущение мягкого ковра под ногами. Особенно сложно передвигаться в темноте, когда невозможно смотреть под ноги. В таких случаях пациенты часто падают.
- Трофические нарушения. Истончается кожа и изменяется её окраска, утолщаются ногтевые пластины. Эти изменения связаны с тем, что периферические нервы не только обеспечивают движения мышц, но и питают мышцы и кожу.
При поражении периферических отделов вегетативной нервной системы нарушается работа внутренних органов. Эти нарушения сопровождаются следующими симптомами:
- ортостатическая гипотензия — давление снижается при перемене положения тела, например когда человек сидел или лежал, а потом резко встал ; в покое;
- ригидный пульс, т. е. исчезновение его физиологической нерегулярности;
- пониженное потоотделение;
- нарушение тонуса мочевого пузыря и недержание мочи;
- запоры и диарея; [3][6] .
Патогенез полинейропатии
Периферической называют ту часть нервной системы, которая не входит в центральную нервную систему, т. е. нервы за пределами головного и спинного мозга.

Периферическую нервную систему образуют длинные отростки нервных клеток, тела которых залегают в спинном мозге, стволе головного мозга, спинномозговых и вегетативных узлах. Эти длинные отростки называют аксонами. Аксоны получают питание из тела нервных клеток [11] .
Выделяют два типа нервных волокон: тонкие ( безмиелиновые ) и толстые ( миелиновые ). Миелин окружает аксон прерывистой электроизолирующей оболочкой, благодаря чему возбуждение передаётся быстрее. Этому способствуют перехваты Ранвье — периодические участки, не покрытые миелином.

Полинейропатии делят на два основных класса:
- аксонопатии, или аксональные полинейропатии, — повреждён непосредственно сам аксон;
- миелинопатии, или демиелинизирующие полинейропатии, — поражена миелиновая оболочка аксона.
Зачастую при поражении миелиновой оболочки позже повреждается и сам аксон, а при первичном повреждении аксона со временем разрушается и миелиновая оболочка.
Классификация и стадии развития полинейропатии
Формы полинейропатии в зависимости от причины:
- инфекционные и инфекционно-аллергические;
- токсические;
- от воздействия физических факторов;
- метаболические;
- паранеопластические.
По течению полинейропатии могут быть:
- острыми — развиваются от нескольких дней до четырёх недель;
- подострыми — симптомы усиливаются в течение 4-8 недель;
- хроническими — развиваются в течение нескольких месяцев или лет.
По патоморфологическим признакам выделяют аксонопатии и миелинопатии.
По преобладанию симптомов выделяют:
- сенсомоторные полинейропатии (в равной степени присутствуют чувствительные и двигательные нарушения);
- преимущественно моторные;
- преимущественно сенсорные;
- преимущественно вегетативно-трофические (с нарушением работы внутренних органов).
В чистом виде они встречаются редко, чаще развивается сочетанное поражение двух или трёх видов нервных волокон [6] .
Осложнения полинейропатии
К ослож нениям полинейропатии можно отнести атрофию мышц и утрату движений в конечностях, тревожные и депрессивные расстройства из-за боли при сенсорных полинейропатиях.
Также на фоне полинейропатии могут возникать ожоги, повреждения кожи из-за нарушения чувствительности и частые падения, которые приводят к травмам [15] .
Диагностика полинейропатии
Сбор анамнеза
При диагностике полинейропатии важно выяснить, на что жалуется пациент, какой образ жизни он ведёт и какими болезнями страдают его близкие родственники.
На приёме доктор спрашивает:
- о наличии хронических и онкологических болезней, а также уточняет, проводилась ли химиотерапия;
- о вредных привычках и профессиональных факторах, например работе с тяжёлыми металлами и фосфорорганическими соединениями;
- о схожих симптомах у родственников, например слабости и онемении в ногах и руках, — эти нарушения могут указывать на наследственную полинейропатию.
Нужно обязательно рассказать доктору о вредных привычках, в том числе о злоупотреблении алкоголем, а также о том, что предшествовало развитию полинейропатии, например инфекция, боль в животе, голодание и т. д.
Неврологический осмотр
Доктор осматривает кожу, ощупывает мышцы, измеряет окружность рук и ног, оценивает сухожильные, надкостничные рефлексы и чувствительность.
Сухожильные рефлексы проверяют с помощью лёгкого удара неврологическим молоточком по сухожилию мышцы:
- при ударе по ахиллову сухожилию стопа сгибается в области подошвы;
- при ударе по сухожилию четырёхглавой мышцы бедра разгибается голень (проверка коленного рефлекса);
- при ударе по шиловидному отростку лучевой кости рука сгибается в локте и поворачивается кисть (проверка надкостничного рефлекса).
Если рефлексы выпадают, описанные движения не происходят.
Чтобы оценить походку, силу мышц рук и ног, доктор просит пациента встать на носки и пятки, сесть на корточки и встать, лёжа потянуть стопы на себя и от себя, согнуть и разогнуть ноги в коленях, сжать кулаки, согнуть и разогнуть руки в локтях и т. д.
Нарушение разных видов чувствительности определяют различными методами:
- для оценки температурной чувствительности к коже прикасаются пробирками с тёплой и холодной водой;
- болевую чувствительность проверяют с помощью лёгкого покалывания заострённой деревянной палочкой;
- вибрационную чувствительность исследуют с помощью камертона;
- при оценке суставно-мышечного чувства пациент закрывает глаза, доктор шевелит пальцами его рук и ног, пациент описывает свои ощущения.
Определить интенсивность боли можно с помощью специальных шкал, например DN4 и визуальной аналоговой шкалы (ВАШ). Принцип ВАШ состоит в том, что пациенту предлагают оценить силу боли по 10-балльной шкале, где 0 — это отсутствие боли, а 10 — самая сильная боль, какую он испытывал в жизни. С помощью этой шкалы можно оценить эффективность лечения, сравнив интенсивность боли до него и после.
Лабораторная диагностика
Лабораторная диагностика позволяет установить причину полинейропатии.
К основным лабораторным методам относятся:
- Общий анализ крови, определение концентрации витамина В12, анализ крови и мочи на содержание тяжёлых металлов, проба Уотсона — Шварца (специфическое исследование мочи при подозрении на порфирию).
- Биохимический анализ крови (глюкоза, гликированный гемоглобин, показатели работы печени, почек).
- Исследование антител к ганглиозидам — информативный метод при моторной мультифокальной и хронической воспалительной демиелинизирующей полинейропатии, синдроме Гийена — Барре и других аутоиммунных невропатиях. Однако повышенный титр антител к GM1-ганглиозидам выявляют у 5 % здоровых людей, зачастую у пожилых пациентов [6] .
- Антитела к ассоциированному с миелином гликопротеину (анти-MAG антитела) — определяются при парапротеинемической полинейропатии и ряде других аутоиммунных полинейропатий.
- Исследование спинномозговой жидкости — проводится при подозрении на демиелинизирующие полинейропатии. Повышенное содержание белка в ликворе может указывать на синдром Гийена — Барре, хроническую воспалительную демиелинизирующую полинейропатию. Реже небольшое повышение встречается при диабетической полинейропатии. Избыток клеток в ликворе может указывать на полинейропатию при ВИЧ-инфекции и болезни Лайма[8] .
- Молекулярно-генетический анализ — назначают при подозрении на наследственные мотосенсорные полинейропатии [6] . При анализе берут кровь из вены и отправляют в лабораторию.
Инструментальная диагностика
- Стимуляционная электронейромиография (ЭНМГ) — основной метод диагностики полинейропатии, при котором определяется скорость проведения импульса по двигательным и чувствительным нервам. Позволяет подтвердить полинейропатию, определить её тип (аксонопатия или миелинопатия).
- Игольчатая электромиография с оценкой состояния мышц рук и ног — проводится, если результаты стимуляционной ЭНМГ сомнительны: например, пограничные между нормой и патологией, или требуется дифференциальная диагностика между полинейропатией и поражением мышц (миопатией) [1][2][6] .
- Ультразвуковое исследование нервов (УЗИ) — позволяет определить, на каком именно участке повреждены нервы.
- Биопсия нервов — при полинейропатии проводится редко, целесообразна при подозрении на васкулит и амилоидную полинейропатию. Чаще всего для биопсии выбирают икроножный нерв [6] .

Лечение полинейропатии
Чтобы вылечить полинейропатию, нужно выявить и устранить причину болезни, а также подавить механизмы её развития.
Методы лечения полинейропатии зависят от основного заболевания:
- при сахарном диабете — подбирают диету и терапию, которая снижает уровень глюкозы;
- при дефиците витаминов — дают рекомендации по питанию и назначают витамины;
- при аутоиммунных воспалительных полинейропатиях — применяют плазмаферез и внутривенно вводят иммуноглобулин [14] .
Чтобы уменьшить нейропатическую боль, применяют:
- медикаментозное лечение — антидепрессанты и антиконвульсанты (препараты для лечения эпилепсии);
- немедикаментозное лечение — психотерапия, методы с биологической обратной связью.
Нестероидные противовоспалительные препараты (НПВС) при нейропатической боли неэффективны [6] [8] .
В терапии диабетической полинейропатии широко применяют препараты тиоктовой кислоты — антиоксиданта, защищающего клетки от повреждения [13] .
Помимо медикаментозного лечения, проводится физическая реабилитация: лечебная физкультура, массаж, методы с биологической обратной связью, физиотерапия (электромиостимуляция) и т. п.
Эффективного лечения наследственных полинейропатий пока не существует [6] . При болезни Рефсума основной метод лечения — это диетотерапия, также может применяться плазмаферез . Пациенту нужно ограничить поступление фитановой кислоты, есть меньше зелёных овощей, говядины, рыбы (тунца, пикши и трески).
Прогноз зависит от течения основного заболевания и своевременного и правильного лечения. Также влияет тип полинейропатии: при миелинопатиях прогноз благоприятнее, чем при аксонопатиях [8] .
Наследственные полинейропатии, как правило, неуклонно прогрессируют, но благодаря их медленному развитию пациенты адаптируются и обслуживают себя самостоятельно до поздних стадий болезни.
Прогноз токсических полинейропатий относительно благоприятный при прекращении интоксикации, например если пациент откажется от алкоголя.
При диабетической полинейропатии с адекватной терапией прогноз тоже относительно благоприятный. Без лечения заболевание прогрессирует, а невропатическая боль снижает качество жизни: пациенты не могут нормально спать и работать [6] [8] .
Профилактика полинейропатии
Профилактика заключается в своевременной диагностике и лечении соматических заболеваний, нарушений обмена веществ, а также отказе от алкоголя. Пациентам с хроническими заболеваниями необходимо регулярно посещать лечащего врача и выполнять его рекомендации. При подозрении на полинейропатию доктор направит больного на электронейромиографию [5] [7] .
Людям, занятым на вредном производстве, необходимо регулярно посещать профпатолога. Обычно такие консультации входят в ежегодный профилактический медицинский осмотр.
Пациентам, чьи родственники страдают наследственными формами полинейропатии, желательно обратиться к медицинскому генетику, чтобы определить свой риск развития болезни.
Читайте также:
