Особенности миокарда новорожденного. Объем циркулирующей крови (ОЦК) новорожденных
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
Актуальность. Фето-фетальный трансфузионный синдром (ФФТС) ассоциирован с нарушениями сердечно-сосудистой системы плодов, которые нередко приводят к антенатальной гибели и/или формированию врожденного порока сердца.
Цель. Оценить влияние ФФТС на сердечно-сосудистую систему плодов.
Материалы и методы. Обследовано 145 беременных монохориальной диамниотической двойней, осложненной ФФТС. Сформированы 2 группы: I группа - беременные женщины с ФФТС I-II стадий Quintero (n=100), II группа - с ФФТС III-IV стадий Quintero (n=45). Проведено экспертное эхокардиографическое исследование с оценкой гипертрофии миокарда, кардиомегалии, состояния клапанного аппарата сердца, венозной гемодинамики.
Результаты. Кардиомиопатия плода-реципиента в исследуемой когорте встречалась в 54,2% случаев. Гипертрофия миокарда диагностировалась чаще при III и IV стадиях ФФТС (100%) по сравнению с I и II (73,8%), р=0,001. Антенатальная летальность плода-реципиента с кардиомиопатией была высокой - 19,3%, р=0,01. При обследовании новорожденных, перенесших ФФТС внутриутробно, у 25,4% сохранялись признаки кардиомиопатии.
Заключение. Кардиомиопатия плода-реципиента является осложнением ФФТС, частота которой увеличивается по мере прогрессирования заболевания. Наличие кардиомиопатии повышает риск антенатальной гибели реципиента. Устранение гемодинамического дисбаланса в результате хирургической коррекции ФФТС способствует нормализации сердечной функции плодов, что иллюстрирует адаптивность развивающегося сердца. Тем не менее у четверти выживших плодов-реципиентов сохраняются кардиомиопатия и риск стеноза легочной артерии.
Монохориальная многоплодная беременность сопровождается высоким уровнем заболеваемости и смертности. При данном типе плацентации достоверно чаще наблюдаются аномалии сердечно-сосудистой системы плодов (4-11%), даже в отсутствие развития фето-фетального трансфузионного синдрома (ФФТС) [1].
При ФФТС сброс крови от одного плода к другому по несбалансированным артерио-венозным анастомозам плаценты приводит к гиперволемии плода-реципиента и гиповолемии плода-донора. Это объясняется особенностью функционирования артерио-венозного анастомоза, ток крови по которому возможен только в одном направлении. Для компенсации гиповолемии у донора усиленно вырабатывается эндотелин II и натрийуретический пептид, которые активизируют ренин-ангиотензин-альдостероновую систему (РААС). Ангиотензин II, являясь мощным вазоконстрикторным веществом, повышает периферическое сосудистое сопротивление и стимулирует продукцию альдостерона корой надпочечников, что ведет к задержке натрия и воды, увеличению объема крови и реабсорбции в почечных канальцах. Хроническая гиперперфузия плода-реципиента и активация РААС плода-донора усугубляет почечную гипоперфузию, приводя к стойкой активации РААС и поддержанию порочного круга. Увеличение объема циркулирующей крови и повышение периферического сосудистого сопротивления приводят к ремоделированию миокарда у плода-реципиента, которое сопровождается широким спектром изменений сердечно-сосудистой системы [2, 3]. Прогрессирование кардиомиопатии проводит к сердечной недостаточности, что и является основной причиной гибели плода реципиента.
Для оценки сердечно-сосудистой системы плодов проводится эхокардиография (Эхо-КГ), которая позволяет диагностировать морфологические и функциональные изменения. При Эхо-КГ осуществляется исследование четырехкамерного среза сердца, срезов через выходные тракты левого и правого желудочков, проекции трех сосудов и трахеи, а также оценивается венозная гемодинамика [4, 5]. Наибольшее внимание исследователей при допплеровской оценке венозной гемодинамики плода в последние годы привлекает изучение кровотока в венозном протоке. При перегрузке правых отделов сердца визуализируется аномальный кровоток в венозном протоке - нулевые и реверсные значения в фазу сокращения предсердий.
Показатель производительности миокарда, также известный как индекс Тэя, является единицей измерения глобальной систолической и диастолической функции миокарда. В нескольких исследованиях было продемонстрировано, что Тэй-индекс коррелирует со степенью дисфункции миокарда даже при ранних стадиях ФФТС [6].
Измерение размеров сердца, расчет кардио-торакального индекса, толщины миокарда желудочков и межжелудочковой перегородки и определение регургитации на атриовентрикулярных клапанах, индекс Тэя, отношение E/A, доказанная обструкция выносящего тракта правого желудочка могут использоваться для оценки прогрессирования ФФТС.
Наличие таких технических трудностей в проведении Эхо-КГ плодов при ФФТС, как выраженное многоводие у реципиента и полное отсутствие вод у донора, обуславливают необходимость высоких требований к специалисту и оборудованию.
Целью данного исследования являлось изучением влияние ФФТС на сердечно-сосудистую систему плодов.
Материалы и методы
Проведено проспективное исследование 145 беременных монохориальной диамниотической двойней, осложненной ФФТС, которые проходили обследование, антенатальное лечение в объеме фетоскопической лазерной коагуляции анастомозов (ФЛКА) плаценты и родоразрешение на базе отделений ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России в период с 2014 по 201.
Анатомо-физиологические особенности сердечно-сосудистой системы у детей
У новорожденных устанавливается внеутробное кровообращение, начинают функционировать малый и большой круги кровообращения. В левом предсердии возрастает давление крови из-за поступления большого ее количества, и клапан овального окна механически закрывается. Принято считать, что закрытие артериального протока происходит под влиянием нервных, мышечных и торсионных факторов.
Обычно к 6-й неделе жизни закрывается артериальный проток, к 2-3 мес. — венозный проток, к 6-7 мес. — овальное окно в межпредсердной перегородке. Вследствие выключения кровотока через плаценту общее периферическое сопротивление почти удваивается. Это в свою очередь ведет к повышению системного артериального давления, а также давления в левом желудочке и предсердии. Одновременно происходит постепенное значительное (примерно в 4 раза) снижение гидростатического сопротивления в малом круге кровообращения из-за повышения напряжения кислорода в тканях легких (особенностью гладкой мускулатуры сосудов малого круга кровообращения является ее сокращение в ответ на гипоксию) до 15-20 мм рт. ст. к 1-2-месячному возрасту.
Следствием снижения сопротивления сосудов малого круга кровообращения является увеличение объема протекающей через них крови, а также снижение систолического давления в легочной артерии, правом желудочке и предсердии.
Сердце новорожденного обладает большой запасной силой: уменьшение вязкости крови (за счет снижения количества эритроцитов), выключение плацентарного кровообращения (что ведет к уменьшению количества циркулирующей крови плода на 25—30 % и сокращению пути, который проходит кровь), в постнатальный период нагрузка на правый желудочек постепенно уменьшается, а на левый — увеличивается (внутриутробно оба желудочка выполняют одинаковую работу, а правый даже несколько большую).
Сердце ребенка имеет ряд анатомо-физиологических особенностей
У новорожденных сердце относительно большое и составляет 0,8 % от массы тела (около 22 г), а у взрослых — 0,4 %. Правый и левый желудочки примерно равны, толщина их стенок составляет 5 мм. С возрастом происходит нарастание массы сердца: к 8 мес. масса удваивается, к 3 годам — утраивается, к 6 годам увеличивается в 11 раз.
Особенно интенсивно в связи с большей нагрузкой на него растет левое сердце, толщина стенки левого желудочка достигает к 14 годам почти 10 мм (правого — 6 мм). Оба предсердия большие, толщина их стенок 2 мм. Одновременно происходит тканевая дифференцировка. Миокард новорожденного имеет очень тонкие мышечные волокна, слабо развиты соединительная ткань, продольная фибриллярность и поперечная исчерченность. Ядра представлены в большом количестве, но они мелкие, малодифференцированные. Хорошо развита сеть мелких артерий, которые обеспечивают хорошее кровоснабжение сердечной мышцы. Магистральные сосуды имеют относительно большие размеры. До 10-12 лет у детей легочная артерия шире аорты, затем просветы их становятся одинаковыми, а после полового созревания устанавливается обратное взаимоотношение. Суммарные просветы артерий и вен большого круга кровообращения в раннем возрасте близки между собой (1:1), у детей старшего возраста это соотношение равно 1:3, у взрослых — 1:5. Система капилляров у детей относительно и абсолютно шире, чем у взрослых, что вызывает затруднения в поддержании температурного гомеостаза.
У новорожденных интенсивно снабжается кровью головной мозг
У новорожденных особенно интенсивно снабжается кровью головной мозг и печень, относительно слабее — скелетные мышцы и почки. С возрастом увеличивается кровоток через скелетные мышцы и почки, а доля минутного объема крови, протекающей через сосуды мозга, уменьшается. Своеобразие кровоснабжения мозга детей раннего возраста определяется наличием родничков, сглаживающих колебания давления в полости черепа, особенно при крике.
Поворот и перемещение сердца ребенка
Сердце новорожденного расположено выше, чем у детей старшего возраста, что частично обусловлено более высоким стоянием диафрагмы. Большая ось сердца лежит почти горизонтально. Форма сердца шарообразная. Левый край его выходит за срединно-ключичную линию, правый — за край грудины. На протяжении первых лет жизни и в подростковом возрасте происходит поворот и перемещение сердца внутри грудной клетки, в связи с чем границы его меняются: верхняя постепенно опускается, левая приближается к срединно-ключичной линии, правая — к краю грудины.
Пульс у детей, частота пульса у ребенка
Пульс у детей всех возрастов более частый, чем у взрослых. Это объясняется более быстрой сокращаемостью сердечной мышцы в связи с меньшим влиянием блуждающего нерва и более интенсивным обменом веществ. Повышенные потребности тканей растущего организма в крови удовлетворяются относительным увеличением минутного объема сердца. Частота пульса у детей с возрастом постепенно уменьшается. Крик, беспокойство, повышение температуры тела всегда вызывают у детей учащение пульса.
Артериальное давление у детей
Артериальное давление у детей тем ниже, чем младше ребенок. У новорожденного ребенка систолическое давление составляет в среднем около 70 мм рт. ст., к году оно увеличивается до 90 мм рт. ст. Рост давления в дальнейшем происходит более интенсивно в первые 2-3 года жизни и в пубертатном периоде. Повышение давления с возрастом идет параллельно росту скорости распространения пульсовой волны по сосудам мышечного типа и связано с повышением их тонуса. С возрастом увеличивается удельное периферическое сопротивление за счет увеличения длины резистивных сосудов и извилистости капилляров, снижения растяжимости стенок резистивных сосудов, усиления тонуса гладких мышц сосудов. Консультации детского кардиолога — поликлиника «Маркушка».
Особенности сердечно-сосудистой системы у детей. Обобщение
Относительно большая масса сердца, относительно более широкие отверстия сердца и просветы сосудов являются факторами, облегчающими циркуляцию крови у детей. Для детей раннего возраста характерны малый систолический объем крови и высокая частота сердцебиений, а минутный объем крови на единицу массы тела относительно велик. Относительно большее количество крови и особенности энергетического обмена у детей заставляют сердце выполнять работу, относительно большую, чем работа сердца взрослого человека. Резервные же возможности сердца в раннем возрасте ограничены из-за большей ригидности сердечной мышцы и короткой диастолы, высокой частоты сердечных сокращений. «Преимуществом» детского сердца является отсутствие отрицательного воздействия на сердечную мышцу хронических и острых инфекций, различных интоксикаций.
Особенности крови и органов кроветворения у детей
Для всей кроветворной системы ребенка характерна крайняя функциональная неустойчивость (лабильность), легкая ранимость самыми незначительными экзогенными факторами.
Уменьшение количества гемоглобина, эритроцитов, появление незрелых элементов красной крови, лейкоцитоза с образованием молодых клеток наблюдаются у детей значительно чаще и развиваются быстрее, чем у взрослых. Образование очагов экстрамедуллярного кроветворения, а иногда и полный возврат к эмбриональному типу могут быть обусловлены у детей не только тяжелой анемией и лейкемией, как у взрослого, но часто происходят под влиянием различных инфекций, интоксикаций и других вредно действующих факторов (бронхопневмония, пиелонефрит, отит и др.). Кровь на инфекции, анализ — детская клиника «Маркушка»
Периферическая кровь здорового ребенка
Эритроцитарная система: эритропоэз начинается со стволовой клетки костного мозга, чувствительной к эритропоэтину (гликопротеин, производимый в ответ на тканевую гипоксию в печени плода и почке ребенка), и идет путем дифференцировки ее в эритробласт, затем в пронормоцит, базофильный нормоцит, полихроматофильный нормоцит, оксифильный нормоцит, ретикулоцит.
Продолжительность жизни эритроцитов — 100-120 дн. С помощью фагоцитирующих макрофагов селезенки, печени, легких, лимфатических узлов за сутки в среднем разрушается 1,4 % эритроцитов.
Состав периферической крови у ребенка
Состав периферической крови у ребенка в первые дни жизни после рождения претерпевает значительные изменения. Сразу же после рождения красная кровь характеризуется повышенным содержанием гемоглобина и большим числом эритроцитов. С конца 1-х — начала 2-х суток жизни происходит снижение содержания гемоглобина и эритроцитов.
Для крови новорожденного характерны отчетливый анизоцитоз, отмечаемый в течение 5-7 дн., макроцитоз (несколько больший в первые дни жизни диаметр эритроцитов — до 8,5- 9 мкм при норме 7,5 мкм). Кровь новорожденного содержит много молодых эритроцитов, что говорит об активно протекающих процессах эритропоэза. В течение нескольких первых дней жизни в крови удается обнаружить ядросодержащие формы эритроцитов, чаще нормоциты и эритробласты. Количество ретикулоцитов в первые часы жизни колеблется от 8 до 42 %. Большое содержание эритроцитов и гемоглобина, а также незрелых форм эритроцитов в периферической крови в первые дни жизни свидетельствует об интенсивном эритропоэзе как реакции на недостаточность снабжения плода кислородом в период внутриутробного развития и во время родов.
После рождения в связи с установлением внешнего дыхания гипоксия сменяется гипероксией
После рождения в связи с установлением внешнего дыхания гипоксия сменяется гипероксией. Это вызывает снижение эритропоэза и падение количества эритроцитов и уровня гемоглобина. Эритроциты, продуцируемые внутриутробно, обладают укороченной продолжительностью жизни по сравнению с таковой у детей старшего возраста и более склонны к гемолизу. Продолжительность жизни эритроцитов у детей первых дней жизни составляет 12 дн., что в 10 раз меньше, чем у взрослых и детей старшего возраста.
Скорость оседания эритроцитов (СОЭ) зависит от многих химических и физических свойств крови. У новорожденного СОЭ составляет 2 мм/ч, у детей раннего и старшего возраста — 4- 8 мм/ч, у взрослых — 5-8 мм/ч. Более медленное оседание эритроцитов у новорожденных объясняется низким содержанием в крови фибриногена и холестерина, а также сгущением крови, особенно ярко выраженным в первые часы после рождения.
Лейкоцитарная система
Лейкоцитарная система: лейкопоэз начинается со стволовой клетки костного мозга и идет путем дифференцировки ее в миелобласт, затем в базофильные, нейтрофильные и эозинофильные сегментоядерные клетки через фазы: промиелоцит — миелоцит — палочкоядерные клетки.
Нейтрофилы непрерывно поставляются в кожу, слизистые оболочки и другие периферические ткани. Их ежедневный оборот составляет порядка 100 млрд. клеток. Длительность жизни гранулоцитов — от 14 до 23 дн. Большую часть своей жизни нейтрофилы проводят в костном мозге. На пути к периферическим тканям нейтрофилы проводят около 10 ч., находясь во внутрисосудистом пространстве, и в любой момент только половина внутрисосудистых клеток находится в движении, а другая обратимо прилипает к эндотелиальной поверхности сосудов (пристеночные клетки). Последние — это запасной пул зрелых клеток, которые могут быть востребованы в случае инфекции или воспаления.
Особенности количества лейкоцитов
С возрастом лейкоцитарная формула претерпевает значительные изменения
Это выражается в снижении числа нейтрофилов и увеличении количества лимфоцитов. На 5-й день жизни их число сравнивается (так называемый первый перекрест), составляя около 40-44 % в формуле белой крови при соотношении нейтрофилов и лимфоцитов 1:1. Затем происходит дальнейшее увеличение числа лимфоцитов (к 10-му дню до 55-60 %) на фоне снижения количества нейтрофилов (приблизительно 30 %). Соотношение между нейтрофилами и лимфоцитами составит уже 1:2.
Постепенно к концу 1-го месяца жизни исчезает сдвиг формулы влево, из крови полностью исчезают миелоциты, содержание палочкоядерных форм снижается до 4-5 %.
К началу 2-го года жизни число лимфоцитов начинает уменьшаться, а число нейтрофилов расти соответственно на 3-4 % клеток в год, и в 5 лет наблюдается «второй перекрест», при котором количество нейтрофилов и лимфоцитов вновь сравнивается (соотношение 1:1). После 5 лет процент нейтрофилов постепенно нарастает по 2-3 % в год и к 10-12 годам достигает величин, как у взрослого человека, — около 60 %. Соотношение нейтрофилов и лимфоцитов снова составляет 2:1.
Такой параллелизм изменений нейтрофилов и лимфоцитов можно объяснить общностью их функциональных свойств, играющих роль в иммунитете. Продолжительность жизни лимфоцитов — 100-300 дн.
Абсолютный и относительный нейтрофилез в первые дни после рождения объясняется поступлением в организм ребенка через плаценту материнских гормонов, сгущением крови в первые часы внеутробной жизни, рассасыванием внутритканевых кровоизлияний, адаптацией организма к внешним условиям.
Содержание эозинофилов, базофилов, моноцитов практически не претерпевает существенных изменений в процессе роста ребенка. Количество лейкоцитов в дальнейшем снижается до (7,6-7,9)х10(9)/л.
Тромбоциты
Тромбоциты, как и все другие клетки крови, ведут свое начало от стволовой клетки костного мозга с последующей дифференциацией: тромбопоэтинчувствительная клетка — мегакариобласт — промегакариобласт — мегакариоцит — тромбоцит. Около 35-40 % циркулирующих тромбоцитов ежедневно разрушаются вследствие старения и непрерывно протекающего в организме процесса свертывания.
Тромбоциты принимают непосредственное участие в процессе гемостаза. Активность тромбоцитарных факторов свертывания крови у новорожденных и детей грудного возраста понижена. Продолжительность кровотечения не изменена, время свертывания крови может быть удлинено, особенно у детей с выраженной желтухой (свыше 6-10 мин.).
Гематокритное число, дающее представление о процентном соотношении между форменными элементами и плазмой крови, меняется в зависимости от возраста. Гематокритная величина повышается при цианотических врожденных пороках сердца, при состоянии дегидратации и др. Уменьшение гематокрита наблюдается при анемиях и заболеваниях, сопровождающихся гидремией.
Периферическая кровь у недоношенных детей
Красная кровь здорового недоношенного ребенка при рождении характеризуется эритробластозом, ретикулоцитозом, повышенным количеством эритроцитов и гемоглобина, а также анизоцитозом и пойкилоцитозом. Вскоре после рождения отмечается постепенное падение содержания эритроцитов и гемоглобина, и на 2-3-м месяце жизни у большинства недоношенных развивается анемия, известная под названием «ранняя анемия недоношенных». В основе патогенеза ее лежат повышенный гемолиз и функциональная незрелость костномозгового кроветворения. Причиной интенсивного гемолиза является преобладание в крови недоношенных детей нестойких эритроцитов, содержащих фетальный гемоглобин.
Таким образом, у здоровых недоношенных детей анемию на 2-3-м месяце жизни можно рассматривать как проявление адаптации при замене экстрамедуллярного кроветворения костномозговым. У больных детей ранняя анемия чаще сопровождается более выраженными изменениями содержания эритроцитов и гемоглобина и имеет длительное течение.
К началу 4-го месяца наблюдается спонтанное увеличение уровня эритроцитов и гемоглобина, однако спустя месяц отмечается повторное снижение показателей и развивается поздняя анемия недоношенных, обусловленная недостатком железа в организме. В отличие от ранней, поздняя железодефицитная анемия поддается профилактике и эффективному лечению препаратами железа.
Кровь у детей в возрасте после года
Кровь у детей в возрасте после года также имеет свои особенности. Количество гемоглобина у детей старше 1 года отчетливо нарастает, постепенно приближаясь к цифрам взрослого человека, хотя и в этом возрасте имеются значительные индивидуальные колебания. Возрастает параллельно и количество эритроцитов; абсолютные количества их и темпы нарастания у детей различных возрастов подвержены довольно широким индивидуальным колебаниям. Число эритроцитов с суправитальной зернистостью постепенно уменьшается, достигая к школьному возрасту цифр, свойственных взрослым, то есть около 2 %. Цветной показатель колеблется от 0,85 до 0,95.
Следует отметить, что в последнее время и у детей, и у взрослых в периферической крови отмечаются некоторые изменения: определенно выявляется тенденция к снижению числа лейкоцитов (у детей — в возрасте от 2 до 15 лет).
Чурсин В.В. Клиническая физиология кровообращения (методические материалы к лекциям и практическим занятиям)
Чурсин В.В. Клиническая физиология кровобращения. Методические материалы к практическим и семинарским занятиям, - 2011. - 44 с.
Содержит информацию о физиологии кровообращения, нарушениях кровообращения и их вариантах. Также представлена информация о методах клинической и инструментальной диагностики нарушений кровообращения.
Данные материалы являются переработанным вариантом предыдущих изданий (1999г., 2003г.), первым автором которых являлся В.Ф.Туркин - доцент кафедры анестезиологии и реаниматологии АГИУВ.
Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Введение
Академик В.В.Парин (1965г.) дает такое пояснение: «Клиническая физиология исходит из положения, что в организме при болезни многие возникающие реакции являются приспособительными. Под влиянием чрезвычайных раздражителей приспособительные реакции резко изменяются и, приобретая опасное для организма значение, становятся реакциями патологическими. Переход приспособительных реакций в патологические является узловым звеном в патогенезе заболеваний. А его детальное изучение является одной из главных задач клинической физиологии кровообращения».
Исходя из этого пояснения, можно отметить, что значение клинической физиологии любой системы предполагает:
Более образно это можно представить в следующем виде (рисунок 1).
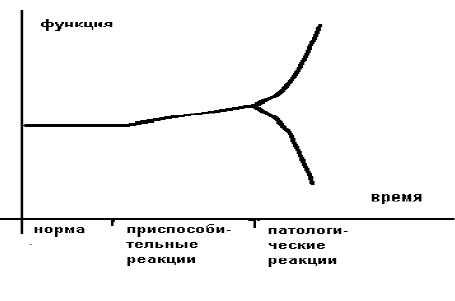
Приспособительные реакции обеспечивают компенсацию, а патологические реакции обуславливают декомпенсацию страдающего органа или страдающей системы. В общем виде отличием (границей) между нормой и приспособлением является изменение свойств приспосабливающего органа или приспосабливающейся системы.
Границей между приспособлением и патологией является резкое изменение ("излом") приспособительной реакции по направлению и величине.
Различают срочные приспособительные реакции и долговременные. Врачам интенсивной терапии чаще приходится иметь дело с острыми расстройствами, поэтому необходимы знания срочных приспособительных реакций и их переход в патологические.
Кровообращение - определение, классификация
Кровообращение - это непрерывное движение (обращение) крови по замкнутой системе, именуемой сердечно-сосудистой.
- 2 - аорта и крупные артерии, имеют много эластических волокон, представляются как буферные сосуды, благодаря им резко пульсирующий кровопоток превращается в более плавный;
- 3 - прекапиллярные сосуды, это мелкие артерии, артериолы, метартериолы, прекапиллярные жомы (сфинктеры), имеют много мышечных волокон, которые могут существенно изменить свой диаметр (просвет), они определяют не только величину сосудистого сопротивления в малом и большом кругах кровообращения (поэтому и называются резистивными сосудами), но и распределение кровопотока;
- 4 - капилляры, это обменные сосуды, при обычном состоянии открыто 20-35% капилляров, они образуют обменную поверхность в 250-350 кв.м., при физической нагрузке максимальное количество открытых капилляров может достигать 50-60%;
- 5 - сосуды - шунты или артериоло-венулярные анастомозы, обеспечивают сброс крови из артериального резервуара в венозный, минуя капилляры, имеют значение в сохранении тепла в организме;
- 7 - вены, крупные вены, они обладают большой растяжимостью и малой эластичностью, в них содержится большая часть крови (поэтому и называются емкостными сосудами), они определяют "венозный возврат" крови к желудочкам сердца, их заполнение и (в определенной мере) ударный объём (УО).
Объем циркулирующей крови (ОЦК)
Вопрос объема имеет важное значение. Прежде всего потому, что определяет наполнение камер сердца и таким образом влияет на величину УО.
По классическому представлению ОЦК составляет у мужчин 77 и у женщин 65 мл/кг массы тела 10%. В среднем берётся 70 мл/кг.
Необходимо чётко представлять, что ОЦК является «жидким слепком сосудистой системы» - сосуды не бывают полупустыми. Ёмкость сосудистой системы может изменяться в достаточно больших пределах, в зависимости от тонуса артериол, количества функционирующих капилляров, степени сдавления вен окружающими тканями («наполненность» интерстиция и тонус мышц) и степенью растянутости свободно расположенных вен брюшной полости и грудной клетки. Разница в ОЦК, определяемая изменением состояния вен, предположительно составляет примерно 500-700 мл у взрослого человека (А.Д.Ташенов, В.В.Чурсин, 2009г.). Мнение, что венозная система может вместить, кроме ОЦК, еще 7-10 литров жидкости, можно считать ошибочным, так как излишняя жидкость достаточно быстро перемещается в интерстиций. Депо ОЦК в организме является интерстициальное пространство, резервная-мобильная емкость которого составляет примерно ещё 1 литр. При патологии интерстиций способен принять около 5-7 литров жидкости без формирования внешне видимых отеков (А.Д.Ташенов, В.В.Чурсин, 2009г.).
Особенностью интерстициальных отеков при некорректной инфузионной терапии является то, что жидкость при быстром поступлении в организм прежде всего уходит в наиболее «мягкие» ткани - мозг, легкие и кишечник.
Последствием этого является наиболее наблюдаемые недостаточности - церебральная, дыхательная и кишечная.
Физиологи на сегодняшний день считают, что практически у среднего человека номинальной величиной ОЦК принимается 5 литров или 5000 см 3 . В ОЦК различают две составных части: объем заполнения (U) и объем растяжения (V) сосудистой системы. U составляет 3300 см., V составляет 1700 см 3 . Последний, объем растяжения имеет непосредственное отношение к давлению крови и скорости объемного потока крови в сосудах.
Избыточная, особенно быстрая, инфузия растворов ведет к увеличению объема, прежде всего в сосудах легких, чем в других органах. При быстрой инфузии, особенно крупномолекулярных растворов (декстраны, ГЭК, СЗП, альбумин) жидкость не успевает переместиться в интерстиций, и при этом жидкость депонируется в первую очередь в легочных венах. Имеются сведения о том, что легочные вены могут дополнительно вместить еще примерно 53% общего легочного объема крови. При дальнейшей избыточной инфузии в действие вступает рефлекс Китаева. При этом рефлексе импульсы с рецепторов перерастянутых легочных вен, возбуждающе действуя на мускулатуру легочных артериол, суживают их, предотвращая таким образом переполнение легочных венозных сосудов.
Из-за спазма легочных артериол при дальнейшей избыточной инфузии наступает объемная перегрузка правых отделов сердца, в первую очередь правого желудочка. При его чрезмерной перегрузке в действие вступает рефлекс Ярошевича. Импульсы с рецепторов легочных артерий, возбуждающе действуя на мускулатуру в устьях полых вен, суживают их, предотвращая таким образом переполнение правых отделов сердца.
Здесь граница, за которой далее приспособление может перейти в патологию. В случае продолжения избыточной инфузии - вследствие избыточного давления в правом предсердии и его перерастяжения возникают следующие условия.
Во-первых ухудшается отток в правое предсердие значительной части крови из коронарных вен. Затруднение оттока по коронарным венам приводит к затруднению притока крови по коронарным артериям и доставки кислорода к миокарду (боль в области сердца).
Во-вторых, может возникнуть рефлекс Бейнбриджа (подробнее - раздел регуляции кровообращения), он вызывает тахикардию, которая всегда увеличивает потребность миокарда в кислороде.
У лиц со скрытой коронарной недостаточностью (что почти никогда не выявляется у больных перед операцией из-за недостаточного обследования) и у лиц с явной ишемической болезнью сердца (ИБС) все это может обусловить возникновение острой коронарной недостаточности вплоть до возникновения острого инфаркта миокарда (ОИМ) с дальнейшим развитием острой сердечной лево-желудочковой недостаточности (ОСЛН).
Если компенсаторные возможности коронарного кровообращения не скомпрометированы и не реализуется рефлекс Бейнбриджа, то дальнейшая объемная перегрузка приводит к растяжению полых вен. При этом с рецепторов, расположенных в устьях полых вен, импульсация поступает к центрам осморегуляции в гипоталамусе (супраоптическое ядро). Уменьшается секреция вазопрессина, приводящая к полиурии (выделению мочи более 2000 мл/сут), что отмечается утром дежурным врачом (и, как правило, безотчётливо) - больной спасает себя. Хорошо, если у больного регуляция водного баланса не нарушена и почки функционируют, в противном случае больной будет «утоплен» с благими намерениями.
Не затрагивая вопросов о «хроническом» уменьшении ОЦК, когда это обусловлено хроническим уменьшением потребления жидкости, коснемся вопроса уменьшения ОЦК, обусловленного именно острой кровопотерей, с чем чаще всего имеют дело врачи анестезиологи-реаниматологи.
По современным представлениям отмечаются следующие приспособительные изменения функции сердечно-сосудистой системы.
Когда ОЦК снижается на 10-20%, то такая кровопотеря представляется компенсируемой. При этом первой приспособительной реакцией является уменьшение емкости венозных сосудов за счёт сдавления их окружающими тканями. Вены из округлых становятся сплющенными или почти полностью спадаются, и таким образом емкость сосудов приспосабливается к изменившемуся объему циркулирующей крови. Венозный приток крови к сердцу и его УО поддерживаются на прежнем уровне. Компенсаторную реакцию организма можно сравнить с ситуацией, когда содержимое неполной 3-х литровой банки переливают в 2-х литровую и она оказывается полной.
Компенсаторным механизмом является и перемещение жидкости из интерстиция за счёт уменьшения венозного давления и увеличения скорости кровотока (укорочения времени изгнания даже без развития тахикардии) - жидкость как бы засасывается из интерстиция. Этот компенсаторный механизм можно наблюдать у доноров при донации, когда экстракция 500 мл крови не приводит к каким-либо изменениям кровообращения.
С уменьшением ОЦК до 25-30% (а это уже потеря растягивающей части ОЦК - V) кровопотеря представляется не компенсируемой за счёт критического уменьшения ёмкости венозной системы. Начинает уменьшаться венозный приток к сердцу и страдает УО. При этом развивается приспособительная (компенсаторная) тахикардия. Благодаря ей поддерживается достаточный уровень сердечного выброса (СВ за минуту = МСВ) за счёт уменьшенного УО и более частых сердечных сокращений. Одновременно с тахикардией развивается сужение периферических артериальных сосудов - централизация кровообращения. При этом ёмкость сосудистой системы значительно уменьшается, подстраиваясь под уменьшенный ОЦК. При сниженном УО и суженных периферических артериальных сосудах поддерживается достаточный уровень среднего артериального давления (АДср) в сосудах, направляющих кровь к жизненно важным органам (мозг, сердце и лёгкие). Именно от величины АДср зависит степень перфузии того или иного органа. Таким образом, развивается приспособительная централизация кровообращения за счет уменьшения кровоснабжения периферических тканей (кожа, скелетные мышцы и т.д.). Эти ткани могут переживать ишемию (I фазу нарушения микроциркуляции) и кислородную недостаточность в течение более продолжительного времени.
Эта реакция аналогична процессу воспаления, при котором организм, образуя грануляционный вал и отторгая омертвевшее, жертвует частью во имя сохранения целого.
Когда ОЦК снижается более чем на 30-40% и восполнение кровопотери задерживается, то такая кровопотеря переходит в разряд некомпенсированной и может стать необратимой. При этом несмотря на тахикардию, СВ уменьшается и снижается АДср. Из-за недостаточного транспорта кислорода в организме усиливается метаболический ацидоз. Недоокисленные продукты метаболизма парализуют прекапиллярные сфинктеры, но периферический кровоток не восстанавливается из-за сохраняющегося спазма посткапиллярных сфинктеров.
Развивается II фаза нарушений микроциркуляции - застойной гипоксии. При этом за счёт ацидоза повышается проницаемость капилляров - плазматическая жидкость уходит в интерстиций, а форменные элементы начинают сладжироваться, образуя микротромбы - развивается ДВС-синдром. К моменту, когда на фоне нарастающего ацидоза парализуются и посткапиллярные сфинктеры (III фаза нарушений микроциркуляции) капиллярное русло уже необратимо блокировано микротромбами.
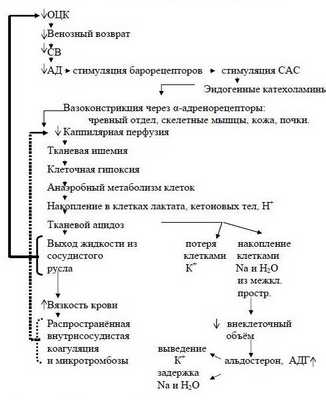
Наступает несостоятельность тканевой перфузии. Во всех случаях затянувшегося синдрома малого СВ присоединяется преренальная анурия. Всё это клиническая форма шока с классической триадой: синдром сниженного СВ, метаболический ацидоз, преренальная анурия. При этом во многих органах, как отмечает профессор Г.А.Рябов, "наступают необратимые изменения и даже последующее восполнение кровопотери и восстановление ОЦК не всегда предотвращает смертельный исход из-за осложнений, связанных с необратимыми изменениями в некоторых органах" - развивается полиорганная недостаточность (ПОН) или мультиорганная дисфункция (МОД).
Последовательность в нарушениях гомеостаза при кровопотере схематически представлена на рисунке 2 (Р.Н.Лебедева и сотр., 1979 г.).
Таким образом, при абсолютном снижении ОЦК практически любого происхождения границей перехода приспособления в декомпенсацию является увеличение частоты сердечных сокращений (ЧСС) с одновременным снижением СВ и АДср.
Данное положение не применимо к случаям, когда имеется относительное уменьшение ОЦК за счет патологической вазодилятации.
Следует учитывать и то, что очень часто острая кровопотеря сопровождается болью и это вносит разлад в последовательность компенсаторных механизмов - раньше чем нужно и в большем количестве выбрасываются эндогенные катехоламины. Централизация развивается быстрее и времени на спасение больного остается меньше.
Диагностика и лечение шока у новорожденных детей
Категории МКБ: Гиповолемический шок (R57.1), Гипотензия неуточненная (I95.9), Гипотензия, вызванная лекарственными средствами (I95.2), Другие виды гипотензии (I95.8), Другие виды шока (R57.8), Идиопатическая гипотензия (I95.0), Кардиогенный шок (R57.0), Септицемия неуточненная (A41.9), Шок неуточненный (R57.9), Шок, не классифицированный в других рубриках (R57)
Общая информация
Краткое описание
Российское общество неонатологов
Клинические рекомендации
Диагностика и лечение шока у новорожденных детей
Год создания: 2019
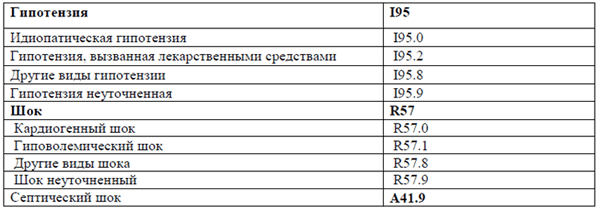
По мере своего развития шок сопровождается снижением артериального давления. Однако, изолированное снижение артериального давления ниже нормативных значений для данного возраста и срока гестации без нарушения перфузии органов и тканей, не является шоком и требует принципиально иных терапевтических подходов.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Выделяют несколько основных видов шока: дистрибутивный шок, кардиогенный шок и гиповолемический шок, который в практике неонатолога, как правило, связан с кровопотерей. В соответствии с этиологической классификацией существует также болевой шок, анафилактический шок, ожоговый шок и другие, однако эти виды шока редко встречаются в неонатальной практике. Особенностью новорожденных является возможность развития некоторых видов шока, нехарактерных для взрослых и детей более старшего возраста (шок на фоне закрытия ОАП при дуктус-зависимом ВПС, шок при фиброэластозе, шок фето-фетальном синдроме, шок при персистирующей легочной гипертензии и др). Кроме того, некоторые врожденные нарушения метаболизма, сопровождающиеся гипераммониемией или гипергликемией, могут также симулировать клинику септического шока.
Наиболее тяжёлым, молниеносно развивающимся, имеющим высокую летальность и наибольшую частоту осложнений является септический шок. В основе диагностического поиска и планирования тактики всегда нужно в первую очередь исключить развитие септического шока.
Особенности наиболее часто встречающихся видов неонатального шока.
Классически выделяют три стадии шока - стадия компенсации, стадия декомпенсации и необратимая стадия. В неонатальной практике четкое выделение стадий шока не всегда возможно.
Лечение следует начинать вне зависимости от подозреваемой стадии шока.


Этиология и патогенез
ЭТИОЛОГИЯ ШОКА
В основе развития шока лежит снижение сердечного выброса и/или снижение периферического сосудистого сопротивления. Сердечный выброс определяется:
Любой из факторов (низкая преднагрузка и сократительная способность или высокая постнагрузка) может привести к снижению сердечного выброса.
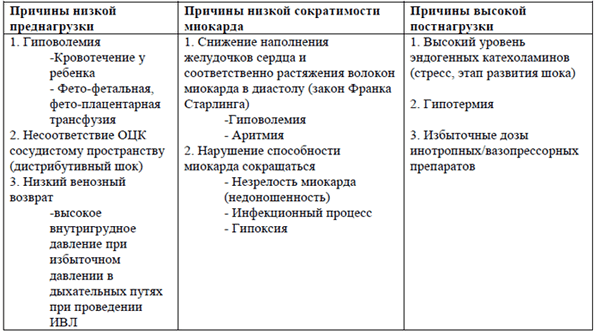
Патологические состояния, которые приводят к описанным изменениям, перечислены в таблице.
Клиническая картина
Cимптомы, течение
В отличие от артериальной гипотонии, которая может протекать бессимптомно, при шоке отмечаются следующие клинические симптомы:
- Акроцианоз, бледность, мраморность, холодные конечности - первые признаки снижения сердечного выброса и централизации кровообращения. Симптом «белого пятна» более 4 сек, снижение периферической пульсации позволяют подозревать развитие шока.
- Со стороны сердечно-сосудистой системы: Нарушения сердечного ритма. Наиболее частый признак развивающегося шока - нарастающая тахикардия. Учащая сердечный ритм, ребенок компенсирует падающий сердечный выброс, не имея возможности адекватно увеличить силу сокращения. У недоношенных детей признаком развивающегося шока, напротив, может быть брадикардия. Нарушения частоты сердечных сокращений - ранний признак развития шока у новорожденного.
- Со стороны дыхательной системы: Тахипное характерно для септического и кардиогенного шока, в частности на фоне ацидоза и повышения уровня лактата. При наличии патологии легких возможно быстрое прогрессирование дыхательных нарушений. Периодическое дыхание и апноэ являются следствием сниженной перфузии головного мозга, что может отмечаться при всех видах шока.
- Со стороны ЦНС: Неврологические нарушения могут быть различными - от резкого угнетения вплоть до отказа от кормления до двигательного возбуждения с быстрым истощением. Как правило, развивается мышечная гипотония в покое, сниженная спонтанная двигательная активность с постепенным нарастанием неврологических нарушений.
- Артериальная гипотония. Следует помнить, что артериальная гипотония - это относительно поздний признак шока. В идеальном варианте диагностика и терапия шока должна быть начата раньше развития тяжелой гипотонии. Нижней допустимой границей среднего артериального давления в мм рт ст эмпирически принято считать ГВ в неделях. Однако нижняя граница артериального давления вне зависимости от ГВ не должна опускаться ниже 30 мм рт ст [1] Только для новорожденных с весом 600г и менее - нижняя допустимая граница среднего артериального давления может быть 28 мм рт ст
- Со стороны мочевыделительной системы: Может отмечаться олигурия вплоть до анурии. Однако, при высокой осмолярности (например, в условиях гипергликемии), а также при массивной диуретической терапии нормальные показатели диуреза могут сохраняться достаточно долго.
- Низкая корреляция между АД и тканевой перфузией
- Низкая специфичность симптома белого пятна. Для новорожденных ≤ 30 недель гестации выявлена незначительная специфичность только при длительности заполнения капилляров более 5 сек
- На фоне шока часто отмечается брадикардия. Характерна клиническая ситуация, когда эпизоды выраженной брадикардии чередуются нормальным или учащенным сердечным ритмом. Нарушения сердечного ритма практически всегда предшествуют снижению АД.
- У глубоконедоношенных детей следует различать артериальную гипотонию, (связанную с незрелостью регуляторных механизмов, относительной адреналовой недостаточностью) и собственно шок. Терапевтические подходы к этим двум состояниям кардинально отличаются.
Диагностика
Сердечный выброс (СВ) - это количество крови, выброшенной сердцем за минуту - величина, характеризующая системный кровоток, синоним - минутный объем кровообращения.
Величина СВ зависит от ЧСС. При значительных нарушениях сердечного ритма - тахикардии или брадикардии - данные могут быть недостоверны.
В педиатрической практике, как правило, под СВ подразумевается СВ левого желудочка. В неонатологии и, в особенности у недоношеннных новорожденных, актуально измерение СВ левого и правого желудочков. Измеряется в мл/кг/мин.
• Недоношенные (без ГЗФАП) - 221 ± 56 мл/кг/мин. У недоношенных новорожденных со значимым шунтированием крови через ОАП СВ левого желудочка не характеризует системный кровоток, так как к его значение может достигать 300 мл/кг/мин и более, характеризуя при этом кровоток в малом круге кровообращения. В такой гемодинамической ситуации для оценки системного кровотока используется СВ правого желудочка.
СВ правого желудочка. Объем крови, выброшенной правым желудочком за минуту. Величина кровотока оценивается на уровне бифуркации легочной артерии. Нормальные показатели соответствуют показателям СВ левого желудочка. В связи с тем, что на сердечный выброс ПЖ не влияет ГЗФАП, этот показатель рекомендуется использовать в первые 24 часа после рождения, а также у недоношенных новорожденных с ГЗФАП. Однако, при значительном шунтировании крови через овальное окно СВ ПЖ также не будет характеризовать системный кровоток. В этой ситуации для косвенной оценки системного кровотока используют данные о возврате крови к сердцу - кровоток в верхней полой вене.
Кровоток в верхней полой вене (ВПВ). Объем крови, проходящий через верхнюю полую вену на уровне ее впадения в правое предсердие. Характеризует кровоток в верхней половине туловища, 70-80% которого составляет кровоток в головном мозге. Измеряется в мл/кг/мин. Составляет 30-50% выброса правого желудочка. Кровоток значительно возрастает в первые 48 часов жизни - от 70 мл/кг/мин в возрасте 5 часов жизни до 90 мл/кг/мин в возрасте 48 часов. Таким образом, с учетом данных о значительном приросте в первые 48 часов, нормальные значения: 40-120 мл/кг/мин.
Ударный объем (УО) - объем крови, который выбрасывается сердцем за одно сокращение. Таким образом, у новорожденного с нормальным сердечным ритмом без значимого шунтирования крови через фетальные коммуникации для оценки уровня системного кровотока используется СВ левого желудочка и кровоток в ВПВ. При наличии значимого шунтирования - используют данные о СВ правого желудочка и кровоток в ВПВ.
Для оценки функции миокарда используются данные о фракции выброса и фракции укорочения. Основной проблемой достоверности этих измерений у недоношенных новорожденных является традиционное использование для этого М-режима, при котором оценивается движение задней стенки ЛЖ и межжелудочковой перегородки. Особенностью недоношенных является малая подвижность межжелудочковой перегородки при сокращении. Для недоношенных новорожденных предпочтительно измерение ФУ методом Симпсона.
Фракция укорочения (ФУ) - отношение конечного систолического размера ЛЖ к конечному диастолическому. Величина, характеризующая способность волокон миокарда сокращаться. Нормальные значения: 35% (26-40%).
Для оценки значимости шунтирования используются данные о диаметре ОАП и признаки переполнения легочного и обеднения системного кровотока.
• Индекс сосудистой резистентности (Ri) передней мозговой артерии >0,8
Оценка давления в ЛА по шунтированию через ОАП. Метод может быть использован при наличии шунтирования через ОАП и данных о системном АД. Для оценки используется модифицированная формула Bernoulli : 4 ∗ 𝑉𝑉ОАПP 2 , где 𝑉𝑉ОАП - скорость кровотока в ОАП.
Например, при шунтировании крови слева-направо и скорости кровотока в ОАП 2м/с (4*22) давление в ЛА будет ниже системного АД на 16 мм рт ст, а при право- левом шунтировании давление в ЛА будет на 16 мм выше системного АД.
Оценка давления в ЛА по степени недостаточности на трикуспидальном клапане. При отсутствии обструкции выходного тракта ПЖ давление в ПЖ рано давлению в ЛА. Давление в правом предсердии на 5-10 м м р т с т н иже д авления в Л А. М етод м ожет б ыть и спользован при наличии недостаточности трикуспидального клапана, так как отсутствие регургитации на клапане будет говорить о том, что давление в ПЖ равно давлению в ПП. Таким образом, если градиент на трикуспидальном клапане равен 36 мм рт ст, давление в ЛА будет равным 42 мм рт ст (36мм рт ст +5мм рт ст).
Оценка давления в ЛА по отношению времени ускорения кровотока в ЛА к времени изгнания. Метод основан на том, что по мере роста давления в ЛА сокращается время достижения пиковой скорости в момент изгнания крови из ПЖ. На основании отношения времени достижения максимальной скорости кровотока в ЛА к полному времени изгнания (TPV/RVET) можно судить о легочной гипертензии.
Лечение
1. В первую очередь следует обеспечить адекватную респираторную терапию. Как правило, требуется перевод на ИВЛ.
2. Обеспечение сосудистого доступа (если отсутствует). Желательно катетеризировать две вены (одну центральную и одну периферическую или две центральных вены) для исключения вероятности изменения скорости введения инотропных препаратов при одновременном назначении других инфузий. В исключительных случаях при наличии жизненных показаний в отсутствие возможности катетеризации центральной вены допустима непродолжительная инфузия вазоактивных препаратов (допамин, адреналин) в периферическую вену. Задержка с назначением инотропных препаратов связана с 20-кратным увеличением риска летальности.
3. Если ребенок получал энтеральное питание, оно должно быть отменено, содержимое желудка эвакуировано. Парентеральное питание должно быть продолжено с учетом клинической картины и особенностей новорожденного (см. протокол проведения парентерального питания).
3. Непосредственно после катетеризации вены, как можно скорее, вводится 10-20 мл/кг физиологического раствора медленно болюсно или капельно. На ранней стадии дистрибутивного шока (септического шока) предпочтительно в первую очередь использовать волюм-эспандерный раствор (физиологический раствор) для поддержания внутрисосудистого пространства. Инотропные препараты назначаются одновременно или немногим позднее. При отсутствии эффекта возможны повторные введения еще 10-15 мл/кг за 15-20 мин, с одновременным назначением инотропного препарата. Волюм-эспандерная терапия при септическом (дистрибутивном) шоке может достигать 40 и более мл/кг в течение первого часа терапии шока.
4. Инотропные препараты. Допамин - вазоактивный препарат первой линии в начальной дозе 5 мкг/кг/мин с повышением дозы по мере необходимости. Повышение дозы производят пошагово, шаг - 2,0-2,5 мкг/кг/мин до 10 мкг/кг/мин каждые 10- 15 мин. Исключение составляет состояние персистирующей легочной гипертензии, когда препаратом первой линии может стать добутамин с 5 мкг/кг/мин, увеличивая дозу с шагом 2,0 -5,0 мкг/кг/мин каждые 10-15 мин. Добутамин (как стартовый препарат) может назначаться при персистирующей легочной гипертензии как изолированно, так и одновременно с допамином
5. Предварительная оценка вида шока (гиповолемический, дистрибутивный (септический), кардиогенный). Начальные мероприятия направлены на поддержание сосудистого пространства и обеспечение поддержки тонуса миокарда и стенок сосудов, коррекцию гипоперфузии органов и тканей. Дальнейшие действия будут зависеть от полученных результатов обследования.
6. Анализ крови на КОС, электролиты, глюкозу, лактат, посев крови (другие исследования, предусмотренные при ухудшении состояния, в соответствии с внутренним протоколом отделения). Подсчет диуреза за предыдущие часы. В случае необходимости - коррекция анемии, ацидоза, дисэлектолитных нарушений, смена антибактериальной терапии.
7. Эхокардиография* для исключения ВПС с оценкой сократительной способности миокарда, системного кровотока (сердечный выброс ЛЖ, кровоток в ВПВ), гемодинамической значимости фетальных коммуникаций:
а. При нормальной сократительной способности миокарда и низком АД - продолжить увеличение дозы допамина до 15-20 мкг/кг/мин.
б. При сниженной сократительной способности миокарда и/или высокой легочной гипертензии - добутамин с 5 мкг/кг/мин до 20 мкг/кг/мин, увеличивая на 2 - 5 мкг/кг/мин каждые 15 мин.
Если у новорожденного сохраняется гиповолемия, высокие дозы инотропных препаратов могут вызвать тахикардию. В этом случае следует увеличить волемическую нагрузку.
а. Для детей с ЭНМТ - назначаются кортикостероиды - гидрокортизон (в дозе 1-2 мг/кг каждые 6 ч, при необходимости доза увеличивается до 2-2,5 мг/кг каждые 4 часа). Возможно также использование дексаметазона (0,5 мг/кг, при необходимости повторное введение каждые 2-6 часов). При отсутствии эффекта от введения кортикостероидов или кратковременном эффекте - в терапию включается адреналин 0,05-0,3 мкг/кг/мин. Каждые 15 мин увеличение дозы на 0,1 мкг/ кг/мин, максимальные дозы при шоке могут достигать 3-5 мкг/кг/мин.
У детей с ЭНМТ оправдано использование нескольких инотропных препаратов одновременно с целью снижения необходимой дозы адреналина, так как использование адреналина сопряжено с рядом побочных эффектов (повышение тонуса мезентериальных сосудов, гипергликемия, увеличение тонуса легочных сосудов, развитие гипертрофии миокарда, лактат-ацидоз)
б. Для детей с весом более 1000г - назначается адреналин (0,1-0,5 мкг/кг/мин). Каждые 15 мин увеличение дозы на 0,1 мкг/кг/мин. При отсутствии эффекта от увеличения дозы адреналина - назначаются кортикостероиды - гидрокортизон (в дозе 1-2 мг/кг каждые 6 ч, при необходимости доза увеличивается до 2-2,5 мг/ кг каждые 4 часа).
Возможно также использование дексаметазона (0,5 мг/кг, при необходимости повторное введение каждые 2-6 часов). После назначения адреналина возможен переход на монотерапию адреналином или сочетание нескольких инотропных препаратов.
9. При неэффективности описанной терапии и подтвержденной нормальной сократимости миокарда возможно использование норадреналина.
Норадреналин в большей степени увеличивает общее периферическое сопротивление сосудов, что приводит к увеличению постнагрузки. При условии здорового миокарда это может привести к увеличению сократимости. При пораженном миокарде повышение постнагрузки сопровождается снижением сердечного выброса. Эффективное и безопасное применение норадреналина возможно после эхокардиографического исследования с оценкой сократительной способности миокарда. Применяется при артериальной гипотонии на фоне сохранной сократительной способности миокарда, только после волемической нагрузки, обычно в комбинации с другими инотропными препаратами. Рекомендована начальная доза и скорость введения от 0,1 до 0,3 мкг/кг/мин. Максимальная доза и скорость введения может достигать 3-5 мкг/кг/мин.
10. Решение о необходимости продолжения введения повышенного объема инфузии принимается на основании клинических данных и данных эхокардиографии:
* Функциональная эхокардиография является основой эффективной терапии шока у новорожденных. В жизнеугрожающей ситуации (например, септический шок) эхокардиографическая оценка может проводиться обученным неонатологом. В случае отсутствия возможности ЭХО-исследования, после проведения начальных мероприятий по стабилизации больного с шоком, возможен выбор любой тактики в рамках предложенных алгоритмов.
При использовании высоких доз адреналина возможна как отмена других инотропных препаратов (допамин, добутамин), так и использование нескольких инотропных препаратов одновременно.
При стабилизации состояния в первую очередь снижают дозу и отменяют норадреналин, затем, по возможности, адреналин, затем добутамин, инфузия допамина в невысоких дозах может потребоваться в течение нескольких суток. Кортикостероиды отменяются сразу после стабилизации АД, в том числе на фоне использования инотропных препаратов.
Следствием шокового состояния может быть повреждение и дисфункция многих органов и систем. В связи с этим после стабилизации состояния необходимо:
b. своевременная коррекция объема вводимой жидкости, состава парентерального питания, дозировки нефротоксичных препаратов в зависимости от функции почек.
d. УЗИ головного мозга
Читайте также:
