Показания, доступ и ход операции спленэктомии при спленомегалии
Добавил пользователь Владимир З. Обновлено: 01.02.2026
Рижская восточная клиническая университетская больница (РВКУБ), клиника "Линэзерс"
Рижская восточная клиническая университетская больница (РВКУБ), клиника "Линэзерс";
Кафедра внутренних болезней
Кафедра физики Рижского университета им. Страдыня
Лапароскопическая спленэктомия у гематологических больных с гиперспленизмом, вызванным циррозом печени
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2012;(6): 13‑18
Видмане-Озола И., Бока В., Цунскис Э., Лейниеце С., Ривкина А., Калниньш И. Лапароскопическая спленэктомия у гематологических больных с гиперспленизмом, вызванным циррозом печени. Хирургия. Журнал им. Н.И. Пирогова. 2012;(6):13‑18.
Vidmane-Ozola I, Boka V, Tsunskis É, Leĭnietse S, Rivkina A, Kalnin'sh I. The laparoscopic splenectomy in patients with hypersplenism, caused by liver cirrhosis. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2012;(6):13‑18. (In Russ.).
При доброкачественных и злокачественных гематологических заболеваниях на этапах лечения производится спленэктомия. Миниинвазивная современная лапароскопическая хирургия успешно применяется также при лечении гематологических больных. Цель исследования - оценка возможностей лапароскопической спленэктомии (ЛС) у больных с гематологическими заболеваниями и гиперспленизмом, вызванным циррозом печени по сравнению с открытой спленэктомией (ОС). В ретроспективное исследование включены 147 пациентов с гематологическими заболеваниями и гиперспленизмом, которые были оперированы в период 2002-2010 гг. в стационаре РВКУБ "Линэзерс". Проведено 125 (85,03%) ОС и 22 (14,97%) ЛС. Статистически достоверно различаются (p
Введение
Операция на селезенке как один из методов лечения пациентов с гематологическими заболеваниями описана еще в 1910 г., ее сделали Sutherland и Burghad в целях лечения наследственного сфероцитоза [14]. Существует несколько доброкачественных (иммунная тромбоцитопения, наследственный сфероцитоз, гемолитическая анемия) и злокачественных (неходжкинская лимфома, хронический лимфолейкоз, лимфома Ходжкина) гематологических заболеваний, на этапах лечения которых производится спленэктомия. Ее делают в случае безуспешной медикаментозной терапии, например при лечении идиопатической тромбоцитопенической пурпуры (ИТП). При злокачественных гематологических заболеваниях, например при болезни Ходжкина и неходжкинской лимфоме, спленэктомию выполняют при наличии спленомегалии и/или гиперспленизма [7, 16]. Спленэктомия является способом лечения гиперспленизма у больных циррозом печени.
Миниинвазивная хирургия успешно применяется у гематологических больных. Лапароскопическая спленэктомия (ЛС) в лечении гематологических болезней стала популярной в 1991 г., когда ее ввели в практику B. Delaitre и B. Maignien [6, 15, 20].
Первая ЛС в Латвии была сделана в 2001 г. в больнице «Линэзерс». В клинике РВКУБ «Линэзерс» каждый год в среднем производится 5-7 плановых лапароскопических и приблизительно 12-15 открытых операций спленэктомии у пациентов с гематологическими заболеваниями и гиперспленизмом, вызванным циррозом печени.
ЛС у гематологических больных широко используется в хирургической практике [2, 14]. Основными вопросами, поставленными на обсуждение Европейской ассоциацией эндоскопических хирургов, являются: операции на большой селезенке (продольный размер селезенки >15 см), визуализация и удаление добавочной селезенки при лапароскопии, кровотечение во время операции, вызванное портальной гипертензией у больных циррозом печени [10].
Цель работы - сравнение результатов лапароскопической и открытой спленэктомии (ОС) у пациентов с гематологическими заболеваниями и гиперспленизмом, вызванным циррозом печени.
Материал и методы
В ретроспективное исследование включены 147 больных с доброкачественными и злокачественными гематологическими заболеваниями и гиперспленизмом, вызванным циррозом печени, которые были оперированы в период 2002-2010 гг. в клинике РВКУБ «Линэзерс». Анализировались амбулаторные карты больных и их истории болезни.
Проанализированы такие факторы, как возраст и пол больного, продолжительность болезни до операции и применявшаяся дооперационная терапия.
Проводился полный анализ крови за 1-2 дня до операции и через 5-7 дней после нее.
Во всех наблюдениях для подтверждения гематологического заболевания перед операцией произведена трепанобиопсия.
Размер селезенки до операции определяли при УЗИ, после спленэктомии селезенку взвешивали на электронных весах и проводили ее гистологическое исследование. При очагах инфильтрации в селезенке, констатированной до операции, производили компьютерную томографию (КТ).
При подготовке больных к операции в соответствии с гематологическими показателями проводили трансфузии эритроцитной и тромбоцитной массы и свежезамороженной плазмы.
Физическое состояние больного оценивали по общепринятой классификации ASA (American Society of Anesthesiologists’).
Были проанализированы доступ к брюшной полости и селезенке - открытая или лапароскопическая операция, продолжительность операции, кровопотеря во время операции, послеоперационные осложнения и день выписки пациента после операции.
Все операции были произведены под эндотрахеальным наркозом, во время операции вводили назогастральный зонд, при выполнении ОС вводили мочепузырный катетер типа Foley 18F. В качестве антибактериального средства во всех наблюдениях при введении в наркоз внутривенно использовали 2 г цефоперазона.
При наличии риска тромбоза глубоких вен или тромбоэмболии легочной артерии проводили соответствующую профилактическую терапию.
В случае ОС при осуществлении срединной лапаротомии больной находился в положении лежа на спине с валиком под поясницей; если разрез проводили в левом подреберье, то больной лежал на правом боку (поворот на 45°). Техника операции зависела от величины селезенки и от ее расположения в брюшной полости.
При нормальной или умеренно увеличенной (12-20 см) селезенке чаще всего ее экстирпацию начинали с разделения lig. gastrolienale, lig. gastrocolicum и lig. pancreaticolienale. Затем лигировали и разделяли ножку селезенки, которую образуют селезеночные артерия и вена. Далее следуют разделение lig. phrenicolienale и удаление селезенки.
При большой селезенке (продольный размер >20 см) точно так же лигировали и разделяли lig. gastrocolicum, lig. lienocolicum, lig. pancreaticolienale, а если возможно, то и lig. phrenicolienale. Селезенку освобождали от окружающих тканей, которые могут быть очень плотными, и тогда орган может быть смещен в операционную рану. После этого производили лигирование и разделение ножки селезенки. Ножку селезенки лигировали дважды нитью из нерассасывающегося материала 00. При необходимости кровоточащие места ушивали. Во время открытой операции селезенку извлекали из брюшной полости целиком.
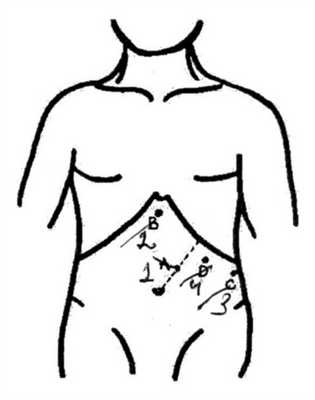
Во время лапароскопической операции больной находился в положении лежа на правом боку под углом 45°, так же с валиком под поясницей. Сначала брюшную полость пунктировали иглой Veressa посредине линии, соединяющей пупок со средней точкой, которая находится чуть ниже реберной дуги, и заполняли CO 2 до 12 мм рт.ст. (см. рис. 1). Рисунок 1. Места расположения троакаров во время лапароскопической операции. Объяснение в тексте. Затем вводили оптический 10-миллиметровый троакар (использовали оптику с углом 30° Olympus optical, Tokyo, Japan). После этого вводили рабочие троакры в эпигастрии слева от печеночной связки (10 мм; см. рис. 2), по linea axillaris anterior под реберной дугой (10 мм; см. рис. 3), по linea medioclavicularis sinistra на 2-3 см ниже реберной дуги (12 мм; см. рис. 4). Все места троакаров можно сдвинуть в зависимости от размера и размещения селезенки в брюшной полости.
При лапароскопической операции селезенку помещали в эндоскопический контейнер и затем извлекали через разрез длиной ~7 см, соединяющий проколы для троакаров 3 и 4. Брюшную полость после операции ушивали послойно.
Как открытая, так и лапароскопическая операции заканчиваются дренированием ложа селезенки.
После операции все больные находились под наблюдением в отделении интенсивной терапии.
Все пациенты вакцинированы Pneumo-23.
Данные исследования обработаны в программе SSPS 10.0, использованы непараметрические методы обработки данных.
Настоящее исследование является частью докторской диссертации и одобрено комиссией по этике Рижского университета им. Страдыня.
Результаты и обсуждение
Произведено 125 (85,03%) ОС и 22 (14,97%) ЛС.

В исследование включены 78 женщин и 69 мужчин. Средний возраст больных 52 года (от 18 до 80 лет). Существуют статистически достоверные различия в среднем возрасте больных, оперированных на селезенке: при ЛС он составил 39 лет, при ОС - 55 лет (p=0,012; табл. 1).
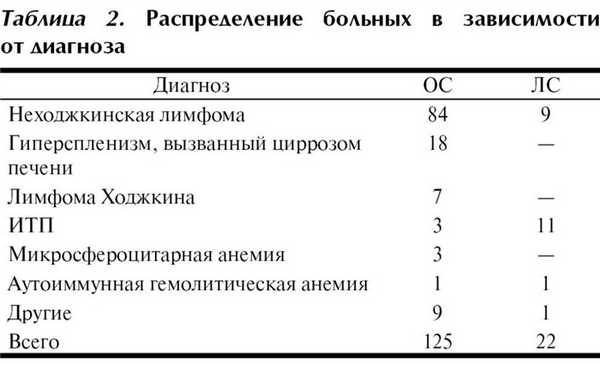
Распределение больных в зависимости от диагноза представлено в табл. 2. При оценке этих данных не обнаружено статистически достоверных различий между диагнозом и способом операции (p>0,05).

Продолжительность болезни до операции составила в среднем 30,15±8,49 мес, самое короткое время до операции - 1 мес после постановки диагноза, самое продолжительное - 276 мес. Средняя продолжительность болезни до операции в обеих группах статистически достоверно не различалась (p>0,05; табл. 3).
Определенные при УЗИ средние размеры селезенки (в группе ОС 19 см, в группе ЛС 12,4 см) статистически достоверно различаются (p
Физическое состояние больных перед операцией оценивалось по классификации ASA с I по IV (см. табл. 1). При использовании метода χ 2 эти данные статистически достоверно не различались в группах ЛС и ОС.
Статистически достоверно различается медиана установленного перед операцией абсолютного числа нейтрофилов - NAC (p=0,025), в то время как медиана числа тромбоцитов - TR не различается.
При сравнении данных медиана продолжительности ЛС была 143 мин, ОС - 90 мин (см. табл. 3). Эти данные статистически достоверно различаются (p<0,001).
Медиана кровопотери во время операции: ЛС - 450 мл, ОС - 400 мл; эти данные статистически достоверно не различаются.
Медиана массы селезенки, измеренная после операции, в группе ЛС равнялась 269 г, в группе ОС - 908 г. Эти данные статистически достоверно различаются (p
После операции произведено гистологическое исследование ткани добавочной селезенки.
В группе ОС (n=125) послеоперационные осложнения отмечены в 29 (23,2%), в группе ЛС (n=22) - в 5 (22,7%) наблюдениях. Частота осложнений при обоих способах операции статистически достоверно не различается (p=0,961, метод χ 2 ).
Трое больных умерли на 8, 23 и 64-й день после ЛС. У всех этих больных были злокачественные гематологические заболевания (у 2 - неходжкинская лимфома, у 1 - миелофиброз).
Во время ОС было произведено 86 биопсий печени, 42 биопсии лимфатических узлов брюшной полости, в связи с инфильтрационным процессом выполнены 4 резекции хвоста поджелудочной железы и 2 холецистэктомии. Конверсию осуществляли в 2 наблюдениях. В одном наблюдении ОС была произведена из-за увеличенного размера селезенки (продольный размер 20 см). В другом наблюдении обнаружен выраженный периспленит, и в связи с повышенным риском интраоперационного кровотечения была произведена открытая операция. В 3 наблюдениях выполнена симультанная операция - лапароскопическая холецистэктомия: при аутоиммунной гемолитической анемии (1), врожденном наследственном сфероцитозе (1), неходжкинской лимфоме (1).
Первую спленэктомию в 1549 г. произвел Adrian Zacarelli в Непале 24-летней женщине, у которой спленомегалия, возможно, была вызвана малярией [22]. Первую спленэктомию при гематологической болезни выполнили Sutherland и Burghad в 1910 г. для лечения наследственного сфероцитоза [4].
Изначально первые лапароскопические операции на селезенке применялись при ее неизмененном или немного увеличенном размере, например при ИТП, наследственном сфероцитозе, аутоиммунной гемолитической анемии [3, 4]. Наиболее часто ЛС использовали при ИТП, так как при этой болезни продольный размер селезенки в большинстве наблюдений не превышал нормы - 12 см [4, 14]. В проведенном исследовании также ЛС чаще всего применялась у больных ИТП, было начато использование лапароскопии при злокачественных гематологических заболеваниях.
На основании проведенного исследования отмечено статистически достоверное различие между возрастом больных, в группах ЛС и ОС: у более молодых больных применена ЛС (p=0,012). Это может быть объяснено тем, что пациенты с ИТП моложе и продольный размер селезенки у большинства из них не изменен.
По данным исследования, не существует статистически достоверного различия (p>0,05) между статусом больного по ASA и способом операции. ЛС возможна при любом статусе по ASA. Если принять во внимание, что с годами число сопутствующих заболеваний увеличивается, а класс ASA повышается, то ЛС можно успешно применять в старшей возрастной группе больных с диагнозом ИТП [8].
Примерно у 15-30% людей можно обнаружить добавочную селезенку. При наличии гематологического заболевания добавочную селезенку находят чаще, чем у прочих больных. Это важно своевременно диагностировать, чтобы во время операции удалить ее, уменьшив таким образом возможность рецидива болезни [14, 25]. Всего в ходе проведенного исследования добавочная селезенка обнаружена в 13 (8,8%) наблюдениях: до операции - в 8, во время ОС - в 5. Одна из них располагалась в большом сальнике, одна - у нижнего полюса селезенки, остальные - в области ворот селезенки. При ЛС добавочная селезенка не была обнаружена.
Медиана кровопотери как при ОС, так и при ЛС статистически достоверно не различается - соответственно 400 и 450 мл (p=0,823). M. Rosen и соавт. и M. Svensson и соавт. описывают меньшую кровопотерю при ЛС - 150-213 мл [23, 26]. С внедрением в нашей клинике новейших технологий - гармонического скальпеля SonoSurg («Olympus»), LigaSure™ сократились как длительность операции, так и величина кровопотери. Описаны также исследования по хирургии vessel sealing system (система заваривания сосудов) на селезенке, которая уменьшает кровотечение [13, 18, 23].
Продольный размер селезенки влияет не только на возможный выбор техники операции, но и на частоту осложнений. J. Horowitz и соавт. считают, что ОС у гематологических больных чревата высоким риском осложнений и опасна для жизни. В исследовании, проведенном J. Horowitz и соавт., количество больных с осложнениями достигает 52%. По некоторым данным, в случае выполнения ОС осложнения отмечаются в 14-16% наблюдений [12]. В проведенном нами исследовании ОС этот показатель равен 23,2% (29 наблюдений). Самое частое осложнение - гематомы операционных ран, в одном наблюдении отмечен абсцесс раны, в двух - гематома в ложе селезенки, в двух - позднее послеоперационное осложнение - псевдокиста поджелудочной железы. Такие серьезные осложнения, как поддиафрагмальный абсцесс, сепсис, послеоперационная пневмония, послеоперационная тромбоэмболия, не наблюдались.
Существует также повышенный риск осложнений при ЛС (5-60% наблюдений) [5, 9, 24, 26, 27, 28]. В проведенном исследовании в группе ЛС было 5 (22,7%) больных с осложнениями. В этой группе главной проблемой оказались гематомы в местах введения троакаров. Не наблюдалось статистически достоверного различия между частотой осложнений и способом операции (табл. 4). Для статистической оценки данных необходимо большее число наблюдений ЛС.
Имеются статистически достоверные различия в массе селезенки между группами ОС и ЛС. С помощью открытой операции по сравнению с лапароскопической удаляли заметно более тяжелые - 908 и 269 г. По имеющимся в литературе данным, способом ЛС оперировали селезенки массой 284-1051 г [9, 21, 24, 29].
Существуют статистически достоверные различия между медианой дня выписки в группах ОС и ЛС - 8 и 7 (p=0,035). Приводимые в литературе показатели в группах ЛС и ОС (от 2,4 до 8,3 дня) [5, 9, 21, 24, 27, 29] меньше полученных в нашем исследовании. В клинике можно было бы решить вопрос о сокращении этих сроков, например выписывать пациентов и в выходные дни, что в настоящий момент не практикуется. Также после ОС число дней до выписки можно уменьшить с 8 до 6-6,5, как описано в литературе [9, 27].
Из дополнительных манипуляций при ЛС проводилась только лапароскопическая холецистэктомия. Биопсия ни лимфоузлов брюшной полости, ни печени при ЛС не проводилась. Это манипуляции, которые могли бы осуществляться в будущем, поскольку в литературе описана биопсия и печеночной ткани, и лимфоузлов брюшной полости, и резекция хвоста поджелудочной железы [30].
Имеются первые публикации, посвященные операциям на селезенке с использованием методики единого доступа (SILS) [27].
Болезни крови и спленэктомия
Наиболее обширную группу больных, нуждающихся в хирургическом удалении селезенки - спленэктомии, в плановой хирургии составляют пациенты с заболеваниями крови.
Гематологические показания к данному вмешательству включают в себя группы заболеваний, основа клинической картины и ведущий патогенетический механизм которых выражается в выполнении селезенкой своих физиологических функций, приобретающих в условиях того или иного нозологического состояния патологический характер (микросфероцитоз, идиопатическая тромбоцитопеническая пурпура, целый ряд аутоиммунных анемий, миелолейкоз, «волосатоклеточный» лейкоз).
Показаниями к спленэктомии при гематологических заболеваниях служат также абдоминальный болевой синдром, вызванный периспленитом, спленомегалией, компрессией и дисфункцией органов брюшной полости, частые инфаркты селезенки, блуждающая селезенка. Рассматриваемое вмешательство в сочетании с биопсией лимфатических узлов брюшной полости, печени выполняется с целью определения типа и распространенности лимфопролиферативных заболеваний, выбора оптимальной лечебной программы. В случае неэффективности консервативных мероприятий при апластических анемиях, спленэктомия может применяться, как операция отчаяния перед трансплантацией костного мозга.
В гематологии показания к спленэктомии могут быть как экстренными, так и плановыми. Экстренную операцию производят у больных с тромбоцитопенической пурпурой при угрозе кровоизлияния и кровотечения, гемобластозах в случае угроза разрыва селезенки; плановую - при аутоиммунной гемолитической анемии, микросфероцитозе, талласэмии, протекающей со спленомегалией и явлениями гиперспленизма, а также при неэффективности гемотрансфузионной терапии.
Как один из методов лечения спленэктомия используется для коррекции хронического миелолейкоза. При ее выполнении удаляется очаг наиболее интенсивного патологического кроветворения и уменьшается масса опухолевых клеток. Удаление селезенки позволяет замедлить развитие терминальной стадии миелолейкоза, повышает чувствительность к цитостатической терапии (М.А. Волкова, 1979).
Однако спленэктомия не является обязательным методом лечения хронического миелолейкоза и производится по определенным показаниям, сформулированным Ф.Д. Файнштейном (1992) и представленным ниже.
- Срочные - разрыв и угрожающий разрыв селезенки.
- Относительные - тяжелый абдоминальный дискомфорт, связанный с большим размером селезенки, повторные перисплениты с резко выраженным болевым синдромом, блуждающая селезенка с опасностью перекрута ножки, глубокая тромбоцитопения, обусловленная гиперспленизмом, значительно выраженные гемолитические кризы.
Существуют также определенные показания к спленэктомии при сублейкемическом миелозе:
- выраженная гемолитическая анемия, как аутоиммунная, так и гиперспленическая, не поддающаяся консервативной терапии и требующая частых гемотрансфузий;
- большая величина селезенки, рецидивирующие инфаркты селезенки, механические компрессионные явления;
- наличие внепеченочного портального блока.
Противопоказаниями для спленэктомии при сублейкемическом миелозе являются:
- ДВС - синдром;
- одновременное значительное увеличение печени;
- терминальная стадия заболевания, характеризующаяся быстрым ростом селезенки, внезапным развитием цитопении, лихорадкой, оссалгией;
- формы заболевания с лейкоцитозом;
- наличие тромбоцитоза.
Правильный отбор больных для спленэктомии при этой форме лейкоза позволяет получить значительный терапевтический эффект сроком более 5 лет.
При хроническом лимфолейкозе показаниями к спленэктомии являются:
спленомегалия, не поддающаяся влиянию лучевой и цитостатической терапии и создающая выраженный абдоминальный дискомфорт, вызывающая явления компрессии органов брюшной полости;
«Волосатоклеточный» лейкоз представляет собой особую форму хронического лимфолейкоза, при котором лимфоциты имеют ряд морфологических признаков: выросты цитоплазмы в виде ворсинок и ядро, напоминающее ядро бластных клеток. Заболевание характеризуется увеличением селезенки, нормальными размерами периферических лимфатических узлов, а также выраженной цитопенией. Приоритетным методом лечения «волосатоклеточного» лейкоза является спленэктомия, приводящая к уменьшению интоксикации и улучшению показателей периферической крови.
Удаление селезенки в последнее время рассматривается как способ лечения анемии при полицитемии (эритремии) в 3 стадии. Показанием к спленэктомии при этом заболевании являются:
- гемолитическая анемия и тромбоцитопения, обусловленные как гиперспленизмом, так и аутоиммунным механизмом; о гемолитическом характере анемии свидетельствует ретикулоцитоз и уменьшение продолжительности жизни эритроцитов;
- значительная величина селезенки, обуславливающая компрессионные осложнения, повторные инфаркты селезенки;
- осложнения внутри- и внепеченочной гипертензии с клиническими проявлениями.
Противопоказаниями к спленэктомии могут быть:
- ДВС-синдром,
- высокий лейкоцитоз,
- увеличение печени,
- полиорганная недостаточность.
Предоперационная подготовка у гематологических больных имеет ряд специфических особенностей в связи с частым развитием геморрагического диатеза. Перед вмешательством необходимо добиться максимального уменьшения кровоточивости с помощью гемостатических растворов, переливания крови и кровезаменителей, сосудоукрепляющих средств.
Как метод лечения спленэктомия используется не только при онкологических, но и при других заболеваниях крови.
Гемолитические анемии - группа наследственных и приобретенных заболеваний, характеризующихся повышенным внутритканевым и внутри сосудистым разрушением эритроцитов.
Спленэктомия как метод лечения применяется при каждой из перечисленных форм гемолитических анемий.
Микросфероцитарная анемия (болезнь Минковского-Шоффара) - наследственное заболевания, обусловленное дефектом белков мембраны эритроцитов, приобретающих сферическую форму с последующим их раз-рушением макрофагами селезенки. Наиболее эффективным методом лечения данного заболевания является спленэктомия, приводящая к клиническому выздоровлению.
Ниже приведены показания к оперативному вмешательству, определенные как абсолютные и относительные.
- выраженная анемия с клиническими проявлениями, гемолитическими кризами;
- осложнения заболевания желчной коликой и камнем в желчном пузыре;
- осложнения трофическими язвами голени;
- упорная желтуха.
- кризовое течение заболевания (гемолитические кризы сменяются периодами анемии);
- большая величина селезенки и появление признаков гиперспленизма;
- абсолютные показания, но при меньшей степени их выраженности.
Наличие камней в желчном пузыре требует одновременного удаления и желчного пузыря, и селезенки. При других наследственных гемолитических анемиях (серповидноклеточная анемия, талассемия) спленэктомия производится в случае значительного увеличения селезенки и развития лейкопении и тромбоцитопении.
Приобретенные аутоиммунные гемолитические анемии - это заболевания, обусловленные образованием антител к собственным антигенам эритроцитов, что ведет к их разрушению. Аутоиммунные гемолитические анемии могут быть идиопатическими (возникающие без известной причины) и симптоматическими (развивающиеся на фоне других известных заболеваний, чаще всего аутоиммуных - СКВ, гепатит, тиреоидит, хронический лимфолейкоз, СПИД). Препаратами выбора при лечении данного заболевания являются глюкокортикостероиды. Больным, у которых применение глюкокортикостероидов не дает ожидаемого эффекта или возникает необходимость в постоянном приеме препарата, а также в случае рецидива гемолиза после отмены преднизолона или развития осложнений в результате проводимой глюкокортикостероидной терапии, рекомендуется спленэктомия. Согласно Л.И. Идельсону (1985 г.), оперативное вмешательство можно рекомендовать при аутоиммунной гемолитической анемии пациентам, вынужденным более 4-5 месяцев постоянно принимать преднизолон или имевшим частые рецидивы в течение года, когда перерывы в лечении преднизолоном не превышают 2 месяца. Спленэктомия дает положительный эффект в 60% случаев. У больных гемолитической анемией, обусловленной гемолизом, операция не предотвращает гемолитические кризы, но они наблюдаются реже, чем до спленэктомии, и легче купируются глюкокортикостероидами; таким образом, и в данном случае положительный эффект от спленэктомии очевиден.
Апластическая анемия - заболевание кроветворной системы, характеризующееся депрессией кроветворения, развитием панцитопении и жировым перерождением костного мозга. Существует несколько этиологических форм апластической анемии - идиопатическая, конституциональная форма (анемия Фанкони), наследуемая по аутосомно-рециссивному типу; приобретенная, вызываемая физическими и химическими агентами; приобретенная, развивающаяся по механизму идиосинкразии после приема некоторых лекарственных препаратов (левомицетин, бутадион, препараты золота); приобретенная, вызываемая хроническим активным гепатитом; апластическая анемия при беременности; анемия, развивающаяся при других заболеваниях: цито-мегаловирусная инфекция, зоб Хашимото, туберкулез легких.
Лечебная программа при апластической анемии состоит из нескольких этапов.
1-й этап: лечение антилимфоцитарными глобулинами, циклоспорином.
2-й этап: пересадка костного мозга и лечение колониестимулирующими факторами.
3-й этап: выполнение спленэктомии.
4-й этап: трансфузия эритроцитов, десферанотерапия, трансфузии тромбоцитов, лечение иммуноглобулинами.
Как видно из вышеприведенной схемы, спленэктомия является одним из основных методов лечения. Л.И. Дворецкий и П.А. Воробьев (1994) считают, что данное вмешательство показано при отсутствии эффекта от глюкокортикоидов всем больным, если они не имеют септических осложнений, а также при подростковой форме парциальной клеточной аплазии. В день операции необходимо увеличить дозу преднизолона в 2-3 раза по сравнению с исходной. Для профилактики кровотечения вводится концентрат тромбоцитов (3-4 дозы от одного донора).
Положительный эффект спленэктомии наблюдается у 84% больных, он обусловлен уменьшением продукции антител против кроветворных клеток, а также снижением секвестрации крови. Но могут быть и противопоказания к спленэктомии (О.К. Гаврилов, 1987 г.), приводимые ниже.
- Быстрый и стойкий положительный эффект, достигаемый другими методами лечения.
- Выраженный геморрагический синдром.
- Гипокоагуляция не обусловленная тромбоцитопенией (фибриногенопения, высокая активность фибринолиза и др.).
- Высокий относительный лейкоцитоз (в периферической крови - 80% и более, в костном мозге - 50% и более), стойко удерживающийся несколько месяцев.
- Пожилой возраст больного.
Показания к спленэктомии при ИТП приведены ниже.
- Отсутствие эффекта после глюкокортикоидной терапии. По данным Ф.И. Гошарова и И.Н. Бокарева (1992), спленэктомия рекомендуется больным с длительностью заболевания более 1 года при наличии 2-3 обострений после глюкокортикоидной терапии.
- Наличие серьезных осложнений глюкокортикоидной терапии, что делает невозможным лечение этими препаратами.
- Рецидивы тромбоцитопении после отмены глюкокортикоидов.
- Абсолютные показания к спленэктомии - тяжелый геморрагический и тромбоцитопенический синдромы с множественными или значительными геморрагиями в области лица, на языке и склерах, головная боль с менингеальными знаками (кровоизлияниями в мозг и его оболочки), геморрагии в сетчатку глаза, очень низкое содержание тромбоцитов в крови.
Механизм положительного действия спленэктомии заключается в уменьшении разрушения тромбоцитов, увеличении продолжительности их жизни. В день операции и в послеоперационном периоде дозу преднизолона увеличивают в 2 раза по сравнению с дозой, применявшейся в процессе лечения. Прием глюкокортикоидов после вмешательства продолжают до тех пор, пока не нормализуется число тромбоцитов, затем эти препараты постепенно отменяют. Обычно после спленэктомии наблюдается быстрый подъем тромбоцитов в крови, поэтому операция чрезвычайно эффективна для больных с угрожающим жизни кровотечением.
Полные и стойкие ремиссии у пациентов с идиопатической тромбоцитопенической пурпурой наступают в 50-60% случаев; рецидивирование заболевания после оперативного вмешательства может быть обусловлено добавочной селезенкой, которую следует удалить, или повышенным разрушением тромбоцитов в печени. При остро протекающей тромбоцитопении с выраженным геморрагическим синдромом должна проводиться срочная спленэктомия на фоне интенсивной терапии глюкокортикоидами и трансфузий тромбоцитов.
Обострение идиопатической тромбоцитопенической пурпуры во время беременности требует выполнения спленэктомии при любом сроке беременности.
Необходимо отметить, что показания к спленэктомии следует выставлять после обсуждения каждого конкретного случая консилиумом специалистов, и проводить данное вмешательство после тщательного обследования и предоперационной подготовки больного. Оптимальным видом оперативного доступа для выполнения спленэктомии является лапароскопический, однако следует учитывать ряд особенностей, таких, как ограничения к наложению пневмоперитонеума, анатомические условия (размеры органа, спаечный процесс, висцеральное ожирение), материально-техническая база клиники, квалификация и мануальные навыки хирургической бригады, определяющие исход оперативного вмешательства.
Полезные ссылки на различные разделы сайта по вопросам оперативного лечения болезней крови:
Показания, доступ и ход операции спленэктомии при спленомегалии
Гематологический научный центр Минздравсоцразвития РФ, Москва
Удаление селезенки при спленомегалии у гематологических больных
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2012;(8): 55‑59
Силаев М.А., Карагюлян С.Р., Шавлохов В.С., Точенов А.В., Гржимоловский А.В., Пантелеев И.В., Веревкина Н.А., Данишян К.И. Удаление селезенки при спленомегалии у гематологических больных. Хирургия. Журнал им. Н.И. Пирогова. 2012;(8):55‑59.
Silaev MA, Karagiulian SR, Shavlokhov VS, Tochenov AV, Grzhimolovskiĭ AV, Panteleev IV, Verevkina NA, Danishian KI. The spleen removal by splenomegaly in hematological patients. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2012;(8):55‑59. (In Russ.).
При массивных (селезенка длиной 25-30 см, массой >2000 г) и гигантских (селезенка занимает более половины объема брюшной полости и составляет в длину более 30 см) размерах селезенки операцией выбора остается открытая спленэктомия (ОСЭ). Спленомегалия обусловливает технические трудности при выполнении операции и сопряжена с высоким риском осложнений. Главным и ведущим фактором, осложняющим выполнение ОСЭ в таких условиях, является соотношение размеров селезенки и свободного пространства в брюшной полости. Создание максимально широкого доступа, предварительное выделение и перевязка селезеночной артерии in situ, щадящее отделение поджелудочной железы от ворот селезенки вместо травматичного традиционного вывихивания селезенки в рану, использование преимущественно лигатурного способа гемостаза составляют основу методического подхода к выполнению спленэктомии в условиях массивной и гигантской спленомегалии. В работе анализируется опыт 374 ОСЭ, выполненных в условиях массивной (254) и гигантской (120) спленомегалии в период с 1988 по 2010 г. Стандартизация техники выполнения ОСЭ при спленомегалии позволила в 2,5 раза уменьшить количество послеоперационных осложнений (с 26,9 до 10,8%), в 1,8 раза снизить количество интраоперационных осложнений и количество повторных оперативных вмешательств с целью ликвидации хирургических осложнений, сократить на 17% интраоперационную кровопотерю. Частота развития острого послеоперационного панкреатита уменьшилась в 4 раза, внутрибрюшного кровотечения - в 2 раза, поддиафрагмальных абсцессов - в 1,5 раза.
Спленэктомию (СЭ) при массивных (селезенка длиной 25-30 см, массой >2000 г, нижний полюс медиально достигает средней линии живота и пупка, а каудально - гребня левой подвздошной кости) и гигантских (селезенка занимает более половины объема брюшной полости и составляет в длину более 30 см) размерах селезенки относят к травматичным операциям [2, 4-6, 10-12, 19, 20, 32]. Главным и ведущим фактором, осложняющим выполнение СЭ в таких условиях, является соотношение размеров селезенки и свободного пространства в брюшной полости. При нормальных размерах селезенки или умеренной спленомегалии (≤20 см) используется преимущественно лапароскопическая спленэктомия (ЛСЭ) или ее варианты (ЛСЭ с ручной ассистенцией, лапароскопически дополненная СЭ). Однако преимущества этого малоинвазивного метода теряются при размерах селезенки >20-25 см [7, 11, 14, 16, 17, 19, 28, 30]. Ряд зарубежных авторов [22, 24, 26, 33, 34] считают возможным применение лапароскопических методов при массивной спленомегалии, несмотря на значительное увеличение длительности операции, бóльший объем кровопотери и высокий индекс конверсии (переход к открытой спленэктомии). Большинство отечественных хирургов [7, 14, 16, 17, 19] считают массивную спленомегалию абсолютным противопоказанием к выполнению ЛСЭ. При массивных и гигантских размерах селезенки создание необходимого для лапароскопической операции рабочего пространства чаще всего невозможно, хотя мы и располагаем наблюдением успешной ЛСЭ при длине селезенки 34 см. Операцией выбора в таких условиях остается открытая спленэктомия (ОСЭ).
За последние 15-20 лет в мире отмечено более чем двукратное увеличение числа больных лимфатическими опухолями, часто сопровождающимися спленомегалией. Среди них возрастает количество больных с массивной и гигантской спленомегалией [15, 21, 23, 25, 27, 29, 31, 35]. ОСЭ у таких больных - наиболее частое хирургическое вмешательство, поскольку является частью лечебного протокола и нередко выступает в качестве первого этапа терапии [8, 13]. Удаление основной массы опухоли дает возможность проведения в последующем полихимиотерапии (ПХТ).
Цель работы - систематизация хирургических приемов и стандартизация техники выполнения каждого этапа ОСЭ для снижения травматичности операции и улучшения результатов хирургического лечения при массивных и гигантских размерах селезенки.
За период с 1988 по 2010 г. в отделении хирургии ГНЦ выполнено 374 ОСЭ, из них при массивной спленомегалии - 254, при гигантской - 120. Максимальный размер удаленной селезенки составил 41 см, масса - 9000 г. Большую часть оперированных составили больные с лимфопролиферативными заболеваниями - 281 (75,1%), с миелопролиферативными заболеваниями - 84 (22,4%). Мужчин было 189, женщин - 185. Возраст больных от 15 до 87 лет (в среднем 53,8 года). В возрасте старше 60 лет было 119 (31,8%) больных. Все оперированные были разделены на 2 основные группы. В 1-ю группу вошли 275 больных с массивной и гигантской спленомегалией, оперированные в период с 1989 по 2005 г., во 2-ю - 99 больных, которым СЭ выполнена с 2006 по 2010 г. с использованием нового методического подхода. Критериями сравнения были объем интраоперационной кровопотери, длительность операции, интра- и послеоперационные хирургические осложнения в каждой из двух групп.
Статистический анализ данных проводился с использованием методов описательной статистики и сравнения выборок: для непрерывных показателей - критерий Стьюдента и U-критерий Манна-Уитни, для дискретных - точный критерий Фишера. Проверка распределения на нормальность осуществлялась с помощью критериев согласия Пирсона (χ-квадрат) и Колмогорова-Смирнова. Данные представлены в виде среднего арифметического ± стандартное отклонение, размаха выборки, медианы. Обработка данных проводилась с использованием программы Statistica 6.0 (StatSoft, Inc.).
Также проведен сравнительный анализ результатов ОСЭ в зависимости от методики и техники выполнения операции (с предварительной перевязкой селезеночной артерии in situ и без предварительной перевязки). Стандартизированная методика ОСЭ при массивной и гигантской спленомегалии заключалась в строгом соблюдении определенной последовательности всех этапов операции: создание максимально широкого доступа к селезенке (тотальная срединная лапаротомия, при необходимости дополненная косым разрезом), мобилизация селезенки, визуализация и перевязка селезеночной артерии in situ до вывихивания, обработка заднедиафрагмальной поверхности под визуальным контролем, щадящее отделение поджелудочной железы от ворот селезенки, выведение селезенки в рану и обработка сосудов ножки селезенки, ушивание ложа селезенки с использованием преимущественно лигатурного способа гемостаза, дренирование и ушивание раны брюшной стенки.
Использование предлагаемого методического подхода при выполнении СЭ позволило снизить количество интраоперационных осложнений с 28 до 15%, уменьшить в 2,5 раза количество послеоперационных осложнений, сократить на 17% интраоперационную кровопотерю. Количество повторных оперативных вмешательств с целью ликвидации хирургических осложнений уменьшилось в 1,8 раза. Стандартизированный методический подход позволил расширить объем операции и выполнить в 2,5 раза больше сочетанных операций, не осложняя течение послеоперационного периода (p in situ во время операции и без нее. Однако при вывихивании селезенки без предварительной перевязки селезеночной артерии количество зафиксированных интраоперационных осложнений в 2,2 раза больше, а послеоперационных в 2,5 раза больше, чем при предварительной ее перевязке. Сочетанных операций выполнено в 2 раза больше по сравнению с 1-й группой. Сравнительный анализ ОСЭ в условиях гигантской спленомегалии показал преимущество систематизированного методического подхода - не только снизилось количество интраоперационных (в 1,5 раза) и послеоперационных (почти в 2 раза) осложнений, но и уменьшился объем интраоперационной кровопотери на 30% (p <0,05). Количество повторных оперативных вмешательств с целью ликвидации хирургических осложнений уменьшилось более чем в 2 раза. Щадящая техника выполнения ОСЭ позволила в 7 раз чаще выполнять сочетанные операции (табл. 1). При анализе послеоперационных хирургических осложнений, помимо снижения общего количества осложнений в 2,3 раза, выявлено изменение и в структуре осложнений. Так, частота развития острого послеоперационного панкреатита уменьшилась в 4 раза, внутрибрюшного кровотечения в 2 раза, поддиафрагмального абсцесса - в 1,5 раза. Закономерным итогом снижения количества хирургических осложнений при использовании систематизированного методического подхода явилось и снижение количества выполненных повторных хирургических вмешательств в 1,8 раза. Летальных исходов при хирургических осложнениях в раннем послеоперационном периоде не зафиксировано. В результате анализа хирургических вмешательств были установлены основные факторы риска осложнений ОСЭ при массивной и гигантской спленомегалии (табл. 2).
С целью создания максимально широкого доступа к селезенке и обеспечения безопасности выполнения дальнейших этапов операции с 2006 г. всем больным с массивной и гигантской спленомегалией выполняли тотальную или субтотальную срединную лапаротомию. В случае гигантской спленомегалии с выраженным периспленитом по задней поверхности селезенки, признаками портальной гипертензии срединный разрез дополняли косопоперечным разрезом в левом подреберье. Доступ обеспечивает свободное для манипуляции селезенкой пространство, позволяет выполнить под контролем зрения мобилизацию верхнего полюса и задней поверхности селезенки.
Традиционная техника выполнения ОСЭ предполагает вывихивание селезенки в рану. Это самый травматичный и ответственный этап операции. Именно на этом этапе происходит массивная одномоментная интраоперационная кровопотеря вследствие надрывов перерастянутых, истонченных сосудов и повреждения капсулы хвоста поджелудочной железы, что зачастую приводит к тяжелому послеоперационному панкреатиту, панкреатическим свищам и поддиафрагмальным абсцессам. В подобной ситуации мы настаиваем на обязательном выделении и перевязке селезеночной артерии in situ до вывихивания. После перевязки артерии на протяжении размеры селезенки сокращались, паренхима ее становилась более дряблой, вследствие этого дополнительно увеличивалось рабочее пространство. Часть депонированной крови селезенки поступала в кровяное русло, что в какой-то мере компенсировало интраоперационную кровопотерю.
Важным этапом операции является обеспечение надежного гемостаза. При гигантской спленомегалии в условиях портальной гипертензии значительный сброс крови из селезенки осуществляется в хорошо развитые венозные забрюшинные коллатерали. Остановка диффузного кровотечения в области ложа селезенки с помощью электрокоагуляции в таких условиях не обеспечивает надежного гемостаза. В послеоперационном периоде нередко наблюдается длительное поступление крови по дренажу, иногда требуется релапаротомия для ревизии и остановки кровотечения. В связи с этим гемостаз осуществляли преимущественно путем перевязки краев разреза задней париетальной брюшины и наложения дополнительно П-образных гемостатических швов (лигатурный способ с прошиванием).
Для динамической оценки кровопотери в раннем послеоперационном периоде и контроля за характером отделяемой жидкости устанавливали две контрольные дренажные трубки к ложу селезенки. Два дренажа необходимы с целью адекватного дренирования большой раневой поверхности в случае закрытия просвета одного из дренажей сгустком крови. С учетом создания широкого оперативного доступа при использовании дополнительного косого разреза особое значение у больных с массивной и гигантской спленомегалией, нередко с развитыми венозными коллатералями в передней брюшной стенке имеет тщательное восстановление анатомической непрерывности тканей.
Таким образом, массивные или гигантские размеры селезенки создают технические трудности при выполнении открытой спленэктомии, сопряжены с высоким риском развития интра- и послеоперационных осложнений. Особенностями стандартизированной техники выполнения спленэктомии у таких больных являются создание максимально широкого доступа с использованием дополнительных разрезов, обеспечивающего обзор всех поверхностей селезенки; предварительное выделение и перевязка селезеночной артерии in situ для увеличения рабочего пространства; щадящее отделение поджелудочной железы от ворот селезенки; использование преимущественно лигатурного способа гемостаза; установка дополнительного дренажа к ложу селезенки. Неукоснительное соблюдение принципов предлагаемой методики позволяет минимизировать объем кровопотери, существенно снизить количество хирургических осложнений.
Доля абдоминальной травмы составляет 1,5-4,4% всех механических повреждений (А.С. Ермолов, 2009). Из них повреждения селезенки составляют 10-30%. Наиболее часто селезенка повреждается при закрытой травме живота - в 85%, значительно реже - при ранениях - в 15% наблюдений [15]. Большинство пациентов с повреждениями селезенки составляют люди трудоспособного возраста [1], у которых повреждения органов брюшной полости являются одной из ведущих причин смерти [8], что представляет серьезную социальную проблему и диктует необходимость дальнейшего поиска путей оптимизации лечебных алгоритмов и быстрейшей реабилитации. Обращает на себя внимание отсутствие тенденции к снижению летальности при повреждениях селезенки, которая за последние 20 лет сохраняется 6-7% [7].
В настоящее время при лечении повреждений селезенки используются спленэктомия, органосохраняющие операции и консервативный метод. Последние два способа применяются в основном при травме I и II степени (Organ Injury Scaling: Spleen and Liver) [10, 12, 20]. При выполнении органосохраняющих операций малая подвижность, полнокровие, слабая капсула и нежная паренхима приводят к неустойчивому гемостазу, что не позволяет даже на современном этапе широко их использовать. Лечебно-диагностический алгоритм в настоящее время представлен динамическим ультразвуковым исследованием, компьютерной томографией и при необходимости эмболизацией селезеночной артерии. В отличие от спленэктомии использование указанных выше методов сопряжено с высоким риском двухмоментного кровотечения, образования абсцессов [6, 16, 21]. Таким образом, на сегодняшний день наиболее часто выполняемым оперативным вмешательством является спленэктомия. Благодаря технологическому прогрессу в хирургии это вмешательство может быть выполнено видеолапароскопическим методом. В плановой хирургии видеолапароскопическая спленэктомия выполняется с 1991 г., отработаны технические аспекты, доказаны эффективность и надежность ее применения, а также преимущества перед «традиционной» операцией [4, 5, 9, 17-19]. Однако публикации, посвященные видеолапароскопической спленэктомии при травме селезенки, единичны и не позволяют на основании данных литературы четко стандартизировать подход к выполнению видеолапароскопической спленэктомии у этой категории пациентов [2, 3, 11, 13, 14].
В связи с изложенным проведен сравнительный анализ видеолапароскопической и «открытой» спленэктомии у пациентов с повреждением селезенки.
Цель исследования - оценка возможности выполнения и эффективности видеолапароскопической спленэктомии при повреждениях селезенки.
Работа основана на анализе результатов лечения 25 больных, оперированных по поводу повреждений селезенки за период с 2009 по 2011 г. Больные были разделены на 2 группы - основную и контрольную. Пациентам основной группы выполняли видеолапароскопическую спленэктомию, контрольной - «открытую» спленэктомию. У всех больных были повреждения селезенки II и III степени по классификации Organ Injury Scaling: Spleen and Liver.
С учетом отсутствия доказательств нормального распределения выборки характеристики выборки приведены в виде: Ме (Q1;Q3), где Ме - медиана, Q1 и Q3 - верхний и нижний квартили соответственно.
Как видно из табл. 1, большинство больных (68%) были мужчинами. Медиана возраста в основной и контрольной группах составила соответственно 22 и 27 лет. Медиана времени до поступления в стационар составила 4 ч в основной группе и 1,5 ч в контрольной группе. В 24 наблюдениях прослежена четкая связь с травмой. Лишь у одной больной 63 лет не удалось установить такую связь.
Медиана тяжести повреждения по шкале Injury Severity Score составила 17 и 16 в основной и контрольной группах.
Тяжесть состояния оценивалась по шкале Revised Trauma Score и медиана составила соответственно 7,108 и 6,376. Во время операции у пациентов основной и контрольной групп медиана объема гемоперитонеума составила 0,3 л в обеих группах.
Всем пациентам выполняли ультразвуковое исследование и компьютерную томографию органов брюшной полости и забрюшинного пространства, рентгенографию груди и живота, клинические анализы крови и мочи.
Как видно из табл. 1, группы сопоставимы по представленным параметрам, что позволяет провести сравнительный анализ.
Показаниями к видеолапароскопии считали повреждение селезенки III степени и выше по OIS; наличие гематомы селезенки с риском ее двухмоментного разрыва.
Кроме того, в ситуациях, когда клинико-инструментальная картина не позволяла исключить повреждение селезенки и имелось увеличение объема жидкости в брюшной полости при ультразвуковом исследовании в динамике, мы считали целесообразным выполнять диагностическую видеолапароскопию.
Техника операции
Первые операции выполняли в положении больного на спине. В последующем мы пришли к выводу о более целесообразном и удобном для манипулирования на селезенке положении на правом боку, что создает большее рабочее пространство, а также обеспечивает перемещение внутренних органов за счет силы тяжести.
Пневмоперитонеум накладывали с помощью иглы Вереша до достижения значений внутрибрюшного давления 12-14 мм рт.ст. Параумбиликально вводили 10-миллиметровый троакар и 30-градусный лапароскоп, а также 5-миллиметровый троакар для манипулятора в левом подреберье. Оценивали объем гемоперитонеума и возможность видеолапароскопической спленэктомии, после чего устанавливали дополнительные троакары: в правом подреберье по срединно-ключичной линии (5 мм), в эпигастрии (10 мм). Троакар в левом подреберье меняли на 10- или 12-миллиметровый.
Для безопасной тракции, визуализации и сокращения интраоперационной кровопотери был разработан оригинальный метод (заявка на получение патента №2010141183), заключающийся в заведении в брюшную полость через троакар силиконовой трубки, которую после пересечения селезеночно-диафрагмальной связки оборачивали вокруг ее ножки (включая короткие желудочные артерии, селезеночную артерию и вену). После этого трубку захватывали эндоскопическим зажимом за оба конца таким образом, чтобы образовавшаяся петля сдавливала сосудистую ножку селезенки в области ее ворот и осуществлялась ее тракция вверх. Этот прием позволил хорошо визуализировать сосуды селезенки и выполнить спленэктомию, используя 3 троакара.
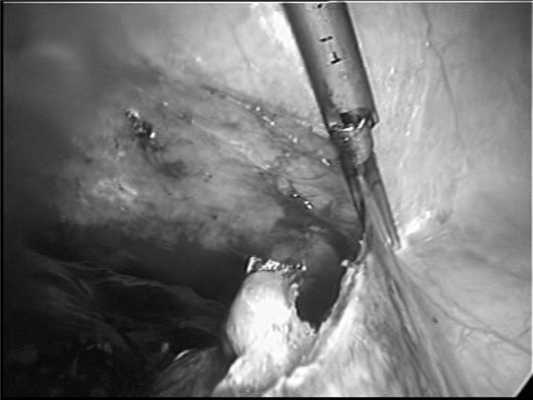
В первую очередь с помощью биполярной коагуляции или ультразвуковых ножниц Ultracision (см. рисунок, а) Рисунок 1. Этапы лапароскопической спленэктомии. а - пересечение связочного аппарата селезенки с помощью ультразвуковых ножниц Ultracision. пересекали селезеночно-ободочную и селезеночно-желудочную связки.

Далее визуализировалась поджелудочно-селезеночная связка с проходящими в ней артерией и веной, при этом хорошо определялись хвост поджелудочной железы и ворота селезенки. При выполнении первых двух операций ножку селезенки обрабатывали сшивающим аппаратом Endo GIA 60 (высота скрепки 2,5 мм) и с дополнительным наложением гемостатических Z-образных швов (см. рисунок, б). Рисунок 1. Этапы лапароскопической спленэктомии. б - пересечение ножки селезенки сшивающим аппаратом.

В дальнейшем, в 7 наблюдениях использовали аппарат Ligasure, что было достаточно для надежного гемостаза (см. рисунок, в). Рисунок 1. Этапы лапароскопической спленэктомии. в - пересечение ножки селезенки с помощью аппарата Ligasure.
После пересечения сосудистой ножки с помощью биполярного зажима и ножниц или ультразвуковых ножниц пересекали селезеночно-почечную связку. Селезенку отделяли тупым способом от забрюшинного пространства. Далее селезенку и сгустки крови помещали в эндоконтейнер, предварительно введенный в брюшную полость. Брюшную полость тщательно промывали изотоническим раствором натрия хлорида, после чего проводили контроль гемостаза. Левое поддиафрагмальное пространство и малый таз дренировали силиконовыми трубками. Эндоконтейнер подтягивали через разрез от троакара (12 мм) и селезенку фрагментарно удаляли.
Сравнительный анализ течения послеоперационного периода в основной и контрольной группах представлен в табл. 2.
При сравнении результатов лечения пациентов с повреждением селезенки в двух группах получены следующие результаты:
Медиана длительности оперативного вмешательства в основной группе составила 2,5 ч, в контрольной - 1,2 ч. Значительную разницу в длительности выполнения операции в основной и контрольной группах мы связываем с этапом отработки методики видеолапароскопической спленэктомии.
В послеоперационном периоде прослежена разница в сроках использования анальгетиков, что объясняется отсутствием большого разреза передней брюшной стенки у больных основной группы.
Более ранняя активизация также отмечена у больных основной группы, у которых был менее выражен болевой синдром и меньше объем операционной травмы. Медиана сроков разрешения пареза составила соответственно 24 и 48 ч у больных основной и контрольной групп.
Меньшее количество легочных осложнений в основной группе можно связать с более ранней активизацией пациентов и менее выраженным болевым синдромом.
Гнойно-воспалительных осложнений и летальных исходов не было в обеих группах.
Представляют интерес следующие клинические наблюдения.
Больная У., 63 лет, поступила 23.04.10 в тяжелом состоянии с жалобами на боль за грудиной, затрудненное дыхание, головокружение. Похожий приступ 20.04 купировался самостоятельно. Травмы отрицала. Госпитализирована в отделение кардиологической реанимации с диагнозом: ИБС, нестабильная стенокардия, тромбоэмболия мелких ветвей легочной аретрии. Выполнена сцинтиграфия легких, при этом признаков тромбоэмболии легочной артерии не обнаружено. Проводилась инфузионная, дезинтоксикационная, бронхолитическая терапия с положительным эффектом. 29.04 отмечено ухудшение состояния: появились боли в левом подреберье и мезогастральной области. Выполнено УЗИ брюшной полости и забрюшинного пространства, отмечено разобщение листков брюшины вокруг селезенки до 0,5 см. При цветовом допплеровском картировании в верхнем полюсе селезенки подкапсульно имеется гипоэхогенная зона размером 6×3,5 см без кровотока. При компьютерной томографии брюшной полости наблюдается небольшое количество жидкости вокруг селезенки, подкапсульная гематома селезенки объемом 280 см 3 . С учетом высокого риска двухмоментного разрыва селезенки и развития внутрибрюшного кровотечения больной выполнена экстренная видеолапароскопия. При ревизии выявлено небольшое количество крови и сгустков в левом поддиафрагмальном пространстве и левом латеральном канале, селезенка несколько увеличена, на диафрагмальной поверхности имеются гематома и разрыв на 2 / 3 длины без активного кровотечения. К селезенке подпаяна прядь большого сальника, по отделении которого вскрылся абсцесс (выделилось около 50 мл сливкообразного гноя), взят материал для посева. Стенками абсцесса являлась висцеральная поверхность селезенки, дно и большая кривизна желудка, большой сальник, диафрагма. Выполнены видеолапароскопическая спленэктомия, санация и дренирование полости абсцесса и брюшной полости. Диагноз: двухмоментный разрыв селезенки, поддиафрагмальный абсцесс слева, постгеморрагическая анемия. Дренажи из брюшной полости удалены на 5-е и 12-е сутки. На 9-е сутки после операции при компьютерной томографии отмечался инфильтрат левого поддиафрагмального пространства без жидкостного компонента, который регрессировал на фоне консервативной терапии. На 19-е сутки после операции пациентка в удовлетворительном состоянии выписана.
Двухмоментное кровотечение остается сложной проблемой при консервативной тактике и может привести не только к внутрибрюшному кровотечению, но и к формированию абсцессов. Этот пример демонстрирует важность видеолапароскопии как диагностической операции для установления точного диагноза. На данном примере очевидно ее преимущество в верификации такого осложнения, как абсцесс брюшной полости, что оказалось невозможным при выполнении неинвазивных методов обследования и консервативном ведении такого больного.
Больная З., 20 лет, поступила с жалобами на боли в нижних отделах груди слева и левом подреберье. Пострадала в ДТП (пассажир) 10.06.10. Через 2,5 ч доставлена в приемное отделение. При поступлении состояние средней тяжести, дыхание ослаблено слева в нижних отделах, частота дыханий 20 в 1 мин, тоны сердца ритмичные, пульс 80 в 1 мин, АД 110/65 мм рт.ст. Живот не вздут, участвует в акте дыхания, при пальпации мягкий, болезненный в левом подреберье. Перитонеальных симптомов нет. При УЗИ брюшной полости и забрюшинного пространства отмечены признаки травмы селезенки и гемоперитонеума. В экстренном порядке выполнена видеолапароскопия. В брюшной полости около 450 мл жидкой крови. Селезенка не увеличена, на диафрагмальной поверхности имеется разрыв размером 4,5×0,5 см, идущий к воротам, с продолжающимся неинтенсивным кровотечением. Произведена видеолапароскопическая спленэктомия. Послеоперационный период протекал без осложнений. В 1-е сутки больная переведена из палаты интенсивной терапии в хирургическое отделение. На 15-е сутки в удовлетворительном состоянии она выписана из стационара.
Этот пример наглядно демонстрирует, что видеолапароскопическая спленэктомия может являться альтернативой открытой спленэктомии у пациентов с повреждением селезенки на фоне стабильной гемодинамики.
При сравнении результатов видеолапароскопической и открытой спленэктомии значимых различий ни по одному из сравниваемых параметров выявлено не было. Большую длительность операции при использовании видеолапароскопического способа мы связываем с освоением методики. Очевидным ее преимуществом является меньшая операционная травма и как следствие менее выраженный болевой синдром в послеоперационном периоде, что позволяет не использовать наркотические анальгетики в том объеме, в каком они используются после традиционной спленэктомии. Активизация больных начинается после видеолапароскопической спленэктомии также в более ранние сроки. Таким образом, в ряде наблюдений при сомнении в эффективности консервативной терапии, как и органосохраняющей операции, видеолапароскопическая спленэктомия может являться адекватной альтернативой открытой спленэктомии.
Читайте также:
- Витрэктомия при кровоизлиянии в стекловидное тело при диабетической ретинопатии. Показания
- Техника одномоментной чреспузырной аденомэктомии. Местная гипотермия при аденомэктомии
- Формы рака предстательной железы. Неэпителиальные формы рака предстательной железы.
- Проблемы продолжительного пребывания на глубине. Проблемы декомпрессии организма
- Зачем мужчины лгут. Как воспринимать мужскую ложь?
