Показания к операции на средостении под местной анестезией. Общая анестезия при операциях на средостении
Добавил пользователь Алексей Ф. Обновлено: 22.01.2026
Представлен опыт лечения 37 больных с тератомами средостения. Клинические проявления тератом носят стертый характер. Решающая роль в диагностике принадлежит КТ, которая выявляет размеры, локализацию и структуру опухоли. Трансторакальная, игловая биопсия была информативной у 18 больных из 37 (46,4%), что объясняется неоднородной структурой опухоли и трудностями в интерпретации биоптата. Выбор оперативного доступа диктовался преимущественно локализацией, а также размерами опухоли. Оперативный доступ - стернотомия был использован у 20 больных, торакотомия - у 17. Опухоль удалена радикально у 34 больных, в 1 случае операция была паллиативной, и у 2 больных выполнены пробные торакотомии. Зрелая тератома была у 32 пациентов, незрелая (злокачественная) - у 5. Послеоперационные осложнения в виде кровотечений случились у 2 (5,4%) больных. Летальных исходов не было. При незрелых тератомах в дальнейшем проводилась лучевая терапия 50-65 Гр и интенсивная химиотерапия на основе платины. Отдаленные результаты прослежены у 16 пациентов. Все пациенты, где были зрелые тератомы, живы. Трое больных, где была малигнизация опухоли, умерли в течение 2 лет, несмотря на адъювантное лечение.
1. Флорикян А.К. Герминогенные опухоли средостения (тератодермоидные новообразования) // Международный медицинский журнал 2009. № 3. C. 74-81.
2. Пикин О.В., Колбанов К.И., Маканин М.А., Казакевич В.И., Рудаков Р.В., Королев А.В. Зрелая тератома передневерхнего средостения, осложненная перфорацией в легкое // Российский онкологический журнал. 2012. № 2. С. 29-31.
4. Miyazawa M., Yoshida K., Komatsu K., Kobayashi N., Haba Y. Mediastinal mature teratoma with rupture into pleural cavity due to blunt trauma. Ann Thorac. Surg. 2012. Vol. 93. N 2. P. 37-40.
5. Ruan Z., Wang S., Wang Z., Ling Y. A rare case of bilateral massive hemothorax from spontaneous rupture of a primary mediastinal mixed germ cell tumor. Ann Thorac. Surg. 2012. Vol. 93. N 6. Р. 62-64.
Тератомы - это своеобразная группа новообразований, состоящих из тканевых и органоподобных элементов. Первое упоминание о тератоме средостения принадлежит Rubino в 1810 году, а в отечественной литературе тератому средостения впервые описал А.П. Буйвид в 1889 году. Тератомы средостения - наиболее частые опухоли, состоящие из герминативных клеток, которые не имеют существенных гендерных различий и могут происходить в любом возрасте, однако наиболее часто возникают в возрасте 20-40 лет, составляя около 15% предсредостенных опухолей у взрослых и 25% предсредостенных опухолей у детей. Тератомы составляют вторую по частоте нозологическую форму новообразований средостения - 15,7-23,1% [1; 2], уступая по частоте только неврогенным опухолям. Тератома средостения возникает в результате спонтанного сосудистого развития некоторых стволовых клеток, оставшихся в средостении во время развития примордиального тимуса на эмбриональной стадии. Тератомы часто встречаются вблизи области тимуса [3]. Обычно данные опухоли в своем составе имеют ткани эктодермы, мезодермы, эндодермы [4]. Тератомы подразделяются на зрелые (доброкачественные) и незрелые (злокачественные), что очень важно для определения тактики лечения и оценки прогноза. По встречаемости зрелые/незрелые тератомы соотносятся 10/1 [5].
Цель настоящей работы - обобщить наш опыт лечения данных опухолей и подчеркнуть основные аспекты данной проблемы.
Материал и методы исследования. В данной работе мы представляем опыт лечения 37 пациентов с тератомами средостения, находившихся на лечении в клиниках торакальной хирургии ГБУЗ СО «ПТД», УНИИФ - филиала ФГБУ «НМИЦ ФПИ» Минздрава России и ГБУЗ СО «СООД». Мужчин было 24, женщин - 13. Возраст больных от 16 до 58 лет. Клинические и анамнестические данные у подавляющего большинства пациентов изначально были неспецифическими: утомляемость и потеря веса у 13 пациентов, одышка у 4, субфебрилитет у 6, боль в груди у 4 и умеренная дисфагия у 1 пациента (у ряда больных эти симптомы сочетались). У 15 пациентов клинических проявлений не было, и заболевание было выявлено при профилактической флюорографии. В 4 случаях пробная торакотомия ранее выполнялась в других больницах. У одного пациента 3 года назад опухоль была удалена не полностью также при торакотомии. У 1 пациентки частичная стернотомия и резекция опухоли выполнены 4 года назад в другом городе. Следовательно, в двух последних случаях речь шла о рецидивах опухоли. При компьютерной томографии (КТ) во всех случаях выявлялось дополнительное солидное образование в переднем средостении, а у 17 больных патологическое образование имело массивные размеры, отклоняло сердце с магистральными сосудами и сдавливало легкие вплоть до полного компрессионного ателектаза. Умеренная компрессия трахеи при трахеобронхоскопии определялась у 2 больных. Морфологическая верификация опухоли имелась у всех больных, перенесших ранее хирургические вмешательства, а у остальных пациентов выполнялась биопсия под рентгеном, КТ- или УЗИ- контролем.
Выбор оперативного доступа диктовался преимущественно локализацией, а также размерами опухоли. Если диаметр опухоли не превышал 10 см и медиальный край ее не достигал срединной линии, то выполняли боковую торакотомию с соответствующей стороны. Стернотомия (полная продольная или частичная продольно-поперечная) выполнялась при больших размерах опухоли и при расположении краев опухоли за срединной линией. Мы выполнили полную продольную стернотомию у 19 пациентов и частичную продольно-поперечную стернотомию - у 1 пациента. У одной пациентки, у которой опухоль рецидивировала после предыдущей резекции, нам пришлось выполнить повторную стернотомию. В 17 была предпринята боковая торакотомия. Для оценки кровопотери на разных этапах операции текущая кровопотеря была измерена у 8 человек на трех этапах: выполнение доступа, мобилизация опухоли в средостении и при отделении опухоли от спаек с грудной стенкой и легким. Для фиксации грудины накладывали обычные проволочные швы. Плевральные полости и средостение дренировали.
Обезболивание. Особых соображений по поводу анестезии не было. Применялась стандартная двулегочная вентиляция легких и внутривенная анестезия.
Дополнительное противоопухолевое лечение не применялось в случаях, когда доброкачественная зрелая тератома была подтверждена при морфологическом исследовании удаленной опухоли. Лучевая терапия 50-65 Гр и интенсивная химиотерапия на основе платины проводились пациентам со злокачественными тератомами.
Результаты исследования и их обсуждение. У 34 пациентов опухоль была удалена полностью. При этом в 2 случаях потребовалось удаление верхней доли левого легкого, а у 4 больных - ограниченные атипичные резекции легких, когда опухоль была тесно спаяна с легочной тканью. В 9 случаях потребовалась резекция перикарда. У одного пациента была проведена субтотальная резекция левой стенки перикарда, после чего мы закрыли дефект широким лоскутом париетальной плевры. Истинная опухолевая инвазия соседних анатомических структур при этом была выявлена при морфологическом исследовании лишь у 3 больных с подтвержденной малигнизацией тератомы. У 1 пациента операция была паллиативной из-за инвазии полой вены и предсердия, а у 2 больных радикальная операция оказалась невозможной по той же причине. Морфологическое исследование также выявило у этих двух пациентов злокачественную трансформацию. Операционная кровопотеря варьировала от 230 до 2530 мл (в среднем = 440 мл) и возникла в основном из-за сильно васкуляризированных спаек между опухолью и грудной стенкой. Наиболее сложным и травматичным этапом хирургического вмешательства оказалось рассечение опухоли от спаек с грудной стенкой. Измерение кровопотери на этапах операции показало, что 83% общей кровопотери произошло во время отделения опухоли от грудной стенки. Во всех этих случаях имели место опухоли больших размеров (более 15 см в наибольшем диаметре). Самая крупная опухоль (зрелая тератома) была массой 3,5 кг. В одном случае опухоль располагалась в переднем косто-диафрагмальном синусе и была изначально трактована как внелегочная секвестрация. При торакотомии оказалось, что это зрелая тератома, исходящая из переднего средостения и спустившаяся на длинной (около 20 см) ножке в передний косто-диафрагмальный синус. Послеоперационные осложнения в виде кровотечений случились у 2 (5,4%) больных, причем у одного пациента, где была удалена гигантская незрелая тератома, это было фибринолизное кровотечение объемом 2530 мл. Летальных исходов не было.
По результатам морфологического исследования зрелая тератома подтверждена у 32 пациентов, незрелая - у 5. Отдаленные (от 2 до 7 лет) результаты прослежены у 16 пациентов. Все пациенты, у которых были зрелые тератомы, живы и здоровы. Трое больных, где была малигнизация опухоли, умерли в течение 2 лет, несмотря на адъювантное лечение.
Приводим следующие наблюдения.
Наблюдение 1. Женщина 18 лет. Студентка. Жалоб не предъявляет. При флюорографии и последующей КТ определяется массивное затемнение, исходящее из переднего средостения, пролабирующее в левую плевральную полость (рис. 1а). Средостение смещено вправо. Структура опухоли неоднородна: видны множественные костно-хрящевые включения и кистозные участки (рис. 1б). Операция: полная продольная стернотомия. Опухоль отделена от грудной стенки. Верхняя доля левого легкого в ателектазе. От легкого опухоль отделена швом аппарата ТА-60. Ножка опухоли исходит из переднего средостения и также пересечена после прошивания ТА-60 (рис. 1в). Продолжительность операции 2 часа 15 минут, кровопотеря 530 мл. Гистологически: зрелая тератома (рис. 1г). Послеоперационный период гладкий. Контрольный осмотр через 2 года - здорова.
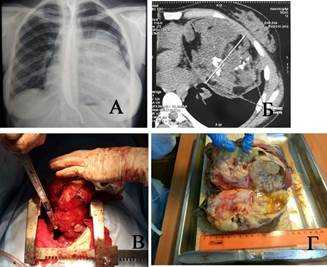
Рис. 1. Наблюдение 1: а) обзорная рентгенограмма пациентки, б) компьютерная томограмма той же больной, в) полная продольная стернотомия, отсечение ножки опухоли, г) опухоль на разрезе - зрелая тератома
Наблюдение 2. Мужчина 24 лет. Строитель. В течение 2 недель стал ощущать слабость, боль в груди, Т >38o, одышку. До этого считал себя здоровым, работал. На КТ определяется массивное солидное гомогенное образование, занимающее практически весь левый гемиторакс и смещающее средостение вправо (рис. 2 а, б). При УЗИ левой плевральной полости определяется жидкость. При плевральной пункции удалено около 2,5 л серозного экссудата. Трансторакальная игловая биопсия: опухолевая ткань, наиболее вероятно герминогенной природы с участками некроза. Операция: полная продольная торакотомия. Опухоль с большими техническими трудностями из-за плотных сращений отделена от грудной стенки. Выделение сопровождалось значительным диффузным кровотечением. Легкое в ателектазе, инвазии его нет. Множественные сосудистые ножки, исходящие из переднего средостения, лигированы и пересечены. Опухоль удалена. Масса опухоли 2,8 кг (рис. 2в). Продолжающееся фибринолизное кровотечение в послеоперационном периоде купировано, кровопотеря возмещена. Дальнейший послеоперационный период без осложнений. При выписке левое легкое полностью расправлено (рис. 2г). Морфологически: незрелая тератома. Далее химиотерапия в режиме ВЕР 4 цикла. Смерть от прогрессирования опухолевого процесса 2 года спустя.
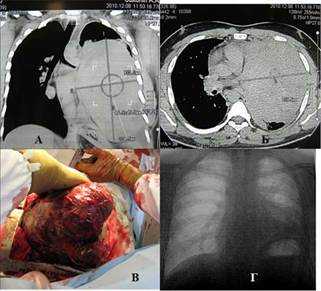
Рис. 2. Наблюдение 2: а, б) компьютерные томограммы пациента, в) полная продольная стернотомия, извлечение препарата, г) обзорная рентгенограмма пациента спустя 7 дней после операции
Клиническая проблема заключается в том, что вначале бессимптомные тератомы переднего средостения могут достигать огромных размеров, но даже при этом симптомы часто бывают неспецифичны. Большинство пациентов с тератомой средостения не имеют явных симптомов, опухоль можно обнаружить лишь при рентгенографии грудной клетки или компьютерной томографии грудной клетки.
Клинические проявления симптоматических пациентов в основном включают: 1. Симптомы связаны с компрессией структуры ткани переднего средостения, вызванной эффектом опухолевой массы, включая стеснение в груди, одышку, массу шеи, синдром верхнего средостения, синдром Хорнера. 2. Симптомы вызваны разрывом опухоли, которая может содержать пищеварительные ферменты, поджелудочной железы, слюнной железы и других тканей, которые действуют на окружающие ткани и проникают в соседние органы, что осложняется плевральным выпотом и гемотораксом, которые в результате вызывают одышку, кровохарканье и обструктивную пневмонию, а также перикардиальный выпот и тампонаду перикарда. У одного из наших пациентов была тупая травма грудной клетки, и гигантская тень изначально была интерпретирована как свернувшийся гемоторакс. Отсюда возникает резонный вопрос: где была профилактическая флюорография? Клинические проявления зрелых тератом у взрослых менее выражены, чем у детей.
Решающая роль в диагностике принадлежит КТ, которая выявляет размеры, локализацию и структуру опухоли. Рентгенография грудной клетки и компьютерная томография могут показать круглую или округлую массу в переднем средостении, частичную дольчатую, кальцификацию в опухоли и даже зуб или кость. Зрелые тератомы - это в основном кистозные массы, в то время как незрелые тератомы - это в основном твердые массы. Большинство тератом средостения расположены в переднем средостении, которые легко ошибочно диагностируются как тимома перед операцией и должны быть тщательно идентифицированы. Однако морфологический диагноз до операции удается получить не всегда.
По нашим данным, игловая биопсия оказалась информативной у 18 больных из 37 (46,4%). Частично этот факт можно объяснить тем, что опухоль имела неоднородную структуру и в значительном большинстве случаев в биоптате преобладали бесструктурные массы, что серьезно затрудняло интерпретацию биоптата.
Вторая проблема - хирургическая. Выбор хирургического метода в основном зависит от локализации, размеров и соотношения опухолевого тела и окружающих тканей. Если опухоль затрагивает средостение билатерально, верхнюю полую вену, внутреннюю вену, сосуды головы и шеи, а начальная часть опухоли неясна, целесообразно выбрать срединную торакотомию для хирургической резекции, когда возможна реконструкция сосудов. Для тех опухолей, у которых опухолевое тело выходит через верхнюю апертуру грудной клетки к шее, Т-образный разрез должен быть сделан через грудину в сочетании с разрезом шейного воротника. При необходимости лобэктомии или клиновидной резекции легкого может быть выбрана заднебоковая торакотомия. При необходимости может быть добавлен боковой разрез грудины с передней торакотомией.
Также может быть использована боковая торакотомия на стороне опухоли. Стоит также отметить, что из-за большой опухоли, обширной адгезии, большой раневой поверхности, неполного расширения легких и остаточной полости в грудной полости и других факторов легко вызвать послеоперационное кровотечение. Следует обратить внимание на защиту диафрагмального нерва, возвратного гортанного нерва, блуждающего нерва и нерва плечевого сплетения, когда опухоль плотно прилегает к поверхности средостения, чтобы избежать серьезных осложнений. В случае если опухоль невозможность удалить полностью, опухолевая ткань должна быть удалена как можно больше, а остаточная кистозная стенка должна быть обработана для уменьшения послеоперационной секреции. Небольшая остаточная опухолевая кистозная стенка в стенке кровеносного сосуда не влияет на прогноз. Непростой аспект операции - выделение опухоли из спаек, на что указывал ряд авторов. На данном этапе операции может развиться тяжелое кровотечение, которое трудно остановить.
Мы также столкнулись с такими проблемами, о чем свидетельствуют наши данные, указанные выше: на данном этапе произошло более 80% общей кровопотери. Развитие таких васкуляризированных спаек можно объяснить длительным медленным ростом опухоли в тесном контакте с париетальной плеврой, перифокальным воспалением. Добавим, что причиной невозможности радикальной операции у 4 наших больных, оперированных ранее, были тяжелые сращения с грудной стенкой, имитирующие инвазию опухоли, и сильное кровотечение при попытках выделения опухоли. Следует подчеркнуть, что мы не обнаружили в таких случаях инвазии опухоли в грудную стенку, а только спайки. На этот факт указывали и другие авторы. Наконец, рассуждая о выборе оперативного доступа, мы можем утверждать, что полная срединная стернотомия предпочтительнее прежде всего потому, что этот доступ обеспечивает хорошую визуализацию и удобство манипуляций в средостении вблизи сердца и магистральных сосудов. Такого же мнения придерживаются ряд отечественных и зарубежных авторов [2; 5].
Заключение. Планируя выбор оперативного доступа, авторы считают, что полная срединная стернотомия предпочтительнее прежде всего потому, что этот доступ обеспечивает хорошую визуализацию и удобство манипуляций в средостении вблизи сердца и магистральных сосудов. И, наконец, онкологическая проблема лечения тератом средостения заключается в отсутствии надежных методов адъювантного лечения, позволяющего остановить опухолевую прогрессию при незрелых тератомах даже в случаях радикального удаления опухоли. Имеющиеся в литературе данные и результаты нашего исследования показали, что прогноз в большинстве таких случаев неблагоприятный, несмотря на последующую химиотерапию и облучение. Химиотерапия на основе платины при незрелых тератомах оставляет надежду на благоприятный прогноз. Однако своевременное обнаружение опухоли на ранней стадии является важнейшим фактором, обеспечивающим удовлетворительный исход лечения.
24.3. Анестезия при операциях на органах средостения
Предоперационная подготовка, премедикация, введение в анестезию и поддержание ее зависят от характера основного патологического процесса, его локализации, вида и объема предстоящего оперативного вмешательства.
При небольших кистах и опухолях средостения анестезия не имеет существенных отличий от общепринятых в современной анестезиологии методик. При больших кистах и опухолях нарушается венозный отток из-за сдавления крупных сосудов в средостении, развиваются застойные явления в верхней части туловища, расширяются венозные сосуды в области шеи. Часто отмечается смещение трахеи, что затрудняет интубацию и проведение ИВЛ Обычно применяют эндотрахеальные трубки (реже эндобронхиальные), так как в условиях смещения и сдавления трахеи они оказывают меньшее сопротивление в дыхательных путях и меньше затрудняют проведение ИВЛ.
При выборе компонентов анестезии и фармакологических средств для нормализации кровообращения важно учитывать неблагоприятные реакции сердечно-сосудистой системы, связанные с раздражением обширных рефлексогенных зон, механической травмой сердца и легких при хирургических манипуляциях, изменением внутригрудного давления.
Анестезия при операциях на пищеводе, выполняемых наиболее часто по поводу рубцовых сужений и злокачественных опухолей, отличается тем, что проводится у истощенных больных с резко выраженными нарушениями водно-электролитного, белкового обмена, КОС на фоне анемии и интоксикации. Большинство онкологических больных в возрасте старше 60 лет страдают сопутствующими заболеваниями сердечно-сосудистой, дыхательной систем, расстройствами функций печени и почек. В связи с этим первостепенное значение имеет тщательная предоперационная подготовка, направленная на коррекцию нарушений гомеостаза.
Ведущее место в комплексе средств, применяемых в предоперационном периоде, занимает парентеральное питание, правильное применение которого способствует уменьшению катаболизма и созданию анаболической направленности метаболических процессов. Основными компонентами парентерального питания являются источники азота и энергии, средства для нормализации водно-электролитного баланса, КОС, витамины, анаболические гормональные препараты. В устранении гиповолемии и анемии важную роль играет переливание крови и ее компонентов, альбумина, протеина, растворов декстратов и др.
Выбор премедикации и средств для общей анестезии требует особого внимания, поскольку в условиях гиповолемии и нарушенного гомеостаза увеличивается токсичность фармакологических препаратов и удлиняется действие мышечных релаксантов из-за быстрого нарастания их концентрации в крови и замедленного метаболизма. Диспротеинемия, снижение уровня альбуминов способствуют увеличению свободной фракции общих анестетиков и усилению их угнетающего действия на миокард, поэтому дозы, общепринятые для премедикации, введения в анестезию и ее поддержания должны быть снижены.
Интубация у больных с заболеваниями пищевода — один из ответственных этапов анестезии, поскольку выше места сужения его или в дивертикулах накапливаются пищевые массы, которые в случае рвоты или регургитации могут попасть в дыхательные пути и вызвать асфиксию. Для предупреждения этого осложнения перед операцией эвакуируют содержимое из пищевода путем промываний и аспирации с помощью зонда; интубацию чаще проводят в сидячем или фовлеровском положении. Во время интубации могут возникнуть трудности у больных после химических ожогов пищевода (рубцовые изменения в глотке, гортани).
Некоторые авторы [Бунятян А.А., 1973] рекомендуют прокалывать трахею иглой Дюфо, через ее просвет вводить тонкий полиэтиленовый катетер по направлению ко рту, а по нему — эндотрахеальную трубку в трахею. Интубация может быть выполнена под контролем зрения с помощью бронхофиброскопа. Последний предварительно вводят в просвет интубационной трубки.
Если не удается осуществить интубацию, то прибегают к трахеостомии. Обычно используют однопросветную эндотрахеальную трубку. Однако при внутриплевральной пластике пищевода возможно развитие двустороннего пневмоторакса, поэтому с целью поддержания адекватного газообмена и создания оптимальных условий для выполнения операции (наложение анастомоза в плевральной полости) производят раздельную интубацию бронхов, чаще всего трубкой Карленса. Учитывая травматичность и длительность хирургического вмешательства, для профилактики осложнений следует поддерживать необходимую глубину общей анестезии (III1 — III2), оптимальную оксигенацию и своевременно восполнять кровопотерю. Широко применяют закись азота и нейролептаналгезию, фторотан, метоксифлуран. Эффективно сочетание общей анестезии с эпидуральной, благоприятно влияющее и на течение послеоперационного периода.
Общие принципы ведения больного после операций на пищеводе состоят в обеспечении полноценного парентерального питания, профилактике острой дыхательной недостаточности, нормализации деятельности сердечно-сосудистой системы, коррекции гиповолемии и нарушений гомеостаза, адекватном обезболивании, предупреждении тромбоэмболических осложнений и несостоятельности пищеводно-кишечного и пищеводно-желудочного анастомозов.
Выжигина М.А., Гиммельфарб Г.Н. Современные аспекты анестезии в хирургии
легких.—Ташкент: Медицина, 1988.
Долина О.А. Анестезия и реанимация в хирургии легких.—М.: Медицина, 1975.
Руководство по анестезиологии / Под ред. Т.М. Дарбиняна.—М.: Медицина, 1973. Справочник по анестезиологии и реаниматологии / Под реД.А.А. Бунятяна. М : Медицина, 1982.
Стручков В.И., Недвецкая Л. М., Долина О.А., Бирюков Ю. В. Хронические нагноительные заболевания легких, осложненные кровотечением.— М. - Медицина. - 1985.
Уэст Дж. Физиология дыхания. Основы: Пер. с англ.— М.: Мир, 1988.
Euler С. On the central pattern generator for the basic breathing rhythmicity // J. appl. Physiol.—1983.— Vol. 55.—P. 1647—1659.
Harrington J. E. An unusual cause of endotracheal tube obstruction // Anesthesiologv — 1984. — Vol. 61. P. 116.
Henrik W. Intrapulmonary shunting during one-lung ventilation and surgical manipulation // Anesthesiology.— 1981.— Vol. 55, № 3.— P. A377.
Hilley M. D., Henderson R. В., Essecke A. N. Puzzlement extubation of the trachea // Anesthesiology.— 1983.—Vol. 59.—P. 149.
Keane W. M., Denneny J. C., Rowe L. D. et al. Complications of intubation // Am. Otol.— 1983.— Vol. 91.— P. 584.
Mehta S. Endotracheal cuff messurc // Brit. Med. J. — 1984.—Vol. 288.^ P. 1763.
Said S. J. Metabolic functions of the pulmonary circulation // Circulat. Res. 1982.—
Smith R. Ventilation at high respiratory frequencies//Anesthesia.—1982.—Vol. 37.—
Steven A. Pulmonary pressure and flow during atelectasis // J. Anesthesiology.—1982.—Vol. 57, № 3. P. A504.
Triner G.A. Simple manocuvrr to verity proper position of an endotracheal tubes //
Anesthesiology.—1982.—Vol. 57. -P. 548.
West G. В., Lahiri S. High altitude and man. — New York: American. Physiological
Анестезия при торакоскопических операциях
Торакоскопия в настоящее время не является исключительно диагностическим методом, ее все шире используют для вмешательств, которые раньше требовали открытой торакотомии. С помощью торакоскопии выполняют биопсию легкого, резекцию сегмента и доли легкого, плевродез, некоторые операции на пищеводе (например, удаление лейомиомы) и даже перикардэктомию (гл. 21). Для подавляющего числа торакоскопических операций достаточно трех (иногда больше) маленьких разрезов; пациент лежит на боку.
Анестезиологическое обеспечение такое же, как при обычной торакотомии; в большинстве случаев показана однолегочная вентиляция. В некоторых клиниках при малых вмешательствах ограничиваются местной анестезией на фоне самостоятельного дыхания; при этом, однако, пациент может испытывать значительный дискомфорт. Открытие порта на коннекторе одного из каналов двухпросветной трубки вызывает спадение ипсилатераль-ного легкого; инсуффляция газа, в отличие от таковой при лапароскопии, не только бесполезна, но даже вредна.
Анестезия при диагностических вмешательствах
Бронхоскопия
Вопросы местной анестезии и анестезии орошением при фибробронхоскопии рассмотрены в гл. 5. Ригидную бронхоскопию, которую применяют для удаления инородных тел и дилатации трахеи, выполняют под общей анестезией. Сложность заключается в том, что во время ригидной бронхоскопии анестезиолог "делит" дыхательные пути с хирургом; к счастью, процедура обычно не занимает более 5-10 мин. После стандартной индукции неингаляционным анестетиком поддержание анестезии осуществляют мощным ингаляционным анестетиком с FiO2 100 % на фоне введения миорелаксан-тов короткой или средней длительности действия.
Можно прибегнуть к другой методике — тотальной внутривенной анестезии (например, с использованием пропофола).
Для респираторной поддержки при ригидной бронхоскопии подходит одна из трех методик:
(1) апнейстическая оксигенация через тонкий катетер, фиксированный вдоль по длине бронхоскопа;
(2) стандартная объемная ИВЛ через боковое окно вентиляционного бронхоскопа (когда проксимальное окно бронхоскопа открывают для отсасывания мокроты или взятия биопсии, то ИВЛ прерывают);
(3) ВЧ ИВЛ через бронхоскоп инжекционного типа. В последнем случае к проксимальному концу бронхоскопа присоединяют тонкий катетер (диаметром 16-18 G), через который под высоким давлением поступает кислород; благодаря эффекту Вентури образующаяся кислородно-воздушная смесь движется в дистальном направлении.
Медиастиноскопия
Медиастиноскопия позволяет визуализировать лимфатические узлы средостения, и это исследование применяют для диагностики или определения резектабельности новообразований. Для выявления смещения и сдавления трахеи перед операцией нужно выполнить КТ.
При медиастиноскопии показана общая эндотрахеальная анестезия с миорелаксантами. Обязательно установление внутривенного катетера крупного калибра (14-16 G), потому что высок риск возникновения сильного кровотечения, которое технически трудно остановить. При медиастиноскопии часто сдавливается безымянная артерия, поэтому АД измеряют на левой руке.
К осложнениям медиастиноскопии относятся:
(1) рефлекторная брадикардия при сдавлении трахеи и крупных сосудов (опосредованная блуждающим нервом);
(3) ишемия головного мозга при сдавлении безымянной артерии (это осложнение можно диагностировать при плетизмографии или пульсоксиметрии правой руки);
(4) пневмоторакс (обычно обнаруживается уже после операции);
(5) воздушная эмболия (возникает в связи с тем, что головной конец операционного стола поднят на 30°; риск воздушной эмболии значительно повышается при самостоятельном дыхании);
(6) повреждение возвратного гортанного нерва;
(7) повреждение диафрагмального нерва.
Бронхоальвеолярный лаваж
Данное вмешательство выполняют при легочном альвеолярном протеинозе, который характеризуется избыточным синтезом сурфактанта и невозможностью его эффективного клиренса. Заболевание проявляется одышкой, на рентгенограмме грудной клетки видны двухсторонние затемнения. Бронхоальвеолярный лаваж показан при тяжелой гипоксемии или в случае прогрессирования одышки. Одномоментно проводят лаваж только одного легкого, что дает возможность пациенту восстановиться и быть готовым через несколько дней к следующей процедуре. Вначале осуществляют лаваж легкого, функционирующего хуже.
Односторонний бронхоальвеолярный лаваж выполняют под общей анестезией, используя двух-просветную эндобронхиальную трубку. Необходимо плотно раздуть манжетки трубки, чтобы исключить попадание жидкости в другое легкое. Пациент должен лежать на спине: в положении на боку риск попадания жидкости в вышерасположенное легкое значительно ниже, но возникает тяжелое нарушение вентиляционно-перфузионных отношений. В легкое вводят теплый физиологический раствор, который затем вытекает под действием силы тяжести; раствор вводят до тех пор, пока вытекающая жидкость не обретет прозрачность (обычно для этого требуется 10-20 л раствора). По окончании бронхоальвеолярного лаважа нужно тщательно аспирировать отделяемое из обоих легких.
Анестезия при трансплантации легких
Общие сведения
Трансплантация показана в терминальной стадии паренхиматозных заболеваний легких или при легочной гипертензии, когда дыхательная недостаточность декомпенсирована и прогноз однозначно неблагоприятен. Критерии варьируются в зависимости от характера заболевания. Наиболее распространенные заболевания, при которых может быть показана трансплантация легких, представлены в табл. 24-5. Количество трансплантатов ограничено числом подходящих органов.
Опухоли средостения: клиника и лечение
Средостение ( mediastinum ) - комплекс органов, расположенных в грудной полости между левой и правой медиастинальной плеврой, задней поверхностью грудины и грудным отделом позвоночника и шейками ребер.
Чаще всего средостение делится на 3 отдела (переднее — периваскулярное, среднее — висцеральное, заднее — паравертебральное). Опухоли и кисты — новообразования различного гистогенеза, объединенные в общую нозологическую группу благодаря расположению в одной анатомической области.
Патоморфологические формы характеризуются чрезвычайным многообразием. Развитие опухолей и кист среди жизненно важных органов в ограниченном пространстве приводит к сдавлению, смещению элементов средостения, создавая риск для жизни больного.
Опухоли могут исходить из самих органов, эктопированных и тканей между ними. Кисты являются следствием патологических процессов и пороков развития с формированием полостей.
Особенностями проблем опухолей и кист являются морфологические и анатомо-физиологические характеристики средостения, трудности морфологической верификации, неопределенность лечебной тактики при ряде заболеваний.
Цены на платные услуги
Клиника и методы диагностики опухолей средостения
В структуре онкологических заболеваний опухоли и кисты составляют 3-7 %, из них 80 % — доброкачественные, 20 % — злокачественные. Озлокачествление доброкачественных опухолей отмечается в 17-41 % случаев.
Чаще встречаются в возрасте 18-45 лет. Рак развивается из тканей органов средостения, нервной и соединительной ткани, клеток стволовых и появляющихся при нарушенном внутриутробном развитии.
Причины заболевания до конца не выяснены. По мнению большинства ученых-медиков, патология развивается из-за воздействия:
- ионизирующего излучения;
- контакта с канцерогенами в быту и профессиональной среде;
- вирусов Энштейна - Барра, ВИЧ и других.
- одышка, головные боли, синюшность губ, расширенные вены и отечность лица и шеи;
- истощение, утомляемость, мышечная слабость;
- нарушение сердечного ритма, его замедление или учащение;
- повышение температуры тела до 37 о С;
- плеврит;
- кашель;
- боль в грудной клетке и суставах;
- кровохарканье;
- значительная потеря массы тела - до 15 кг.
Заболевание может маскироваться под вялотекущий бронхит или пневмонию, что затрудняет диагностику. У трети больных на начальных стадиях симптомов нет.
В клинике опухолей и кист средостения выделяют два периода:
- скрытый бессимптомный — опухоль случайно выявлена на рентгене легких или компьютерной томографии;
- выраженную клинику — боль, затруднение дыхания, кашель, субфебрилитет, признаки компрессии органов (верхней полой вены, пищевода, трахеи, нервов и спинного мозга, сердца).
Для диагностики используют:
- рентгеноскопию грудной клетки в нескольких проекциях;
- УЗИ;
- КТ и МРТ, позитронно-эмиссионную томографию;
- эндоскопические методики - фибробронхоскопию, медиастиноскопию, видеоторакоскопию;
- пункционную биопсию, в том числе увеличенных лимфоузлов;
- лабораторные анализы.
Злокачественные опухоли средостения имеют короткий бессимптомный период развития, быстро увеличиваются в размерах, метастазируют, дают симптомы компрессии органов.
Лечение опухоли средостения
Тактика зависит от стадии заболевания. Хирургический метод приоритетен при всех формах опухолей и кист, за исключением лимфом, при которых тактика требует индивидуализации (приоритет — химиолучевой метод). При злокачественных опухолях средостения хирургический метод может сочетаться с лучевым, химиотерапией, которые повышают эффективность терапии.
Показанием к хирургическому лечению являются опухоли и кисты средостения независимо от наличия клиники, локального и местного распространения, за исключением лимфом. При герминогенных опухолях возможна неоадъювантная химиотерапия.
Противопоказания к хирургическому лечению:
- выраженный синдром сдавления верхней полой вены (венозное давление выше 200 мм вод. столба.);
- генерализация злокачественного процесса;
- прорастание пищевода, трахеи, главных бронхов с невозможностью их резекции;
- сопутствующая органная недостаточность.
При невозможности хирургического лечения показано проведение химиолучевой терапии.
Биопсия и наркоз
В некоторых случаях в международной клинике Медика24 делают биопсию под наркозом - пациента погружают в состояние седации или проводят общую анестезию. Поговорим о том, в каких ситуациях это необходимо.
Выбор способа обезболивания зависит от того, какой вид биопсии планирует провести врач. Зачастую можно обойтись местным обезболиванием: когда раствором анестетика обкалывают место, где будет проводиться вмешательство. Как правило, пункционная биопсия выполняется под местным обезболиванием.
Что такое седация, и когда она нужна
Седация - введение медикаментозных препаратов, которые помогают расслабиться, успокоиться и лучше перенести процедуру. Сознание не выключается, пациент в полусонном состоянии, но осознает происходящее, может разговаривать с доктором.
Седацию применяют при биопсии, когда процедура сложная, продолжается долго, если пациент испытывает сильное чувство страха, но при этом нет показаний к наркозу. В состоянии седации человек по-прежнему чувствует боль, поэтому ее сочетают с местной анестезией.
В качестве примеров, когда применяется седация, можно привести биопсию молочной железы, печени, легкого, почки, эндоскопическую биопсию желудка, толстой кишки. В данных случаях речь не идет о хирургических методах забора материала через разрез.
Когда биопсию нужно проводить под наркозом
Наркоз показан в случаях, когда нужно делать разрез, вторгаться глубоко в ткани организма, в брюшную, плевральную полость, полость черепа. Иными словами, общая анестезия нужна, когда забор материала проводится во время «открытой» или лапароскопической операции.
Читайте также:
- Тошнота и рвота при перитоните. Симптом Блюмберга
- Токсикоз беременных: причины, симптомы и лечение
- Аморолфин. Аллиламины ( нафтифин, тербинафин ). Гризеофульвин. Свойства и спектр действия аморолфина, нафтифина, тербинафина, гризеофульвина.
- Добавочный нерв. Оценка функции добавочного нерва
- Акт рвоты. Этапы рвоты и причины тошноты
