Поляризационная микроскопия. Интерференционная микроскопия. Люминесцентная микроскопия. Техника микроскопии.
Добавил пользователь Morpheus Обновлено: 22.01.2026
Интерференционная микроскопия решает те же задачи, что и фазово-контрастная. Но если последняя позволяет наблюдать лишь контуры объектов исследования, то с помощью интерференционной микроскопии можно изучать детали прозрачного объекта и проводить их количественный анализ. Это достигается благодаря раздвоению луча света в микроскопе: один из лучей проходит через частицу наблюдаемого объекта, а другой мимо нее. В окуляре микроскопа оба луча соединяются и интерферируют между собой. Возникающую разность фаз можно измерить, определив т. о. массу различных клеточных структур. Последовательное измерение разности фаз света с известными показателями преломления дает возможность определять толщину живых объектов и нефиксированных тканей, концентрацию в них воды и сухого вещества, содержание белков и т. д. На основании данных интерференционной микроскопии можно косвенно судить о проницаемости мембран, активности ферментов, клеточном метаболизме объектов исследования.
Поляризационная микроскопия
Поляризационная микроскопия позволяет изучать объекты исследования в свете, образованном двумя лучами, поляризованными во взаимноперпендикулярных плоскостях, т. е. в поляризованном свете. Для этого используют пленчатые поляроиды или призмы Николя, которые помещают в микроскопе между источником света и препаратом. Поляризация меняется при прохождении (или отражении) лучей света через различные структурные компоненты клеток и тканей, свойства которых неоднородны. В так называемых изотропных структурах скорость распространения поляризованного света не зависит от плоскости поляризации, в анизотропных структурах скорость его распространения меняется в зависимости от направления света по продольной или поперечной оси объекта.
Если показатель преломления света вдоль структуры больше, чем в поперечном направлении, возникает положительное двойное лучепреломление, при обратных взаимоотношениях - отрицательное двойное лучепреломление. Многие биологические объекты имеют строгую молекулярную ориентацию, являются анизотропными и обладают положительным двойным преломлением света. Такими свойствами обладают миофибриллы, реснички мерцательного эпителия, нейрофибриллы, коллагеновые волокна и др. Сопоставление характера преломления лучей поляризованного света и величины анизотропии объекта позволяет судить о молекулярной организации его структуры. Поляризационная микроскопия является одним из гистологических методов исследования, способом микробиологической диагностики, находит применение в цитологических исследованиях и др. При этом в поляризованном свете можно исследовать как окрашенные, так и неокрашенные и нефиксированные, так называемые нативные препараты срезов тканей.
Люминесцентная микроскопия
Широкое распространение имеет люминесцентная микроскопия. Она основана на свойстве некоторых веществ давать свечение - люминесценцию в УФ-лучах или в сине-фиолетовой части спектра. Многие биологические вещества, такие как простые белки, коферменты, некоторые витамины и лекарственные средства, обладают собственной (первичной) люминесценцией. Другие вещества начинают светиться только при добавлении к ним специальных красителей -- флюорохромов (вторичная люминесценция). Флюорохромы могут распределяться в клетке диффузно либо избирательно окрашивают отдельные клеточные структуры или определенные химические соединения биологического объекта. На этом основано использование люминесцентной микроскопии при цитологических и гистохимических исследованиях. С помощью иммуно-флюоресценции в люминесцентном микроскопе выявляют вирусные антигены и их концентрацию в клетках, идентифицируют вирусы, определяют антигены и антитела, гормоны, различные продукты метаболизма и т. д. В связи с этим люминесцентную микроскопию применяют в лабораторной диагностике таких инфекций, как герпес, эпидемический паротит, вирусный гепатит, грипп и др., используют в экспресс- диагностике респираторных вирусных инфекций, исследуя отпечатки со слизистой оболочки носа больных, и при дифференциальной диагностике различных инфекций. В патоморфологии с помощью люминесцентной микроскопии распознают злокачественные опухоли в гистологических и цитологических препаратах, определяют участки ишемии мышцы сердца при ранних сроках инфаркта миокарда, выявляют амилоид в биоптатах тканей.
Специальные виды микроскопии
Темнопольная микроскопия. Используют специальный конденсор, выделяющий контрастирующие структуры неокрашенного материала. Темнопольная микроскопия позволяет наблюдать живые объекты. Наблюдаемый объект выглядит как освещённый на тёмном поле. При этом лучи от осветителя падают на объект сбоку, а в линзы микроскопа поступают только рассеянные лучи.
Фазово-контрастная микроскопияпозволяет изучать живые и неокрашенные объекты. При прохождении света через окрашенные объекты изменяется амплитуда световой волны, а при прохождении света через неокрашенные — фаза световой волны, что и используют для получения высококонтрастного изображения в фазово-контрастной и интерференционной микроскопии.
Поляризационная микроскопия — формирование изображения неокрашенных анизотропных структур (например, коллагеновые волокна и миофибриллы).
Интерференционная микроскопия объединяет принципы фазово-контрастной и поляризационной микроскопии и применяется для получения контрастного изображения неокрашенных объектов. Специальная интерференционная оптика (оптика Номарского) нашла применение в микроскопах с дифференциальным интерференционным контрастом.
Люминесцентная микроскопия применяется для наблюдения флюоресцирующих (люминесцирующих) объектов. В люминесцентном микроскопе свет от мощного источника проходит через два фильтра. Один фильтр задерживает свет перед образцом и пропускает свет длины волны, возбуждающей флюоресценцию образца. Другой фильтр пропускает свет длины волны, излучаемой флюоресцирующим объектом. Таким образом, флюоресцирующие объекты поглощают свет одной длины волны и излучают в другой области спектра.
· Катехоловые амины. Объект может флюоресцировать после специальной обработки ткани. Так, катехоламины, включая адреналин и норадреналин, флюоресцируют после обработки ткани в парах параформальдегида при 60-80 °C. Метод разработан группой шведских учёных и известен как метод Фалька.
· Флюоресцирующие красители (флюоресцеин, родамин и др.) избирательно связываются со специфическими макромолекулами.
Сканирующий ближнепольный оптический микроскоп. В основе работы сканирующего ближнепольного оптического микроскопа лежит использование светового луча, диаметр которого меньше, чем длина волны источника, вследствие чего предел разрешения у такого микроскопа фактически отсутствует. Свет пропускают через субволновую диафрагму (отверстие с диаметром меньшим, чем длина волны используемого излучения). Исследуемый объект размещается непосредственно за отверстием в ближней зоне. Источник субдлинноволнового света размещают на расстоянии 10 нм и менее над объектом. Перемещая исследуемый объект или источник света (диафрагму с субволновым отверстием) в горизонтальном направлении, получают ближнепольное изображение поверхности образца, регистрируемое в виде распределения интенсивности оптического излучения в зависимости от положения диафрагмы. В качестве источника субдлинноволнового света обычно используют зонд, изготовленный путём растягивания расплавленного оптического волокна (плавленно-тянутый зонд), травления и др.; конусовидное остриё зонда покрывают металлом (например, алюминием с помощью его испарения). В источниках света используют мелкие люминесцирующие частицы (бусина размером 10 нм, размещённая на конце зонда, люминесцирующая под воздействием ультрафиолетового облучения). В этом случае прохождение света через объект регистрируют с помощью детектора, покрытого поглощающим ультрафиолет слоем.
Интерференционная микроскопия
Специализированные микроскопы, предназначенные для работы в режиме фазового контраста, их используют главным образом для наблюдения культур клеток, и они позволяют видеть изменения клеток в процессе культивирования. Эти модели микроскопов адаптированы для наблюдения клеток в чашках Петри, в сосудах Карреля и других культуральных сосудах. Инвертированные микроскопы имеют обратное расположение оптики - объективы находятся снизу, а конденсор - сверху.
Направление хода лучей, прошедших сверху вниз через объектив, изменяется системой зеркал, и в глаз наблюдателя они попадают, как обычно, снизу вверх. Микроскопы этого типа предназначены так же для исследования громоздких объектов, которые трудно или невозможно расположить на предметных столиках обычных микроскопов.
Метод интерференционного контраста (интерференционная микроскопия) состоит в том, что каждый луч, входящий в микроскоп, раздваивается; один из полученных лучей направляется сквозь наблюдаемую частицу, а второй — мимо неё по той же или дополнительной оптической ветви микроскопа. В окулярной части микроскопа оба луча вновь соединяются и интерферируют между собой. Результат интерференции определяется разностью хода лучей d, которая выражается формулой d = Nl = (n0 — nm)d, где n0, nm — показатели преломления частицы и окружающей среды, d — толщина частицы, N — т. н. порядок интерференции, l — длина волны света.
Метод интерференционного контраста в некоторых отношениях сходен с методом фазового контраста — оба они основаны на интерференции лучей, прошедших через микрочастицу и миновавших её. Как и фазово-контрастная микроскопия, этот метод позволяет наблюдать прозрачные и бесцветные объекты, но их изображения могут быть и разноцветными (интерференционные цвета). Оба метода пригодны для изучения живых тканей и клеток (и часто применяются именно с этой целью).
Отличие интерференционного метода от метода фазового контраста заключается главным образом в возможности, используя компенсаторы, с высокой точностью (до 1 /300 l) измерять разности хода, вносимые микрообъектами. Это открывает широкие возможности количественных исследований — на основании таких измерений могут быть рассчитаны общая масса и концентрация сухого вещества в микрообъекте (например, в растительной или животной клетке), показатель преломления и размеры объекта. Метод интерференционного контраста часто сочетают с другими методами микроскопии, в частности с наблюдением в поляризованном свете; применение его совместно с микроскопией в ультрафиолетовых лучах позволяет, например, определить содержание нуклеиновых кислот в общей сухой массе объекта.
Интерференционная микроскопия дает изображение, как будто объект освещен сбоку, изображение формируется как сочетание свет-тень. Имеют значение даже небольшие различия в коэффициентах преломления и толщине участков объекта. Позволяет изучать крупные органоиды. Оптика Номарского - специальная призма, улучшающая качество изображения в интерференционном микроскопе.
Микроскопия в поляризованном свете(поляризационная микроскопия) - другой способ наблюдения неокрашенных препаратов.
Метод наблюдения в поляризованном свете (поляризационная микроскопия) служит для микроскопического исследования препаратов, включающих оптически анизотропные элементы (или целиком состоящих из таких элементов). К ним относятся многие минералы, зёрна в шлифах сплавов, некоторые животные и растительные ткани и пр. Оптические свойства анизотропных микрообъектов различны в разных направлениях и проявляются по-разному в зависимости от ориентации этих объектов относительно направления наблюдения и плоскости поляризации света, падающего на них. Наблюдение можно вести как в проходящем, так и в отражённом свете. Свет, излучаемый осветителем, пропускают через поляризатор; сообщенная ему при этом поляризация меняется при последующем прохождении света через препарат (или отражении от него), и эти изменения изучаются с помощью анализатора и различных оптических компенсаторов. По таким изменениям можно судить об основных оптических характеристиках анизотропных микрообъектов: силе двойного лучепреломления, количестве оптических осей и их ориентации, вращении плоскости поляризации, дихроизме.
Дифференциально-интерференционный контраст в проходящем свете (DIC)
Дифференциально интерференционный контраст (интерференционный контраст по Номарскому), - наиболее популярный метод достижения контраста, используемый сейчас даже чаще, чем фазовый контраст. Он давно применяется в материаловедении, где часто используется падающий свет, а теперь метод Номарского быстро вытесняет фазовый контраст в биологических исследованиях.
Принцип метода состоит в том, что луч плоскополяризованного света расщепляется призмой Волластона на два луча. Оба они проходят через объект очень близко друг к другу, однако достаточно далеко для глаза наблюдателя, что создает эффект объемности за счет различий в интенсивностях освещенности деталей в конечном изображении. Два луча совмещаются второй призмой Волластона, расположенной в задней фокальной плоскости объектива. Анализатор завершает формирование изображения.
Два луча имеют боковой сдвиг друг относительно друга, и направление сдвига воспринимается как направление подсветки изображения с одной стороны. Разность длин оптических путей двух лучей обычно устанавливается так, чтобы получился так называемый нулевой серый фон, на котором объект будет ограничен соответственно светлой или темной каймой. Однако, перенастроив микроскоп, можно добиться поворота тени на 180°. Поворот тени дает интересный эффект. Препарат, который сначала имел сходство с яичницей-глазуньей, после перенастройки приобретает вид пластинки с углублениями. Это необходимо учитывать, представляя фотомикрографии, полученные этим методом. Аналогичный результат может получиться, если поворачивать отпечаток.
Сильно передвинув призму Волластона, можно получить окрашенное изображение на приятном цветном фоне. Цвета снова относятся к отрицательной части интерференционной шкалы Ньютона для белого света.
Витальная микроскопия.
Методы прижизненной (витальной) окраски. Прижизненные красители - органические соединения ароматического ряда, обладающие относительно небольшой токсичностью для живых клеток. Различаются основные и кислые красители. Проникая в клетку, они соединяются главным образом с белками, и вначале вся цитоплазма приобретает диффузную окраску, после чего некоторые красители откладываются в цитоплазме в виде гранул. Окраска живых клеток дает возможность выявлять изменения, происходящие в клетках и тканях при разных внешних воздействиях. В последнем случае чрезвычайно важно то, что количество красителя, поглощенного неповрежденными или поврежденными путем какого-либо воздействия клетками, можно точно определить и выразить количественно. Разница в количестве красителя, поглощенного неповрежденными и поврежденными клетками, свидетельствует о характере и степени изменений, возникающих под влиянием различных внешних воздействий.
Индиго окрашивает ядра клеток, а метиленовый фиолетовый - все структуры клетки.
Красители для витального окрашивания должны обладать низкой токсичностью и способностью легко проникать в клетки живого окрашиваемого объекта. Используются красители для видимого света и флуоресцентные красители.
Метиленовый синий - используется для витального окрашивания простейших, изолированных клеток, культур тканей, тонких плёнок живых тканей. Используется раствор 1:1000 — 1:10 000. В ботанике используется для окраски вакуолей, накапливаясь в клетках, содержащих дубильные вещества. Может использоваться для окраски митохондрий.
Методы световой микроскопии
Световая, или оптическая, микроскопия — это один из основных методов исследования частиц, неразличимых человеческим глазом. Данный метод имеет широкое распространение в медицине, фармакологии, биологии, металлографии, криминалистике и других сферах.
Увеличение изображения в световом микроскопе обеспечивается системой собирательных линз, расположенных в окуляре и объективе.

Световой микроскоп — оптический прибор, позволяющий рассмотреть мелкие детали.
Метод световой микроскопии
Предельная разрешающая способность человеческого глаза составляет около 0,1 мм. Это понятие отражает минимальное расстояние, на котором 2 соседние точки определяются как отдельные объекты. Микрочастицы, клеточные структуры и дефекты поверхности имеют размер менее 100 мкм, поэтому для их исследования требуется специальное оборудование.
Историческая справка
Первые оптические микроскопы были изобретены в XVI-XVII вв. Первым, кто заметил увеличительный эффект комбинации из нескольких линз, был венецианский врач Джироламо Фракасторо. В 1609 г. Галилео Галилей представил собственный вариант прибора с 2 стеклами: выпуклым и вогнутым. Первое устройство называлось оккиолино (occhiolino).
Через 10 лет после этого голландский ученый Корнелиус Дреббель усовершенствовал конструкцию, использовав для объектива 2 выпуклые линзы.
Практическое применение микроскопа началось с конца XVII в., когда Антони Ван Левенгук использовал собственное оптическое устройство для исследования биологических структур. Его микроскоп содержал всего одно мощное стекло, что уменьшало количество дефектов картинки.
Приборы Левенгука позволяли увеличить изображение в 275 раз и рассмотреть строение бактерий, дрожжей, эритроцитов, одноклеточных микроорганизмов и насекомых.
Популяризации микроскопии способствовала и книга английского исследователя Роберта Гука, которая вышла в 1664 г. В ней ученый ввел термин «клетка» и опубликовал гравюры некоторых микрообъектов.

Методы микроскопии выбираются в зависимости от характера и свойств изучаемых объектов.
В течение следующих столетий конструкция оптического микроскопа непрерывно совершенствовалась. Несмотря на то, что в первой половине XX в. были изобретены электронные приборы, которые позволяли рассмотреть нанообъекты, световой метод не теряет своей популярности. В 2006 г. группа немецких ученых разработала оптическое устройство под названием наноскоп, которое обладает разрешающей способностью 10 нм.
Подробно о принципе действия
Принцип работы оптического микроскопа основывается на прохождении прямого или отраженного луча света через систему линз.
Объектив прибора содержит до 14 стекол. При прохождении светового пучка через эту часть устройства изображение увеличивается до 100 раз, а при прохождении окуляра — в 20-24 раза. Выпуклые и вогнутые стекла позволяют сфокусировать картинку на сетчатке или приспособлениях для документирования информации.
Видимое излучение, которое создает осветительная система прибора, ограничивают несколькими диафрагмами. Это повышает четкость изображения.
Увеличивающие линзы имеют 2 дефекта. Сферическая аберрация мешает фокусировать сразу все поле исследования, а хроническая приводит к появлению яркой каймы по контуру изображения. Чтобы компенсировать дефекты, окуляр и объектив оснащаются корригирующими стеклами.
Где применяется
Методы световой микроскопии применяют в следующих областях науки и промышленности:
- медицине и лабораторной диагностике;
- биологии;
- металлографии, неразрушающих методах контроля на производстве;
- микроэлектронике;
- минералогии, кристаллографии;
- археологии, геологии;
- криминалистике;
- пищевой промышленности;
- ювелирном деле и др.

Световая микроскопия применяется в медицине и биологии.
В целом об устройстве светового микроскопа
Оптический микроскоп состоит из следующих элементов:
- штатива;
- тубуса;
- окуляра;
- объектива;
- призмы;
- источника света;
- конденсора;
- апертурной и полевой диафрагм;
- фокусировочного механизма;
- светофильтра;
- зеркала;
- предметного столика.
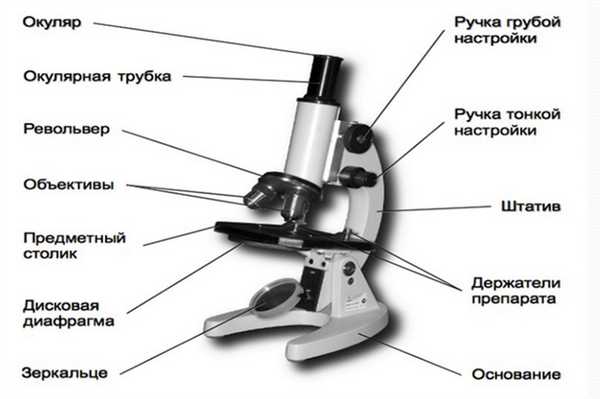
Устройство светового микроскопа.
Некоторые модели прибора оборудованы дополнительными объективами, системами записи и передачи информации.
Виды световых микроскопов с описанием
Особенности конструкции зависят от предназначения микроскопа. Для увеличения четкости изображения используют методы флуоресценции, люминесценции, инверсии и др.
Биологическое оборудование
Биологические приборы позволяют исследовать прозрачные или полупрозрачные объекты. Принцип их работы основан на изучении светлого поля в потоке проходящего света. Такие микроскопы применяют в лабораторной диагностике, ботанике, цитологии, микроэлектронике, археологии и пищевой промышленности.

Биологическое оборудование позволяет исследовать прозрачные объекты.
Для повышения разрешающей способности используют иммерсионные оптические системы. В этом случае между образцом и первым стеклом вводится жидкость с высоким коэффициентом преломления (минеральное масло, раствор глицерина, дистиллированная вода и др.).
Криминалистическое оборудование
Главная особенность криминалистического микроскопа — это возможность сравнения 2 объектов. Такое исследование помогает найти сходство между компонентами взрывных устройств, гильзами, пулями, волосами, волокнами и другими уликами.
Приборы для криминалистики оснащают фото- и видеокамерами, а также программным обеспечением.
Это позволяет снизить вероятность ошибок, построить модели объектов и сравнить с данными из электронных источников.
Флуоресцентные микроскопы
Флуоресцентные, или люминесцентные, микроскопы позволяют исследовать объекты, которые испускают световой поток после облучения ультрафиолетом. Они оборудованы коротковолновым источником освещения, светофильтрами и интерференционной пластинкой.

Флуоресцентный микроскоп — оптический прибор, показывающий в увеличенном виде клетки.
Флуоресцентные микроскопы активно применяют в лабораторной диагностике, в частности, при изучении клеток крови и антигенов. Для анализа предметов, которые не излучают свет, используют люминесцентные красители и порошки.
Поляризационные микроскопы
Поляризационный прибор является наиболее сложным из всех представленных видов микроскопов. Его используют для исследования анизотропных материалов, полимеров, некоторых клеток и микробиологических объектов.
Источник света со специальными фильтрами формирует поляризованный поток, который облучает образец.
Оптическая система интерпретирует двойное лучепреломление среды и позволяет изучить ее структуру.
Инвертированные с перевернутым положением объектива
В инвертированном микроскопе объектив располагается не над образцом, а под предметным столиком. Такие приборы применяют в биологии, медицине, промышленности, металлографии, криминалистике и других сферах.

Инвертированный микроскоп имеет особенную конструкцию.
Перевернутое положение оптической системы позволяет изучать более крупные образцы и работать со специальной посудой.
Микроскопы для металлографии
Металлографические микроскопы предназначены для исследования поверхности непрозрачных объектов. Изображение получают путем преломления отраженного светового луча.
Предметом изучения являются микродефекты поверхности и зерна сплавов. Помимо металлургии и промышленности, такие устройства применяют в геологии и археологии. Для обеспечения четкости используют специальные системы линз и зеркал.
Стереомикроскопы (дают объемное изображение)
Стереомикроскопы оснащены 2 объективами, что позволяет получать объемное изображение исследуемого образца. По сравнению с устройствами плоского поля они дают более резкую, четкую и контрастную картинку.

Стереомикроскопы позволяют получать объемное изображение.
Такие приборы используют в точном машиностроении, ювелирном деле и других областях промышленности.
Моновидеомикроскопы с возможностью получения видео
Видеомикроскопы предназначены для динамического наблюдения за образцом и фиксации изображения. Для повышения эффективности работы их оснащают специальными линзами, светофильтрами и адаптерами.
Разновидности методов световой микроскопии
Выбор метода оптической микроскопии определяется особенностями объектов и целью исследования.
Светлое поле в потоке проходящего света
Данный метод основан на принципе прохождения потока света через образец. Предмет частично поглощает и рассеивает попадающие на него лучи, что позволяет сформировать изображение.

Светлое поле в потоке — метод, который построен на принципе прохождения света.
Светлопольную микроскопию применяют для изучения окрашенных тканей животных и растений, тонких шлифов и др. Для прохождения светового пучка препарат должен быть прозрачным.
Косое освещение
Данный метод является разновидностью микроскопии светлого поля. Чтобы выявить рельеф и сделать изображение более контрастным, поток направляют под большим углом к образцу.
Светлое поле в отраженном свете
Светопольная микроскопия в отраженном свете позволяет исследовать поверхности непрозрачных предметов (сплавов, покрытий, руд и др.). Свет падает на образец сверху, а основная оптическая система исполняет роль объектива и конденсора.
Светлое поле в отраженном свете позволяет исследовать поверхности непрозрачных предметов.
Изображение формируется за счет того, что элементы поверхности по-разному отражают и рассеивают попадающие лучи. Травление дает возможность изучить не только дефекты, но и микроструктуру и фазовый состав образца.
Темное поле
Метод темного поля предназначен для изучения прозрачных образцов, которые не абсорбируют свет. Специальный конденсор направляет лучи так, что они формируют полый конус, в центре которого находится объектив. Таким образом, большая часть лучей не попадает в оптическую систему.
Изображение представляет собой темное поле с небольшими светлыми включениями, которые формируются за счет рассеяния света частицами препарата.
Ультрамикроскопия
Метод ультрамикроскопии является разновидностью темнопольного. Для исследования образцов используют сильные источники света, а лучи направляют перпендикулярно предметному столу. Эффект рассеяния волн позволяет обнаружить частицы менее 10 нм.

Ультрамикроскопия — метод наблюдения и анализа коллоидных частиц.
Фазовое контрастирование
Метод фазового контраста позволяет изучать прозрачные и неокрашенные образцы. При малом различии в коэффициенте преломления изображение нельзя получить ни на светлопольном, ни на темнопольном микроскопе, поскольку разница в поглощении и рассеянии света будет минимальной.
Однако при прохождении через образец волна приобретает фазовый рельеф, который фиксируется специальным объективом. В изображении он отображается как различие в яркости элементов.
Аноптральный контраст
Данная методика является подвидом фазовой микроскопии. На иммерсионную линзу наносят кольцо из сажи, которое пропускает 10% лучей и совпадает с контуром кольцевой диафрагмы конденсора. При отсутствии образца амплитуда световых волн уменьшается на 90%.
Проходя через среды разной плотности, лучи дифрагируют, в результате чего их амплитуда остается неизменной.
За счет этого поле исследования получается темным, а частицы образца — светлыми.
Поляризационный метод
Анализ анизотропных материалов проводят в свете, пропущенном через специальную фильтрующую пластинку. При прохождении через образец плоскость поляризации лучей меняется.
По разнице между начальными и конечными характеристиками волн определяют количество оптических осей, их ориентацию и др.
Интерференционная микроскопия
Интерференционный метод основан на параллельном прохождении 2 лучей через предметный столик и мимо него. В окуляре микроскопа когерентные волны соединяются и интерферируют между собой.
При прохождении через образец первый луч запаздывает по фазе, что влияет на результирующую амплитуду и яркость изображения.
Люминесценция или флуоресценция
Принцип люминесцентной микроскопии основан на том, что некоторые образцы испускают видимый свет после облучения ультрафиолетом. Перед исследованием препараты обрабатывают флуоресцирующими антисыворотками, порошками или маркерами.
Волны ультрафиолетового спектра применяют для повышения разрешающей способности микроскопа. Для изучения препаратов, которые не испускают видимый свет после воздействия УФ-лучей, используют фотокамеры и кварцевые линзы.
Принцип работы флуоресцентного микроскопа
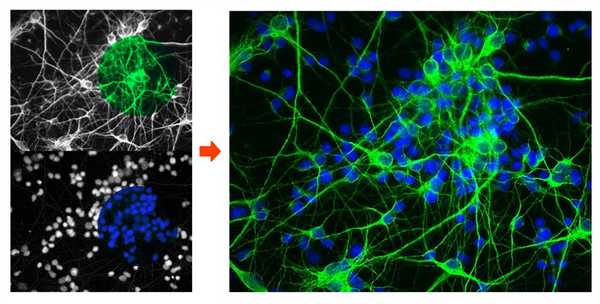
Флуоресцентный микроскоп стал важнейшим инструментом в современной биологии и медицине. Он позволяет детально исследовать динамические процессы на уровне молекулярных и клеточных структур, предоставляя специалистам высокоточные изображения изучаемых объектов.

Флуоресцентный микроскоп для проведения исследований.
Основные понятия
Флуоресценция относится к процессам люминесценции, при которых чувствительные молекулы испускают свет, находясь в электронно-возбужденных состояниях, создаваемых физическими или химическими механизмами.
В данном случае свечение становится следствием воздействия излучений ультрафиолетового или видимого спектра.
Флуоресцирующие молекулы называют флуорофорами. Поглощение и испускание фотонов веществом происходят почти одновременно. При более длительном временном интервале между этими процессами целесообразно говорить о явлении фосфоресценции.
Сфера использования
Высокочувствительные флуоресцентные микроскопы широко используются в медико-биологических областях. Они позволяют наблюдать за локализацией молекул и микроорганизмов, визуализировать и исследовать их специфические особенности.
При этом флуоресценция не оказывает мощного угнетающего действия на клетки, что облегчает мониторинг их внутренних динамических процессов.
Подобные микроскопы также применяются в материаловедении. Они помогают при анализе составов химических субстанций, обнаружении нежелательных вещественных вкраплений, выявлении дефектов поверхностей и решении прочих подобных задач.
Кратко о методе флуоресцентной микроскопии
Метод основан на способности фоточувствительных молекул к структурной интеграции с микрообъектами. Они прикрепляются к образцам с помощью функциональных химических групп и при световом облучении возвращают часть поглощенных фотонов.
Исследователи принимают и анализируют интенсивность волновых сигналов, делая выводы о строении изучаемых объектов и протекающих в них процессах.
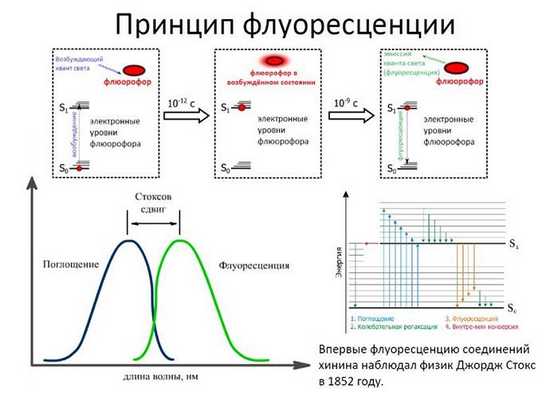
Принцип флуоресценции соединений.
Какие процессы участвуют
При флуоресценции происходят поглощение квантов и их последующее частичное высвобождение. Электроны облучаемого флуорофора приобретают дополнительную энергию и на мгновение перемещаются на более высокий энергетический уровень.
При возвращении в первичное состояние происходит высвобождение фотонов во внешнюю среду. В этом процессе часть энергии тратится на восстановление термодинамического равновесия, поэтому величина испускаемой волны больше длины волны возбуждения. Разницу между энергиями возбуждающего и испускаемого излучений называют стоксовым сдвигом.
Формирование изображения
Микроскопы оснащены электронными модулями, позволяющими визуализировать исследуемые объекты при низких уровнях световых сигналов. Эти узлы содержат устройства с зарядовой связью, способные преобразовывать волновую энергию в фототок.
Далее электрические заряды сканируются регистрами сдвига и преобразуются в аналоговые, а затем в цифровые сигналы. На основе полученных данных формируется изображение высокого разрешения в 12- или 16-битном формате.
Ключом к качественной визуализации является правильный подбор оптических фильтров, гарантирующих надежное разделение испускаемого тусклого от возбуждающего яркого света.

Оптическая схема микроскопа.
Подробно о конструкции и принципе работы микроскопа
Устройство разработано на базе традиционного оптического микроскопа, но имеет иной принцип работы. Исследуемый образец помечают люминесцирующими веществами, а затем с помощью сложной системы фильтров собирают испускаемые фотоны и визуализируют микрообъекты.
Устройство микроскопа
В основном прибор обладает всеми модулями, характерными для оптических микроскопов. Однако он, в отличие от них, оснащен флуоресцентным модулем.
Задачами данного технологического узла являются направление возбуждающего излучения на образец и последующее отделение отраженного света от общего потока. Для этого используется сложная система фильтров, объединенных в единый блок.
Также особенностью флуоресцентного микроскопа является тип осветителя. Оптические устройства в качестве источника света используют лампы накаливания с непрерывным спектром и максимумом в красной зоне.
Такие приборы плохо подходят для возбуждения флуоресцирующих красителей, поглощающих излучение в коротковолновом диапазоне. Вместо них применяют галогенные или светодиодные лампы.
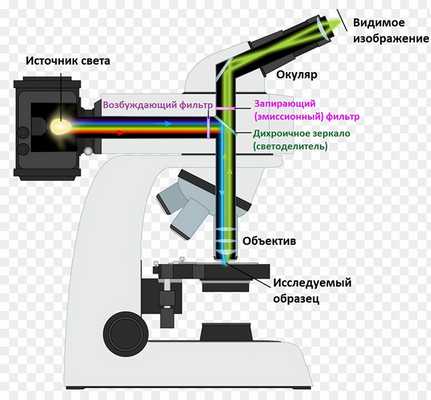
Устройство флуоресцентного микроскопа.
Конструкция фильтров-блоков
В основе конструкции микроскопа лежит блок, включающий набор следующих оптических элементов:
- фильтра возбуждения;
- дихроичного светоделителя;
- эмиссионного фильтра.
Фильтр возбуждения принимает излучение от источника света, пропуская длины волн заранее установленного диапазона. Дихроичное зеркало сначала отражает фотоны через оптический объектив на образец, а затем направляет флуоресценцию к системе обнаружения. Далее на пути испускаемого излучения стоит эмиссионный фильтр, который блокирует нежелательные волны.
При установке фильтров важно обеспечить правильный угол наклона и ориентацию относительно светового пути, чтобы эффективно управлять фотонным потоком.
Производители помечают в основном белой точкой отражающую сторону дихроичного зеркала, а на остальных деталях указывают направляющие стрелки.
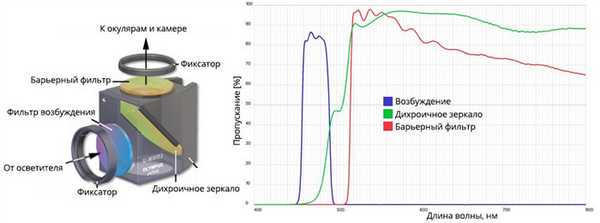
Конструкция и спектральная характеристика фильтр-блоков.
Используемые осветители
В качестве источников света люминесцентные микроскопы чаще используют галогенные лампы. Они имеют небольшие размеры, хорошую цветопередачу и невысокую стоимость. Однако из-за низкой яркости и малого срока службы эти устройства постепенно вытесняются светодиодными LED-элементами.
Источники света на основе LED-технологии считаются самыми востребованными в современной микроскопии. Это универсальные полупроводниковые осветители, обладающие широким набором спектральных характеристик. Они позволяют использовать излучение в диапазоне от ультрафиолетовой до ближней инфракрасной зоны.
Ранее в люминесцентной микроскопии широко применялись ртутные лампы высокого давления. Их использование запрещено российским законодательством с 2020 г.
Это надежные и непрерывно работающие установки, обладающие наиболее высокими значениями яркости по сравнению галогенными и светодиодными приборами.
Однако они имеют ряд существенных недостатков: малый срок службы, изменение спектральной характеристики с возрастом и продолжительные интервалы между выключением и включением.
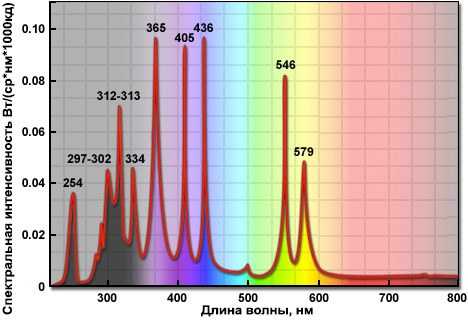
Спектральная интенсивность ртутной лампы НВО 100.
Флуоресцентные камеры
Камера считается одним из важнейших и самых дорогих компонентов микроскопа. Она должна обладать высокой чувствительностью и низким уровнем шума, чтобы захватить как можно больше фотонов.
Для флуоресцентной визуализации предпочтительно монохромное устройство, которое обеспечивает одинаковое обнаружение сигналов на всех пикселях и увеличивает общую чувствительность.
Камера оснащается 1 из 2 типов матриц: прибором с зарядовой связью (CCD) или устройством на металл-оксид-полупроводниковых транзисторах (sCMOS).
Они преобразуют волновые сигналы в электрические заряды, которые поступают на усилитель, а затем передаются в аналогово-цифровой преобразователь.
В CCD-камерах все сигналы сканируются одновременно, что позволяет снизить уровень шума и повысить чувствительность. В sCMOS-устройствах считывание происходит произвольно, вследствие чего возникают нежелательные вибрации, искажается геометрия объектов при визуализации.
Выбор камеры зависит от типа исследуемых образцов, требуемой частоты кадров, угла обзора, разрешения и чувствительности. Например, для промышленных изысканий необходимы высокое качество изображений и скорость работы, а для медико-биологических исследований важнее чувствительность устройства.
Высокочувствительные камеры с большим разрешением.
Обозначения для фильтров
Производители разрабатывают собственные системы кодов для обозначения фильтров, используемых во флуоресцентной микроскопии, что нередко приводит к путанице в терминологии. Кодировка в основном отражает вещественный состав изделия или его функциональные свойства.
При маркировке фильтров возбуждения часто используют аббревиатуры UG и BG, обозначающие ультрафиолетовое и синее стекла соответственно.
Современные фильтры высокого разрешения с интерференционной оптикой многими производителями кодируются сокращением IF. На узкополосных моделях встречаются символы KP или SP.
Дихроичные светоделители маркируются следующими акронимами: DM — дихроичное зеркало, CBS — хроматический светоделитель, TK — щелевой делитель, FT — делитель цвета, RKP — узкополосный отражатель. Все эти обозначения взаимозаменяемы.
Эмиссионные фильтры кодируются следующими символами: L или LP — широкополосный элемент, GG или Y — желтое стекло, OG или O — оранжевое стекло, RG или R — красное стекло, BA — запирающее стекло, K — щелевой фильтр.
Иногда наряду с акронимом присутствует числовое значение, указывающее на длину волны в нанометрах, на которой фильтр достигает половины величины максимальной пропускной способности.

Флуоресцентный светофильтр.
Скорость обесцвечивания образцов
При исследовании микропрепаратов важно учитывать скорость процесса фотообесцвечивания — необратимого распада фоточувствительных молекул вследствие окисления их кислородом под воздействием светового потока высокой интенсивности.
Фотообесцвечивание неминуемо, но его скорость зависит от реакционной способности и окружения флуорофоров.
Для замедления процесса исследователи используют:
- специальные реагенты, способные менять фотофизические свойства флуорофоров посредством варьирования функциональных групп;
- фотостабильные красители;
- фильтры нейтральной плотности, уменьшающие количество фотонов, падающих на образец.
Кроме того, необходимо снижать интенсивность светового излучения и сокращать продолжительность волнового воздействия.
Иногда образец содержит собственные молекулы или органеллы, способные к люминесценции. Нередко они испускают волны той же длины, что и искусственно внедренные флуорофоры.
При визуализации сложно различать ожидаемые и эндогенные сигналы. В этом случае фотообесцвечивание может оказаться полезным. Образец подвергают длительному воздействию ультрафиолета для разрушения его собственных фоточувствительных компонентов. Затем в структуру изучаемого объекта внедряют флуоресцентные белки, с помощью которых осуществляют визуализацию.
Читайте также:
