Последовательность SRP - частицы распознающей сигнал
Добавил пользователь Валентин П. Обновлено: 22.01.2026
Органоиды, или органеллы, - постоянные специфические структуры цитоплазмы, выполняющие определенные функции, необходимые для поддержания жизнедеятельности клетки.
Различают органоиды общего значения и специальные органоиды. Органоиды общего значения имеются во всех клетках и выполняют функции, общие для всех клеток - митохондрии, рибосомы, эндоплазматическая сеть, комплекс Гольджи, лизосомы, пероксисомы, цитоскелет и клеточный центр.
Органоиды специального значения имеются только в клетках какого-то определенного типа и обеспечивают выполнение функций, присущих только этим клеткам.
Мембранные органоиды:
Немембранные органоиды
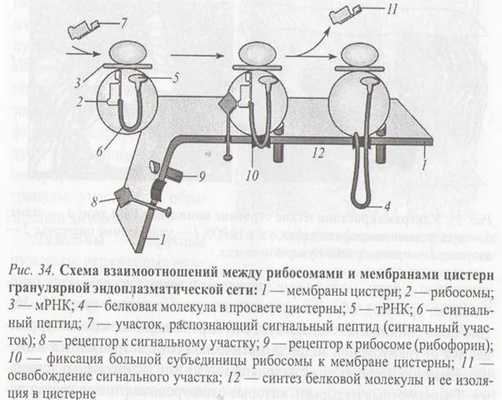
Эндоплазматическая сеть открыта Портером в 1945 году. Морфология - сеть канальцев и цистерн сложенных мембранами. Различают гранулярную (шероховатую, зернистую) и гладкую ЭПС.
Гранулярная ЭПС содержит рибосомы на наружной стороне мембраны, обращенную к гиалоплазме. Гладкая ЭПС не содержит рибосомы. В скелетных мышцах ЭПС носит название саркоплазматический ретикулум. ЭПС пронизывает всю клетку. Полость ЭПС сообщается с перинуклеарным пространством ядра, а мембрана ЭПС с плазматической мембраной ядра. На рибосомах гранулярной ЭПС синтезируются секреторные белки, предназначенные для выведения из клетки, а также белки лизосом и внеклеточного матрикса.
Синтез указанных белков включает 5 этапов:
1. Связывание сигнал распознающий частицы (SRP), состоящий из 6-ти белков и малой цитоплазматической РНК (srpРНК) с сигнальной последовательность полипептидной цепи.
2. Взаимодействие комплекса матричной РНК (мРНК) - рибосома - SRP со специфическим белком-рецептором (SRP-рецептором), находящимся на цитоплазматической стороне мембраны.
3. Освобождение SRP от комплекса; связывание рибосомы с белок-транслоцирующим комплексом мембраны шероховатой ЭПС транслоконом и встраивание сигнальной последовательности в канал транслокона.
4. Возобновление трансляции и перенос растущей полипептидной цепи в полость ЭПС.
5. Удаление сигнальной последовательности от полипептида под действием фермента.
Частица распознавания сигнала
Секреторные или мембранные белки поступают в ЭР сразу после того, как их растущие полипептидные цепи выходят из канала большой рибосомной субъединицы, как описано выше. Эти типы белков содержат сигнальный пептид, расположенный вблизи N-конца полипептида. Сигнальный пептид состоит преимущественно из гидрофобных аминокислот. Тип и длина сигнального пептида могут меняться, но в целом он должен быть гидрофобным.
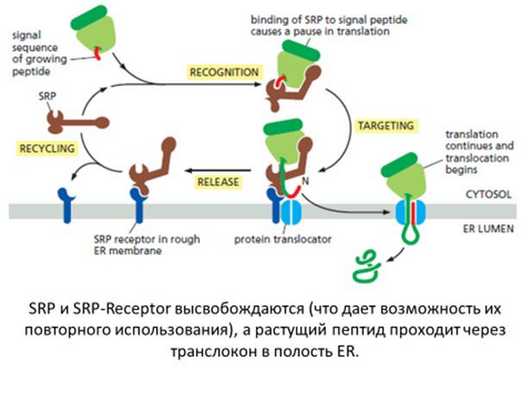
Когда эта последовательность растущего белка сходит с рибосомы, происходят определенные процессы. Сначала частица распознавания сигнала ( signal recognition particle , SRP ) узнает пептид и немедленно связывается с ним (рис. 3-13).
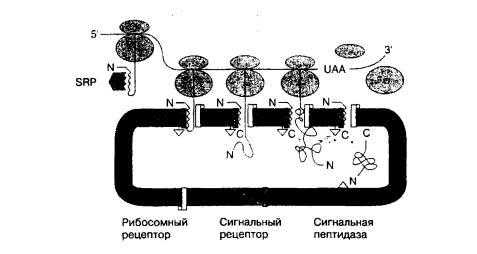
Рис. 3-13. Перенос белков в эндоплазматический ретикулум. Рибосомы, синтезирующие белки, перемещаются по мРНК от 5' конца к 3’ концу. Когда сигнальнй пептид белка, предназначенного для секреции, мембраны клетки или лизосомы, выходит из большой единицы рибосомы, он связывается с частицей распознавания сигнала (SRP). Это прекращает дальнейшую трансляцию до тех пор, пока комплекс - «рибосома — растущая цепь — SRP» не свяжется с SRP рецептором на цитоплазматической поверхности эндоплазматического ретикулума. В реакции, требующей гидролиза GTP, SRP возвращается в цитоплазму, и синтез белка (элонгация) продолжается. При переносе начального участка полипептида происходит открытие белкового канала, и растущая белковая цепь входит в ЭР. Затем сигнальный пептид отщепляется сигнальной пептидазой. После завершения синтеза белка две субъединицы рибосомы диссоциируют, С-конец белка входит в ЭР, и происходит разборка субъединиц канала. (N - N-конец белка; С — С-конец белка.) (Воспроизведено с изменениями с разрешения авторов из: Регата Е, Linappa VR. Transport of proteins into and across the endoplasmatic reticulum membrane. In: Protein Transfer and Organelle Biogenesis. Das RC, Robbins RW (editors). Academic Press, 1988.)
Другая важная структура в составе SRP-54 — это недавно открытый GТРазный домен, который локализован в белке снаружи от М-домена. SRP-R — это гетеродимер, состоящий из α и β цепей. Обе цепи содержат GТРазный домен. Таким образом, число GTPa3, участвующих в направлении белка, увеличивается до трех.
Частица распознавания сигнала - Signal recognition particle

Распознавание сигнала частица (SRP ) представляет собой обильный цитозольный универсально консервативный рибонуклеопротеин (комплекс белок - РНК ), который распознает и нацеливает специфические белки эндоплазматического ретикулума у эукариот и плазматической мембраны у прокариот.
Содержание
- 1 История
- 2 Механизм
- 3 Состав
- 4 Аутоантитела
- 5 См. Также
- 6 Ссылки
- 7 Внешние ссылки
История
Функция SRP была обнаружена путем изучения обработанных и необработанных легкие цепи иммуноглобулина ; вновь синтезированные белки у эукариот несут N-концевые гидрофобные сигнальные последовательности, которые связываются с помощью SRP, когда они выходят из рибосомы.
Механизм
В эукариот, SRP связывается с сигнальной последовательностью вновь синтезированного пептида, когда он выходит из рибосомы. Это связывание приводит к замедлению синтеза белка, известному как «остановка элонгации», консервативной функции SRP, которая способствует связыванию процессов транслокации белка и транслокации белка. Затем SRP нацеливает весь этот комплекс (комплекс рибосомы с растущей цепью ) в проводящий белок канал, также известный как транслокон, в эндоплазматическом ретикулуме ( ER) мембрана. Это происходит посредством взаимодействия и стыковки SRP с родственным ему рецептором SRP, который расположен в непосредственной близости от транслокона.
У эукариот есть три домена между SRP и его рецептором, которые функционируют в связывании и гидролизе гуанозинтрифосфата (GTP). Они расположены в двух родственных субъединицах рецептора SRP (SRα и SRβ) и белка SRP54 (известного как Ffh у бактерий). Было показано, что скоординированное связывание GTP с помощью SRP и рецептора SRP является предпосылкой для успешного нацеливания SRP на рецептор SRP.
После стыковки формирующаяся пептидная цепь вставляется в канал транслокона, где она входит в приемную. Синтез белка возобновляется по мере высвобождения SRP из рибосомы. Рецепторный комплекс SRP-SRP диссоциирует посредством гидролиза GTP, и цикл SRP-опосредованной транслокации белка продолжается.
Попав внутрь ER, сигнальная последовательность отщепляется от основного белка сигнальной пептидазой. Следовательно, сигнальные последовательности не являются частью зрелых белков.
Состав
Несмотря на то, что функция SRP аналогична у всех организмов, ее состав сильно различается. Ядро SRP54- РНК SRP с активностью GTPase является общим для всей клеточной жизни, но некоторые субъединицы полипептиды специфичны для эукариот.
| Эукариот | Археи | Бактерии |
|---|---|---|
| SRP9 | No | Нет |
| SRP14 | No | Нет |
| SRP19 | Да | Нет |
| SRP54 | Да | Ffh |
| SRP72 | No | Нет |
| 7SL РНК | Да | 6SL /4.5SL РНК |
SRP19-7S.S РНК-комплекса SRP из M. jannaschii
S-домен человеческого SRP
Аутоантитела
Антитела против распознающих сигнал частиц в основном связаны с полимиозитом, но не очень специфичны для него. У людей с полимиозитом наличие антител к SRP связано с более выраженной мышечной слабостью и атрофией.
Биология и медицина
SRP, частица, распознающая сигнал (a signal-recognition particle)
SRP - частица, распознающая сигнал (a signal-recognition particle) и направляющая сигнальный пептид ЭР к специфическому рецептору в мембране ЭР . Это сложная частица, состоящая из шести различных полипепдидных цепей, связанных с одной молекулой 7SL-РНК.
Частица, распознающая сигнал, связывается с сигнальным пептидом, как только он "сходит" с рибосомы. Это приводит к временной остановке синтеза белка. Возникшая пауза в трансляции , вероятно, дает возможность рибосоме связаться с мембраной ЭР до того, как синтез полипептидной цепи будет завершен. Благодаря этому ненужного высвобождения белка в цитозоль не происходит.
Пауза в трансляции длится до тех пор, пока захватившая рибосому частица не свяжется с SRP-рецептором , находящемся на цитоплазматической стороне мембраны шероховатого ЭР . Он взаимодействует с SRP-связанными рибосомами таким образом, что частица меняет свое положение, и трансляция возобновляется. Одновременно рибосома связывается с мембраной ЭР, и растущая на ней полипептидная цепь переносится к системе транслокации в мембране. Эта система изучена плохо, известно только, что она включает белок-рецептор второго сигнального пептида, отличающийся от SRP. По- видимому, ее роль заключается в связывании рибосомы, на которой синтезировался сигнальный пептид ЭР, с мембраной ЭР; участвует она и в последующем переносе белка через мембрану.
Рецептор частицы распознавания сигнала - Signal recognition particle receptor
рецептор частицы распознавания сигнала (SRP), также называемый стыковочный белок, представляет собой димер, состоящий из 2 различные субъединицы, которые связаны исключительно с грубым ER в клетках млекопитающих . Его основная функция - идентифицировать блоки SRP. SRP (частица распознавания сигнала) - это молекула, которая помогает комплексам рибосома -мРНК- полипептид оседать на мембране эндоплазматический ретикулум.
рецептор SRP
Рецептор SRP эукариот (называемый SR) представляет собой гетеродимер SR-альфа (70 кДа) и SR-бета (25 кДа), оба из которых содержат GTP -связывающий домен, тогда как прокариотический рецептор SRP включает только мономерный, слабо связанный с мембраной гомолог SR-альфа FtsY. SR-альфа регулирует нацеливание комплексов SRP-рибосома-растущий полипептид на транслокон. SR-альфа связывается с субъединицей SRP54 комплекса SRP. Субъединица SR-бета представляет собой трансмембранную GTPase, которая прикрепляет субъединицу SR-alpha (GTPase периферической мембраны) к мембране ER. SR-бета взаимодействует с N-концевым SRX-доменом SR-альфа, который не присутствует в бактериальном гомологе FtsY. SR-бета также задействована в рекрутировании растущего полипептида SRP в канал, проводящий белок.
Это семейство представляет собой гомологи альфа-субъединицы рецептора SR. Члены этой записи состоят из центрального шестицепочечного антипараллельного бета-листа, зажатого спиралью альфа1 с одной стороны и спиралями альфа2-альфа4 с другой. Они взаимодействуют с малой GTPase SR-beta, образуя комплекс, который соответствует классу малых комплексов G-белок-эффектор, включая Rap-Raf, Ras-PI3K (гамма), Ras-RalGDS и Arl2-PDE (дельта).
Частица распознавания сигнала (SRP)
частица распознавания сигнала (SRP) представляет собой мультимерный белок, который вместе со своим рецептором конъюгата (SR) участвует в нацеливании на секреторные белки к мембране грубого эндоплазматического ретикулума (RER) у эукариот или к плазматической мембране у прокариот. SRP распознает сигнальную последовательность растущего полипептида на рибосоме, замедляет его удлинение и присоединяет комплекс SRP-рибосома-полипептид к мембране RER через рецептор SR. SRP состоит из шести полипептидов (SRP9, SRP14, SRP19, SRP54, SRP68 и SRP72) и одной молекулы 7S РНК из 300 нуклеотидов. Компонент РНК катализирует взаимодействие SRP с его рецептором SR. У высших эукариот комплекс SRP состоит из домена Alu и домена S, связанных с помощью РНК SRP. Домен Alu состоит из гетеродимера SRP9 и SRP14, связанного с 5'- и 3'-концевыми последовательностями РНК SRP. Этот домен необходим для замедления удлинения растущей полипептидной цепи, что дает SRP время для стыковки комплекса рибосома-полипептид с мембраной RER.
Контртрасляционная транслокация белков в полость эндоплазматического ретикулума
Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные транслокационные комплексы на мембране ЭПР. Сигнальная последовательность для ЭПР включает обычно 5-10 преимущественно гидрофобных аминокислот и расположена на N-конце белка. В ее удаленном от конца части имеется консенсусная последовательность, узнаваемая специфической протеазой. Эта сигнальная последовательность опознаётся специальным комплексом — «опознающей сигнал частицей» (signal-recognition particle, SRP). В состав SRP входит шесть белков и короткая молекула РНК [1]. Один участок SRP связывает сигнальную последовательность, а другой связывается с рибосомой и блокирует трансляцию. Отдельный домен SRP отвечает за связывание с SRP-рецептором на мембране ЭПР.
Вместе с SRP рибосома перемещается к ЭПР и связывается с рецептором SRP (интегральным белком) на цитозольной стороне мембраны ЭПР. Этот комплекс (рибосома — SRP — рецептор SRP) связывается с порой — транслокатором белка на мембране ЭПР. Обычно с мРНК связаны несколько рибосом, и на мембране ЭПР сидят полирибосомы, причем каждая рибосома присоединена к своей поре. Дойдя до 3'-конца мРНК, рибосома возвращается в цитоплазму, однако мРНК удерживается у мембраны ЭПР за счет того, что новые рибосомы, вязанные с SRP, присоединяются к ее 5'-концу.
После связывания с транслокатором комплекс SRP — рецептор SRP отделяется от рибосомы, и это приводит к возобновлению трансляции. Сейчас доказано, что белок по мере трансляции проникает в ЭПР через водный канал транслокатора, имеющий воротный механизм и сформированный у эукариот четырьмя субъединицами комплекса Sec61 (гомологичные белки есть и на мембранах бактериальных клеток).
После возобновления трансляции гидрофобный участок сигнальной последовательности остается связан с транслокатором, а вновь синтезируемый белок в виде петли проталкивается внутрь ЭПР. Этот процесс не требует дополнительных затрат энергии АТФ. После того, как С-конец белка отделяется от рибосомы и оказывается внутри ЭПР, протеаза сигнального пептида отрезает его от белка. Белок внутри ЭПР сворачивается, приобретая нормальную конформацию, а сигнальный пептид через открывшийся в транслокаторе боковой канал перемещается в липидный бислой мембраны ЭПР, где быстро разрушается протеазами.
Попавший в ЭПР белок остается в этой органелле, если имеет специальную «удерживающую в ЭПР» (ER-retaining) последовательность из четырех аминокислот на С-конце. Некоторые из остающихся в ЭПР белков играют важную роль в сворачивании и посттрансляционной модификации проходящих через ЭПР белков. Так, фермент дисульфид-изомераза катализирует окисление свободных SH-групп цистеина и образование дисульфидных связей, в белок-шаперон BiP препятствует неправильному сворачиванию и агрегации белков до образования ими четвертичных структур, а также способствует удержанию связанных с ним белков в ЭПР.
SPR-частица и ее рецептор
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Читайте также:
