Предоперационная подготовка при портальной гипертензии. Виды операций при портальной гипертензии
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
В клинику поступила пациентка К. 60-ти лет с жалобами на слабость и потерю веса. С 2012 года страдает аутоимунным гепатитом, в 2020 году выявлен цирроз печени, варикозно расширенные вены пищевода.
Состояние пациентки осложнялось состоявшимся профузным кровотечением из вен пищевода.
Данное осложнение у пациентов с циррозом печени возникает вследствие резкого увеличения давления в портальной системе и в системе вен пищевода портальная гипертензия. Из -за чего они расширяются и разрываются.
Кровотечение из вен пищевода ассоциируется с высокой летальностью. Пациенке предложено и выполнено трансъюгулярное внутрипеченочное портосистемное шунтирование (TIPS), одномоментно выполнена эмболизация варикозных вен пищевода с хорошим клиническим результатом.
Операция проводится с целью снижения давления в портальной венозной системе. Затруднение оттока крови от органов брюшной полости через печень приводит к развитию варикозного расширения вен пищевода.
Кровотечения из таких вен приводят к гибели половины пациентов, независимо от методов их лечения. Создание дополнительного пути оттока при ТИПС устраняет венозную гипертензию и риск опасных для жизни кровотечений.
В нашей клинике такие операции проводятся с использованием безопасного контрастирования с помощью углекислого газа.
После пункции правой яремной вены под рентгенконтролем катетер проведен в правую печеночную вену
Выполнена селективная катетеризация и контрастирование печеночных вен углекислым газом. Углекислый газ очень хорошо проникает через паренхиму печени и позволяет обнаружить систему воротной вены, выполняя контрастирование через печеночную вену. после детального определения всех ориентиров, специальной металлической иглой выполнена чреспеченочная пункция воротной вены. Игла проходит из печеночной вены через печень в воротную вену - это самый сложный и опасный этап операции.
Прямая портография
По игле внутрь ветви воротной вены проведен проводник и катер. После чего выполнена прямая портография . Отмечается сеть расширенных коллатеральных сосудов в области желудка, что чревато профузным и неуправляемым кровотечением.
Создание соустья между воротной и печеночной системой
После определения оптимальных точек имплантации между воротной и печеночными венами через слой паренхимы печени установлены 2 стента по технологии сэндвич. Данная технология является уникальной и предложена проф. Шиповским В.Н. Суть методики состоит в том , что нитиноловый стент создает тракт в печени, а специальный покрытый стент устанавливается внутрь нитинолового и защищает тракт от прорастания паренхимы и зарастания шунта. Данная методика позволила увеличить эффективность процедуры до 86%, и многим пациентам удалось отложить трансплантацию печени на 10-15 лет. После завершения основного этапа выполнен суперселективный поиск источников кровоснабжения варикозно расширенных вен пищевода, которые были эмболизированы плотной пеной этоксисклерола.
Контрольное УЗИ печени через неделю после операции
Операция выполнялась под местной анестезией, и во время всех процедур сохранялся полный контакт с больной. Уже через несколько часов после операции она смогла беспрепятственно передвигаться по палате. На вторые сутки выполнено контрольное УЗИ брюшной полости. В печени хорошо виден стент, скорость кровотока по которому достигает 40 см в секунду. Достигнут хороший клинический эффект. На УЗИ хорошо видно функционирующий портокавальный шунт в паренхиме печени. Клинически отмечается значительное улучшение. Исчезновение асцита. Наблюдение за оперированным пациентом проводится каждые 3 месяца с обязательным выполнением УЗИ исследования для оценки функции портокавального анастомоза.
Операции при портальной гипертензии
Исследование типичных клинических синдромов нарушенного портального кровотока. Изучение основных причин портальной гипертензии. Обзор классификации операций при данном заболевании. Характеристика сущности операций, проводимых при портальной гипертензии.
| Рубрика | Медицина |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 13.05.2016 |
| Размер файла | 20,9 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
ГБОУ ВПО ОрГМУ МИНЗДРАВА РОССИИ
КАФЕДРА ОПЕРАТИВНОЙ ХИРУРГИИ И КЛИНИЧЕСКОЙ АНАТОМИИ ИМЕНИИ С.С. МИХАЙЛОВА
На тему: «Операции при портальной гипертензии»
Выполнила: Заморева А.С.
Проверил: Фатеев И.Н.
Оренбург, 2016 г.
Причины портальной гипертензии
Классификация операций при портальной гипертензии
Сущность операций, проводимых при портальной гипертензии
Список используемой литературы
Портальная гипертензия - это патологическое состояние, обусловленное повышением давления в системе воротной вены свыше 200 мм вод. ст., что связано с наличием препятствия кровотоку на разных уровнях абдоминальной венозной системы. Типичными клиническими синдромами нарушенного портального кровотока являются увеличение селезёнки, варикозное расширение вен пищевода и желудка с кровотечением из них, асцит, геморрой. У некоторых больных также выявляют гепатомегалию и расширение подкожных вен живота или всего туловища.
Портальная гипертензия наиболее часто наблюдается при циррозе печени. Изменение объемной скорости портального кровотока вызывает значительное повышение портального давления, что способствует интенсивному развитию коллатерального кровообращения. По мере формирования новых анастомозов и открытия существующих соустий дальнейшее нарастание портальной гипертензии замедляется. Развитие коллатералей в большинстве случаев недостаточное, часто приводит к выраженным дистрофическим изменениям внутренних органов.
Этиологические факторы, приводящие к развитию портальной гипертензии, многообразны. Ведущей причиной выступает массивное повреждение печеночной паренхимы вследствие заболеваний печени: острых и хронических гепатитов, цирроза, опухолей печени, паразитарных инфекций. Портальная гипертензия может развиваться при патологии, обусловленной внепеченочным или внутрипеченочным холестазом, вторичном билиарном циррозе печени, первичном билиарном циррозе печени, опухолях холедоха и печеночного желчного протока, желчнокаменной болезни, раке головки поджелудочной железы, интраоперационном повреждении или перевязке желчных протоков. Определенную роль играет токсическое поражение печени при отравлениях гепатотропными ядами.
К развитию портальной гипертензии может приводить тромбоз, врожденная атрезия, опухолевое сдавление или стеноз портальной вены; тромбоз печеночных вен при синдроме Бадда-Киари; повышение давления в правых отделах сердца при рестриктивной кардиомиопатии, констриктивном перикардите. В некоторых случаях развитие портальной гипертензии может быть связано с критическими состояниями при операциях, травмах, обширных ожогах, ДВС-синдроме, сепсисе.
Непосредственными разрешающими факторами, дающими толчок к развитию клинической картины портальной гипертензии, нередко выступают инфекции, желудочно-кишечные кровотечения, массивная терапия транквилизаторами, диуретиками, злоупотребление алкоголем, избыток животных белков в пище.
портальная гипертензия операция кровоток
Показаниями к оперативному вмешательству при портальной гипертензии являются: кровотечение из варикозно расширенных вен пищевода и желудка, спленомегалия, гиперспленизм и асцит.
Существует классификация операций, выполняемых при портальной гипертензии.
I. По виду выполняемой операции выделяют следующие типы:
1. Межсосудистые анастомозы: Спленоренальный анастомоз; Мезентерикокавальный анастомоз; Прямой портокавальный анастомоз; Перитонеовенозное шунтирование;
2. Паллиативные операции: Перевязка ветвей чревного ствола; Спленэктомия: Органоанастомозы: Пишеводно-кардиальная резекция и гастрэктомия; Операции, дренирующие брюшную полость; Операции при продолжающемся кровотечении из вен пищевода.
II. По времени выполнения выделяют следующие типы операций:
2. Операции первичной профилактики - проводятся при наличии варикозных вен и отсутствии в анамнезе кровотечения, однако статистически значимого улучшения выживаемости по сравнению с группами пациентов, получивших медикаментозную терапию и эндоскопическое лечение, при этом не отмечено. 3. Операции вторичной профилактики (элективные) - выполняются в ранние сроки после кровотечения и являются наиболее перспективным методом оперативного лечения кровотечений из ВРВ пищевода и желудка при ПГ.
III. В зависимости от механизма действия выделяют две основные группы операций:
1.Направленные на декомпрессию портальной системы - шунтирующие операции.
2. Прекращающие приток крови в ВРВ пищевода и желудка путем разобщения венозных систем воротной и верхней полой вен - разобщающие операции.
Противопоказаниями для оперативного вмешательства при ПГ являются: декомпенсированная портальная гипертензия, наличие активного воспалительного процесса в печени, выраженные проявления печеночно-клеточной недостаточности.
Спленоренальный анастомоз - это вид соустья между системой воротной и нижней полой вены наиболее распространен среди других портакавальных ангиоанастомозов.
Спленоренальный анастомоз впервые был выполнен в 1967 г. Д. Вареном. Метод базируется на создании двух изолированных зон давления в брюшной полости: низкого давления в левой половине брюшной полости (за счет оттока крови из гастроэзофагеальной области через короткие вены желудка и левую желудочно-сальниковую вену в селезенку, а оттуда через анастомоз «конец в бок» с левой печеночной веной в систему нижней полой вены) и высокого давления в правой половине (за счет сохраненного мезентериального венозного притока в воротную вену), что препятствует дальнейшему снижению портальной перфузии и значительно уменьшает вероятность развития послеоперационной энцефалопатии. В дальнейшем были предложены анастомозы между левой желудочной и левой почечными венами, анастомоз «бок в бок» между нижней брыжеечной и нижней полой венами, анастомозы с использованием аутовенозной и синтетических вставок. Расширенная селезеночная вена и лигирование селезеночной артерии.
Абдоминальный парацентез - при данной операции механически механически асцитическая жидкость из брюшной полости через прокол кожи в области пупка. Специальный клапан позволяет осуществлять процедуру многократно.
Трансъюгулярное внутрипеченочное портосистемное шунтирование заключается в создании искусственного внутрипеченочного канала между печеночной веной и крупным стволом воротной вены и установке в него металлического саморасправляющегося стента. Эта методика позволяет практически всегда остановить кровотечение, в том числе и рефракторное к другим видам терапии. Процедуру выполняют под местной анестезией, ее этапы включают: пункцию яремной вены, проведение катетера в среднюю печеночную вену, пункцию воротной вены (иглой, проведенной по катетеру), расширение пункционного канала баллоном (по установленному через иглу проводнику), постановку стента. Основным недостатком методики является практически неизбежное развитие печеночной энцефалопатии, высокая ее сложность и малая доступность в условиях нашей страны.
Операция М. Д. Пациоры - представляет собой прошивание кровоточащих вен пищевода и кардиального отдела желудка. Из абдоминального доступа выполняется гастротомия, прошивание и перевязка вен дистального отдела пищевода и проксимального отдела желудка. При проведении этого вмешательства ранняя послеоперационная летальность довольно низкая - до 15%. В тоже время отмечается высокая частота рецидивов кровотечения в раннем послеоперационном периоде (10-20%) и в течение последующих 5 лет (45-60%).
Перитонеовенозное шунтирование. На брюшину накладывают кисетный шов, в центре которого делают отверстие и через него вводят заборную трубку в брюшную полость. Под кожей живота и грудной клетки делают туннель до правой ключицы. В туннеле проводят шунт, выполняя дополнительный разрез кожи над ключицей. Выделяют внутреннюю или наружную яремную вену и в нее вводят отводящий катетер.
Оменопариетопексия - создание обходных сосудистых коллатералей путем подшивания большого сальника к передней брюшной стенке.
Операции, способствующие отведению асцитической жидкости - перитонеально-венозное шунтирование (клапаны Левина, Денвера), лимфовенозный анастомоз.
Радикальные операции (удаление опухолей, кист, тромбов, вскрытие абсцессов, обширные резекции печени вместе с опухолью, экстирпация пораженной печени с пересадкой здоровой.
Дренирование брюшной полости. Операция Кальба (1916). В области бедренных треугольников иссекают участки париетальной брюшины и мышц диаметром до 3--4 см. Лапаротомный разрез ушивают наглухо, в результате, асцитическая жидкость всасывается подкожной клетчаткой.
Дренирование брюшной полости. Ронте (отведение жидкости в сосудистое русло). Большую подкожную вену выделяют на протяжении 10--15 см и пересекают, периферический конец ее перевязывают, а центральный заворачивают кверху и вшивают в отверстие брюшины над паховой связкой.
В 1964 г. Уалкер предложил операцию, идея которой состоит в разобщении систем воротной и верхней полой вен путем полного пересечения пищевода или желудка с последующим восстановлением их целостности - трансторакальную пищеводную транссекцию с ручным эзофагоэзофагоанастомозом. При торакотомии достигается хороший доступ к источнику кровотечения и быстрая его остановка, однако из-за травматичности выполнения при этой операции отмечается высокая летальность (30-70%).
Спленэктомия. Хотя спленэктомия как самостоятельная операция ведет к снижению портального давления, однако это практически не влияет на размер варикозных вен и частоту рецидива кровотечений из них и поэтому не оказывает значимого клинического эффекта. В тоже время, удаление селезенки сопровождается ростом летальности, связанной с частым развитием таких послеоперационных осложнений, как внутрибрюшное кровотечение, абсцессы, тромбоз воротной вены, развитие аспленической геморрагической тромбоцитопении. В связи с этим показания к спленэктомии как к самостоятельной операции при ПГ в настоящее время резко сужены. Они ограничиваются тремя ситуациями: 1) сегментарной внепеченочной ПГ, когда болезнь проявляется в основном профузными кровотечениями из варикозных вен желудка вследствие непроходимости селезеночной вены; 2) сосудистой фистулой между селезеночной артерией и селезеночной веной, приводящей к ПГ вследствие перегрузки объемом крови; 3) при инфантилизме у подростков, когда удаление селезенки больших размеров ведет к быстрой нормализации физических параметров организма.
На сегодняшний день проблема портальной гипертензии и ее основных осложнений - кровотечения из варикозно расширенных вен пищевода и желудка, а также риск возникновения летального исхода, являются насущной проблемой современной хирургии.
Для решения этого вопроса оперативная хирургия продолжает разрабатывать новые способы устранения портальной гипертензии с как можно меньшим развитием осложнений и успешно применять современные методы лечения портальной гипертензии.
1. Ерамишанцев А. К. Эволюция хирургического лечения кровотечений из варикозно расширенных вен пищевода и желудка / Ерамишанцев А. К. под ред. В. С. Савельева. - М.: Медиа Медика, 2003. - С. 261-267.
2. Подымова С.Д. Болезни печени / Подымова С.Д. - М.: ОАО «Изд-во «Медицина», 2005. - 768 с.
3. Борисов А. Е., Андреев Г. Н., Земляной В. П. и др. Современные методы хирургической коррекции асцитического синдрома при циррозе печени/ Борисов А. Е., Андреев Г. Н., Земляной В. П. // журн. Политехника, 2000. - 222 с.
4. Любивый Е. Д., Киценко Е. А. Сравнительная оценка результатов портокавальных анастомозов и прошивания варикозно расширенных вен пищевода и желудка у больных циррозом печени и портальной гипертензией/ Любивый Е. Д., Киценко Е. А. // Актуальные проблемы соврем. хирургии: Тез. межд. хирург. конгресса. - М.:2003. - 21 с.
5. Назыров Ф. Г., Акилов Х. А., Мансуров А. А. и др. Опыт лечения кровотечений из варикозного расширения вен пищевода и желудка при циррозе печени / Назыров Ф. Г., Акилов Х. А., Мансуров А. А. // Актуальные проблемы соврем. хирургии: Тез. межд. хирург. конгресса. - М., 2003. - 14 с
Подобные документы
Этиология портальной гипертензии. Коррекция водно-электролитных нарушений и поддержание сердечно-сосудистой деятельности. Лечение асцита. Степень компенсации активности процесса в печени по Чайлду-Пью. Операции гемодинамической коррекции болезни.
реферат [38,9 K], добавлен 02.05.2015
Классификация портальной гипертензии. Основные причины развития предпеченочной, внутрипеченочной и постпеченочной портальной гипертензии. Повышение сопротивления соответствующего участка сосудистого русла. Нарушение оттока в системе воротной вены.
реферат [29,9 K], добавлен 25.06.2015
Понятие портальной гипертензии как синдрома повышенного давления в системе воротной вены. Симптомы портальной гипертензии, сопутствующие заболевания. Цирроз печени как одна из причин возникновения заболевания, его эпидемиология, классификация и патогенез.
презентация [2,1 M], добавлен 29.03.2015
Формирование коллатерального кровообращения через портокавальные анастамозы при портальной гипертензии. Варикозное расширение вен пищевода (ВРВП) вследствие портальной гипертензии. Эндоскопические и эндоваскулярные методы остановки кровотечения из ВРВП.
реферат [1,1 M], добавлен 06.04.2015
Предпеченочный блок: цирроз печени, кисты и опухоли печени, эхинококкоз, фрожденный фиброз. Осложнение портальной гипертензии: печеночная энцефалопатия, асцит, варикозное расширение вен пищевода, брюшной стенки, прямой кишки. Лечение данного заболевания.
Предоперационная подготовка при портальной гипертензии. Виды операций при портальной гипертензии
Российский научный центр хирургии им. Б.В. Петровского, РАМН
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Современное состояние проблемы хирургического лечения больных портальной гипертензией
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2013;(2): 30‑34
Шерцингер А.Г., Жигалова С.Б., Лебезев В.М., Манукьян Г.В., Киценко Е.А. Современное состояние проблемы хирургического лечения больных портальной гипертензией. Хирургия. Журнал им. Н.И. Пирогова. 2013;(2):30‑34.
Shertsinger AG, Zhigalova SB, Lebezev VM, Manuk'ian GV, Kitsenko EA. Surgical treatment of portal hypertension: the state of art. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2013;(2):30‑34. (In Russ.).
Статья посвящена одной из актуальных тем хирургии - лечению и профилактике кровотечений портального генеза. В последние годы отмечается рост числа диффузных заболеваний печени и хронических миелопролиферативных заболеваний крови, которые лежат в основе формирования синдрома портальной гипертензии и развития его осложнений. Авторы подробно описали современные подходы к лечению больных с этим тяжелым заболеванием. Предложенная тактика является дифференцированной. Способ лечения выбирается с учетом формы портальной гипертензии, функционального состояния печени, неотложности ситуации и тяжести кровопотери, локализации и степени варикозного расширения вен, состояния центральной гемодинамики, наличия сопутствующих заболеваний. Показано место малоинвазивных методов в алгоритме лечения. Доказана целесообразность разработки единой программы лечения больных портальной гипертензией в условиях специализированных клиник.
В последние годы стал очевидным факт увеличения количества больных портальной гипертензией. Если в 2006 г. в клинике находились на лечении
294 больных, то в 2011 г. - уже 365 больных.
Наблюдается рост количества больных внепеченочной портальной гипертензией за счет увеличения хронических миелопролиферативных заболеваний крови и тромбофилий [4]. Увеличивается число больных вирусным и алкогольным циррозом печени [7, 11, 18, 27, 29].
Основной причиной смерти больных портальной гипертензией являются кровотечения из варикозно-расширенных вен (ВРВ) пищевода и желудка. Известно, что летальность вследствие первого кровотечения составляет от 40 до 70% [1, 15, 20, 22, 25, 28, 32, 34, 35].
За многолетний период работы отделения экстренной хирургии и портальной гипертензии тактика лечения больных портальной гипертензией неоднократно пересматривалась. В первый период работы основным хирургическим пособием было прямое портокавальное шунтирование. Значительное количество послеоперационных осложнений в виде шунтовой энцефалопатии и высокая летальность заставили пересмотреть хирургическую тактику. Внедрение самых разнообразных операций азигопортального разобщения, таких как операции
М.Д. Пациоры, Берема-Крайля, Таннера, Сигиура, резекция пищевода и кардиального отдела желудка, позволило снизить процент гепатогенной энцефалопатии. Наряду с этим отмечено увеличение рецидивов пищеводно-желудочных кровотечений в отдаленном периоде наблюдения и летальности в ближайшем послеоперационном периоде вследствие увеличения количества гнойно-септических осложнений из-за большого и травматичного объема оперативных вмешательств [1, 8, 11] .
За последние годы, несмотря на увеличение количества тяжелобольных, прослеживается тенденция снижения летальности. Рациональный выбор вмешательства в зависимости от функционального состояния печени и локализации ВРВ, по отчетам работы отделения экстренной хирургии и портальной гипертензии, позволил снизить летальность за последние 5 лет при циррозе печени с 18,0 до 9,7% в группе больных с внепеченочной портальной гипертензией - с 4,8 до 1,1%.
На наш взгляд, снижение летальности связано с внедрением в клиническую практику новых малоинвазивных эндоскопических технологий. Доля эндоскопических вмешательств (лигирования и склерозирования) среди всех методов лечения за последние годы возросла с 52 до 63%. Внедрение методик эндоскопического лигирования и склерозирования послужило основанием для отказа от тяжелых травматичных операций, что положительно сказалось на результатах лечения.
Снижение летальности на фоне увеличения доли эндоскопических вмешательств наглядно демонстрирует приоритет эндоскопических методик в лечении ВРВ пищевода и желудка. Эндосклеротерапия и эндоскопическое лигирование стали широко применяться для остановки и профилактики кровотечений из ВРВ пищевода и желудка [2, 7, 12, 21, 23, 24, 26].
Анализ опыта работы предыдущих лет позволил сформулировать оптимальную, на наш взгляд, тактику, в которой четко разработаны показания к выбору того или иного способа хирургического или эндоскопического вмешательства. При этом в обязательном порядке учитываются форма портальной гипертензии, функциональное состояние печени у больных циррозом, неотложность ситуации и тяжесть кровопотери, локализация и степень ВРВ по данным эндоскопического обследования, состояние центральной и портальной гемодинамики; наличие сопутствующих заболеваний.
Выбор метода лечения больных внепеченочной портальной гипертензией
Первичная внепеченочная портальная гипертензия
У больных с врожденной аномалией развития воротной вены приоритетным является наложение любого вида сосудистого анастомоза (спленоренального или мезентерико-кавального; рис. 1, 2 и далее на цв. вклейке). Рисунок 1. Дистальный спленоренальный анастомоз W. Warren. Рисунок 2. Парциальный мезентерико-кавальный анастомоз с синтетической вставкой из политетрафторэтилена. Выполнение этой операции решает все проблемы с кровотечениями из ВРВ пищевода и желудка. Особенно хорошие результаты отмечены при портокавальном шунтировании в детском возрасте. После операции больные подлежат контрольному эндоскопическому обследованию с периодичностью 1 раз в 2 года, при котором хорошая функция анастомоза констатируется в случае исчезновения ВРВ. Эти пациенты практически здоровы и трудоспособны [5, 10].
Вторичная (приобретенная) внепеченочная портальная гипертензия
Данный контингент на 30% состоит из больных хроническими миелопролиферативными заболеваниями крови, на 60% - из больных наследственной (мутации генов свертывающей и противосвертывающей системы крови) или приобретенной (активация системы гемостаза при наличии провоцирующих факторов) тромбофилией. Остальные 10% приходятся на больных сегментарной внепеченочной портальной гипертензией на фоне изолированной окклюзии селезеночной вены.
Для больных вторичной внепеченочной портальной гипертензией характерен тотальный или сегментарный тромбоз сосудов портальной системы, что, как правило, не дает возможности выполнить шунтирующую операцию вследствие поражения магистральных сосудов и истончения венозной стенки крупных коллатералей. По данным разных авторов, среди взрослых больных внепеченочной портальной гипертензией «нешунтабельная» портальная гипертензия встречается в 30-50% наблюдений. У больных внепеченочной портальной гипертензией на фоне системного заболевания крови этот показатель достигает 80% и более [4].
Операцией выбора при тотальном тромбозе портальной системы является азигопортальное разобщение: операция М.Д. Пациоры с обязательной перевязкой всех коммуникантных вен желудка по большой и малой кривизне (рис. 3). Рисунок 3. Операция М.Д. Пациоры в сочетании с деваскуляризацией желудка.
Через 3-6 мес после операции при эндоскопическом контроле решается вопрос о необходимости выполнения эндоскопического лигирования ВРВ пищевода, оставшихся вне зоны открытой операции [8].
Все изложенное относится только к плановой ситуации. При развитии профузного кровотечения после верификации источника кровотечения первичный гемостаз достигается зондом-обтуратором, проводится трансфузионная терапия, желудок отмывается от крови. После этого выбирается вариант окончательного гемостаза в зависимости от распространенности ВРВ и локализации источника кровотечения. При локализации источника геморрагии в пищеводе возможно эндоскопическое лигирование, при подтекании крови в субкардии после удаления зонда Блейкмора хорошо зарекомендовало себя эндоскопическое склерозирование. Наличие больших стволов ВРВ в желудке, а также рецидив кровотечения после эндоскопического гемостаза в течение 1 сут являются показаниями к срочному хирургическому вмешательству - гастротомии с прошиванием ВРВ желудка и нижней трети пищевода. Не рекомендуется расширять объем оперативного вмешательства в экстренной ситуации и выполнять деваскуляризацию желудка. Цель операции - только гемостаз [2].
Сегментарная портальная гипертензия
Выбор метода лечения больных с изолированной окклюзией селезеночной вены, развитием порто-портальных анастомозов через фундальный отдел желудка и в экстренной и плановой ситуации однозначен - это спленэктомия. Проведение консервативных мероприятий, таких как тампонада зондом-обтуратором в момент кровотечения, бывает неэффективным. Риск развития кровотечения у больных изолированным ВРВ желудка очень высок. По данным S. Sarin и соавт. (2010), представленным на Согласительной конференции по портальной гипертензии, он составляет 78%, по нашим данным - 56,5% [19].
Все попытки эндоскопического гемостаза у больных изолированным ВРВ дна желудка в нашем исследовании потерпели неудачу. Склеротерапия варикозных узлов диаметром 12-15 мм окончилась рецидивом кровотечения. Введение 30-40 мл склерозанта паравазально не прерывает кровотока по варикозно-измененным венам. Во время гастротомии у больного после случайного прокалывания иглой блокированного сосуда произошло струйное кровотечение.
Эндоскопическое лигирование также оказалось малоэффективным. Так как диаметр латексных колец и нейлоновых петель не превышает 13 мм, основной проблемой при выполнении эндоскопического лигирования ВРВ дна желудка является неполный захват вены, кроме того, желудочный сок действует на латекс, что в конечном итоге приводит к раннему отторжению лигатур. Известны рекомендации японских авторов применять при лигированиии большую нейлоновую петлю с внутренним диаметром 4 см при захвате периферической части узла щипцами через второй канал эндоскопа [31, 35]. Однако они не нашли практического применения, так как стандартный лигатор не приспособлен для работы с таким диаметром петли.
Самым надежным методом профилактики кровотечения, позволяющим окончательно решить проблему сегментарной портальной гипертензии, является спленэктомия. Мы провели анализ лечения 23 больных сегментарной внепеченочной портальной гипертензией и варикозным расширением вен свода желудка, которым была выполнена спленэктомия. В 3 наблюдениях операцию дополнили дистальной резекцией поджелудочной железы при верификации опухоли дистального отдела поджелудочной железы. У 2 больных спленэктомия сочеталась с гастротомией, так как большой дефект на вене в своде желудка являлся источником продолжающегося кровотечения.
Выполнение операции М.Д. Пациоры без сплен- эктомии больным сегментарной портальной гипертензией дает кратковременный гемостатический эффект. Как показал наш опыт, после прошивания ВРВ свода желудка рядом с лигированными венами возникают новые узлы, что не позволяет решить проблему окончательного гемостаза. Данное явление легко объяснить. Прошивание ВРВ свода желудка перекрывает кровоток от селезенки, что ведет к образованию новых варикозных узлов в подслизистом слое.
Из 23 больных 22 были выписаны из клиники в удовлетворительном состоянии. Умер один больной, страдающий наследственной тромбофилией, от тромбоза легочных сосудов на 9-й день после спленэктомии. Это обстоятельство делает необходимым контроль коагулограммы и количества тромбоцитов после спленэктомии в ближайшем и отдаленном периодах, особенно у больных хроническими миелопролиферативными заболеваниями крови и тромбофилией. Летальность в этой группе больных составила 4,3%. Трехлетний период наблюдения за этими больными демонстрирует 100% гемостатический эффект и выживаемость.
Тактика лечения больных циррозом печени

Выбор метода лечения таких больных базируется на функциональном состоянии печени и наличии или отсутствии кровотечения. Всех больных мы разделили на 5 групп согласно критериям Г.В. Манукьяна [11] (см. таблицу).
Больные циррозом печени в компенсированной стадии подлежат профилактическому шунтированию, а именно выполнению дистального спленоренального или дозированного мезентерико-кавального анастомоза с диаметром синтетической вставки 9 мм. При невозможности выполнения декомпрессивного шунтирования следует производить операцию азигопортального разобщения с максимально возможной деваскуляризацией желудка [13, 17].
Основная масса больных группы В не переносит наложения портокавального анастомоза. Выбор метода лечения зависит от локализации и размера ВРВ. При локализации таких вен изолированно в пищеводе преимущества имеют эндоскопические методики, а именно эндоскопическое лигирование вен пищевода. При выявлении гастроэзофагеальных вен I типа альтернативой операции азигопортального разобщения является комбинированное эндоскопические лигирование ВРВ пищевода и желудка. В выборе преимущественного метода лечения определяющим является размер ВРВ [33].
При наличии гастроэзофагеальных вен II типа с формированием венозных конгломератов больших размеров выполнение эндоскопического лигирования чревато развитием большого количества осложнений. Приоритет в данном случае принадлежит операции азигопортального разобщения - гастротомии с прошиванием ВРВ желудка и дистального отдела пищевода в сочетании с полной деваскуляризацией желудка по большой и малой кривизне.
Выявление эктопических ВРВ желудка IV типа предусматривает выжидательную тактику - динамическое эндоскопическое наблюдение вследствие того, что вены этой локализации крайне редко осложняются кровотечением [6].
У больных группы В, которые по функциональному состоянию печени приближаются к группе С, операция сопровождается большим количеством послеоперационных осложнений, среди которых превалируют асцит-перитонит и рецидивы пищеводно-желудочных кровотечений. Г.В. Манукьян [11] выделил этих больных в отдельную группу «В-С». Основным способом профилактики геморрагии у этих больных является эндоскопическое лигирование ВРВ.
Ранее проведенные в клинике исследования еще раз подтвердили точку зрения, что при декомпенсированном циррозе печени в плановом порядке следует применять профилактические малоинвазивные методы лечения. Оперативное лечение для них непереносимо [3].
Развитие пищеводно-желудочного кровотечения делает условным распределение на группы по классификации Чайлда-Пью. Многие больные на фоне кровопотери переходят в низший класс, при этом выполнение оптимального лечения становится невозможным [11, 14].
Применение зонда-обтуратора и эндоскопических вмешательств с целью достижения первичного гемостаза позволяет отсрочить рецидив кровотечения и подготовить больного к более радикальному вмешательству. Отсутствие результатов от проводимого лечения диктует необходимость экстренного хирургического вмешательства - операции М.Д. Пациоры [2, 14].
Наиболее проблематичной при кровотечении, по нашему мнению, является группа больных субкомпенсированным циррозом печени.
При планировании профилактической операции больным этой группы большое значение имеет функциональный резерв организма. Нередко адекватно проведенное предоперационное лечение нормализует показатели функции печени, что позволяет отнести больных к группе А и соответственно выполнить шунтирующую операцию [11, 14].
Судьбу больного субкомпенсированным циррозом печени определяют сроки проведения гемостаза и лечение печеночной недостаточности. Алгоритм выбора метода лечения при пищеводно-желудочных кровотечениях остается таким же, как и в плановой группе В.
Тяжелая кровопотеря, промедление с проведением лечебных действий приводят больных в состояние печеночной недостаточности и комы. Эндоскопическое склерозирование источника кровотечения, выполненное своевременно, дает хороший результат, позволяет вывести больных из тяжелого состояния и подготовить их к более радикальному вмешательству, т.е. эндоскопические технологии в группе В-С являются основными мерами лечения и профилактики кровотечений из ВРВ пищевода и желудка [1, 6, 9, 30, 31].
В случае развития кровотечения у больных с декомпенсированным течением цирроза печени методом выбора должна быть только консервативная тактика, основу которой составляют тампонада ВРВ зондом-обтуратором, проведение грамотной инфузионно-трансфузионной терапии с учетом показателей центрального венозного давления, а также назначение гепатотропного и дезинтоксикационного лечения.
Выполнение эндоскопических вмешательств в этой группе больных приводит к развитию большого количества геморрагических осложнений на фоне исходной белково-энергетической недостаточности и кровопотери.
Дистрофические изменения миокарда, сердечная недостаточность и гипокинетический тип центральной гемодинамики у больных декомпенсированным циррозом печени приводят к застою в непарной и полунепарной венах, что усугубляет нарушение оттока крови из портальной системы. Выполнение любых вмешательств, в том числе малоинвазивных, в такой ситуации не имеет перспектив достижения стойкого гемостаза [2, 12, 16].
Таким образом, внедрение малоинвазивных эндоскопических вмешательств радикальным образом повлияло на результаты лечения больных с синдромом портальной гипертензии, но, несмотря на малоинвазивность, следует строго придерживаться наработанных установок при выполнении этих процедур. Разработка единой программы лечения больных портальной гипертензией возможна только в специализированных клиниках.
Модификация операции М.Д. Пациоры у больных портальной гипертензией
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2012;(10): 9‑13
Шерцингер А.Г., Манукьян Г.В., Жигалова С.Б., Манукьян В.Г., Черкасов В.А. Модификация операции М.Д. Пациоры у больных портальной гипертензией. Хирургия. Журнал им. Н.И. Пирогова. 2012;(10):9‑13.
Shertsinger AG, Manuk'ian GV, Zhigalova SB, Manuk'ian VG, Cherkasov* VA. The modification of the M.D. Patsiora's operation by portal hypertension. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2012;(10):9‑13. (In Russ.).
У 85 больных с гистологическим подтвержденным диагнозом цирроза печени, портальной гипертензии, варикозным расширением вен пищевода и желудка проведено исследование коллатерального венозного кровообращения желудка путем прямой чрескожной чреспеченочной портографии. Установлено, что в 100% наблюдений в формировании варикозной трансформации принимает участие левая желудочная вена, которая в изолированном варианте встречается в 27% наблюдений. В 68% наблюдений установлено значительное расширение задней желудочной ("полярной") вены, причем у 19 (22%) пациентов ее расширение отмечено в сочетании с расширением левой и короткими венами желудка. Полученные данные позволили модифицировать операцию М.Д. Пациоры, дополнив ее деваскуляризацией желудка в виде перевязки левой, задней и коротких вен желудка. Применение данной модификации позволило повысить двухлетнюю выживаемость с 77 до 97%, усилить гемостатический эффект с 51 до 89%, снизить частоту рецидивов венообразования с 25 до 5%, уменьшить проявления гастропатии в отдаленном послеоперационном периоде, обеспечивая таким образом повышение эффективности операции азигопортального разобщения.
Введение
Среди арсенала возможных хирургических вмешательств с целью лечения и профилактики гастроэзофагеальных кровотечений наибольшее распространение получили различные варианты портокавальных анастомозов (ПКА) и операции азиго-портального разобщения (АПР) [4, 8, 9, 12-14]. Ортотопическая трансплантация печени в России не может претендовать на роль основного метода хирургического лечения больных циррозом печени (ЦП) и портальной гипертензией (ПГ) [1, 2].
Доля малоинвазивных пособий в общей структуре хирургических вмешательств значительно возросла, но только в специализированных клиниках крупных городов России [10, 11].
Единственным вмешательством, выдержавшим испытание временем, вследствие простоты исполнения и доступности в любом хирургическом отделении остается операция, предложенная М.Д. Пациорой в 1965 г. Она заключается в проксимальной гастротомии и тщательном прошивании варикозно-расширенных вен (ВРВ) кардиального отдела желудка и кардиоэзофагеального перехода [3, 6].
Многолетний опыт наблюдения за оперированными больными (более 2000) позволил выявить наряду с положительными результатами определенные негативные моменты: появление новых ВРВ эзофагеальной зоны с последующим кровотечением из них в ближайшие или отдаленные сроки после операции [5, 7].
В связи с этим возникла необходимость изучения роли коллатеральных вен желудка (КВЖ), участвующих в формировании варикозной трансформации. Эти знания послужили основой для комбинированного хирургического вмешательства, при котором наряду с выполнением операции М.Д. Пациоры обязательным компонентом является перевязка или пересечение всех коллатералей, идущих из забрюшинного пространства к кардиальному отделу желудка [1, 13].
Материал и методы
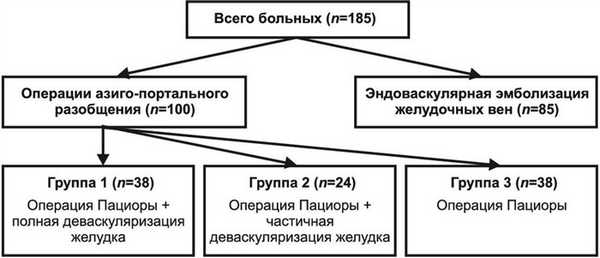
Всего в исследование включены 185 пациентов с клинически и гистологически подтвержденным диагнозом ЦП. 100 больным была выполнена операция АПР из абдоминального доступа, 85 - чрескожная чреспеченочная эмболизация вен желудка. Из 100 больных, которым произведена операция АПР, 62 в дополнение к операции М.Д. Пациоры была выполнена деваскуляризация желудка, остальным 38, составившим контрольную группу, - только операция М.Д. Пациоры. Не всем пациентам удалось произвести предполагаемый объем деваскуляризации, поэтому в свою очередь 62 пациента были разделены на 2 группы: 1-я - полная деваскуляризация (n=38), 2-я - частичная деваскуляризация (n=24). Таким образом, 100 больных разделены на 3 группы (рис. 1). Рисунок 1. Распределение пациентов по характеру хирургических вмешательств.
Критериями включения больных в исследуемые группы были:
1) наличие ВРВ пищевода и желудка II-III степени с угрозой пищеводно-желудочного кровотечения;
2) тяжесть течения ЦП, соответствующая группам А, АВ, В и ВС согласно классификации РНЦХ;
3) отсутствие в анамнезе каких-либо хирургических вмешательств, направленных на коррекцию ПГ и лечение ВРВ пищевода и желудка.
Главным критерием исключения больных из проводимого исследования являлось наличие признаков декомпенсации заболевания.
Исследуемые группы были репрезентативны по полу и возрасту.
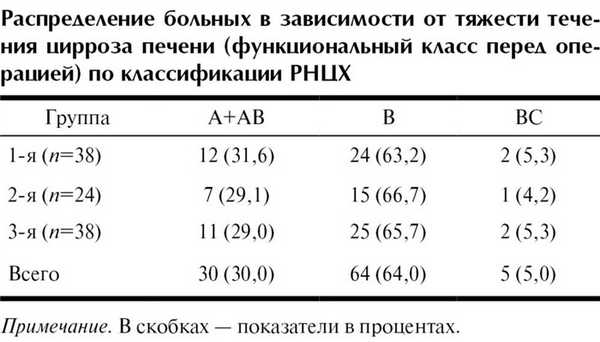
Распределение больных в зависимости от функционального состояния печени представлено в таблице.
Анализ результатов операций АПР проводился по следующим направлениям:
1) характер операции;
2) особенности течения ближайшего послеоперационного периода;
3) оценка результатов в отдаленный послеоперационный период.
В ближайшем послеоперационном периоде учитывали наличие различных осложнений и уровень летальности.
Результаты хирургического лечения в отдаленном послеоперационном периоде оценивали с учетом частоты и причин развития кровотечений на протяжении года после операции, выживаемости пациентов, рецидивов венообразования в желудке, а также состояния слизистой и ВРВ желудка. С этой целью проводили эндоскопический мониторинг в сроки 3, 6 и 12 мес после операции.
При выполнении эндоскопического исследования при поступлении больного, а также в отдаленном послеоперационном периоде оценивали состояние ВРВ, слизистой пищевода и желудка, а также определяли наличие признаков угрозы кровотечения.
В нашей работе у всех больных до операции диагностировали наличие ВРВ пищевода и желудка III степени (по классификации А.Г. Шерцингера, 1986 г.).
У 85 больных (54 мужчины и 31 женщина) с диагнозом ЦП проводили анализ результатов чрескожной чреспеченочной портографии [1] .
По функциональному состоянию печени субкомпенсированное течение ЦП отмечено у 55, декомпенсированное - у 30 больных.
Основными критериями включения в группу исследования являлись:
1) наличие клинически установленного диагноза ЦП;
2) сохранная проходимость спленопортальной оси (по данным УЗДГ);
3) наличие ВРВ пищевода и желудка II-III степени с угрозой развития пищеводно-желудочного кровотечения;
4) отсутствие в анамнезе сосудистых шунтирующих операций.
Результаты и обсуждение
В результате анализа полученных спленопортограмм нами установлено, что внеорганные региональные венозные желудочные коллекторы играют значительную роль в формировании варикозной трансформации вен пищевода и желудка.
Главным венозным коллектором, по нашим данным, является левая желудочная вена (ЛВЖ), расширение которой отмечено в 100% наблюдений. У 23 (27%) больных ЛЖВ выступала в качестве единственно значимого коллектора, участвующего в формировании ВРВ желудка и пищевода.
Изолированного участия КВЖ в формировании ВРВ мы не выявили. Частота вовлечения КВЖ в формирование ВРВ желудка составила 51% (43 пациента), причем в 39 (46%) наблюдениях - в сочетании с ЛЖВ и задней желудочной веной (ЗЖВ), в 4 (5%) - в сочетании с расширением ЛЖВ.
Роль КВЖ, участвующих в формировании варикозной трансформации, обсуждается давно. Речь идет о том, на какие коллатерали стоит обращать внимание при обсуждении причин рецидива венообразования в отдаленном периоде после выполнения операции АПР.
Каково практическое значение полученных данных? Прежде всего следует остановиться на роли коллатерали, впадающей в среднюю треть селезеночной вены, которую на начальном этапе исследований мы трактовали как самую проксимальную по месту отхождения КВЖ. Нам импонирует название описанной венозной коллатерали - «задняя желудочная вена».
Роль этой коллатерали в развитии ВРВ желудка недооценена. По нашему мнению, недиагностированное наличие ЗЖВ может повысить вероятность развития рецидивных ВРВ и кровотечения в отдаленном периоде после операции.
Из 85 наблюдений в 58 (68%) было выявлено расширение «полярной», или так называемой задней, желудочной вены, причем у 19 (22%) больных оно сочеталось с расширением ЛЖВ, у 39 (46%) - с расширением ЛЖВ и КВЖ.
Эти обстоятельства диктуют необходимость внедрения в существующий диагностический алгоритм в период, предшествующий хирургическому вмешательству, исследования коллатерального кровотока желудка, которое возможно либо путем прямой портографии, либо с помощью компьютерной ангиотомографии с трехмерной реконструкцией коллатерального венозного кровообращения желудка.
Произведенные хирургические вмешательства имели определенные особенности. Так, хотя средняя продолжительность операций в 1-й (158±43 мин) и 2-й (174±37 мин) группах по сравнению с контрольной группой (145±33 мин) была больше, это различие оказалось недостоверным (р>0,05). Нами не получено также достоверных различий по объему интраоперационной кровопотери.
Таким образом, такие факторы, как технические сложности хирургического вмешательства, объем интраоперационной кровопотери и продолжительность операции в рассматриваемых группах больных, не могли значимо влиять на течение ближайшего послеоперационного периода.
Из общего количества оперированных больных осложнения развились в 11% наблюдений. У 11 больных мы констатировали развитие 21 осложнения. Из этих 11 больных умерли 4, в том числе 2 во 2-й группе и 2 в контрольной. Общая летальность в послеоперационном периоде по отношению ко всем оперированным больным составила 4%. Летальных исходов в 1-й группе не отмечено.
Ведущим осложнением, приведшим к летальному исходу, стал геморрагический синдром, который проявился эпизодами пищеводно-желудочных и внутрибрюшных кровотечений.
Главной причиной подавляющего большинства развившихся осложнений, по нашему мнению, является исходная тяжесть течения заболевания со снижением степени компенсации функционального состояния печени и резервного потенциала пациентов.
Отдаленные результаты хирургических вмешательств в исследуемых группах больных изучены в сроки до 2 лет после операции. К концу 1-го года наблюдения мы имели информацию о течении отдаленного послеоперационного периода у 36 пациентов 1-й группы, у 20 больных 2-й группы и у 33 больных 3-й группы. К концу 2-го года наблюдения отдаленные результаты были изучены у 31, 15 и 28 больных соответственно 1, 2 и 3-й группы.
Эти количественные взаимоотношения к окончанию срока наблюдения сформировались вследствие имевших место летальных исходов в определенной части наблюдений и невозможности проконтролировать судьбу некоторых больных из-за смены места жительства и потери контакта с ними. В течение первых 6 мес наблюдения ни в одной из групп не отмечено летальных исходов.
В течение второго полугодия умерли 2 больных 2-й группы и 2 больных 3-й группы. В течение 2-го года наблюдения умерли еще 5 больных: 1 в 1-й группе, 2 во 2-й и еще 2 в 3-й группе.
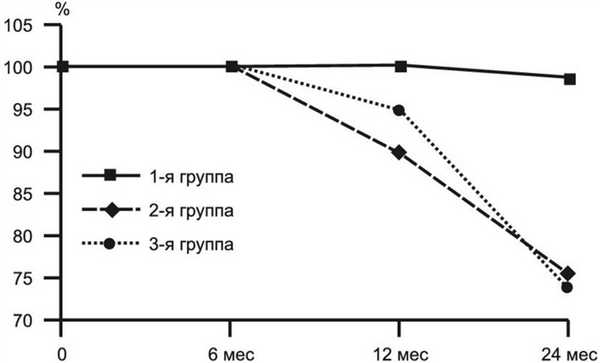
Полученные данные позволили рассчитать показатели выживаемости больных (рис. 2). Рисунок 2. Выживаемость больных в течение 2 лет наблюдения. К 6 мес наблюдения во всех группах отмечена 100% выживаемость. При дальнейшем наблюдении ситуация по данному показателю начинает меняться: к годичному периоду выживаемость в 1-й группе составляет 100%, во 2-й группе она снизилась до 94%, в 3-й - до 88%. К 2 годам наблюдения выживаемость в 1-й группе составила 96,7%; во 2-й - 78% и в 3-й группе - 77%.
Эндоскопический мониторинг осуществляли через 3, 6, 12 мес. С учетом полученных данных рецидивы венообразования в 1-й группе были достоверно ниже (p<0,05) по сравнению со 2-й и контрольной группами.
Также констатировали значительно худшую картину гастропатии (большая частота и тяжесть изменений в слизистой желудка) в контрольной и 2-й группах по сравнению с 1-й.
О роли деваскуляризации и методах ее проведения в общей композиции операции АПР можно судить на основании результатов проведенных исследований, посвященных проблеме формирования варикозной трансформации вен пищевода и желудка.
Применение многими авторами технологии деваскуляризации пищевода и желудка предусматривает пристеночное пересечение связочного аппарата вдоль малой и большой кривизны желудка, при этом стволовая часть регионарных коллекторов - ЛЖВ и ЗЖВ - остается интактной, что способствует более быстрой венозной реваскуляризации в местах пересечения и образованию вторичных ВРВ.
Кроме того, такая мобилизация представляет собой не что иное, как селективную или суперселективную ваготомию, целесообразность которой у этой категории больных сомнительна. К тому же подобный вариант деваскуляризации сопровождается пересечением не только множества мелких венозных, но и артериальных сосудов, что может негативно отразиться на трофике слизистой желудка и пищевода.
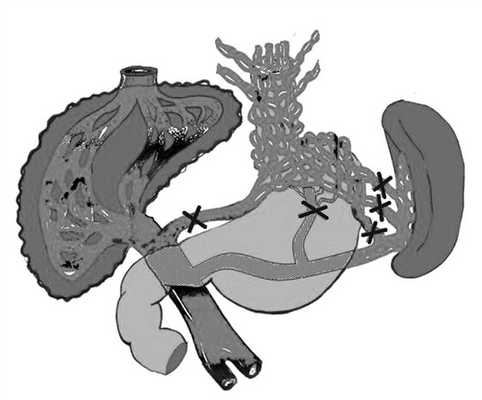
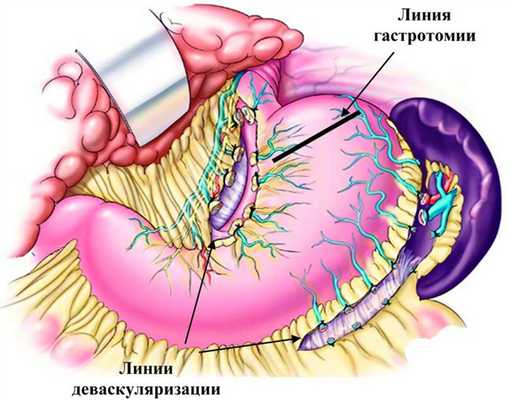
По нашему мнению, если в отношении КВЖ, проходящих в составе желудочно-селезеночной связки, особых разногласий в способе их блокирования нет - это достигается путем мобилизации верхней трети и кардиоэзофагеального отдела желудка, то в отношении ЛЖВ мы стоим на позиции необходимости ее пересечения или перевязки в составе желудочно-панкреатической связки, до момента ее разветвления в толще малого сальника (рис. 3). Рисунок 3. Схема деваскуляризации желудка.
Обязательным компонентом вмешательства является перевязка или пересечение всех коллатералей, идущих из забрюшинного пространства к кардиальному отделу желудка, особенно ЗЖВ.
Данный элемент АПР мы сочетаем с основным этапом операции - проксимальной гастротомией и тщательным прошиванием ВРВ эзофагокардиальной зоны, т.е. операцией по методу М.Д. Пациоры.
Оценка роли деваскуляризации при проведении операций АПР позволяет нам высказать ряд соображений.
1. Применение деваскуляризации в качестве самостоятельного метода лечения и профилактики кровотечений из ВРВ малоэффективно.
2. Выполнение деваскуляризации в качестве дополнительной меры АПР в ходе выполнения операции М.Д. Пациоры повышает эффективность вмешательства по отношению к профилактике кровотечений из ВРВ пищевода и желудка.
3. Осуществление деваскуляризации путем интраоперационной стволовой блокады основных венозных коллекторов желудка является менее травматичным, по сравнению с другими технологиями деваскуляризации.
5. Роль ЗЖВ в формировании варикозной трансформации вен желудка и необходимости ее перевязки при проведении этапа деваскуляризации недооценена.
6. При проведении операции М.Д. Пациоры в изолированном виде или в сочетании с неполной деваскуляризацией требуется более строгий послеоперационный мониторинг и при рецидиве венообразования следует, кроме эндоскопических методов их облитерации, использовать рентгено-эндоваскулярную эмболизацию сохранных венозных коллекторов желудка.
Таким образом, операция М.Д. Пациоры, дополненная деваскуляризацией желудка, не сопровождается достоверным увеличением интраоперационной кровопотери и продолжительности вмешательства. Применение деваскуляризации желудка в дополнение к прошиванию варикозно-расширенных вен пищевода и желудка позволило повысить двухлетнюю выживаемость с 77 до 97%, усилить гемостатический эффект с 51 до 89%, снизить частоту рецидивов венообразования с 25 до 5%, уменьшить проявление гастропатии в отдаленном послеоперационном периоде, обеспечивая таким образом повышение эффективности операции азигопортального разобщения.
С целью предоперационной верификации особенностей внеорганного коллатерального венозного кровотока желудка, планирования объема операции азиго-портального разобщения следует использовать компьютерную ангиотомографию или прямую портографию.
[1] Все исследования и вмешательства выполнял к.м.н. В.А. Черкасов - старший научный сотрудник отделения рентгенохирургических методов диагностики и лечения РОНЦ им. Н.Н. Блохина.
Читайте также:
