Предопухолевые изменения под действием стронция. Появление атипичных клеток под действием стронция
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
В представленной работе обобщен первый опыт применения бивалоса в терапии постменопаузального остеопороза (ПМОП) в России. Основная цель настоящего исследования заключалась в изучении влияния терапии бивалосом в течение 1 года на минеральную плотность костей (МПК) позвоночника пациенток с ПМОП. В качестве вторичных целей исследования изучали влияние бивалоса на МПК шейки бедра и бедренной кости в целом, на уровень маркеров костного метаболизма, на качество жизни пациенток с ОП, а также переносимость длительной терапии. В исследование включено 60 женщин в возрасте от 55 до 75 лет с ПМОП, проходивших лечение в 3 медицинских центрах Москвы (Эндокринологический научный центр, Институт ревматологии РАМН, Центральный институт травматологии и ортопедии им. Н.Н. Приорова) - по 20 пациенток в каждом. Через 1 год применения бивалоса отмечено достоверное увеличение МПК в поясничных позвонках на 4,68 ± 4,94%, в шейке бедра - на 2,0 ± 4,29% и по общему показателю МПК проксимального отдела бедренной кости - на 3,10 ± 3,34%. Оценка динамики маркеров костного метаболизма выявит статистически значимый прирост костной щелочной фосфатазы на 19,5 % и снижение уровня С-терминального телопептида коллагена I типа на 16,5%, что подтверждает разнонаправленный эффект бивалоса на костеобразование и резорбцию костной ткани. Терапия бивалосом повышает качество жизни пациентов: расширяет двигательную активность, снижает уровень депрессии, повышает самооценку. В результате уменьшается количество пациентов с болью в спине, снижается уровень боли и час- 31 ПРОБЛЕМЫ ЭНДОКРИНОЛОГИИ, 2008. Т. 54. гй 4. тота ее возникновения. Бивалос хорошо переносится пациентами, частота нежелательных явлений, связанных с его приемом, не превышает 15%, а отмена препарата из-за нежелательных явлений потребовалась в 5% случаев. Не наблюдалось серьезных побочных явлений. Несмотря на то что было проведено открытое несравнительное контролируемое клиническое исследование, наши результаты сходны с данными многоцентровых двойных слепых плацебо-контролируемых исследований с большой статистической мощностью.
Ключевые слова
Для цитирования:
Рожинская Л.Я., Арапова С.Д., Дзеранова Л.К., Молитвословова Н.Н., Марова Е.И., Шишкина А.А., Сазонова Н.И., Чернова Т.О., Ильин А.В., Беневоленская Л.И., Никитинская О.А., Короткова Т.А., Торопцова Н.В., Смирнов А.В., Демин Н.В., Родионова С.С., Буклемишев Ю.В., Шумский А.А. Влияние стронция ранелата (бивалоса) на минеральную плотность кости, костные маркеры и качество жизни при лечении постменопаузального остеопороза. Проблемы Эндокринологии. 2008;54(4):31-37.
For citation:
Rozhinskaya L.Y., Arapova S.D., Dzeranova L.K., Molitvoslovova N.N., Marova Y.I., Shishkina A.A., Sazonova N.I., Chernova T.O., Ilyin A.V., Benevolenskaya L.I., Nikitlnskaya O.A., Korolkova T.A., Toroplsova N.V., Smirnov A.V., Demin N.V., Rodionova S.S., Buklcmeshev Yu.V., Shumsky A.A. Effect of strontium ranelatc (bivalos) on bone mineral density, bone markers and quality of life in the treatment of postmenopausal osteoporosis. Problems of Endocrinology. 2008;54(4):31-37. (In Russ.)
Большинство средств для лечения остеопороза (ОП) с доказанной антипереломной активностью влияют в основном на процессы костной резорбции (бисфосфонаты, эстрогены, селективные модуляторы эстрогенных рецепторов, кальцитонины). Существующая антирезорбтивная терапия ОП реализуется через подавление активности остеокластов, что вызывает снижение костного метаболизма и уменьшает глубину резорбтивных полостей. Это способствует улучшению механической прочности и увеличивает минерализацию кости. Однако костное ремоделирование является двусторонним процессом, т. е. снижение активности остеокластов из-за антирезорбтивного лечения сочетается с уменьшением активности остеобластов [3, 7, 19]. Не вызывает сомнений, что антирезорбтивная терапия останавливает прогрессирование ОП. Это выражается в повышении минеральной плотности кости (МПК) путем заполнения ремоделирующих пространств и увеличения минерализации матрикса, однако антирезорбтивная терапия только консервирует, но не восстанавливает разрушенную микроархитектуру [19]. В тяжелых случаях ОП только прекращение потери костной ткани может быть недостаточным для предотвращения будущих переломов. В этих случаях лечение, стимулирующее костеобразование и восстанавливающее костные потери, способно предотвратить переломы [1, 14]. С этой точки зрения, большой интерес вызвали исследования, показавшие костестимулирующее и антирезорбтивное действие солей стронция на костную ткань. Для клинического применения была выбрана стронциевая соль ранеловой кислоты — стронция ранелат (СР). Международные многоцентровые плацебо-контролируемые исследования эффективности СР (бивалоса) при постменопаузальном ОП (ПМОП) доказали достоверное снижение риска как позвоночных, так и периферических переломов костей, существенное повышение МПК и уникальное, разнонаправленное действие препарата на костный метаболизм [12, 13, 15, 16, 18]. В представленной работе обобщен первый опыт применения бивалоса в терапии ПМОП в России.
Цель настоящего исследования — изучение влияния терапии бивалосом на МПК у пациенток с ПМОП, на уровень маркеров костного метаболизма, на качество жизни пациенток с ОП, а также переносимости длительной терапии.
Материалы и методы
Обследованы и пролечены в течение 12 мес 60 женщин в постменопаузе на базе 3 медицинских центров Москвы (по 20 в каждом центре): Эндокринологического научного центра (ЭНЦ) Росмедтехнологий, Института ревматологии (ИР) РАМН и Центрального института травматологии и ортопедии (ЦИТО) им. Н. Н. Приорова Росмедтехнологий. Проведено многоцентровое открытое несравнительное контролируемое клиническое исследование IV фазы в условиях, наиболее приближенных к реальной клинической практике.
Работа проведена в соответствии с правилами качественной клинической практики. У всех пациенток было получено письменное информированное согласие на участие в исследовании.
- амбулаторные пациентки в возрасте от 55 до 75 лет, находившиеся в состоянии постменопаузы в течение не менее 2 лет;
- письменное информированное согласие на участие в исследовании;
- снижение МПК в поясничном отделе позвоночника (Ц—LIV) более чем на 2,5 стандартного отклонения (СО) по сравнению со средними значениями этих показателей у здоровых женщин в период пременопаузы, но не более —4,5 СО.
- любая из причин вторичного ОП: гиперпаратиреоз, синдром мальабсорбции, болезнь Педжета, почечные остеодистрофии, остеомаляция;
- злокачественные новообразования в течение предшествующих 5 лет;
- некомпенсированные гипотиреоз и гипертиреоз;
- выраженные нарушения функции печени или почек;
- наличие более 3 переломов позвонков (или более 1 в поясничном отделе позвоночника);
- клинически значимые отклонения от нормы результатов клинического и биохимического анализов крови;
- снижение уровня 25 OHD ниже 15 нг/мл;
- сопутствующее лечение средствами, способными повлиять на метаболизм костной ткани или минеральный обмен (андрогены, анаболические стероиды, бисфосфонаты, кальцитонин, глюкокортикоиды, эстрогены, фториды, препараты паратиреоидного гормона, непрямые антикоагулянты, антиконвульсанты), в течение предшествующих 1—6 мес (в зависимости от препарата) перед включением в исследование.
Краткое описание исследования. После завершения процедур скрининга (1-й визит) пациенткам, соответствовавшим критериям включения и не имевшим критериев исключения из исследования, на исходном визите (2-й визит) назначали терапию бивалосом на 12 мес с визитами в клинику через 3 мес (3-й визит), 6 мес (4-й визит) и 12 мес (5-й визит, заключительный) лечения. Исследуемый препарат бивалос (СР) назначали в виде порошка по 2,0 г для ежедневного приема на ночь (через 2— 3 ч после последнего приема пищи). Пациентки растворяли порошок в 100 мл воды. Кроме того, на протяжении всего исследования они получали перорально терапевтические дозы кальция (минимум 500 мг элементарного кальция в день) и витамин D (400 ME в день) в виде одной жевательной таблетки кальций D3 Никомед.
Критериями оценки эффективности терапии являлись:
- МПК поясничных позвонков, шейки бедра и МПК бедренной кости в целом;
- маркеры костного метаболизма: содержание в крови остеокальцина (ОК), костной щелочной фосфатазы (КЩФ), сывороточного С-терминаль- ного телопептида коллагена I типа (СТХ);
- качество жизни по опроснику EuroQol (EQ5D);
- оценка боли в спине (по валидизированной анкете);
- оценка эффективности терапии врачом;
- оценка эффективности терапии пациентками;
- оценка безопасности и переносимости.
Денситометрия. Всем пациенткам до включения в исследование и на 5-м визите проводили денситометрию с определением МПК в L,—LIV, измеренной в передне-заднем направлении, шейки бедра (FN) и общего показателя проксимального отдела бедренной кости (TH). Денситометрическое исследование в ЭНЦ и ЦИТО осуществляли с помощью рентгеновского костного денситометра ’’Prodigy” (GE Lunar Corporation, США), в ИР РАМН — на аппарате QDR 4500W ("Hologic", США).
В связи с этим результаты денситометрии МПК (BMD) были стандартизированы с применением следующих формул:
МПК = 1,0755 • МПК Hologic;
МПК = 0,9522 • МПК Lunar.
- Для общего показателя проксимального отдела бедренной кости:
МПК = 1,008 • МПК Hologic + 0,006;
МПК = 0,979 • МПК Lunar - 0,031.
Биохимические маркеры костного метаболизма. Биохимические маркеры формирования костной ткани: КЩФ и ОК, а также маркер костной резорбции СТХ — определяли в сыворотке крови исходно, через 3 и 12 мес лечения. Гидроксивитамин D измеряли только на скрининговом визите. КЩФ исследовали методом иммуноферментного анализа (ИФА), используя диагностические наборы ВСМ Diagnostics, гидроксивитамин D — также методом ИФА, используя наборы IDS № АС-57.ОК, СТХ — иммунохемилюминесцентным методом на приборе Elecsys 2010 диагностическими наборами компании Рош. Эти исследования проводили в лаборатории ЭНЦ.
Рентгенологическое исследование. На 2-м визите проводили латеральную рентгенографию поясничного (Lj—LIV) и грудного (TIV—TXII) отделов позвоночника для выявления предшествующих и переломов тел позвонков. Степень снижения высоты тел позвонков (от I до III) определяли рентгеноморфометрически соответственно методике Н. Genant [13]. Исследование выполнялось централизованно в ИР РАМН.
Качество жизни пациенток оценивали с помощью опросника оценки качества жизни Европейской группы качества жизни EuroQol EQ-5D и анкеты по оценке боли в спине исходно, через 6 и 12 мес от начала лечения. Опросник качества жизни EQ-5D состоит из пяти 3-балльных шкал (подвижности, ухода за собой, привычной повседневной деятельности, боли и дискомфорта, тревоги и депрессии) и одной 100-балльной визуальной шкалы самооценки здоровья.
Боль в спине оценивали по следующим параметрам: наибольшее число дней подряд с болью в спине за последние 3 мес; общее число дней с болью в спине за последние 3 мес; сила боли в спине до начала терапии: нет боли, очень слабая, слабая, умеренная, сильная, очень сильная.
Безопасность лечения оценивали по данным о нежелательных явлениях (НЯ), клинически значимых изменениях жизненно важных показателей и результатов лабораторных тестов. НЯ оценивали по степени тяжести, связи с терапией исследуемым препаратом и соответствию критериям серьезного нежелательного явления (СНЯ) согласно общепринятым определениям.
Стандартные лабораторные тесты, которые включали общий анализ крови, общий анализ мочи, биохимический анализ крови, определение ТТГ на визите скрининга и контроль биохимических показателей крови (общий билирубин, общая ЩФ, ГГТ, АЛТ, ACT, мочевая кислота, фосфор, кальций) на 4-м и на 5-м визитах.
Статистический анализ проведен с использованием статистического пакета SAS R (версия 8.02, SAS Institute, США). Все статистические тесты вы-
Антропологические и демографические характеристики пациенток, включенных в анализ эффективности
Предопухолевые изменения под действием стронция. Появление атипичных клеток под действием стронция
1. Василенко И.Я., Василенко О.И. Стронций радиоактивный // Энергия: экономика, техника, экология. 2002, № 4, 26-32 с.
2. Сысуев Е.Б. Разработка и исследование новой фармацевтической продукции как средств профессиональной защиты / Е.Б. Сысуев, А.Д. Доника // Международный журнал прикладных и фундаментальных исследований. 2012. № 11. С. 95.
Радиоактивный стронций относится к биологически значимым радионуклидам и характеризуется высокой токсичностью. Его доля в глобальном радиоактивном загрязнении внешней среды и облучении населения значительна. Дозы облучения в подавляющем большинстве случаев можно отнести к категории малых с низкой мощностью дозы.
Изучение свойств и биологического действия стронция является актуальным, т.к. содержание его во всех растительных и животных организмах в количестве 10-2-10-3 % сухой массы; суточное поступление с пищей и водой составляет около 1.9 мг. Избыточное содержание в организме становится реальной угрозой развития уровской болезни (болезнь Кашина-Бека), проявляющейся в заболевании суставов, повышенной ломкости и уродства костей. Основным источником загрязнений внешней среды 90Sr являются испытания ядерного оружия и аварии на предприятиях топливно-ядерного цикла. Населению нуклид поступает с загрязненными продуктами, ингаляционно, через раневые и ожоговые поверхности. Растворимые соединения стронция хорошо всасываются в кишечнике. Резорбция зависит от возраста человека, физиологического состояния, характера питания и особенно содержания в рационе кальция. Радиоактивный стронций относится к остеотропным биологически опасным радионуклидам. Избирательно откладывается в костях и подвергает, тем самым, костный мозг постоянному облучению. В костях стронций накапливается неравномерно. В эпифизе первоначальная концентрация нуклида в 2.5 раза выше, чем в диафизе. В других органах и тканях стронций депонируется в значительно меньших количествах.
Ранелат стронция (Бивалос): место препарата в терапии постменопаузального остеопороза (анализ клинических исследований)
Постменопаузальный остеопороз — это прогрессирующее системное заболевание скелета, характеризующееся снижением костной массы и нарушением архитектоники кости, сопровождающееся повышенной склонностью к переломам. Остеопороз является важной медицинской и социальной проблемой в связи с его высокой распространенностью и частыми осложнениями — переломами костей скелета, которые приводят к временной и стойкой утрате трудоспособности, ухудшают качество жизни, повышают смертность, особенно среди лиц пожилого и старческого возраста. По данным различных авторов, показатели смертности в течение 1-го года после перелома шейки бедра составляют от 12 до 40%. У половины больных, выживших после перелома, существенно ограничивается или утрачивается способность к самообслуживанию.
В связи с этим в последние 20 лет разрабатывается проблема оптимальной терапии остеопороза, направленная на создание условий для минимизации рисков переломов у пациентов с низкой костной массой и факторами риска заболевания. Кардинальные вопросы, стоящие перед врачом в отношении пациента с установленным остеопорозом, можно сформулировать следующим образом: кому следует инициировать лечение и какое лекарственное средство выбрать для индивидуального лечения. Было бы ошибочно считать, что лишь применение антиостеопоротических препаратов позволит решить поставленные задачи. Требуется комплексный подход, заключающийся в коррекции потенциально устранимых факторов риска остеопороза и переломов немедикаментозными способами, назначении профилактических лекарственных средств, содержащих достаточные дозы кальция и витамина D.
Основными показаниями для назначения антиостеопоротических препаратов являются низкая минеральная плотность костной ткани (МПК) осевого скелета (в шейке бедра и/или в поясничном отделе позвоночника), особенно в сочетании с имеющимися факторами риска и/или наличием в анамнезе остеопоротических переломов, развившихся при незначительной травме.
В настоящее время сформировались высокие требования к современным лекарственным препаратам для лечения остеопороза. В первую очередь лекарственная терапия должна способствовать значимому снижению риска как вертебральных, так и внепозвоночных (включая переломы шейки бедра) переломов, причем желательно, чтобы эффект развивался уже через 1 год после лечения. Поскольку терапия планируется на длительный период времени (во всяком случае, не менее чем на 2 года), препараты должны обладать хорошей переносимостью и быть удобными в применении пациентами, что позволяет повысить приверженность терапии.
Выбирая препарат для лечения остеопороза, врач должен руководствоваться следующими данными: эффективность (доказанное снижение риска переломов), профиль переносимости (сравним с плацебо по безопасности), возможность достижения высокой комплаентности. Согласно современным представлениям, лекарственный препарат может назначаться пациентам с остеопорозом, если его эффективность была доказана в многоцентровых рандомизированных двойных слепых плацебо- контролируемых исследованиях (РК.И), в которых первичной конечной точкой было снижение числа переломов осевого скелета, а длительность исследования превышала 3 года.
Современный арсенал антиостеопоротических препаратов позволяет врачу осуществить выбор при соблюдении перечисленных требований. Это и бисфосфонаты, и селективные модуляторы эстрогеновых рецепторов, действие которых основано на подавлении костной резорбции. Также в практике используются кальцитонины, эстрогены и активные метаболиты витамина D с некоторыми допущениями по уровню эффективности, показаниям и противопоказаниям. Все перечисленные группы препаратов обладают антирезорбтивным эффектом.
Однако механизм развития остеопороза связан не только с повышенной костной резорбцией. При некоторых типах и клинических вариантах остеопороза низкое костеобразование является ведущим звеном патогенеза, что требует применения другого подхода. В связи с этим стали активно разрабатываться препараты анаболического действия, например рекомбинантный 1-34 или 1-84 ПТГ человека, которые значительно повышают плотность костной ткани и снижают частоту обусловленных остеопорозом переломов.
Перспективным направлением в реализации подхода, направленного на восстановление баланса костного метаболизма в пользу образования кости, стало открытие действия на костную ткань различных солей природного минерала стронция, на основе которого создан препарат бивалос (ранелат стронция).
Действие стронция на костную ткань впервые установлены еще в 1910 г., однако синтез химического соединения (стронция ранелата), которое в дальнейшем могло бы быть использовано для лечения остеопороза, осуществлен только в 1988 г. С этого времени с целью изучения основных эффектов ранелата стронция проведено большое количество исследований на культурах клеток и лабораторных животных. Полученные обнадеживающие результаты позволили организовать и провести клинические исследования II и III фазы, которые продолжались в течение 2—5 лет. Синтезированный препарат (Protelos® в странах ЕС и Бивалос® в России) в сентябре 2004 г. был одобрен Европейской комиссией и разрешен для клинического применения в лечении постменопаузального остеопороза.
Доклинические исследования
На доклинической стадии изучения основных эффектов ранелата стронция на состояние костного метаболизма проведено большое количество исследований, как in vitro, так in vivo.
На моделях культивированных клеток костного мозга мышей было показано, что ранелат стронция снижал базальную и стимулированную кальцит- риолом костную резорбцию на 29 и 36% соответственно [12]. Ранелат стронция также ингибировал на 66% резорбтивную активность костно-мозговых клеток новорожденных крыс, инкубированных на тонких срезах кортикальной кости быков и подавлял дифференцировку остеокластов [2], причем эти изменения носили дозозависимый характер.
Вместе с тем было установлено, что в культурах костных клеток под воздействием ранелата стронция в несколько раз повышался синтез ДНК в фибробластах и преостеобластах, а также на 34% увеличивался синтез коллагеновых и неколлагеновых белков. Одновременно отмечено, что усиливалась репликация преостеобластов [3].
В эксперименте на моделях остеопении (ова- риоэктомированные или иммобилизованные животные) установлено, что ранелат стронция способствует повышению прочности кости при проведении компрессионных тестов [2], увеличению МПК, а также стимулирует образование новой костной ткани, что подтверждено результатами гистоморфометрии и повышением уровня маркеров формирования кости и инсулиноподобного фактора роста-1 [7]. При этом S. Bain и соавт. [3] доказали улучшение микроархитектоники трабекулярной кости, взятой из проксимального эпифиза бедра овариоэктомированных крыс, обусловленное увеличением объема кости, числа трабекул и уменьшением трабекулярного пространства после применения ранелата стронция в различных дозировках. В опытах на 7-недельных крысах, которые в течение 104 нед получали ранелат стронция в различных дозировках, было показано увеличение МПК в шейке бедра на 13—48%, а в поясничных позвонках — на 16—57% [1]. Ни в одном исследовании не указывалось на нарушение минерализации костной ткани.
Такие же результаты были получены на приматах. Ранелат стронция, который применяли в различных дозировках у интактных самок обезьян, дозозависимо подавлял костную резорбцию. На основе гистоморфометрических исследований кости было выявлено снижение количества остеокластов на 53% и уменьшение поверхности, покрытой остеокластами, на 61%, причем в фазе минерализации ранелат стронция встраивался в структуру как компактной, так и губчатой кости. Большее количество ранелата стронция обнаруживалось в новых, только что сформировавшихся участках кости, тогда как в зрелой, раннее образованной костной ткани, препарат не выявлен. Важно отметить, что ранелат стронция быстро выводился из костной ткани после прекращения терапии, при этом гистологические признаки костеобразования не менялись [5].
Таким образом, многочисленные экспериментальные исследования продемонстрировали двойной механизм действия ранелата стронция на костную ткань, заключающийся в подавлении костной резорбции и стимуляции костеобразования. Помимо этого, было доказано положительное влияние ранелата стронция на показатели МПК и архитектонику костной ткани, что послужило основанием для проведения клинических исследований II и III фазы.
Рандомизированные клинические исследования ранелата стронция при установленном постменопаузальном остеопорозе
PREVOS (Prevention of early postmenopausal bone loss by strontium ranelate) — 2-летнее многоцентровое рандомизированное плацебо-контролируемое клиническое исследование II фазы, в которое были включены 160 женщин в раннем постменопаузальном периоде. Пациенток распределили по группам случайным образом в зависимости от дозировки ранелата стронция (125 мг/день, 500 мг/день и 1 г/день). Основной целью исследования явилось доказательство предотвращения костных потерь в поясничном отделе позвоночника.
В исследовании PREVOS было убедительно показано, что в группе пациенток, получавших ранелат стронция в дозе 1 г/день, отмечалось достоверное увеличение МПК на 5,53% по сравнению с группой плацебо (р 0,001). Также было продемонстрировано статистически значимое повышение щелочной фосфатазы (маркера костеобразования). На основании вышеизложенного сделан основной вывод о том, минимальной эффективной дозой ранелата стронция для предотвращения костных потерь в раннем постменопаузальном периоде у женщин, не имевших остеопороза, следует считать 1 г/день [10].
STRATOS (The strontium ranelate for treatment of osteoporosis) — 2-летнее, многоцентровое европейское исследование II фазы, в которое были включены 353 женщины белой расы (средний возраст 66 лет), получавшие ранелат стронция в различных дозах (500 мг/день, 1 или 2 г/день) или плацебо [8]. При включении в исследование женщины с установленным остеопорозом имели хотя бы 1 вертебральный перелом и МПК < -2,4 SD. Все пациентки получали 500 мг/день элементарного кальция и 800 ME витамина D3. Основной целью исследования была оценка влияния терапии на показатели МПК поясничного отдела позвоночника. В группе женщин, получавших ранелат стронция в дозе 2 г/ день, отмечено повышение МПК на 7,3% ежегодно. У этих пациенток также регистрировалось значительное повышение костной фракции щелочной фосфатазы (р = 0,05) и снижение N-телопептида (маркер костной резорбции) (р 0,004) через 6 мес наблюдения. Вместе с тем на 44% уменьшилось количество пациенток с признаками деформации позвонков на 2-й год лечения по сравнению с группой плацебо, при этом снижение относительного риска (RR) переломов тел позвонков составило 0,77 [95% доверительный интервал (CI), 0,54—1,09].
Исследование FIRST. С целью получения доказательств по влиянию ранелата стронция на риск переломов у женщин с установленным остеопорозом было проведено 2 РКИ, названные SOTI (Spinal Osteoporosis Therapeutic Intervention) и TROPOS (Treatment of Peripheral Osteoporosis). Оба исследования начинались с так называемого вводного периода (Run-in-Period), который получил название FIRST. В исследование FIRST было включено 9196 пациенток с постменопаузальным остеопорозом в ограниченном временном периоде от 2 до 24 нед. В общей сложности в этих РКИ приняли участие 75 клинических центров из 12 стран. Исследование FIRST ставило перед собой задачу достижения стабилизации кальциевого обмена и нормализации содержания витамина D у пациенток путем назначения заместительной терапии препаратами кальция в дозировке 1000 мг/день в сочетании с витамином D в дозировке от 400 до 800 ME в день. По окончании этого подготовительного периода была проведена рандомизация пациенток с их последующим включением в исследование SOTI или TROPOS.
Первые результаты исследований SOTI и TROPOS были опубликованы через 3 года наблюдения.
SOTI — 5-летнее международное многоцентровое исследование III фазы, в которое было включено 1649 женщин в постменопаузе, из которых 1442 — отнесены в анализируемую группу (Intention-to- Treat-Population): 719 пациенток получали 2 г/день ранелата стронция (Protelos®), 723 получали плацебо. Всем пациенткам назначалась поддержка препаратами кальция и витамина D.
Главной первичной конечной точкой исследования SOTI было выяснение действия ранелата стронция на риск клинических позвоночных переломов. Клинический перелом определялся как перелом, сопровождавшийся болевым синдромом и/ или снижением роста пациентки не менее чем на 1 см. Критериями включения в исследование были: возраст пациенток старше 50 лет, наличие как минимум одного обусловленного остеопорозом перелома позвонка, снижение МПК тел позвонков < 0,840 г/см 2 .
Абсолютное снижение риска вертебральных переломов составило в 1-й год лечения 5,8%, а показатель NNT был равен 17. При анализе результатов
- летнего наблюдения за пациентками, получавшими ранелат стронция, абсолютный риск переломов достиг 11,9%, а показатель NNT составил 8.
На протяжении всего исследования в группе, получавшей ранелат стронция, отмечалось постоянное увеличение МПК поясничных позвонков, достигавшее статистической достоверности уже через 6 мес. Через 3 года различия между группами составили 14,4% в поясничном отделе позвоночника и 8,3% в шейке бедра. Через 3 мес лечения было отмечено значимое повышение уровня костной фракции щелочной фосфатазы (показателя костеобразования), при этом уровень фермента в течение 3 лет не снижался. Вместе с тем наблюдалось достоверное снижение уровня С-телопептида коллагена I типа (маркера резорбции костной ткани) в сыворотке крови пациенток из группы, получавшей ранелат стронция, по сравнению с группой плацебо.
Биопсия гребня подвздошной кости была выполнена 20 пациенткам с проведением двойного тетрациклинового теста. Каких-либо признаков остеомаляции или нарушений минерализации кости не выявлено.
TROPOS — 5-летнее международное многоцентровое двойное слепое плацебо-контролируемое исследование III фазы, в которое была включена 5091 пациентка в постменопаузе, из них 4932 женщины вошли в анализируемую группу: 2479 получали ранелат стронция в дозе 2 г/день, 2453 — плацебо. Пациентки, участвовавшие в исследовании, с одной стороны, должны были соответствовать критериям отбора исследования FIRST, а с другой стороны, быть старше 74 лет или как вариант в возрасте от 70 до 74 лет при наличии одного дополнительного фактора риска переломов. Кроме того, у больных должно было быть выявлено снижение МПК шейки бедра, соответствовавшее Г-критерию < 2,5 SD. В итоге средний возраст участниц исследования составил 77 лет. Главной целью исследования TROPOS являлось определение риска развития внепозвоночных (периферических, включая перелом шейки бедра) переломов на фоне терапии ранелатом стронция.
Сводные данные, отражающие эффективность ранелата стронция при лечении постменопаузального остеопороза
Предрак - симптомы и лечение
Что такое предрак? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ефетова Сергея Константиновича, онколога со стажем в 14 лет.
Над статьей доктора Ефетова Сергея Константиновича работали литературный редактор Юлия Липовская , научный редактор Вячеслав Михайличенко и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Предрак (precancer) — это определённые изменения в клетках организма, которые увеличивают вероятность развития злокачественной опухоли.
Cинонимы: предопухолевое состояние, предраковое заболевание.

Предрак — это не онкологическое заболевание и не его начальная стадия. Предопухолевые клетки могут долго существовать без изменений, но при любом предраковом состоянии обязательно нужно лечиться или наблюдаться у врача, чтобы предотвратить развитие онкологического заболевания [1] [2] .
Чаще всего предраковые изменения появляются в клетках эпителия — слоя клеток, который выстилает поверхность (эпидермис) и полости тела, а также слизистые оболочки внутренних органов, желудочно-кишечного тракта, дыхательной системы и мочеполовых путей. Кроме этого, эпителий образует большинство желёз организма.
Какие состояния относят к предопухолевым
1. Заболевания желудочно-кишечного тракта:
- и эритроплакия полости рта. При лейкоплакии наблюдается повышенное ороговение слизистой оболочки рта, при эритроплакии слизистая оболочка истончается [3] .
- Пищевод Барретта. Это осложнение хронической гастроэзофагеальной рефлюксной болезни (ГЭРБ), при котором эпителий пищевода превращается в кишечный эпителий. Развивается примерно у 10 % пациентов с симптомами ГЭРБ. Появление таких атипичных клеток (отличных от нормальных) может привести к развитию рака пищевода[4] .
- . При этом заболевании изменяются и погибают клетки слизистой оболочки желудка, которые вырабатывают желудочный сок и соляную кислоту. В 80 % случаев атрофический гастрит вызван инфекцией Helicobacter pylori, в 5-10 % — реакцией иммунитета с отторжением клеток эпителия (аутоиммунный гастрит) [5][6] .
- Аутоиммунные воспалительные заболевания кишечника, например язвенный колит и болезнь Крона.
- Полипозы кишечника: спорадические, т. е. спонтанные, которые могут возникнуть у любого человека (одиночные, аденоматозные и ворсинчатые полипы толстой кишки), или наследственные, которые передаются от родителей и могут быть у других родственников (семейный аденоматозный полипоз, синдром Пейтца — Егерса ) [7][8][9][10] .
- Синдром Линча. Это н аследственное заболевание, которое приводит к развитию неполипозного рака толстой кишки [11] .
2. Заболевания дыхательной системы, например бронхиальная эпителиальная дисплазия (плоскоклеточная дисплазия, атипическая аденоматозная и диффузная идиопатическая нейроэндокринная гиперплазия). При этом состоянии изменяются клетки, которые выстилают поверхность бронхов. Бронхиальная эпителиальная дисплазия увеличивает вероятность развития рака лёгкого, чаще всего она возникает у курящих людей [12] [13] .
3. Заболевания кожи, например актинический (старческий, или солнечный) кератоз, кератоакантома, папилломатоз, диспластические невусы, пигментная ксеродерма [14] .
4. Заболевания половой системы:
Распределение предраковых состояний по полу и возрасту различны. Причины появления предраковых состояний тоже разнообразны, для каждого органа есть свои факторы риска и наиболее уязвимые группы людей.
Факторы риска
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы предрака
Предраковые состояния часто никак не проявляются или протекают с неспецифичными симптомами, т. е. такими, которые характерны одновременно для множества заболеваний, как доброкачественных, так и злокачественных. Кроме этого, симптомы зависят от органа, в котором появились изменённые клетки.
В полости рта:
- При лейкоплакии появляется налёт белого цвета, который сохраняется при чистке зубов, полоскании полости рта и после приёма пищи, при осмотре врач не может снять его шпателем. Термин «лейкоплакия» используется для тех образований, которые появляются в полости рта без очевидной причины.
![Белый налёт в полости рта при лейкоплакии [20, 21]](https://probolezny.ru/media/bolezny/predrak/belyy-nalyot-v-polosti-rta-pri-lyaykoplakii-20-21_s.jpg)
- Эритроплакия — б олее редкое и опасное состояние. Для него характерно появление красного пятна на слизистой оболочке. Поверхность такого пятна бархатистая, иногда с изъязвлениями. Если во рту появился белый налёт, покраснение или припухлость вокруг каймы губ, которые не проходят больше двух недель, нужно сразу обратиться к врачу-стоматологу [3] .
![Красное пятно в полости рта при эритроплакии [22]](https://probolezny.ru/media/bolezny/predrak/krasnoe-pyatno-v-polosti-rta-pri-eritroplakii-22_s.jpg)
При пищеводе Барретта симптомы обычно такие же, как и при неосложнённой ГЭРБ. Может беспокоить изжога, тягостная, жгучая боль за грудиной, отрыжка, тошнота, кашель по утрам из-за попадания желудочного содержимого в глотку [4] .
При атрофическом гастрите часто ухудшается аппетит, появляется отрыжка тухлой пищей, тошнота и рвота, боли в животе, чувство тяжести после приёма пищи [6] .
Воспалительные заболевания кишечника, такие как язвенный колит и болезнь Крона, часто вызывают боль в животе и диарею, которая может чередоваться с запорами. Стул может быть с примесями крови и слизи, при осложнённом течении, например из-за присоединения инфекции, в кале появляется большое количество гноя, позывы на дефекация могут стать мучительными, схваткообразными и возникать несколько раз в день. Часто повышается температура, возникает слабость, боль в суставах, ухудшается аппетит, из-за этого снижается вес. Может беспокоить боль в правой подвздошной области, а при прощупывании живота иногда определяются объёмные образования — воспалительные инфильтраты (скопление в повреждённых тканях избытка жидкости и клеток крови) [18] . Однако такой набор жалоб или каждая жалоба в отдельности могут возникать и при других заболеваниях [9] .

При полипозах кишечника и синдроме Линча может не быть никаких жалоб, иногда появляются симптомы, характерные для многих заболеваний желудочно-кишечного тракта: боли в животе, вздутие, запоры или диарея. Также могут беспокоить вялость, слабость, головокружение и утомляемость, связанные с анемией из-за небольшой, но постоянной потери крови. Если после дефекации на туалетной бумаге или стенках унитаза появилась кровь, нужно как можно скорее обратиться к врачу. Он назначит исследование толстого кишечника — колоноскопию, чтобы выявить источник кровотечения [9] .
При дисплазии шейки матки обычно ничего не беспокоит, но иногда появляются маточные кровотечения, необычные кровянистые или другие выделения, нехарактерные для определённого периода менструального цикла, менопаузы или постменопаузы [15] .
Проявления предраковых состояний кожи также неспецифичны. Должны насторожить: любые подозрительные высыпания; незаживающие раны и изъязвления; родинки или пигментные пятна, которые изменили форму, цвет или размер; выделение жидкости на родинках. При появлении этих признаков нужно немедленно обратиться к врачу для обследования.
При актиническом кератозе появляются небольшие (менее 1 см в диаметре) желто-коричневые, красные или телесные образования с грубой, похожей на наждачную бумагу, поверхностью. Могут наблюдаться выросты, которые получили название «кожный рог». Чаще поражаются открытые участки кожи (лицо, руки, тыльная сторона кистей), иногда изменения появляются на губах (актинический хейлит) [14] .
![Образование на коже при актиническом кератозе [23]](https://probolezny.ru/media/bolezny/predrak/obrazovanie-na-kozhe-pri-aktinicheskom-keratoze-23_s.jpg)
Патогенез предрака
Как выглядят нормальные эпителиальные клетки
Эпителиальные клетки тесно прилежат друг к другу и в один или несколько слоёв покрывают многие органы, отделяя их от внешней среды (эпителий кожи, полости носа, бронхов) или от внутренней (эпителий пищевода, желудка, кишечника). Есть несколько типов эпителиальных клеток, и они выполняют множество жизненно важных функций: эпителий кожи защищает организм от бактерий и загрязнений, эпителий органов ЖКТ позволяет усваиваться питательным веществам и жидкости [14] .

Почему появляются изменённые клетки
Эпителиальные клетки довольно быстро обновляются и делятся. Этот процесс регулируется генами, в них заложены своеобразные инструкции, которые помогают клетке правильно работать и делиться в необходимом количестве. Под воздействием различных факторов в генах может возникнуть поломка — мутация, ошибка в инструкции. Из-за этого строение эпителиальной клетки меняется, она перестаёт быть похожей на обычные, здоровые клетки организма, т. е. становится атипичной:
- клеточные ядра, отвечающие за жизнедеятельность и размножение клеток, увеличиваются;
- слои изменённых клеток лежат неровно, неупорядоченно, нарушается постепенный рост по направлению к поверхности эпителия.
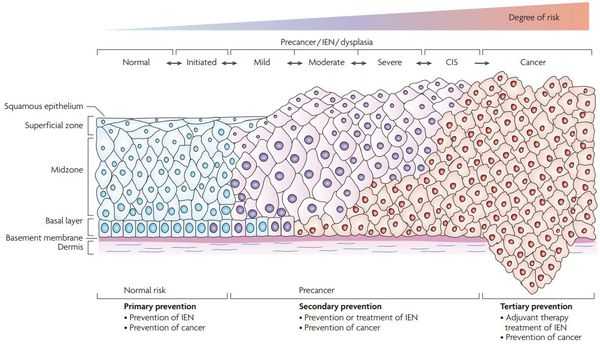
Для этого процесса используют термин «дисплазия», что буквально означает нарушение роста [2] [8] [14] . Диспластические клетки не являются злокачественными, они не могут прорастать в окружающие органы и ткани и не распространяются по организму, но в них уже есть изменения.

Классификация и стадии развития предрака
Классификация предраковых заболеваний по частоте перехода в рак:
- Облигатные — рак возникает примерно в 80-95 % случаев. К ним относится семейный аденоматозный полипоз кишечника, синдром Линча, пигментная ксеродерма, актинический хейлит и др. Такие заболевания требуют не только тщательного наблюдения, но и лечения.
- Факультативные предраковые заболевания — рак развивается не более чем в 5-10 % случаев [1] . К ним относится пищевод Барретта, язвенный колит, актинический кератит, атрофический гастрит, атипическая протоковая гиперплазия, атипическая гиперплазия предстательной железы.
Чтобы определить степень дисплазии клеток, используется классификация GRADE. Она помогает предположить, как будет протекать заболевание, и определить тактику лечения. Для этого в ходе гистологического исследования ткани врач-патоморфолог определяет свойства клеток (например, число поделившихся клеток и разнообразие их формы), которые типичны для злокачественной опухоли, затем подсчитывает сумму баллов. Эта сумма сверяется со шкалой злокачественности опухоли. Например, для оценки рака предстательной железы используется шкала Глисона:
- 2-6 баллов по Глисону — низкая степень злокачественности. Клетки новообразования очень похожи на нормальные (их называют хорошо дифференцированными) и растут медленно.
- 7 баллов — промежуточная степень. Клетки не похожи на нормальные (умеренно дифференцированные) и растут быстрее, чем обычно.
- 8-10 баллов — высокая степень. Клетки сильно отличаются от нормальных (малодифференцированные или недифференцированные) и быстро растут .
Осложнения предрака
Осложнение предракового состояния — развитие онкологического заболевания. Несмотря на то, что предопухолевые клетки могут длительно существовать без изменений, при любом предраке обязательно нужно регулярно проходить обследования или лечиться с последующим наблюдением. Это поможет предотвратить развитие онкозаболевания [19] .
Диагностика предрака
Врач может заподозрить предопухолевое состояние, тщательно расспросив пациента об истории его жизни и болезни. Доктор может спросить:
- Были ли случаи онкологических заболеваний в семье.
- Какие есть хронические заболевания.
- Проходит ли пациент скрининговые обследования, которые рекомендованы по возрасту. Скрининговыми называют исследования, помогающие выявить болезни, когда они ещё не вызывают симптомов.
Чтобы выявить предраковые состояния желудочно-кишечного тракта (пищевод Барретта, атрофический гастрит, аденоматозный полипоз желудка), проводится гастроскопия [4] [5] .
При подозрении на воспалительные заболевания кишечника (язвенный колит и болезнь Крона), полипозы кишечника или синдром Линча необходима колоноскопия.
При подозрении на бронхиальную эпителиальную дисплазию проводится бронхоскопия.
Чтобы обнаружить изменённые клетки шейки матки, используется ПАП-тест. Это скрининговое исследование мазка с шейки матки, окрашенного по Папаниколау. Его нужно делать всем женщинам 25-65 лет каждые три года. Чтобы уточнить диагноз, проводится кольпоскопия — визуальное исследование шейки матки с помощью специального увеличительного прибора.
![ПАП-тест [24]](https://probolezny.ru/media/bolezny/predrak/pap-test-24_s.jpg)
Однако точно поставить диагноз предрака или самого онкологического заболевания можно только после гистологического исследования врачом-патоморфологом. Для этого в ходе биопсии берут кусочек изменённой ткани.
Как проводят биопсию
В зависимости от органа, в котором находятся изменённые клетки, биопсию выполняют по-разному. Чтобы взять образец кожи и слизистых оболочек полости рта, требуется небольшая операция под местной анестезией.
Образец ткани некоторых внутренних органов можно взять только при эндоскопическом исследовании: гастроскопии, колоноскопии, бронхоскопии или кольпоскопии.
Когда образец получен, врач внимательно изучает строение кусочка ткани под микроскопом. Никакие другие методы не позволяют точно определить предрак или онкологическое заболевание. Именно результат гистологического исследования, т. е. заключение врача-патоморфолога, определяет план ведения и лечения пациента.
Лечение предрака
Лечение каждого случая предрака прежде всего зависит от степени дисплазии (изменения клеток) и от того, в каком органе есть предопухолевые изменения [15] . Например, при атрофическом гастрите, который вызван инфекцией Helicobacter pylori, проводится антибактериальная терапия. При актиническом кератозе — операция по удалению изменённого участка кожи. При воспалительных заболеваниях кишечника, синдроме Линча, семейном аденоматозном полипозе может потребоваться профилактическая операция, которая существенно снижает риск возникновения колоректального рака.
Тактику лечения определяет команда специалистов, в которую входят онкологи, хирурги и другие врачи, занимающиеся лечением заболеваний конкретного органа: маммологи, дерматологи, гинекологи, колопроктологи и др.
Прогноз. Профилактика
Дисплазия не всегда превращается в злокачественную опухоль. Умеренная дисплазия затрагивает не все слои эпителия и может быть обратимой, если устранить причину повреждения клеток [8] . Однако вероятность рака при дисплазии увеличивается по сравнению с обычными клетками.

Прогноз некоторых предраковых состояний выглядит следующим образом:
- Большинство аденокарцином пищевода связано с пищеводом Барретта, но развивается эта злокачественная опухоль не очень часто: при низкой степени дисплазии — у 0,5 % больных в год, при дисплазии высокой степени — у 6 % пациентов в год [25] .
- У пациентов с синдромом Линча вероятность заболеть колоректальным раком составляет 70-80 %.
- При семейном аденоматозном полипозе, для которого характерны множественные полипы в толстой кишке, к 40 годам может развиться карцинома [17] .
В то же время современные методы наблюдения и лечения пациентов с предраковыми заболеваниями существенно снижают риск развития онкологического заболевания или позволяют выявить его на ранней стадии, что значительно улучшает прогноз.
Профилактика предрака
- Проводить самообследование: еженедельно осматривать кожу после гигиенических процедур, осматривать полость рта, женщинам обследовать молочные железы через 7-10 дней после окончания каждой менструации.
- Посещать стоматолога не реже, чем раз в полгода, для осмотра полости рта.
- Проходить диспансеризацию и ежегодный осмотр у терапевта.
- Меньше бывать на солнце, отказаться от посещения солярия, использовать солнцезащитный крем.
- Отказаться от курения и жевательного табака.
- Лечить хеликобактерную инфекцию и вакцинироваться от ВПЧ, это снизит риск развития рака желудка и шейки матки.
Также необходимо делать скрининговые обследования, показанные в определённом возрасте:
Дисплазия шейки матки - симптомы и лечение
Что такое дисплазия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Татьяны Алексеевны, гинеколога со стажем в 14 лет.
Над статьей доктора Игнатенко Татьяны Алексеевны работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Дисплазия шейки матки, или цервикальная интраэпителиальная неоплазия (ЦИН), или Cervical Intraepithelial neoplasia (CIN) — это патологический процесс, при котором в толще клеток, покрывающих шейку матки, появляются клетки с различной степенью атипии (неправильного строения, размера, формы).
Причины дисплазии шейки матки
Папилломавирусная инфекция (ВПЧ) — основная причина дисплазии и рака шейки матки. К болезни приводит длительное персистирование именно ВПЧ высокого канцерогенного риска. У женщин с риском развития цервикальной неоплазии распространенность онкогенных типов ВПЧ чрезвычайно велика. ВПЧ становится причиной CIN 2-3 и рака шейки матки в 91,8% и 94,5% случаев соответственно. [1]
К факторам риска дисплазии шейки матки относится длительный приём контрацептивов и курение. Выявлена связь между пассивным курением среди некурящих и повышенным риском возникновения CIN 1. [3]
Другие факторы риска — раннее начало половой жизни, большое число и частая смена половых партнеров, употребление алкоголя, сопутствующие половые инфекции, много беременностей и родов. Риск цервикальной CIN 2 особенно высок у женщин, которые до этого имели опыт пересадки органов, у них выявлена ВИЧ-инфекция или они принимают иммунодепрессанты. [2]
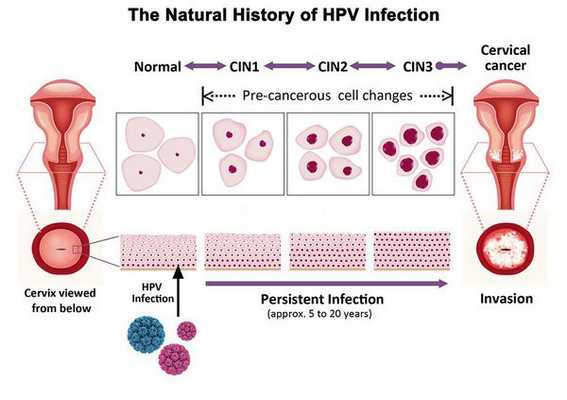
Симптомы дисплазии шейки матки
Дисплазия шейки матки, как правило, имеет бессимптомное течение, поэтому пациентки не предъявляют никаких специфических жалоб.
Патогенез дисплазии шейки матки
Критический фактор развития цервикальной интраэпителиальной неоплазии — инфицирование вирусом папилломы человека. Во многих случаях цервикальная интраэпителиальная неоплазия легкой степени отражает временную реакцию организма на папиломавирусную инфекцию и без лечения исчезает в течение полугода-года наблюдения. При цервикальной интраэпителиальной неоплазии умеренной и тяжелой степени высока вероятность встраивания вируса папилломы человека в клеточный геном. Инфицированные клетки начинают продуцировать вирусные белки E6 и Е7, которые продлевают жизнь клетки, сохраняя ее способность к неограниченному делению. Неизбежно формирующиеся на этом фоне мутации клеток ведут к формированию предрака (дисплазии) и рака шейки матки, влагалища и вульвы.
Онкогенные белки ВПЧ (Е6, Е7) взаимодействуют с регуляторными белками клеток шейки матки, приводя к повышению активности онкомаркера p16INK4A, что свидетельствует о неконтролируемом размножении клеток шейки матки. Таким образом, сверхэкспрессия p16INK4A, определяемая в материале шейки матки, который получают при биопсии, является биомаркером интеграции вируса папилломы человека высокого риска в геном и трансформации эпителиальных клеток под действием вируса, что делает эту информацию полезной при оценке прогноза развития предраковых и злокачественных поражений, связанных с инфицированием генитального тракта вирусом папилломы человека. [5]
Классификация и стадии развития дисплазии шейки матки
Для постановки цитологического диагноза (по результатам цитологического исследования соскобов шейки матки и цервикального канала с окрашиванием по Папаниколау (Рар-тест) или жидкостной цитологии) используется классификация Бетесда (The Bethesda System, 2014), основанная на термине SIL (Squamous Intraepithelial Lesion) - плоскоклеточное интраэпителиальное поражение. [10]
Выделяют три вида результатов соскобов с поверхности шейки матки (экзоцервикса):
- нормальные мазки, без изменений клеток шейки матки (NILM, Negative for intraepithelial lesion or malignancy);
- «непонятные» мазки без определенного значения, по которым нельзя определить характер поражения, однако они при этом не являются нормой (ASC-US, Atypical Squamous Cells of Undetermined Significance) или, что хуже, ASC-H, Atypical squamous cells cannot exclude HSIL, обнаружение атипичных клеток плоского эпителия, не исключающее SIL высокой степени);
- предраки низкой (LSIL, Low Grade Squamous Intraepithelial Lesion) и высокой (HSIL, High Grade Squamous Intraepithelial Lesion) степени.
Классификация Папаниколау
- 1-й класс — нормальная цитологическая картина (отрицательный результат);
- 2-й класс — изменение морфологии клеток, которое обусловлено воспалением во влагалище и (или) шейке матки;
- 3-й класс — единичные клетки с аномалией ядер и цитоплазмы (подозрение на злокачественное новообразование);
- 4-й класс — отдельные клетки с явными признаками озлокачествления;
- 5-й класс — много типично раковых клеток (злокачественное новообразование).
Существуют также гистологические классификации для оценки материала, полученного при биопсии.
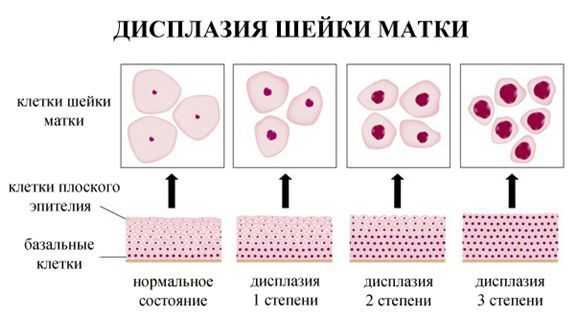
По классификации R. M. Richart (1968) в зависимости от глубины поражения поверхностного клеточного слоя выделяют три степени дисплазии шейки матки:
- ЦИН 1 (дисплазия слабой степени) — признаки папилломавирусной инфекции (койлоцитоз и дискератоз). Поражение до 1/3 толщины клеточного пласта;
- ЦИН 2 (дисплазия средней степени) — поражена 1/2 толщины клеточного слоя;
- ЦИН 3 (дисплазия тяжелой степени) — поражение более 2/3 клеточного слоя. [8]
В приведенной ниже таблице даны соотношения классификаций предраковых поражений шейки матки. [9]
| Система Папаниколау | Описательная система ВОЗ | CIN | Терминологи- ческая система Бетесда (ТСБ) |
|---|---|---|---|
| Класс 1 (норма) | Отсутствие злокачественных клеток | Отсутствие неопластических изменений | Норма |
| Класс 2 (метаплазия эпителия, воспалительный тип) | Атипия, связанная с воспалением | Реактивные изменения клеток ASC: ASC - US, ASC - H | |
| Класс 3 ("дискариоз") | Слабая дисплазия | CIN 1 койлоцитоз | LSIL |
| Умеренная дисплазия | CIN 2 | HSIL | |
| Тяжелая дисплазия | CIN 3 | ||
| Класс 4 (клетки, подозрительные на рак или карцинома in situ | Карцинома in situ | ||
| Класс 5 (рак) | Инвазивная карцинома | Карцинома | Карцинома |
Осложнения дисплазии шейки матки
Последствия дисплазии шейки матки
Основное и самое опасное осложнение цервикальной интраэпителиальной неоплазии заключается в развитии рака шейки матки, любой случай развития которого — результат упущенных возможностей диагностики и лечения дисплазии шейки матки. [7]
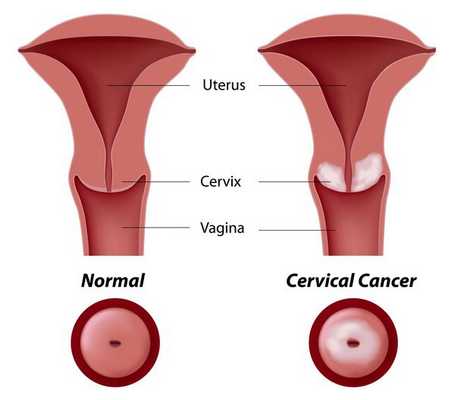
Проводились длительные, систематические исследования риска рака шейки матки у женщин с диагнозом цервикальной интраэпителиальной неоплазии 3 степени (CIN3) по сравнению с женщинами, у которых были нормальные цитологические результаты. Согласно полученным данным, долгосрочный относительный риск развития рака шейки матки зависит от различных гистологических типов CIN3 и выше всего он для аденокарциномы in situ. Даже через 25 и более лет после конизации (хирургического иссечения патологических тканей шейки матки) риск злокачественного перерождения клеток был значительным. [4]
Диагностика дисплазии шейки матки
Для ранней диагностики предраковых поражений шейки матки во многих странах мира существует система цервикального скрининга.
Методы диагностики дисплазии шейки матки
В России система цервикального скрининга включает последовательность действий:
- Цитологическое исследование: РАР-тест;
- ВПЧ-тестирование: в США и странах Евросоюза ВПЧ-тест применяется для первичного скрининга рака шейки матки (РШМ). В России его использование вариативно: при первичном скрининге в сочетании с РАР-тестом, в качестве самостоятельного теста, при ведении пациенток с неясными результатами РАР-теста (ASCUS) и для наблюдения паценток после лечения HSIL;
- Кольпоскопия: показаниями к исследованию являются положительные результаты РАР-теста (класс 2-5). Метод основан на осмотре шейки матки при помощи увеличивающих оптических систем и проведения диагностических проб с растворами уксусной кислоты и йода (Люголя). С помощью кольпоскопии определяют локализацию поражения, его размер, выбирают участок для проведения биопсии, определяют тактику лечения.
При кольпоскопии должна быть тщательно оценена зона трансформации (переходная зона стыка двух видов покровного эпителия шейки матки).
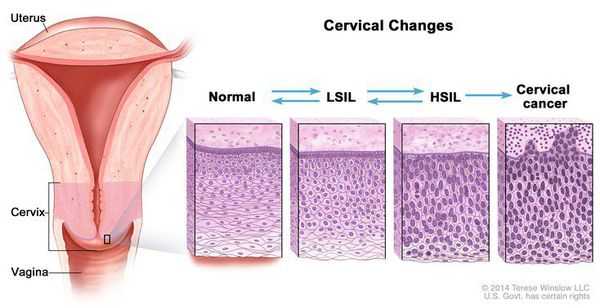
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
- Зона трансформации 1 типа — переходная зона видна полностью. Это самый оптимальный и прогностически «благоприятный» вариант кольпоскопического заключения.
- Зона трансформации 2 типа — переходная зона частично скрыта в канале шейки матки. Адекватно оценить такую картину сложно, так как наиболее измененные участки могут быть не видны и пропущены.
- Зона трансформации 3 типа — переходная зона находится глубоко в канале шейки матки и оценить её кольпоскопически невозможно. Кольпоскопия в этом случае считается неинформативной, поскольку глубина залегания патологического очага остается неизвестной.
- Биопсия: прицельная или расширенная биопсия (конизация) всегда должна выполняться под контролем кольпоскопии. Выбор метода биопсии зависит от типа поражения, возраста пациентки и зоны трансформации. Важной информацией, которую дает биопсия, является возможность иммуногистохимического определения маркера ранней диагностики дисплазии с высокой степенью риска озлокачествления: p16INK4a.
Лечение дисплазии шейки матки
Динамическому наблюдению подлежат молодые пациентки (до 35 лет) с LSIL (ВПЧ, ЦИН 1, ЦИН 2, если при биопсии не обнаружен белок р16, являющийся признаком проникновения ВПЧ высокого риска в геном и трансформации опухолевых клеток под действием вируса). Наблюдать возможно пациенток только с 1 и 2 кольпоскопическим типом зоны трансформации.
Контрольные осмотры, цитологическое и ВПЧ-тестирование показаны через 6 и 12 месяцев после первичного обнаружения патологии.
Хирургическое лечение дисплазии
При выявлении HSIL (ЦИН 2 c обнаружением белка р16 при биопсии, ЦИН 3) неизбежно хирургическое лечение в виде абляции («прижигания») или эксцизии (удаления) поврежденной ткани. Для абляции используют электро-/радио-, крио- и лазерные воздействия. Эксцизия возможна электро-/радиоволновая или ножевая.
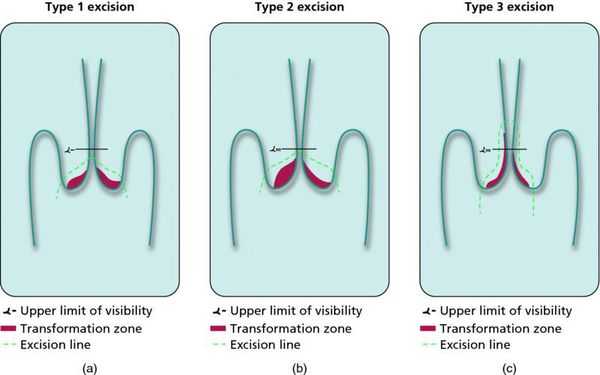
Немаловажно, что при выявлении по кольпоскопии 3 типа зоны трансформации на фоне положительного РАР-теста гинеколог обязан провести выскабливание слизистой канала шейки матки и/или широкую эксцизионную биопсию (конизацию шейки матки) для исключения опухолевого процесса, потенциально располагающегося вне зоны кольпоскопического обзора. Немаловажно наблюдение после операции через 6 и 12 месяцев с выполнением цитологического соскоба и ВПЧ-теста.
Следует отметить, что процедура хирургического иссечения патологических тканей на шейке матки увеличивает риск преждевременных родов. А сама по себе цервикальная интраэпителиальная неоплазия первой степени на течении беременности и родов никак не отражается и зачастую опасности не представляет. [12]
Средний возраст женщин, когда может потребоваться хирургическая коррекция цервикальной внутриэпителиальной неоплазии — около 30 лет. Хирургическое лечение нередко ассоциировано с неблагоприятным течением последующей беременности. Частота и тяжесть неблагоприятных осложнений возрастают с увеличением глубины иссекаемых тканей. [13]
Реабилитация после хирургического лечения
В течение месяца после операции следует воздержаться от спринцеваний, половых контактов и не пользоваться тампонами. На 2-3 недели исключают тяжёлые физические нагрузки и тепловые процедуры. Незначительные сукровичные выделения, усиливающиеся иногда до менструальноподобных, в течение 10-20 дней после операции — это нормальное явление.
При реабилитации после хирургического лечения шейки матки эффективны препараты, содержащие антисептик и стимулятор регенерации эпителия.
После лечения возможен рецидив, поэтому необходимо пожизненное наблюдение: цитологический мазок через 6 и 12 месяцев после операции, затем раз в год в течение 10 лет, далее раз в 3 года.
Планировать беременность после операции на шейке матки можно не ранее, чем через 3-6 месяцев. Эти сроки будут зависеть от глубины эксцизии или конизации и длины шейки матки [9] .
Лечение дисплазии при беременности
В большинстве случаев лечение должно быть отложено на послеродовый период. При беременности на фоне дисплазии шейки матки каждые три месяца проводится кольпоскопический и цитологический контроль. При выявлении рака шейки матки пациентку консультирует онкогинеколог. Доктор подбирает тактику лечения, может потребоваться прервать беременность по онкологическим показаниям [9] .
Дополнительными факторами риска прогрессирования ПВИ с формированием предраковой патологии являются:
- курение;
- длительное использование гормональных контрацептивов;
- многократные травматичные роды;
- ВИЧ-инфекция.
- У пациенток с ЦИН часто обнаруживают вирус простого герпеса 2 типа, цитомегаловирусную инфекцию, хламидийную урогенитальную инфекцию, бактериальный вагиноз, ассоциированный с резким снижением или отсутствием вагинальной лактофлоры, повышенным ростом во влагалище Gardnerella vaginalis и Atopobium vaginae, повышение концентрации в бакпосеве грибов рода Candida, Mycoplasma hominis.
Устранение и профилактика данных факторов способны снизить вероятность развития предраковой патологии шейки матки.
Рак шейки матки поражает преимущественно женщин репродуктивного возраста. Скрининг является важной стратегией вторичной профилактики. Длительный процесс канцерогенной трансформации от появления в организме вируса папилломы человека (ВПЧ) до инвазивного рака дает широкие возможности для выявления заболевания на стадии, когда лечение высокоэффективно. Подходящими скрининговыми тестами в мире признаны цитологическое исследование, визуальный осмотр после применения уксусной кислоты и тесты на выявление ВПЧ. Всемирная организация здравоохранения рекомендует проводить скрининг женщин по крайней мере один раз в жизни в возрасте от 30 до 49 лет. [14]
Согласно приказу Министерства здравоохранения РФ от 03.02.2015. N36ан "Об утверждении порядка проведения диспансеризации определенных групп взрослого населения", осмотр со взятием мазка (соскоба) с поверхности шейки матки и цервикального канала на цитологическое исследование производится 1 раза в 3 года для женщин в возрасте от 21 года до 69 лет включительно.
Читайте также:
