Пример множественного рака из полипов ЖКТ. Доказательство множественности рака
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Слово «опухоль» вызывает страх у большинства пациентов, даже если ее называют «доброкачественной». В этом случае дела обстоят намного лучше, чем при раковом новообразовании, но мы все равно не имеем права расслабляться.
Некоторые доброкачественные опухоли обладают способностью перерождаться в злокачественное заболевание. В это время главное — обнаружить и обработать образование, прежде чем оно изменит статус и поставит под угрозу жизнь человека.
Полип — это тоже доброкачественная опухоль. Это результат аномального роста и разрастания клеток слизистой оболочки. Полипы появляются во многих органах. Иногда это совершенно безвредно, иногда это предраковое состояние и требует строгого наблюдения. В этой статье мы расскажем о наиболее распространенных полипах, причинах их развития, риске перерождения и методах лечения.
Полипы в кишечнике
Излюбленное место полипов — большая и прямая кишка. Образования, развивающиеся из эпителиальных клеток этих органов, называются колоректальными. Чаще всего обнаруживаются именно такие полипы, поэтому начнем с них.
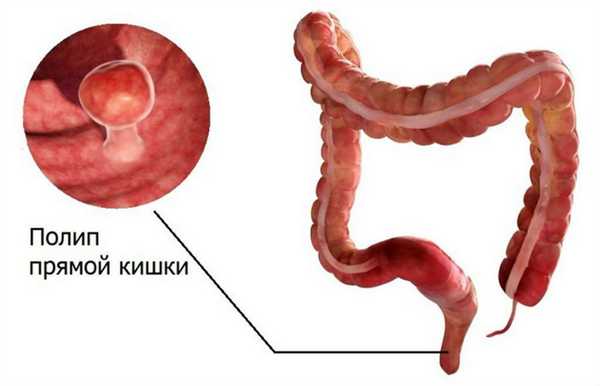
Полип прямой кишки
По статистике, 20-30% взрослых людей имеют какой-либо колоректальный полип. Это правда, что большинство этих опухолей безвредны, но также бывает, что колоректальный полип вызывает рак кишечника.
Почему и как развивается полип пока неизвестно. Пока мы можем только назвать факторы, которые способствуют этому процессу. Также врачи не могут с уверенностью сказать, полностью ли застрахован человек от развития полипов или, наоборот, это неизбежное заболевание. Так или иначе известно, что полип — не что иное, как результат внеклеточной активности клеток.
Нормальная клетка планомерно растет и делится. Это естественный процесс. Проблемы начинаются, когда гены мутируют и клетки начинают бесконтрольно размножаться — новые клетки не нужны, но они все еще могут формироваться. Бесконтрольно растущие клетки кишечника производят полипы. Полипы могут возникать в любой области кишечника, хотя чаще всего они возникают на левой стороне толстой и прямой кишки.
Типы полипов кишечника
Есть два типа полипов — неопухолевые и неопластические. Первый тип полипов не отличается злокачественным перерождением, второй — опасный. Неопластические полипы делятся на аденомы и зубчатые полипы. Большинство полипов кишечника — это аденома. Такой полип напоминает железу. Ее часто называют аденомой, а рак, который развивается из нее, называют аденокарциномой. Аденокарцинома — самый распространенный тип рака прямой кишки.
В целом, чем больше полип, тем выше риск злокачественного образования, особенно в случае опухолевых полипов.
Повышает риск развития самих полипов:
- Возраст старше 50 лет;
- Воспалительные заболевания кишечника (болезнь Крона, язвенный колит );
- Семейный анамнез полипоза;
- Курение и чрезмерное употребление алкоголя;
- Ожирение и низкая физическая активность;
- Афроамериканское происхождение;
- Плохо контролируемый диабет 2 типа.
Встречаются генетические мутации человека, которые вызывают наследственность полипов. Наличие такой мутации также повышает риск развития колоректального рака.
Врожденными патологиями, вызывающими полипы, являются:
- Синдром Линча — у человека с этим заболеванием развивается небольшое количество полипов, хотя они склонны к быстрой злокачественности. Синдром Линча — наиболее частая причина врожденного рака кишечника. Он также был связан с раком груди, желудка, тонкой кишки, мочевыводящих путей и яичников.
- Семейный полипоз аденомы — это редкое заболевание, вызывающее сотни, а иногда и тысячи полипов в толстой кишке. Заболевание начинается в подростковом возрасте. На фоне допустимого полипоза рак развивается почти в ста случаях из ста, а, как правило, до 40 лет.
- Синдром Гарднера — при этом заболевании полипы развиваются в толстом и тонком кишечнике. Для синдрома характерно появление новообразований на коже, костях и других участках тела.
- MYH-ассоциированный полипоз — это состояние похоже на синдром Гарднера. На этот раз мутации в т.н. MYH развивается в генах. У пациента часто диагностируют множественные полипы аденомы и в раннем возрасте у него развивается рак кишечника.
- Синдром Пэйсерс-Эгерса — заболевание начинается с появления пигментных пятен по всему телу, включая губы, десны, стопы, а затем появляются полипы по всему кишечнику.
- Синдром зубного полипоза — в это время в верхней части толстой кишки развиваются множественные зубчатые полипы.
Симптомы полипов в кишечнике
Полипы редко вызывают клинические симптомы. Это плохо. Судите сами: невидимое безобидное новообразование превращается в невидимую опасную болезнь и проявляется, когда уже слишком поздно. Даже в случае клинических проявлений симптомы неспецифичны.
Например, для полипа характерны:
- Ректальное кровотечение . Кровотечение из прямой кишки вызывается многими другими заболеваниями: геморроем, трещинами заднего прохода, раком прямой кишки. Невооруженным глазом никто не может сказать, что стоит за кровотечением, но симптом в любом случае требует внимания.
- Изменение цвета стула . Кровь иногда проявляется красными каплями в стуле, иногда она меняет цвет стула на малиновый. Пища, лекарства и пищевые добавки также могут изменить цвет стула. Так что этот знак тоже неспецифический, но заслуживающий внимания.
- Изменение функции кишечника . Список заболеваний, вызывающих запор или диарею, еще более обширен. Если дефекация продолжается более недели, возможно, мы имеем дело с большим полипом. Выделение слизи из прямой кишки также является заметным признаком.
- Боль . Полипы толстого кишечника также периодически проявляются болевым синдромом. Образование частично сжимает кишечник и вызывает спастические боли внизу живота. Понятно, что полип — не единственная причина этого симптома.
- Железодефицитная анемия . Список причин анемии также довольно обширен. На анемию указывает общая слабость, утомляемость, одышка, диарея. Какая связь между полипами и анемией? Когда полип вызывает кровотечение, ожидается железодефицитная анемия.
Хроническое кровотечение приводит к дефициту железа, что со временем приводит к недостатку эритроцитов и гемоглобина, поэтому в случае анемии необходимо обследовать пациента на предмет скрытого кровотечения, что, в свою очередь, может указывать на наличие полипов.
Таким образом, боли в животе, кровянистый стул, изменения дефекации указывают на необходимость обращения к врачу, однако, как мы уже говорили, эти симптомы проявляются не всегда, поэтому рассчитывать на них нельзя.
Диагностика полипов кишечника
Основное средство диагностики основного заболевания — скрининг. Это золотой стандарт диагностики заболевания и наиболее эффективная стратегия — скрининг позволяет нам обнаружить проблему до того, как она перерастет в злокачественное заболевание. Скрининг также может выявить рак на ранней стадии, и начало лечения на этой стадии намного надежнее и эффективнее.
Поскольку колоректальный полип считается предраковым состоянием, выявлению данной патологии при скрининге уделяется особое внимание.
Во время скрининга проводятся два теста. Стул сначала исследуется на предмет скрытого кровотечения. Этот метод обнаруживает даже небольшое количество крови в кале, которое не видно во время опорожнения желудка. Однако положительный результат теста еще не означает наличие полипа, особенно рака. Это лишь указывает на то, что в организме есть скрытое кровотечение. Помогает определить его причину колоноскопия.
Колоноскопия — самый чувствительный метод обнаружения полипов и рака. Во время обследования в заднюю часть тела вводится тонкая трубка с камерой. Врач своими глазами видит слизистую кишечника. Обследование также позволяет сделать биопсию — взять образец ткани полипа для гистологического исследования. На колоноскоп также накладывается проволочная петля для безболезненного удаления полипов.
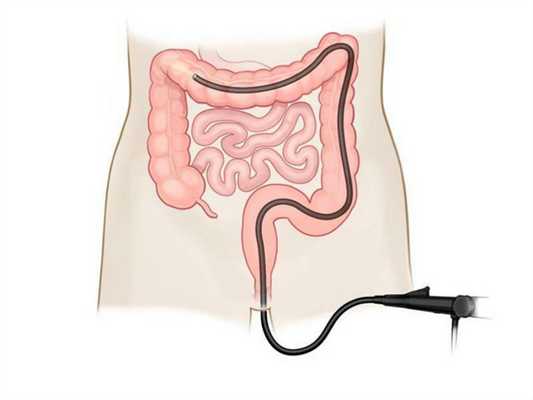
Колоноскопия
Если результат анализа кала в пределах нормы, повторный анализ назначают через два года, однако по назначению врача его можно провести и раньше.
Полипы можно обнаружить с помощью виртуального колоноскопа (КТ-колонография), подвижного сигмоидоскопа и других методов, но вам все равно потребуется колоноскопия для биопсии или удаления полипа.
Лечение полипов — полипэктомия
«Нет полипа — нет риска» — вот главный принцип лечения полипов. Большинство полипов не являются злокачественными, однако, к сожалению, никто не может точно сказать, какой полип превратится в рак, а какой останется безвредным, поэтому подход прост: все полипы следует удалить, и чем раньше это произойдет, тем лучше.
Есть несколько способов сделать полипэктомию:
- Удаление пинцетом или проволочной петлей — в этом случае полипэктомия выполняется во время колоноскопии. Если полип длиннее одного сантиметра, под него вводят жидкость. Образование высоко поднимается, что позволяет ему изолироваться от окружающих тканей и облегчить его удаление.
- Минимально инвазивная хирургия — Чрезмерно большие полипы или полипы, которые невозможно удалить безопасно, следует удалять лапароскопическим способом во время колоноскопии. Это малоинвазивная процедура.
- Полная проктоколэктомия — при врожденных патологиях из-за большого количества полипов невозможно удалить их по одному, поэтому врач полностью иссекает большую и прямую кишки.
Лечение и наблюдение не заканчиваются удалением полипов, особенно если полип неопластический и большой. По статистике в тридцати случаях из ста происходит регенерация сухожилия, поэтому наблюдение после полипэктомии необходимо.
Колоноскопия рекомендуется после резекции полипа:
- 5-10 лет спустя, если у вас был только один или два небольших полипа;
- Через 3 года, если у вас было больше двух или хотя бы 1 см полипа аденомы;
- 3 года, если у вас было более десяти аденом;
- 6 месяцев, если у вас была очень большая аденома или аденома, которую нужно было удалить по частям.
Кстати, считается, что аспирин и нестероидные противовоспалительные препараты снижают риск рецидива полипов, но принимать их можно только по рецепту врача и ни в коем случае — произвольно.
Возможна ли профилактика?
Основой профилактики рака кишечника и полипов является скрининг, хотя есть данные о профилактическом действии и других факторов. Например, некоторые исследования показывают, что потребление кальция предотвращает рецидив аденомы толстой кишки (к сожалению, до сих пор неизвестно, оказывает ли кальций защитный эффект против рака толстой кишки), в то время как другие исследования показывают, что витамин D помогает предотвратить развитие колоректального рака.
Этот вопрос все еще является предметом изучения, но есть уже отработанные и проверенные и проверенные рекомендации: риск развития опасных кишечных заболеваний будет значительно снижен, если вы выработаете здоровые привычки — включите в свой рацион больше фруктов, овощей, зерновых, уменьшите жир, будете избегать. Физически нужно поддерживать здоровый вес.
Пример множественного рака из полипов ЖКТ. Доказательство множественности рака
Ростовский научно-исследовательский онкологический институт Минздрава РФ
Ростовский научно-исследовательский онкологический институт, Ростов-на-Дону, Россия
ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России, Ростов-на-Дону, Россия
Первично-множественный колоректальный рак: клинические аспекты
Резюме Цель исследования. Определить некоторые клинические особенности синхронного и метахронного колоректального рака (КРР). Материалы и методы. Объектом исследования послужили данные о 150 больных первично-множественным КРР T1-4N0-2M0-1. Проведен анализ клинических, биологических, морфологических особенностей синхронных и метахронных опухолей. Результаты. Первично-множественные опухоли составили 6,01% от всех форм КРР. Преобладал синхронный КРР (63,75%) с локализацией опухоли в сигмовидной и прямой кишке. Синхронные колоректальные опухоли у женщин чаще сочетались с раком молочной железы, метахронные выявлялись после лечения опухолей половых органов. У мужчин синхронные колоректальные опухоли чаще сочетались с раком почки, метахронные выявлялись после лечения рака желудка. Заключение. Выявленные особенности первично-множественных колоректальных опухолей возможно учитывать в программах как первичной диагностики, так и диспансерного наблюдения после лечения больных со злокачественными опухолями, что позволит улучшить раннее выявление и результаты лечения онкологических больных.
КРР - колоректальный рак
МКО - метахронная колоректальная опухоль
Проблема колоректального рака (КРР) на протяжении нескольких десятилетий продолжает оставаться актуальной, что обусловлено как ростом заболеваемости, так и прогрессивными достижениями в лечении [1]. Наряду с увеличением общей онкологической заболеваемости наблюдается увеличение заболеваемости первично-множественными опухолями толстой и прямой кишки [2], которые в настоящее время составляют 17% от всех первично-множественных злокачественных новообразований и являются одной из наиболее частых локализаций первично-множественных злокачественных опухолей после первично-множественного рака кожи [3, 4].
В настоящее время проводится изучение как клинических, так и онкобиологических аспектов первичной множественности опухолей толстой и прямой кишки 6, тем не менее многие аспекты в этой проблеме остаются открытыми, что и побудило нас коснуться некоторых вопросов первично-множественного КРР.
Цель исследования: определить некоторые клинические особенности синхронного и метахронного КРР.
Материалы и методы
Из 2497 больных КРР T1-4N0-M0-1, подвергшихся хирургическому лечению в клинике ФГБУ «РНИОИ» МЗ РФ за последние 5 лет, первично-множественный рак выявлен у 150 (6,01%), данные о которых мы и использовали для анализа. Статистическую обработку результатов выполняли с применением пакетов программ Microsoft Excel 2010 и Statistica 8.0. Оценку различий проводили с использованием критерия χ 2 , статистически значимыми считали различия при р
Результаты
Анализ клинических проявлений первично-множественного КРР показал, что отдельные симптомы многообразны и соответствуют таковым при одиночной опухоли толстой или прямой кишки. Известно, что при локализации опухоли в правой половине ободочной кишки это чаще всего хроническая анемия, нарушение общего состояния (слабость, похудание), кишечный дискомфорт (снижение аппетита, чувство тяжести в верхней половине живота, иногда рвота через несколько часов после еды), боли в животе и наличие пальпируемой опухоли. При локализации опухоли в левой половине ободочной кишки преобладают: кишечные расстройства (запоры, поносы и их чередование), патологические выделения (кровь, слизь) при дефекации. При локализации опухоли в прямой кишке основными симптомами являются тенезмы, выделение крови и слизи при дефекации, боли в прямой кишке.
При синхронных колоректальных опухолях наблюдаются симптомы, соответствующие локализации опухоли в кишке. Так, анемия в течение нескольких лет, пальпируемая опухоль в правой подвздошной области и тенезмы свидетельствуют о синхронной опухоли слепой и прямой кишки. Оценка клинической картины заболевания с обязательным обследованием всех отделов толстой и прямой кишки позволят выявить синхронный КРР и избежать диагностических ошибок. В большинстве случаев нераспознанной синхронная колоректальная опухоль остается в случае, если в связи со стенозирующим характером дистальной опухоли эндоскоп не проходит в проксимальные отделы кишки и не позволяет произвести их осмотр. Об этом следует помнить, и в таких случаях производить дополнительное обследование вышележащих отделов толстой кишки (это может быть исследование пассажа бария по кишке, спиральная рентгеновская компьютерная томография органов брюшной полости и малого таза с пероральным контрастированием).
Следует отметить возможность развития одновременно опухоли колоректальной локализации и других органов. В этом плане важным является наличие в клинической картине симптомов, не характерных для КРР, даже если диагноз уже установлен. При этом следует продолжить обследование больного для исключения опухоли другой локализации. Анализ преимущественного поражения других органов синхронным раком будет произведен далее.
В случае метахронного развития опухолей как толстой и прямой кишки, так и других органов после излечения КРР диагностика не вызывает особых трудностей. Это связано с регулярной диспансеризацией и обследованием излеченных больных, приводящей к своевременной постановке диагноза.
Оценка частоты проявления симптомов заболевания показала, что при одиночном КРР преобладали боли (60%), кровь в кале (56,7%) и запоры (46,7%). При синхронных колоректальных опухолях наиболее частыми симптомами были боль (56,7%), слабость (53,3%) и похудание (40%). При метахронном КРР в клинической картине преобладали слабость (63,6%) и боль (56,7%) (табл. 1).
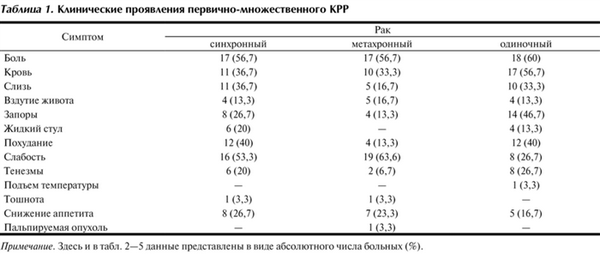
Таблица 1. Клинические проявления первично-множественного КРР Примечание. Здесь и в табл. 2-5 данные представлены в виде абсолютного числа больных (%).
В нашем исследовании время от появления первых клинических симптомов до момента обращения в специализированный онкологический стационар у больных одиночным раком составило преимущественно 6-12 мес (40% больных), а первично-множественным раком - 2-3 мес (48,3% больных).
Среди больных первично-множественным КРР синхронные и метахронные опухоли, локализующиеся только в толстой и прямой кишке, выявлены у 80 (53,3%). В этой группе больных преобладал синхронный КРР - 51 (63,75%) больной. Средний возраст пациентов составил 62,9 года. Преобладали мужчины - 32 (62,75%), средний возраст 63,2 года, женщин 19 (37,25%), средний возраст 62,5 года. Локализация синхронных опухолей в толстой и прямой кишке представлена в табл. 2. Согласно представленным данным синхронные опухоли преимущественно локализовались в сигмовидной (у 32 больных, 62,75%) и прямой кишке (у 29 больных, 56,86%). При этом сочетание опухолей в прямой и сигмовидной кишке выявлено у (35,29%). Половые различия по локализации синхронных опухолей в толстой и прямой кишке отсутствовали.

Таблица 2. Локализация синхронных опухолей в толстой и прямой кишке Примечание. Здесь и в табл. 3-5 * - различия между подгруппами достоверны (р<0,05).
У 34 (66,67%) мужчин и женщин распространение синхронных колоректальных опухолей ограничено только кишкой, без регионарных и отдаленных метастазов. Опухоли с регионарными метастазами имелись у 11 (21,57%) больных, с отдаленными - у 6 (11,76%). Распределение синхронных колоректальных опухолей по гистологической структуре свидетельствует о преобладании синхронных умереннодифференцированных аденокарцином (у 25, 49,02%), в основном у мужчин (у 17, 53,13%). У женщин часто встречались и слизеобразующие аденокарциномы (у 6, 31,58%).
Таким образом, синхронные опухоли составили 34% от всего первично-множественного КРР. Средний возраст больных достигал 62,9 года. Среди заболевших преобладали мужчины (62,75%). Синхронные опухоли преимущественно локализовались в сигмовидной (62,75%) и прямой кишке (56,86%), представлены в основном умереннодифференцированными аденокарциномами (49,02%), без регионарных и отдаленных метастазов (66,67%).
Метахронный КРР среди первично-множественного рака с локализацией опухолей только в толстой и прямой кишке выявлен у 29 (36,25%) больных (средний возраст 64,7 года). В этой группе было 16 (55,17%) женщин (средний возраст 66,9 года). Метахронная колоректальная опухоль (МКО) выявлена у них в среднем через 8,3 года после выявления первой опухоли. Среди больных метахронным первично-множественным КРР было 13 (44,83%) мужчин (средний возраст 62,5 года), метахронная опухоль выявлена у них в среднем через 4,5 года после первой опухоли.
Данные по локализации метахронных опухолей в толстой и прямой кишке отражены в табл. 3, представляющей распределение по локализации опухоли в следующем порядке: прямая кишка (51,72%, 15 больных), сигмовидная и правая половина ободочной кишки (по 48,28%, 14 больных), левая половина ободочной кишки (37,93%, 11 больных). В группе больных метахронным первично-множественным КРР наблюдались половые различия по локализации опухоли. Так, у женщин метахронные опухоли чаще локализовались в правой половине ободочной кишки - у 9 (56,25%) и прямой кишке - у 8 (50%). У мужчин МКО преимущественно локализовались в прямой и сигмовидной кишке - по 7 (53,85%) больных.

Таблица 3. Локализация метахронных опухолей в толстой и прямой кишке
У 14 (48,28%) больных распространение МКО ограничено только кишкой, без регионарных и отдаленных метастазов. Статистически значимых половых различий МКО по стадии TNM мы не наблюдали. Распределение МКО по гистологической структуре свидетельствует о значительном преобладании метахронных умереннодифференцированных аденокарцином - у 22 (75,86%) больных, как у мужчин, так и у женщин.
Итак, метахронный КРР составил 19,33% от всего первично-множественного рака толстой и прямой кишки. Средний возраст больных достигал 69,9 года, женщины были на 4 года старше мужчин. Среди заболевших было одинаковое число мужчин и женщин. Интервал между первой и последующей колоректальной опухолью у женщин в 2 раза больше (8,31 года), чем у мужчин (4,5 года). Метахронные опухоли у женщин преимущественно локализовались в правой половине ободочной кишки (56,25%) и прямой кишке (50%), у мужчин - в прямой и сигмовидной кишке (по 53,85%). МКО представлены в основном умереннодифференцированными аденокарциномами (75,86%), без регионарных и отдаленных метастазов (48,28%).
Среди больных первично-множественным КРР синхронные и метахронные опухоли, локализующиеся помимо толстой или прямой кишки, также в других органах, выявлены у 70 (46,7%). В этой группе синхронный первично-множественный рак наблюдался у 26 (37,14%) больных. Средний возраст пациентов составил 67,1 года. Женщин и мужчин было поровну - по 13 больных. Женщины на 7 лет моложе мужчин (63,6 и 70,5 года соответственно).
Локализация синхронных первично-множественных опухолей представлена в табл. 4, из которой видно, что синхронные колоректальные опухоли у женщин чаще сочетались с опухолями гениталий - у 8 (61,5%), причем у 5 - с раком молочной железы. У половины 7 (53,8%) мужчин синхронный КРР сочетался с опухолями мочевыделительной системы, причем у 6 из них - с раком почки.
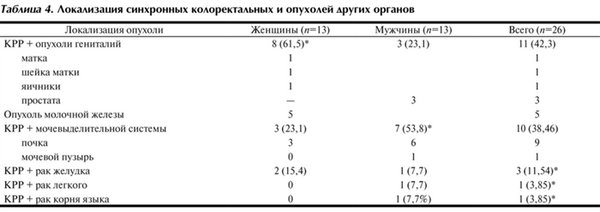
Таблица 4. Локализация синхронных колоректальных и опухолей других органов
У 65,4% больных опухоль была местно-распространенной, с наличием регионарных метастазов у одной из опухолей. Статистически значимых половых различий по стадии TNM синхронных колоректальных опухолей и других локализаций рака мы не наблюдали.
Распределение синхронных колоректальных опухолей при наличии и другой локализации рака по гистологической структуре свидетельствует о значительном преобладании синхронных умереннодифференцированных аденокарцином (80,8%) у мужчин и женщин.
Итак, синхронный КРР с другими локализациями опухолей составил лишь 17,33% от всего первично-множественного рака толстой и прямой кишки. Средний возраст больных достигал 67,1 года, женщины были на 7 лет моложе мужчин. Среди заболевших было одинаковое число женщин и мужчин. Синхронные колоректальные опухоли у женщин чаще сочетались с раком молочной железы. У мужчин синхронный КРР чаще сочетался с раком почки. Синхронные колоректальные опухоли представлены в основном умереннодифференцированными аденокарциномами (80,8%), местно-распространенными, с наличием регионарных метастазов (65,4%).
Метахронный КРР после лечения первой опухоли, локализующейся в других органах, составил 44 (29,33%) случая среди первично-множественных КРР и 62,86% среди первично-множественного КРР, сочетающегося с опухолями других органов. Средний возраст больных достигал 65,1 года. В этой группе больных было 24 (54,55%) женщины (средний возраст 61,3 года) и 20 (45,45%) мужчин (средний возраст 69 лет) на 8 лет старше женщин. Среднее время выявления МКО после лечения опухоли другой локализации у женщин составило 5,7 года, у мужчин - 4,4 года.
Локализация метахронных первично-множественных опухолей показана в табл. 5. Согласно представленным данным МКО у женщин чаще сочетались с опухолями половых органов - у 19 (79,23%), преимущественно матки и молочной железы. У мужчин метахронный КРР чаще сочетался с раком желудка - у 11 (55%).
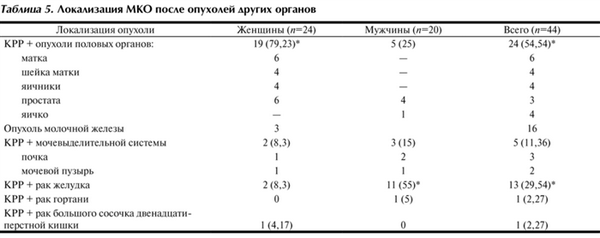
Таблица 5. Локализация МКО после опухолей других органов
28 (63,6%) больных имели местно-распространенную форму МКО и других локализаций рака, без отдаленных метастазов. Половые различия при этом отсутствовали.
Распределение МКО при наличии и другой локализации рака свидетельствует о значительном преобладании метахронных умеренно дифференцированных аденокарцином у мужчин и женщин - 33 (75%) больных.
Итак, метахронный КРР с другими локализациями опухолей составил 29,33% от всего первично-множественного рака толстой и прямой кишки. Средний возраст больных достигал 65,1 года, женщины на 8 лет моложе мужчин. Среди заболевших одинаковое число женщин и мужчин. Среднее время выявления МКО после лечения опухоли другой локализации у женщин составило 5,7 года, у мужчин - 4,4 года. МКО у женщин преимущественно выявлялись после лечения опухолей половых органов (79,23%). У мужчин метахронный КРР чаще наблюдался после лечения рака желудка (55%). МКО представлены в основном умереннодифференцированными аденокарциномами (75%), местно-распространенными, без отдаленных метастазов (63,64%).
Заключение
Клиническая картина первично-множественного КРР характеризуется наличием симптомов, не свойственных только одной локализации рака. Это обусловливает необходимость расширения диагностического поиска для исключения синхронной опухоли. При этом более выраженное клиническое проявление симптомов первично-множественного заболевания приводит к уменьшению до 3 мес сроков от появления клинической картины недуга до обращения за специализированной помощью у большинства больных (50% больных синхронным и 70% больных метахронным раком). В этот срок при одиночном КРР обращаются лишь 30% больных.
Диагностика метахронных опухолей облегчается наличием диспансеризации и регулярного обследования больных после излечения первой опухоли.
Первично-множественный КРР с локализацией опухолей только в толстой и прямой кишке составил 53,33% от всех форм первично-множественного КРР. В этой группе больных преобладал синхронный КРР (63,75%), которым заболевают чаще в 62,9 года, несколько чаще мужчины (62,75%). Синхронные опухоли преимущественно локализовались в сигмовидной (62,75%) и прямой кишке (56,86%). Средний возраст больных при выявлении МКО был старше, чем синхронных - 69,9 года. Интервал между выявлением первой и последующей колоректальной опухоли у женщин был в 2 раза больше, чем у мужчин (8,3 и 4,5 года соответственно). Метахронные опухоли у женщин преимущественно локализовались в правой половине ободочной кишки (56,25%) и прямой кишке (50%), у мужчин - в прямой и сигмовидной кишке (по 53,85%).
Если КРР выявлялся одновременно с опухолями других органов, то средний возраст больных (67,1 года) был на 4,2 года больше, чем при выявлении синхронного КРР, а женщины при выявлении опухолей на 7 лет моложе мужчин. Синхронные колоректальные опухоли у женщин чаще сочетались с раком молочной железы, у мужчин - с раком почки. Выявление колоректальной опухоли после лечения опухоли другой локализации наблюдается примерно в том же возрасте, что и синхронное (65,1 года), но несколько чаще, чем их одновременное выявление (62,86%). МКО у мужчин выявлялась в среднем через 4,4 г, чаще после лечения рака желудка (55%). У женщин колоректальная опухоль выявлялась в среднем через 5,7 года, преимущественно после лечения опухолей половых органов (79,17%).
Все первично-множественные колоректальные опухоли представлены в основном умереннодифференцированными аденокарциномами (как наиболее распространенного гистологического типа колоректальной опухоли), местно-распространенными, без отдаленных метастазов (возможно, в связи с тем что больные отобраны для хирургического лечения). Преобладание при первично-множественном КРР, сочетающемся с опухолями других органов, регионарных метастазов, возможно, свидетельствует о его более агрессивном течении по сравнению с другими видами первично-множественных колоректальных опухолей.
Выявленные особенности первично-множественных колоректальных опухолей можно учитывать в программах как первичной диагностики, так и диспансерного наблюдения после лечения больных со злокачественными опухолями, что позволит улучшить раннее выявление и результаты лечения больных с первично-множественными опухолями.
Карциноид из энтерохромаффинных клеток
Злокачественный карциноид из ECL-клеток
Нейроэндокринная карцинома NOS***
Крупноклеточная нейроэндокринная карцинома
Мелкоклеточная нейроэндокринная карцинома
Смешанная нейроэндокринная и ненейроэндокринная опухоль (MiNEN)
Примечание. * — новые коды для МКБ-O; ** — см. пояснения в тексте статьи; *** — NOS — not otherwise specified (без дополнительных уточнений).
В 5-м издании классификации значительно увеличены разделы, касающиеся фоновых и предопухолевых поражений, а также доброкачественных эпителиальных опухолей желудка.
К фоновым состояниям относят:
— атрофию и кишечную метаплазию,
— полипы фундальных желез,
— гиперпластические полипы желудка.
Большое внимание уделяется гастриту, вызванному Helicobacter pylori, стадированию атрофических изменений по системе OLGA [2—4], а также различным видам кишечной метаплазии.
Предопухолевые изменения слизистой оболочки желудка (дисплазия /железистая интраэпителиальная неоплазия) определены как неопластические изменения эпителия слизистой оболочки без признаков стромальной инвазии. Наиболее часто дисплазия встречается в антруме, однако может наблюдаться в любых отделах желудка [5]. В 5-м издании, как и в 4-м, выделяется два основных вида дисплазии: кишечного и фовеолярного (желудочного) типа. При этом в 5-м издании выделяют также подтипы дисплазий желудка: зубчатую дисплазию высокой степени, зубчатую дисплазию низкой степени, дисплазию желудочных ямок/крипт. Однако, несмотря на то что эти подтипы вынесены в классификационную таблицу, в тексте обозначено, что их клиническое значение определено нечетко и приводятся крайне короткие описания. Таким образом, решение составителей классификации о внесении редких подтипов дисплазии с неясной клинической значимостью в основную классификационную таблицу остается труднообъяснимым.
Дисплазия/железистая интраэпителиальная неоплазия желудка может представлять собой плоский, втянутый или полиповидный участок поражения слизистой оболочки. Градация дисплазии желудка предусматривает выделение дисплазии низкой степени (low grade) и дисплазии высокой степени (high grade) [6, 7].
Дисплазия кишечного типа описывается как очаг, состоящий из тубулярных, тубулярно-ворсинчатых или ворсинчатых структур, выстланных высоким цилиндрическим эпителием с увеличенными, удлиненными, гиперхромными ядрами, расположенными в эпителиальном пласте в несколько рядов. Часто встречается терминальная дифференцировка в виде наличия бокаловидных или нейроэндокринных клеток, иногда клеток Панета. Выявляется экспрессия MUC2, CD10, CDX2 [8].
Дисплазия фовеолярного типа описывается как очаг из тубулярно-ворсинчатых и/или зубчатых железистых структур, выстланных кубическим или низким цилиндрическим эпителием, напоминающим фовеолярный эпителий. Ядра круглые или овальные, с четко различимыми ядрышками. Цитоплазма клеток бледно-эозинофильная. Выявляется положительное иммуногистохимическое окрашивание с маркерами MUC5AC, MUC6.
Дисплазия желудочных ямок/крипт. В оригинальном тексте классификации употреблен термин «ямки/крипты», в связи с чем обращаем внимание, что использование термина «крипты» для слизистой оболочки желудка не соответствует международной гистологической номенклатуре. Такой тип дисплазии наблюдается в базальных отделах желудочных ямок, где железистые структуры демонстрируют созревание до поверхностных эпителиальных клеток. В 49—72% случаев встречается по периферии традиционной неоплазии и считается независимым предиктором прогрессии в инвазивный рак [9], однако в тексте классификации не указано, чем она отличается от дисплазии фовеолярного типа.
Зубчатая дисплазия локализуется только в желудочных ямках, характеризуется наличием микропапиллярных структур, экспрессирующих MUC5AC. Подобные гистологические изменения в литературе иногда называют зубчатой аденомой желудка [10].
Классификация доброкачественных эпителиальных опухолей значительно изменена. Если ранее понятия «аденома кишечного типа» и «аденоматозный полип» являлись синонимами, то в новой редакции аденомы кишечного типа стоят особняком, а к аденоматозным полипам относят образования, ранее находившиеся в группе аденом желудочного типа (аденомы фовеолярного типа, аденомы из пилорических желез). К группе аденоматозных полипов в новой классификации также относят аденомы из кислотообразующих желез (oxyntic gland adenoma), не упоминавшиеся в предыдущей классификации. Полипы фундальных желез (fundic gland polyps) более не рассматриваются как истинные опухоли и не имеют кода МКБ-О. Итак, к доброкачественным эпителиальным опухолям относят аденомы кишечного типа и аденоматозные полипы (аденомы фовеолярного типа, аденомы из пилорических желез, аденомы из кислотообразующих желез (oxyntic gland adenoma). Причем каждая из этих категорий может сопровождаться дисплазией высокой или низкой степени. Аденомам кишечного типа соответствуют коды МКБ-О 8144/0 и 8144/2 в зависимости от степени дисплазии, а для всех разновидностей аденоматозных полипов предусмотрены единые коды 8210/0 и 8210/2.
Аденома кишечного типа является третьим по частоте встречаемости образованием среди полиповидных новообразований желудка (после гиперпластических полипов и полипов фундальных желез), локализуется преимущественно в тех отделах желудка, где распространена кишечная метаплазия (в 60% случаев поражаются дистальные отделы желудка) [11]. Пациенты обычно старше 60 лет. Аденомы кишечного типа часто сочетаются с атрофическим гастритом и выраженной кишечной метаплазией. Выделяют два подтипа аденом кишечного типа: спорадические и синдромные. Синдромные аденомы иногда являются одним из проявлений семейного аденоматозного полипоза. Размеры аденом не превышают 2 см. Гистологически аденомы кишечного типа представляют собой совокупность тубулярных структур, выстланных пролиферирующим эпителием с признаками дисплазии, которые формируют полиповидное образование. Аналогичная картина на плоской слизистой оболочке без формирования полиповидного образования обозначается как дисплазия (интраэпителиальная неоплазия). Большинство клеток имеют цилиндрическую форму, вытянутое вдоль длинной оси ядро, присутствуют бокаловидные клетки и клетки Панета. При наличии дисплазии высокой степени аденомы кишечного типа стадируются как Tis.
Аденома фовеолярного типа — доброкачественная опухоль из фовеолярного эпителия. Локализуются обычно в теле или дне желудка, развиваются без предшествующих фоновых процессов в виде гастрита или атрофии/метаплазии [12]. Спорадические опухоли крайне редки [13], обычно аденомы фовеолярного типа возникают при семейном аденоматозном полипозе и других наследственных синдромах. Гистологически опухоли состоят из сосочковых и тубулярных структур, покрытых цилиндрическим эпителием фовеолярного типа с удлиненными ядрами и признаками дисплазии (чаще всего низкой степени). Поверхностный эпителий содержит нейтральные (ШИК-позитивные) муцины, что отличает аденому фовеолярного типа от аденомы из пилорических желез. Отмечается выраженная диффузная экспрессия MUC5AC и локальная слабая экспрессия MUC6; реакции с MUC2 и CDX2 отрицательные. Однако ориентироваться при постановке диагноза необходимо в первую очередь на окраску гематоксилином и эозином и ШИК-реакцию, нежели чем на иммуногистохимию.
Аденома из пилорических желез — доброкачественная опухоль из эпителия пилорических желез, возникающая обычно в теле и дне желудка [14]. Большинство таких аденом выявляется у пациентов 60—70 лет и сочетается с атрофией/метаплазией слизистой оболочки дна и тела желудка, вызванной аутоиммунным или H. pylori-ассоциированным гастритом [14]. Размер от 0,3 до 10 см (средний — 2 см). Аденомы из пилорических желез представлены плотно лежащими железами пилорического типа, выстланными кубическим или низким цилиндрическим эпителием. Клетки со светлой или слегка эозинофильной цитоплазмой, ядра расположены базально, округлые или овоидные, со слабо различимыми ядрышками. Поверхностный эпителий не содержит нейтральные (ШИК-позитивные) муцины. В крупных опухолях железы могут быть кистозно-расширены. В 40—50% случаев в аденомах из пилорических желез встречаются дисплазия высокой степени и фокусы аденокарциномы, однако только в 10% случаев наблюдается инвазия в подслизистый слой [15]. Риск прогрессии в аденокарциному увеличивается с размером аденомы, при наличии тубуловорсинчатых структур. В связи с высоким риском прогрессии в рак желудка рекомендовано тотальное удаление образования.
Аденома из кислотообразующих желез (oxyntic gland adenoma) — доброкачественная опухоль из главных (зимогенных) и/или обкладочных (париетальных) клеток с высоким риском прогрессии в инвазивный рак. Локализуется в верхней трети желудка, точная частота встречаемости не установлена. Опухоль состоит из тубулярных структур, выстланных цилиндрическими клетками со светлой эозинофильной цитоплазмой, слабой ядерной атипией, похожих на клетки фундальных желез (преимущественно главные). Может находиться на поверхности, однако чаще встречается внутрислизистое расположение. Дифференцировку клеток можно подтвердить иммуногистохимически с помощью окраски на пепсиноген I (главные клетки) и Н+/К+ АТФазу (обкладочные клетки) [16]. Иногда в опухоли формируются солидные структуры и анастомозирующие тяжи, что может симулировать картину нейроэндокринной опухоли (NET) [17]. В таких случаях полезно определение экспрессии хромогранина А, в аденомах из кислотообразующих желез желудка данный маркер не выявляется.
Рак желудка занимает в мире 3-е место по уровню смертности [27], несмотря на снижение заболеваемости, ежегодно в мире выявляется около 1 млн новых случаев рака желудка [18, 19]. Наиболее высокий уровень заболеваемости отмечается в центральной и восточной Азии, восточной Европе и Южной Америке [18].
Рак желудка развивается под воздействием комбинации различных неблагоприятных факторов, в 90% случаев является спорадическим и только у 10% пациентов связан с наследственными/врожденными причинами. Факторы риска для развития рака желудка перечислены в табл. 2. В новом издании эти факторы разделены на две группы в зависимости от различного уровня доказательности. Следует отметить, что авторы придают большое значение инфекционным (H. pylori, вирус Эпштейна—Барр) и химическим агентам [20], а также особенностям диеты [19, 21—24], в то время как рефлюкс желчи больше не выносится как значимый фактор риска.
Таблица 2. Факторы риска возникновения рака желудка
Факторы, для которых имеются достаточные доказательства участия в канцерогенезе рака желудка у человека:
Полипы желудка
Нередко к гастроэнтерологу обращаются пациенты, у которых при эндоскопическом исследовании — эзофагогастродуоденоскопии (ЭГДС) желудка, проводимой по поводу или хронического гастрита, или болей в верхней половине живота, или с профилактической целью, выявляются полипы желудка — доброкачественные новообразования. Это тревожит больного. Задается вопрос: «Полип — это рак желудка?»
Полип представляет собой разрастание слизистой оболочки желудка. Его возможность трансформации в рак желудка зависит от гистологических, т.е. морфологических особенностей каждого полипа, изученных под микроскопом. Поэтому при обнаружении полипа или множества полипов при ЭГДС должна быть взята биопсия.
Виды полипов
Полипы желудка различают по гистологическим признакам. Гиперпластические полипы, вследствие разрастания (гиперплазии), отека поверхностного эпителия желудка, встречаются в 70-90 % всех полипов желудка. Часто встречаются множественные полипы. Полипы могут быть на тонкой ножке или широком основании. Риск злокачественного перерождения низок и составляет 0,6-4,5%.
Аденоматозные полипы — истинные полипы из железистого эпителия слизистой желудка. Они составляют 10-20% диагностированных полипов. Риск озлокачествления аденоматозных полипов высок, по различным сведениям от 5 до 75%, и зависит от размеров полипа. Крайне высокий риск злокачественного перерождения имеют полипы более 2 см.
Таким образом, риск злокачественного перерождения полипов выше при аденоматозных полипах, чем гиперпластических. Риск увеличивается с возрастом.
Существует ли связь хронического гастрита и возникновения полипов
Как правило, аденоматозные и гиперпластические полипы желудка возникают на фоне хронического гастрита. Они часто являются поздним проявлением хеликобактерной инфекции или хронического гастрита А (при В12 -дефицитной анемии, пернициозной анемии). Чтобы уточнить наличие и тяжесть хронического гастрита, необходимо выполнить множественные биопсии слизистой оболочки желудка. Следует обращать внимание на перестройку слизистой желудка и появление кишечной метаплазии. Диагноз гастрита - морфологический диагноз. Если обнаруживается инфекция H.pylori, следует провести антибактериальное лечение.
Что следует делать при обнаружении полипов
При обнаружении доброкачественных новообразований желудка (полипов) показано их удаление. Эпителиальные полипы размерами 3-5 мм полностью удаляются при биопсии, которая становится и диагностической, и лечебной процедурой. Полипы на ножке и на широком основании удаляются специальной петлей, большие полипы удаляются хирургическим путем. Все удаленные ткани подвергаются гистологическому исследованию.
Окончательный диагноз доброкачественного образования в желудке (полипа) возможен после проведения эндоскопического обследования, биопсии и после морфологического исследования биоптата.
Как проявляются клинически полипы желудка
Около 50% полипов желудка протекают бессимптомно. Иногда могут проявляться болями в животе или желудочно-кишечными кровотечениями.
Удаление полипов при эндоскопическом исследовании достаточно безопасно и хорошо переносится пациентом. При удалении большого полипа на широком основании образуется повреждение слизистой, и для ускорения процесса заживления назначается короткий курс противоязвенной терапии (антисекреторные препараты, сукральфат).
Какие обследования необходимо пройти при выявлении полипа
При желудочных проблемах необходимо знать очень важные характеристики желудка:
- кислотность желудочного сока,
- уровень гормона гастрин-17,
- антитела к хеликобактер пилори.
Эти исследования возможно провести по анализу крови - гастропанели, клиническому анализу крови и уровню витамина В12 в крови.
Нужно ли наблюдать пациентов с полипами желудка
Если у пациента с выявленными полипами проведена правильная диагностика и установлена гиперпластическая форма полипа, то наблюдение не требуется. После удаления больших полипов на широком основании, представляющих аденоматозный полип, ЭГДГ повторяют через 3 месяца и через год. Если рецидива полипа нет, то ЭГДГ проводят по программе диспансеризации или «по требованию».
Рак толстой кишки (РТК) относится к наиболее распространенным онкологическим заболеваниям. Генетические факторы оказываются значимыми в 15-30 % случаев. Одной из основных наследственных причин РТК является семейный аденоматозный полипоз (САП). Без лечения к 40 годам у таких пациентов обычно развивается РТК. Поэтому молекулярно-генетическое исследование наследственных форм колоректального рака необходимо как для самих пациентов в целях индивидуализации лечения, так и для их кровных родственников для формирования групп риска развития рака толстой кишки. САП - аутосомно-доминантный синдром, развивающийся вследствие герминальных мутаций в гене АРС. Целью настоящего исследования стало определение спектра мутаций гена АРС у пациентов, проживающих на Юге России и проходивших диагностику и лечение на базе ФГБУ «РНИОИ». В исследование вошли 7 пациентов с клинической картиной аденоматозного полипоза и 12 кровных родственников. Два пациента не имели семейного отягощенного анамнеза по САП. Молекулярно-генетическое исследование включало выделение ДНК из лейкоцитов периферической крови пациентов, амплификацию экзонов гена АРСи прямое секвенирование ампликонов по методу Сэнгера. В исследуемой группе больных было выявлено пять пациентов с герминальной мутацией в гене АРС, что составило 71,4 %. Обнаружены следующие мутации: три вида нонсенс-мутаций - 847C>T (p.Arg283Term), c.2362A>T (p.Lys788Term) и c.2365C>T (p.Gln789Term), мутация сайта сплайсинга - с.1744-2A>G, делеция - 1309del5 (c.3927_3931delAAAGA). Наследственные мутации обнаружены у четырех кровных родственников пациентов. Проведено медико-генетическое консультирование, даны рекомендации.
1. Кит О.И., Водолажский Д.И. Молекулярная биология колоректального рака в клинической практике / О.И. Кит, Д.И. Водолажский // Молекулярная биология. - 2015. - Т. 49. - № 4. - С. 531-540.
2. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность) / под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. - М., 2017. - 250 с.
3. Lodewijk A.A., Brosens G., Johan A., Offerhaus Francis M. Giardiello. Hereditary Colorectal Cancer: Genetics and Screening / A.A. Lodewijk, G. Brosens, A. Johan, Francis M. Offerhaus, Giardiello // Surg Clin North Am. 2015 Oct.; 95(5):1067-80. doi: 10.1016.
4. Petersen G.M., Slack J., Nakamura Y. Screening guidelines and premorbid diagnosis of familial adenomatous polyposis using linkage // Gastroenterology 1991;100(6):1658-1664.
5. Kastrinosand F., Syngal S. Inherited Colorectal Cancer Syndromes // J. Cancer. 2011. 17 (6), pp. 405-415.
6. Talseth-Palmer B.A. The genetic basis of colonic adenomatous polyposis syndromes / B.A. Talseth-Palmer // Hered Cancer ClinPract. 2017 Mar. 16;15:5. doi: 10.1186/s13053-017-0065-x. eCollection 2017.
7. Brosens L.A., van Hattem W.A., et al. Gastrointestinal polyposis syndromes / L.A. Brosens, W.A. van Hattem, M. Jansen // CurrMol Med. 2007 Feb.;7(1):29-46.
8. Nielsen M., Hes F.J., Nagengast F.M., et al. Germline mutations in APC and MUTYH are responsible for the majority of families with attenuated familial adenomatous polyposis / М. Nielsen, F.J. Hes, F.M. Nagengast // Clin Genet 2007;71:427-33.
9. Yingzi Yang. Wntsignaling indevelopment and disease / Yang Yingzi // CELL & BIOSCIENCE, 2(1), 14,2012. DOI: 10.1186/2045-3701-2-14.
10. Wachsmannova-Matelova L., Stevurkova V., Adamcikova Z., Holec V., Zajac V. Different phenotype manifestation of familial adenomatous polyposis in families with APC mutation at codon 1309 / L. Wachsmannova-Matelova, V. Stevurkova, Z. Adamcikova, V. Holec, V. Zajac // Neoplasma. 2009;56(6):486-9.
11. Ripa R., Bisgaard M.L., Bülow S. and Nielsen F.C. De novo mutations in familial adenomatous polyposis (FAP) / R. Ripa, M.L. Bisgaard, S. Bülow and F.C. Nielsen // Eur. J. Hum. Gen. 2002. Vol.10. P.631-63.
12. Kastrinosand F., Syngal S. Inherited Colorectal Cancer Syndromes / F. Kastrinosand, S. Syngal // Cancer J. 2011. 17 (6). P. 405-415.
13. Поспехова Н.И., Цуканов А.С., Шубин В.П., Сачков И.Ю., Ачкасов С.И., Кашников В.Н., Фролов С.А, Шелыгин Ю.А. Молекулярно-генетическая диагностика основных наследственных форм колоректального рака // Медицинский алфавит. - 2014. - № 2. - С. 11-15.
14. Syngal S., Brand R.E., Church J.M., Giardiello F.M., Hampel H.L., Burt RWACG clinical guideline: Genetic testing and management of hereditary gastrointestinal cancer syndromes // Am J. Gastroenterol. 2015 Feb.;110(2):223-62; quiz 263.
15. Stoffel E.M., Mangu P.B., Gruber S.B., Hamilton S.R., Kalady M.F., Lau M.W., Lu K.H., Roach N., Limburg P.J. American Society of Clinical Oncology; European Society of Clinical Oncology. Hereditary colorectal cancer syndromes: American Society of Clinical Oncology Clinical Practice Guideline endorsement of the familial risk-colorectal cancer: European Society for Medical Oncology Clinical Practice Guidelines // J. Clin. Oncol. 2015 Jan. 10;33(2):209-17.
В большинстве случаев рак толстой кишки носит спорадический характер. Генетические факторы оказываются значимыми в 15-30 % случаев. Однако только около 5 % всех форм колоректального рака развивается на фоне хорошо известных наследственных синдромов, таких как синдром Линча (наследственный неполипозный рак толстой кишки, ННПРТК), семейный аденоматозный полипоз (САП) и MUTYH-ассоциированный полипоз (МАП) [3].
Семейный аденоматозный полипоз (САП) - тяжелое аутосомно-доминантное заболевание, развивающееся в гене APC (AdenomatousPolyposisColi). Частота встречаемости данного синдрома колеблется от 1 на 6800 до 1 на 29000 человек [4]. Около 1 % от всех случаев рака толстой кишки связывают САП, который характеризуется преимущественным поражением толстой кишки множественными аденоматозными полипами и высоким индексом их малигнизации (до 100 %) [5]. Количество полипов толстой кишки может варьировать. Сотни и тысячи полипов характерны для классической формы заболевания, менее 100 для аттенуированной [6].
Мутации APC гена обнаруживаются в 80-90 % случаев классического САП и в 10-30 % аттенуированного САП (АСАП) [7]. Следует отметить, что олигополипоз может быть проявлением также и биаллельной мутации гена MUTYH [8]. АРС является геном-супрессором опухолевого роста. Он играет ключевую роль в работе wnt-сигнального пути, участвуя в деградации β-катенинав цитоплазме клеток. Мутации, изменяющие структуру белка APC, приводят к нарушению работы деградирующего комплекса (GSK3β, аксин-1 и APC) и увеличению концентрации β-катенина. В результате накапливающийся в цитоплазме свободный β-катенин проникает в ядро и активирует транскрипцию некоторых генов и онкогенов, контролирующих клеточный рост и деление [9].
АРС-ген расположен на длинном плече пятой хромосомы (5q21-22). Состоит из 8535 пар оснований, организованных в 15 кодирующих экзонов. Белок содержит 2843 аминокислотных остатка. Мутации в АРС впервые были описаны в 1991 году и сегодня известно более 600 вариантов. Наиболее частыми являются мутации, приводящие к синтезу укороченного бека АРС: это мутации со сдвигом рамки считывания (68 %), нонсенс мутации (30 %), крупные делеции (2 %). Горячие точки гена локализованы в 1309 и 1061 кодонах, частота мутаций в которых составляет 17 % и 11 % соответственно [10]. Примерно у 10-30 % заболевание развивается вследствие мутации denovo [11,12].
Целью настоящего исследования стало определение спектра мутаций гена АРС у пациентов, проживающих на Юге России и проходивших диагностику и лечение на базе ФГБУ «РНИОИ».
Материалы и методы
Поиск наследственных мутаций проводился у 7 пациентов с клиническими признаками семейного аденоматозного полипоза (САП) и у всех больных изучался семейный анамнез.
У пяти пациентов наблюдалась классическая форма САП, характеризующаяся тысячами полипов на протяжении всей толстой кишки, а у двоих - аттенуированная форма с менее чем 30 колоректальными аденомами. Выделение геномной ДНК было выполнено из лейкоцитов переферической крови по стандартной методике, используя фенол-хлороформную экстракцию. Концентрацию полученных препаратов ДНК измеряли на флюориметре «Qubit 2.0» (Invitrogen, USA) с помощью набора Quant-iTТМdsDNA и нормализовывали её до 2 нг/мкл. 15 кодирующих экзонов гена АРС с примыкающими частями интронов (50-100 пар нуклеотидов) амплифицировали методом полимеразной цепной реакции с использованием 23 пар праймеров. В случае аттенуированного полипоза также проводилось исследование 16 кодирующих экзонов гена MUTYH с использованием 9 пар праймеров. Далее полученные фрагменты ДНК секвенировали по двум комплементарным цепям с использованием ABI PRISM 3500 (8 capillaries; Applied Biosystems).
Средний возраст постановки диагноза составил 31,3 года. Диагноз САП был подтвержден гистологически у всех пробандов. В исследуемой группе больных было выявлено пять пациентов с герминальной мутацией в гене АРС, что составило 71,4 %. Поиск мутаций был проведен у 12 кровных родственников пациентов. У 4 человек были выявлены аналогичные варианты. Все семьи прошли медико-генетическое консультирование с рекомендациями по осуществлению пожизненного клинического мониторинга лицам с выявленными мутациями (таблица).
Данные об исследованных пациентах с обнаруженной герминальной мутацией в гене АРС.
Возраст возникнове-ния полипоза
Количество родственников с мутацией
Более 1000 полипов
2 (брат и племянница)
Четыре пациента имели родственника первой степени родства с аденоматозным полипозом, и у одного пациента с высокой вероятностью мутация возникла de novo. У пациентов с аттенуированной формой полипозамутации в генах APC и MUTYH обнаружены не были. Герминальные мутации были представлены следующими типами: три нонсенс-мутации (60 %), одна делеция (20 %) и одна мутация сайта сплайсинга (20 %): 847C>Tp.Arg283Term), c.2362A>T(p.Lys788Term), c.2365C>T(p.Gln789Term), с.1744-2A>G, 1309del5(c.3927_3931delAAAGA) (рис. 1). Все они приводят к возникновению укороченного белка и, следовательно, являются истинно патогенными. Спектр выявленных мутаций несколько отличается от обнаруженных вариантов мутаций у населения центральной России [13].
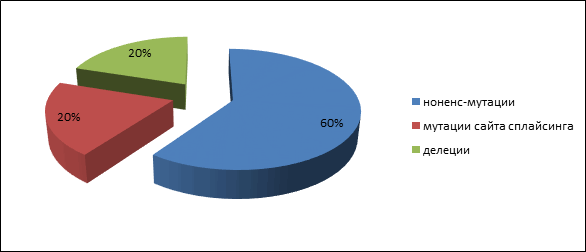
Рис. 1. Частота патогенных мутаций АРС гена
В качестве примера приводим клиническое описание и анализ родословной одного из пациентов с мутацией 1309del5(c.3927_3931delAAAGA)(рис. 2).
Пробанд К., 33 года, классическая форма САТК. При гистологическом исследовании выявлены тубулярные аденомы толстого кишечника с дисплазией 2 степени эпителия желёз. При колоноскопии обнаружено более тысячи полипов от 0,3 до 3 см во всех отделах толстой кишки. В семье отец Пробанда (II-4) в 36 лет прооперирован по поводу рака толстой кишки на фоне САТК, в 42 года умер. Братья и сестры отца здоровы. Бабушка Пробанда (I-1) умерла в 67 лет от рака почки, дедушка - в 72 года от рака легкого. Брат Пробанда (III-1) в 30 лет прооперирован в РОНЦ РАМН по поводу рака толстой кишки на фоне САТК. Проведено генетическое исследование детей Пробанда и брата. Мутация 1309del5 (рис. 3) выявлена у племянницы Пробанда, 7 мес. (IV-1).
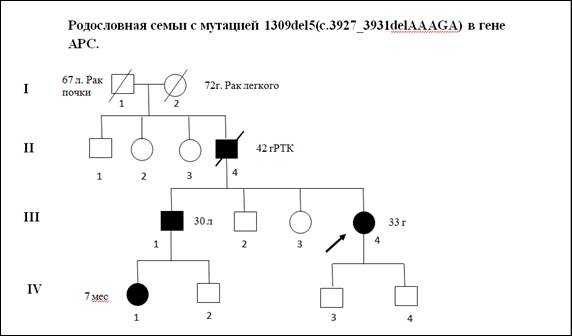
Рис. 2. Родословная семьи c семейным аденоматозным полипозом
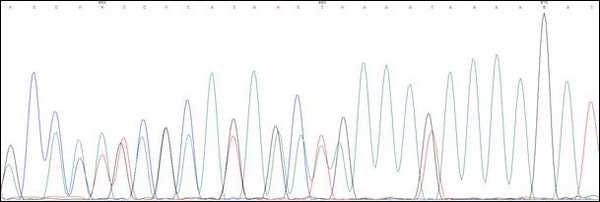
Рис. 3. Сиквенс пациента с мутацией 1309del5(c.3927_3931delАAAGA)
Поиск мутаций при наследственных опухолевых синдромах позволяет определить тактику хирургического лечения, план последующей диспансеризации больного, а также помогает выявить родственников - носителей мутации. Это имеет важное значение при оценке риска развития злокачественных опухолей еще до клинической манифестации заболевания и способствует реализации стратегии персонализированной медицины и улучшению качества оказания онкологической медицинской помощи.Согласно рекомендациям американского общества по гастроэнтерологии (ACG), индивидуумы, имеющие более 10 колоректальных полипов, с наличием в семейном анамнезе родственника с синдромом полипоза, либо данные об аденомах и внекишечных проявлениях, характерных для САП (аденомы двенадцатиперстной кишки, десмоидные опухоли, папиллярный рак щитовидной железы, врожденная гипертрофия пигментного эпителия сетчатки, эпидермальные кисты, остеомы), должны быть обследованы на наличие синдромов аденоматозного полипоза. Генетическое тестирование включает анализ генов APC и MUTYH. Лицам, находящимся в группе риска по развитию САП, а также пациентам с уже имеющимися проявлениями САП с целью исключения малигнизации полипов необходимо ежегодное проведение колоноскопии или гибкой ректороманоскопии начиная с пубертата. В семьях с АСАП рекомендовано проведение колоноскопии. Абсолютными показаниями для неотложной колэктомии при САП, АСАП и МАП являются: подтвержденный или предполагаемый рак, либо наличие значимых симптомов злокачественного процесса. Относительные показания к операции включают наличие множественных аденом> 6 мм, увеличение числа аденом и невозможность адекватного обследования толстой кишки из-за множества мелких полипов. Эндоскопия верхних отделов ЖКТ показана пациентам в возрасте 25-30 лет и далее раз в 0,5-4 года в зависимости от стадии дуоденального полипоза по Шпигельману. 0 ст. - раз в 4 года, I ст. - раз в 2-3 года, II ст. - раз в 1-3 года, III ст. - раз в 6-12 мес, IVст.- хирургическое лечение. Также показано ежегодное УЗИ щитовидной железы. Детям до 7 лет раз в два года следует проводить исследование α-фетопротеина и УЗИ. Послеоперационное наблюдение за пациентами должно включать в себя ежегодную эндоскопию прямой кишки или кармана подвздошной кишки и осмотр илеостомы каждые два года [14]. Согласно рекомендациям Европейского Общества Медицинской Онкологии (ESMO)эндоскопическое обследование при классическом аденоматозном полипозе должно проводиться пожизненно. При бессимптомном носительстве мутации рекомендуется выполнение ректороманоскопии гибким фиброскопом каждые 2 года, начиная с 10-12-летнего возраста. При обнаружении хотя бы одной аденомы колоноскопию в последующем следует проводить ежегодно. Хирургическое лечение показано при большом количестве аденом, а также при наличии аденом с высокой степенью дисплазии. Эндоскопия верхних отделов ЖКТ проводится с 20-25 лет, либо с момента обнаружения колоректальных аденом. Частота проведения эндоскопии зависит от стадии дуоденального полипоза по Шпигельману. С целью исключения рака щитовидной железы показано ежегодное УЗИ. Диагностика десмоидных опухолей проводится с помощью КТ либо МРТ и может быть показана пациентам с семейным анамнезом, а также при локализации мутации в определенных сайтах гена АРС [15].
Частота возникновения наследственных мутаций в гене APC у пациентов с классической формой САТК составила 71,4 %: три нонсенс-мутации (60 %), одна делеция (20 %) и одна мутация сайта сплайсинга (20 %). Полученные результаты указывают на необходимость исследования всех кодирующих экзонов гена APC у больных классической (тяжелой) формой семейного аденоматоза толстой кишки, а также обязательное обследование всех кровных родственников больного. При обнаружении мутации можно говорить о чрезвычайно высокой вероятности развития опухолевого синдрома (не менее 80 %) в течение жизни.
Читайте также:
- Рентгенограмма, КТ, МРТ, УЗИ при инфекции и абсцессе селезенки
- Синерго-антагонизм ферментов. Типы действия ферментов
- Пример порока сердца при синдроме Шершевского-Тернера. Опухоли наподчечников при врожденном пороке сердца
- Изменения брюшной полости при системных заболеваниях
- Полезные продукты, которые могут навредить здоровью. Соблюдайте во всем меру!
